扩张型心肌病治疗剂的制作方法
本发明涉及扩张型心肌病治疗剂。
背景技术:
扩张型心肌病(dcm)是在特发性心肌病中以心肌收缩功能衰竭和左心室腔的扩张为特征的疾病组,且大多数情况为进行性。另外,扩张型心肌病是以慢性心脏衰竭症状为特征、且反复急性加重的预后不良的疾病。进而,有时会引起由致死性心律不齐导致的猝死、动脉的血栓栓塞症。扩张型心肌病是混合了遗传性和后天性的疾病组,在定义上基于形态学和功能学分类,在临床上存在多种导致“左心室扩张”和“左心室收缩功能障害”的类似的疾病。因此,在考虑到扩张型心肌病时,一般需要排除其它各种类似的特定心肌病。
长期以来扩张型心肌病的病因一向不明,但已证实与遗传因素以及病毒感染和自身免疫异常有关,可观察到各种各样的细胞性免疫异常。有报告表明扩张型心肌病患者的血清中控制性t细胞减少,取而代之辅助t细胞增加,在使用了心肌活检标本的研究中发现了mhcii类分子的表达。另外,扩张型心肌病患者的血清中存在各种各样的抗心肌自身抗体。还证实了在家族性扩张型心肌病患者中可检测出大量这样的抗心肌自身抗体(非专利文献1)。进而,在约20%的家族性扩张型心肌病患者中可检测出某些基因突变,该突变中的大多数是编码直接与心收缩相关的肌节蛋白的基因、编码负责传递心收缩力的作用的抗肌萎缩蛋白相关蛋白的基因的突变。这样的基因突变不仅成为扩张型心肌病发病的直接原因,而且还可作为发病的遗传基础起作用,若具有基因突变,则推测出在病毒感染后自身免疫机制持续工作而转变为扩张型心肌病。另外,扩张型心肌病患者由于预后不良而常常成为心脏移植的对象,但除了供体不足的问题之外,移植时的排斥反应也成为问题所在。因此,期望开发出扩张型心肌病的新型治疗法。
对于由阿霉素(doxorubicin)、5-阿扎胞苷(5-azacytidine)等药物诱发了心肌病的动物,将其作为扩张型心肌病病状模型、进行了利用间充质干细胞(msc)的治疗效果的研究(非专利文献2-3)。然而,由阿霉素、5-阿扎胞苷等药物诱发的心肌病被称为药物性心肌病,虽然是临床上与扩张型心肌病类似的心肌病疾病组,但根据与扩张型心肌病以及相关的继发性心肌病的治疗相关的准则(涉及心血管病的诊断和治疗的准则2011),作为与扩张型心肌病不同的分类来处理。另外,作为扩张型心肌病的遗传性成因,认为与心肌δ-肌聚糖、肌动蛋白、肌球蛋白等细胞质中所包含的蛋白质的基因异常相关,但在这点上与由药剂引发的心肌病存在根本性成因的不同。因此,即使在药物性心肌病模型中观察到改善效果,也很难说对实际的扩张型心肌病发挥效果。
有关于缺损δ肌聚糖的j2n仓鼠的报告。该仓鼠在出生后16w左右出现扩张型心肌病,可观察到心功能降低、心脏细胞肥大、纤维化等形态学病变等。由于这些形态学病变等与人的病状相似,因此作为人的扩张型心肌病的模型来使用。另外,在人的扩张型心肌病中也观察到δ肌聚糖的突变,还已知在j2n仓鼠和人的扩张型心肌病中ant-1的功能降低(非专利文献4~6)。
另一方面,间充质干细胞是由friedenstein(1982)首次从骨髓分离的具有多分化能力的前体细胞(非专利文献7)。已经明确的是该间充质干细胞存在于骨髓、脐带、脂肪等各种各样的组织中,间充质干细胞移植有望成为针对各种难治性疾病的新型治疗方法(专利文献1~4)。最近,已知存在具有与脂肪组织、胎盘、脐带、卵膜等胎儿附属物的基质细胞同等功能的细胞。因此,有时也将间充质干细胞称为基质细胞(mesenchymalstromalcell)。
现有技术文献
专利文献
专利文献1:日本特表2002-506831号公报
专利文献2:日本特表2000-508911号公报
专利文献3:日本特开2012-157263号公报
专利文献4:日本特表2012-508733号公报
非专利文献
非专利文献1:友池仁畅等、《循環器病の診断と治療に関するガイドライン2011》(涉及循环器病的诊断和治疗的准则2011)
非专利文献2:mol.cellbiochem.,2014,387,pp.279-285
非专利文献3:med.sci.monit.basicres.,2013.14,pp.20-31
非专利文献4:circ.j.,2005,69,pp.107-113
非专利文献5:j.biochem.,2003,34(2),pp.269-76
非专利文献6:jci.,2000,106,pp.655-662
非专利文献7:pittengerf.m.etal.,science,1999.284,pp.143-147
技术实现要素:
发明要解决的问题
本发明是基于上述那样的实际情况而完成的,其目的在于提供扩张型心肌病的治疗中发挥优异的效果、且对大多数患者可以得到一定的效果的扩张型心肌病治疗剂。
用于解决问题的方案
本发明人等为了解决上述课题而进行了深入研究,结果发现通过对扩张型心肌病给予间充质干细胞或源自间充质干细胞的微粒,从而能够显著改善心功能等。本发明是基于这些见解而完成的。即,为了解决上述课题而做出的发明如下。
[1]一种扩张型心肌病治疗剂,其含有选自由间充质干细胞和源自间充质干细胞的微粒组成的组中的至少1种。
[2]根据[1]所述的扩张型心肌病治疗剂,其中,上述间充质干细胞具有含有微粒或分泌微粒的能力。
[3]根据[1]或[2]所述的扩张型心肌病治疗剂,其中,上述微粒的平均粒径为1000nm以下。
[4]根据[1]~[3]中任一项所述的扩张型心肌病治疗剂,其中,上述微粒为外来体(exosome)。
[5]根据[1]~[4]中任一项所述的扩张型心肌病治疗剂,其中,上述微粒含有选自由白细胞介素10(il-10)、hgf、脱脂载脂蛋白a-2(apoproteina-2)、色素上皮衍生因子(pigmentepithelium-derivedfactor(pedf)、serpinf1)及触珠蛋白(haptoglobin)组成的组中的至少1种因子。
[6]根据[1]~[5]中任一项所述的扩张型心肌病治疗剂,其中,上述间充质干细胞相对于被检体为同种异体。
[7]根据[1]~[6]中任一项所述的扩张型心肌病治疗剂,其中,上述间充质干细胞为脂肪来源、脐带来源或骨髄来源。
[8]根据[1]~[7]中任一项所述的扩张型心肌病治疗剂,其中,上述扩张型心肌病为选自由特发性扩张型心肌病、家族性扩张型心肌病和遗传性扩张型心肌病组成的组中的扩张型心肌病。
[9]根据[1]~[8]中任一项所述的扩张型心肌病治疗剂,其中,上述间充质干细胞为冷冻保存的细胞。
[10]一种扩张型心肌病的纤维化抑制剂,其含有选自由间充质干细胞和源自间充质干细胞的微粒组成的组中的至少1种。
[11]一种扩张型心肌病的心脏肥大抑制剂,其含有选自由间充质干细胞和源自间充质干细胞的微粒组成的组中的至少1种。
[12]一种扩张型心肌病治疗用试剂盒,其包含:[1]~[9]中任一项所述的扩张型心肌病治疗剂、[10]所述的纤维化抑制剂或[11]所述的心脏肥大抑制剂、容器和标签。
[13]一种扩张型心肌病的治疗方法,其特征在于,给予选自由间充质干细胞和源自间充质干细胞的微粒组成的组中的至少1种。
[14]一种扩张型心肌病的纤维化抑制方法,其特征在于,给予选自由间充质干细胞和源自间充质干细胞的微粒组成的组中的至少1种。
[15]一种扩张型心肌病的心脏肥大抑制方法,其特征在于,给予选自由间充质干细胞和源自间充质干细胞的微粒组成的组中的至少1种。
发明的效果
基于本发明的扩张型心肌病治疗剂,通过对扩张型心肌病的疾病进行间充质干细胞或源自间充质干细胞的微粒的给药,能够显著改善心脏等疾病部位的功能、结构等。由于上述间充质干细胞对于同种异体的受试体也不易发生排斥反应,可以将对预先制备的供体的细胞进行扩大培养并冷冻保存的细胞作为本发明的扩张型心肌病治疗剂中的间充质干细胞使用。另外,同样地,通过预先制备的供体的细胞进行扩大培养并冷冻保存的间充质干细胞得到的源自间充质干细胞的微粒,可以作为本发明的扩张型心肌病治疗剂中的源自间充质干细胞的微粒使用。因此,与制备自身的间充质干细胞来使用的情况相比,还具有易于商品化,且容易得到稳定的一定效果这样的优点。
附图说明
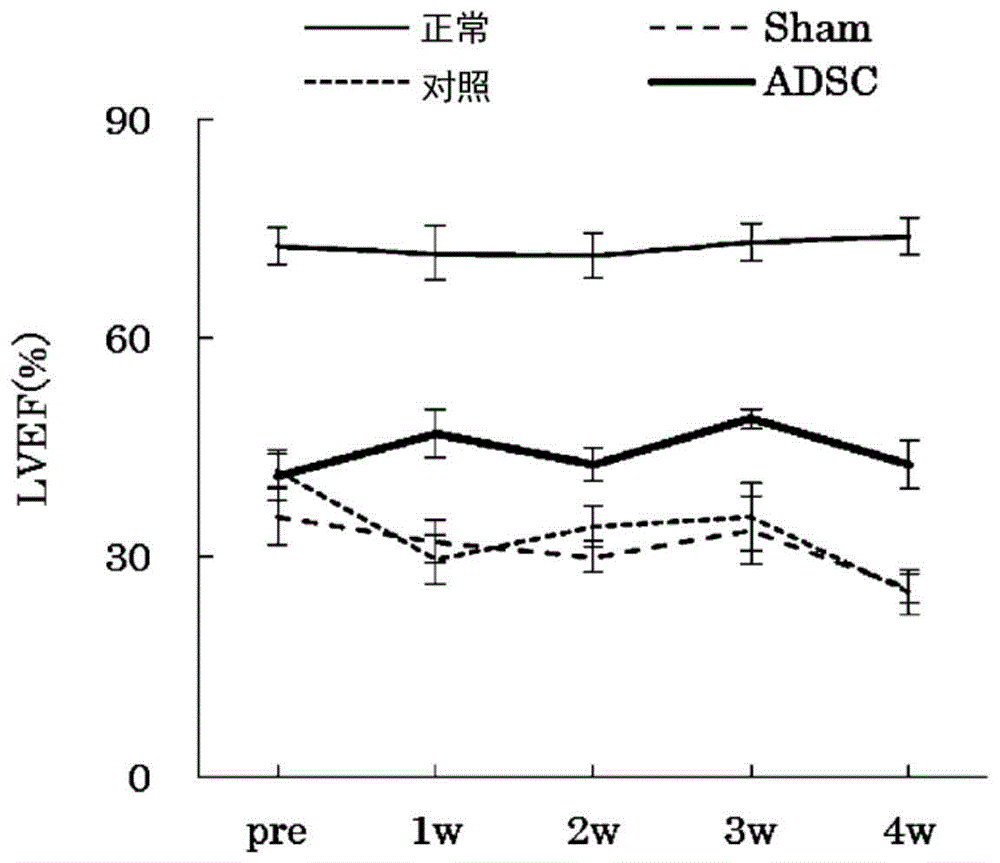
图1是示出本发明的扩张型心肌病治疗剂对作为扩张型心肌病的模型动物的j2n-k仓鼠的治疗效果的图(心功能评价)。
图2是示出本发明的扩张型心肌病治疗剂对作为扩张型心肌病的模型动物的j2n-k仓鼠的治疗效果的图(心组织中的atp含量)。
图3是示出本发明的扩张型心肌病治疗剂对作为扩张型心肌病的模型动物的j2n-k仓鼠的治疗效果的图(心组织中线粒体的mt.ant-1表达量)。
图4是示出本发明的扩张型心肌病治疗剂对作为扩张型心肌病的模型动物的j2n-k仓鼠的治疗效果的图(心脏的直径)。
图5是示出本发明的扩张型心肌病治疗剂对作为扩张型心肌病的模型动物的j2n-k仓鼠的治疗效果(长期)的图(心功能评价)。
图6是本发明的扩张型心肌病治疗剂对人心肌细胞的功能亢进效果的图。
具体实施方式
以下对本发明的扩张型心肌病治疗剂、纤维化抑制剂、心脏肥大抑制剂及扩张型心肌病治疗用试剂盒进行详细地说明。
<扩张型心肌病治疗剂>
本发明的扩张型心肌病治疗剂含有选自由间充质干细胞和源自间充质干细胞的微粒组成的组中的至少1种。
〈间充质干细胞〉
本发明中间充质干细胞是指:具有分化为属于间充质类的细胞(骨细胞、心肌细胞、软骨细胞、肌腱细胞、脂肪细胞等)的分化能力,并在维持该能力的状态下能够增殖的细胞。本发明中使用的间充质干细胞的术语是指与基质细胞相同的细胞,不对两者进行特别区分。作为包含间充质干细胞的组织,例如可列举出:脂肪组织、脐带、骨髓、脐带血、子宫内膜、胎盘、真皮、骨骼肌、骨膜、牙囊、牙周组织、牙髓、牙胚等。因此,例如脂肪组织来源间充质干细胞是指脂肪组织中含有的间充质干细胞,还可称为脂肪组织来源基质干细胞。其中,从本发明的扩张型心肌病治疗剂发挥的内脏疾病改善等作用效果的观点和获得容易性的观点等出发,优选脂肪组织来源间充质干细胞、脐带来源间充质干细胞、骨髓来源间充质干细胞、胎盘来源间充质干细胞、牙髄来源间充质干细胞,更优选脂肪组织来源间充质干细胞、脐带来源间充质干细胞。
本发明中的间充质干细胞优选相对于受试体为同种同体或同种异体。由于间充质干细胞对于同种异体的受试体也不易发生排斥反应,因此可以使用对预先制备的供体的细胞进行扩大培养并冷冻保存后的细胞,作为本发明的扩张型心肌病治疗剂中的间充质干细胞。因此,与制备自身的间充质干细胞来使用的情况相比易于商品化且容易稳定地得到一定效果,从这样的观点出发,本发明中的间充质干细胞更优选为同种异体。
由于间充质干细胞对于同种异体的受试体也不易发生排斥反应,因此可以使用对预先制备的供体的细胞进行扩大培养并冷冻保存后的细胞作为本发明的扩张型心肌病治疗剂中的间充质干细胞。另外,同样地,可以将由对预先制备的供体的细胞进行扩大培养并冷冻保存的间充质干细胞得到的源自间充质干细胞的微粒作为本发明的扩张型心肌病治疗剂中的源自间充质干细胞的微粒使用。因此,与自身的间充质干细胞或微粒来使用的情况相比,从易于商品化且容易稳定地得到一定效果这样的观点出发,本发明中的间充质干细胞更优选为同种异体。
另外,在本发明中间充质干细胞是指:包含间充质干细胞的任意的细胞群体。该细胞群体的至少20%以上,优选30%、40%、50%、60%、70%、75%、80%、85%、90%、93%、96%、97%、98%或99%为间充质干细胞。
本发明中脂肪组织是指:含有脂肪细胞和包含微血管细胞等的基质细胞的组织,例如,是将哺乳动物的皮下脂肪外科切除或吸取哺乳动物的皮下脂肪而得到的组织。脂肪组织可以由皮下脂肪获得。优选从与后述的脂肪组织来源间充质干细胞的给药对象为同种的动物获得、考虑到对人给药,更优选为人的皮下脂肪。皮下脂肪的供给个体可以是存活或死亡的,但本发明中使用的脂肪组织优选为从存活个体采集的组织。从个体采集时,吸脂例如可示例出:pal(动力辅助)吸脂、erchonia激光吸脂或body-jet吸脂等,从维持细胞的状态这样的观点出发,优选不使用超声波。
本发明中脐带是连接胎儿和胎盘的白色的管状组织,由脐带静脉、脐带动脉、胶状组织(华顿氏胶;wharton’sjelly)、脐带基质本身等构成,富含间充质干细胞。脐带优选从与使用本发明的扩张型心肌病治疗剂的受试体(给药对象)为同种的动物获得,考虑到将本发明的扩张型心肌病治疗剂对人给药,更优选为人的脐带。
本发明中骨髓是指填充骨的内腔的实质组织(parenchyma),为造血器官。骨髓中存在骨髓液,将存在于其中的细胞称为骨髓细胞。骨髓细胞中除了红细胞、粒细胞、巨核细胞、淋巴细胞、脂肪细胞等之外,包含间充质干细胞、造血干细胞、血管内皮祖细胞等。骨髓细胞例如可以由人髂骨、长骨或其它骨采集。
本发明中,所谓脂肪组织来源间充质干细胞、脐带来源间充质干细胞、骨髓来源间充质干细胞的各组织来源间充质干细胞是指:分别包含所谓脂肪组织来源间充质干细胞、脐带来源间充质干细胞、骨髓来源间充质干细胞的各组织来源间充质干细胞的任意的细胞群体。该细胞群体的至少20%以上,优选30%、40%、50%、60%、70%、75%、80%、85%、90%、93%、96%、97%、98%或99%为脂肪组织来源间充质干细胞、脐带来源间充质干细胞、骨髓来源间充质干细胞的各组织来源间充质干细胞。
本发明中的间充质干细胞例如还可以利用生长特征(例如,从传代至老化为止的群体的倍增能力、倍增时间)、核型分析(例如,正常的核型、母体系统或新生儿系统)、通过流式细胞仪(例如,facs分析)进行的表面标记物表达、免疫组织化学和/或免疫细胞化学(例如,表位检测)、基因表达谱(例如,基因芯片阵列;逆转录pcr、实时pcr、传统型pcr等聚合酶链式反应)、mirna表达谱、蛋白质阵列、细胞因子等蛋白质分泌(例如,血浆凝血解析、elisa、细胞因子阵列)、代谢产物(代谢组学解析)、本领域中公知的其它方法等而赋予特征。
〈间充质干细胞的制备方法〉
该间充质干细胞可以通过本领域技术人员利用公知的方法来制备。以下作为一个例子对脂肪组织来源间充质干细胞的制备方法进行说明。脂肪组织来源间充质干细胞可以利用例如美国专利第6,777,231号中记载的制造方法得到,例如,可以利用包括以下的工序(i)~(iii)的方法来制造:
(i)通过酶消化脂肪组织而得到细胞悬浮物的工序;
(ii)使细胞沉淀,将细胞再悬浮于适合的培养基的工序;以及
(iii)在固体表面培养细胞,去除不显示出与固体表面结合的细胞的工序。
工序(i)中使用的脂肪组织优选使用经清洗的脂肪组织。清洗可以通过使用生理学允许的生理盐水溶液(例如磷酸缓冲盐水(pbs)),并剧烈地搅拌使其沉淀来进行。其原因在于,从组织中去除脂肪组织中包含的杂质(也称为残骸(debris),例如损伤组织、血液、红细胞等)。因此,通常重复进行清洗和沉淀直至从上清液中整体上去除了残骸。残留的细胞以各种各样的尺寸的块的形式存在,因此为了将细胞本身的损伤抑制在最小限度并且使其解离,而优选用使细胞间结合变弱或破坏细胞间结合的酶(例如,胶原酶、分散酶或胰蛋白酶等)对清洗后的细胞团块进行处理。这样的酶的量和处理期间依赖于所使用的条件而变化,在本技术领域中是已知的。可以替代这样的酶处理或组合地利用机械的搅拌、超声波能量、热能等其它处理法将细胞团块分解,但为了将细胞的损伤抑制在最小限度而优选仅通过酶处理进行。使用酶时,为了将对细胞的有害作用抑制在最小限度,期望的是在经过合适的期间后使用培养基等使酶失活。
通过工序(i)而得到的细胞悬浮物包含聚集状的细胞的浆料或悬浮物、以及各种夹杂细胞、例如红细胞、平滑肌细胞、内皮细胞和成纤维细胞。接着,还可以分离、去除聚集状态的细胞和它们的夹杂细胞,但由于能够通过后述的工序(iii)中的粘附和清洗来去除,因此可以省略该分离、去除。在分离、去除夹杂细胞时,可以通过将细胞强制分成上清液和沉淀的离心分离来实现。将包含得到的夹杂细胞的沉淀悬浮于生理学允许的溶剂中。虽然有悬浮状的细胞中包含红细胞的担心,但由于红细胞会通过后述的由粘附于固体表面进行的选择而被排除,因此未必一定需要溶解的工序。作为选择性地溶解红细胞的方法,可以使用本技术领域中公知的方法例如通过用氯化铵溶解在高渗培养基或低渗培养基中进行培育等。溶解后,还可以通过例如过滤、离心沉淀或密度分级,从所需的细胞中分离溶解物。
工序(ii)中,对于悬浮状的细胞,为了提高间充质干细胞的纯度,还可以进行1次或连续多次清洗、离心分离,并再悬浮于培养基中。此外,还可以基于细胞表面标记物图谱或基于细胞的尺寸和颗粒性对细胞进行分离。
再悬浮时使用的培养基只要是能培养间充质干细胞的培养基就没有特别限定,这样的培养基还可以通过如下方式制作:在基础培养基中添加血清、和/或添加白蛋白、运铁蛋白、脂肪酸、胰岛素、亚硒酸钠、胆固醇、胶原蛋白前体、微量元素、2-巯基乙醇、3’-硫代甘油等中的1种以上的血清替代物。这些培养基还可以根据需要进一步添加脂质、氨基酸、蛋白质、多糖、维生素、生长因子、低分子化合物、抗生素、抗氧化剂、丙酮酸、缓冲剂、无机盐类等物质。基础培养基,例如可列举出:imdm培养基、medium199培养基、伊格尔最低必需培养基(eagle’sminimumessentialmedium(emem))、αmem培养基、达尔伯克改良伊格尔培养基(dulbecco’smodifiedeagle’smedium(dmem))、ham’sf12培养基、rpmi1640培养基、fischer’s培养基、mcdb201培养基以及它们的混合培养基等。血清例如可列举出:人血清、胎牛血清(fbs)、牛血清、仔牛血清、山羊血清、马血清、猪血清、绵羊血清、兔子血清、大鼠血清等,但不限定于这些。使用血清时,可以相对于基础培养基添加5v/v%~15v/v%,优选添加10v/v%。脂肪酸可示例出:亚油酸、油酸、亚麻酸、花生四烯酸、肉豆蔻酸、棕榈酸(palmitoylacid)、棕榈酸(palmiticacid)和硬脂酸等,但不限定于这些。脂质可示例出:磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰胆碱等,但不限定于这些。氨基酸例如包括:l-丙氨酸、l-精氨酸、l-天冬氨酸、l-天冬酰胺、l-半胱氨酸、l-胱氨酸、l-谷氨酸、l-谷氨酰胺、l-甘氨酸等,但不限定于这些。蛋白质例如可示例出:大肠杆菌素、还原型谷胱甘肽、纤维连接蛋白和β2-微球蛋白等,但不限定于这些。多糖可示例出糖胺聚糖,糖胺聚糖中尤其可示例出透明质酸、硫酸乙酰肝素等,但不限定于这些。生长因子例如可示例出:血小板来源生长因子(pdgf)、碱性成纤维细胞生长因子(bfgf)、转化生长因子β(tgf-β)、肝细胞生长因子(hgf)、表皮生长因子(egf)、结缔组织生长因子(ctgf)、血管内皮细胞生长因子(vegf)等,但不限定于这些。从将本发明中得到的脂肪来源间充质干细胞用于细胞移植这样的观点出发,优选使用血清等不包含异种来源成分(无异源,xeno-free)的培养基。这样的培养基例如以由promocell公司、lonza公司、biologicalindustries公司、veritas公司、r&dsystems公司、corning公司和rohto公司等作为间充质干细胞(基质细胞)用预先制备的培养基的形式提供。
接着,工序(iii)中,对于工序(ii)中得到的细胞悬浮液中的细胞,不使之分化而在固体表面上、在适合的细胞密度和培养条件下使用上述的适合的细胞培养基对其进行培养。本发明中,“固体表面”是指:能够结合本发明中的脂肪组织来源间充质干细胞的任意材料。在特定的方式中,这样的材料是为了促进哺乳类细胞与该表面的结合而经处理的塑料材料。具有固体表面的培养容器的形状没有特别限定,可适宜地使用培养皿、烧瓶等。为了去除非结合状态的细胞和细胞的碎片,在培育后清洗细胞。
本发明中,可以选择最终以与固体表面结合的状态滞留的细胞作为脂肪组织来源间充质干细胞的细胞群体。
对于所选择的细胞,为了确认为本发明中的脂肪组织来源间充质干细胞,还可以使用流式细胞仪等利用现有的方法对表面抗原进行解析。进而,还可以对分化为各细胞系列的能力进行检测,这样的分化可以利用现有的方法进行。
本发明中的间充质干细胞可以如上所述进行制备,但还可以定义为具有以下特性的细胞;
(1)在标准培养基中的培养条件下,对塑料显示出粘附性、
(2)表面抗原cd44、cd73、cd90为阳性,cd31、cd45为阴性、和
(3)在培养条件下能分化为骨细胞、脂肪细胞、软骨细胞。
〈间充质干细胞的冷冻保存〉
本发明中的间充质干细胞只要具备疾病治疗效果就可以是适宜重复进行了冷冻保存和融解的细胞。本发明中,冷冻保存可以通过如下方式进行:本领域技术人员将间充质干细胞悬浮于公知的冷冻保存液中进行冷却。悬浮可以通过如下方式进行:利用胰蛋白酶等剥离剂使细胞剥离,转移至冷冻保存容器中进行适宜处理后,加入冷冻保存液。
冷冻保存液作为冷冻保护剂还可以含有二甲基亚砜(dmso:dimethylsulfoxide),但dmso除了细胞毒性之外还具有分化诱导间充质干细胞的特性,因此优选减少dmso含量。作为dmso的替代物,可示例出:甘油、丙二醇或多糖类。使用dmso时,含有5v/v%~20v/v%,优选含有5v/v%~10v/v%、更优选含有10v/v%。此外还可以包含wo2007/058308中记载的添加剂。作为这样的冷冻保存液,例如还可以使用由bioverdeinc.、nippongeneticsco,ltd.、reprocellinc.、zenoaq公司、cosmobioco.,ltd.、kohjinbioco.,ltd.、thermofisherscientificinc.等提供的冷冻保存液。
冷冻保存上述悬浮的细胞时,在-80℃~-100℃之间的温度(例如,-80℃)下保管为宜,可以使用能达到该温度的任意的冷冻仪来进行。没有特别限定,为了避免急剧的温度变化,还可以使用程序冷冻仪来适宜控制冷却速度。冷却速度可以根据冷冻保存液的成分进行适宜选择,可以依据冷冻保存液的制造者指示来进行。
保存期间只要在上述条件下经冷冻保存的细胞融解后保持与冷冻前同等性质就没有特别限定,例如可列举出:1周以上、2周以上、3周以上、4周以上、2个月以上、3个月以上、4个月以上、5个月以上、6个月以上、1年以上或更长时间。通过在更低的温度下保存而能够抑制细胞毒性,因此还可以移至液氮上的气相(从-180℃以上至约-150℃以下)中进行保存。在液氮上的气相中保存时,可以使用本领域技术人员公知的保存容器来进行。没有特别限定,例如保存2周以上时,优选在液氮上的气相中进行保存。
融解的间充质干细胞还可以适宜培养至接下来的冷冻保存前。间充质干细胞的培养使用能培养上述的间充质干细胞的培养基进行,没有特别限定,还可以在30~40℃,优选为在约37℃的培养温度下、在含有co2的空气气氛下进行。co2浓度为约2~5%,优选为约5%。在培养时,在相对于培养容器到达适合的汇合(例如可列举出相对于培养容器,细胞占50%至80%的情况)后,还可以用胰蛋白酶等剥离剂使细胞剥离,以适合的细胞密度接种于另行准备的培养容器中继续进行培养。在接种细胞时,作为典型的细胞密度,可示例出:约100细胞/cm2~约100000细胞/cm2、约500细胞/cm2~约50000细胞/cm2、约1000~10000细胞/cm2、约2000~10000细胞/cm2等。在特定的方式中,细胞密度为2000~10000细胞/cm2。优选为3天~7天到达适合的汇合的方式进行调节。在培养时,还可以根据需要适宜更换培养基。
经冷冻保存的细胞的融解可以通过本领域技术人员利用公知的方法来进行。例如可示例出通过在37℃的恒温槽内或热水浴中静置或振荡来进行的方法。
〈源自间充质干细胞的微粒〉
本发明中的源自间充质干细胞的微粒是由间充质干细胞得到的微粒,且由间充质干细胞产生。本发明中的间充质干细胞的微粒可以包含在间充质干细胞中,可以包含在间充质干细胞培养上清液中,还可以是从间充质干细胞中或间充质干细胞培养上清液分离的微粒。即,本发明中的源自间充质干细胞的微粒可以是任意的形态,可以是微粒本身,还可以是具有含有微粒或分泌微粒的能力的间充质干细胞的形态。
作为微粒的分离方法,可列举出:超离心法、精密过滤法、通过抗体的捕捉、微流体系统的利用等。分离的微粒可以包含间充质干细胞等细胞,另外,还可以包含间充质干细胞培养培养基。
本发明中的源自间充质干细胞的微粒可以从使用上述的培养基对间充质干细胞进行培养而得到的培养上清液中回收。在回收培养上清液时,例如,可以使间充质干细胞在培养容器中达到亚汇合或汇合的状态并更换至新的培养基中后,进而进行1~5天培养,回收该培养上清液。还可以将该培养上清液作为本发明的扩张型心肌病治疗剂使用,还可以利用超离心分离法、密度梯度离心法、各种微粒分离试剂盒等将微粒分离,将其作为本发明的扩张型心肌病治疗剂的材料使用。
本发明的扩张型心肌病治疗剂除了上述微粒之外,还可以含有具有包含上述微粒或分泌上述微粒的能力的间充质干细胞本身。需要说明的是,还可以解释为:扩张型心肌病治疗剂包含具有含有上述微粒或分泌上述微粒的能力的间充质干细胞时,满足通过包含上述间充质干细胞,从而同时包含上述微粒这样的条件。
本发明中的源自间充质干细胞的微粒典型的是由间充质干细胞释放的、能够通过电子显微镜确认尺寸的囊泡。作为微粒的尺寸,平均粒径为1nm以上且1000nm以下,优选为10nm以上且500nm以下,进一步优选30nm以上且200nm以下。此处,平均粒径是通过动态光散射法或电子显微镜测定的各颗粒的直径的平均值。上述微粒可以具有包围生物体分子的脂双层。
另外,作为上述微粒,例如可列举出:膜颗粒、膜囊胞、微囊胞、纳米囊胞、微泡(microvesicles、平均粒径30~1000nm)、外来体样囊泡、外来体(exosome、平均粒径30~200nm)、核外粒体样囊泡、核外粒体(ectosome)或外囊泡(exovesicle)等,优选为外来体。还基于细胞内起源、在蔗糖中的微粒的密度、形状、沉淀速度、脂质组成、蛋白质标记物和分泌的方式(即,信号(诱导性)后或自发性(构成性))来区别种类不同的源自间充质干细胞的微粒。微粒例如在密度梯度离心法中,被分级为1.0~1.5g/ml,优选为1.1~1.3g/ml。进而,微粒含有磷脂酰丝氨酸、胆固醇、鞘磷脂和神经酰胺中的任意者作为其构成脂质。
本发明中的源自间充质干细胞的微粒包含蛋白质、脂肪酸、mirna等核酸。作为上述蛋白质、脂肪酸,例如可列举出:白细胞介素10(il-10)、肝细胞生长因子(hepatocytegrowthfactor(hgf))、脱脂载脂蛋白a-2(apoproteina-2)、色素上皮衍生因子(pigmentepithelium-derivedfactor(pedf)、serpinf1)、触珠蛋白(haptoglobin)、壬酸、月桂酸、肉豆蔻酸、十五烷酸、异十五烷酸、棕榈酸、异棕榈酸、十七烷酸、异十七烷酸(isoheptadecanoicacid)、硬脂酸、异硬脂酸、油酸、反油酸、亚油酸、十九烷酸、异十九烷酸、花生酸、11z-二十碳烯酸(11z-eicosenoicacid)、双高-γ-亚麻酸(dihomo-γ-linolenicacid)、花生四烯酸、芥酸、13z,16z-二十二碳二烯酸、13z,16z,19z-二十二碳二烯酸、肾上腺酸(adrenicacid)、鰶鱼酸(clupanodonicacid)等,优选为il-10、hgf、脱脂载脂蛋白a-2(apoproteina-2)、色素上皮衍生因子(pigmentepithelium-derivedfactor(pedf)、serpinf1)、触珠蛋白(haptoglobin)、壬酸、月桂酸、肉豆蔻酸、十五烷酸、异十五烷酸、棕榈酸、异棕榈酸、十七烷酸、异十七烷酸、硬脂酸、异硬脂酸、油酸、反油酸、亚油酸、花生酸、11z-二十碳烯酸、花生四烯酸、芥酸、13z,16z-二十二碳二烯酸,进一步优选为il-10、hgf、脱脂载脂蛋白a-2(apoproteina-2)、色素上皮衍生因子(pigmentepithelium-derivedfactor(pedf)、serpinf1)、触珠蛋白(haptoglobin)、肉豆蔻酸、十五烷酸、棕榈酸、十七烷酸、异十七烷酸、硬脂酸、油酸、亚油酸、十九烷酸、芥酸、13z,16z-二十二碳二烯酸,特别优选为il-10、hgf、棕榈酸、十七烷酸、硬脂酸、油酸、13z,16z-二十二碳二烯酸,本发明中的源自间充质干细胞的微粒优选为包含这些的微粒。
〈间充质干细胞和源自间充质干细胞的微粒的形态〉
本发明的间充质干细胞可以是任意状态的细胞,例如可以是将培养中的细胞剥离并回收的细胞,还可以是在冷冻保存液中被冷冻的状态的细胞。使用将扩大培养而得到的相同批次的细胞分成小部分进行冷冻保存后的细胞时,在稳定地得到作用效果方面、操作性优异方面等是优选的。冷冻保存状态的间充质干细胞可以在即将使用之前进行融解并悬浮于冷冻保存液的状态下直接给药、还可以悬浮于输液或培养基等后给药。另外,可以利用离心分离等方法去除冷冻保存液后混合在输液或培养基等中。
本发明的源自间充质干细胞的微粒可以是任意状态的微粒,例如可以是从培养中的细胞分离的源自间充质干细胞的微粒,还可以是源自冷冻保存液中冷冻状态的间充质干细胞的微粒。使用将从通过扩大培养而得到的相同批次的细胞分离的源自间充质干细胞的微粒分成小部分并冷冻保存后的细胞时,在可以得到稳定的作用效果方面、操作性优异方面等是优选的。冷冻保存状态的分离的源自间充质干细胞的微粒可以在即将使用前融解并悬浮于冷冻保存液中的状态下直接给药,还可以在悬浮于输液或培养基中后给药。另外,还可以利用离心分离等方法去除冷冻保存液后混合在输液或培养基中。
此处,本发明中的“输液”是指:对人进行治疗时所使用的溶液,没有特别限定,溶液例如可列举出:生理盐水、日本药典生理盐水、5%葡萄糖液、日本药典葡萄糖注射液、林格氏液、日本药典林格溶液、乳酸林格氏液、乙酸林格氏液、1号液(初始溶液)、2号液(脱水补充剂)、3号液(维持液)、4号液(术后恢复液)等。需要说明的是,还可以以包含后述的其它成分(药学上容许的载体、添加物)的方式制备上述的输液或培养基等。
本发明的扩张型心肌病治疗剂只要在不损害本发明的效果的范围内还可以根据其用途、形态,按照常规方法含有药学上可接受的载体、添加物。作为这样的载体、添加物,例如可列举出:等渗剂、增稠剂、糖类、糖醇类、防腐剂(保存剂)、杀菌剂或抗菌剂、ph调节剂、稳定化剂、螯合剂、油性基质、凝胶基质、表面活性剂、悬浮化剂、粘结剂、赋形剂、润滑剂、崩解剂、发泡剂、流动化剂、分散剂、乳化剂、缓冲剂、助溶剂、抗氧化剂、甜味剂、酸味剂、着色剂、呈味剂、香料或清凉化剂等,但不限定于这些。
本发明的扩张型心肌病治疗剂根据目的可以以各种形态、例如固体制剂、半固体制剂、液体制剂等各种各样的剂型来提供。例如可以以固体制剂(片剂、粉末、散剂、颗粒剂、胶囊剂等)、半固体制剂[软膏剂(硬软膏剂、软软膏剂等)、霜剂等]、液体制剂[洗剂、萃取剂、悬浮剂、乳剂、糖浆剂、注射剂(包括输液剂、嵌入式注射剂、缓释型注射、使用时制备型的注射剂)、透析用剂、气雾剂、软胶囊剂、营养剂等]、贴剂、巴布剂等的形态加以利用。另外,本发明的扩张型心肌病治疗剂还可以以油性或水性的赋形剂中的溶液或乳液等的形态加以利用。进而,本发明的扩张型心肌病治疗剂还可以通过喷雾来用于患部,本发明的扩张型心肌病治疗剂还可以以喷雾后在患部被凝胶化或片化的形态加以利用。本发明的扩张型心肌病治疗剂还可以在将上述间充质干细胞制成片状或立体结构体后用于患部。
对于本发明的扩张型心肌病治疗剂,可以使用生理盐水、日本药典生理盐水、5%葡萄糖液、日本药典葡萄糖注射液、林格氏液、日本药典林格氏液、乳酸林格氏液、乙酸林格氏液、碳酸氢盐林格氏液、1号液(初始溶液)、2号液(脱水补给液)、3号液(维持液)、4号液(术后恢复液)等输液、或dmem等细胞培养培养基进行悬浮或稀释来使用,优选用生理盐水、5%葡萄糖液、1号液(初始溶液)、更优选用5%葡萄糖液、1号液(初始溶液)进行悬浮或稀释来使用。
本发明的扩张型心肌病治疗剂为液体制剂时,扩张型心肌病治疗剂的ph只要在药物上、药理学上(制药上)或生理学上可接受的范围内就没有特别限定,作为一个例子,可列举出为2.5~9.0,优选为3.0~8.5、更优选为3.5~8.0的范围。
本发明的扩张型心肌病治疗剂为液体制剂时,对于扩张型心肌病治疗剂的渗透压,只要在生物体可接受的范围内就没有特别限制。作为本发明的组合物的渗透压比的一个例子,可列举出优选为0.7~5.0、更优选为0.8~3.0,进一步优选为0.9~1.4的范围。渗透压的调节可以使用无机盐、多元醇、糖醇、糖类等,利用该技术领域中已知的方法进行。渗透压比是基于第十五次修订日本药典、试样的渗透压相对于286mosm(0.9w/v%氯化钠水溶液)的渗透压之比,渗透压参考日本药典中记载的渗透压测定法(冰点下降法)进行测定。需要说明的是,对于渗透压比测定用标准液(0.9w/v%氯化钠水溶液),可以如下制备:将氯化钠(日本药典标准试剂)在500~650℃下干燥40~50分钟后,在干燥器(硅胶)中进行自然冷却,准确称量其0.900g,溶解于纯化水中准确地制成100ml,或使用市售的渗透压比测定用标准液(0.9w/v%氯化钠水溶液)。
本发明的扩张型心肌病治疗剂还可以是如下形态:将间充质干细胞或源自间充质干细胞的微粒、及用于悬浮间充质干细胞或源自间充质干细胞的微粒的溶液分别封入不同的容器中进行保管,在使用时将两者混合来使用。需要说明的是,在保管时,上述间充质干细胞或源自间充质干细胞的微粒及用于悬浮间充质干细胞或源自间充质干细胞的微粒的溶液可以是冷冻状态,还可以是冷藏状态。
本发明的扩张型心肌病治疗剂可以适宜用于扩张型心肌病的治疗,其中,可以更适宜用于遗传性扩张型心肌病、家族性扩张型心肌病或特发性扩张型心肌病的治疗。
本发明的扩张型心肌病治疗剂的给药途径可列举出:对心脏表面的直接给药、心脏内给药、经口给药、皮下给药、肌肉给药、静脉内给药、动脉内给药、髄腔内给药、舌下给药、直肠给药、阴道给药、经鼻给药、吸入、经皮给药等,从本发明的扩张型心肌病治疗剂的有效性的观点出发,优选为对心脏表面的直接给药、肌肉给药、静脉内给药、动脉内给药。
本发明的扩张型心肌病治疗剂中,间充质干细胞的用量(给药量)可以根据患者的状态(体重、年龄、症状、身体状况等)及本发明的扩张型心肌病治疗剂的剂型等而不同,从发挥充分的扩张型心肌病治疗剂的治疗效果的观点出发,有优选间充质干细胞的量大的倾向,另一方面,从抑制副作用的表现的观点出发,有优选间充质干细胞的量小的倾向。通常,在对成人给药(喷雾)时,作为细胞数,为1×103~1×1012个/次,优选为1×104~1×1011个/次、更优选为1×105~1×1010个/次,进一步优选为5×106~1×109个/次。另外,作为患者的单位体重的间充质干细胞的给药(喷雾)量,为1×10~5×1010个/kg,优选为1×102~5×109个/kg、更优选为1×103~5×108个/kg,进一步优选为1×104~5×107个/kg。需要说明的是,可以将本用量作为1次量来进行间充质干细胞多次给药(喷雾),还可以将本用量分成多次进行给药(喷雾)。
本发明的扩张型心肌病治疗剂中,包含分泌微粒的间充质干细胞时,其用量(给药量)可以根据患者的状态(体重、年龄、症状、身体状况等)及本发明的扩张型心肌病治疗剂的剂型等而不同,从发挥充分的扩张型心肌病治疗剂的治疗效果的观点出发,其量有优选量大的倾向,另一方面,从抑制副作用的表现的观点出发,其量有优选量小的倾向。通常,在对成人给药时,作为细胞数,为1×103~1×1012个/次,优选为1×104~1×1011个/次,进一步优选为1×105~1×1010个/次,特别优选为5×106~1×109个/次。需要说明的是,可以将本用量作为1次量来进行多次给药,还可以将本用量分成多次进行给药。
本发明的扩张型心肌病治疗剂包含分泌微粒的间充质干细胞时,其用量(给药量)可以根据患者的状态(体重、年龄、症状、身体状况等)及本发明的扩张型心肌病治疗剂的剂型等而不同,通常,在对成人给药时,作为细胞数,为1×10~5×1010个/kg,优选为1×102~5×109个/kg,进一步优选为1×103~5×108个/kg,特别优选为1×104~5×107个/kg。需要说明的是,可以将本用量作为1次量来进行多次给药,还可以将本用量分成多次进行给药。
本发明的扩张型心肌病治疗剂含有分离的微粒或包含微粒的间充质干细胞培养上清液时,其用量(给药量)可以根据患者的状态(体重、年龄、症状、身体状况等)及本发明的扩张型心肌病治疗剂的剂型等而不同,通常,在对成人给药时,作为微粒,为1×104~5×1013个/kg,优选为1×105~5×1012个/kg,进一步优选为1×106~5×1011个/kg,特别优选为1×107~5×1010个/kg。需要说明的是,可以将本用量作为1次量来进行多次给药,还可以将本用量分成多次进行给药。
本发明的扩张型心肌病治疗剂可以与1种或2种以上的其它药剂一起给药。作为其它药剂,可列举出可以作为心脏疾病的扩张型心肌病治疗剂使用的任意药剂,例如可列举出:ace抑制剂、血管紧张素ii受体拮抗药、β受体阻断药、抗血小板药、华法林、钙拮抗药、硝酸药、利尿剂、hmg-coa还原酶抑制剂、胺碘酮等。需要说明的是,本发明的扩张型心肌病治疗剂与1种或2种以上的其它药剂一同给药的情况是指包括:本发明的扩张型心肌病治疗剂与其它药剂同时使用的情况,将任一种药剂给药并经过一定时间后再将另一种药剂给药的情况,它们的组合等各种情况。
本发明的扩张型心肌病治疗剂对患有扩张型心肌病的受试体发挥显著的治疗效果。上述治疗效果可以通过例如超声心动检测、病理组织学检测(心脏肥大、纤维化的检测)来加以确认。具体而言,本发明的扩张型心肌病治疗剂抑制患有扩张型心肌病的受试体的心脏肥大、心组织的纤维化,能够恢复心功能。进而能够长期维持该效果。另外,本发明的扩张型心肌病治疗剂有助于患有扩张型心肌病的受试体的心组织中的atp含量的上升、线粒体中的ant-1蛋白的表达上升等,能够提高生存率。
〈扩张型心肌病治疗剂的制备方法〉
本发明的扩张型心肌病治疗剂可以根据各自的剂型并利用常规方法将间充质干细胞或源自间充质干细胞的微粒与适当的细胞或微粒悬浮用液体等(包括药学上容许的载体、添加物)混合而得到。作为优选的一个例子,可列举出如下方法:将间充质干细胞或源自间充质干细胞的微粒悬浮于纤维蛋白原溶液中,将得到的悬浮液和凝血酶溶液实质上同时直接喷雾在疾病部位;或者,将间充质干细胞或源自间充质干细胞的微粒悬浮于凝血酶溶液中,将得到的悬浮液和纤维蛋白原溶液实质上同时直接喷雾在疾病部位,由此制备凝胶状的扩张型心肌病治疗剂。
<纤维化抑制剂>
本发明还包括扩张型心肌病的纤维化抑制剂,其含有间充质干细胞或源自间充质干细胞的微粒。上述的本发明的扩张型心肌病治疗剂具有特别是抑制扩张型心肌病中的纤维化的显著的效果,因此作为扩张型心肌病中的纤维化抑制剂也是有效的。需要说明的是,对于本发明的扩张型心肌病中的纤维化抑制剂的具体的说明,可以适用上述的扩张型心肌病治疗剂的说明。
<心脏肥大抑制剂>
本发明还包括扩张型心肌病的心脏肥大抑制剂,其含有间充质干细胞或源自间充质干细胞的微粒。上述的本发明的扩张型心肌病治疗剂具有特别是抑制扩张型心肌病中的心脏肥大的效果,因此作为扩张型心肌病中的心脏肥大抑制剂也是有效的。需要说明的是,对于本发明的扩张型心肌病中的心脏肥大抑制剂的具体的说明,可以适用上述的扩张型心肌病治疗剂的说明。
<扩张型心肌病治疗用试剂盒>
本发明还包括扩张型心肌病治疗用的试剂盒,其包含:上述的本发明的扩张型心肌病治疗剂、纤维化抑制剂或心脏肥大抑制剂、容器和标签。作为本发明的试剂盒所包含的适当的容器,没有特别限定,例如可列举出:间充质干细胞或源自间充质干细胞的微粒冷冻用的内旋盖冻存管、间充质干细胞或源自间充质干细胞的微粒悬浮用溶液用的瓶、小瓶、试验管等。这些容器可以由玻璃、金属、塑料或它们的组合等各种材料形成。这些容器上的标签上记载有用于说明内容物的内容。
<治疗方法>
本发明还包括扩张型心肌病的治疗方法,其特征在于,给予选自由间充质干细胞和源自间充质干细胞的微粒组成的组中的至少1种。根据本发明的治疗方法,针对扩张型心肌病的疾病,通过给予间充质干细胞或源自间充质干细胞的微粒,从而能够显著改善心脏等疾病部位的功能、结构等。由于上述间充质干细胞对于同种异体的被检体也不易发生排斥反应,因此可以使用对预先制备的供体的细胞进行扩大培养并冷冻保存后的细胞。另外,同样地,可以使用由对预先制备的供体的细胞进行扩大培养并冷冻保存的间充质干细胞得到的源自间充质干细胞的微粒。因此,与制备自身的间充质干细胞来使用的情况相比,还具有易于商品化且容易得到稳定的一定效果这样的优点。需要说明的是,本发明的治疗方法可以说是通过给予上述的本发明的扩张型心肌病治疗剂来治疗扩张型心肌病的方法,对于间充质干细胞和源自间充质干细胞的微粒的说明、其它说明可以适用上述的扩张型心肌病治疗剂的项中的说明。
另外,本发明还包括纤维化的抑制方法、特别是扩张型心肌病中的纤维化的抑制方法,其特征在于,给予选自由间充质干细胞和源自间充质干细胞的微粒组成的组中的至少1种。进而,本发明还包括心脏肥大、特别是扩张型心肌病中的心脏肥大的抑制方法,其特征在于,给予选自由间充质干细胞和源自间充质干细胞的微粒组成的组中的至少1种。需要说明的是,本发明的抑制方法可以说是通过给予上述的本发明的扩张型心肌病治疗剂来治疗纤维化、心脏肥大的方法,对于本发明的抑制方法中的间充质干细胞和源自间充质干细胞的微粒的说明、其它说明可以适用上述的扩张型心肌病治疗剂的项中的说明。
本发明的试剂盒可以包含包括其它添加剂、其它药剂、稀释剂、过滤器、针、注射器、记载了使用方法的附件资料在内的从商业及利用者的观点出发所期望的其它材料。
实施例
通过以下的实施例对本发明进行具体地说明,但本发明不限定于实施例。
[1]本发明的扩张型心肌病治疗剂的制备
(脂肪组织来源间充质干细胞的制备)
获得人供体的同意后,用生理盐水清洗利用吸脂法得到的皮下脂肪组织。为了实现细胞外基质的破坏和细胞的分离,添加胶原酶(roche公司)(溶剂为生理盐水),在37℃下振荡90分钟使其分散。接着,回收该细胞并将悬浮液以800g进行5分钟离心分离而得到间质血管细胞群的沉淀。在上述细胞的沉淀中加入间充质干细胞用无血清培养基(rohto公司),将该细胞悬浮液以400g进行5分钟离心分离,去除上清液后再悬浮于间充质干细胞用无血清培养基(rohto公司)中,将细胞接种于烧瓶中。将细胞在37℃下5%co2中培养数天。数天后用pbs清洗培养物来去除培养液中包含的血球、脂肪组织的残留等,得到粘附于塑料容器中的脂肪组织来源间充质干细胞(adiposederivedmesenchymalstemcells;adsc)。
(脂肪组织来源间充质干细胞的冷冻保存)
使用胰蛋白酶将得到的脂肪组织来源间充质干细胞剥离,转移至离心管中,以400g进行5分钟离心分离而得到细胞的沉淀。去除上清液后加入适量细胞冷冻保存液(stem-cellbanker(zenoaq公司))使其悬浮。将该细胞悬浮液分注于内旋盖冻存管中后,在冷冻仪内以-80度保存,然后转移至液氮上的气相中继续进行保存。
(细胞表面标记物的解析(流式细胞术))
利用流式细胞仪实施了脂肪组织来源间充质干细胞上的各种表面标记物的评价。将脂肪组织来源间充质干细胞再悬浮于facs染色用缓冲剂中。用于facs分析的抗体为fitc(异硫氰酸荧光素)或pe(藻红蛋白)标识的小鼠抗人抗体cd11b、cd45、cd73、cd90和对应的小鼠igg1同型对照抗体。细胞在室温下进行30分钟染色,接着进行清洗,使用bdfadscantoii(bdbiosciences、sanjose、ca)进行解析。数据使用bdfacsdivasoftwcre(bdbiosciences)进行分析。其结果,脂肪组织来源间充质干细胞对cd45呈阴性,对cd73、cd90呈阳性。
(喷雾用扩张型心肌病治疗剂的制备)
喷雾用的纤维蛋白原溶液和凝血酶溶液使用
[表1]
[2]移植试验1
(移植试验的方案)
将j2n-k仓鼠(20周龄、雄)开胸后,将分别封入至不同的注射器内的上述表1所示的组成的溶液a和b同时直接滴加在患有扩张型心肌病的心脏的表面(心嚢膜内)来覆盖了疾病部位(adsc组)。在介质给药组中,将j2n-k仓鼠(20周龄、雄)开胸后,将分别封入至不同的注射器内的下述表2所示的组成的溶液a’和b同时直接喷雾至患有扩张型心肌病的心脏的表面(心嚢膜内)来覆盖了疾病部位(对照组)。在伪手术中,针对j2n-k仓鼠(20周龄、雄)和未患有心肌病的正常仓鼠的j2n-n仓鼠(20周龄、雄)仅进行开胸,未进行上述的药剂的滴加(分别为sham组、正常)。
[表2]
在移植前(基线)、移植后1周、2周、3周和4周,实施了超声心动检测。在该项研究的最末期,为了对动物进行心脏组织的组织学和生化学分析而在细胞移植4周后进行了人道主义处死。以下对移植试验进行详细地说明。
(脂肪来源间充质干细胞移植实验)
针对j2n-k仓鼠(20周龄、雄)和j2n-n仓鼠(20周龄、雄),在全身麻醉下进行胸骨正中切口,实施了脂肪组织来源间充质干细胞、介质的移植或伪手术中的任一者。基于表面的瘢痕和异常的壁运动能够在视觉上确认患有心肌梗塞的部位。具体而言,对于adsc组,将分别封入在不同的注射器内的上述表1所示的组成(包含1×106个脂肪组织来源间充质干细胞)的溶液a(20μl)和b(20μl)同时直接喷雾在患有心肌梗塞的部位的表面(心脏表面)来覆盖疾病部位。在控制了温度的各个笼中使j2n-k仓鼠和j2n-n仓鼠恢复。
(脂肪组织来源间充质干细胞移植的效果)
通过检测心功能和病理组织学评价了脂肪组织来源间充质干细胞的移植对j2n-k仓鼠和j2n-n仓鼠的效果。作为心功能的检测,利用超声心动检测测量了lvef。对于病理组织学的检测,对心脏肥大和纤维化进行了评价。另外,测定了心肌组织中的atp含量。进而,由心组织分离线粒体,利用免疫印迹法测定了线粒体中表达的腺嘌呤核苷酸转运体-1(mt.ant-1、genesymbol:slc25a4)。以下对各自的评价方法进行说明。
(超声心动检测)
如上所述对j2n-k仓鼠和j2n-n仓鼠进行了麻醉。超声波心脏检测使用市售的生态机器(hitachi:prosoundf75premiercv)来实施。将8.0-mhz的环状阵列换能器用于心脏评价。j2n仓鼠和j2n-n仓鼠以左侧卧位进行检测。基于teichholz公式计算出lv舒张末期和收缩终末期容积(lvedv和lvesv)。基于下述的式子计算出左心室射血分数(lvef)。将结果示于图1。
lvef(%)=100×(lvedv-lvesv)/(lvedv)
如图1所示,在仅进行了开胸的sham组、给予了介质的对照组中,lvef经时地降低,观察到心功能的降低;但脂肪组织来源间充质干细胞的移植组中,未观察到lvef的降低,抑制了扩张型心肌病的进行。
(心组织中的atp含量的测定)
使用市售的atp测定试剂盒测定了移植后2周的心组织中的atp含量。如图2所示,对仅进行了开胸的sham组、给予了介质的对照组,与正常仓鼠相比atp含量显著降低。相对于此,脂肪组织来源间充质干细胞的移植组中,未观察到atp含量的降低,与sham组相比atp含量显著上升。
(心组织中线粒体的mt.ant-1/cox4的测定)
由移植后2周的心组织分离线粒体,利用免疫印迹法测定了线粒体中表达的腺嘌呤核苷酸转运体-1(mt.ant-1、genesymbol:slc25a4)。需要说明的是,将细胞色素c氧化酶iv亚型(cytochromecoxidase4:cox4)作为免疫印迹法中的内参照。
如图3所示,与正常仓鼠相比,仅进行了开胸的sham组、给予了介质的对照组的mt.ant-1表达量显著降低。相对于此,在脂肪组织来源间充质干细胞的移植组(adsc)中,与sham组和对照组相比mt.ant-1的表达量显著增高。同样地,测定了移植后4周的心组织中的mt.ant-1。其结果,与移植后2周同样地,在sham组和对照组中mt.ant-1的表达量为显著低的值,但在脂肪组织来源间充质干细胞的移植组(adsc)中,表达量高至与正常组之间不存在显著差异的程度。
(心脏尺寸的测定)
在移植后4周,使用心脏的he染色标本通过在显微镜下测定了心脏的直径。如图4所示,在仅进行了开胸的sham组、给予了介质的对照组中,扩张型心肌病进行,与正常仓鼠相比心脏肥大。相对于此,在脂肪组织来源间充质干细胞的移植组中,与sham组相比心脏肥大得到显著抑制,改善了扩张型心肌病。
(纤维化面积的测定)
在移植后4周,使用心脏的天狼猩红染色标本测定了纤维化面积。相对于仅进行了开胸的sham组的纤维化面积,脂肪组织来源间充质干细胞的移植j组的纤维化面积为78.3%,证实了通过间充质干细胞使扩张型心肌病的纤维化得到抑制。
(δ肌聚糖表达量的测定)
在移植后4周,利用免疫染色法测定了心脏的δ肌聚糖表达。在sham组、sham组和adsc组中的任意组中均未观察到δ肌聚糖的表达,证实了δ肌聚糖基因不受脂肪组织来源间充质干细胞的影响。
[3]移植试验2
与移植试验1同样地,针对j2n-k仓鼠(20周龄、雄),在全身麻醉下进行胸骨正中切口,移植了脂肪组织来源间充质干细胞(adsc)或介质(对照)。具体而言,与移植试验1同样地,对于adsc组,将分别封入在不同的注射器内的上述表1所示的组成(包含1×106个脂肪组织来源间充质干细胞)的溶液a(20μl)和b(20μl)同时直接滴加在患有心肌病的部位的表面(心表面)来覆盖疾病部位。在控制了温度的各个笼中使这些j2n-k仓鼠恢复。在移植前(基线)、移植后的2周、4周、8周、12周、16周和20周,实施超声心动检测通过心功能评价了脂肪组织来源间充质干细胞对j2n-k仓鼠的移植效果。作为心功能的检测,与移植试验1同样地,通过超声心动检测测量了lvef。需要说明的是,试验中使用的动物在细胞移植20周后进行了人道主义处死。
如图5所示,在给予了介质的对照组中,lvef经时降低;但在脂肪组织来源间充质干细胞的移植组(adsc)中,未观察到lvef的降低,抑制了扩张型心肌病症状的进行。另外,该抑制扩张型心肌病症状进行的效果在移植后20周这样的长期间内得到了维持。
[4]移植试验3
与移植试验1同样地,针对j2n-k仓鼠(20周龄、雄),在全身麻醉下进行胸骨正中切口,移植了全身脂肪组织来源间充质干细胞(adsc)或介质(对照)中的任一者。具体而言,与移植试验1同样地,在adsc组中,将分别封入在不同的注射器内的上述表1所示的组成(包含1×106个脂肪组织来源间充质干细胞)的溶液a(20μl)和b(20μl)同时直接喷雾在患有心肌梗塞的部位的表面(心表面)来覆盖疾病部位。在控制了温度的各个笼中使j2n-k仓鼠恢复。
其结果,示出了:对于12周后的死亡率,对照组为28.6%,而adsc给药组为12.5%,通过移植脂肪组织来源间充质干细胞而使死亡率降低。
[5]微粒的制备和针对心肌细胞的效果的研究
回收与前述同样制备的脂肪来源间充质干细胞的培养上清液,使用过滤器(0.22μm、默克密理博)将回收的培养上清液过滤后,通过离心(35000rpm、70分钟、4℃、beckmanoptimaxe-90)回收了微粒。得到的微粒的平均粒径为155±6nm(平均±标准偏差、n=3)。
将由间充质干细胞的培养上清液60ml中回收的微粒悬浮于0.5ml的pbs中。将得到的脂肪来源间充质干细胞来源微粒分别以10μl、30μl和100μl添加至人来源心肌细胞(promocell公司制、5×105个细胞/培养皿)中,测定了nadph活性作为能量产生量,结果能量产出量与微粒量呈现依赖性的增加(图6)。由此,启示出:由间充质干细胞带来的心功能改善效果可能与间充质干细胞所分泌的微粒有关。
[6]微粒所包含的蛋白的解析
在脂肪来源间充质干细胞的培养上清液(无血清培养基)100ml中加入totalexosomeisolation(thermofisherscientificinc.、商品编号:4478359)50ml,充分地进行颠倒混和。在冰箱(2~8℃)中保存一夜后进行离心分离(10000×g、1小时、2~8℃),去除了其上清液。此时将得到的沉淀悬浮于500μl的pbs中,将该悬浮液作为含有微粒的悬浮液。在含有微粒的悬浮液150μl中加入20%三氯乙酸(trichloroaceticacid(tca)和光纯药工业株式会社制)150μl,使蛋白质聚集并沉淀。在得到的沉淀总量中加入tris-hcl缓冲液(trishydrochlorideacidbuffer(tris-hcl)、ph8.5)20μl并使沉淀溶解。进而,加入包含0.01%的胰蛋白酶(trypsin、aproscienceinc.制)的tris缓冲液(tris-hcl、ph8.0),在37℃下反应20小时。然后,通过lc-ms/ms(lc:michrombioresources公司制、ms:thermofisherscientific公司制)对得到的样品溶液进行分析,结果检测出脱脂载脂蛋白a-2(apolipoproteina-2)、色素上皮衍生因子(pigmentepithelium-derivedfactor(pedf)、serpinf1)和触珠蛋白(haptoglobin)。
产业上的可利用性
根据本发明的扩张型心肌病治疗剂,能够显著改善扩张型心肌病的心脏的功能等。由于上述间充质干细胞对于同种异体的受试体也不易发生排斥反应,因此能将对预先确认了治疗效果的供体细胞进行扩大培养并冷冻保存后的细胞作为本发明的扩张型心肌病治疗剂中的间充质干细胞来使用。因此,与制备自身的间充质干细胞来使用的情况相比,具有易于商品化且容易得到一定效果这样的优点。
- 还没有人留言评论。精彩留言会获得点赞!