膜脂包被纳米颗粒及其使用方法与流程
交叉引用
本申请要求于2017年4月21日提交的美国临时申请序列号62/488,685的权益,该申请通过引用以其整体并入本文。
发明背景
溶瘤病毒(ov)是优先感染和杀死癌细胞的病毒。这些病毒生长并导致癌细胞裂解(溶瘤作用)或触发其他机制以干扰癌免疫抑制微环境并触发机体的免疫反应,从而清除癌细胞。最近成功的临床数据和药物批准增加了公众对溶瘤病毒疗法的关注。溶瘤病毒疗法的使用可与其他药物、免疫检查点抑制剂和t细胞疗法相结合,以改善癌症患者的结果。
ov的递送途径包括瘤内(i.t.)注射、静脉内(i.v.)递送和腹膜内递送,其中瘤内注射最为常用。
技术实现要素:
根据本发明,本发明提供了一种制备特定纳米颗粒的方法,所述方法包括在非盐水溶液中将包含病毒等的内核与包含衍生自细胞的细胞膜的外表面结合;对所述溶液施加超声处理以形成纳米颗粒,所述纳米颗粒包括包被有所述外表面的所述内核。
在一方面,本文提供了纳米颗粒,所述纳米颗粒包括包含病毒的内核;和包含衍生自细胞的细胞膜的外表面。
援引并入
本说明书中所提到的所有出版物、专利和专利申请均通过引用并入本文,其程度如同特别且单独地指出每个单独的出版物、专利或专利申请通过引用而并入。
附图说明
在所附权利要求书中具体阐述了本发明的新颖特征,通过参考以下对利用了本发明原理的说明性实施方案加以阐述的详细描述以及附图,将会对本发明的特征和优点获得更好的理解,在附图中:
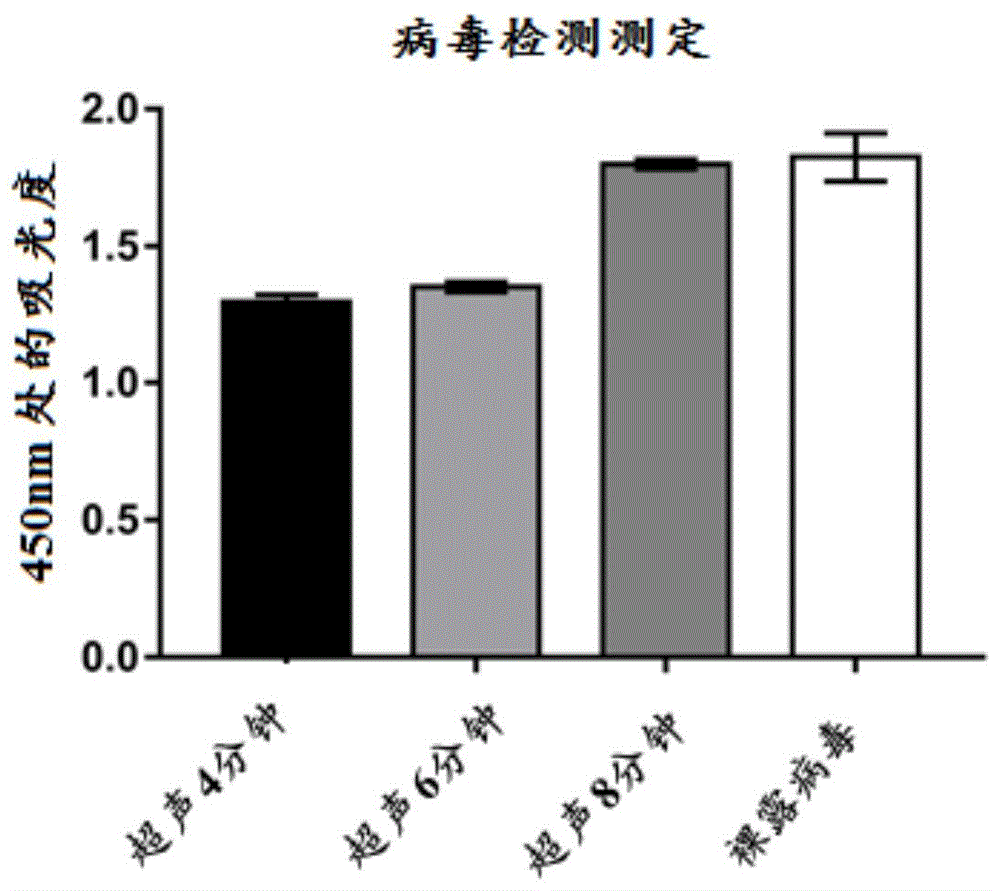
图1显示了通过分别施加4分钟、6分钟、8分钟的不同超声处理时间而制备的不同样品批次以及裸露病毒的病毒检测测定的示例性结果。
图2显示了在纳米颗粒制备过程中,通过在各种溶液中将rbc膜与病毒核心结合而制备的不同样品批次的病毒检测测定的示例性结果。有四个样品批次(将rbc膜与病毒贮存液分别在盐水、蔗糖、葡萄糖和赖氨酸-葡萄糖溶液中结合)和一个对照批次(裸露病毒)。
图3显示了裸露病毒和包被病毒的tem图像。
图4显示了通过动态光散射测量的裸露病毒和包被病毒的大小。
图5显示了病毒检测测定的示例性结果,表明该病毒得到包被,其在450nm处的吸光度非常低,而裸露病毒在此处的吸光度要高得多。
图6提供了在包被病毒纳米颗粒经过去包衣处理后得到的裸露病毒相比于包被病毒的后续病毒检测测定。
具体实施方式
目前,大多数溶瘤病毒疗法仅限于局部区域注射(如瘤内注射,i.t.),且单次注射是否足以达到治疗效果仍在研究中。此外,一些ov已被证明具有急性、短暂的毒性形貌,因此,注射病毒可能引起竞争性的免疫反应以对抗病毒,而不是对抗肿瘤细胞。静脉内递送ov也存在问题,即ov可能很快从血流中清除,因此需要频繁或高剂量施用,导致治疗成本增加和潜在的安全问题。因此,需要提供一种包含ov的组合物,该组合物可被施用并在长时间段内保持在循环中,以便最终将治疗剂递送至靶细胞。
本领域中已知采用聚乙二醇(peg)来实现纳米颗粒上的隐身部分。然而,可能触发抗peg免疫学反应,因此这种方法是有问题的。已经提出了替代的方法,诸如利用两性离子材料(例如聚(羧基甜菜碱)和聚(磺基甜菜碱))。
最近实现了一种自上而下的仿生方法,该方法通过用包含膜脂和相关膜蛋白的天然红血球膜包被来提供功能化的纳米颗粒,从而提供长期循环的货物递送。参照c-m.j.hu等人,“erythrocytemembrane-camouflagedpolymericnanoparticlesasabiomimeticdeliveryplatform,”proc.natl.acad.sci.usa2011年7月5日;108(27):10980-10985。特别地,衍生自血细胞(例如,红细胞(rbc)、白细胞(wbc)或血小板)的膜脂对于包被除了溶瘤病毒等之外的多种物质尤其令人感兴趣。
按照已知的方法,进行了多种尝试来用rbc包被的溶瘤病毒制备纳米颗粒,但均未成功。这是首次将溶瘤病毒等用rbc膜包被。根据本发明的实践,惊讶地发现,制备本文公开的本发明纳米颗粒必须采用一定的条件。
本文所指的“溶瘤病毒”包括但不限于疱疹病毒;牛痘病毒;呼肠孤病毒;腺病毒;麻疹病毒、细小病毒,或它们的组合。
本领域中已知,病毒可以用作递送自杀基因、编码酶的载体,其可以将单独施用的无毒前药代谢成强有力的细胞毒素,该细胞毒素可以扩散到邻近细胞并杀死它们。因此,本文公开的治疗剂还包括这样的载体、自杀基因或编码酶。
根据本发明,令人惊讶地发现了一种制备纳米颗粒的方法,该方法包括在非盐水溶液中将包含病毒(一种治疗剂)的内核与包含细胞膜的外表面结合;对所述溶液施加超声处理以形成纳米颗粒,所述纳米颗粒包括包被有所述外表面的所述内核。与在内核方法的细胞膜包被中需要盐溶液如盐水和pbs溶液的已知方法相反,在对病毒如溶瘤病毒进行包被时需要的是非盐水溶液(例如含糖溶液)或类似溶液(如与糖具有相似性质的组分的水溶液)。根据本发明的实践,首次地制备出了一种纳米颗粒,该纳米颗粒包括包含病毒的内核;和包含衍生自细胞的细胞膜的外表面。令人惊讶地发现,在制备包含病毒等核心的纳米颗粒的过程中,需要使用5%至15%、7%至14%、9%至11%的非盐水溶液(如含糖溶液)。在一些实施方案中,在制备包含病毒等核心的纳米颗粒的过程中,需要使用5%、6%、7%、8%、9%、10%、11%、12%、13%、14%或15%的非盐水溶液(如含糖溶液)。
在一些实施方案中,提供了一种纳米颗粒,该纳米颗粒包括包含病毒的内核;和包含衍生自细胞的细胞膜的外表面。在某些实施方案中,所述病毒为溶瘤病毒。在某些实施方案中,所述溶瘤病毒为疱疹病毒;牛痘病毒;呼肠孤病毒;腺病毒;麻疹病毒、细小病毒,或它们的组合。在某些实施方案中,所述病毒为腺病毒。
在一些实施方案中,所述细胞为血细胞、脂肪细胞、干细胞、内皮细胞、外泌体、分泌小泡或突触小泡。在某些实施方案中,所述血细胞为红细胞、白细胞或血小板。在某些实施方案中,所述血细胞为红细胞。
在一些实施方案中,提供了一种制备纳米颗粒的方法,该方法包括在非盐水溶液中将包含病毒的内核与包含衍生自细胞的细胞膜的外表面结合;对所述溶液施加超声处理以形成纳米颗粒,所述纳米颗粒包括包被有所述外表面的所述内核。在某些实施方案中,所述非盐水溶液包含糖或其类似物(如与糖具有相似性质的组分的水溶液)。在某些实施方案中,所述非盐水溶液为糖溶液。在某些实施方案中,所述糖溶液为含有蔗糖或葡萄糖的溶液。在一些实施方案中,所述病毒为溶瘤病毒。在某些实施方案中,所述溶瘤病毒为疱疹病毒;牛痘病毒;呼肠孤病毒;腺病毒;麻疹病毒、细小病毒或它们的组合。在某些实施方案中,所述溶瘤病毒为腺病毒。在一些实施方案中,所述细胞为血细胞、脂肪细胞、干细胞、内皮细胞、外泌体、分泌小泡或突触小泡。在某些实施方案中,所述血细胞为红细胞、白细胞或血小板。在某些实施方案中,所述血细胞为红细胞。
本发明提供一种用于递送治疗剂如溶瘤病毒的细胞膜衍生纳米颗粒。该治疗剂基本上是通过用细胞膜脂将治疗剂如溶瘤病毒包被来进行伪装。
在一些实施方案中,治疗剂如溶瘤病毒包被有与受试者(例如患者)血流内的循环相容的脂质。这允许药物经由epr(增强的渗透性和滞留)效应递送到肿瘤脉管系统,其中某些分子倾向于在肿瘤组织中的积累得要比在正常组织中多。epr效应通常被用来描述纳米颗粒和脂质体向癌组织的递送。其中一个示例是关于用金纳米颗粒进行热烧蚀的研究。因此,在一些实施方案中,本文公开的纳米颗粒将在肿瘤脉管结构附近聚集,并且治疗剂(例如ov)将与癌细胞接触。然后ov感染细胞,导致细胞裂解、死亡或清除。
在一些实施方案中,本文提供了纳米颗粒,该纳米颗粒包括包含溶瘤病毒等的内核;和包含衍生自诸如血细胞(例如红细胞(rbc或红血球)、白细胞或血小板)、脂肪细胞、干细胞、内皮细胞等细胞的细胞膜的外表面。在某些实施方案中,所述细胞膜衍生自血细胞,如红细胞。
在一些实施方案中提供了用于制备本文公开的纳米颗粒的方法。例如,血细胞可以从全血中提纯,或来自从血液供应商获得的经处理的红细胞。rbc由于其在人血液中的丰富性和从单个供体收集血液的便利性而特别可用作膜源。rbc可以以红血球血影(或rbc血影)的形式提供,其中内部蛋白被耗尽,留下基本完整的膜组分。使用rbc血影还减少了rbc细胞蛋白的存在,这些蛋白可能会在包被过程中产生干扰。在一些实施方案中,rbc是o型阴性血细胞(即“万能供体”)。这种膜源可用于制备纳米颗粒,以将治疗剂(例如ov)递送给更多的受试者。在某些实施方案中,可以将衍生自同一患者的细胞膜用于纳米颗粒的个性化批次。
相较于peg包被纳米颗粒等其他平台,rbc膜衍生的纳米颗粒具有很多表面标志物,如cd47、cd59(mac抑制蛋白,避免补体细胞裂解)、cd55(daf)、cd35(cr1)以及免疫球蛋白超家族中的其他成员,以保护其自身不被身体清除。在一些实施方案中,本文中用于包被的细胞膜可进一步并入非脂质组分,如细胞表面标志物、mhc分子和糖蛋白。在其他实施方案中,所述细胞膜可进一步并入亲水组分,如peg。
如本文所用的,术语“细胞膜”是指在细胞或新兴病毒颗粒(emergentviralparticle)内或周围作为选择性屏障的生物膜封闭或分离结构。细胞膜可选择性渗透离子和有机分子,并控制物质进出细胞的移动。细胞膜包括磷脂单层或双层,以及可选的相关蛋白质和碳水化合物。如本文所用的,细胞膜是指从细胞或细胞器的天然存在的生物膜获得的膜,或由其衍生的膜。
如本文所用的,术语“天然存在的”是指在自然界中存在的。
如本文所用的,术语“由其衍生”是指天然膜的任何后续修饰,如分离细胞膜,产生膜的部分或片段,从取自细胞或细胞器的膜去除和/或向其添加某些组分,如脂质、蛋白质或碳水化合物。膜可以通过任何适用的方法从天然存在的膜获得。例如,膜可以从细胞制备或分离,并且制备或分离的膜可以与其他物质或材料结合以形成衍生膜。在另一实例中,可以将细胞重组工程化,以产生在体内并入其膜的“非天然”或“天然”物质,并且可以从该细胞制备或分离细胞膜或病毒膜,从而形成衍生膜。
细胞膜可由已知的方法制备。例如,将细胞用微流化器(mf)或低渗溶液如水破碎,然后用盐水或pbs进行超滤或渗滤。在一些情况下,具有较高离子强度的溶液可用于从猪肝中去除血液,因此pbs或nacl溶液可有助于通过过滤过程去除细胞内物质。抗凝剂,如edta,也可以用于在例如渗滤期间去除杂质。在一些实施方案中,可以使用切向流过滤(tff)装置或离心来将膜提纯。可以例如通过bca蛋白测试来测试提纯的膜组分中细胞蛋白的存在。优选地,在包被之前去除大部分非膜组分。
尽管付出了很多努力,但发现按照已知方法,如us2013/0337066中的程序,病毒(如溶瘤病毒)或crispr(来自病毒的dna序列)无法被细胞膜(例如rbc膜)包被或封装。令人惊讶地发现,只有在某些条件下,细胞膜(例如rbc血影)才可以包被病毒等。本文公开的制备纳米颗粒的方法需要(1)对rbc血影和ov的混合物进行超声处理,该超声处理在(2)非盐溶液如蔗糖溶液中进行。
根据本发明的实践,适用于包被的病毒包括溶瘤病毒以及其他可以感染癌细胞的病毒。病毒可具有包膜形式或无包膜形式。在一些实施方案中,优选采用病毒载体,因为它们可以感染癌细胞并复制(复制能力)。
某些制药和医学术语
如本文所用的,就制剂、组合物或成分而言,术语“可接受的”是指对所治疗的受试者的总体健康没有持续的有害影响。
如本文所用的,术语“运载体”是指相对无毒的化学化合物或药剂,其促进化合物向细胞或组织中的并入。
如本文所用的,术语“共同施用”等意指包括将选择的的治疗剂施用给单个患者,还旨在包括这样的治疗方案,其中药剂以相同或不同的施用途径或在相同或不同的时间施用。
术语“稀释剂”是指在递送前用于稀释感兴趣化合物的化学化合物。稀释剂也可以用来稳定化合物,因为它们可以提供更稳定的环境。本领域中,溶解在缓冲液(其也可提供ph控制或保持)中的盐用作稀释剂,包括但不限于磷酸盐缓冲盐溶液。
如本文所用的,术语“有效量”或“治疗有效量”是指足够量的所施用的药剂或化合物,其将会在一定程度上减轻所治疗的疾病或病症的一种或多种症状。结果可能是疾病的迹象、症状或原因的减少和/或缓解,或任何其他期望的生物系统的改变。例如,用于治疗用途的“有效量”是在临床上显著减少疾病症状所需的包含如本文公开的化合物的组合物的量。在任何个体情况下,可以使用诸如剂量递增研究等技术来确定适当的“有效”量。
如本文所用的,术语“增强”是指增加或延长期望效果的效力或持续时间。因此,关于增强治疗剂的效果,术语“增强”是指在效力或持续时间上增加或延长其他治疗剂对系统的效果的能力。如本文所用的,“增强有效量”是指足以增强另一种治疗剂在所需系统中的效果的量。
术语“药物组合物”是指纳米颗粒(即本文所述的纳米颗粒)与其他化学组分的混合物,该其他化学组分是例如崩解剂、粘合剂、润滑剂、运载体、稳定剂、稀释剂、分散剂、悬浮剂、增稠剂和/或赋形剂。药物组合物促进化合物向生物体的施用。本领域存在多种施用化合物的技术,包括但不限于静脉内施用、口腔施用、气溶胶施用、肠胃外施用、眼部施用、肺部施用和局部施用。
术语“受试者”或“患者”包括哺乳动物。哺乳动物的实例包括但不限于哺乳动物纲的任何成员:人、非人灵长动物如黑猩猩以及其他猿和猴物种;农场动物,如牛、马、绵羊、山羊、猪;家养动物,如兔、狗和猫;实验动物,包括啮齿动物,如大鼠、小鼠和豚鼠等。在一个实施方案中,哺乳动物为人。
如本文所用的,术语“治疗”包括缓解、减轻或改善疾病或病症的至少一种症状;预防其他症状;抑制该疾病或病症,例如阻止该疾病或病症的发展;减轻疾病或病症;引起疾病或病症的消退;减轻由疾病或病症引起的状况;或预防性和/或治疗性停止疾病或病症的症状。
本文描述的所有各种实施方案或选项可在任何和所有变化中进行组合。以下的实施例仅用于说明本发明的,并非以任何方式解释为限制本发明。
实施例
实施例1:细胞膜制备的示例性制备
细胞膜制备(例如rbc血影制备)是本领域已知的。在此,按照制备细胞膜——rbc细胞膜的非限制性实例来提供用于本发明纳米颗粒制备的示例性细胞膜。
设备和材料要求:
程序:
1.将浓缩红细胞袋放置于-80℃的冰箱中并冷冻过夜。次日早晨将浓缩红细胞在4℃的冰箱中解冻。
2.向培养基瓶中倒入360ml0.5mmedta,储存于冰箱中过夜。
3.将来自prbc的40ml血液添加至培养基瓶,摇动以混合均匀。在冰箱中温和地混合30min。
4.将400mlwfi水置入tff(milliporelabscaletff系统)过程贮液池中并关闭贮液池。启动tff系统,将流量旋钮转到4级。将系统再循环5min,并驱动所有的水通过渗透管线以预湿过滤器(microporepellicon2微型tff过滤器,pxdvppc50)。暂停系统。
5.将来自步骤3的混合物倒入tff过程贮液池中。
6.将混合物浓缩至100ml。
7.用400mlpbs进行渗滤。将pbs缓慢倒入贮液池中,以使贮液池中的溶液保持在100±50ml。
8.用200ml0.5mmedta进行渗滤。将edta溶液缓慢倒入贮液池中,以使贮液池中的溶液保持在100±50ml。
9.最后浓缩至40ml。监测压力,降低泵速以使压力<40psi。
10.将脂质泵入50ml锥形管中,储存在-80℃的冷冻箱中以供进一步分析来确认细胞膜的制备和/或过程。
实施例2:按照已知方法用不同超声处理时间研究来制备包含病毒核心的纳米颗粒的失败尝试
该程序描述了使用探针超声处理的针对1ml包被病毒(10^10个vp/ml)的实验室规模过程。该过程中所用的赋形剂细胞膜(例如红血球膜)相当于以0.1ml浓缩红细胞为原材料。以下是关于按照已知方法尝试制备包含病毒核心的纳米颗粒的详细描述。
由于开始数次尝试按照已知方法(如美国公开号2013/0337066中的方法)制备包含病毒核心的纳米颗粒均未成功,因此我们决定通过施加不同的超声处理时间(4分钟、6分钟、8分钟)来探索能量条件,希望能够制备出包含示例性病毒(即人类腺病毒5型)核心的纳米颗粒。
设备和材料:以下是用于合成1ml包被病毒的设备和材料的简要说明:
探针式超声波仪:qsonicaxl2000
原材料清单:
程序:
1.向1.5ml微型离心管中添加800μl盐水。
2.向管中添加200μlrbc膜(1.5mg/ml),混合均匀。这会使过程混合物具有0.3mg/ml的膜。
3.打开探针式超声波仪的电源,用70%乙醇擦拭探针,并且仅将探针移入生物罩。
4.将超声波仪的功率调整到2级(输出约3w)。
5.准备具有冷水的冰盒,以使过程温度保持在小于4℃。
6.将10μl腺病毒贮存液(vectorbiolabs,批号20170922)添加到过程混合物中。
7.将管放入冰盒中。将探针浸入管中。不要让探针触碰底部。
8.对混合物进行手动超声处理,超声持续1秒,每次超声间隔1秒。保持这个步骤持续4分钟、6分钟、8分钟,以生产三个样品批次。
9.对于裸露病毒,按照步骤1~8进行,但将步骤2中的溶液改用分子级的水。
10.按照供应商的程序(virusyscorporation,ak290-2)获得每个批次的夹心法elisa数据。
包被的病毒纳米颗粒将通过病毒检测测定来确认。该测定是一种双抗体(夹心法)elisa,它利用单克隆抗腺病毒抗体从样品中捕获抗原。样品温育后,添加生物素化的检测抗体,该步骤之后添加hrp-链霉亲和素。通过添加hrp底物,之后添加终止试剂使六邻体抗原的存在可视化。孔内颜色的显现表明样品中存在腺病毒六邻体抗原。出于定量目的,virusys提供了单独的校准套件(ak291,腺病毒抗原校准套件),其可与该产物结合使用以生成用于定量测量的标准曲线。
结果显示,基于病毒检测测定(见图1),施加4分钟超声处理时间似乎提供了更好的结果。然而,当比较所有批次与对照样品(即裸露病毒样品)之间的测试结果时,吸光度差异不够大,难以证明病毒包被成功。因此,需要改变其他条件。
实施例3:按照已知方法用高剪切均质器制备包含病毒核心的纳米颗粒的失败尝试
使用的设备和材料与实施例2中相同,但使用pbs溶液用于rbc膜与病毒贮存液的混合。混合物之后经历高剪切均质器处理,细节如下。
程序:
1.将冷水倒入lm10高剪切匀质器(microfluidics)的冷却箱内。将压缩空气连接到机器,调整空气压力到120psi左右。
2.用100ml去离子水填充贮液池,处理压力设为10kpsi。将系统用去离子水和pbs洗涤两次。
3.将14mlpbs与1ml细胞脂质(1.5mg/ml)和50μl腺病毒(10^12个vp/ml,vectorbiolabs)混合,将混合物倒入贮液池中。
4.启动机器,重复高剪切冲程5次
5.从产物容器中收集样品。
实验不成功,使用病毒检测测定未检测到病毒。该病毒可能被设备产生的高剪切力破坏。因此,尽管成功地将rbc膜施加于包含非病毒材料的核心,但产生本文公开的包含示例型病毒核心的成功纳米颗粒的条件仍然存在问题。
实施例4:改变不同混合物溶液来制备包含病毒核心的纳米颗粒的尝试
在已知的方法和科学原理中,由于盐水或pbs溶液被用于制备rbc血影,因此在rbc膜包被或封装过程中需要盐水或pbs溶液。与已知的程序相反,本文使用了一些非盐溶液来探究“非传统”程序。
1.在1.5ml微型离心管中添加800μl不同种溶液(例如盐水、蔗糖、葡萄糖、赖氨酸-葡萄糖)。
2.向管中添加200mlrbc膜(1.5mg/ml),混合均匀。这会使过程混合物具有0.3mg/ml的膜。
3.打开探针式超声波仪的电源,用70%的乙醇擦拭探针,并且仅将探针移入生物罩。
4.将超声波仪的功率调整到2级(输出约3w)。
5.准备具有冷水的冰盒,以使过程温度保持在小于4℃。
6.将10μl腺病毒贮存液(vectorbiolabs,批号20170721.2)添加到过程混合物中。
7.将管放入冰盒中。将探针浸入管中。不要让探针触碰底部。
8.对混合物进行手动超声处理,超声持续1秒,每次超声间隔1秒。保持这个步骤持续4分钟以生产多个批次。
9.按照供应商的程序(virusyscorporation,ak290-2)获得夹心法elisa数据,以用于所制备批次的确认和比较。
根据us2013/0337066中描述的已知程序,应该使用盐水或pbs来制备纳米颗粒。然而,图2中清楚地显示,盐水批次产生了非常差的封装(或包被)纳米颗粒的结果,因为elisa测定显示,与未包被病毒(对照)相比,其吸光度几乎相同。另一方面,出乎意料且令人惊讶的是,非盐溶液批次,如含糖溶液批次(例如蔗糖、葡萄糖和赖氨酸-葡萄糖),表现出低得多的吸光度,这表明在病毒核心上更多且更好地包被了rbc膜。
实施例5:示例性条件下rbc膜对溶瘤病毒的包被
为了验证将非盐溶液用于rbc膜与病毒贮存液的混合所发现的出乎意料的结果,使用如下所示的示例性发明程序来制备包含病毒核心的纳米颗粒。
设备、材料与实施例2中相同,但将11%蔗糖溶液用于rbc膜与病毒贮存液的混合。
原材料清单:
缓冲液和溶液清单:
程序:
1.向1.5ml微型离心管中添加800μl11%蔗糖溶液。
2.向管中添加200μlrbc膜(1.5mg/ml),混合均匀。这会使过程混合物具有0.3mg/ml的膜。
3.打开探针式超声波仪的电源,用70%乙醇擦拭探针,并且仅将探针移入生物罩。
4.将超声波仪的功率调整到2级(输出约3w)。
5.准备具有冷水的冰盒,以使过程温度保持在小于4℃。
6.将2.5μl示例性溶瘤病毒(例如,腺病毒贮存液(vectorbiolabs,批号20170721.2))添加到过程混合物中,致使混合物中蔗糖溶液为9%左右。本领域技术人员可以预期,在相似的条件下5%-15%的糖溶液都将可行。
7.将管放入冰盒中。将探针浸入离心管中。不要让探针触碰底部。
8.对混合物进行手动超声处理,超声持续1秒,每次超声间隔1秒。保持这个步骤4分钟以制备含病毒核心的纳米颗粒。
9.对于裸露病毒,按照步骤1~9进行,但将步骤2中的溶液改用分子级的水。
通过透射电子显微镜(tem)将所得的包被纳米颗粒成像。图3显示了裸露病毒与rbc膜包被病毒的图像对比。粒径对比如图4所示,其表明包被层约为10nm。tem图像显示纳米颗粒的大小在110nm-120nm范围内(约118nm)。
图5显示,rbc膜包被病毒被保护免于检测出抗体,而裸露病毒得到清楚显示;吸光度差异非常显著,表明rbc膜包被的效果非常好。接下来,使包被的纳米颗粒经历去除rbc膜的过程,然后经受相同的elisa测试以进一步确认包被结果。
对于包衣去除,将200μl包被病毒与50μl样品制备缓冲液(virusyscorporation,含表面活性剂)混合,然后进行elisa检测。图6显示,在去除rbc膜后,再次检测到病毒,确认了之前的包被病毒。
虽然本文已经示出和描述了本发明的优选实施方案,但对于本领域技术人员显而易见的是,这些实施方案仅以示例的方式提供。在不脱离本发明的情况下,本领域技术人员现在将会想到多种变化、改变和替换。应当理解,本文所述的本发明实施方案的各种替代方案可用于实施本发明。旨在以下列权利要求限定本发明的范围,从而涵盖这些权利要求的范围内的方法和结构及其等同物。
- 还没有人留言评论。精彩留言会获得点赞!