治疗进行性核上性麻痹的PPARγ激动剂的制作方法
相关申请的交叉引用
本申请要求2017年4月3日提交的美国临时专利申请序列号62/480,838和2018年4月2日提交的美国临时专利申请序列号62/651,653的优先权,其各自内容通过引用其全文纳入本文。
发明领域
本发明涉及治疗进行性核上性麻痹的方法。本发明还涉及(至少部分涉及)使用chs-131治疗样品中神经丝轻链蛋白水平升高(例如,相较于神经丝轻链蛋白参照水平)的对象的方法,所述样品包含获自所述对象的脑脊液、血液、血清或血浆。
背景技术:
神经性病症可以导致永久和不可逆的损伤,其可以影响患者的生活质量,例如语言、认知技能、运动技能和新陈代谢。对于诊断为早期或中期神经性病症的患者,需要能够延缓对象中神经性病症症状出现的治疗。
进行性核上性麻痹是一种残酷且致命的tau蛋白病,其占美国全部帕金森病病例的约10%。psp患者表现出多种运动功能障碍,包括姿势不稳,跌倒,步态异常,运动迟缓,垂直凝视麻痹,假性球性麻痹和无肢体僵直的轴向僵硬,以及认知障碍,包括冷漠,执行功能丧失和流利度降低。psp的神经病理学特征在于异常胞内微管相关蛋白tau的积累,导致不可溶的成对螺旋丝。psp神经变性的神经病理学表现位于皮质下区域,包括黑质、苍白球和丘脑下核。psp的神经变性的特征在于激活的小胶质细胞和星形胶质细胞的组织破坏和细胞因子概况。这些发现与作为psp中氧化应激和炎症局部来源的这些激活的神经胶质细胞一致。
美国每年有大约1400例psp的新诊断,平均生存期为5.9-6.9年。目前尚无用于psp的疾病改良治疗。当前的护理标准是姑息治疗。处于疾病晚期的患者通常会插入饲管以避免窒息的危险并提供营养。
虽然有一些疗法可以减轻psp的一些症状,但没有一种可以保护大脑或减缓神经细胞的衰退。当前用于治疗psp的症状的药物包括多巴胺激动剂,三环抗抑郁药,美塞麦肽(methysergide),奥那肉毒杆菌毒素a(onabotulinumtoxina)(用于治疗面部肌肉僵硬)。然而,随着疾病进展和症状恶化,药物可能无法充分减轻症状。
因此,需要对进行性核上性麻痹进行新的安全且有效的治疗。
发明概述
现已发现过氧化物酶体增殖物激活受体γ(pparγ)激动剂int131(chs131)可有效治疗进行性核上性麻痹(“psp”)。pparγ是一种属于配体激活的转录因子超家族的转录因子,包括类固醇,甲状腺和类视黄醇受体[thiemermann,2004#12090]。迄今为止,pparγ激动剂已成为包括肥胖症、2型糖尿病和血脂异常等新陈代谢疾病的治疗剂。当前,已经证明新型选择性pparγ激动剂chs-131将减少炎症并且在复发型多发性硬化患者中具有神经保护性。
一方面,本发明提供了治疗进行性核上性麻痹及其症状的方法。该方法通常包括给予有需要的对象治疗有效量的美国专利7,601,841中描述的化合物int131。int131在pparγ激动剂中是独特的,因为它在中枢神经系统中发挥有效的抗炎作用而没有全身免疫抑制的迹象,并且是非常有限数量的pparγ途径的选择性激活剂。其中,int131敏感途径是包括由激素脂联素调节的那些途径在内的代谢途径。
作为这种选择性激活的结果,给予患者int131导致比给予其他pparγ激动剂更少的副作用。例如,int131在降低hba1c水平方面与45mg吡格列酮同样有效,但服用int131的对象比服用吡格列酮的对象经历更少的水肿、体重增加和血液稀释。参见depaoli等人,diabetescare.2014年7月;37(7):1918-23。因此,可以给予int131来治疗psp,同时限制副作用。限制副作用是有利的,因为它有助于保持服用药物的对象的生活质量并且能够改善对象服用药物的顺应性。
具体地,本发明提供了一种治疗有此需要的对象的进行性核上性麻痹或其症状的方法,包括给予所述对象包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体的药物组合物
在一个实施方式中,式(i)化合物(即int131)以苯磺酸盐的形式提供。
在一个实施方式中,治疗有效量为约0.1至约15mg。在另一个实施方式中,治疗有效量为约1至约10mg。在另一个实施方式中,治疗有效量为约2至约6mg。在另一个实施方式中,治疗有效量为约3mg。在另一个实施方式中,治疗有效量为约15mg,约14mg,约13mg,约12mg,约11mg,约10mg,约9mg,约8mg,约7mg,约6mg,约5mg,约4mg,约3mg,约2mg,或约1mg。
用于本发明方法的药物组合物可以每天两次,每天,每隔一天,每周三次,每周两次,每周,每隔一周,每月两次或每月给予所述对象。
优选地,本发明的方法导致对象中脂联素水平增加至少约30%,至少约68%,至少约175%或至少约200%。
本文提供了治疗对象的方法,所述方法包括:选择样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平(例如,本文所述的任何示例性神经丝轻链蛋白参照水平)升高的对象,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和向所选择对象给予药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体
本文还提供了为对象选择治疗的方法,所述方法包括:鉴定样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平(例如,本文所述的任何示例性神经丝轻链蛋白参照水平)升高的对象,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和针对鉴定的对象选择药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。本文所述方法中任一个的一些实施方式进一步包括向鉴定的对象给予选择的治疗。
本文还提供了选择治疗对象的方法,所述方法包括:鉴定样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平(例如,本文所述的任何示例性神经丝轻链蛋白参照水平)升高的对象,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和选择所述鉴定的对象进行使用药物组合物的治疗,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了选择参与临床试验的对象的方法,所述方法包括:鉴定样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平(例如,本文所述的任何示例性神经丝轻链蛋白参照水平)升高的对象,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和选择所述鉴定的对象参与临床试验,所述临床试验包括给予包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体的药物组合物。
本文还提供了预测对象中治疗功效的方法,所述方法包括:确定样品中神经丝轻链蛋白的水平,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和确定使用药物组合物的治疗在样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平(例如,本文所述的任一示例性神经丝轻链蛋白参照水平)升高的对象中比在样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平不升高的对象中更可能有效,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体,所述样品包含获自所述对象的脑脊液、血液、血清或血浆。
在本文所述任何方法的一些实施方式中,所述对象尚未诊断为神经性病症或神经组织损伤。在本文所述任何方法的一些实施方式中,所述对象并不存在神经性病症或神经组织损伤的症状(例如,本文所述或本领域已知的神经性病症或神经组织损伤的任何症状)。在本文所述任何方法的一些实施方式中,所述对象尚未诊断患有神经性病症(例如,本文所述或本领域已知的任何神经性病症)或神经组织损伤。在本文所述任何方法的一些实施方式中,所述对象经诊断患有进行性核上性麻痹。在本文所述任何方法的一些实施方式还包括进行试验以确定获自对象的样品中神经丝轻链蛋白的水平(例如,本文所述或本领域已知用于确定神经丝轻链蛋白水平的任何示例性试验)。在本文所述任何方法的一些实施方式中,所述试验是单分子阵列试验。
在本文所述任何方法的一些实施方式中,所述对象之前曾经接受过不同的药物组合物给药,并且确定所述不同的药物组合物不具有治疗效果。
本文还提供了确定对象中治疗功效的方法,所述方法包括:确定样品中神经丝轻链蛋白的第一水平,所述样品包含在第一时间点获自所述对象的脑脊液、血液、血清或血浆;确定样品中神经丝轻链蛋白的第二水平,所述样品包含在第二时间点获自所述对象的脑脊液、血液、血清或血浆,其中所述对象在所述第一和第二时间点期间接受至少一个剂量的药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体;和将所述药物组合物鉴定为在如下所述对象中有效,所述对象中神经丝轻链蛋白的第二水平相较于所述神经丝轻链蛋白的第一水平降低。
在本文所述任何方法的一些实施方式中,所述对象是临床试验的参与者。在本文所述任何方法的一些实施方式中,所述方法还包括给予经鉴定在所述对象中有效的所述药物组合物的一个或多个增加的剂量。
本文提供了治疗对象的方法,所述方法包括:选择在第二时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第二水平相较于在第一时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第一水平升高的对象;和向所述选择的对象给予药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了为对象选择治疗的方法,所述方法包括:鉴定在第二时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第二水平相较于在第一时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第一水平升高的对象;和针对所述鉴定的对象选择药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。本文所述方法中任一个的一些实施方式进一步包括向鉴定的对象给予选择的治疗。
本文还提供了选择治疗对象的方法,所述方法包括:鉴定在第二时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第二水平相较于在第一时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第一水平升高的对象;和选择所述鉴定的对象进行使用药物组合物的治疗,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了选择参与临床试验的对象的方法,所述方法包括:鉴定在第二时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第二水平相较于在第一时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第一水平升高的对象;和选择所述鉴定的对象参与临床试验,所述临床试验包括给予包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体的药物组合物。
在本文所述任何方法的一些实施方式中,其中所述对象尚未诊断为神经性病症(例如,本文所述或本领域已知的任何神经性病症)或神经组织损伤。在本文所述任何方法的一些实施方式中,所述对象并不存在神经性病症或神经组织损伤的症状(例如,本文所述或本领域已知的神经性病症或神经组织损伤的任何症状)。在本文所述任何方法的一些实施方式中,所述对象经诊断患有神经性病症(例如,本文所述或本领域已知的任何神经性病症)或神经组织损伤。在本文所述任何方法的一些实施方式中,所述对象经诊断患有进行性核上性麻痹。
在本文所述任何方法的一些实施方式包括进行试验以确定分别在第一时间点和第二时间点获自对象的样品中神经丝轻链蛋白的第一水平和第二水平(例如,本文所述或本领域已知用于确定神经丝轻链蛋白水平的任何试验)。在本文所述任何方法的一些实施方式中,所述试验是单分子阵列试验。
在本文所述任何方法的一些实施方式中,所述对象之前曾经接受过不同的药物组合物给药,并且确定所述不同的药物组合物不具有治疗效果。在本文所述任何方法的一些实施方式中,所述对象尚未诊断为神经性病症(例如,本文所述或本领域已知的任何神经性病症)或神经组织损伤。在本文所述任何方法的一些实施方式中,所述对象并不存在神经性病症或神经组织损伤的症状(例如,本文所述或本领域已知的神经性病症或神经组织损伤的任何症状)。
附图简要说明
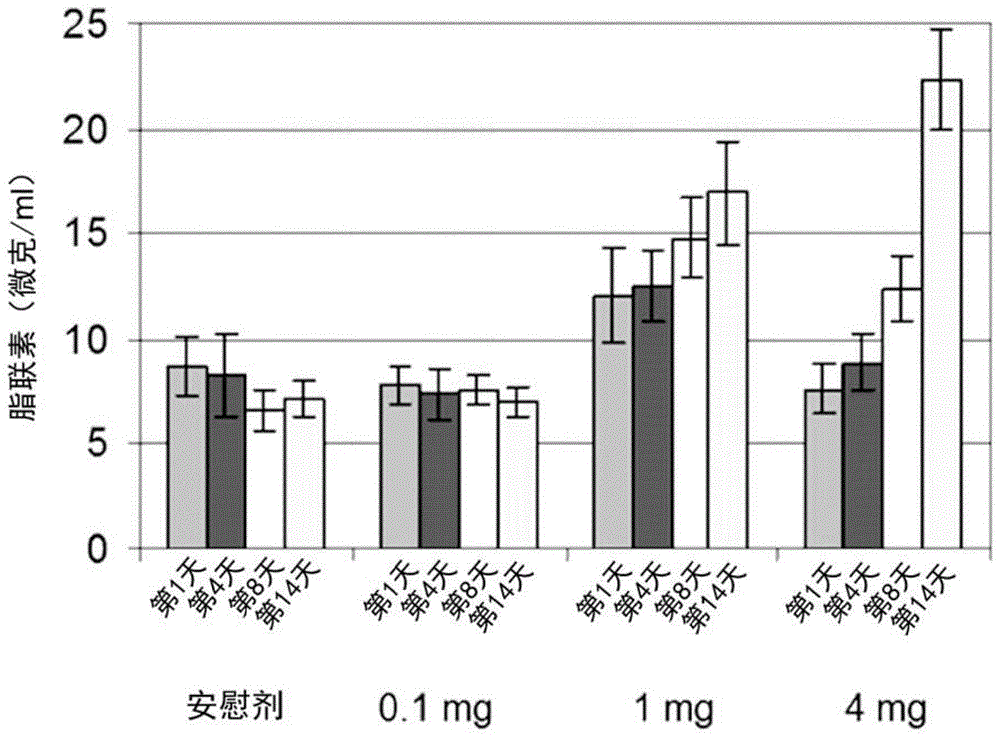
图1:给予安慰剂或0.1、1.0或4.0mgint131后第1、4、8和14天时的血清脂联素水平。
图2:chs-131的神经保护作用:患有神经变性疾病(rrms)给予每日3mg的chs-131的对象相较于安慰剂具有小34.2%的皮质体积损失和小50%的全脑体积损失。
发明详述
具体地,已经发现化合物(i)对于进行性核上性麻痹的治疗出乎意料地有效
该化合成也称之为int131或chs131。
定义
术语“治疗”和“处理”是指减轻或消除疾病和/或其伴随症状的方法。在另一个实施方式中,治疗是指减缓或停止疾病的进展。在另一个实施方式中,治疗是指延长患有疾病的对象的生命。
在一些实施方式中,治疗可以导致神经性病症(例如,进行性核上性麻痹)或神经组织损伤的一种或多种(例如,2、3、4、5或6)症状和/或度量(例如,评分)的数量、严重程度和/或持续时间(例如,本文所述或本领域已知的任何神经性病症的任何症状和/或度量)(例如,本文所述或本领域已知的进行性核上性麻痹的任何症状和/或度量)减少(例如,减少约1%-约99%、减少约1%-约95%、减少约1%-约90%、减少约1%-约85%、减少约1%-约80%、减少约1%-约75%、减少约1%-约70%、减少约1%-约65%、减少约1%-约60%、减少约1%-约55%、减少约1%-约50%、减少约1%-约45%、减少约1%-约40%、减少约1%-约35%、减少约1%-约30%、减少约1%-约25%、减少约1%-约20%、减少约1%-约15%、减少约1%-约10%、减少约1%-约5%、减少约5%-约99%、减少约5%-约95%、减少约5%-约90%、减少约5%-约85%、减少约5%-约80%、减少约5%-约75%、减少约5%-约70%、减少约5%-约65%、减少约5%-约60%、减少约5%-约55%、减少约5%-约50%、减少约5%-约45%、减少约5%-约40%、减少约5%-约35%、减少约5%-约30%、减少约5%-约25%、减少约5%-约20%、减少约5%-约15%、减少约5%-约10%、减少约10%-约99%、减少约10%-约95%、减少约10%-约90%、减少约10%-约85%、减少约10%-约80%、减少约10%-约75%、减少约10%-约70%、减少约10%-约65%、减少约10%-约60%、减少约10%-约55%、减少约10%-约50%、减少约10%-约45%、减少约10%-约40%、减少约10%-约35%、减少约10%-约30%、减少约10%-约25%、减少约10%-约20%、减少约10%-约15%、减少约15%-约90%、减少约15%-约85%、减少约15%-约80%、减少约15%-约75%、减少约15%-约70%、减少约15%-约65%、减少约15%-约60%、减少约15%-约55%、减少约15%-约50%、减少约15%-约45%、减少约15%-约40%、减少约15%-约35%、减少约15%-约30%、减少约15%-约25%或减少约15%-约20%)。
术语“进行性核上性麻痹”或“psp”表示未知来源的神经性病症,其逐渐破坏大脑许多区域并积累微管相关蛋白tau的异常聚集,导致不可溶的成对螺旋丝[friedhoff,2000#12095],包括显示出tau蛋白不可溶的螺旋丝的中脑和额叶皮层中神经元和神经胶质细胞的逐渐退化。
psp起始于症状发生前阶段,期间神经病理学异常增加。然后,患者发展出提示psp的孤立症状(sopsp)。在本文所述的任何方法中,psp可以是典型psp-理查森综合征(psp-richardson’ssyndrome(psp-rs)),psp-帕金森症(psp-parkinsonism(psp-p),psp-皮质基底细胞综合征(psp-corticobasalsyndrome(psp-cbs)),psp-进行性非流畅性失语(psp-progressivenon-fluentaphasia(psp-pnfa))或psp-纯少动伴冻结步态型(psp-pureakinesiawithgaitfreezing(psp-pagf))(ling等,j.mov.discord.9(1):3-13,2016)。在本文所述方法的一些实施方式中,对象可以先前被鉴定或诊断为患有psp(例如,psp-rs、psp-p、psp-pnfa或psp-pagf)。在本文所述方法的一些实施方式中,对象可以先前被鉴定为患psp的风险增加(例如,有遗传相关家族成员(例如,父母,祖父母,姑/姨,叔/伯/舅或兄弟姊妹)已经被鉴定为或诊断为患有psp的对象)。在本文所述方法中的任一个的一些实施方式中,对象可以先前被鉴定或诊断为患有症状发生前psp(pre-symptomaticpsp)或psp提示期(suggestive-of-psp)。
发作后,psp症状迅速恶化。诊断患有psp的对象可能在五年内严重残疾,并在六年内死亡。
psp的症状通常首先在60岁时出现,然后恶化直至死亡。患有psp的人通常死于因功能性脑细胞丧失而引起的肺炎、窒息或其他并发症,从而导致自主神经和运动功能丧失(例如,吞咽能力)。
psp的征兆和症状分为运动、认知和精神疾病。psp中的随意运动可能受到损害,包括假性球麻痹(即无法控制面部运动),运动迟缓(即缓慢或异常的肌肉运动),颈部和躯干僵硬,步态受损,平衡能力受损,姿势不稳定以及讲话和吞咽困难。不能吞咽食物的个体可以安装饲管以提供营养。该疾病最明显的外在迹象是无法正常协调和移动眼睛,从而导致垂直凝视麻痹。认知障碍包括执行功能的丧失(例如,注意力控制,抑制控制,工作记忆,认知灵活性,推理,问题解决和计划)和流利度降低。相关精神病症状包括抑郁、烦躁的感觉、悲伤或冷漠、失眠、疲倦和精力不足。
在一些实施方式中,可以使用mdspsp诊断标准鉴定对象患有psp(例如hoglinger等,mov.disord.31:644-652,2016中所述)。
在一些实施方式中,可以将对象鉴定为处于发展出psp的风险增加或者鉴定为患有psp(例如,本文所述任何类型的psp),例如,(至少部分)通过检测编码微管相关蛋白tau(mapt)的基因中的遗传改变(例如,mapt基因中的任何反转(inversion)多态性,mapt基因中的任何单体型特异性多态性,罕见编码的mapt变体(a152t),或者增强mapt基因中外显子10剪接的突变,述于例如hoglinger等,naturegenet.43:699-705,2011和hinz等,coldspringharb.perspectbiol.中)。编码mapt的基因中遗传改变的非限制性示例包括导致mapt蛋白产生的突变,其包括s285r、l284r、p301l和g303v中的一个或多个点突变。可以用于鉴定对象发展psp的风险增加或者可以用于鉴定对象患有psp(例如,本文所述的任何类型的psp)的编码mapt蛋白的基因中的其他特异性遗传突变述于例如boxer等,lancet16:552-563,2017。
在一些实施方式中,可以将对象鉴定为发展出psp的风险增加或者鉴定为患有psp(例如,本文所述任何类型的psp),例如,(至少部分)通过检测tau蛋白沉淀(例如,4-重复tau蛋白沉淀),检测中脑和/或小脑上丘的萎缩(例如,使用本文所述或本领域已知的任何成像技术,例如,磁共振成象(mri)或正电子放射断层造影术(pet)扫描,和/或检测对象中额叶皮质、尾状核和/或丘脑的低代谢(例如,使用本文所述或本领域已知的任何成像技术,例如,mri、ct扫描或pet扫描)。
例如,在一些实施方式中,可以鉴定或诊断对象患有psp(例如,本文所述的任何类型的psp),例如,(至少部分)通过使用mri以检测脑萎缩(min等,nat.med.21:1154-1162,2015;yanamandra等,ann.clin.transl.neurol.2:278-288,2015),局部灰白质体积的改变以检测萎缩(参见例如,josephs等,brain137:2783-2795,2014;santos-santos等,jamaneurol.73:733-742,2016),和通过检测对象中中脑区域和容量的中脑萎缩(josephs等,neurobiol.aging29:280-289,2008;whitwell等,eur.j.neurol.20:1417-1422,2013)。在一些实施方式中,可以将对象诊断或鉴定为患有psp(例如,本文所述任何类型的psp),例如,(至少部分)通过给予对象tau蛋白示踪剂(例如,av1451或pbb3)和通过pet扫描检测对象脑中的tau蛋白(参见例如,marquie等,ann.neurol.78:787-800,2015;cho等,mov.disord.32:134-140,2017;whitwell等,mov.disord.32:124-133,2017;和smith等,mov.disord.32:108-114,2017)。在一些实施方式中,可以诊断或鉴定对象患有psp(例如,本文所述的任何psp),例如,(至少部分)通过使用pet扫描检测对象中双耳掩蔽水平中的差异(参见例如,hughes等,j.neurophysiol.112:3086-3094,2014)。
在一些实施方式中,可以将对象鉴定为处于发展出psp的风险增加或者鉴定为患有psp(例如,本文所述的任何类型的psp),例如,(至少部分)通过检测对象中一个或多个生物标志物的存在与否或者升高水平(例如,相较于健康对照对象中的水平)。在一些实施方式中,可以将对象鉴定或诊断为患有psp(例如,本文所述任何类型的psp),例如,(至少部分)通过检测对象的血液和/或脑脊液中神经丝轻链的存在与否或者升高水平(例如,相较于健康对照对象中的水平)(例如,使用scherling等,ann.neurol.75:116-126,2014;bacioglu等,neuron91:56-66,2016;和rojas等,ann.clin.transl.neurol.3:216-255,2016中所述的任何免疫试验)。在一些实施方式中,可以将对象鉴定或诊断为患有psp(例如,本文所述任何类型的psp),例如,(至少部分)通过检测来自对象的脑脊液中ykl-40的存在与否或者升高水平(例如,相较于健康对照对象中的水平)(例如,magdalinou等,j.neurol.neurosurg.psychiatry2014年10月:85(10):1065–1075;和magdalinou等,j.neurol.neurosurg.psychiatry86:1240-1247,2015)。
在一些实施方式中,可以诊断或鉴定对象患有psp(例如,本文所述的任何类型的psp),例如,(至少部分)通过使用红外眼科(infraredoculography)检测对象中降低的扫视速度和增加(参见例如,boxer等,arch.neurol.69:509-517,2012;boxer等,lancetneurol.132:676-685,2014)。在一些实施方式中,可以诊断或鉴定对象患有psp(例如,本文所述的任何类型的psp),例如,(至少部分)通过检测对象中与psp相关的自发性和诱发性眨眼率(参见例如,bologna等,brain132:502-510,2009)。在一些实施方式中,可以诊断或鉴定对象患有psp(例如,本文所述的任何类型的psp),例如,(至少部分)通过使用光学相干断层成像术检测对象眼中视网膜厚度降低(参见例如,schneider等,j.neuraltransm.121:41-47,2014)。在一些实施方式中,可以诊断或鉴定对象患有psp(例如,本文所述的任何类型的psp),例如,(至少部分)通过检测对象中破坏的昼夜节律与睡眠(参见例如,walsh等,sleepmed.22;50-56,2016)。
在一些实施方式中,可以诊断或鉴定对象患有psp(例如,本文所述的任何类型的psp),例如,(至少部分)通过检测对象中33kdatau与55kdatau比例降低(例如,相较于健康对象中的33kdatau与55kdatau比例)。在一些实施方式中,可以诊断或鉴定对象患有psp(例如,本文所述的任何类型的psp),例如,(至少部分)通过检测蛋白酪氨酸磷酸酶i(ptpn1)的存在与否或者检测升高的水平(例如,述于santiago等,mov.discord.29(4):550-555,2014)。
本文所述任何方法的一些实施方式可以包括监测对象中psp的进展,例如,通过评估对象中psp随时间的严重程度,例如,使用进行性核上性麻痹评定量(psprs)(例如,如golbe等,brain130(6):1552-1565,2007中所述)。psprs根据其进行日常活动、行为、延髓功能、眼部运动功能、肢体运动功能和步态评估对象。
在本文所述方法的任一个的一些实施方式中,可以进一步给予对象左旋多巴和/或物理疗法(例如,述于lamb等,curr.treatoptionsneurol.14:42,2016和clerici等,plosone12:e0170927,2017)。
术语“治疗有效量”是指足以治疗疾病的化合物的量。在一个实施方式中,治疗有效量足以防止所治疗的病症或疾病的一种或多种症状发展或在一定程度上缓解。
术语“对象”在本文中定义为包括动物,例如哺乳动物,包括但不限于灵长类动物(例如人),牛,绵羊,山羊,马,狗,猫,兔,大鼠,小鼠等。在优选实施方式中,对象是人。
在本文所述方法的任一个的一些实施方式中,对象可以指患者。在本文所述方法的任一个的一些实施方式中,对象是40岁或以上(例如,41岁或以上、42岁或以上、43岁或以上、44岁或以上、45岁或以上、50岁或以上、55岁或以上、60岁或以上、65岁或以上、70岁或以上、75岁或以上、80岁或以上、90岁或以上或41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102或103岁)。
在一些实施方式中,对象没有出现神经性病症或神经组织损伤(例如,进行性核上性麻痹,多发性硬化,复发缓解型ms(rrms),临床孤立综合征(cis),原发进行性ms(ppms),继发进行性ms(spms)或放射学上孤立的综合征(ris))的症状(例如,本文所述或者本领域已知的任何症状)。在一些实施方式中,已经诊断对象患有神经性病症(例如,多发性硬化,复发缓解型ms(rrms),临床孤立综合征(cis),原发进行性ms(ppms),继发进行性ms(spms)或放射学上孤立的综合征(ris))或神经组织损伤。在其他实施方式中,对象已经诊断为患有神经组织损伤(例如,严重的颅脑外伤,运动相关外伤性脑损伤或脑震荡后综合征)。在其他实施方式中,对象尚未诊断为患有神经性病症或神经组织损伤。
在一些实施方式中,对象患有退化性和创伤性神经性病症(例如,痴呆、肌萎缩性侧索硬化或脊髓损伤)。
在其他实施方式中,对象已经诊断或鉴定为患有将受益于使用增殖物激活受体γ(pparγ)激动剂(例如,chs-131)的治疗的神经性病症。
在一些实施方式中,对象之前已经被给予至少一个剂量的chs-131。在一些实施方式中,对象是临床试验的参与者。
在其他实施方式中,所述对象之前曾经接受过不同的药物组合物给药,并且确定所述不同的药物组合物不具有治疗效果。
术语“药学上可接受的盐”意指包括根据本文所述化合物上发现的具体取代基,用相对无毒的酸或碱制备的活性化合物的盐。当本发明化合物含有相对酸性的官能团时,可通过将这种化合物的中性形式接触足量的所需碱(纯的或在合适的惰性溶剂中)获得碱加成盐。药学上可接受碱加成盐的示例包括钠盐、钾盐、钙盐、铵盐、有机氨基盐或镁盐,或类似盐。当本发明所述的化合物含有相对碱性的官能团时,可通过将这种化合物的中性形式接触足量的所需酸(纯的或在合适的惰性溶剂中)获得酸加成盐。药学上可接受酸加成盐的示例包括:衍生自无机酸的盐,所述无机酸如盐酸、氢溴酸、硝酸、碳酸、一氢碳酸、磷酸、一氢磷酸、二氢磷酸、硫酸、一氢硫酸、氢碘酸或亚磷酸等,以及衍生自相对无毒有机酸的盐,所述有机酸如乙酸、丙酸、异丁酸、草酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、扁桃酸、邻苯二甲酸、苯磺酸、对-甲基苯磺酸、柠檬酸、酒石酸、甲磺酸等。还包括如精氨酸等的氨基酸的盐,和如葡萄糖醛酸或半乳糖醛酸等的有机酸的盐(参见例如,berge,s.m.等,“《药用盐》(pharmaceuticalsalts)”,journalofpharmaceuticalscience,1977年,66,1-19)。本发明的某些特定化合物含有允许该化合物转化为碱或酸加成盐的碱性和酸性官能团。
所述化合物的中性形式可通过使盐与碱或酸接触并以传统方式将母体化合物分离进行再生。所述化合物的母体形式在某些物理性质(例如,在极性溶剂中的溶解度)与多种盐形式不同,但其它情况下所述盐等同于用于本发明目的的化合物的母体形式。
除盐形式以外,本发明还提供了前药形式的化合物。本文所述的化合物的前药是在生理条件下易于经历化学变化以提供本发明所述的化合物的那些化合物。此外,前药可通过化学或生物化学方法在活体外环境中转化成本发明所述的化合物。例如,当放置在含有合适酶或化学试剂的透皮贴片贮器中时,前药可缓慢转化为本发明所述的化合物。前药通常是有用的,因为在某些情况下,它们可能比母体药物更容易给药。它们可以通过口服给药是生物可利用的,而母体药物则不是。与母体药物相比,前药在药理学组合物中的溶解度也可提高。本领域已知多种前药衍生物,例如依赖于前药的水解裂解或氧化活化的那些。前药的一个实例(但不限于此)是作为酯(“前药”)给予的本发明的化合物,但随后代谢水解成羧酸,即活性实体。另外的实例包括本发明化合物的肽基衍生物。
本发明的某些化合物可以非溶剂化形式以及溶剂化形式(包括水合形式)存在。通常,溶剂化形式等同于非溶剂化形式,应涵盖在本发明范围内。本发明的某些化合物可以多晶或无定形形式存在。通常,在本发明所考虑的应用中所有物理形式是等同的,并且旨在于在本发明的范围内。
某些本发明化合物具有不对称碳原子(光学中心)或双键;外消旋物,非对映异构体,几何异构体和单独的异构体都包括在本发明的范围内。
本发明所述的化合物在组成该化合物的一个或多个原子上也可含有非天然比例的原子同位素。例如,化合物可以用放射性同位素(例如氚(3h),碘-125(125i)或碳-14(14c))进行放射性标记。无论是否有具有放射性,本发明所述的化合物的所有同位素变体均包括在本发明的范围内。
如本文所用术语“生物样品”或“样品”表示获自或源自对象的样品。例如,样品可以包含脑脊液(csf)、血液、血清或血浆。在一些实施方式中,样品可以是或者包含血液样品。在一些实施方式中,样品可以是或者包含血清样品。在一些实施方式中,样品可以是或者包含血浆样品。
本文使用“获得”或者“获自”可以是通过“直接”或“间接”方式取得样品的任何方式。直接获得样品意指执行过程(例如,执行物理方法,如提取或放血)以获得来自对象的样品。间接获得样品表示从另一方或来源(例如,直接获取样品的第三方实验室)接收样品。因此,获得用于指代由对象收集和/或去除样品。本文所述的任何方法的一些实施方式可以包括由对象获得一种或多种样品。
短语“升高的”或“增加的水平”可以是,例如,相较于神经丝轻链蛋白的第一水平或参照水平(例如,本文所述的任何示例性参照水平),升高或增加至少1%(例如,至少2%、至少4%、至少6%、至少8%、至少10%、至少12%、至少14%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少100%、至少110%、至少115%、至少120%、至少140%、至少150%、至少200%、至少250%、至少300%、至少350%、至少400%,或1%-400%、1%-300%、1%-200%、1%-100%、1%-50%、1%-25%、1%-10%、10%-400%、10%-300%、10%-200%、10%-100%、10%-50%、50%-400%、50%-300%、50%-200%、50%-100%、50%-75%、75%-100%,或1%、2%、4%、5%、6%、8%、10%、12%、14%、16%、18%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、105%、110%、115%、120%、125%、130%、135%、140%,145%、150%、155%、160%、165%、170%、175%、180%、185%、190%、195%、200%、250%、300%、350%或400%)。
在一些实施方式中,升高的水平可以是,例如,相较于神经丝轻链蛋白的第一水平或参照水平(例如,本文所述的任何示例性参照水平),升高或增加约约1%-约500%、约1%-约450%、约1%-约400%、约1%-约350%、约1%-约300%、约1%-约250%、约1%-约200%、约1%-约150%、约1%-约100%、约1%-约50%、约1%-约25%、约1%-约20%、约1%-约15%、约1%-约10%、约1%-约5%、约2%-约500%、约2%-约450%、约2%-约400%、约2%-约350%、约2%-约300%、约2%-约250%、约2%-约200%、约2%-约150%、约2%-约100%、约2%-约50%、约2%-约25%、约2%-约20%、约2%-约15%、约2%-约10%、约5%-约500%、约5%-约450%、约5%-约400%、约5%-约350%、约5%-约300%、约5%-约250%、约5%-约200%、约5%-约150%、约5%-约100%、约5%-约50%、约5%-约25%、约5%-约20%、约5%-约15%、约5%-约10%、约10%-约500%、约10%-约450%、约10%-约400%、约10%-约350%、约10%-约300%、约10%-约250%、约10%-约200%、约10%-约150%、约10%-约100%、约10%-约50%、约10%-约25%、约10%-约20%、约10%-约15%、约15%-约500%、约15%-约450%、约15%-约400%、约15%-约350%、约15%-约300%、约15%-约250%、约15%-约200%、约15%-约150%、约15%-约100%、约15%-约50%、约15%-约25%、约15%-约20%、约20%-约500%、约20%-约450%、约20%-约400%、约20%-约350%、约20%-约300%、约20%-约250%、约20%-约200%、约20%-约150%、约20%-约100%、约20%-约50%、约20%-约25%、约25%-约500%、约25%-约450%、约25%-约400%、约25%-约350%、约25%-约300%、约25%-约250%、约25%-约200%、约25%-约150%、约25%-约100%、约25%-约50%、约50%-约500%、约50%-约450%、约50%-约400%、约50%-约350%、约50%-约300%、约50%-约250%、约50%-约200%、约50%-约150%、约50%-约100%、约100%-约500%、约100%-约450%、约100%-约400%、约100%-约350%、约100%-约300%、约100%-约250%、约100%-约200%、约100%-约150%、约150%-约500%、约150%-约450%、约150%-约400%、约150%-约350%、约150%-约300%、约150%-约250%、约150%-约200%、约200%-约500%、约200%-约450%、约200%-约400%、约200%-约350%、约200%-约300%、约200%-约250%、约250%-约500%、约250%-约450%、约250%-约400%、约250%-约350%、约250%-约300%、约300%-约500%、约300%-约450%、约300%-约400%、约300%-约350%、约350%-约500%、约350%-约450%、约350%-约400%、约400%-约500%、约400%-约450%或约450%-约500%。
“降低的水平”可以是,例如,相较于神经丝轻链蛋白的第一水平,神经丝轻链蛋白的第二水平降低1%-约99%、降低1%-约95%、降低1%-约90%、降低1%-约85%、降低1%-约80%、降低1%-约75%、降低1%-约70%、降低1%-约65%、降低1%-约60%、降低1%-约55%、降低1%-约50%、降低1%-约45%、降低1%-约40%、降低1%-约35%、降低1%-约30%、降低1%-约25%、降低1%-约20%、降低1%-约15%、降低1%-约10%、降低1%-约5%、降低约5%-约99%、降低约5%-约95%、降低约5%-约90%、降低约5%-约85%、降低约5%-约80%、降低约5%-约75%、降低约5%-约70%、降低约5%-约65%、降低约5%-约60%、降低约5%-约55%、降低约5%-约50%、降低约5%-约45%、降低约5%-约40%、降低约5%-约35%、降低约5%-约30%、降低约5%-约25%、降低约5%-约20%、降低约5%-约15%、降低约5%-约10%、降低约10%-约99%、降低约10%-约95%、降低约10%-约90%、降低约10%-约85%、降低约10%-约80%、降低约10%-约75%、降低约10%-约70%、降低约10%-约65%、降低约10%-约60%、降低约10%-约55%、降低约10%-约50%、降低约10%-约45%、降低约10%-约40%、降低约10%-约35%、降低约10%-约30%、降低约10%-约25%、降低约10%-约20%、降低约10%-约15%、降低约15%-约99%、降低约15%-约95%、降低约15%-约90%、降低约15%-约85%、降低约15%-约80%、降低约15%-约75%、降低约15%-约70%、降低约15%-约65%、降低约15%-约60%、降低约15%-约55%、降低约15%-约50%、降低约15%-约45%、降低约15%-约40%、降低约15%-约35%、降低约15%-约30%、降低约15%-约25%、降低约15%-约20%、降低约20%-约99%、降低约20%-约95%、降低约20%-约90%、降低约20%-约85%、降低约20%-约80%、降低约20%-约75%、降低约20%-约70%、降低约20%-约65%、降低约20%-约60%、降低约20%-约55%、降低约20%-约50%、降低约20%-约45%、降低约20%-约40%、降低约20%-约35%、降低约20%-约30%、降低约20%-约25%、降低约25%-约99%、降低约25%-约95%、降低约25%-约90%、降低约25%-约85%、降低约25%-约80%、降低约25%-约75%、降低约25%-约70%、降低约25%-约65%、降低约25%-约60%、降低约25%-约55%、降低约25%-约50%、降低约25%-约45%、降低约25%-约40%、降低约25%-约35%、降低约25%-约30%、降低约30%-约99%、降低约30%-约95%、降低约30%-约90%、降低约30%-约85%、降低约30%-约80%、降低约30%-约75%、降低约30%-约70%、降低约30%-约65%、降低约30%-约60%、降低约30%-约55%、降低约30%-约50%、降低约30%-约45%、降低约30%-约40%、降低约30%-约35%、降低约35%-约99%、降低约35%-约95%、降低约35%-约90%、降低约35%-约85%、降低约35%-约80%、降低约35%-约75%、降低约35%-约70%、降低约35%-约65%、降低约35%-约60%、降低约35%-约55%、降低约35%-约50%、降低约35%-约45%、降低约35%-约40%、降低约40%-约99%、降低约40%-约95%、降低约40%-约90%、降低约40%-约85%、降低约40%-约80%、降低约40%-约75%、降低约40%-约70%、降低约40%-约65%、降低约40%-约60%、降低约40%-约55%、降低约40%-约50%、降低约40%-约45%、降低约45%-约99%、降低约45%-约95%、降低约45%-约90%、降低约45%-约85%、降低约45%-约80%、降低约45%-约75%、降低约45%-约70%、降低约45%-约65%、降低约45%-约60%、降低约45%-约55%、降低约45%-约50%、降低约50%-约99%、降低约50%-约95%、降低约50%-约90%、降低约50%-约85%、降低约50%-约80%、降低约50%-约75%、降低约50%-约70%、降低约50%-约65%、降低约50%-约60%、降低约50%-约55%、降低约55%-约99%、降低约55%-约95%、降低约55%-约90%、降低约55%-约85%、降低约55%-约80%、降低约55%-约75%、降低约55%-约70%、降低约55%-约65%、降低约55%-约60%、降低约60%-约99%、降低约60%-约95%、降低约60%-约90%、降低约60%-约85%、降低约60%-约80%、降低约60%-约75%、降低约60%-约70%、降低约60%-约65%、降低约65%-约99%、降低约65%-约95%、降低约65%-约90%、降低约65%-约85%、降低约65%-约80%、降低约65%-约75%、降低约65%-约70%、降低约70%-约99%、降低约70%-约95%、降低约70%-约90%、降低约70%-约85%、降低约70%-约80%、降低约70%-约75%、降低约75%-约99%、降低约75%-约95%、降低约75%-约90%、降低约75%-约85%、降低约75%-约80%、降低约80%-约99%、降低约80%-约95%、降低约80%-约90%、降低约80%-约85%、降低约85%-约99%、降低约85%-约95%、降低约85%-约90%、降低约90%-约99%、降低约90%-约95%或降低约95%-约99%。
本文所用“第一时间点”可以,例如,表示初始时间点,其中对象尚未接受药物组合物(例如,本文所述的任何药物组合物)剂量。在一些实施方式中,第一时间点可以是,例如,当对象接受任何治疗(例如,本文所述的任何示例性治疗)之前已经诊断为神经性病症或神经组织损伤,的时间点。在其他示例中,第一时间点可以是当对象发展出至少一种(例如,1、2、3、4、5、6、7、8、9或10种)与神经性病症或神经组织损伤相关的症状(例如,本文所述或者本领域已知的神经性病症或神经组织损伤的任何示例性症状)并尚未接受任何治疗的时间点。在一些实施方式中,第一时间点可以表示对象之前已经接受不同的药物治疗并且不同的药物治疗被认为并未成功的时间点。
本文所用“第二时间点”可以,例如,表示第一时间点之后的第二时间点。在一些实施方式中,对象可以在第一和第二时间点之间接受或者已经接受至少一个(例如,1、2、3、4、5、6、7、8、9或10个)剂量的药物组合物(例如,任何药物组合物)。在一些实施方式中,第一和第二时间点之间的时间差可以是,例如,1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、31天、32天、33天、34天、35天、36天、37天、38天、39天、40天、41天、42天、43天、44天、45天、46天、47天、48天、49天、50天、51天、52天、53天、54天、55天、56天、57天、58天、59天、60天、61天、62天、63天、64天、65天、66天、67天、68天、69天、70天、71天、72天、73天、74天、75天、76天、77天、78天、79天、80天、81天、82天、83天、84天、85天、86天、87天、88天、89天、90天、91天、92天、93天、94天、95天、96天、97天、98天、99天、100天、101天、102天、103天、104天、105天、106天、107天、108天、109天、110天、111天、112天、113天、114天、115天、116天、117天、118天、119天、120天、121天、122天、123天、124天、125天、126天、127天、128天、129天、130天、131天、132天、133天、134天、135天、136天、137天、138天、139天、140天、141天、142天、143天、144天、145天、146天、147天、148天、149天、150天、151天、152天、153天、154天、155天、156天、157天、158天、159天、160天、161天、162天、163天、164天、165天、166天、167天、168天、169天、170天、171天、172天、173天、174天、175天、176天、177天、178天、179天、180天、7个月、8个月、9个月、10个月、11个月或1年。
除非另外定义,否则,本文中使用的所有技术和科学术语具有本发明所属领域普通技术人员通常所理解的同样含义。本文所述方法和材料用于本发明;本领域已知的其他合适的方法和材料也可使用。材料、方法和实施例都仅是说明性的,不构成限制。本文中述及的所有出版物、专利申请、专利、序列、数据库条目及其他参考文献都通过引用全文纳入本文。若有抵触,以本说明书(包括定义)为准。
从下文的详述和附图,以及所附权利要求中能够很容易地了解本发明的其他特征和优点。
具体实施方式
现已发现调节pparγ的已知化合物的新用途。具体地,已发现pparγ激动剂,特别是int131,可有效治疗进行性核上性麻痹。
因此,在一个实施方式中,本发明涉及在有需要的对象中治疗进行性核上性麻痹或其症状的方法,包括给予所述对象包含治疗有效量的int131或其药学上可接受的盐、前药或异构体的药物组合物。
不希望受限于特定理论,据信int131增加脑细胞中的pparγ活化(包括pparγ途径中元件的活化),增加脂联素水平,改善脑细胞中的能量代谢,并减少或防止异常tau蛋白的聚集,这通过减少氧化应激和神经炎症,并且因此治疗进行性核上性麻痹。
脂联素影响葡萄糖和脂质代谢、胰岛素敏感性和炎症。yamauchit,等,脂联素通过激活amp激活的蛋白质激酶刺激葡萄糖利用以及脂肪酸氧化(adiponectinstimulatesglucoseutilizationandfatty-acidoxidationbyactivatingamp-activatedproteinkinase)。natmed.2002;8:1288–1295;bergah,等,脂细胞分泌的蛋白acrp30增强肝脏胰岛素作用(theadipocyte-secretedproteinacrp30enhanceshepaticinsulinaction)。natmed.2001;7:947–953.;和yamauchit,等,靶向破坏adipor1和adipor2导致代谢作用和脂联素结合的取消(targeteddisruptionofadipor1andadipor2causesabrogationofadiponectinbindingandmetabolicactions)。natmed.2007;13:332–339。此外,脂联素靶向中枢神经系统并且其还调节食欲和能量平衡。此外,脂联素刺激食物摄入。kubotan,等,脂联素刺激下丘脑中amp激活的蛋白质激酶并增加食物摄入(adiponectinstimulatesamp-activatedproteinkinaseinthehypothalamusandincreasesfoodintake)。cellmetab.2007;6:55–68。由于患有进行性核上性麻痹的对象经历体重减轻,因此给予int131以增加脂联素并刺激食物摄入将治疗患有进行性核上性麻痹的对象。
psp一直与增加的氧化应激和神经炎症相关。具体地,丙二醛是氧化应激的生物标志物,已证明其在受psp影响的大脑区域的神经元中升高,但在未受影响的区域中不升高。albersds,等,进行性核上性麻痹中的额叶功能障碍:氧化应激和线粒体损伤的证据(frontallobedysfunctioninprogressivesupranuclearpalsy:evidenceforoxidativestressandmitochondrialimpairment),jneurochem.2000年2月;74(2):878-81。此外,psp患者的皮质显示酮戊二酸脱氢脱氢酶/谷氨酸脱氢酶比例降低了39%,这表明对这些区域的氧化应激。albers,等2000。最后,受psp影响的患者表现出异常的脂质过氧化和蛋白质过氧化,这是氧化应激的标志。odettip,等,脂过氧化选择性地参与进行性核上性麻痹(lipoperoxidationisselectivelyinvolvedinprogressivesupranuclearpalsy),jneuropatholexpneurol.2000年5月;59(5):393-7。
在psp患者大脑受影响区域中发现了与神经炎症相关的激活的小胶质细胞和星形胶质细胞。ferreri,等,阿尔茨海默病,匹克氏病,进行性核上性麻痹和皮质基底皮变性中磷酸化map激酶(erk1、erk2)表达与神经元和胶质细胞中早期tau沉积相关,但是与核dna脆弱性和细胞死亡增加无关(phosphorylatedmapkinase(erk1,erk2)expressionisassociatedwithearlytaudepositioninneuronsandglialcells,butnotwithincreasednucleardnavulnerabilityandcelldeath,inalzheimerdisease,pick'sdisease,progressivesupranuclearpalsyandcorticobasaldegeneration),brainpathol.2001年4月;11(2):144-58。最近的研究表明,相较于帕金森氏病或阿尔茨海默氏病脑,psp患者黑质中il-1β的区域特异性上调。而且,已经发现在psp患者脑部受影响区域中神经炎症的其他标志物,包括tnfα,和il-6升高,而抗炎细胞因子tgfβ和il-10并未升高。fernandez-botranr,等,进行性核上性麻痹中的细胞因子表达和小胶质细胞活化(cytokineexpressionandmicroglialactivationinprogressivesupranuclearpalsy),parkinsonismrelatdisord.2011年11月;17(9):683-8。
pparγ激动剂,包括int131,已经显示出抑制动物模型和人的氧化应激和神经炎症。具体地,已经在下述证明了该抑制:针对再灌注的缺血性中风的吡格列酮和罗格列酮,collinom,等,暴露于脑缺血/再灌注的大鼠海马结构中通过ppar-γ激动剂调节氧化应激和炎症反应(modulationoftheoxidativestressandinflammatoryresponsebyppar-gammaagonistsinthehippocampusofratsexposedtocerebralischemia/reperfusion),eurjpharmacol.2006年1月13日;530(1-2):70-80.;针对颅脑外伤的吡格列酮和罗格列酮,kapadiar,等,ppar-γ激动剂的抗炎和神经保护作用机理(mechanismsofanti-inflammatoryandneuroprotectiveactionsofppar-gammaagonists),frontbiosci.2008年1月1日;13:1813-26;针对2型糖尿病的int131,lee,dh,等,选择性pparγ调节剂int131使胰岛素信号传导缺陷正常化并改善饮食诱导的肥胖小鼠的骨量(selectivepparγmodulatorint131normalizesinsulinsignalingdefectsandimprovesbonemassindiet-inducedobesemice).amjphysiolendocrinolmetab.2012;302:552–560;和针对多发性硬化症的int131,美国专利申请公开号2014/0213612。
值得注意的是,用罗格列酮和吡格列酮治疗人类存在缺点。avandia(罗格列酮)仅被批准用于治疗2型糖尿病患者,并且增加了以下风险:心力衰竭,伴有心力衰竭的个体中的心血管事件,水肿,体重增加,黄斑水肿,骨折,血红蛋白和血细胞比容降低以及其他不良事件。此外,avandia不穿过血脑屏障。avanida包装说明书,2016年9月。由于只有9-14%的罗格列酮穿过血脑屏障,它可能具有有限的功效或需要更频繁和更高的剂量来充分治疗诸如进行性核上性麻痹。与avandia一样,actos(吡格列酮)仅被批准用于治疗2型糖尿病患者。actos还存在一些严重的警告和预防措施,包括:增加的以下风险:导致充血性心力衰竭的液体潴留,低血糖,有时致命的肝功能衰竭,膀胱癌,水肿,骨折,黄斑水肿和其他不良事件。actos包装插页,2016年12月。值得注意的是,不同于两种市售可得的ppar-γ配体,罗格列酮和吡格列酮,int131容易穿过血脑屏障。
尽管有完整pparγ激动剂可降低氧化应激和神经炎症的数据,但int131的益处令人惊讶,因为尚不清楚int131的选择性pparγ途径激活是否会治疗psp。
因此,int131可以治疗进行性核上性麻痹是令人惊讶和出乎意料的。
在一个实施方式中,int131减轻进行性核上性麻痹的征兆和症状。int131降低进行性核上性麻痹的一种或多种征兆或症状。在另一个实施方式中,进行性核上性麻痹的征兆和症状的减少是进行性核上性麻痹的征兆和症状的数量减少。在另一个实施方式中,进行性核上性麻痹的征兆和症状的减少是进行性核上性麻痹的至少一种征兆和症状的严重性或程度减少。在另一个实施方式中,进行性核上性麻痹的征兆和症状的减少是进行性核上性麻痹的至少一种征兆和症状的持续时间减少。
在另一个实施方式中,给予患有进行性核上性麻痹的对象int131后,预防或延迟患有进行性核上性麻痹的对象中进行性核上性麻痹的征兆或症状的发作。
在另一个实施方式中,int131降低了患有进行性核上性麻痹的对象的神经炎症。
在一个实施方式中,int131在患有进行性核上性麻痹的对象中具有神经保护作用。在另一个实施方式中,int131治疗神经元变性。在另一个实施方式中,int131减少患有进行性核上性麻痹的对象中脑的萎缩或变性。在进一步的实施方式中,int131减少实质性黑质、苍白球、丘脑下核和/或小脑的萎缩或降解。
在另一个实施方式中,int131降低或预防了患有进行性核上性麻痹的对象的体重损失。在另一实施方式中,int131增加患有进行性核上性麻痹的对象的食欲。
在另一实施方式中,int131治疗患有进行性核上性麻痹的对象中的代谢功能障碍。在又一个实施方式中,int131增加患有进行性核上性麻痹的对象中的脂联素水平。在另一个实施方式中,int131改善或增加患有进行性核上性麻痹的对象的葡萄糖代谢。在另一实施方式中,int131降低患有进行性核上性麻痹的对象中的高血糖症。
在另一个实施方式中,int131改善线粒体功能。在进一步的实施方式中,int131改善线粒体钙处理和线粒体运输。在又一个实施方式中,int131增加过氧化物酶体增殖物激活受体γ共激活因子1-α(pgc-1α)的表达和线粒体生物发生。这导致患有进行性核上性麻痹的对象的行为改善,存活率(即寿命)提高和脑退化减少。
在另一个实施方式中,int131减少患有进行性核上性麻痹的对象中不正常tau蛋白或tau蛋白片段的聚集。在其他实施方式中,int131改善脑中神经保护蛋白的减少。在又一个实施方式中,int131减少脑源性神经营养因子和bcl2的减少。
在另一实施方式中,观察到患有进行性核上性麻痹的对象中int131治疗作用的一段时间包括1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、1.25年、1.5年、1.75年、2年、2.25年、2.5年、2.75年、3年、3.5年、4年、4.5年和5年。
在一个实施方式中,int131处于苯磺酸盐的形式。
在另一实施方式中,治疗有效量为约0.1至约10毫克。在另一实施方式中,治疗有效量为约1至约4毫克。在另一实施方式中,治疗有效量为约2至约3毫克。
在另一个实施方式中,将包含治疗有效量的int131的组合物以包括但不限于每天两次,每天一次,每隔一天,每周三次,每周两次,每周一次,每隔一周,每月两次,每月一次和每隔一月的间隔给予有需要的对象。
在另一个实施方式中,将包含治疗有效量的int131的组合物口服给予对象。在又一个实施方式中,该组合物与美国专利公开号2013-0243865中公开的组合物基本相同,其公开内容明确地通过引用并入本文。
在一个实施方式中,int-131与其他疗法一样有效或更有效地治疗进行性核上性麻痹。这些疗法包括批准用于治疗进行性核上性麻痹的疗法和正在研发的用于治疗进行性核上性麻痹的疗法。这些疗法包括但不限于:治疗运动障碍的药物,治疗精神疾病的药物,心理疗法,言语疗法,物理疗法和作业疗法(occupationaltherapy)。
用于治疗运动障碍的药物包括但不限于:丁苯那嗪(tetrabenazine),抗精神病药物,例如氟哌啶醇,氯丙嗪,利培酮和喹硫平,以及其他药物,例如金刚烷胺,左乙拉西坦和氯硝西泮。
治疗精神病的药物包括但不限于:抗抑郁药,例如西地那普、氟西汀和舍曲林,抗精神病药物,例如喹硫平、利培酮和奥氮平,以及情绪稳定药物,包括抗惊厥药物,例如丙戊酸盐、卡马西平和拉莫三嗪。
心理疗法包括但不限于谈话疗法,以帮助对象管理行为问题、抑郁和自杀念头。
言语疗法包括但不限于提高对象清楚说话的能力以及改善用于进食和吞咽的肌肉的功能和控制。
物理疗法包括但不限于:增强力量,灵活性,平衡和协调,降低跌倒的风险,以及改善姿势以减轻运动问题的严重性。
作业疗法包括但不限于使用提高功能能力的辅助装置,例如扶手,以及用于运动技能降低的对象的饮食用具。
在另一个实施方案中,将int-131与本文列出的一种或多种疗法组合给予需要的对象。
本文还提供了治疗对象的方法,所述方法包括:选择鉴定或诊断为患有psp(例如,本文所述任何类型的psp)的对象(例如,使用用于鉴定或诊断本文所述psp的任何技术)和向所述选择的对象给予治疗有效剂量的式(i)化合物或其药学上可接受的盐、前药或异构体。在这些方法的一些实施方式中,鉴定或诊断为患有psp的对象并不受益于之前给予的(不同的)psp治疗处理。
本文还提供了治疗对象的方法,所述方法包括:选择鉴定或诊断为发展出psp(例如,本文所述任何类型的psp)的风险增加的对象(例如,使用用于鉴定或诊断发展出psp的风险增加的对象的任何技术)和向所述选择的对象给予治疗有效剂量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了治疗对象的方法,所述方法包括:鉴定或诊断患有psp(例如,本文所述任何类型的psp)或发展出psp(例如,本文所述任何类型的psp)的风险增加的对象(例如,通过进行本文所述或本领域已知的用于鉴定或诊断患有psp的对象的任何技术,或者通过进行本文所述或本领域已知的用于鉴定发展出psp的风险增加的对象的任何技术),和向所述诊断或鉴定的对象给予治疗有效剂量的式(i)化合物或其药学上可接受的盐、前药或异构体。
在本文所述方法的一些实施方式中,方法可以导致对象中发展出合并症的风险降低(例如,相较于含有相似神经性疾病(例如,psp)但给予不同治疗的相似对象中发展出并合症的风险)。本文所述方法的一些实施方式可以还包括向对象给予试剂,所述试剂减轻对象中式(i)化合物或其药学上可接受的盐、前药或异构体的不良副作用(例如,体重减轻或情绪波动)。
在本文所述方法的一些实施方式中,该方法可以导致延长对象的寿命(例如,相较于含有相似神经性疾病(例如,psp)但接受不同治疗的相似对象)。在本文所述方法的一些实施方式中,该方法可以导致对象运动功能的改善(例如,相较于对象治疗之前的运动功能)。
本文所述任何治疗方法的一些实施方式还可以包括给予对象试剂用于治疗抑郁症,强迫行为和/或冷漠。本文所述任何治疗方法的一些实施方式还可以包括给予对象减轻眼刺激和/或闭眼症状的试剂。本文所述任何方法的一些实施方式还可以包括给予对象用于减少体重减轻的治疗或用于降低发展出吸入性肺炎风险的治疗。
还提供了降低对象中psp进展的速度(例如,相较于具有相似阶段的psp但是给予不同治疗的相似对象)的方法,所述方法包括:鉴定患有早期psb(例如,症状发生前psp或psp提示期)的对象(例如,通过进行用于确定本文所述psp阶段的任何技术);和向所述鉴定的对象给予治疗有效剂量的式(i)化合物或其药学上可接受的盐、前药或异构体。
还提供了降低对象中psp进展的速度(例如,相较于具有相似阶段的psp但是给予不同治疗的相似对象)的方法,所述方法包括:向鉴定或诊断为患有早期psp(例如,症状发生前psp或psp提示期)的对象(例如,使用本文所述任何技术)给予治疗有效剂量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了为对象选择治疗的方法,所述方法包括:选择鉴定或诊断为患有psp(例如,本文所述任何类型的psp)的对象(例如,使用用于鉴定或诊断本文所述对象中的psp的任何技术),和为所述选择的对象选择治疗有效剂量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了为使用式(i)化合物或其药学上可接受的盐、前药或异构体的治疗选择对象的方法,所述方法包括:选择鉴定或诊断为发展出psp(例如,本文所述任何类型的psp)的风险增加的对象(例如,使用本文所述或本领域已知的用于鉴定具有发展出psp的风险增加的对象的任何技术);和为使用治疗有效剂量的式(i)化合物或其药学上可接受的盐、前药或异构体的治疗选择所述选择的对象。
本文还提供了确定患有psp的对象中治疗功效的方法,所述方法包括:(a)确定在第一时间点获自对象的样品中一种或多种生物标志物的第一水平(例如,通过进行免疫试验);(b)第一时间点后向对象给予治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体;和(c)确定在第二时间点获自对象的样品中一种或多种生物标志物的第二水平(例如,通过进行免疫试验),其中第二时间点在第一时间点之后和步骤(b)之后出现,其中如果第二水平相较于第一水平大致相同、相较于第一水平降低或者在第一水平的+/-20%内(例如,+/-15%内,+/-10%内或+/-5%内),那么将给予的式(i)化合物或其药学上可接受的盐、前药或异构体鉴定为有效。在一些实施方式中,用于确定患有psp的对象中治疗功效的方法包括:(a)确定包含在第一时间点获自对象的血液或脑脊液的样品中神经丝轻链的第一水平(例如,通过进行免疫试验);(b)第一时间点后向对象给予治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体;和(c)确定包含在第二时间点获自对象的血液或脑脊液的样品中神经丝轻链的第二水平(例如,通过进行免疫试验),其中第二时间点在第一时间点之后和步骤(b)之后出现,其中如果第二水平相较于第一水平大致相同、相较于第一水平降低或者在第一水平的+/-20%内(例如,+/-15%内,+/-10%内或+/-5%内),那么将给予的式(i)化合物或其药学上可接受的盐、前药或异构体鉴定为有效。
本文还提供了监测患有psp并接受含有式(i)化合物或其药学上可接受的盐、前药或异构体的治疗的对象的方法,所述方法包括:确定包含在不同时间点获自患有psp(例如,本文所述的任何类型的psp)的对象的血液或脑脊液的样品中生物标志物的2个或更多个水平(例如,通过进行免疫试验)。在一些实施方式中,生物标志物是神经丝轻链。这些方法的一些实施方式可以还包括对对象的脑进行mri、ct扫描或pet扫描。
在一些实施方式中,确定治疗效力的方法或监测对象的方法可以进一步包括评估对象中psp的一种或多种其他症状的严重性、持续时间和/或频率(例如,使用本文所述任何示例性技术或度量,本文所述的psp的任何症状)。
本文所述任何方法的一些实施方式还可以包括给予对象物理疗法,言语和语言疗法,作业疗法和/或抗抑郁剂。
本文还提供了治疗对象的方法,所述方法包括相较于神经丝轻链蛋白参照水平(例如,本文所述的任何神经丝轻链蛋白参照水平),选择样品中具有神经丝轻链蛋白升高水平的对象,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和向所述选择的对象给予药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体(例如,使用本文所述任何给药剂量或频率)。
本文还提供了为对象(例如,本文所述的任何对象)选择治疗的方法,所述方法包括鉴定样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平(例如,本文所述的任何示例性神经丝轻链蛋白参照水平)升高的对象,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和为所述鉴定的对象选择药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文提供了选择治疗对象的方法,所述方法包括:相较于神经丝轻链蛋白参照水平(例如,本文所述的任何示例性神经丝轻链蛋白参照水平),鉴定样品中具有神经丝轻链蛋白升高水平的对象(例如,本文所述的任何对象),所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和为使用药物组合物的治疗选择所述鉴定的对象,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文提供了选择参与临床试验的对象的方法,所述方法包括:相较于神经丝轻链蛋白参照水平(例如,本文所述的任何示例性神经丝轻链蛋白参照水平),鉴定样品中具有神经丝轻链蛋白升高水平的对象(例如,本文所述的任何对象),所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和选择所述鉴定的对象参与临床试验,所述临床试验包括给予包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体的药物组合物。
本文提供了预测对象(例如,本文所述任何对象)中治疗效力的方法,所述方法包括:确定样品中神经丝轻链蛋白水平的水平,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和确定使用药物组合物的治疗在样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平(例如,本文所述的任一示例性神经丝轻链蛋白参照水平)升高的对象中比在样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平不升高的对象中更可能有效,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体,所述样品含脑脊液、血液、血清或血浆。
本文提供了确定对象(例如,本文所述任何对象)中治疗效力的方法,所述方法包括:确定样品中神经丝轻链蛋白的第一水平,所述样品包含在第一时间点获自所述对象的脑脊液、血液、血清或血浆;确定样品中神经丝轻链蛋白的第二水平,所述样品包含在第二时间点获自所述对象的脑脊液、血液、血清或血浆,其中所述对象在所述第一和第二时间点期间接受至少一个(例如,至少一个、至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个或至少十个)剂量的药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体;和将所述药物组合物鉴定为在如下所述对象中有效,所述对象中神经丝轻链蛋白的第二水平相较于所述神经丝轻链蛋白的第一水平降低。
本文提供了治疗对象的方法,所述方法包括:相较于包含在第一时间点获自所述对象的脑脊液、血液、血清或血浆的样品中神经丝轻链蛋白的第一水平,选择包含在第二时间点获自所述对象的脑脊液、血液、血清或血浆的样品中具有升高的神经丝轻链蛋白第二水平的对象(例如,本文所述的任何对象);和向所述选择的对象给予药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文提供了为对象选择治疗的方法,所述方法包括相较于包含在第一时间点获自所述对象的脑脊液、血液、血清或血浆的样品中神经丝轻链蛋白的第一水平,鉴定包含在第二时间点获自所述对象的脑脊液、血液、血清或血浆的样品中具有升高的神经丝轻链蛋白第二水平的对象(例如,本文所述的任何对象);和为所述鉴定的对象选择药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了选择治疗对象的方法,所述方法包括:相较于包含在第一时间点获自所述对象的脑脊液、血液、血清或血浆的样品中神经丝轻链蛋白的第一水平,鉴定包含在第二时间点获自所述对象的脑脊液、血液、血清或血浆的样品中具有升高的神经丝轻链蛋白第二水平的对象(例如,本文所述的任何对象);和选择所述鉴定的对象进行使用药物组合物的治疗,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了选择参与临床试验的对象的方法,所述方法包括:相较于包含在第一时间点获自所述对象的脑脊液、血液、血清或血浆的样品中神经丝轻链蛋白的第一水平,鉴定包含在第二时间点获自所述对象的脑脊液、血液、血清或血浆的样品中具有升高的神经丝轻链蛋白第二水平的对象(例如,本文所述的任何对象);和选择所述鉴定的对象参与临床试验,所述临床试验包括给予包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体的药物组合物。
除非另外定义,否则,本文中使用的所有技术和科学术语具有本发明所属领域普通技术人员通常所理解的同样含义。本文所述方法和材料用于本发明;本领域已知的其他合适的方法和材料也可使用。材料、方法和实施例都仅是说明性的,不构成限制。本文中述及的所有出版物、专利申请、专利、序列、数据库条目及其他参考文献都通过引用全文纳入本文。若有抵触,以本说明书(包括定义)为准。从详述的说明书和附图,以及权利要求中能够很容易地了解本发明的其他特征和优点。
神经丝轻链蛋白和检测神经丝轻链蛋白的方法
神经丝是iv型中间丝和杂聚物。神经丝在大脑中表达并且是神经元细胞所特有的。中枢神经系统中的神经丝包括神经丝重链(nfh)、神经丝中链(nfm),神经丝轻链(nfl)和α-互联蛋白。外围神经系统中的神经丝包括nfh、nfm、nfl和外周蛋白。神经丝对于维持轴突口径、轴突径向生长以及沿轴突的电脉冲的胞内运输至关重要(eyer和peterson,neuron12:389-405,1994;ohara等,j.cellbiol.121:387-395,1993;zhu等,exp.neurol.148:299-316,1997)。
已经证明nfl基因中的突变导致charcot-marie牙病,脱髓鞘1f型(cmt1f)和charcot-marie牙病,轴突2e型(cmt2)。nfl基因中的突变影响神经元中神经丝的组装(sasaki等,hum.mol.genet.15:943-952,2006;和yates等,eur.j.cellbiol.88:193-202,2009)。
连同中型和重型亚基,神经丝轻链表示神经元细胞骨架的骨架蛋白中的一个(teunissen等,mult.scler.18(5):552-556,2012)并且在轴突损伤后释放在胞外空间中。
分别在seqidno:1和seqidno:2中提供了人神经丝轻链的cdna序列和蛋白质序列。分别在seqidno:3和seqidno:4中提供了小鼠神经丝轻链的cdna序列和蛋白质序列。
人神经丝轻链cdna序列(seqidno:1)
atgagttccttcagctacgagccgtactactcgacctcctacaagcggcgctacgtggagacgccccgggtgcacatctccagcgtgcgcagcggctacagcaccgcacgctcagcttactccagctactcggcgccggtgtcttcctcgctgtccgtgcgccgcagctactcctccagctctggatcgttgatgcccagtctggagaacctcgacctgagccaggtagccgccatcagcaacgacctcaagtccatccgcacgcaggagaaggcgcagctccaggacctcaatgaccgcttcgcc
agcttcatcgagcgcgtgcacgagctggagcagcagaacaaggtcctggaagccgagctgctggtgctgcgccagaagcactccgagccatcccgcttccgggcgctgtacgagcaggagatccgcgacctgcgcctggcggcggaagatgccaccaacgagaagcaggcgctccagggcgagcgcgaagggctggaggagaccctgcgcaacctgcaggcgcgctatgaagaggaggtgctgagccgcgaggacgccgagggccggctgatggaagcgcgcaaaggcgccgacgaggcg
gcgctcgctcgcgccgagctcgagaagcgcatcgacagcttgatggacgaaatctcttttctgaagaaagtgcacgaagaggagatcgccgaactgcaggcgcagatccagtacgcgcagatctccgtggagatggacgtgaccaagcccgacctttccgccgcgctcaaggacatccgcgcgcagtacgagaagctggccgccaagaacatgcagaacgctgaggaatggttcaagagccgcttcaccgtgctgaccgagagcgccgccaagaacaccgacgccgtgcgcgccgccaag
gacgaggtgtccgagagccgtcgtctgctcaaggccaagaccctggaaatcgaagcatgccggggcatgaatgaagcgctggagaagcagctgcaggagctggaggacaagcagaacgccgacatcagcgctatgcaggacacgatcaacaaattagaaaatgaattgaggaccacaaagagtgaaatggcacgatacctaaaagaataccaagacctcctcaacgtgaagatggctttggatattgagattgcagcttacaggaaactcttggaaggcgaggagacccgactcagtttc
accagcgtgggaagcataaccagtggctactcccagagctcccaggtctttggccgatctgcctacggcggtttacagaccagctcctatctgatgtccacccgctccttcccgtcctactacaccagccatgtccaagaggagcagatcgaagtggaggaaaccattgaggctgccaaggctgaggaagccaaggatgagcccccctctgaaggagaagccgaggaggaggagaaggacaaggaagaggccgaggaagaggaggcagctgaagaggaagaagctgccaaggaagagtct
gaagaagcaaaagaagaagaagaaggaggtgaaggtgaagaaggagaggaaaccaaagaagctgaagaggaggagaagaaagttgaaggtgctggggaggaacaagcagctaagaagaaagattga
人神经丝轻链氨基酸序列(seqidno:2)
mssfsyepyystsykrryvetprvhissvrsgystarsayssysapvssslsvrrsyssssgslmpslenldlsqvaaisndlksirtqekaqlqdlndrfasfiervheleqqnkvleaellvlrqkhsepsrfralyeqeirdlrlaaedatnekqalqgeregleetlrnlqaryeeevlsredaegrlmearkgadeaalaraelekridslmdeisflkkvheeeiaelqaqiqyaqisvemdvtkpdlsaalkdiraqyeklaaknmqnaeewfksrftvltesaakntdavraakdevsesrrllkaktleieacrgmnealekqlqeledkqnadisamqdtinklenelrttksemarylkeyqdllnvkmaldieiaayrkllegeetrlsftsvgsitsgysqssqvfgrsaygglqtssylmstrsfpsyytshvqeeqieveetieaakaeeakdeppsegeaeeeekdkeeaeeeeaaeeeeaakeeseeakeeeeggegeegeetkeaeeeekkvegageeqaakkkd
小鼠神经丝轻链cdna序列(seqidno:3)
atgagttcgttcggctacgatccgtacttttcgacctcctacaagcggcgctatgtggagacgccccgggtgcacatctccagcgtgcgcagcggctacagcacggcgcgctccgcgtactccagctactccgcgccggtctcctcctcgctgtccgtgcgccgcagctactcgtccagctctggctctttgatgcccagcctggagaatctcgatctgagccaggtagccgccatcagcaacgacctcaagtctatccgcacacaagagaaggcacagctgcaggacctcaacgatcgcttcgccagcttcatcgagcgcgtgcacgagctggagcagcagaacaaggtcctggaagccgagctgttggtgctgcgccagaaacactctgagccttcccgcttccgcgccctgtacgagcaggagatccgcgatctgcggctggcagcggaagacgccactaacgagaagcaggcgctgcagggcgagcgcgaggggctggaggagactctgcgcaacctgcaggctcgctatgaggaagaagtgctgagccgcgaggacgccgagggccggctgatggaagcgcgcaaaggtgcggatgaggccgcgctcgcccgcgccgagctggagaagcgcatcgacagcctgatggacgagatagctttcctgaagaaggtgcacgaggaagagatcgccgagctgcaggctcagatccagtatgctcagatctccgtggagatggacgtgtcctccaagcccgacctctccgccgctctcaaggacatccgcgctcagtacgagaagctggccgccaagaacatgcagaacgccgaagagtggttcaagagccgcttcaccgtgctaaccgagagcgccgccaagaacaccgacgctgtgcgcgctgccaaggacgaggtgtcggaaagccgccgcctgctcaaggctaagaccctggagatcgaagcctgccggggtatgaacgaagctctggagaagcagctgcaggagctagaggacaagcagaatgcagacattagcgccatgcaggacacaatcaacaaactggagaatgagctgagaagcacgaagagcgagatggccaggtacctgaaggagtaccaggacctcctcaatgtcaagatggccttggacatcgagattgcagcttacagaaaactcttggaaggcgaagagaccaggctcagtttcaccagcgtgggtagcataaccagcggctactctcagagctcgcaggtcttcggccgttctgcttacagtggcttgcagagcagctcctacttgatgtctgctcgctctttcccagcctactataccagccacgtccaggaagagcagacagaggtcgaggagaccattgaggctacgaaagctgaggaggccaaggatgagcccccctctgaaggagaagcagaagaggaggagaaggagaaagaggagggagaggaagaggaaggcgctgaggaggaagaagctgccaaggatgagtctgaagacacaaaagaagaagaagaaggtggtgagggtgaggaggaagacaccaaagaatctgaagaggaagagaagaaagaggagagtgctggagaggagcaggtggctaagaagaaagattga
小鼠神经丝轻链氨基酸序列(seqidno:4)
mssfgydpyfstsykrryvetprvhissvrsgystarsayssysapvssslsvrrsyssssgslmpslenldlsqvaaisndlksirtqekaqlqdlndrfasfiervheleqqnkvleaellvlrqkhsepsrfralyeqeirdlrlaaedatnekqalqgeregleetlrnlqaryeeevlsredaegrlmearkgadeaalaraelekridslmdeiaflkkvheeeiaelqaqiqyaqisvemdvsskpdlsaalkdiraqyeklaaknmqnaeewfksrftvltesaakntdavraakdevsesrrllkaktleieacrgmnealekqlqeledkqnadisamqdtinklenelrstksemarylkeyqdllnvkmaldieiaayrkllegeetrlsftsvgsitsgysqssqvfgrsaysglqsssylmsarsfpayytshvqeeqteveetieatkaeeakdeppsegeaeeeekekeegeeeegaeeeeaakdesedtkeeeeggegeeedtkeseeeekkeesageeqvakkkd
本文所述任何方法的一些实施方式可以包括进行试验以确定一个或多个样品(例如,在第一和第二时间点获自对象的样品)中神经丝轻链蛋白的一个或多个水平(例如,第一和第二水平)。本文描述了可以用于检测神经丝轻链的一个或多个水平的非限制性试验。本领域已知可以用于检测神经丝轻链的一个或多个水平的其他试验。
商业可及的酶联免疫吸附试验(umandiagnostics)可以用于测量包含获自对象的脑脊液、血液、血清或血浆的一个或多个样品中神经丝轻链蛋白的一个或多个水平。基于电化学发光(ecl)的试验可以用于检测神经丝轻链的一个或多个水平。参见例如,lycke等,j.neurol.neurosurg.psychiatry64(3):402-404,1998;teunissen等,neurology72(15):1322-1329,2009;disanto等,j.neurol.neurosurg.psychiatry87(2):126-129,2015;和kuhle等,mult.scler.22(12):1550-1559,2016)。可以进行以检测神经丝轻链蛋白的一个或多个水平的另一试验是单分子阵列(simoa)试验,其详述于kuhle等,clin.chem.labmed.54(10):1655-166,2016;和gisslen等,ebiomedicine3:135-140,2016)。用于神经丝轻链的simoa试验商购自quanterix
可以用于检测样品中神经丝轻链蛋白水平的其他非限制性试验包括:酶联免疫吸附试验(elisa),敏感性夹心elisa试验,基于电化学发光(ecl)试验,质谱(ms),western印迹,荧光激活细胞分选术(facs),免疫组织化学。
可以用于检测获自对象的样品(例如,本文所述的其他示例性样品)中神经丝轻链的一个或多个水平的其他试验包括免疫试验(例如,酶联免疫吸附试验、夹心酶联免疫吸附试验和免疫沉淀反应)和蛋白质组学技术。
检测神经丝轻链蛋白
用于检测血清、血浆或血液样品中神经丝轻链(nfl)的试验
单分子阵列(simoa)试验是一种高敏感性试验,其能够准确定量低神经丝轻链浓度(disanto等,ann.neurol.81(6):857-870,2017;rohrer等,neurology87(13):1329-1336,2016;和novakova等,neurology89(22):2230-2237,2017)。
捕获单克隆抗体(mab)47:3经缓冲液交换并稀释至0.3mg/ml。4x106顺磁性珠(quanterix公司)经缓冲液交换并使用0.5mg/ml1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(quanterix)激活,然后在室温进行30分钟的孵育(hulamixer,塞默飞世尔科学公司(thermofischerscientific))。混合器上于室温孵育2小时,稀释的捕获mab47:3与洗涤并激活的顺磁性珠偶联。孵育后,使用磁性分离器洗涤珠三次并封闭。然后,将偶联的珠悬浮并储存于4℃。
simoa试验在使用两步试验neat20方案的simoahd-1仪器(quanterix公司)上运行。简言之,将100μl校准物/样品的tris-缓冲的盐水(tbs)、0.1%吐温20、1%奶粉、400μg/mlheteroblock(欧米茄生物公司(omegabiologicals)),25μl偶联珠的tbs、0.1%吐温20、1%奶粉、300μg/mlheteroblock,和20μl的mab2:1(0.1μg/ml的tbs,0.1%吐温20,1%奶粉,300μg/mlheteroblock)孵育35分钟15秒(47个节奏,1个节奏为45秒)。然后,洗涤混合物。然后,添加100μl的链霉亲和素偶联的β-半乳糖苷酶(150pm;quanterix公司),然后进行5分15秒(7-节奏)的孵育和洗涤。然后将混合物置于simoahd-1仪器。读取之前,添加25μl试卤灵β-d-半乳糖苷(quanterix公司)。使用来自nflelisa(nf-light,umandiagnostics公司)的标准构建校准曲线。一式两份测量样品和校准物。
nfl水平经过log转换以满足正常的假设。通过根据rigby和stasinopoulous,statmed23:3053-3076,2004使用box-coxt分布的位置、比例和形状的广义可加性模型(gamlss)的方式建模snfl在健康对照中的分布,并且获得三次样条和百分位曲线。
为了定量试验内和试验间变异性,通过从健康对照中抽取100个随机样本进行自举。
线性回归模型用于研究与logsnfl的关联。线性广义估计方程(gee)模型类似地用于研究与logsnfl的关联。
通过超敏感simoa试验的血液nfl测量
血清nfl水平在纵向血液样品中研究。
可商购的elisa(umandiagnostics
参照水平
在本文所述任何方法的一些实施方式中,参照水平可以是获自对象(例如,介于18-70年龄的对象)的相似样品中检测的神经丝轻链蛋白水平,所述对象尚未诊断或鉴定为患有神经性疾病(例如,ms)或神经组织损伤,并且其不具有神经性疾病(例如,ms)或神经组织损伤的家族史。在一些实施方式中,参照水平可以是神经丝轻链蛋白的阈值水平。
神经丝轻链蛋白的参照水平(例如,对于含有血清的样品)是约10pg/ml-约35pg/ml(例如,约10pg/ml-约30pg/ml、约10pg/ml-约25pg/ml、约10pg/ml-约20pg/ml、10pg/ml-约15pg/ml、15pg/ml-约35pg/ml、约15pg/ml-约30pg/ml、约15pg/ml-约25pg/ml、约15pg/ml-约20pg/ml、约20pg/ml-约35pg/ml、约20pg/ml-约30pg/ml、约20pg/ml-约25pg/ml、约25pg/ml-约35pg/ml或约25pg/ml或约30pg/ml)。
在一些实施方式中,神经丝轻链蛋白参照水平可以是健康对象(例如,尚未诊断或鉴定为患有疾病(例如,本文所述任何神经性疾病或神经组织损伤)的对象,并未表现出病症或疾病(例如,神经性疾病或病症)症状的对象,和并未被认为发展出神经性疾病或病症的风险增加的对象)群体的相似样品中检测的神经丝轻链蛋白水平的百分比值(例如,均值,99%百分比、95%百分比、90%百分比、85%百分比、80%百分比、75%百分比、70%百分比、65%百分比、60%百分比、55%百分比或50%百分比)。
在一些实施方式中,参照水平可以是在早期时间点获自对象的相似样品中的神经丝轻链水平。
chs-131(int-131)
chs-131是式(i)的示例性化合物。
在一个方面中,chs-131降低已经诊断患有神经性病症(例如,多发性硬化症(ms),复发性缓解型ms(rrms)或阿尔茨海默氏病)或神经组织损伤的对象或并未出现神经系统病症(例如,多发性硬化症(ms),复发性缓解型ms(rrms)或阿尔茨海默氏病)或神经组织损伤症状的对象的神经炎症。在一些实施方式中,可以鉴定或诊断对象患有早期神经性病症或早期或中期神经组织损伤。
在一些实施方式中,给予chs-131减少对象(例如,本文所述的任何对象)中脑的萎缩或变性。在一些实施方式中,给予chs-131减少对象(例如,本文所述的任何对象)黑质、苍白球、丘脑下核和/或小脑的萎缩或退化。在一些实施方式中,给予chs-131减少对象(例如,本文所述的任何对象)脑皮层的萎缩。
在一个方面中,给予chs-131降低对象(例如,本文所述的任何对象)发展出合并症(例如,心血管疾病,2型糖尿病)的风险。
在一个实施方式中,chs-131比其他疗法有效或更有效地治疗神经系统疾病或神经组织损伤。这些疗法包括经批准用于治疗神经性病症或神经组织损伤(例如,本文所述任何神经性病症)的疗法以及研发用于治疗神经性病症或神经组织损伤(例如,本文所述任何神经性病症)的那些。
本文所述任何方法的一些实施方式,包含治疗有效量的式(i)或其药学上可接受的盐、前药或异构体的药物组合物可与一种或多种其他治疗(例如,本文所述任何其他示例性治疗或疗法)共同给予对象。
治疗的其他方法
本文提供了治疗对象的方法,所述方法包括:相较于神经丝轻链蛋白参照水平(例如,本文所述或本领域已知的任何示例性神经丝轻链蛋白参照水平),选择样品中具有神经丝轻链蛋白升高水平的对象(例如,本文所述任何示例性对象),所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和使用本文所述任何给药剂量或频率向所述选择的对象给予药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体(例如,chs-131)。
本文还提供了治疗对象(例如,本文所述任何对象)的方法,所述方法包括:选择在第二时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第二水平相较于在第一时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第一水平升高的对象;和向所述选择的对象给予药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体(例如,chs-131,例如,用本文所述任何给药剂量或频率)。
为对象选择治疗的方法
本文提供了为对象(例如,本文所述任何对象)选择治疗的方法,所述方法包括:鉴定样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平(例如,本文所述的任何示例性神经丝轻链蛋白参照水平)升高的对象,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和针对鉴定的对象选择药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了为对象(例如,本文所述任何对象)选择治疗的方法,所述方法包括:鉴定在第二时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第二水平相较于在第一时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第一水平升高的对象;和针对所述鉴定的对象选择药物组合物,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。在包括检测第一和第二样品中神经丝轻链蛋白水平的任何方法中,本领域技术人员将理解的是,例如,样品应当是相似的(例如,两个样品都是血清样品,两个样品都是血液样品,两个样品都是血浆样品,或者两个样品都是脑脊液样品)。
这些方法的一些实施方式还包括向鉴定的对象给予一个或多个剂量(例如,至少两个、至少五个或至少十个剂量)选择的药物组合物。这些方法的一些实施方式进一步包括将选择的药物组合物记录于鉴定的对象的临床记录中。
本文还提供了选择治疗对象的方法,所述方法包括:鉴定样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平升高的对象,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和选择所述鉴定的对象进行使用药物组合物的治疗,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了选择治疗对象(例如,本文所述任何对象)的方法,所述方法包括:鉴定在第二时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第二水平相较于在第一时间点获自所述对象的含脑脊液、血液、血清或血浆的样品中的神经丝轻链蛋白第一水平升高的对象进行使用药物组合物的治疗,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体。
本文还提供了选择对象(例如,本文所述任何对象)参与临床试验的方法,所述方法包括:鉴定样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平(例如,本文所述的任何示例性神经丝轻链蛋白参照水平)升高水平的对象,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和选择所述鉴定的对象参与临床试验,所述临床试验包括给予包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体的药物组合物(例如,chs-131,例如,使用本文所述任何给药剂量或频率)。
还提供了选择参与临床试验的对象的方法,所述方法包括:相较于包含在第一时间点获自所述对象的脑脊液、血液、血清或血浆的样品中神经丝轻链蛋白的第一水平,鉴定包含在第二时间点获自所述对象的脑脊液、血液、血清或血浆的样品中具有升高的神经丝轻链蛋白第二水平的对象(例如,本文所述的任何对象);和选择所述鉴定的对象参与临床试验,所述临床试验包括给予包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体的药物组合物(例如,chs-131,例如,使用本文所述任何给药剂量或频率)。
预测方法
本文提供了预测对象中治疗功效的方法,所述方法包括:确定样品中神经丝轻链蛋白水平的水平,所述样品包含获自所述对象的脑脊液、血液、血清或血浆;和确定使用药物组合物的治疗在样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平升高的对象中比在样品中神经丝轻链蛋白水平相较于神经丝轻链蛋白参照水平不升高的对象中更可能有效,所述药物组合物包含治疗有效量的式(i)化合物或其药学上可接受的盐、前药或异构体,所述样品含脑脊液、血液、血清或血浆。
在一些方面中,该方法可包括由对象获得第二样品和重复所述确定步骤,所述第二样品包含第二时间点的脑脊液、血液、血清或血浆。
组合物和试剂盒
本文还提供了包含本文所述任何化合物的至少一种式(i)化合物的组合物(例如,药物组合物)以及用于进行本文所述任何方法的说明书。在一些实施方式中,组合物(例如,药物组合物)可以置于无菌瓶或预先加载的注射器。
在一些实施方式中,配制组合物(例如,药物组合物)用于不同途径的给药(例如,颅内,静脉内,皮下或肌内)。在一些实施方式中,组合物(例如,药物组合物)可以包括药学上可接受的盐(例如,磷酸盐缓冲盐水)。在一些实施方式中,组合物(例如,药物组合物)可以包括其前药或异构体。本文所述任何药物组合物的单次或多次给药可以基于例如患者所需或者其所耐受的剂量和频率给予对象。药物组合物的剂量应当提供足够量的式(i)化合物,其药学上可接受的盐、前药或异构体,以有效治疗或减轻状况、疾病或症状。
本文还提供了试剂盒,所述试剂盒包含本文所述任何药物组合物中的一种或多种(例如,至少2、3、4、5、6、7、8、9、10、12、14、16、18、20),所述药物组合物包含有效量的(i)化合物,或其药学上可接受的盐、前药或异构体。在一些实施方式中,试剂盒可以包括用于进行本文所述任何方法的说明书。在一些实施方式中,试剂盒可以包括本文所述任何组合物(例如,药物组合物)中的至少一个剂量。在一些实施方式中,试剂盒可以提供用于给予本文所述任何药物组合物的注射器。本文所述试剂盒不限于此;对于本领域普通技术人员而言,其他变形是显而易见的。
以下实施例进一步描述了本发明,这些实施例并不限制权利要求书所述的本发明范围。
实施例
实施例1:int131是脂联素水平降低患者中的强效脂联素上调剂
方法
进行了一项随机、双盲、安慰剂对照的为期24周的研究,其中测量了脂联素水平。该研究有2周的导入期,24周的双盲治疗期和2周的随访期。367名2型糖尿病(td2)(即患者脂联素水平降低的疾病)的患者被随机分配每天接受0.5、1、2或3毫克(“mg”)的int131苯磺酸盐,45毫克吡格列酮或安慰剂,为期24周。为了测量脂联素水平,在第0周,第2周,第6周,第12周和第24周抽取血液。
该研究的结果表明,与安慰剂相比,1、2和3毫克剂量的int131导致hba1c水平的统计学显著降低。此外,该研究表明,2毫克和3毫克剂量的int131降低了hba1c水平,至少与45毫克吡格列酮一致,其中,吡格列酮是fda批准的td2治疗药物。参见depaoli等人,diabetescare2014;37:1918–1923。因此,2毫克和3毫克剂量的int131将有效治疗td2。
脂联素结果
在基线(第0周),平均脂联素水平为1.94微克/毫升(μg/ml)。基线和第24周的平均脂联素水平以及从基线(第0周)到第24周的脂联素水平的平均变化在下表1中显示。每组中测试样品的标准偏差列于(括号)中。治疗组的平均基线脂联素值相似。
表1.脂联素血清水平的变化
1毫克、2毫克和3毫克剂量的int131与安慰剂治疗相比具有统计学显著性(p≤0.0109)。这表明用int131治疗导致患有脂联素水平降低的疾病(例如td2)的患者中脂联素水平的统计学显著增加。因此,int131在治疗患有其中增加降低的脂联素水平可能是有益的疾病(例如,进行性核上性麻痹)的患者中具有治疗效果。
另外,0.5毫克、1毫克和3毫克剂量的int131与45毫克吡格列酮的治疗相比具有统计学显著性(p≤0.0408)。因此,int131对脂联素水平的剂量依赖性增加与吡格列酮导致的增加无关。
结论
评估治疗对血清脂联素的影响,使得能够更直接地比较int131和45毫克吡格列酮作为选择性pparγ调节剂的相对效力。使用locf(结果最后一次观察),脂联素从基线到第24周的平均变化对于安慰剂组为0.05μg/ml,对于int1310.5mg组为0.56μg/ml,对于int1311mg组为1.28μg/ml,2mg组为3.27μg/ml,int1313mg组为3.83μg/ml,吡格列酮45mg组为2.96μg/ml。因此,以与hba1c的作用定量不同的方式,其中大致相当于45mg吡格列酮的int131的剂量在2mg至3mg之间,对于增加脂联素水平而言1mg至2mg的int131剂量相当于吡格列酮45mg。
令人惊讶的是,给予2或3mg的int131导致血清脂联素水平的上调比给予剂量至少大22倍的吡格列酮的上调更大。与其他也会增加脂联素水平的药物相比,少量的int131在治疗脂联素水平降低的疾病中至少同样有效。由于int131比其他pparγ激动剂更容易穿过血脑屏障,因此需要较少的int131来实现相同的脂联素增加,并且int131比其他pparγ激动剂具有更少的副作用,int131是神经疾病的优良治疗。
给予1、2或3mgint131治疗患有这样疾病的患者,所述疾病中预防或抑制脂联素水平降低或者增加脂联素水平可能是有益的(例如,进行性核上性麻痹)。
实施例2:int131是健康对象中脂联素的强效上调剂
方法
进行了一项研究以确定int131对血清脂联素水平的影响。随机选择30名健康对象,每天接受安慰剂,0.1mgint131,1mgint131或4mgint131,持续14天。为了测量脂联素水平,在第1、4、8和14天抽取血液。
结果
从第1天到第14天,给予安慰剂和0.1mgint131血清脂联素水平没有显著变化,进一步给予0.1mgint131导致脂联素水平与安慰剂相比没有显著变化。见图1。然而,给予1mg或4mgint131导致血清脂联素水平相对于安慰剂的显著变化且从第1天到第14天有显著变化。因此,int131的给药能够上调健康个体中的脂联素(即,没有因为疾病或失调而降低脂联素水平的对象)。
因为int131上调了脂联素,即使对象的脂联素水平并未被疾病或病症减少,上调患有进行性核上性麻痹的对象中的脂联素对于延缓疾病的症状和征兆的进展而言可能是有益的。
实施例3:int131在神经变性疾病中具有神经保护性并且能够用于治疗psp
方法
在俄罗斯境内的21个地点,将227名从未治疗的成人对象(平均年龄31[范围为18-50];65%女性)随机分至3个组中的一个:以3mg口服chs-131(n=76);以1mg口服chs-131(n=76);安慰剂(n=75)。97%完成第1部分。纳入标准:复发型多发性硬化(rrms)≤3年,招募1年之内的≥1钆阳性病灶,和筛选时edss≤6。患者经历月度mri检查,以鉴别新的炎症病灶。以盲测方式在布法罗神经显像和分析中心(布法罗,纽约)读取所有mri。除了ce病灶,图像针对累积性新的/扩大的t2病灶进行评分,并进行连续皮质和全脑体积分析。
结果
chs-131治疗导致累积性ce病灶中超过6个月的剂量依赖性降低(完全病例分析)。相较于安慰剂(7.8[ls均值6.49]),每日3毫克降低52%的ce病灶负担(4.2病灶[ls均值3.10])(p=0.003)。相较于安慰剂(7.6[ls均值5.15]),1毫克治疗效果不那么强-21%降低(p=ns)。新的/扩大的t2病灶相较于安慰剂降低了30%(3mg)(p=0.0767)。
除了剂量依赖性抗-神经炎症作用,chs-131治疗似乎减少了6个月时的灰质体积损失。相较于安慰剂,在3毫克组中,皮层体积减少了34.2%和全脑体积减少了50%。在6个月时,1毫克治疗组中的体积损失与安慰剂相似。参见图2。
这些数据证明chs-131具有神经保护性。因此,向患有进行性核上性麻痹的对象给予chs-131对于延缓+征兆的进展而言是可以是有益的。
其它实施方式
应理解虽然本发明已结合其详述进行描述,但以上描述意在说明而不是限制本发明的范围,该范围由所附权利要求的范围限定。其它方面、优势和修改在所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!