用于检测生物传感器的体内性质的方法和电子单元与流程
本发明涉及一种用于检测生物传感器的体内性质的方法,一种适于执行该方法的电子单元以及一种包括生物传感器和这种电子单元的系统。根据本发明的方法,电子单元和系统主要可以用于长期监测体液中的分析物浓度,特别是用于长期监测葡萄糖水平或体液中一种或多种其他类型分析物的浓度。本发明可以在家庭护理的领域以及专业护理(诸如在医院中)的领域二者中应用。但是,其他应用也是可行的。
背景技术:
监测某些身体功能(更特别地监测某些分析物的一个或多个浓度)在各种疾病的预防和治疗中扮演了重要的角色。在不限制进一步可能的应用的情况下,下面参考间质液中的葡萄糖监测来描述本发明。然而,还可以将本发明应用于其他类型的分析物。具体而言,除了光学测量之外,还可以通过使用电化学生物传感器来进行血糖监测。从us5,413,690a,us5,762,770a,us5,798,031a,us6,129,823a或us2005/0013731a1中已知用于测量葡萄糖,特别是血液或其他体液中的葡萄糖的电化学生物传感器的示例。
除了其中以有针对性的方式从用户(即人或动物)中获取体液样品并就分析物浓度进行检查的“点测量”外,连续测量也变得越来越多。因此,在最近一段时间,例如已经将间质组织中葡萄糖的连续测量(也被称为“连续葡萄糖监测”或缩写为“cgm”)建立为用于管理、监测和控制糖尿病状态的另一重要方法。在此,有源传感器区域直接施加到通常布置在间质组织中的测量部位,并且可以例如通过使用酶特别是葡萄糖氧化酶(通常缩写为“god”)将葡萄糖转化为修改的实体。结果,可检测的电流可能与葡萄糖浓度有关,并且因此可以用作测量变量。在us6,360,888b1或us2008/0242962a1中描述了此类经皮测量系统的示例。
us2012/262298a1公开了用于处理传感器数据和自校准的方法和设备。本文中,提供了能够基于初始灵敏度来校准连续分析物传感器,并且然后在不使用或减少使用参考测量的情况下连续执行自校准的方法和装置。本文还描述了用于使用刺激信号确定分析物传感器的性质的方法和设备,其中传感器的性质可用于针对灵敏度漂移来补偿传感器数据,或确定与传感器相关的另一性质,例如温度,传感器膜损坏,湿气进入传感器电子器件和缩放系数。
通常,当前的连续监测系统是经皮系统或皮下系统。因此,实际的生物传感器或生物传感器的至少测量部分可以布置在用户的皮肤下方。但是,系统的评估和控制部分(也可以称为“补丁”)通常可以位于用户身体之外。在此,通常通过使用插入仪器来施加生物传感器,在us6,360,888b1中以示例性方式描述了该插入仪器。然而,其他类型的插入仪器也是已知的。此外,通常可能需要控制部分,该控制部分可以位于身体组织外部并且必须与生物传感器通信。通常,通过在生物传感器和控制部分之间提供至少一个电接触来建立通信,其中该接触可以是永久电接触或可释放电接触。用于提供电接触的其他技术(例如通过适当的弹簧接触)通常是已知的,并且也可以应用。
在连续的葡萄糖测量系统中,可以通过采用包括至少具有工作电极和对电极的电化学电池的电化学传感器来确定分析物葡萄糖的浓度。在此,工作电极可以具有试剂层,该试剂层包括具有适于支持体液中的分析物的氧化的氧化还原活性酶辅因子的酶。
要解决的问题。
因此,本发明的目的是提供一种用于检测生物传感器的体内性质的方法,一种适于执行该方法的电子单元以及一种包括生物传感器和这种电子单元的系统,其至少部分地避免这种已知设备和方法的缺点。
特别地,期望该方法能够以可靠且反复的方式检测生物传感器中可能的体内漂移,其中随后实际检测到的体内漂移可以适用于补偿生物传感器中漂移的影响,尤其是以便能够可靠且反复地确定分析物值。
此外,期望根据本发明的方法可以容易地能够在电子单元中实施,该电子单元可以与标准生物传感器一起操作,并且因此可以在没有必要修改的情况下可适用于现有的生物传感器系统。
技术实现要素:
该问题通过具有独立权利要求的特征的用于检测生物传感器的体内性质的方法,适于执行该方法的电子单元以及包括生物传感器的系统和这种电子单元来解决。在从属权利要求中公开了可以以隔离的方式或以任何任意组合实现的本发明的优选实施例。
如下所使用的,术语“具有”,“包括”或“包含”或其任意的语法变体以非排他性的方式使用。因此,这些术语可以指代在其中除了由这些术语引入的特征之外在该上下文中描述的实体中不存在其他特征的情况和在其中存在一个或多个其他特征的情况二者。作为一个示例,表述“a具有b”、“a包括b”和“a包含b”可以指代在其中除了b之外a中不存在其他元件的情况(即在其中a仅仅并且排他地由b组成的情况)和在其中除了b之外在实体a中存在一个或多个其他元件(诸如元件c、元件c和d或甚至其他元件)的情况二者。
此外,应注意,表示特征或元素可存在一次或多次的术语“至少一个”,“一个或多个”或类似表达通常在引入相应的特征或元素时仅使用一次。在下文中,在大多数情况下,当提到相应的特征或元素时,尽管相应的特征或元素可能只存在一次或不止一次,但不会重复“至少一个”或“一个或多个”的表达。
进一步地,如在下面中使用的,在不约束备选可能性的情况下结合可选特征使用术语“优选地”、“更优选地”、“特别地”、“更特别地”、“具体地”、“更具体地”或类似术语。因此,由这些术语引入的特征是可选特征并且不意图以任何方式约束权利要求的范围。如技术人员将会认识到的,可以通过使用备选特征来执行本发明。类似地,在没有关于本发明的备选实施例的任何约束的情况下,在没有关于本发明的范围的任何约束的情况下,并且在没有关于将以这种方式提出的特征与本发明的其他可选或非可选特征相组合的可能性的任何约束的情况下意图使由“在本发明的实施例中”或类似表述提出的特征成为可选特征。
在本发明的第一方面,公开了一种用于检测生物传感器的体内性质的方法,其中,所述生物传感器与适于以电化学方式确定体液样品中的分析物的至少一个值的电子单元互操作,其中所述生物传感器包括至少一个工作电极,其中所述工作电极被膜覆盖并且包括用于提供与分析物的反应的酶,其中所述膜具有电阻并且所述工作电极具有电容,其中电子单元适于测量原始电流和指示生物传感器导纳的电流响应。在此,该方法包括以下方法步骤,列举如下:
a)提供生物传感器的灵敏度与导纳的关系(sensitivity-to-admittancerelation);
b)测量生物传感器中的原始电流;
c)测量指示生物传感器的体内导纳的体内电流响应,其中在至少一个第一操作点和至少一个第二操作点测量体内电流响应,其中选择第一操作点以用于提供与膜的电阻有关的第一特征值,并且其中选择第二操作点以用于提供与工作电极的电容有关的第二特征值;以及
d)通过使用原始电流确定体液样品中的分析物值,并通过使用第一特征值确定灵敏度的实际值来校正原始电流的测量值,从而补偿生物传感器中的体内灵敏度漂移,从而考虑步骤a)期间提供的灵敏度与导纳的关系;以及
e)基于第一特征值和/或第二特征值监测传感器的故障安全操作。
在此,所指示的步骤可以优选地以给定的顺序执行,由此以方法步骤a)开始并且以方法步骤d)结束,其中,然而,任何或所有所指示的步骤,特别是方法步骤b)和c)可以至少部分地同时(例如在确定的时间段内)执行。另外,任何或所有指示的步骤也可以重复几次,以允许检测生物传感器的体内性质(例如在预定时间之后或由于发生预定事件)。此外,也可以执行附加的方法步骤,无论是否在此描述。
如通常使用的,术语“生物传感器”可以指被配置用于进行至少一种医学分析的任意设备。为此目的,生物传感器可以是被配置用于执行至少一个诊断目的的任意设备,并且具体地,包括用于执行至少一种医学分析的至少一个分析物传感器。具体地,该生物传感器可以包括能够彼此相互作用的两个或更多个部件的组件,例如以便执行一个或多个诊断目的,例如为了执行医学分析。具体地,两个或更多个组件可以能够执行对体液中的至少一种分析物的至少一种检测和/或以便有助于对体液中的至少一种分析物的至少一种检测。通常,生物传感器还可以是传感器组件,传感器系统,传感器套件或传感器装置中的至少之一的一部分。此外,生物传感器可以可连接到评估装置,例如电子单元。
在本发明的特别优选的实施例中,生物传感器可以是完全可植入或部分可植入的生物传感器,其可以特别地适于执行对皮下组织中的体液中(特别是间质液中)的分析物的检测。如本文所使用的,术语“可植入生物传感器”或“皮下生物传感器”可以指适于完全或至少部分地布置在患者或用户的身体组织内的任意生物传感器。为此,生物传感器可以包括可插入部分。在本文中,术语“可插入部分”通常可以指被配置为可插入到任意身体组织中的元件的一部分或组件。优选地,生物传感器可以完全或部分地包括生物相容性表面,即可以至少在典型的使用期间对用户,患者或身体组织具有尽可能小的有害影响的表面。为此,生物传感器的可插入部分可具有生物相容性表面。根据本发明,生物传感器,特别是其可插入部分,被至少一种生物相容性膜(例如至少一种聚合物膜或凝胶膜)完全或部分覆盖,该生物相容性膜一方面可以对于体液或至少对于包含在其中的分析物是可渗透的,并且另一方面可以将传感器物质(例如一种或多种测试化学品)保留在传感器中,从而防止其迁移到身体组织中。生物传感器的其他部分或组件可以保留在身体组织的外部。
如通常使用的,术语“患者”和“用户”可以指代人类或动物,其独立于人类或动物可以相应地处于健康状况或可以患有一种或多种疾病的事实。作为一个示例,患者或用户可以是患有糖尿病的人类或动物。然而,附加地或备选地,本发明可被应用于其他类型的用户、患者或疾病。
如本文中进一步使用的,术语“体液”通常可以指通常可以存在于用户或患者的身体或身体组织中和/或可以由用户或患者的身体产生的流体,特别是液体。优选地,可以从由血液和间质液组成的组中选择体液。然而,另外地或替代地,可以使用一种或多种其他类型的体液,例如唾液,泪液,尿液或其他体液。在检测至少一种分析物期间,体液可存在于身体或身体组织内。因此,生物传感器可以具体地被配置用于检测身体组织内的至少一种分析物。
如本文进一步使用的,术语“分析物”可以指体液中存在的任意元素,组分或化合物,其中分析物的存在和/或浓度可能是用户,患者,或医务人员(例如医师)所感兴趣的。特别地,分析物可以是或可以包含至少一种可以参与用户或患者的代谢的任意化学物质或化合物,例如至少一种代谢物。作为一个示例,可以从由葡萄糖、胆固醇、甘油三酯、乳酸组成的组中选择至少一种分析物。然而,另外或备选地,可以使用其他类型的分析物和/或可以确定分析物的任何组合。特别地,至少一种分析物的检测尤其可以是分析物特定的检测。在不限制进一步可能的应用的情况下,下面特别参考对间质液中葡萄糖的监测来描述本发明。如通常使用的,分析物的至少一种性质可以由与该性质有关的“值”表征,例如分析物的浓度。但是,其他种类的性质也可能是可行,例如干扰物质或“干扰物”,即体液中包含的其他氧化还原活性物质,它们可能以类似方式被氧化,并且因此可能会产生可作为额外的电流被检测出的其他电子。
如本文进一步使用的,术语“测量”是指生成表征至少一次测量的结果的至少一个信号,特别是至少一个测量信号的过程。具体地,至少一个信号可以是或可以包括至少一个电子信号,例如至少一个电压信号和/或至少一个电流信号,特别是原始电流信号。至少一个信号可以是或可以包括至少一个模拟信号和/或可以是或可以包括至少一个数字信号。尤其是在电气系统中,可能需要将预定信号施加到特定设备,以便能够记录所需的测量信号。举例来说,特别是根据方法步骤b),测量原始电流可能需要向设备施加电压信号,反之亦然。
另外,本文所使用的术语“测量”还指生成与测量信号有关的附加值,其中,各个测量信号可能受到能够影响测量信号的变量的影响。如本文中所使用的,因此可以通过测量生物传感器的原始电流i来测量生物传感器的灵敏度s,由此可以考虑诸如葡萄糖的分析物的浓度c。在理想的表示中,生物传感器的灵敏度s通常可以由等式(1)定义:
s=(i–i0)/c,(1)
其中项i0指代可能来自干扰物的可能的零电流。在实践中,等式(1)对于低于100mg/dl至150mg/dl葡萄糖的经验值的浓度可以成立,其中对于高于该经验值的浓度,生物传感器的灵敏度s可以表现出更复杂的曲率。实际上,可以测量原始电流i,并且随后可以在灵敏度漂移的情况下校正灵敏度。可替代地,在这种情况下,可以校正原始电流i的值。
进一步根据本发明,根据方法步骤c)测量指示生物传感器的体内导纳y(t)的体内电流响应。如通常所使用的,术语“体内”是指在将生物传感器应用于患者或用户期间的生物传感器的实际状态,该状态尤其可以与制造或最初提供给患者或用户的生物传感器的状态相反。特别地,可以通过向生物传感器施加时变电压u(t)来确定体内电流响应i(t)。众所周知,生物传感器的导纳y(t)可以由等式(2)定义:
y(t)=i(t)/u(t)=y'(t)+iy''(t),(2)
其中,术语y′(t)和y″(t)分别是指复导纳y(t)的时变实部和虚部。替代地或附加地,可以测量导纳的倒数值,其通常被表示为生物传感器的“阻抗”。关于用于实际测量指示生物传感器的体内导纳y(t)的体内电流响应的优选过程的更多细节,可以参考以下描述。
如本文中进一步使用的,术语“确定”涉及通过使用表征测量结果的至少一个信号,特别是至少一个测量信号来产生至少一个代表性结果,例如多个代表性结果的过程。因此,如本文所用,可以通过在生物传感器的灵敏度s和导纳y(t)之间提供至少一种选择的关系来确定灵敏度与导纳的关系,其中生物传感器的灵敏度s的至少一个测量值和生物传感器的导纳y(t)的至少一个测量值可以用于该目的。如通常所使用的,可以通过在至少一个第一值(例如,与灵敏度s相关的)和至少一个第二值(例如与导纳y(t)有关的)之间应用运算(例如,数学运算)来提供两个值(例如,灵敏度s和导纳y(t))之间的选定“关系”。举例来说,数学运算可以选自比率,加权比率或功能比率中的至少一个,其中,加权比率是指每项都经过预先加权的比率,并且其中功能比率是指在形成该比率之前每项都要经受诸如多项式函数,指数函数或对数函数之类的函数的比率。但是,其他种类的操作和功能也是可行的。在优选实施例中,灵敏度与导纳的关系可以是灵敏度与导纳比s(t)/y(t),其可以优选地通过形成灵敏度s相对于导纳y(t)的比率来确定,其中可以使用生物传感器的灵敏度s的至少一个测量值和生物传感器的导纳y(t)的至少一个测量值。但是,为此目的,其他类型的关系也可能可行。
如本文中进一步使用的,术语“监测”是指连续记录数据并从其导出所需信息而无需用户交互的过程。为此,产生并评估多个测量信号,由此确定期望的信息。在此,多个测量信号可以在固定的或可变的时间间隔内或者替代地或附加地在至少一个预定事件发生时被记录。特别地,根据本发明的生物传感器可以尤其适于连续监测一种或多种分析物,特别是葡萄糖,诸如用于管理,监测和控制糖尿病状态。
根据本发明的生物传感器是电化学或安培度量传感器。如本文所用,术语“电化学传感器”或“安培度量传感器”均指代适于执行至少一个电化学测量,特别是多个或一系列电化学测量以通过使用安培度量法检测包含在体液中的至少一种物质的传感器。特别地,术语“电化学测量”或“电化学测量”是指通过采用安培度量法来检测物质的电化学可检测性质(例如电化学检测反应)。因此,例如,可以通过施加并比较一个或多个电极电势来检测电化学检测反应。具体地,电化学传感器可适于产生至少一个电传感器信号,其可直接或间接指示电化学检测反应的存在和/或程度,例如至少一个电流信号和/或至少一个电压信号。该测量可以是定性和/或定量测量。尽管如此,其他实施例也是可行的。
为此目的,如本文所使用的电化学传感器以电化学电池的方式布置,并且因此采用至少一对电极。如本文中所使用的,术语“电极”指代被适配成与体液或者直接或者经由至少一个半透膜或层进行接触的测试元件的实体。关于本发明,至少一个电极被膜覆盖,其中该电极可以以在该电极的至少一个表面上可能发生电化学反应的方式来体现。特别地,该电极可以以在电极的选定表面处可以发生氧化过程和/或还原过程的方式来体现。在本文所用的特别优选的实施例中,生物传感器具有工作电极,参考电极和对电极,其中工作电极和参考电极都可以被膜覆盖,其中(与参考电极相反)工作电极还包括酶,其中工作电极可以包含酶或可以被酶层覆盖。另外,对电极可以被膜覆盖或不被膜覆盖。然而,具有不同数量的电极或被膜覆盖的不同数量的电极的其他实施例也是可行的。
更特别地,电化学传感器可以是多域(field)传感器,其中,工作电极可以覆盖诸如聚酰亚胺基板之类的基板上的一个以上的域,例如4、8、12或16个域,而对电极可以放置在基板的背面。优选地,工作电极可以包括碳糊,作为催化剂和/或介体的mno2颗粒,以及施加至导电层(例如沉积在基板上的金和/或铜层)的葡萄糖氧化酶(god)和/或葡萄糖脱氢酶(gdh)的组合物,而对电极可以优选地是金电极或包括金电极,并且参考电极可以是ag/agcl电极。此外,覆盖工作电极的膜可以包括两个单独的部分膜,其可以彼此堆叠。在此,可以邻近工作电极定位的第一部分膜可以构成扩散垒,该扩散垒尤其可以是亲水层,例如具有亲水侧链和疏水侧链的亲水聚氨酯。与此相反,可以放置在第一部分膜之上并且因此可以邻接适于容纳体液的体积的第二部分膜可以是生物相容性层,其优选地可以包括生物凝胶,例如具有疏水主链和亲水性侧链的聚丙烯酸酯嵌段共聚物。特别地,两个部分膜都可以通过使用浸涂工艺来施加。
此外,工作电极,参考电极和对电极可以优选通过恒电位仪连接,其中可以通过恒电位仪在工作电极和参考电极之间施加电势差。因此,此处可以通过比较一个或多个电极电势,特别是工作电极与参考电极之间的电势差,来检测氧化还原反应的详细过程。如本文所用,术语“恒电位仪”是指适于调节和/或测量电化学电池中的两个电极之间,特别是工作电极与参考电极之间的电势差的电子设备。为此目的,可以实现恒电位仪,以便能够通过对电极将电流注入电化学电池,对电极为此也被称为辅助电极。恒电位仪的这种设置可以允许既调节电化学电池内工作电极与参考电极之间的电势差,又替代地或另外地测量(优选地在工作电极和对电极之间)原始电流i。另外,同样可采用恒电位仪以便测量原始电流i,由此不会由于恒电位仪的有源电流调节而可能发生电势降。结果,恒电位仪可以在工作电极和参考电极之间施加电压,例如直流电压或交流电压,优选直流电压,并且优选地同时测量优选地由此在工作电极和对电极之间产生的直流或可替代地交流原始电流i。结果,生物传感器可能能够测量工作电极和参考电极之间的原始电流i。此外,可以从原始电流i相对于分析物的浓度c的时间过程获得灵敏度s。如下面更详细地描述的,优选地,可以使用另一电路来确定体内电流响应,其指示电化学电池的体内导纳y(t),由此,此外,可以测量电化学电池的复导纳y(t)或与此有关的值。
工作电极可以进一步包含酶,或者可以被酶层覆盖,其中所述酶或酶层可以是或包括测试化学物(testchemistry),而参考电极和对电极可以优选地保持没有测试化学物。通常,术语“测试化学物”是指适于在存在至少一种分析物的情况下改变至少一种可检测性质的任意材料或材料组合物,其中此处可检测性质选自上文提及的电化学可检测性质。具体来说,该至少一个测试化学物可以是高度选择性的测试化学物,其仅在分析物存在于施加于测试元件的体液的样品中的情况下才改变性质,然而如果分析物可能不存在则不发生改变。更优选地,该至少一个性质的程度或改变取决于体液中分析物的浓度,以便允许分析物的定量检测。如本文中所使用的,该测试化学物可包括一种或多种酶(诸如葡萄糖氧化酶(god)和/或葡糖脱氢酶(gdh)),优选地,通过其自身和/或与检测器物质的其他成分相组合的酶被适配成与要被检测的至少一个分析物执行氧化过程或还原过程。另外地或替代地,测试化学物可包含一种或多种辅助组分,例如一种或多种辅酶和/或可包含一种或多种催化剂和/或氧化还原介体。此外,测试化学物可包括一种或多种染料,该染料优选地与一种或多种酶相互作用,可在存在要被检测的至少一个分析物的情况下改变它们的颜色。
在本发明的特别优选的实施例中,生物传感器可以是扩散控制的生物传感器,特别是扩散控制的安培度量生物传感器。如通常使用的,术语“扩散”是指物质(例如分子或颗粒)在流体中从包含高浓度物质的区域到低浓度物质的区域使浓度梯度向下的净运动。不希望受到理论的束缚,在生物传感器中,诸如葡萄糖之类的分析物从体液到工作电极表面的扩散可以认为是典型浓度范围内的限速步骤。在此,生物传感器可以在可以以到达带有酶的工作电极表面的分析物的反应的方式调节分析物的扩散速度与反应速度的比率的状况中被称为“扩散控制的”,以及反应后的其他步骤(例如电子转移)可能会迅速发生,以至于工作电极表面的分析物浓度可能消失。该方案尤其可以通过过量存在于工作电极表面上的酶与膜传输性质,特别是膜的厚度和渗透率的组合来实现。结果,根据等式(1),经过良好调整的扩散控制的生物传感器因此可以呈现出相对于分析物浓度c的灵敏度的高线性,同时可以避免灵敏度s的漂移,尤其可能是由于测量时间或存储时间而导致的酶活性下降或损失而发生的灵敏度s的漂移。因此,生物传感器的灵敏度s因此可以取决于膜的传输性质,特别是取决于膜的厚度和渗透率。换句话说,膜性质的变化可以被认为是引起灵敏度s变化的原因。
另一方面,通过采用生物传感器的介电特性来研究膜的性质可能是可行的。特别地,静态实验已经显示出灵敏度s与膜的电阻或电导之间的良好相关性。如通常所使用的,在dc电路的情况下,膜的电导率与膜的电阻rm的倒数有关。在此,只要酶过量存在,离子浓度保持恒定,并且温度保持恒定,就可以在膜的所有溶胀(swelling)状态下证明离子扩散与葡萄糖扩散之间的良好相关性。
不希望被理论所束缚,因此,生物传感器的功能测试可以提供灵敏度s的趋势,其中膜关于分析物的渗透率pana,膜的厚度d和电极的几何面积a可以根据等式(3)加以考虑:
s=(i–i0)/c〜pana/d∙a(3)
〜符号表示一方面灵敏度s与另一方面膜关于分析物的渗透率pana相对于膜厚度d与电极表面积a的乘积的比率之间的比例。
此外,可以在工作电极的表面上形成双层电容,该双层电容可以保持在0.01hz至1mhz,优选0.1hz至100khz,更优选1hz至10khz,特别是10hz至1khz的频率下。结果,导纳y(t)的测量可能不被法拉第电流来确定,包括但不限于零电流,但是也可以主要指膜中的离子(诸如na+或cl-)的电导率。因此,生物传感器的介电特性可为导纳y(t)提供以下趋势,其中膜关于离子的渗透率pion,膜的厚度d和电极的实际表面积a可以根据等式(4)来加以考虑:
y(t)=〜pion/d∙a(4)
因此,根据等式(5),可以将灵敏度与导纳的关系s(t)/y(t)估计为仅取决于分别与分析物和离子相关的各个膜渗透率pana,pion的比率:
s(t)/y(t)=〜pana/pion(5)
结果,可以采用灵敏度与导纳的关系s(t)/y(t),以提供关于固有膜传输性质的当前状态的信息,而可以忽略与膜有关的几何性质,特别是膜的厚度d和工作电极的表面积a的信息。因此,通过确定灵敏度与导纳的关系s(t)/y(t),例如通过在生物传感器的操作期间膜的溶胀来造成的膜的渗透率和厚度的改变可能有利地是可忽略的。换句话说,可以将灵敏度与导纳的关系s(t)/y(t)假定为在生物传感器的操作期间保持恒定,只要该生物传感器可以被认为是扩散受控的生物传感器即可。如上所述,术语“扩散受控”是指其中分析物的反应速率与分析物的扩散速率相比可能高得多的生物传感器。结果,在生物传感器中可能不会发生体内漂移,其中术语“体内漂移”涉及由于在生物传感器的体内操作期间生物传感器的体内性质(诸如膜性质,特别是固有膜性质)的改变而引起的生物传感器灵敏度的改变。
根据步骤c),在两个不同的操作点,即在第一操作点和第二操作点,测量指示生物传感器的体内导纳的原始电流i和体内电流响应。如本文所用,术语“操作点”是指可以通过将电子单元的确定状态施加到生物传感器来实现的生物传感器的特定状态。根据本发明,选择第一操作点以提供与膜的电阻有关的第一特征值,而选择第二操作点以用于提供与工作电极的电容有关的第二特征值。如本文中进一步使用的,术语“特征值”是指与操作点有关并且提供生物传感器在相应操作点的状态的代表信息的数值。
如下面更详细地描述的,第一特征值可以优选地包括可以与膜的电阻有关、特别是与膜的电阻成比例的值,特别是与承载膜的工作电极的几何面积(即横截面)、膜的厚度以及膜关于至少一种离子的渗透率成比例的值。关于膜的厚度和/或渗透率,可参考本文其他地方的描述。类似地,第二特征值可以包括可以与工作电极的电容的倒数有关的值,特别是与工作电极的电容的倒数成比例的值,特别是与承载膜的工作电极的实际表面积成比例以及与膜中可用的催化剂和/或介体的量成比例的值。关于催化剂和/或介体,可参考本文其他地方的描述。然而,其他种类的特征值也可能是可行的。
如通常所使用的,术语“电极的几何面积”是指电极的测量尺寸,其取决于用于电极的身体的物理尺寸,并且因此预期在生物传感器的操作期间不会改变。与此相反,术语“电极的实际表面积”是指实际上承载膜的电极表面的分区(partition)。结果,电极的实际表面积可以与电极的几何面积相同,只要电极的几何面积被膜完全覆盖即可。但是,电极的实际表面积可能会在生物传感器运行期间发生变化,特别是在其中电极化学物可能至少部分与电极垫分离的情况下,该电极垫可被视为电极化学物脱离后的活性电极表面。在这种情况下,可以保留由电极焊盘确定的电极表面与扩散面积之比,而可以忽略电极糊的粗糙度和伪电容的影响。因此,该过程允许在确定生物传感器的相应体内性质时考虑到生物传感器中存在的不同种类的区域。特别地,该过程有利地允许使用不依赖于电极的实际面积的值来解释在生物传感器的操作期间膜的溶胀。
根据方法步骤a),通常可以提供生物传感器的参考灵敏度与导纳的关系以供进一步参考。为此,可以优选地通过应用校准程序至少一次确定参考灵敏度与导纳的关系,对于该校准程序,优选地,可以将诸如普通测试条的已知生物传感器用于点测量。优选地,校准程序可以作为简化的“多重校准”来执行,尤其是以生物传感器的定期校准或根据事件的校准(例如患者实际佩戴生物传感器或在预定事件之后的请求)的形式来执行。更优选地,可以通过在患者处的生物传感器的初始体内操作之前在初始阶段期间关于实际佩戴该生物传感器的特定患者对生物传感器进行校准(优选地单次),以将该校准程序执行为“初始校准”。然而,最优选地,可以将校准程序执行为“工厂校准”,其包括在制造设施中校准生物传感器,特别是独立于将要佩戴该特定生物传感器的患者通过使用生物传感器的体外操作来进行校准,因此,有利地避免了对任何患者进行侵入性点测量。然而,其他可能性也是可设想的。与选择的校准程序无关,参考灵敏度与导纳的关系因此允许确定与在预定条件下研究的固有膜性质相比的固有本征膜性质,其中,如果适用,最近确定的灵敏度与导纳的关系可以优选地用于步骤d)的目的。
因此,根据本发明,检测生物传感器的体内性质。如本文所用,术语“体内性质”是指特定生物传感器的实际物理和化学性质,其代表在体内确定体液样品中的分析物值期间特定生物传感器的实际状态,并且其可能能够影响由处于特定状态的特定生物传感器确定的分析物值。如上所述,特定生物传感器的物理和化学性质可以包括但不限于覆盖工作电极的膜的性质,特别是固有性质。下文将更详细地描述可能能够影响分析物值的其他种类的性质。
因此,根据步骤d),一方面通过使用原始电流并通过补偿生物传感器灵敏度的体内漂移(如下所述),并且另一方面通过至少考虑第一特征值(但是优选地也考虑第二特征值)来确定体液样品中的分析物值。为此,特别是在第一方面根据步骤d)考虑了第一特征值以及优选地还有第二特征值,而在第二方面根据步骤e)还考虑了生物传感器的故障安全操作,其中故障安全操作如下文更详细地描述的那样是基于第一特征值和第二特征值中的至少一个。更具体地,尽管在任何情况下根据本发明都使用与膜的电阻的倒数有关的第一特征值,但是与工作电极的电容有关的第二特征值可以(如上所述,由于它独立于生物传感器中存在的不同种类区域)尤其在改善原始电流和分析物值之间的相关性中有用。
根据本发明,可以通过使用体内导纳的第一特征值并且优选还使用其第二特征值来校正灵敏度的实际确定值,来补偿生物传感器中的体内灵敏度漂移,由此考虑步骤a)期间提供的灵敏度与导纳的关系的值。根据等式(1),原始电流i可以根据生物传感器的灵敏度s而变化,其中,似乎与温度和时间有关的生物传感器的灵敏度s可能在货架期(shelflife)内衰减(例如由于取决于存储条件的膜重组(reorganization)),但在生物传感器的体内操作期间可能增加(例如由于膜的溶胀)。以这种方式,生物传感器中的体内灵敏度漂移尤其可以涉及覆盖生物传感器的工作电极的膜的固有膜性质随时间的变化或由于意外事件的变化,并且因此可能影响从原始电流i确定分析物值。
如本文中进一步使用的,术语“补偿”涉及修改能够受到副作用影响的测量值的过程,为此目的,应用了附加的考虑,通过该附加考虑,可以减少或特别优选地完全消除副作用,其中附加考虑尤其可以基于相同生物传感器上的附加测量结果。如本文所用,生物传感器中的体内灵敏度漂移能够影响原始电流i,并且因此根据方法步骤d)通过如上所述的考虑第一特征值和优选地第二特征值来进行补偿。为了既确定第一特征值又确定第二特征值,如本文中其他地方所述,在两个不同的操作点测量指示生物传感器的体内导纳的体内电流响应。在一个优选实施例中,因此可以通过使用第一特征值和优选地第二特征来确定灵敏度的实际值,通过校正原始电流的测量值来补偿生物传感器中的体内灵敏度漂移,从而将步骤a)期间提供的灵敏度与导纳的关系的值考虑在内。但是,也可以适用导出补偿的其他方式。
然而,与现有技术相反(在现有技术中,仅可以测量灵敏度s(t)的时间漂移,并且可以在已经过预定时间间隔之后和/或当灵敏度s(t)的时间漂移可能已经超过给定阈值时可以对生物传感器进行校准),本发明允许同时考虑导纳y(t)相对于灵敏度s(t)的时间漂移的时间变化。如等式(5)特别描述的,在体内操作期间,体内灵敏度与导纳比s(t)/y(t)可能对生物传感器中的许多变化不敏感,并且因此,尽管单独同时改变灵敏度s(t),也不会改变。然而,如由等式(5)后面的生物传感器的实际操作机制所特别表示的,因此在预定的时间间隔和/或灵敏度s(t)的时间漂移超过给定阈值之后,可能因此不再需要重新校准生物传感器。结果,与现有技术相比,本方法可以允许减少校准的数量,并且还能够依赖于生物传感器的初始校准或更优选地工厂校准。基于这些考虑,此外,本方法还可以应用于监测生物传感器的故障安全操作,这将在下面更详细地描述。
在本发明的特别优选的实施例中,可以通过应用非法拉第法,特别是通过在生物传感器处应用特别是在工作电极和参考电极之间的电势差的至少一个电势阶跃来实现对指示生物传感器的体内导纳y(t)的体内电流响应的测量。为此,可以优选使用恒电位仪。如本文所使用的,术语“电势阶跃”可以指的是由可以以电脉冲的形式提供的附加电势对包括膜的工作电极的冲击。在此,可以优选地在施加电势阶跃之后,通过10μs,更优选地50μs至1000μs,更优选地250μs,尤其是大约100μs的时间间隔的电脉冲来提供附加的电势。
由此,电势阶跃的高度可以选择为以便定义可以施加到生物传感器的膜的最大电压umax或最大电流imax之一。举例来说,电势阶跃可包括相对于膜上主导的(prevailing)电势e1在时间间隔δt内施加增强或减小的电势e2,从而向膜证明电势差δe。在这方面,可以强调的是,可以将电势阶跃的符号选择为正或负。在此,电势差δe可以优选地提供相对于主导电势e1为10mv至500mv,更优选为50mv至100mv的附加电压。
然而,可能能够向生物传感器提供随时间变化的电势的其他种类的测量也是可行的。如本文所使用的,术语“电势阶跃”也可以包括这些类型的测量。特别地,时变波形是正弦波或余弦波或正弦波和/或余弦波的线性或非线性组合,至少一个线性或非线性扫描,(诸如由伏安法提供的)至少一个周期性变化的信号也可以是适用的,只要它可以允许确定指示生物传感器的体内导纳y(t)的体内电流响应即可。作为进一步的替代方案,可以通过施加交流信号来确定生物传感器的体内电流响应。
进一步考虑工作电极的电容c,施加电势阶跃后的电流i(t)响应可能会遵循指衰减
或者
其中imax表示最大电流,i0表示零电流,rm表示膜的电阻,rd表示电子转移电阻,以及项
τ=rm∙c(8)
表示时间常数τ,其可被分配给由于电势阶跃引起的电流衰减,因此指示生物传感器的体内导纳y(t)。
作为进一步的结果,出现以下关系:
rm=∆e/imax,(9)
c=τ/rm,(10)
并且
c=q/∆e,(11)
其中项
q=∫i(t)dt(12)
表示通过电势阶跃提供给电极表面的额外电荷。
根据本发明,这些类型的测量可以在使用两个不同的操作点的情况下执行,优选地,可以通过在两个不同的时间常数下观察体内电流响应来选择这些操作点。根据等式(8),时间常数τ由工作电极的电容c和膜的电阻rm通过以下等式确定:
τ=rm∙c(8)。
因此,在特别优选的实施例中,可以将第一操作点选择为低于τ,而可以将第二操作点选择为高于τ,优选地高于2τ,3τ,4τ或5τ。结果,第一操作点反映了与膜的电阻有关的第一特征值,从而提供了有关承载膜的工作电极的几何面积,膜的厚度以及膜对于至少一种离子的渗透率的信息,而第二操作点则反映与工作电极的电容有关的第二特征值,从而提供有关承载膜的工作电极的实际表面积和膜中可用的催化剂和/或介体的量的信息。因此,优选地,取决于膜厚度和/或介体负荷,可以根据生物传感器的架构来选择第二操作点。另外,可以设想进一步的考虑。因此,这种测量可以适于整体地考虑在膜的溶胀和去溶胀期间可能出现的所有不同的膜厚度。
关于确定体液样品中的分析物值,本方法同时用于监测生物传感器的故障安全操作。如通常使用的那样,术语“故障安全操作”是指生物传感器的操作模式,其包括检测生物传感器中的可能能够影响分析物值的故障,其中该故障可能是由于传感器在其一段时间内的操作期间的结构修改和/或由于生物传感器操作所需的物质的(例如催化剂,介体和/或酶活性)损失而引起的。优选地,故障安全操作包括生物传感器的操作模式,该模式选自无有效值的指示,重新校准的建议以及关闭生物传感器的请求中的至少一项。为此,可以确定灵敏度s,工作电极的电容c和膜的电阻rm,其中,根据等式(8)的工作电极的电容c和膜的电阻rm根据时间常数τ与彼此相关。特别地,因此可以通过组合灵敏度s,工作电极的电容c和膜的电阻rm中的至少两个的改变来确定生物传感器的结构修改。下面给出了特别适合于监测生物传感器的故障安全操作的示例性实施例。
在特别优选的实施例中,可以以预定格式将体液样品中的分析物值和关于生物传感器的故障安全操作的信息两者呈现给患者或用户。在此,分析物值可以以明确的形式,优选以mg/dl和/或作为图示出分析物值的时间变化的曲线来显示。代替指示或显示关于生物传感器的故障安全操作获得的确定结果,可以执行灵敏度漂移补偿而无需明确通知患者或用户,同时可以提供与所提议的反应有关的标记。举例来说,在生物传感器处于故障安全操作模式的情况下,可以显示指示“有效值”的标志,而在生物传感器处于故障安全操作模式之外的情况下,可以替代地显示从“无有效值”,“需要重新校准”或“关闭”中的一个选择的标志。但是,说明所获得结果的其他方式也是可行的。
如以上进一步提到的,本文所使用的生物传感器可以是完全可植入的生物传感器或可替代地是部分可植入的生物传感器。特别地,生物传感器可以适于连续监测体液中的分析物,优选地用于连续测量皮下组织中,特别是诸如血液的间质液中的分析物。然而,其他种类的生物传感器以及该生物传感器的应用也是可行的。如以上进一步提到的,分析物可以优选地包含葡萄糖,其中所述酶可以是葡萄糖氧化酶(god)。或者,也可以使用其他种类的酶,例如葡萄糖脱氢酶(gdh)。
在本发明的另一方面,公开了一种用于通过执行如上所述的方法来检测生物传感器的体内性质的电子单元。为此目的,电子单元与生物传感器互操作,适于以电化学方式确定体液样品中的分析物的至少一个值,其中电子单元还适于测量指示生物传感器的导纳的原始电流和电流响应。
如本文中所使用的,术语“电子单元”可以指代可以独立于生物传感器处理的任意设备,优选地指电子设备。电子单元也可以尤其适于与生物传感器相互作用以将电压施加到电极中的至少一个并且同时或随后检测由所述生物传感器的电极中的一个所产生的至少一个信号。为此目的,电子单元可以被配置为施加至少一个电脉冲和/或执行至少一个阻抗测量,如上文和/或下文所述。为此,电子单元尤其可以适于在生物传感器的至少一个工作电极和至少一个参考电极之间施加电势并且优选地用于在工作电极和生物传感器的至少一个对电极之间测量由此产生的原始电流。
电子单元可以进一步被配置为通过使用所述生物传感器的电极来执行至少一个安培度量测量,特别是用以(优选地,同时或随后)检测至少一个直流信号和至少一个电流响应。为此目的,电子单元可以特别地被配置为能够向生物传感器的电极施加主导电势和电势阶跃两者并且检测响应,如本文其他地方所述。特别地,电子单元因此可以包括直流测量单元并且包括电势阶跃响应测量单元,其中,直流电测量单元可以被配置用于测量原始电流,而电势阶跃响应测量单元可以被配置用于测量指示生物传感器的体内导纳的体内电流响应。为此,电势阶跃响应测量单元至少包括电荷计数器和峰值检测器。但是,其他实施例也是可行的。
电子单元可以进一步被适配成导出与根据该检测的体液样品中的分析物有关的分析物值的信息中的至少一项。为此,电子单元可以包括至少一个与电极相互作用的电子评估装置,特别地以便从至少一个信号中导出至少一个分析物值。因此,电子单元可以包括至少一个评估设备,该评估设备包括至少一个数据处理装置,例如微控制器,专用集成电路(asic),现场可编程门阵列(fpga)中的一个或多个。但是,其他类型的设备也可能是可行的。
在本发明的另一方面,公开了一种用于操作生物传感器以便以电化学方式检测体液样品中的至少一个分析物值的系统。因此,该系统包括至少一个如上所述和/或下面所述的生物传感器,其适于以电化学方式检测体液样品中的至少一个分析物值,其中该生物传感器可通过使用如上文和/或下文所述的电子单元通过执行如上文和/或下文所述的方法来操作,该电子单元因此适于测量原始电流并确定灵敏度和生物传感器的导纳。为此目的,电子单元被配置为用于通过执行本文其他地方所述的方法来补偿生物传感器中的体内灵敏度漂移。
根据本发明的方法,电子单元和系统相对于现有技术具有许多优点。与现有技术相比,所提出的方法尤其可以允许减少校准的数量,并且还能够依赖于生物传感器的初始校准,或者特别优选地,依赖于生物传感器的工厂校准,例如通过仅由制造商确定一次灵敏度与导纳的关系。
总而言之,以下实施例是本发明的潜在实施例。然而,其他实施例是可行的。
实施例1:一种确定体液样品中至少一个分析物值的方法,其中生物传感器与电子单元互操作,适于以电化学方式确定体液样品中分析物的至少一个值,其中该生物传感器包括至少一个工作电极,其中所述工作电极被膜覆盖并且包括用于提供与分析物的反应的酶,其中该膜具有电阻并且该工作电极具有电容,其中电子单元适于测量指示生物传感器的导纳的原始电流和电流响应,该方法包括以下步骤:
a)提供生物传感器的灵敏度与导纳的关系;
b)测量生物传感器中的原始电流;
c)测量指示生物传感器的体内导纳的体内电流响应,其中在至少一个第一操作点和至少一个第二操作点测量体内电流响应,其中选择第一操作点以用于提供与膜的电阻有关的第一特征值,并且其中选择第二操作点以用于提供与工作电极的电容有关的第二特征值;以及
d)通过使用原始电流确定体液样品中的分析物值,并通过使用第一特征值确定灵敏度的实际值来校正原始电流的测量值,从而补偿生物传感器中的体内灵敏度漂移,从而考虑步骤a)期间提供的灵敏度与导纳的关系;以及
e)基于第一特征值和/或第二特征值来监测生物传感器的故障安全操作。
实施例2:一种用于检测生物传感器的体内性质的方法,其中所述生物传感器与电子单元互操作,适于以电化学方式确定体液样品中的分析物的至少一个值,其中所述生物传感器包括至少一个工作电极,其中所述工作电极被膜覆盖并且包括用于提供与分析物的反应的酶,其中所述膜具有电阻,并且所述工作电极具有电容,其中所述电子单元适用于测量指示生物传感器的导纳的原始电流和电流响应,该方法包括以下步骤:
a)提供生物传感器的灵敏度与导纳的关系;
b)测量生物传感器中的原始电流;
c)测量指示生物传感器的体内导纳的体内电流响应,其中在至少一个第一操作点和至少一个第二操作点处测量体内电流响应,其中选择第一操作点以用于提供与膜的电阻有关的第一特征值,并且其中选择第二操作点以用于提供与工作电极的电容有关的第二特征值;以及
d)通过使用原始电流确定体液样品中的分析物值,并通过考虑第一特征值和基于第一特征值和/或第二特征值的生物传感器的故障安全操作来补偿生物传感器中的体内灵敏度漂移。
实施例3:根据前述两个实施例中的任一个所述的方法,其中考虑第一特征值和第二特征值两者以便确定分析物值。
实施例4:根据前述实施例中任一个所述的方法,其中生物传感器至少具有至少两个电极。
实施例5:根据前述实施例所述的方法,其中生物传感器至少具有包括膜,参考电极的工作电极和对电极,其中在该工作电极和参考电极之间施加电势差。
实施例6:根据前述实施例所述的方法,其中,工作电极,参考电极和对电极通过恒电位仪连接,其中,通过恒电位仪在工作电极和参考电极之间施加电势差。
实施例7:根据前述实施例中任一个所述的方法,其中,通过观察原始电流相对于分析物值的过程来确定生物传感器的灵敏度。
实施例8:根据前述实施例中任一个所述的方法,其中,在所述工作电极和所述对电极之间测量所述原始电流。
实施例9:根据前述实施例中任一个所述的方法,其中,所述分析物值是指所述体液中的所述分析物的浓度。
实施例10:根据前述实施例中任一个所述的方法,其中通过测量生物传感器的原始电流i确定生物传感器的灵敏度s,从而根据等式(1)考虑分析物的浓度c
s=(i–i0)/c,(1)
其中i0是可能的零电流。
实施例11:根据前述实施例中任一个所述的方法,其中,所述第一特征值包括与所述膜的电阻有关,优选地与所述膜的电阻成比例的值。
实施例12:根据前述实施例所述的方法,其中第一特征值与承载膜的工作电极的几何面积,膜的厚度以及膜关于至少一种离子的渗透率成比例。
实施例13:根据前述实施例中的任一个所述的方法,其中,所述第二特征值包括与所述工作电极的电容有关,优选地与所述工作电极的电容成比例的值。
实施例14:根据前述实施例所述的方法,其中第二特征值与承载膜的工作电极的实际表面积和电极中可用的催化剂和/或介体的量成比例。
实施例15:根据前述实施例中任一个所述的方法,其中时间常数τ根据等式(8)由工作电极的电容c和膜的电阻rm来确定:
τ=rm∙c(8)
其中,在τ以下选择第一操作点,在τ以上选择第二操作点。
实施例16:根据前述实施例所述的方法,其中,第二操作点被选择为高于2τ,3τ,4τ或5τ中的一个。
实施例17:根据前述实施例中任一个所述的方法,其中,通过在所述生物传感器所包括的两个电极之间施加至少一个时变电势来确定指示所述生物传感器的体内导纳的体内电流响应。
实施例18:根据前述实施例所述的方法,其中,通过对两个电极之间提供的电势差施加至少一个电势阶跃来确定指示生物传感器的体内导纳的体内电流响应。
实施例19:根据前述实施例所述的方法,其中,至少一个电势阶跃包括在两个电极之间施加具有正号或负号之一的附加电势。
实施例20:根据前述实施例所述的方法,其中,在施加电势阶跃之后,通过在10μs,优选地50μs至1000μs,优选地250μs,尤其是大约100μs的时间间隔的电脉冲来提供附加电势。
实施例21:根据前述两个实施例中任一个所述的方法,其中,除了电势差之外,还通过具有10mv至500mv,更优选地50mv至100mv的附加电压的电脉冲来提供附加电势。
实施例22:根据前述实施例中任一个所述的方法,其中体内电流响应显示出最大电流。
实施例23:根据前述实施例所述的方法,其中在第一操作点处(优选地在施加电势阶跃之后的10μs至100μs的时间间隔内)观察到最大电流。
实施例24:根据前述两个实施例中的任一个所述的方法,其中所述膜的电阻rm根据等式(9)来确定:
rm=∆e/imax,(9)
其中∆e是施加到生物传感器的电势差的高度,并且imax是电流响应所表现出的最大电流。
实施例25:根据前述两个实施例中的任一个所述的方法,其中,通过观察由于到第二操作点的电势阶跃带来的生物传感器的累积电荷q(t)的时间过程并通过在电势阶跃期间施加到生物传感器的电势差δe的高度来确定所述工作电极的电容c。
实施例26:根据前述实施例中任一个所述的方法,其中,通过组合灵敏度s,膜的电阻rm和工作电极的电容c中的至少两个的变化来确定生物传感器的结构修改。
实施例27:根据前述实施例中任一个所述的方法,其中,以明确的形式,优选地以mg/dl和/或作为图示出了所述分析物值的时间变化的曲线来显示所述分析物值,并且其中,优选同时地,在生物传感器处于故障安全操作模式的情况下,显示指示“有效值”的标志,并且在生物传感器处于故障安全操作模式之外的情况下,显示从“无有效值”,“需要重新校准”或“关闭”中的一个选择的标志。
实施例28:根据前述实施例中任一个所述的方法,其中,通过使用用于所述生物传感器的灵敏度的至少一个值和用于指示所述生物传感器的导纳的电流响应的至少一个值来确定所述灵敏度与导纳的关系。
实施例29:根据前述实施例中任一个所述的方法,其中,所述故障安全操作包括所述生物传感器的操作模式,所述操作模式选自无有效值的指示,重新校准的建议以及关闭生物传感器的请求中的至少一项。
实施例30:根据前述实施例中任一个所述的方法,其中,所述生物传感器的校准选自多重校准中的至少一个,优选地,初始校准,并且最优选地,工厂校准。
实施例31:根据前述实施例中任一个所述的方法,其中,所述生物传感器是完全可植入生物传感器或部分可植入生物传感器。
实施例32:根据前述实施例所述的方法,其中生物传感器是用于连续监测分析物的生物传感器。
实施例33:根据前述实施例所述的方法,其中生物传感器是用于连续测量皮下组织中的分析物的生物传感器。
实施例34:根据前述实施例所述的方法,其中生物传感器是用于连续测量体液中的分析物的生物传感器。
实施例35:根据前述实施例所述的方法,其中生物传感器是用于连续测量间质液中的分析物的生物传感器。
实施例36:根据前述实施例所述的方法,其中生物传感器是用于连续测量血液中的分析物的生物传感器。
实施例37:根据前述五个实施例中的任一个所述的方法,其中分析物包括葡萄糖。
实施例38:根据前述实施例所述的方法,其中所述酶是葡萄糖氧化酶或葡萄糖脱氢酶中的一种。
实施例39:一种用于通过执行根据前述实施例中任一个所述的方法来检测生物传感器的体内性质的电子单元,其中,所述电子单元与所述生物传感器互操作,适于以电化学方式确定体液样品中分析物的至少一个值,其中所述生物传感器包括至少一个工作电极,其中所述工作电极被膜覆盖并且包括用于提供与所述分析物的反应的酶,其中所述电子单元还适于测量原始电流和指示生物传感器的导纳的电流响应。
实施例40:根据前述实施例的电子单元,包括直流测量单元和电势阶跃响应测量单元,其中,直流测量单元被配置为测量原始电流,并且其中电势阶跃响应测量单元被配置为测量指示生物传感器导纳的电流响应。
实施例41:根据前述实施例的电子单元,其中电势阶跃响应测量单元至少包括电荷计数器和峰值检测器。
实施例42:根据前述实施例的电子单元,其中,峰值检测器被配置用于测量与膜的电阻有关的第一特征值。
实施例43:根据前述两个实施例中的任一个所述的电子单元,其中,所述电荷计数器被配置用于测量与所述工作电极的电容有关的第二特征值。
实施例44:一种用于通过执行根据前述实施例中任一个所述的方法来检测生物传感器的体内性质的电子单元,其中,所述电子单元与所述生物传感器互操作,适于以电化学方式确定体液样品的中分析物的至少一个值,其中所述生物传感器包括至少一个工作电极,其中所述工作电极被膜覆盖并且包括用于提供与所述分析物的反应的酶,其中所述电子单元还适于测量原始电流和指示所述生物传感器的导纳的电流响应,其中,所述电子单元包括电势阶跃响应测量单元,其中,所述电势阶跃响应测量单元被配置用于测量指示所述生物传感器的导纳的电流响应,其中,所述电势阶跃响应测量单元包括至少一个电荷计数器和至少一个峰值检测器,其中,峰值检测器被配置用于测量与膜的电阻有关的第一特征值,并且其中电荷计数器被配置用于测量与工作电极的电容有关的第二特征值。
实施例45:根据前述实施例的电子单元,其中,所述电子单元包括直流测量单元,其中,所述直流测量单元被配置为测量原始电流。
实施例46:根据引用电子单元的前述实施例中的任一个所述的电子单元,其中,所述电子单元还适于在所述生物传感器的所述至少一个工作电极和至少一个参考电极之间施加电势并且用于测量(优选地在生物传感器的工作电极和对电极之间的)由此产生的原始电流。
实施例47:一种用于操作生物传感器以便以电化学方式检测体液样品中的至少一个分析物值的系统,该系统包括至少一个生物传感器以便以电化学方式检测体液样品中的至少一个分析物值,其中可通过执行根据引用方法的前述实施例中的任何一个的方法以及根据引用电子单元的前述实施例中的任何一个的电子单元来操作该生物传感器。
附图说明
可以从以下优选实施例的公开中得出本发明的其他细节。实施例的特征可以以隔离的方式或以任何组合来实现。本发明不限于实施例。在附图中示意性地描绘这些实施例。附图中相同的附图标记指代相同的元件或功能相同的元件或就其功能而言彼此对应的元件。
在附图中:
图1示意性地图示了适于确定生物传感器的灵敏度的电路;
图2图示了分别用于测量生物传感器的灵敏度(图2a)和生物传感器的介电特性(图2b)的示意性机制;
图3图示了对生物传感器的电势阶跃的施加(图3a)以及生物传感器的电流响应(图3b)和相关电荷(图3c)的相应过程;
图4图示了以使生物传感器的频率行为可视化的波特图的形式的生物传感器的阻抗的相应过程的描绘;
图5图示了生物传感器的灵敏度(图5a),导纳(图5b),灵敏度与导纳比(图5c),灵敏度与导纳比与中值的相对偏差(图5d)和电容(图5e)的时间过程;
图6图示了生物传感器中电流(图6a),导纳(图6b)和电流与导纳比(图6c)的时间过程;
图7图示了包括生物传感器和电子设备的系统的示意性电路图;
图8图示了特别适合于电荷确定的电路的优选示例;以及
图9图示了特别适合于峰值确定的电路的三个优选示例。
具体实施方式
图1示意性地图示了与确定生物传感器110的灵敏度s有关的多个方面。为了表征整体上构成电化学电池的生物传感器110,可以应用如图1中示意性描绘的电路112。在此,采用恒电位仪114,其中恒电位仪114包括输出端116,其各自同时连接至生物传感器110的电极118之一,即连接到工作电极120,参考电极122和对电极124。恒电位仪114可适于调节和/或测量生物传感器110中的两个电极118之间,特别是工作电极120和参考电极122之间的电势差。为此目的,可以实现恒电位仪114以便能够通过对电极124将电流注入生物传感器110中。电路112因此可以既允许调节工作电极120与参考电极122之间的电势差,又可以替代地或另外地测量工作电极120与对电极124之间的直流原始电流i。结果,电路112可能能够测量工作电极120和对电极124之间的原始电流i。
根据等式(1),
s=(i–i0)/c,(1)
其中项i0指代可能的零电流,生物传感器110的灵敏度s可以进一步从直流原始电流i相对于分析物(例如葡萄糖)的浓度c(由生物传感器110确定)的过程得出。因此,电路112可能能够提供生物传感器110对施加至生物传感器110的分析物轮廓(例如葡萄糖轮廓)的总体响应。然而,dc原始电流i不能区分可能由于生物传感器110的不同分区而引起的效应,如下文更详细地描述的。在电路112中,用于检测假象的附加电化学技术只能应用于工作电极120,而与参考电极122或对电极124有关的假象可能因此仍然无法被检测到。
图2a以高度示意性的方式图示了生物传感器110的灵敏度s的体内确定的特别优选的机制,这也可以称为生物传感器110的“功能测试”。在生物传感器110中,通常可以将具有表面积a的工作电极120放置在基板126上,优选放置在柔性印刷电路板128上,并配备阻焊剂130。此外,工作电极120被具有厚度d的膜132覆盖。在此,膜132可以优选地包括酶134,特别是葡萄糖氧化酶,通常缩写为“god”。由体液140提供的分析物136,(特别是葡萄糖)和氧138的反应可导致过氧化氢h2o2的形成,该过氧化氢h2o2可能与也存在于工作电极表面的二氧化锰mno2(作为催化剂和/或介体)反应,从而向工作电极120提供自由电子2e-,由此产生直流原始电流。根据等式(3),
s=pana/d∙a,(3)
除了工作电极120的表面积a和膜的厚度d,膜132相对于诸如葡萄糖的分析物的渗透率pana可能能够影响生物传感器110的灵敏度s。结果,生物传感器110的功能测试可以提供生物传感器110的灵敏度s,其可以取决于多个变量,例如厚度d和膜132的面积,这些变量可以由于制造效应而变化。
图2b以高度示意性的方式图示了一种测量指示生物传感器110的体内导纳y(t)的体内电流响应的特别优选的机制,也可以称为生物传感器110的体内“介电特性”或“体内性质的检测”。再次,具有表面积a的生物传感器110的工作电极120通常可以放置在诸如柔性印刷电路板128之类的基板126上,并配备有阻焊剂130。特别优选地,工作电极120可以被具有厚度d的膜132覆盖。同样,膜132可以优选地包含酶134,特别是葡萄糖氧化酶。根据等式(4),
y(t)=〜pion/d∙a,(4)
生物传感器110的导纳y(t)可取决于膜相对于所述离子(例如na+或cl-离子)的渗透率pion,该膜的厚度d,以及电极118的面积a。
如在图2b中进一步指出的,电极118的表面积a可以通过具有由双层电容表示的双层来描述(如在下面的图8中示意性地描绘的),其中可以通过测量生物传感器110的体内电流响应来确定双层电容。如本文中所使用的,双层电容可以用作表示电极118的表面积a的量。双层电容的测量可以揭示与电极表面有关的变化,特别是电极118的接触损失,漏电(draining)或脱离。结果,双层电容的测量可以用作附加参数,特别是适于提供关于生物传感器的操作的附加故障安全信息。
通过比较如图2a和图2b中示意性示出的各个结果,可以确定灵敏度与导纳比s(t)/y(t),其有利地仅根据等式(5)取决于各个膜相对于分析物和离子的渗透率pana,pion的比率:
s(t)/y(t)=〜pana/pion(5)
如上所述,所确定的灵敏度与导纳比s(t)/y(t)可以允许提供关于与膜132的相应的渗透率有关的固有膜传输性质的当前状态的信息,而可以忽略关于生物传感器的几何性质(特别是膜132的厚度d)和工作电极120的几何面积a的信息。结果,通过确定灵敏度与导纳比s(t)/y(t),可以忽略(例如由生物传感器110的体内操作期间膜132的溶胀导致的)膜132的厚度d的变化。
图3图示了对生物传感器110施加电势阶跃150以及生物传感器110对电势阶跃150的施加的响应,以作为被配置为确定指示生物传感器的体内导纳y(t)的体内电流响应的优选实施例。
如图3a所示意性描绘的,电势阶跃150可以看作是在时间间隔∆t=t1–t0上相对于膜上主导的电势e1施加增强的电势e2,由此在时间间隔δt内向膜提供电势差δe。作为替代方案(此处未显示),可以在时间间隔δt上再次相对于在膜上主导的电势e1施加减小的电势e2,从而在时间间隔δt上向膜提供电势差δe。进一步的替代方案可以使用不同的时变电势,特别是时变波形,至少一个线性或非线性扫描,或至少一个周期性变化的信号,例如以上更详细描述的。为了简单起见,电势阶跃150在下面将包括这些随时间变化的电势中的任何一个。
图3b示意性地示出了生物传感器110的电流响应i(t)的对应过程152,如在时间t0=0s处由到生物传感器110的第一电势阶跃的第一施加以及随后在时间t1=0.24s处由到生物传感器110的第二电势阶跃的第二施加的影响,由此,在该特定示例中,相对于第一电势阶跃的第一施加,第二施加展示出第二电势阶跃的相反符号。然而,除了改变电势阶跃150的符号之外,其他种类的电势阶跃的施加也是可行的,替代地或附加地,也可以改变电势差δe的高度。
因此,考虑到膜132的电容c,在施加电势阶跃150之后,在膜132处的电流i(t)可以接着如图3b中示意性地描绘的呈现出指数衰减154,展现正号的第一电势阶跃的第一施加之后该指数衰减可以由等式(6)或(7)中的任何一个来描述:
或者
其中,imax表示最大电流,并且i0表示零电流。对于电势阶跃150的负号,第二电势阶跃的第二施加之后,膜132处的电流i(t)可以类似地用交替的符号来描述。
如在图3b和等式(8)中进一步指出的,可以通过参考如下项来描述指数衰减154
τ=rm∙c,(8)
其中,项τ涉及时间常数τ,由于将电势阶跃150施加到生物传感器110,该时间常数τ可以分配给电流i(t)的指数衰减154。如通常所使用的,时间常数τ可以被定义为与一时间间隔有关,在该时间间隔之后,在该时间间隔的开始处的初始强度已经减小到该初始强度的大约1/e≈0,367879的值。然而,时间常数τ的其他种类的定义也可以适用,例如在时间间隔之后强度衰减到初始强度的大约1/2的值。
特别地,如图3b中示意性描绘的指数衰减154因此可以用于根据等式(9)确定膜132的电阻rm
rm=∆e/imax,(9)
由此,在时间常数τ以下,在第一操作点156处,优选在施加电势阶跃150之后的10μs至100μs的时间间隔处,仅在电势阶跃150期间施加到生物传感器110的电势差δe的高度和可以从生物传感器110的电流响应i(t)的过程152中得出的所观察到的最大电流imax。
如图3b进一步示意性的描绘的,另外在τ以上,优选在2τ,3τ,4τ或5τ以上选择第二操作点158,以确定工作电极120的电容c。通过根据等式(11)应用电容c的一般定义
c=q/∆e,(11)
这可能允许确定额外电荷
q(t)=∫i(t)dt,(12)
其已通过施加电势阶跃150被提供给膜132。
图3c示意性地描绘了生物传感器110的附加电荷q(t)的对应过程160,如在时间t0=0s处对生物传感器110的第一电势阶跃的第一施加以及随后在时间t1=0.24s处对生物传感器110的第二电势阶跃的第二施加所影响的,由此,在该特定示例中,第二施加再次展示了第二电势阶跃相对于第一电势阶跃的第一施加的相反符号。
图4示意性地描绘了“波特图”,其通常描述了涉及强度相对于所施加的频率f的波特幅值图和涉及相移相对于所施加的频率f的波特相位图的组合。如图4左侧所示,阻抗z的绝对值的对数以欧姆为单位,并且在右侧,绘制了生物传感器110的响应的相移与频率f相对于施加到生物传感器110的交流电压或电流的底数10的对数的关系。在图4中,各种曲线162是指与阻抗z的绝对值的对数与频率f的对数的关系有关的波特幅值图。
如在图4中可以进一步看到的,曲线162表现出可以在预定频率范围处出现的各种特征。一方面,如上参考图2b所述,通常认为可观察到的朝向较低频率的阻抗z的增加164归因于双层cdl的电容行为。另一方面,通常认为可观察到的朝向较高频率的阻抗z的减小166是由于膜电阻的高频欧姆行为引起的。
如图4进一步公开的,曲线162相对于彼此表现出区别168,特别是在1hz至10khz的范围内,特别是在3hz至3khz的范围内,尤其是在10hz至1khz的范围内。表示膜132的电阻变化170的这种行为通常可以归因于膜132的渗透率和厚度的变化,例如,作为如上所述的生物传感器110的在体内操作期间膜132溶胀的结果。因此,通过施加指示范围内的单个频率来测量生物传感器110的阻抗z可能是特别有利的。
图5图示了与生物传感器110有关的多个数量的时间过程,其可以通过本文所述的测量来提供。
首先,图5a图示了在分析物的恒定浓度c下生物传感器110的电流响应i(t)的时间过程,根据等式(1),该恒定浓度c与生物传感器110的灵敏度s成比例。如可从图5a得出的,特别是由于膜132的溶胀(例如由等式(3)表示),可能会发生累积高达100%的大灵敏度变化。结果,生物传感器110的灵敏度s可以接受生物传感器110的操作,并且因此,即使当分析物的浓度c可以保持恒定时,也不适合于确定生物传感器110中的体内漂移。
类似地,图5b图示了生物传感器110的导纳y(t)的时间过程,其中曲线172是通过施加电势阶跃150获得的,而曲线174是通过应用电化学阻抗谱(eis)而获得的,特别是用于目的比较。与曲线172、174的产生方式无关,生物传感器110的导纳y取决于生物传感器110的几何性质,因为它由于膜132的溶胀而改变其值,例如,由等式表示(4)。
与此相反,图5c图示了生物传感器110的灵敏度与导纳比s(t)/y(t)的时间过程,根据等式(5),该灵敏度与导纳比不取决于生物传感器的几何性质,尤其是既不取决于膜132的厚度d,也不取决于工作电极120的表面积a。同样,通过施加电势阶跃150获得曲线172,而通过应用eis获得曲线174。结果,生物传感器110的灵敏度与导纳比s(t)/y(t)允许提供关于与膜132关于分析物和离子的渗透率pana,pion有关的固有膜传输性质的当前状态的信息。从图5c可以得出,只要固有的膜传输性质保持恒定,生物传感器110的灵敏度与导纳比s(t)/y(t)的时间过程就不会受到传感器的其他变化(如这里描绘的膜132在时间间隔内的溶胀)的影响。因此,如图5c所描绘的,生物传感器110的灵敏度与导纳比s(t)/y(t)因而允许确定生物传感器110的体内漂移,随后在通过使用原始电流确定分析物值时对所述体内漂移进行补偿。
作为图5c的一种放大,图5d图示了以与中位数的偏差百分比给出的灵敏度与导纳比s(t)/y(t)与中位数的相对偏差的时间过程,其中,再次通过施加电势阶跃150获得曲线172,而通过应用eis获得曲线174。从图5d可以得出,除了其中生物传感器110中的膜132的温度略有变化的时间段176外,灵敏度与导纳比s(t)/y(t)与中值的相对偏差在所描绘的时间间隔内保持恒定。实际上,由于温度变化太小而在图5c中无法引起注意,因此可以认为温度变化特别小。因此,这种行为清楚地证明灵敏度与导纳比s(t)/y(t)的确定看起来是特别适合于确定生物传感器110的体内漂移的合理量,因为温度变化可以被认为是触发生物传感器110的体内漂移的因素。
作为替代措施,图5e再次图示了生物传感器110的电容c的时间过程,示出了通过施加电势阶跃150获得的曲线172,而曲线174是通过应用eis获得的。类似于图5c,生物传感器110的电容c的时间过程在所描绘的时间间隔上实际上保持恒定。
图6呈现了可以如本文所述通过施加电势阶跃150来提供的与生物传感器110有关的许多体内性质的时间过程的另一示例,其中,与图5a至5e相反,这里时间尺度超过了整整两天半。
在此,图6a图示了在恒定浓度c=10mm的分析物葡萄糖的情况下生物传感器110的电流响应i(t)的时间过程。在图6b中描绘了生物传感器110的相应的导纳y(t),而如图6c所示的,在如此处适用的恒定分析物浓度下,生物传感器110的相应的电流与导纳比i(t)/y(t)与灵敏度与导纳比s(t)/y(t)成比例。再次,从图6c可以得出,除了运行的最初几个小时,生物传感器110的灵敏度与导纳比s(t)/y(t)在±5%的阈值内保持恒定,因此,这暗示了生物传感器110的完美补偿的灵敏度漂移。
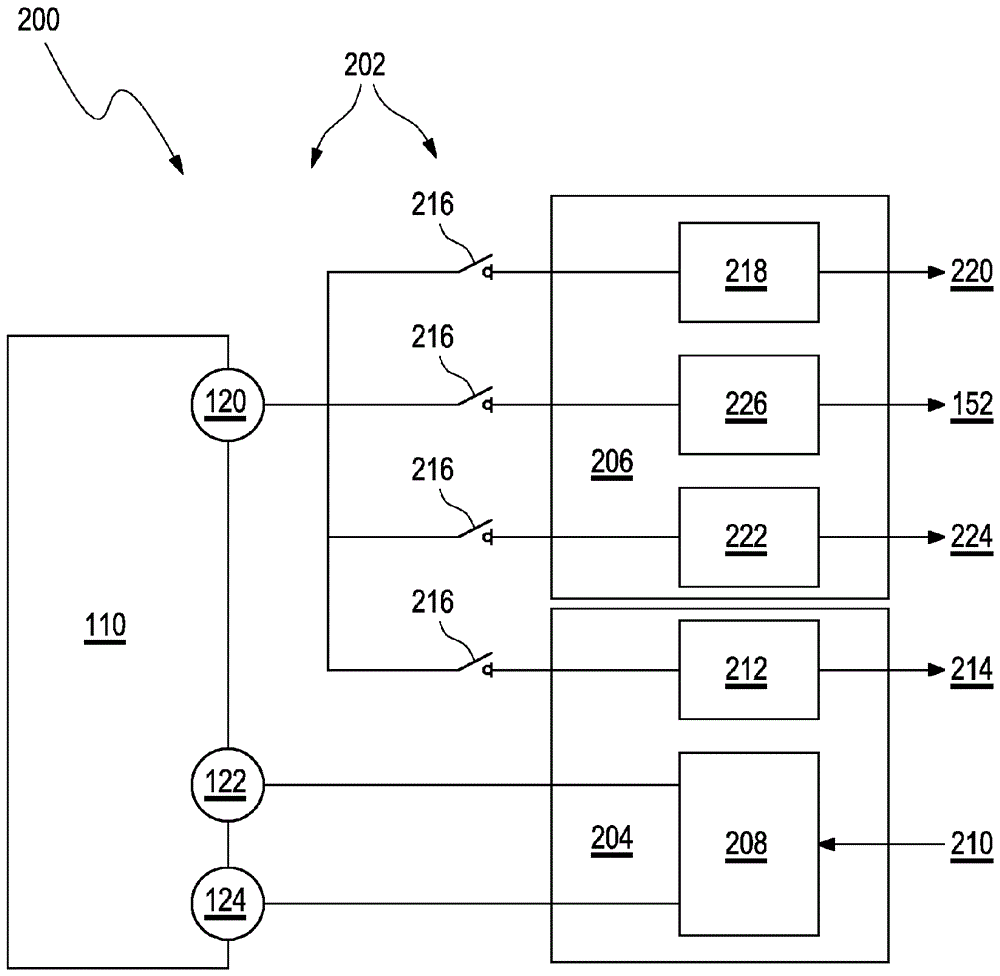
图7图示了系统200的示意性电路图,该系统200包括生物传感器110和电子单元202,其中电子单元202包括直流测量单元204和电势阶跃响应测量单元206。与其他可能的实施例相比,图7的电路包括更多的模拟电子元件,其允许减少微控制器上的负载,从而以减少的技术努力提供了电子单元202内的更快处理。
如图7所描绘的,直流测量单元204包括模拟控制器208,其可以如上所述地控制可以由输入210驱动并且驱动电极118(特别是工作电极120,参考电极122和对电极124)的恒电位仪114,特别是通过施加电势以测量原始电流i,并且另外通过施加电势阶跃150以便测量生物传感器110的体内导纳。此外,直流测量单元204包括葡萄糖电流测量单元212,其适于测量并提供dc输出214,该dc输出是原始电流i或与原始电流i有关的值,优选地,是如针对分析物葡萄糖所测量的电压转换的原始电流i。然而,也可以在dc输出214处提供其他种类的值。
如在图7的示例性实施例中进一步示出的,电子单元202还包括多个开关216(这里实际上描绘了四个开关216),其被配置为允许在直流测量单元204所包括的葡萄糖电流测量单元212与电势阶跃响应测量单元206所包括的一个或多个单元之间切换生物传感器110,特别是工作电极120的输出,尤其是除了原始电流i外还允许测量生物传感器110的导纳。
为此,电势阶跃响应测量单元206可以包括电荷计数器218,该电荷计数器218可以将与累积在工作电极120的膜132中的电荷c有关的值提供给电荷输出220。在图8中示出了被配置为用作电荷计数器218的优选示例电路。
此外,电势阶跃响应测量单元206可以包括峰值检测器222,该峰值检测器222可以将与在工作电极120的膜132中累积的电荷的峰值有关的信息提供给峰值信息输出224,其中该峰值信息可以优选地为:是最大电流imax或与此相关的值,特别是电压转换后的最大电流imax。在图9a至9c中示出了被配置为用作峰值检测器222的电路的三个不同示例性实施例。
根据如图7所描绘的示例性实施例,电势阶跃响应测量单元206可以另外包括快速采样块226,其可以被配置为允许对电流响应i(t)的过程152进行快速采样,以将电势阶跃150施加于生物传感器110。因此,在此,电流响应i(t)的过程152除了由电势阶跃响应测量单元206的其他两个单元218、222提供的电荷c和最大电流imax之外还可以提供可用的额外信息。除此之外,电势阶跃响应测量单元206可以包括用于处理由生物传感器110提供的输出的另外的单元,并且由此,特别是出于冗余的目的,获取附加信息或相同信息。
如上所述,图8示出了用于电荷确定的电路228的优选示例。如此处所图示,电路228包括三个连续的级230、232、234,其中每个级230、232、234具有运算放大器。在此,第一级230是电流—电压转换器,其在电阻r24之后作为输出在连接点236处提供电流响应i(t)的与电压相反的过程152。第二级232是差分放大器,而第三级234是积分单元,其被配置为在电路228的输出处为电荷c提供期望的值。
图9a至9c各自图示了电路238的优选示例,其特别适合于峰值确定。
如图9a所示,电路238包括三个连续的级240、242、244,其中每个级240、242、244具有运算放大器。在此,第一级240再次是电流—电压转换器,而第三级244再次是差分放大器。第二级242包括电容器c1和反向偏置的二极管d1的组合,其使进入的电荷被存储在电容器c1中,由于反向偏置的二极管d1而不能立即放电。结果,可以通过电容器c1和反向偏置二极管d1的组合来确定峰值,随后在第三级244中对该峰值进行放大。根据该特定实施例,电容器c1的最终放电只能在一段时间之后实现。仅在该时间段之后,才可以通过使用电路238的该特定实施例来确定另一个峰值。
因此,为了允许更快地重复测量,可以优选地使用如图9b和9c所示的用于峰值确定的修正电路238。这里,图9b的电路238包括第二级246,其具有二极管d2,电容器c2和开关sw1的组合,其中,如果需要,开关sw1可以用于使电容器d2放电。此外,图9c的电路238包括具有四个级240、250、248、244的布置,其允许改进的峰值确定。
如上所述,本方法还包括监测生物传感器110的故障安全操作。为此,可以使用至少两个,优选三个测量值的组合。特别是,以下值可能被认为与相应的技术部分和效应有关:
-生物传感器110的灵敏度s可以与膜132中的酶的活性,膜132中的催化剂和/或介体的量以及特别是通过工厂校准或通过初始校准获得的校准值有关;
-膜132的电阻rm一方面可能与膜132在体内的溶胀有关(溶胀时导致缓慢的反应),并且另一方面与膜132和电极材料的接触有关(在损失的情况下导致快速反应);以及
-工作电极120的电容c一方面可能与工作电极120处的催化剂和/或介体的量有关(在损失的情况下导致缓慢反应),并且另一方面与工作电极120和电极垫的接触损失(在损失的情况下导致快速反应)。
因此,关于生物传感器110的灵敏度s的行为的信息可能是不足的,因为它们可能是由于生物传感器110内的许多不同的变化所致。然而,通过将关于生物传感器110的灵敏度s的行为的信息与关于膜132的电阻rm和工作电极120的电容c的进一步信息进行组合,尽管如此,仍能够用于监测生物传感器110的故障安全操作,特别地根据下表。在本文中,通过体内校准生物传感器110的灵敏度s的可用性可以确定关于膜132的电阻rm和工作电极120的电容c的信息是否可以用于补偿或用在故障安全操作中。
如该表中所示,可以从以下中的至少一项选择关于对生物传感器110的灵敏度s,膜132的电阻rm和工作电极120的电容c中的至少一个的变化的观察的可能反应:
-自动的“灵敏度漂移补偿”;
-“无有效值”的指示;
-“重新校准”的建议;或
-“关闭”生物传感器110的请求。
参考数字列表
110生物传感器
112电路
114恒电位仪
116输出
118电极
120工作电极
122参考电极
124对电极
126基板
128印刷电路板
130阻焊剂
132膜
134酶
136分析物
138氧
140体液
150电势阶跃
152当前响应的过程i(t)
154指数衰减
156第一操作点
158第二操作点
160附加电荷q(t)的过程
162波特相位图中的曲线
164向较低频率增加
166向较高频率降低
168区别
170电阻变化
172施加电势阶跃获得的曲线
174通过施加交流电获得的曲线
200系统
202电子单元
204直流测量单元
206电势阶跃响应测量单元
208模拟控制器
210输入
212葡萄糖电流测量单元
214直流输出
216开关
218电荷计数器
220电荷输出
222峰值检测器
224峰值信息输出
226快速采样块
228用于电荷确定的电路
230级
232级
234级
236连接点
238用于峰值确定的电路
240级
242级
244级
246级
248级
250级
- 还没有人留言评论。精彩留言会获得点赞!