心脏标测和模型合并的方法与流程
相关申请的交叉引用
本申请要求以下专利申请的优先权:2017年8月1日提交的美国临时专利申请第62/539,740号,标题为“心脏标测和定向引导的方法”;2017年8月1日提交的美国临时专利申请第62/539,787号,标题为“心脏标测和定向引导的方法”;2017年8月1日提交的美国临时专利申请第62/539,802号,标题为“心脏标测和模型合并的方法”;和2018年7月30日提交的美国临时专利申请第62/711,777号,标题为“心脏标测系统、方法和包含基准标记物的试剂盒”,所有这些申请通过引用全文并入本文。
背景技术:
传导系统中的一些心脏缺陷导致心脏的异步收缩(心律失常),并且有时被称为传导障碍。结果,心脏没有泵送足够的血液,这可能最终导致心力衰竭。传导障碍有多种原因,包含年龄、心脏(肌肉)损伤、药物治疗和遗传。
室性期前收缩(pvc)是指始于心室某处异常或不正常的心脏搏动,而不是像正常窦性搏动那样始于心脏的上腔。pvc通常导致心输出量降低,因为心室在有机会完全充满血液之前收缩。pvc也可能引发室性心动过速(vt或v-tach)。
室性心动过速(vt或v-tach)是由心室中异常电信号引起的另一种心律失常障碍。在vt中,异常电信号导致心脏比正常搏动更快,通常超过每分钟100次,搏动从心室开始。vt通常发生在潜在心脏异常的人群中。vt有时会发生在结构正常的心脏中,并且在这些患者中,异常电信号的来源可能在心脏的多个位置。一个常见的位置是右心室流出道(rvot),其为血液从右心室流向肺部的路径。在心脏病发作的患者中,心脏病发作留下的疤痕会形成完整的心肌环境和使患者易患vt的疤痕。
传导障碍的其它常见原因包含左心室和/或右心室快速激活纤维、希氏-浦肯野系统或疤痕组织的缺陷。结果,左右心室可能不同步。这被称为左束支传导阻滞(lbbb)或右束支传导阻滞(rbbb)。
心脏再同步治疗(crt),也称为双心室起搏或多点心室起搏,是lbbb或rbbb情形中改善心脏功能的一种已知方法。crt包含使用起搏器同时起搏右心室(rv)和左心室(lv)。为了实现crt,除了常规rv心内膜导联(有或没有右心房(ra)导联)之外,还放置了冠状窦(cs)导联用于lv起搏。crt的基本目标是通过恢复扩张型心肌病患者的lv同步性和扩大的qrs周期(这主要是lbbb的结果)来改善lv的机械功能。
导管消融是vt和/或有症状pvc患者的首选治疗方法。消融的目标是心脏中发生pvc的位置或vt发作发生的位置。为了确定合适的消融位置,治疗医生可以首先使用电导联刺激提议的位置,以便确定提议位置处的消融是否将提供心脏的期望电激活模式刺激。
目前,确定导联的正确位置以获得最大的心脏同步或所需的电激活模式需要手术医生进行一定程度的猜测。
然而,目前的方法不允许在逐个患者的基础上确定电联线的最佳位置。进一步,如果当心脏在给定位置被刺激时没有实现期望的激活模式,则当前的方法不提供用于调节导联位置的定向引导以提供改进的激活模式。因此,在确定crt的电导联的正确位置和确定消融位置时,需要改进的引导。
技术实现要素:
各种实施例提供心脏标测和模型合并的方法,包含:基于三维(3d)心脏模型和在心脏的室性期前收缩(pvc)期间的pvc心电图(ecg)数据记录,生成心脏的pvc激活图;通过对电生理(ep)过程中收集的逐点接触数据进行三角化来生成所述心脏的3d内表面模型;将3d激活图和3d内表面模型合并以形成pvc激活表面模型;使用ep导管在第一起搏位置起搏心脏,第一起搏位置设置在pvc激活表面模型中识别的最早激活区域中。
各种实施例提供心脏标测的方法,包含:将心电图(ecg)设备的12个电极附接到患者的胸部;使用心电图(ecg)设备记录ecg数据;基于患者心脏的ecg数据、3d胸部模型和二维(2d)图像生成心脏的激活图,该pvc激活图包含最早激活的区域;基于激活模型中最早激活的区域和最早激活的预测区域的比较,确定3d胸部模型中包含的每个电极的实际位置和每个电极的理想位置之间的偏移;以及基于所确定的偏移来调整激活图。一些实施例包含将基准标记物应用于患者的身体(例如,胸部或躯干)以识别解剖位置,该标记物被配置为通过检测从图像数据中包含的基准标记物反射的光而在图像数据中被识别,从而可以生成患者特定的三维(3d)解剖模型,该模型通过将识别的解剖位置与从ct或mri扫描获得的成像中的相应解剖位置配准来将图像数据与患者的胸部的3d解剖模型合并。
附图说明
附图并入本文且构成本说明书的一部分,说明本发明的示例性实施例,并与上文给出的一般说明及下文给出的详细说明来解释本发明的特征。
图1是根据各种实施例的心脏的3d模型的示例。
图2a是根据各种实施例的心脏的电激活的3d模型的平面图。
图2b是根据各种实施例的心脏的电激活的3d模型的平面图。
图2c是根据各种实施例的同步性图的平面图。
图2d是根据各种实施例的同步性图的平面图。
图3是根据各种实施例的心脏成像系统的示意性表示。
图4a和图4b是根据各种实施例的心脏的电激活的3d模型的平面图。
图4c和图4d是根据各种实施例的同步性图的平面图。
图5是根据各种实施例的心脏成像系统的示意性表示。
图6是示出根据各种实施例的方法的流程图。
图7a是根据各种实施例的心脏的电激活的3d模型的lao和pa视图的示意性表示。
图7b是根据各种实施例的同步性图的lao和pa视图的示意性表示。
图8a是根据各种实施例的心脏的电激活的3d模型的lao和pa视图的示意性表示。
图8b是根据各种实施例的同步性图的lao和pa视图的示意性表示。
图9是根据各种实施例的外科成像系统的示意图。
图10是根据各种实施例的使用图9的系统的方法的流程图。
图11a是根据各种实施例的使用图9的系统的方法的流程图。
图11b示出了在图11a的方法期间生成的参考心脏图像的示例。
图11c和图11d示出了可以在图11a的方法期间生成的激活图。
图12是根据各种实施例的使用图9的系统的方法的流程图。
图13是根据各种实施例的心脏成像系统的系统框图。
图14a和图14b是根据各种实施例的患者的躯干上的电导联和基准标记物的3d图像。
具体实施方式
参考附图对各种实施例进行详细描述。在可能的情况下,在所有附图中,相同的附图标记将用于指代相同或相似的部件。对特定示例和实现的引用是为了说明的目的,并不旨在限制本发明或权利要求的范围。
心电图(ecg)在本文中被定义为(优选地非侵入性地)将心肌的实际电活动与心脏的测量或导出(电活动)相关联的任何方法。在经典心电图的情况下,体表电极之间的电位差与心脏的电活动相关。还可以通过其它方式(例如,通过所谓的icd(植入型心律转复除颤器)进行测量)获得导出的ecg。为了获得这样的功能图像,必须提供对电活动的运动的估计。
心脏不同步通过降低左心室(lv)机械性能,同时增加心肌耗氧量,对心脏功能产生有害影响。此外,心脏不同步可能导致lv重构。因此,心脏不同步加速了慢性充血性心力衰竭(chf)的进展,并且降低了患者的存活率。
在正常传导过程中,心脏激活开始于左心室(lv)和右心室(rv)心内膜中。特别地,电脉冲(即去极化波)基本上同时穿过左心室和右心室。束支传导阻滞(bbb)是一种沿电脉冲路径存在延迟或阻塞的情况。延迟或阻塞可能发生在向左心室或右心室发送电脉冲的路径上。
左bbb是向lv的电脉冲减慢的一种情况,是心脏不同步的主要原因中的一种。特别地,激活仅始于rv中,并且在到达lv心内膜之前通过隔膜进行。
起搏器是一种电子设备,大约有怀表的大小,可以感知内在的心律,并且在指示时提供电刺激。心脏起搏可以是暂时的,也可以是永久的。
永久起搏最常见的是通过经静脉将导联放置到心内膜(即右心房或心室)或心外膜(即通过冠状窦的lv表面)来完成,随后将它们连接到放置在锁骨下区域皮下的起搏发生器。然而,小型化起搏器已经被开发出来直接心脏表面移植或植入心脏。
心脏再同步治疗(crt)是一种提供双心室起搏的特殊起搏器治疗。crt是在使用或不使用植入型心律转复除颤器(icd)的情况下进行的,植入型心律转复除颤器是一种用于治疗和预防有室性心动过速(vt)或心室纤颤(vf)风险的患者的设备。
在该应用中,心脏中由起搏电极、微导管等电刺激(例如起搏)的区域可以互换地称为“起搏位置”或“刺激位置”。
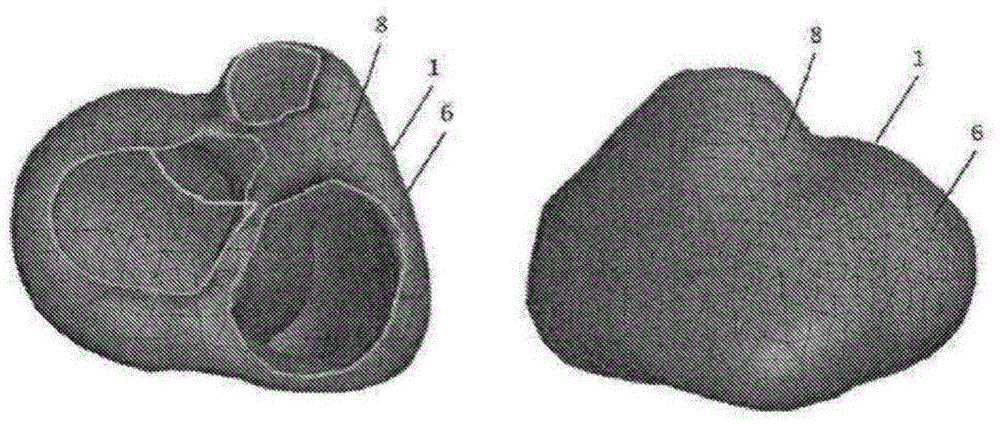
图1示出了从两个不同方向观察到的心脏1的三维(3d)模型。3d模型包含代表心脏外表面的网状物6,这里是心肌表面。在这个示例中,模型还可以包含隔膜壁。网状物6具有多个节点8。在这个示例中,网状物是三角形网状物,其中心脏的表面由相邻的三角形近似。
图2a-2d是心脏的3d模型4,示出了心脏1从各种单一刺激位置10的初始电激活。图2a-2c示出了具有隔膜壁2的心肌的心室表面。通常,3d模型4可以包含代表心脏的心室表面的网状物6,这里是如图1中所示的具有隔膜壁的心室心肌的外表面。网状物6具有多个节点8。在所示示例中,心脏1在刺激位置10处被电刺激。在刺激位置10处进行电刺激时,电信号将穿过心脏组织。因此,心脏的不同部分将在不同的时间被激活。心脏上的每个位置相对于初始刺激都有特定的延迟。每个节点8具有与其相关联的值,该值代表在刺激位置10处刺激心脏1和在相应节点8处激活心脏之间的时间延迟。共享相同延迟时间的位置由图2a-2d中的等时线12连接。在这个应用中,等时线被定义为在3d心脏表面模型上绘制的线,该线连接模型上激活同时发生或到达的点。在本示例中,穿过心脏表面的节点的延迟时间也通过不同的渲染阴影来显示。竖条指示与相应颜色相关联的时间延迟(毫秒)。应当理解的是,刺激位置10可以是心脏1的内在激活位置。
图3是系统100的系统框图,用于提供心脏组织的电激活的同步性的表示。系统100包含处理单元102和存储器104。
3d电激活模型4可以通过在系统100中组合心电图和医学成像数据来获得。这个数据可以存储在存储器104中。处理单元102可以连接到心电图系统106和医学成像系统108,用于检索数据并且将相应的数据存储在存储器104中。处理单元102可以应用能够从12导联ecg确定心脏激活的心电图成像(ecgi)方法,以确定心脏的电激活的3d模型4。在ecgi方法中,为了计算心脏等时线的位置,ecg信号可以与心脏、肺和/或躯干的患者特定的3d解剖模型相结合。患者特定的3d解剖模型可以从自医学成像系统108接收的磁共振图像(mri)或计算机断层摄影(ct)图像中获得。可替代地或附加地,可以从包含多个3d解剖模型的数据库中选择并且可选地修改显示与患者最接近一致性的3d解剖模型。所选择的并且可选地修改的3d解剖模型可以用作患者特定的3d解剖模型。
3d模型4还可以包含进一步的信息。在图2a中所示的示例中,3d模型4可以包含心肌上的心脏血管14和/或静脉。这个信息可以被添加到3d模型4中,因为节点被指示为与这样的血管相关联。血管14然后可以被识别并且可选地显示在3d模型4中。可选地,处理单元102可以包含第一识别单元110,该第一识别单元被布置用于从患者的心脏的3d解剖模型中自动检索代表这种血管的位置的信息。处理单元102然后可以自动将这个信息插入3d模型4中。
3d模型4还可以包含关于疤痕组织的信息。疤痕组织位置可以从延迟增强磁共振成像(mri)图像中获得,并且添加到3d模型4中。疤痕组织可以在3d模型4中通过降低电信号的传播速度来模拟。疤痕组织也可以通过出售心脏壁中存在疤痕组织的区域从一个节点到另一节点的过渡到非常慢或非过渡来解释。可选地,处理单元102可以包含第二识别单元112,该第二识别单元被配置和布置用于从患者特定的心脏的3d解剖模型自动检索代表这种疤痕组织的位置的信息。处理单元102可以自动将这个信息插入3d模型4中。
在各种实施例中,获得的3d模型4可以用于获得关于心脏的电激活的进一步的信息。例如,可以确定从一个节点到另一节点的激活的时间延迟。这可以用于基于3d模型4生成由网状物6的其它节点处的初始刺激产生的其它视图。为了实现这一点,处理单元102可以包含插入单元114,其可以采用3d模型4并且将某个节点定义为刺激位置。应当理解的是,3d模型4可以假设在预定节点处刺激。出于计算目的,插入单元114可以移除预定节点处的刺激。
图2b示出了由另一刺激位置10′处的初始刺激产生的3d模型4的示例。应当理解的是,可以为网状物6的每个节点生成由网状物6的其它节点处的初始刺激产生的视图。
由特定节点处的刺激产生的整个心脏1的特定电激活序列可以概括为单个参数,即心脏激活同步性。心脏激活同步性提供了整个心脏如何同步地被激活的指示。对于普通情况,心脏的更同步的激活被认为是有益的。本示例中心脏激活同步性的测量是心脏的去极化(dep)时间的标准偏差(std)。因此,心脏激活同步性提供了作为相应节点处刺激的结果的整个心脏的激活的同步性的指示。处理单元102可以包含配置为确定心脏激活同步性的同步性确定单元116。
在各种实施例中,心脏激活同步性可以针对每个节点处的刺激单独确定。因此,可以为网状物的每个节点提供心脏激活同步性的测量。处理单元102可以包含同步性图生成单元118,该同步性图生成单元配置为基于由同步性确定单元116对每个节点的心脏激活同步性的计算来生成同步性图。处理单元102可以与输出单元120连接,该输出单元布置为向用户输出同步性图15和/或替代数据。输出单元可以是显示单元、打印机、消息单元等。
图2c示出了心脏同步性图15的示例。在图2c所示的示例中,为图15中的每个节点指示心脏激活同步性。在这个示例中,可以通过提供假色和/或等同步线16来显示该指示。等同步线16连接具有相同心脏激活同步性的节点。心脏同步性图15提供了单一的3d概观,显示了心脏上导致良好心脏激活同步性的位置,以及如果心脏在这些位置处被刺激,则显示了心脏上导致较差心脏激活同步性的位置。在图2c所示的示例中,可以看出原始刺激位置10没有提供特别好的同步,心脏激活同步性值大约为心脏去极化时间的45ms标准偏差。最不利的刺激位置(这里是心脏激活同步性值最高的位置)用s-指示。在这个示例中,出现最低心脏激活同步性值的最有利的刺激位置用s+指示。在一些情况下,如图2d中所示,当从另一方向看同步性图15时,最有利的刺激位置s+可以被最佳地看到。
心脏激活同步性测量的另一示例是去极化时间的范围(最大去极化时间-最小去极化时间)。去极化时间的范围可以根据周期长度进行校正。心脏激活同步性测量的另一示例是仅左心室(lv)去极化时间的标准偏差。心脏激活同步性测量的另一示例是刺激和隔膜激活之间的延迟。心脏激活同步性测量的另一示例是av延迟。心脏激活同步性测量的另一示例是vv延迟。应当理解的是,心脏激活同步性的测量可以根据手头的任务和/或根据患者经历的特定状况或异常来选择。
图4a示出了第二示例,其中定义了第二刺激位置18。使用3d模型4以及在第一刺激位置10和第二刺激位置18的同时刺激来计算心脏的电激活。在这个示例中,出于计算目的,插入单元114不移除第一位置8处的刺激。图4a示出了计算出的心脏1的所得电激活。在图4a所示的示例中,由于添加了第二刺激位置18,总激活时间缩短。在这个示例中,第一刺激位置10表示心脏的内在激活的位置,或者第一选择的刺激位置,或者由心脏内已经存在的起搏器导联产生的刺激。
图4b示出了由在第二刺激位置18′处的初始刺激与第一刺激位置10处的刺激同时产生的心脏的电激活的示例。应当理解的是,可以为网状物6的每个节点生成由网状物6的第二节点处的初始刺激(和与第一刺激位置10相关联的第一节点处的刺激同时发生)产生的视图。
在图4c和图4d中所示的示例中,整个心脏的特定电激活序列被组合并且示出为心脏激活同步性。在这个示例中,电激活序列包含在第二刺激位置18处的刺激(同时在第一刺激位置10处发生刺激)。心脏激活同步性再次提供了如何同步地激活整个心脏的指示。在一些实施例中,心脏激活同步性可以针对每个节点的刺激单独确定(同时在第一刺激位置10和第二刺激位置18发生刺激)。这为充当网状物6的第三刺激位置的每个节点提供了心脏激活同步性的测量。
图4c示出了心脏同步性图的示例,其示出了如果在第一刺激位置10和第二刺激位置18处同时刺激,在这些位置刺激心脏,导致良好的心脏激活同步性的心脏上的位置,以及导致不良的心脏激活同步性的心脏上的位置。在图4c所示的示例中,当同时刺激第一刺激位置10和第二刺激位置18时,最不利的第三刺激位置s-具有大约41ms的最高心脏激活同步性值。在这个示例中,当同时刺激第一刺激位置10和第二刺激位置18时,最有利的第三刺激位置s+具有最低的心脏激活同步性值。在一些情况下,当从另一方向看同步性图15时,最有利的刺激位置s+可以被最佳地看到,如图4d中所示。
图5是用于提供同步性图的系统100的数据流表示。图6示出了一种根据一个实施例使用图3和图5中示出的系统100确定心脏同步性的方法。参考图3和图5,系统100包含从硬件模块接收数据的处理单元102。可选地,处理单元102可以从心电图系统106接收ecg数据。处理单元可以从医学成像系统108接收患者特定的解剖数据。
处理单元102可以从定位系统109接收关于ecg导联相对于患者的解剖结构的位置的信息,诸如包含电极的患者胸部的3d图像。3d图像和躯干模型可以对齐,并且可以调整模型中电极的位置以与3d图像中电极的位置一致。ecg电极相对于心脏的位置的知识,特别是v1-6心前区电极的知识,对于准确计算pvc的发作位置可能特别重要。
在一些实施例中,电极相对于其假设的理想位置的偏移,特别是v1-6电极的偏移,可以基于检测到的正常心脏搏动的ecg信号与理想ecg正常心脏搏动信号的比较来确定。例如,可以基于检测到的ecg信号将如何受到电极相对于理想电极位置的位置变化的影响来确定偏移。特别地,记录的ecg数据可以用于确定正常搏动的刺激发作位置。因为sa结点中的正常发作位置是已知的,所以可以将所确定的偏移位置与这个已知的发作位置进行比较,并且可以基于电极之间的变化来推断它们的偏移。因此,可以在不生成3d图的情况下确定电极偏移。
根据患者特定的解剖数据,处理单元102可以确定同步性图15。处理单元102可以包含以下单元,并且可以执行图6中所示和下面描述的方法200的操作,以生成同步性图。在方法200中,处理单元102可以使用患者的胸腔的患者特定的3d解剖模型以及胸腔内心脏的尺寸、方位和位置。可以在框201中选择这样的模型,以供处理单元102进一步使用。处理器可以在确定框202中确定这样的模型是否已经可用。如果模型还不可用(即,确定框202=n),则在确定框204中,检索单元103可以检查该患者的合适的解剖模型是否存在于数据库117中。
如果数据库117中没有合适的患者特定的解剖模型可用(即,确定框202=n),则检索单元103可以在框208中基于接收到的患者特定的解剖3d图像数据生成患者特定的解剖模型。
如果数据库117中有合适的患者特定的解剖模型可用(即,确定框202=y),则在框206中,检索单元103从数据库117中检索合适的解剖模型。同样在框206中,检索单元103可以将来自数据库的解剖模型适配于患者的3d图像,以便将选择的解剖模型转换成(准)患者特定的3d解剖模型。可选地,患者特定的3d模型还可以包含患者体内其它结构的尺寸、方位和/或位置,诸如肺部和/或其它器官。患者特定的3d模型可以是体积导体模型。
如果患者模型可用(即,确定框202=y),或者使用在框208中创建的患者模型或在框206中适配于该患者的存储模型、ecg导联的位置以及患者特定的模型,则导联定位器模块105可以确定患者特定3d模型中ecg导联的相应位置,以在框210中提供增强的患者特定模型。
在确定框212中,当患者特定的解剖模型和/或增强的患者特定模型可用时,确定代表内在或刺激激活的ecg数据是否可用。如果来自一个或多个已经存在的起搏器导联的内在激活数据或起搏刺激可用(即,确定框212=y),则在框214中,激活单元107可以基于患者特定的模型和ecg数据生成示出患者的心脏的当前激活的3d电模型。
如果没有关于内在或刺激激活的ecg数据可用(即,确定框212=n),则在框216中,虚拟刺激单元111可以基于先前确定的和/或假设的节点之间的转变速度,将初始虚拟刺激添加到心脏的电模型。例如,假设的转变速度可以是0.8ms。如上所述,电模型可以包含动脉、静脉和/或疤痕组织。在框218中,可以生成患者的心脏的虚拟激活的3d电模型。
如上所述,在框222中,同步性确定单元116可以从患者的心脏的内在、刺激或虚拟激活的3d电模型中生成同步性图15。基于同步性图,处理单元102可以在确定框230中确定人工刺激位置或虚拟刺激位置是否导致最佳激活和同步性。如果是(即,确定框230=y),则处理单元可以在框234中计算患者心脏的最佳刺激位置。
如果在框230中确定没有达到最佳同步性(即,确定框230=n),则方法200前进到确定框232,其中确定是否需要或应该添加额外的虚拟刺激位置,或者虚拟刺激位置是否应该相对于定时参数移动或改变。这种确定可以由临床医生、处理单元或临床医生基于处理单元在显示器上呈现的信息或建议来做出。
如果确定需要额外的虚拟导联(即,确定框232=y),则在框224中,可以根据所确定的同步性添加虚拟起搏位置。如果确定不需要额外的虚拟导联并且虚拟刺激位置应该被移动或改变(即,确定框232=n),则可以在框225中相应地调整人工或虚拟刺激位置。
在框226中,可以生成新的激活。然后,在框222中可以重新计算同步性,并且可以重复该过程,直到在确定框230中确定实现期望的激活。
系统100还可以相对于其当前刺激参数虚拟地调整当前人工刺激位置,即起搏器导联位置,以达到最佳同步性。
系统100也可以用于评估多重刺激。例如,多重刺激可以是内在激活和刺激激活(起搏)的组合。例如,多重刺激可以是多重刺激激活(起搏)。用户或处理单元102有可能确定232是否需要附加刺激位置,诸如附加起搏器导联。
如果期望附加刺激位置,可以通过插入单元114插入附加刺激位置。那么在框226中可以再次确定具有原始刺激位置和添加的虚拟刺激位置的情况的激活,并且在框222中可以重新计算同步性。基于同步性图,处理单元102可以在确定框230中确定附加虚拟刺激位置是否导致最佳同步性。如果没有达到最佳同步性,则方法200前进到框232,其中确定是否应该相对于定时参数添加额外的虚拟刺激位置,或者是否应该移动或移除虚拟刺激位置。在这种情况下,该过程可以重复一次或多次。
基于患者特定的心脏激活模型,可以生成心脏同步性模型。同步性模型可以是包含如上所述的等同步线的3d心脏表面模型,其中等同步线代表心脏的激活同步性。这种同步性可以基于特定的激活条件,诸如起搏器的导联位置处的右心室激活。
作为示例,可以生成同步性模型,并且可以在以下框中确定内在lbbb模式的激活等时线。
1a)心脏、肺部和胸腔的患者特定的解剖3d模型可以例如基于患者的mri或ct图像来生成,或者例如使用3d照相机从取自适配患者尺寸的数据库的模型中导出。解剖3d模型可以包含心脏的3d表面模型、肺部的3d表面模型和胸腔的3d表面模型。3d表面模型可以是通过多个多边形(诸如三角形)的网状物对心脏的实际表面的接近近似,这些多边形在它们的拐角处连接。互连的角形成网状物的节点。
1b)可以测量ecg,例如12导联ecg。可以记录ecg设备的电极在胸腔上的准确位置。电极在3d解剖模型中的位置用于估计通过心脏组织的电活动的分布、波动和/或移动。记录导联或ecg设备的准确位置可以输入胸腔的解剖3d表示中。
1c)可选地,疤痕组织可以并入到心脏的解剖3d表示中。疤痕组织的存在和位置可以从延迟增强mri图像中导出。
1d)ecg设备每条记录导联的测量值可能与心脏和躯干的几何形状有关。使用相反的过程,可以确定内在的激活。通过心脏组织的电活动的分布、波动和/或移动可以基于心肌距离函数、最快路径算法、最短路径算法和/或快速行进算法。
2)一旦确定了内在lbbb模式的激活等时线,刺激部位可以被添加到心脏上每个节点的内在激活中,并且可以根据结果计算心脏的期望同步性。“节点”是指解剖3d心脏模型所基于的三角形的交点。
上述方法也可以用于确定放置心脏起搏器电极的最佳位置。为了确定最佳起搏部位,可以计算同步性图。内在激活图,结合确定的刺激点,可以应用于新的心脏等时线定位图。
图7a示出了心脏的lbbb激活模式的3d同步性图的示例。在左侧,图7a示出了左前斜(loa)视图。在右侧,图7a示出了后前(pa)视图。图7b示出了图7a的心脏的同步性图。在左侧,图7b示出了lao视图,以及在右侧,图7b示出了pa视图。
图7b的同步性图示出了由于一个额外的刺激位置与心脏的内在激活相结合而导致的心脏的去极化时间的标准偏差。从图7b可以看出,在基底左自由壁20上选择附加的刺激位置最大程度地降低了心脏的去极化时间的标准偏差。因此,在这个示例中,基底左自由壁上的区域可以被选为起搏器电极的最佳位置。
可以生成心脏的电激活的更新的3d模型,包含内在激活(同时在基底左自由壁上的区域中发生刺激)。然后,这个更新的3d图可以用于生成新的同步性图,以检查rv中的导联位置。通过这样做,临床医生可以确定导联是否也应该刺激,而不仅仅是感知。临床医生也可以确定是否应该移动导联。临床医生也可以确定是否应该添加额外的刺激导联。
临床医生也可以确定内在av传导是否有益。内在av传导将通常传导至右束,之后需要通过刺激lv来激活lv。这也可以反过来,即rbbb等待lv激活,并且在最佳位置刺激rv自由壁。通过对左心室和右心室重复该过程,心脏起搏的准确位置和定时可以被微调。
当内在激活信号由于心脏的严重损伤而不可用时,整个过程可以仅使用模拟(起搏器)刺激而不是内在激活来执行。在这种情况下,上面的框1b和框1d可以省略。然后整个过程将基于人工激活。
图8a示出了lbbb模式的左刺激激活的示例。在左侧,图8a示出了lao视图,在右侧示出了pa视图。图8b示出了图8a中所示的心脏的同步性图15的示例。在左侧,图8b示出了lao视图,在右侧示出了pa视图。图8b的同步性图示出了由于一个额外的刺激位置与心脏的左刺激激活相结合而导致的心脏的去极化时间的标准偏差。从图8b可以看出,在基底左自由壁20上的区域中选择附加的刺激位置最大程度地降低了心脏的去极化时间的标准偏差。因此,在这个示例中,基底左自由壁上的区域可以被选为起搏器电极的最佳位置。可以生成心脏的电激活的更新的3d模型,包含内在激活(同时在基底左自由壁上的区域中发生刺激)。
上述整个过程可以在植入过程中进行,以找到最佳起搏部位。
图9是根据各种实施例的心脏成像系统的框图。图10是示出根据各种实施例的使用图9的系统植入电极的方法300的流程图。参考图9和图10,在框301中,可以由系统的处理单元400生成患者的心脏的3d激活图。特别地,患者的胸部和/或心脏的3d模型可以由ct或mri设备108生成,患者的ecg数据可以由ecg记录器106记录,并且患者的躯干的3d图像可以由3d照相机109生成。这个数据可以被提供给处理单元400的激活图生成器320。ecg数据可以包含从患者处接收的外在和/或内在刺激信号。
在框302中,可以识别一个或多个预测的最佳起搏位置的位置。例如,激活图可以被提供给同步性确定单元322以确定心脏同步性。然后,这个数据可以由虚拟刺激点生成器324使用,以识别一个或多个建议的起搏位置。
在crt患者中,起搏位置可以位于心脏不同步发生的位置,从而预测其刺激以生成最大量的心脏激活和/或同步。起搏位置可以基于例如lv和rv激活时间之间的差异、lv和/或rv的最早和/或最晚激活、检测到的去极化波阻塞等。
在框304中,可以显示一个或多个虚拟起搏位置。例如,一个或多个起搏位置可以作为虚拟起搏位置添加到激活图中。可选地,由实时成像设备328(诸如荧光镜、射线照相设备、x-光计算机断层摄影(ct)设备等)生成的激活图和图像可以被提供给图像积分器326。图像积分器326可以比较和/或对准激活图和实时图像。基于比较和/或对准,包含刺激点的激活图可以覆盖在实时图像上。在其它实施例中,虚拟刺激点可以被添加到实时图像,以产生修改的实时图像,该修改的实时图像可以被提供给显示器330用于渲染。
在一些实施例中,除了显示激活图之外,框304可以包含向显示器330提供示出心脏的内部结构的参考图像。附加图像可以基于2d心脏图像,诸如用于生成激活图的mri或ct图像之一。这种2d图像可以被修改以示出附加特征。例如,可以修改2d心脏图像以识别包含在最早激活的区域中的结构和/或包含在激活图中的起搏位置。因此,当使用实时成像设备328定位电极时,可以参照参考图像。下面参考图11b详细讨论参考图像。
在框306中,一个或多个起搏电极可以位于所识别的虚拟刺激点。医生可以使用显示器330中所示的参考图像和/或激活图来将起搏电极与虚拟刺激点对准。然后可以对心脏进行起搏,并且可以收集得到的ecg数据。
在框308中,收集的ecg数据可用于生成更新的激活图,以示出刺激的效果。在一些实施例中,ecg数据可用于识别起搏位置,起搏位置可显示在激活图上。由于起搏电极设置在起搏位置处,起搏位置可以代表起搏电极的当前位置。因此,可以在导航到起搏位置时显示起搏电极位置。因此,可能不需要附加的标测应用来确定起搏电极的位置,从而显著降低起搏过程的成本。
在确定框310中,可以确定起搏电极是否设置在合适的心脏位置。例如,在crt患者中,可以确定刺激是否是足够量的同步性和/或恢复了期望量的心脏功能。如果是这样(即,确定框310=是),则电极可以在框312中缝合到位。如果不是(即,确定框310=否),则可以基于在框308中生成的更新的激活图,在框302中生成新的心脏刺激点。例如,可以将一个或多个虚拟刺激点移动到新的位置,和/或可以添加附加的虚拟刺激点。然后,在框304中,虚拟刺激点可以被添加到实时心脏图像中。在一些实施例中,也可以调节刺激lv和rv的起搏间隔。
对于pvc和/或vt患者,确定框310可以包含使用更新的激活图来确定刺激是否复制了患者的pvc。换句话说,确定框310可以包含确定刺激点是否是合适的消融点。如果是这样(即,确定框310=是),则在框312中可以在刺激点处消融心脏。如果不是(即,确定框310=否),则在框302中可以基于在先前刺激期间收集的ecg数据来生成新的刺激点。
在一些实施例中,激活图可用于确定crt是否适合于患者。例如,如果在优化放置起搏器或起搏导联后,患者的心脏输出没有被预测为达到可接受的水平,则可以确定crt不适合于患者。
在各种实施例中,可以使用的工作站包含处理单元400、显示器330以及到其它硬件的有线或无线连接,其它硬件诸如ct/mri设备108、3d照相机109、ecg记录器106和/或实时成像设备328。工作站也可以包含用于控制手术设备的接口,诸如导管植入设备或其它机器人手术设备。
图11a是示出根据各种实施例的使用图9的系统的心脏成像方法500的流程图。图11b和图11c示出了可以在图11a的方法期间生成的激活图。
消融是对pvc和/或vt的有效治疗。然而,一些患者可能会经历阵发性vt和/或pvc,在这种情况下,当患者在进行导管插入术过程中在医院进行测试或在电生理学测试过程中在电生理学设施进行测试时,事件或症状可能不会发生。为了确保为表现出阵发性vt和/或pvc的症状的患者获得足够的ecg数据,可以使用便携式ecg记录设备106(诸如holter型设备)来记录ecg数据。
参考图9和图11a,处理单元400可以生成pvc激活图,其示出了在框501中pvc过程中的电激活。例如,pvc激活图可以识别pvc过程中最早激活的区域。pvc激活图可以基于pvc过程中收集的ecg数据,以及如上所述的来自患者的ct和/或mri数据。特别地,数据可以被提供给处理单元400的激活图生成器320。在一些实施例中,来自单个pvc搏动的ecg数据可能足以生成pvc激活图。pvc激活图可以识别心脏中pvc心脏搏动过程中最早激活的区域。
在一些实施例中,该方法可以可选地包含框502。在框502中,处理器400可用于生成示出心脏的内部结构的参考图像。激活图和参考图像可以同时或在不同时间显示在同一显示器上或不同显示器上。换句话说,框501和框502可以包含向显示器330提供生成的激活图和参考图像。
参考图像可以基于心脏图像,诸如用于生成激活图的2dmri或ct图像之一。除了心脏图像中所示的内部心脏结构之外,参考图像还可以包含附加特征。例如,为了形成参考图像,可以修改心脏图像以示出包含在最早激活区域中的结构和/或包含在激活图中的虚拟起搏位置。
在一些实施例中,处理单元400可以被配置为选择最接近由实时成像设备328提供的图像的心脏图像,如框503中所讨论的。在其它实施例中,参考图像可以基于手动选择的心脏图像。因此,当使用实时成像设备328定位电极时,可以参照参考心脏图像。
图11b示出了pvc/vt患者的参考图像的示例。参考图11b,参考图像可以识别最早激活区域340(例如,可以识别包含在最早激活区域中的2d图像中的心脏结构)。参考图像还可以包含起搏位置342。起搏位置342可以是由刺激点生成器324生成的虚拟起搏位置。在一些实施例中,起搏位置342可以是实际的起搏/导管位置。例如,当心脏受起搏时,处理单元400可以分析所得ecg数据以识别相应的起搏位置342,从而识别起搏导管、起搏电极等的当前位置。
在一些实施例中,如果起搏位置342不提供期望的心脏响应(诸如模拟pvc或期望的心脏同步性),则引导信息生成器332可以提供引导信息(诸如示出电极应该移动的方向的向量344)。
在框503中,该方法包含执行电生理(ep)过程,该过程包含将导管插入心脏以分析电活动并且确定心律失常位于何处。在pvc患者中,ep过程的目标可能是在产生与患者的症状pvc非常接近的pvc的位置处起搏心脏。例如,ep过程可以包含在最早激活区域的位置使用导管对心脏起搏。在ep过程中,还可以插入附加的电极来内部检测ecg数据。例如,起搏数据可以通过在起搏期间记录ecg数据来记录。
ep过程还可以包含标测患者心脏的内部特征,诸如最早激活的pvc区域内和周围的特征。在一些实施例中,ep过程可以包含通过将心脏的不同点与导管接触来在逐点的基础上生成3d三角化内表面模型。执行ep过程的合适系统包含ensiteprecision标测系统和carto3标测系统。这种系统能够跟踪导管在体内的3d位置,并且在每次导管和心脏组织接触时记录心脏内表面的位置。这些3d位置的收集与心脏搏动同步,从而确保当心脏处于与其它记录点相同的状态时(即,与收缩相反的全容积),收集每个点。除了建立模型,相对ecg激活时间可以被记录并且标测到心脏模型上。
如上所述,框503还可以包含使用实时成像设备328生成心脏的实时图像。在一些实施例中,可以在生成实时图像之后执行框502,使得参考图像可以基于近似于实时图像的心脏图像。
ep过程还可以包含将导管定位成与最早激活区域中的位置接触。在框504中,导管然后可用于通过电刺激来起搏心脏。起搏的目标可能是在产生与患者症状pvc非常接近的pvc的位置处起搏心脏。在ep过程中,还可以插入附加的电极来内部检测ecg数据。例如,起搏数据可以通过在起搏期间记录ecg数据来记录。
尽管ep过程和起搏在图11a中显示为单独的框,但是本公开不限于此。例如,ep过程和起搏都可以在单个过程中发生。
在一些实施例中,框504可以包含使用收集的ecg数据来生成更新的激活图,以显示刺激的效果。在一些实施例中,ecg数据可用于识别起搏位置,起搏位置可显示在激活图上。由于起搏电极设置在起搏位置处,起搏位置可以代表起搏电极的当前位置。因此,可以在导航到起搏位置时显示起搏电极位置。因此,可能不需要附加的标测应用来确定起搏电极的位置,从而显著降低起搏过程的成本。
在确定框506中,可以分析起搏数据,以确定起搏电极是否设置在合适的心脏位置,用于实现期望的心脏响应。例如,起搏数据可以与用于生成激活图的ecg数据进行比较。在pvc中,可对起搏进行分析,以确定起搏数据是否与患者的pvc呈现期间记录的pvcecg数据充分匹配。换句话说,对起搏数据进行分析,以确定导管是否已经识别出可以消融以减轻患者的pvc和/或vt的位置。在crt患者中,可以分析起搏数据以确定是否已经实现了足够的心脏同步和/或激活。
如果确定已经实现了期望的心脏响应(即,确定框506=是),则在框510中,导管可以用于在pvc患者的消融位置处消融心脏。在crt患者中,在框510中,起搏电极和/或微型起搏器可以缝合到位。
如果确定没有实现期望的心脏响应(即,确定框506=否),则在框508中,处理单元400可以使用起搏数据、pvcecg数据和/或导管位置数据来识别导管应该移动的方向,以便更好地模拟患者的pvc。例如,起搏数据和导管位置数据可以被提供给处理单元400的引导信息生成器332。引导信息生成器332可以包含算法,该算法被配置为将起搏数据和/或位置数据与pvcecg数据进行比较,以便确定导管应该移动的方向和/或距离,从而正确模拟患者的pvc。这个信息可以使用图标和/或文本来呈现。在crt患者中,可以分析起搏数据以确定是否应该移动一个或多个起搏电极来实现期望的心脏响应。
引导信息生成器332可以向激活图生成器320提供引导信息。激活图生成器320可以基于由引导信息生成器332提供的引导信息来更新激活图,如下面参考图11b和图11c所讨论的。在其它实施例中,引导信息生成器332可以向图像积分器326提供引导信息,用于与由实时成像设备328提供的图像集成。在其它实施例中,引导信息可以被提供给ep系统,并显示在由此生成的ep图上。
在框508中显示了引导信息之后,该方法返回到框504以再次起搏心脏。然而,在一些实施例中,该方法可以返回到框503,执行ep过程。因此,在pvc/vt患者中,可以刺激多个位置,直到起搏产生精确复制患者的pvc的pvc,并且识别相应的消融位置。在crt患者中,可以调整刺激位置,直到达到期望的心脏响应。此外,可以向医生提供引导信息,以帮助识别刺激点。
在一些实施例中,框503可以包含使用图9的标测系统在心脏起搏期间外部记录ecg数据。进一步,框504还可以包含使用标测系统基于记录的ecg数据来确定心脏内的起搏位置。例如,起搏位置可以通过在心脏起搏期间识别最早激活的区域来确定。进一步,框508还可以包含将起搏位置添加到pvc激活图中。这样,至少导管的起搏电极的位置可以在pvc激活图上识别,因为起搏电极在起搏期间设置在起搏位置处。
参考图11c,更新的激活图可以包含第一点700,其示出了对应于最近起搏位置和/或导管位置的起搏/刺激位置。更新的激活图还可以包含最早激活的区域710,其可以是消融的目标区域。在一些实施例中,激活图可以包含向量712,其示出了用于将导管移动到最早激活区域710中的新刺激位置的方向和距离建议。
在一些实施例中,如图11d中所示,更新的激活图可以包含显示先前起搏位置的一个或多个第三点704。例如,更新的激活图可以包含代表第一刺激位置的第一点700、代表第二刺激位置的第二点702、代表第三(例如,当前)刺激位置的第三点704以及代表建议刺激位置的第四点706。在一些实施例中,可以基于来自每个起搏的ecg数据来重新计算最早激活区域710。
点700-706可以是不同的颜色、阴影和/或形状,以提供时序信息。例如,点700-706可以阴影化以表示创建点的顺序,从而识别导管的路径。例如,点700-706可以逐渐变亮或变暗。在一些实施例中,第四点706可以比其它点亮。一旦起搏发生在由第四点706表示的位置,点700-706中的每一个都可以变暗,或者被修改以指示这些点表示先前的起搏位置。
在其它实施例中,点可以通过线708连接,以表示在ep过程中导管的路径。在一些实施例中,除了第四点706之外,或者代替第四点,图11b的向量712也可以应用于图11c的激活图。
图12是示出根据各种实施例的图像集成方法800的框图。方法800可以使用图9的系统来执行。参考图9和图12,在框801中,如上所述,可以使用处理器400生成患者的心脏的pvc激活图。
在框802中,可以通过3d三角化在逐点的基础上生成心脏的3d内表面模型。特别地,可以通过心脏的内表面和ep导管之间的点接触,在逐点的基础上标测患者的心脏的内表面特征,诸如心室表面特征。执行ep过程的合适系统包含ensiteprecision标测系统和carto3标测系统。这种系统能够跟踪导管在体内的3d位置,并且在每次导管和心脏组织接触时记录心脏表面的位置。这种逐点接触数据的收集与心脏搏动同步,从而确保当心脏处于与其它记录的接触点相同的状态时(即,心脏的体积基本相同),收集每个点。例如,当进行点接触时,心脏可能处于完全容积或完全收缩。
在常规ep系统中,内表面模型与采集的mri或ct数据集合并以形成心脏模型。特别地,合并可以包含调整内表面模型数据以更准确地表示心脏的真实几何形状,以及显示在ep过程中未被标测的附加的心脏特征。这个过程包含计算在ct或mr中哪个点的大小代表组织对血液。然后可以进行调整以更好地表示心脏几何形状。
ep过程还可以包含在逐点接触期间记录相对ecg数据(例如,激活时间)。在一些实施例中,这个ecg数据可以被标测到内表面模型上。这可能包含标测正常ecg信号,因为这允许在心脏/导管接触发生时快速收集点。
为了确定消融点,可以生成pvc激活图,因为pvc激活图包含pvc期间最早激活的区域。然而,当使用常规ep系统生成pvc激活图时,导管必须在pvc期间与心脏接触。由于pvc可能只是间歇性出现,与使用无症状ecg数据相比,使用常规方法生成pvc激活图可能需要明显更长的时间。这增加了病人的压力和手术资源的使用。
这样,在框804中,框802中生成的内表面模型可以与框801中生成的pvc激活图合并,以形成pvc激活表面模型。特别地,包含在pvc激活图中的pvc激活数据可以应用于内表面模型。进一步,包含在pvc激活图中的表面特征(其已经包含mri或ct数据)可以与包含在内表面模型中的三角化的逐点数据合并。这样,pvc内表面模型可以在不执行将三角化的逐点数据和mri或ct数据合并的常规过程的情况下生成,这进一步简化了过程。
在框806中,导管可以位于eppvc激活模型上显示的pvc最早激活区域,并且可以起搏心脏。起搏期间可以记录起搏ecg数据。
在框808中,可以分析起搏数据以确定消融位置是否已经被识别。特别地,可对起搏数据进行分析,以确定起搏数据是否与患者的pvc发作期间记录的ecg数据充分匹配。换句话说,对起搏数据进行分析,以确定导管是否已经起搏出可以消融以减轻患者的pvc和/或vt的位置。
在确定框810中,确定消融位置是否已经被识别。如果消融位置已经被识别(即,确定框810=是),则在框814中,导管用于在识别的消融位置处消融心脏。
如果消融位置没有被识别(即,确定框810=否),则可以在框812中提供引导信息,如以上关于图11a的方法所讨论的。该方法然后可以前进到框806。然而,在一些实施例中,当消融位置未被识别时(即,确定框810=否),可以省略框812,并且该方法可以直接从确定框810前进到框806。方法800然后可以重复,直到在框814中识别并且消融消融位置。
在一些实施例中,该方法可以包含在pvc激活图上显示起搏位置。例如,pvc激活表面模型可以与pvc激活图配准,并且起搏位置可以被添加到pvc激活图中。起搏位置也可以代表起搏期间ep导管的位置。在其它实施例中,处理器400可以分析起搏期间记录的ecg数据,以确定起搏和/或起搏导管位置,然后将其添加到pvc激活图中。
在一些实施例中,方法800可以包含生成并且显示具有pvc激活图的参考图像和/或显示引导信息,如以上参考图11a-11d所讨论的。
一些实施例包含硬件系统,硬件系统包含配置有软件的处理单元,以接收患者特定的数据,基于ecg成像数据以患者的心脏的同步性图的形式生成和显示心脏电激活的3d模型,并且使用身体上用作基准参考点的可识别标记物(本文称为“基准标记物”)将3d模型/图与患者的身体相关联或配准。外部成像系统,诸如3d照相机,可用于获得患者的身体(例如躯干或胸部)的3d图像数据,其具有关键解剖参考点(例如锁骨、肩部、肋骨等,由临床医生作为crt过程设置的一部分应用于患者的标记物来指示)。患者特定的3d解剖模型可以通过将识别的解剖位置与从ct或mri扫描获得的成像中的相应解剖位置配准,将图像数据与患者的胸部的3d解剖模型合并。
图13是根据各种实施例的心脏成像系统1000的系统框图。参考图13,系统1000包含处理单元102,该处理单元可以电连接到硬件模块,诸如心电图系统106、内部成像系统1080、外部成像系统1090和输出单元1200。
处理单元1020从硬件模块接收患者特定的数据。根据患者特定的解剖数据,处理单元1020可以生成患者的心脏的同步性图,该同步性图可以被输出到输出单元1200。输出单元1200可以被配置为向用户输出同步性图和/或替代数据。输出单元可以是显示单元、打印机、消息单元等。
例如,处理单元1020可以从心电图系统1060(诸如12导联ecg设备)接收心电图(ecg)成像数据。处理单元1020可以使用ecg数据来确定心脏的电激活的3d模型4。特别地,为了计算心脏等时线的位置,ecg信号可以与心脏、肺和/或躯干的患者特定3d解剖模型相结合。
患者特定的3d解剖模型可以从内部成像系统1080获得,诸如mri设备或ct设备。可替代地或附加地,可以从包含多个3d解剖模型的数据库中选择并且可选地修改显示与患者最接近一致性的3d解剖模型。所选择的并且可选地修改的3d解剖模型可以用作患者特定的3d解剖模型。
进一步,处理单元1020可以从外部成像系统1090接收患者图像数据。例如,外部成像系统1090可以是3d照相机,并且处理单元1020可以接收患者的胸部表面的3d图像数据,如图14a或图14b中所示。
参考图14a,3d图像数据可以包含ecg导联相对于患者的解剖结构的位置,诸如图14a中所示的v1-6心前区电极。ecg电极相对于心脏的位置的知识,特别是v1-6心前区电极的知识,对于准确计算pvc的发作位置可能特别重要。
在一些实施例中,电极相对于其假设的理想位置的偏移,特别是v1-6电极的偏移,可以基于检测到的正常心脏搏动的ecg信号与理想ecg正常心脏搏动信号的比较来确定。例如,可以基于检测到的ecg信号将如何受到电极相对于理想电极位置的位置变化的影响来确定偏移。特别地,记录的ecg数据可以用于确定正常搏动的刺激发作位置。因为sa结点中的正常发作位置是已知的,所以可以将所确定的偏移位置与这个已知的发作位置进行比较,并且可以基于电极之间的变化来推断它们的偏移。因此,可以在不生成3d图的情况下确定电极偏移。
处理单元1020可以配置为对准和/或合并由外部成像系统1090生成的3d图像数据和由内部成像系统1080生成的解剖躯干和/或心脏模型,并且躯干模型中的电极位置可以被调整为与3d图像数据中的电极位置一致。然而,如果外部成像系统1090没有与躯干正确对准,可能难以正确地对准3d图像数据和解剖模型。
为了便于3d图像数据和解剖躯干模型的对准,系统100可以包含在由外部成像系统109生成的3d图像数据中捕获的之前放置在(例如粘附到)患者的躯干上的基准标记物。临床医生可以在躯干模型中识别的设定解剖位置将基准标记物放置在患者身上,以便于患者的3d图像与解剖躯干模型对准。在一些实施例中,基准标记物可以是具有被配置为粘附到皮肤上的粘性背衬的贴纸,具有能够通过处理3d图像数据的处理器自动识别和定位标记物的形状、颜色和/或表面材料(例如,反射或回射材料)。
例如,第一基准标记物900可以放置在患者的肩部的设定解剖位置,诸如每个锁骨的远端。第二基准标记物902可以放置在第一基准标记物902之间的设定解剖位置处,诸如患者的胸骨上的设定位置处。
处理单元1020可以配置为基于由外部成像设备收集的3d图像数据中包含的基准标记物900、902的一个或多个识别特征来识别这两个基准标记物及其对应的解剖位置。在一些实施例中,处理单元1020可以配置为基于图像数据中包含的相应解剖标记物的颜色、形状和/或反射率来识别对应于基准标记物900、902的解剖位置。
在一些实施例中,基准标记物900、902可以配置为反射特定波长的光。例如,第一基准标记物900可以具有第一颜色,并且第二基准标记物902可以具有第二颜色。在一些实施例中,每个标记900、902可以具有不同的颜色。
在一些实施例中,基准标记物900、902可以包含反射材料,其可以是反射涂层的形式。在一些实施例中,反射材料可以配置为反射一个或多个特定波长或波长范围的光。例如,在一些实施例中,基准标记物900、902可以由配置为反射可见光、红外光、紫外光或其组合的材料形成。在一些实施例中,外部成像系统1090可以包含光源,并且反射材料可以配置为反射从光源发射的全部或部分光。例如,基准标记物900、902可以配置为选择性地反射特定波长或波长范围的发射光。处理单元1020可以配置为基于由此反射的光来识别基准标记物900、902。
在一些实施例中,基准标记物300、302可以包含回射材料。特别地,回射材料可以配置为以基本上等于入射光的入射角的角度反射入射光或其一部分(即,直接返回入射光的源)。例如,众所周知,回射材料用于安全背心和交通标志。在这样的实施例中,处理单元102可以配置为检测从外部成像系统接收的图像数据中的亮度峰值这样的光。
在一些实施例中,基准标记物可以具有一种或多种不同的形状。例如,如图14b中所示,系统1000可以包含三角形基准标记物904、十字形基准标记物906和/或梯形基准标记物908。处理单元1020可以配置为基于基准标记物的形状来识别对应于基准标记物的解剖位置。
然而,各种实施例不限于识别特性的任何特定基准标记物,只要基准标记物包含可由处理单元1020识别并且可由外部成像系统1090检测的特性。进一步,虽然在图14a和图14b中示出了三个基准标记物,但是可以使用任何合适数量的基准标记物。
前述方法描述和过程流程图仅作为说明性示例提供,并不旨在要求或暗示各种实施例的步骤必须以呈现的顺序执行。如本领域技术人员将理解的,前述实施例中的步骤顺序可以以任何顺序执行。诸如“后文”、“然后”、“下一步”等词并不旨在限制步骤的顺序;这些单词只是用来引导读者完成方法的描述。进一步,任何对权利要求元件的单数引用,例如,使用冠词“一”、“一个”或“该”不应被解释为将元件限制为单数。
结合本文公开的实施例描述的各种说明性逻辑块、模块、电路和算法步骤可以实现为电子硬件、计算机软件或两者的组合。为了清楚说明硬件与软件的这种可互换性,已经在上文根据其功能大体描述了各种说明性组件、框、模块、电路和步骤。这种功能实现为硬件还是软件取决于特定的应用和对整个系统的设计约束。本领域技术人员可以为个特定应用以不同方式实现描述的功能,但这种实现决定不应被解释为导致偏离本发明的范围。
用于实现结合本文所公开的方面描述的各种说明性逻辑、逻辑块、模块和电路的硬件可以用通用处理器、数字信号处理器(dsp)、专用集成电路(asic)、现场可编程门阵列(fpga)或其它可编程逻辑器件、分立门或晶体管逻辑、分立硬件组件或设计用于执行本文所述功能的它们的任意组合来实现或执行。通用处理器可以是微处理器,但是可替代地,处理器可以是任何常规处理器、控制器、微控制器或状态机。处理器也可以被实现为计算设备的组合(例如,dsp和微处理器的组合、多个微处理器、一个或多个微处理器与dsp内核的结合或者任何其它这样的配置)。可替代地,一些步骤或方法可以由特定于给定功能的电路来执行。
在一个或多个示例性方面中,所描述的功能可以用硬件、软件、固件或其任意组合来实现。如果以软件实现,这些功能可以作为一个或多个指令或代码存储在非暂时性计算机可读介质或非暂时性处理器可读介质上。本文公开的方法或算法的步骤可以体现在处理器可执行软件模块和/或处理器可执行指令中,其可以驻留在非暂时性计算机可读或非暂时性处理器可读存储介质上。非暂时性服务器可读、计算机可读或处理器可读存储介质可以是可由计算机或处理器访问的任何存储介质。作为示例而非限制,这种非暂时性服务器可读、计算机可读或处理器可读介质可以包含ram、rom、eeprom、闪存设备、cd-rom或其它光盘存储装置、磁盘存储装置或其它磁存储设备,或者可以用于以指令或数据结构的形式存储期望的程序代码并且可以由计算机访问的任何其它介质。如本文使用的碟和盘,包含致密盘(cd)、激光盘、光盘、数字化通用盘(dvd)、软盘以及蓝光光盘,其中碟通常以磁方式复制数据,而盘利用激光器以光学方式复制数据。上述的组合也包含在非暂时性服务器可读、计算机可读和处理器可读介质的范围内。另外,方法或算法的操作可以作为代码和/或指令的一个或任何组合或集合驻留在非暂时性服务器可读、处理器可读介质和/或计算机可读介质上,它们可以被包含在计算机程序产品中。
对所公开实施例的以上描述被提供为使任何本领域技术人员都能够实现或使用本发明。对这些实施例的各种修改对于本领域技术人员而言将是显而易见的,并且在不脱离本权利要求书精神和范围的前提下在本文中限定的一般性原理可以应用于其它实施例。因此,本发明并不旨在受限于本文所示的实施例,而是应当被赋予符合以下权利要求书以及本文公开的原理和新颖特征的最宽泛的范围。
- 还没有人留言评论。精彩留言会获得点赞!