用于微创手术的机器人系统的制作方法
本发明是有关于用于执行机器人控制的微创手术程序(特别是用于切除肿瘤,且特别是用于脑肿瘤)的系统以及方法的领域,且所述系统以及方法包含针对待进行程序的区域的性质的初步研究。
背景技术:
在与本申请具有共同发明人的美国公开专利申请第2014/0025088号中,描述了一种用于进行微创神经程序的机器人装置,所述机器人装置使用一空心针(cannulatedneedle)用于插入至颅骨组织中,所述空心针具有一柔性内针同轴地配置在所述空心针内,且能够以与所述空心针的轴呈最大90°的角度离开所述空心针,从而能够接近位于所述装置的出口孔侧面的组织。所述空心针的旋转能够以与所述空心针轴呈任何角度方位设置的组织接近。所述柔性内针有利于自组装结构,在以上引用的申请中描述了其中几个替代实施例。
为了确定患者的脑组织内任何组织异常(例如,肿瘤的生长)的三维位置以及范围,使用基于任何术前成像方式(例如,mri或ct)的一术前治疗计划。然后,这些术前图像可以用于确定要对所述生长进行的手术程序。所述空心针以及所述柔性内针的运动是机器人控制的,其具有机器人坐标系统配准至所述患者的颅骨,且因此配准至所述多个术前图像上的细节。然而,由于脑脊液(cerebrospinalfluid,csf)的泄漏对脑物质的治疗以及对机器人探针插入所述脑组织的影响,脑移位效应的存在使得这种系统的治疗位置仅基于先前成像的靶组织的预期位置,这是一种有风险或甚至危险的程序,因为无法知道实际在何处进行治疗。因此,需要一种机器人控制的手术系统存在(其考虑到正在手术的所述组织的运动),其克服了现有技术的系统以及方法的至少一些缺点,且使得所述治疗只在希望治疗的病变组织上安全地进行,同时保持任何健康组织的完整。
在本说明书的此部分以及其他部分中提到的每个公开的揭示内容均通过引用将其全部内容并入本文中。
技术实现要素:
本揭示描述了用于进行微创手术程序(特别是用于切除肿瘤,且特别是用于脑肿瘤)的新的示例性系统以及方法。为了避免破坏健康组织,所述系统使用了机器人插入的治疗探针,所述探针在对所述组织进行任何不可逆的治疗程序(例如,烧蚀)之前,首先检测在通过所述患者的组织的一预定路径时肿瘤组织的存在。因此,此预治疗检测程序基本上能够避免健康组织的破坏。此外,即使通过所述探针未自检出病变组织,但多个术前图像指示在某个区域中有肿瘤组织的可能性,可以使用所述探针在任何烧蚀程序启动之前确认预期的位置处是否存在肿瘤组织。为了确保在一术前手术计划中指示的所述治疗程序仅在肿瘤组织上进行,且不仅仅依赖于如通过多个术前图像所指示的所述肿瘤组织的假想位置,此类伴随术中实时检测程序以及治疗方法的需求是必要的。这对于在脑上进行神经外科手术特别重要,因为对于这种应用,由于在手术程序期间发生脑移位,依赖多个术前图像可能不准确。因此,很大程度上避免了对健康组织的损害。因此,在这种神经外科手术程序中,所述肿瘤的这种实时检测以及治疗是非常有利的。所述设备以及程序可以用于移除良性或恶性生长。
为了说明所述设备及其使用方法,在本揭示中使用脑外科手术的实例,这是使用当前所述的系统以及方法特别有利的应用。所述系统使用一组合的检测以及治疗探针作为以上引用的us2014/0025088中所述的装置类型的内针或探针。此探针通过一孔口(优选地与外套管的纵轴呈直角配置)从所述外套管离开。所述内针可以具有一自组装结构,使其可以改变其组件状态,同时在所述外套管的外径范围内商定所述出口孔口的尖锐曲线,然后,在其离开所述孔口之后,自身重新组装成一刚性针或探针。因此,当涉及所述内针或探针时,在以上引用的us2014/0025088中使用的术语“柔性”、以及如本揭示中所使用的、以及如本文中所要求保护的,被理解为包含这一种可重新组装的针或探针。这一种组合的检测以及治疗针或探针可以在所述脑组织内以增量的步骤进行操作,以确保在所述脑的任何增量体积的任何治疗之前确认异常组织检测。通过这种方式,仅在肿瘤组织上进行治疗,而健康组织实质上不受损害。因此,所述检测以及所述治疗皆在一非常局部的体积上进行,并通过机器人控制所述外套管的插入以及旋转、以及所述柔性内探针的突出范围,确保在所有三维空间对所述脑组织进行检查以及治疗,并对周围健康脑组织的损害最小。所述探针运动的分辨率可以使小于1ml的体积得到有效治疗,而不会对周围健康组织造成实质损害。
位于所述柔性或自组装内探针的远端处的所述肿瘤检测工具可以利用多种替代肿瘤检测方法中的任何一种,例如,使用5-氨基乙酰丙酸(5-ala)诱导的荧光检测、一超声检测器、多个直接光学检测器(上述5-ala方法除外)、多个电阻抗测量、或用于肿瘤组织的任何类似的检测程序。所述治疗工具也位于所述柔性或自组装内探针的所述远端处,其可以是任何局部烧蚀装置,例如,激光烧蚀、rf烧蚀、冷冻烧蚀等。
为了使所述探针的所述检测以及治疗元件能够在所述套管孔口处形成锐利(优选为90°)的弯曲,且优选地在一内径不超过3至4毫米的一套管内实现这种弯曲,所述检测方式可以有利地基于一光学程序,其可以在一细光纤光学装置中实施,其具有目标照明以及多个返回的光谱分析信号通过一单一光纤或一渐变芯光纤传播,或在所述探针的所述末端处具有一光纤光学照明传递以及一光谱过滤的光检测器。也可以在这一种柔性的或自组装的内探针装置中实现电阻抗测量以及超声探测,例如,在以上引用的公开专利申请us2014/0025088中所述的任何探针。同样地,可以通过沿一光纤传输的一更高功率的激光烧蚀光束来有利地对检测到的任何肿瘤组织进行烧蚀。替代地,还可以在非常紧密的径向尺寸内提供电或超声烧蚀方式。通常设置在所述内部柔性或自组装探针下方的一工作通道可以用于提供冲洗液、或用于抽吸冷凝液以提高切割速度。无论使用哪种方法,都可以使用所述检测器工具以闭合所述机器人系统运动控制的回路,从而可以完全自动地进行所述检测以及治疗过程。
所述整个机器人手术程序可以包含以下步骤:
(i)成像(例如,通过mri或其他能够提供所需对比度以及分辨率的成像模式)以及通过一计算机控制台或一监视器在所述多个图像上描绘所述肿瘤;
(ii)将所述机器人系统安装至所述患者的颅骨上,在所述多个术前图像可识别的一位置;
(iii)将所述图像数据配准至所述机器人系统;
(iv)在所述颅骨内钻一锁孔;以及
(v)基于所述术前成像数据,检测-治疗-运动的多个自动增量机器人步骤。
首先,使用附接至所述颅骨的多个标记对所述患者进行成像。在将所述机器人系统连接至一立体定向的框架之后,将这些图像配准至所述机器人坐标系统,所述立体定向的框架的位置是在所述多个术前图像中通过识别所述多个标记的位置确定。替代地,所述机器人系统可以直接地附接至所述颅骨。所述机器人程序不仅仅依赖于此配准,因为在所述程序之前或期间发生脑移位可能会使此方法不准确。取而代之的是,所述系统使用所述多个术前图像以获得一预期的关注区域,但是随后结合了实时肿瘤检测以实现最大的安全性,这将在下面进一步解释。然后,医生在所述三维图像集上标记所述肿瘤边缘。此标记的体积定义了在所述程序期间用于所述机器人运动范围的三维极限。接着,所述医生在所述颅骨中钻一小锁孔,以使外套管针沿着最安全的路径进入所述肿瘤,如已通过所述多个术前图像确定。在此方面,进行所述术前成像以提供所述肿瘤的大致位置,所述医生在此基础上知道在哪里钻所述锁孔进入孔,且所述机器人控制需要在哪个方向对准所述装置以用于其插入,而实际治疗是使用在所述内针探针的末端上的所述检测探针进行局部校正来完成。所述机器人控制器应优选地配置为使得所述外套管针的插入不超过所述肿瘤的近端边缘,使得所述治疗可以从所述肿瘤的最近端边缘开始。一旦所述外套管已到达所述肿瘤的所述近端区域,则所述机器人控制器将所述柔性或自组装的内针从所述外套管的侧向孔口中移出,且优选地与所述外套管的轴呈90°的角度,并进入所述脑瘤。从此刻开始,将根据以下工作流程自动地进行所述程序:
(i)启动所述检测工具;
(ii)如果发现所述组织有癌变,则进行局部治疗,然后抽吸治疗的组织(可选的);
(iii)然后,所述内针进行一步运动(通常横向约1毫米),且再次启动所述检测工具;
(iv)如果发现所述组织有病变,则再次进行治疗以移除癌组织体积,然后,进行另一步从所述开口向外的横向运动;
(v)另一方面,如果发现组织的任何新的区域都是健康的,则认为已经达到所述肿瘤组织的外侧范围,并将所述内针完全地收回。如果所述肿瘤组织在到达肿瘤组织的另一个节点之前有一健康组织的区域的情况下,则医生依靠所述多个术前图像来决定如何进行操作-是否在不进行任何组织烧蚀的情况下将所述内探针推入穿过所述健康组织,或是否通过另一条轨迹进入以治疗所述肿瘤组织;
(vi)以一增量角度(例如,1度)进行一外套管针旋转,且以新的方位角重复组合的检测-治疗步骤(i)至(v);
(vii)重复此程序,直到所述针完成最多360度的旋转,检测以及烧蚀在此侧向水平处的所有肿瘤,直至显示器上标记的所述肿瘤的外边界为止;
(viii)将所述内针从所述组织中完全地抽出,以便将其装入所述外套管针中,然后,将其向下移动一增量距离(例如,1毫米),并在新的远端水平处重复整个程序,依此类推,直至治疗整个肿瘤体积。
所述多个术前图像是通过所述系统用于指示所述实时检测程序的大概起点。然而,所述癌区域的形状可以是不规则的,例如,在侧向远离主要肿瘤区域具有额外的癌组织,但在其间则有健康组织的区域。根据上述的运动系统,仅基于所述实时检测的一系统可能将所述内针到达的健康组织误解为所述肿瘤范围的末端,且停止其增量横向运动并开始旋转运动,因此无法达到癌组织的额外裂片(lobe)。因此,所述控制系统应包含一交互程序,必要时可以使用所述多个术前图像的数据,以便覆盖通过所述实时检测尖端确定的运动决策,从而确保到达所述肿瘤的所有描绘区域。这一种算法可以确定治疗所述组织的顺序,所述顺序是有效且合乎逻辑的,并考虑到三种运动类型的顺序:横向运动、旋转、然后向下的方式-以确保治疗所有不健康组织。
对于所述外套管针旋转以及向下运动,所述内针机构在所述外套管针内部是完全地收回,以防止对所述脑组织造成不必要的损害。医生会在所述多个术前图像上以及所述实时检测工具的结果监视所述机器人针的运动,且如果所述脑移位使治疗的位置相对于预期的位置处于不清楚的水平,医生可以随时停止手术。
根据本揭示的所述多个系统以及方法的另一实施方式,描述了一实时肿瘤检测以及治疗工具,其可以独立于上文所述的所述机器人插入装置使用。现有的用于神经外科的治疗工具(包含卡维特隆超声外科手术抽吸器(cavitronultrasonicsurgicalaspirator,cusa)、rf、低温热治疗等)旨在基于术前成像(例如,mri以及ct)或术中导航系统(允许在所述治疗期间进行超声成像)中的一个或两个进行肿瘤烧蚀。本申请揭示了一种实时肿瘤检测工具,其结合在一治疗工具的所述尖端中,并且在到达一健康组织时实时警告医生,从而防止对所述组织进行所述治疗,同时最大化癌组织的切除/烧蚀。
尽管本揭示在切除颅骨肿瘤的一示例性应用中描述了所述系统,但应理解的是,这仅仅是其使用的一个示例,且无意于限制要求保护的发明,以及所述系统可以用于切除所述受试者的解剖结构的任何部位的癌生长,前提是可提供适当的锚定以将所述机器人装置安装在其上。所述设备可以直接地锚定至骨头部位中,也可以使用带子(strap)将所述设备附接至其他身体部位。
因此,根据本揭示中所述的装置的一示例性实施方式,提供了一种用于检测以及治疗一受试者的一组织中的多个病变区域的系统,所述系统包括:
(i)具有一横向定向的远侧孔口的一刚性套管针以及能够从所述刚性套管针穿过所述孔口横向地展开的一柔性内探针,所述柔性内探针在其远端具有一尖端,包括:
(a)一传感器元件,配置为在所述尖端的区域中检测所述组织的状态,以及
(b)靠近所述传感器元件的一治疗元件,配置为治疗通过所述传感器元件检测为病变的所述组织的多个区域,
(ii)一机器人机构,用于将所述探针移动至所述受试者的组织的一选定区域中,其中多个术前图像指示存在一病变区域的组织,以及
(iii)一控制器,适于向所述机器人机构提供多个指令,以在所述受试者的组织的所述选定区域内增量地且协同地移动所述刚性套管针以及所述柔性内探针,从而治疗所述受试者的组织的体积内多个实质病变区域的组织。
在上述系统的任一个中,所述组织可以是所述受试者的脑组织。此外,在这种系统中,所述传感器元件可以是一光纤荧光探针,然后所述治疗元件可以是传递一烧蚀激光束的一光纤的尖端。这一种荧光探针适于检测由5-氨基乙酰丙酸(5-aminolevulinicacid,5-ala)的uv激发产生的荧光的存在。
另外,在这些系统的任一个中,所述传感器元件可以是一超声成像探针、一直接光学检测探针、或一电阻抗测量探针中的任一个,且所述治疗元件是一组射频烧蚀电极或一低温烧蚀尖端中的任一个。
关于上述系统,所述柔性内探针包括多个自组装元件。此外,所述孔口可以实质上与所述刚性套管针的轴呈直角定向。
最后,这一种系统还可以包括一组标记,适于安装在所述受试者的身体上以在一术前图像集中呈现,且所述机器人机构可以适于安装在所述受试者的身体上相对于所述多个标记的一已知位置中,使得所述机器人机构可以配准至所述术前图像集。
本揭示中所述的另一种实施方式,进行一种检测以及治疗一受试者的组织中多个病变区域的方法,所述方法包括:
(i)确定所述多个病变区域的组织的三维范围,
(ii)将具有一横向定向的孔口的一刚性套管针以及能够从所述刚性套管针穿过所述孔口横向地展开的一柔性内探针插入至所述组织中,所述柔性内探针在其远端具有一尖端,所述尖端具有检测元件以及治疗元件,
(iii)以多个增量步骤从所述横向定向的孔口展开所述柔性内探针,且在每个步骤通过所述检测元件的方式确定所述尖端的区域中的组织是否病变,
(iv)如果所述尖端的区域中的所述组织病变,则启动所述治疗,
(v)在纵向以及旋转方向上对所述刚性外套管进行多个连续的增量展开步骤之后,连续地重复所述柔性内探针的所述展开,以及
(vi)重复步骤(iii)至(v),直到所述尖端中的所述检测元件已经穿过所述多个病变区域的组织的整个所述三维范围展开,从而治疗整个所述多个病变区域的组织。
在这一种方法中,所述组织可以是所述受试者的脑组织。此外,在这些方法的任一个中,所述检测元件可以是一光纤荧光探针,且所述治疗元件可以是传递一烧蚀激光束的一光纤的尖端。在这种情况下,所述检测元件可以替代地是一超声成像探针,且所述治疗元件可以是一组射频烧蚀电极或一低温烧蚀尖端中的任一个。最后,在这些所述方法的任一个中,所述柔性内探针包括多个自组装元件,且所述孔口可以与所述刚性套管针的轴呈直角定向。
还提供了另一种手术治疗一受试者的方法,所述方法包括:
(i)在一术前图像集上描绘所述受试者的组织的一待治疗的区域,
(ii)在靠近所述区域的所述受试者的身体上安装一机器人系统,所述机器人系统包括一套管针,所述套管针在其远端具有一侧向定向的孔口,
(iii)将所述套管针插入所述受试者的组织中,直到所述孔口到达所述待治疗的区域的一选定横向水平,
(iv)将一柔性探针插入所述套管针中,使得所述柔性探针的远端离开所述横向定向的孔口,所述柔性探针在其远端具有一尖端,所述尖端包括检测以及治疗元件,
(v)使用所述检测元件以确定所述组织邻近所述尖端的部分是否需要治疗,且如果需要,则启动所述治疗元件,
(vi)增量地推进所述尖端,且重复步骤(v),直到所述尖端到达不需要治疗的组织,
(vii)将所述柔性探针收回至所述套管针中,增量地旋转所述套管针,并重复步骤(v)以及(vi),
(viii)重复步骤(vii),直到覆盖所有的所述侧向水平,
(ix)将所述柔性探针收回至所述套管针中,且进一步将所述套管插入至另一侧向水平,以及
(x)重复步骤(v)至(ix),直到治疗所述受试者的组织的需要治疗的所有部分。
在这一种方法中,所述选定的横向水平可以是所述待治疗的区域的最近水平、或是所述待治疗的区域的最远水平、或任何其他合适的水平。
最后,这一种方法可以应用于作为所述受试者的一脑组织的组织上,然后所述机器人系统可以刚性地安装在所述受试者的颅骨上。在这一种实施方式中,使用所述检测元件以确定所述脑组织邻近所述尖端的部分是否需要治疗可以提供对脑移位的影响的补偿。
附图说明
以下详细描述中将结合附图更全面地明白以及理解本发明,其中:
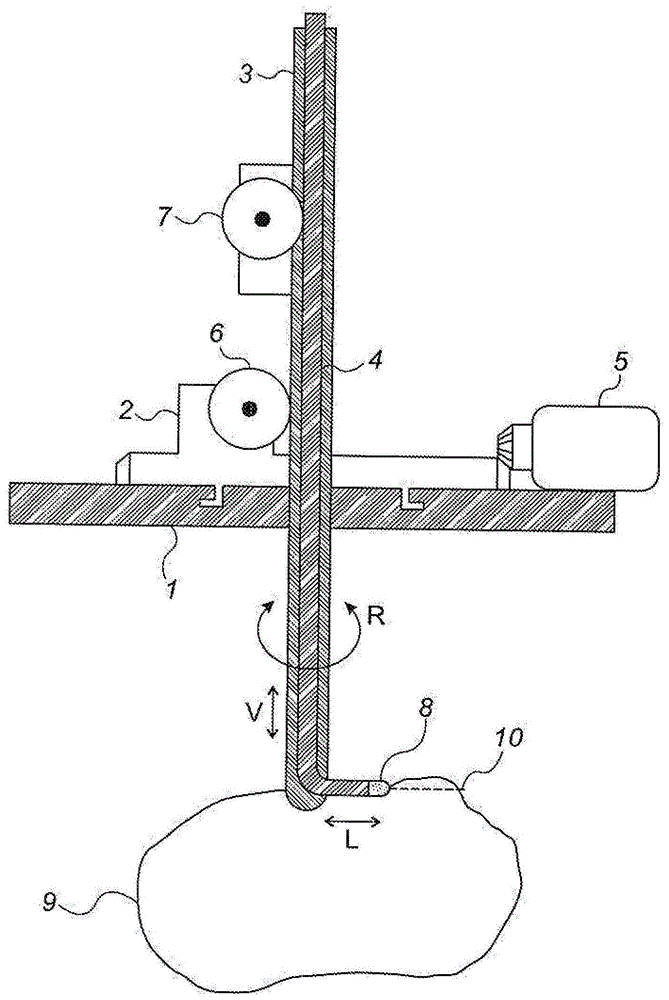
图1示意性地示出了根据本揭示的一示例性机器人控制的神经外科手术设备的一示例性实施方式。
图2是使用图1的所述设备执行以下提及的多个步骤的一典型方法的图示流程图表现形式。
图3是将检测/治疗探针尖端插入至患者的脑中时进行的多个步骤的一种示例性方法的流程图。
图4是示出用于执行图3的所述方法的图1的所述设备的控制系统以及多个受控制的元件的示意性方块图。
图5示意性地示出了一第一光纤,其中组织的检测以及烧蚀治疗以光学方式进行。
图6示意性地示出了用于组合的检测/治疗尖端的一替代结构,其使用用于确定所遇到的组织的性质的一超声探针以及用于破坏肿瘤组织的一电烧蚀头。
具体实施方式
现在参考图1,其示意性地示出了根据本揭示中提出的多个新颖设计的一机器人控制的神经外科手术设备的一示例性实施方式。在一新颖的排列中,内部柔性针探针4在其远端具有一组合的检测以及治疗模块8。以下示出了此检测以及治疗模块的各种实施方式的进一步构造以及操作细节。其他特征是外套管针3、用于将所述设备固定在所述受试者的颅骨上的各种组件、以及所述探针4的机器人控制机械运动。后者包含可旋转地安装在一主基座1上的一基座部分2,所述主基座1应固定至所述受试者的颅骨上。所述基座部分2围绕所述主基座1的旋转可以借助一机器人启动马达5(其还应包含一角度位置编码器)的方式来进行,使得所述基座部分2的角度取向是已知的。
所述内部柔性针探针4的所述插入可以通过一机器人马达以及编码器7的方式、或通过一线性马达(未示出)的方式来控制。替代地,所述内部柔性针探针4可以从外套管3突出的其近端部分移动。完整的双针组件相对于基座板的线性插入以及抽出运动可以通过另一个马达以及编码器6的方式来控制。如果所述系统与mri术中成像一起使用,则可以有利地使用线性或旋转压电马达来提供所述运动。
图1的所述设备通过三个独立轴的协同机器人运动使用,第一标记v(用于垂直,但不限于一空间或重力垂直方向)由马达6启动,以驱动所述外套管针3的穿透深度;第二标记l(用于横向)由马达7启动,以驱动所述内部柔性针探针4从所述外套管针3的孔口的横向延伸量;以及第三标记r(用于旋转)由马达5启动,以通过旋转基座部分2来旋转完整组合的针组件。
所述柔性针探针4的所述远端包括一尖端区域8,其中集成有一检测模块,所述检测模块能够分析所述尖端前方的敏感区域内的组织,且确定所述组织是否为具有一肿瘤性质的组织或为健康组织。以下图4至图6描述了可以进行此检测的多个结构。一旦所述检测模块已经确认在接近所述尖端区域8的前方有肿瘤组织的存在,则一信号将传送回系统控制单元(在图中未示出,但通常是基于微处理器或基于计算机),所述系统控制单元输出另一信号以启动所述治疗模块。所述治疗模块在所述治疗模块的有效范围内烧蚀或破坏良性或恶性组织。另外,如果正在进行例如细针穿刺活检(fineneedleaspirationbiopsy,fnab)程序之类的程序作为所述手术治疗,则本发明描述的设备以及方法可确保从所述肿瘤区域抽吸多个细胞的准确性。独立于所使用的细胞破坏或提取的特定方法,本揭示中描述的复合检测/治疗探针能够自主地检测以及破坏或抽吸所述柔性针探针进入的范围内的肿瘤组织。
现在描述了使用本揭示的所述系统的一特定方式,其定义了三个独立的运动,这些运动提供了对所插入的装置的纵轴的任一侧上的一三维区域中任意点的进入。此方法的一个重要特征是,所述内部柔性探针4以与所述外套管针3的纵轴呈等于或接近90°的角度从所述外套管针3弹出。因此所述探针尖端8沿一横向远离所述外套管针3的所述孔口移动。此特征具有一重要的优点,其提供了进入一肿瘤9体积的最大限度,而对所述肿瘤周围的健康组织的损害最小。通过插入所述装置使其远端刚好到达所述肿瘤9的最上边缘,且通过使用横向延伸,所述检测/治疗探针尖端8能够在不伤害任何健康细胞的情况下在所述肿瘤9的上限破坏肿瘤组织(不论是在破坏所述肿瘤组织期间通过穿过健康组织或通过附带的损害)。如果所述孔口与所述外套管轴的角度小于一直角,则可能造成这种损伤。而在后者的情况下,所述探针尖端将必须穿过健康组织以到达所述肿瘤顶部边缘的病变组织。
在使用中,外科医生钻一进入单孔(burrhole),且将所述装置以其轴对准所述肿瘤9的中心插入,直到所述孔口到达所述肿瘤9的所述顶部边缘,如通过所述受试者的颅骨的多个术前图像所预期的。考虑到脑移位的任何影响,一更准确的程序将是使所述装置推进直到其到达所述肿瘤组织的预期顶部边缘上方的一预定点,并从此点开始搜索程序。然而,在一近端方向上的脑移位通常不太可能发生,因此,如果没有此额外步骤,则可以假定此程序具有良好的效率。然后,所述内部柔性探针在操作所述尖端8中的所述肿瘤检测模块的情况下离开所述孔口,使得后续可以通过操作所述尖端8中的烧蚀功能立即地移除任何检测到的肿瘤物质。所述尖端横向地推进直至其到达所述肿瘤10的外边缘,此时所述检测单元将指示所述装置控制器不再出现肿瘤组织,停止烧蚀,且所述尖端通过所述内部柔性探针收回至所述外套管中。现在可以将整个装置旋转一增量角度(incrementalangle),通常为1°,且用所述检测/烧蚀模块在所述孔口所在的水平上从另一方位角移除肿瘤组织来重复所述程序。一旦清除了此径向路径的肿瘤组织,就以另一增量角度重复所述程序,直到移除了在所述第一横向水平的所述肿瘤的整个圆周切片。然后,将所述装置增量地向下移动,通常为1毫米,且在此新的径向侧向水平重复整个程序。在连续的径向侧面水平重复所述程序,直到达到一水平,其中此水平上通过整个360°旋转皆未发现肿瘤组织,这表明所述柔性探针已到达所述肿瘤的最远端。所述肿瘤应已被彻底根除。
如以上程序中所述,通过其顺序地清除整个侧向切片的肿瘤物质的所述方法仅是一种可以从一受试者的脑移除一三维肿瘤的方法。同样可以通过选择一个方位角进行所述三维治疗过程,其中从顶部至底部清除所述肿瘤的一垂直部分(形状类似于一片水果),然后,将所述孔口增量地旋转至一不同的方位角,其中从顶部至底部移除所述肿瘤的一第二部分,依此类推,直到所述肿瘤的完整三维旋转体积被治疗。此方法可能不如第一描述的一个接一个地清除多个水平侧向切片的方法有利,这是因为清除一平行形状的径向切片的组织涉及旋转所述切片时所述径向切片内部的多次横越(traverse),从而导致浪费程序时间。然而,尽管一些运动组合可能比其他运动组合在治疗时间上更有效率,但是本揭示的所述多个方法并不旨在限于覆盖一肿瘤的整个体积的任何特定扫描算法。
现在参考图2,其是使用图1的所述多个设备执行上述多个步骤的一典型方式的图示流程图表现形式。
在步骤(a)中,对所述受试者的颅骨拍摄多个术前mri图像,用多个标记20以定义所述颅骨上的多个空间参考位置,且在所述多个图像上描绘出图像中显示的一肿瘤9的范围。
在步骤(b)中,所述外科医生在所述颅骨中钻一锁孔(keyhole)21,所述锁孔的位置适当以提供对于所述肿瘤最安全的入口。
在步骤(c)中,将所述机器人装置22附接至所述颅骨的一位置中,所述位置与在所述多个术前图像中所示的所述多个标记20具有一已知关系,且如所述多个术前图像中所示,对所述机器人坐标系统相对于所述肿瘤10进行配准。
在步骤(d)中,将所述装置的所述外针3插入至所述脑中,直到其到达最接近所述颅骨上的插入点的肿瘤层,如从多个术前颅骨图像以及所述肿瘤的描绘位置所预期的。从所述肿瘤的最近端位置开始的此种插入程序可能是覆盖待治疗的整个体积的最简单方法,但应理解的是,治疗轨迹(trajectory)以及包膜(envelope)也可能在可疑的肿瘤体积内开始、或在其远端并返回向近端运行。
在步骤(e)中,使所述内部检测探针4穿过所述外针中的出口孔口并进入至所述脑组织中,以及启动实时(real-time)检测传感器以确定所述组织在所述尖端到达的所述点处是否为肿瘤。
如果所示的所述组织是健康的,则在步骤(f)中将所述内针4收回至所述外针3中,然后收回所述整个装置23。
另一方面,如果所示的所述组织为肿瘤,则在步骤(g)中,对所述组织进行治疗性烧蚀(在此图中示为激光烧蚀24),并施用抽吸25以移除烧蚀副产物。
在步骤(h)中,在完成步骤(g)中的所述烧蚀治疗之后,将所述内针向外移动一增量步骤26,或可选地,所述组件旋转27或向下移动,这全部取决于到达的所述位置。
在到达其新位置之后,如步骤(i)所示,再次启动所述实时检测探针(如步骤(e)中所示),以确定所述尖端所到达的新点处的所述组织是否为肿瘤。
然后,检测-治疗-运动的多个自动递归的(recursive)机器人步骤通过步骤(e)、(g)以及(h)进行,直到移除所述整个肿瘤。
现在参考图3,其是在将所述检测/治疗探针尖端插入至所述患者的脑中时进行的多个步骤的一个示例性方法的流程图,使得所述检测/治疗探针覆盖一可疑的肿瘤的整个体积。
在步骤30中,将一立体定向的框架或所述装置基座1固定至所述受试者的头部,且生成所述受试者的头部的多个术前图像,用多个标记或螺钉指示所述框架或基座位置。
在步骤31中,所述机器人装置本身是固定至所述框架或所述基座。
在步骤32中,所述机器人装置坐标系统可以通过与所述立体定向的框架或所述基座相关联的所述多个标记或螺钉的方式(其出现在所述头部的所述多个术前图像中)配准至所述受试者的成像头部的所述坐标系统。
在步骤33中,医生在所述多个术前图像上标记所述肿瘤的范围以及将直接通向所述肿瘤区域的选定的进入路径,并在所述颅骨中钻一单孔以能够进入所述选定的进入路径。
在步骤34中,所述机器人控制系统将所述整个针组件沿所述选定的路径向下移动至一位置,使得所述柔性针探针孔口与所述肿瘤的上边界相对,如通过所述医生在所述多个术前图像上的多个标记来确定。如先前结合图2的所述图示流程图的步骤(d)所解释的,在所述肿瘤的所述最近端位置开始检测以及治疗的这种插入程序可能是覆盖所述待治疗的整个体积的最简单方法,但应理解的是,所述治疗轨迹以及包膜也可能在所述可疑的肿瘤体积内的一不同优选水平处开始、或甚至在其远端用所述探针返回向近端运行。
在步骤35中,启动在所述柔性针探针的所述尖端处的所述检测工具,以确定在所述探针前方的所述组织的性质。如果遇到健康组织,则在步骤40中,将所述柔性针探针向内收回,直到不再突出所述装置,然后可以将所述整个针组件旋转一预定的增量角度而不会损坏周围的组织,以继续进行搜索所述整个针组件的下端位置周围的癌组织。
另一方面,如果在步骤35中遇到癌组织,则在步骤36中,启动在所述尖端中的所述治疗工具,以烧蚀或以其他方式破坏所述癌组织。
在步骤37中,可选地启动抽吸,以移除所述烧蚀的物质。
在步骤38中,所述控制系统确定所述工具是否已经到达所述肿瘤的外边缘,如通过所述医生在所述多个图像上的的多个标记来确定,或为了考虑到任何脑移位,如通过所述医生的多个标记来确定,除了至少一个额外的增量步骤,以通过实时感测而不是使用一术前图像集的一假设的范围来对所述肿瘤的范围生成一阳性的确定。
如果尚未到达所述肿瘤的所述外边缘,则在步骤39中,将所述柔性针探针向下移动一预定的增量,通常为1毫米,使得所述检测/治疗工具穿过所述肿瘤向外移动预定的量。在图1中所示的示例中,所述检测/治疗工具的所述路径通过所述工具前方的虚线指示。在预期的运动之后,当再次启动所述检测工具以确定所述探针尖端现在所在的所述组织的性质时,所述方法返回至步骤35。
另一方面,如果在步骤38中,已达到所述肿瘤的所述外边缘,如图1中通过标记为10的点所示(可能还包含额外的增量运动以消除脑移位的任何影响,且可能还包含烧蚀一少量额外增量的健康组织以确保完全移除所述病变组织),所述方法返回至步骤40,所述整个组件旋转上述预定的增量角度,且整个检测以及治疗的过程(如步骤35至39中所述)以新的方位角重复进行。
在步骤41中,所述控制系统检查在所述组件的整个360°旋转中是否已经在当前插入水平处进行所述程序。如果不是,则在步骤42中,将所述整个针组件旋转一更多的角度增量,且所述整个检测以及治疗的过程(如步骤35至41中所述)以所述新的方位角重复进行。
另一方面,如果现在已经完成所述组件的整个360°旋转,则在步骤43中,所述系统控制确定所述外针组件是否已达到所述肿瘤的下边缘(如通过所述医生标记的)。
如果步骤43指示尚未达到所述肿瘤的较低范围,则在步骤45中,所述整个外针组件向下移动一预定的增量(通常为1毫米),且所述系统将所述过程返回至步骤35的所述程序,其中在所述整个组件的新插入水平处启动所述检测工具。
为了确保完全移除所述肿瘤组织,即使已经达到所述肿瘤的所述下边缘,也可以建议将所述整个组件再进行一个增量步骤,以检测是否还有其他癌组织存在于所述肿瘤的假定下限之外。作为一替代方案,可能结合面向所述整个组件的运动方向(即,在本申请的附图中朝下)的一感测元件,从而可以确定这种可能性,而无需在必要时将所述组件插入。
另一方面,如果所述系统控制器确定所述外针组件已达到如通过所述医生标记的所述肿瘤的所述下边缘,且没有通过所述检测探针检测到进一步的病变组织(包含一可选的额外增量插入运动),则在步骤44中,由于假定已经移除所述肿瘤的所述整个体积,且所述程序终止,因此所述系统收回所述整个针组件。
现在参考图4,其示意性地示出当前揭示的装置的所述控制系统,包含所述感测元件和受控元件及其相互作用。所述控制系统本身可以是一专用微处理器或基于asic的控制器或通用计算机系统,其被编程以执行图3的所述流程图定义的所述方法,或可以成功地进行所需的动作以监督所述系统的操作的一类似算法。
在所述程序开始时,所述控制器60输入从所述受试者关注的区域(在本揭示中用于描述本发明的实施例中的所述脑)生成的所述多个术前图像中获得的数据66,包含通过所述医生输入至所述图像集的任何标记,以描绘待移除的所述肿瘤组织的预期外边界。然后,所述控制器启动所述外针组件插入驱动马达mext65,且推进所述整个针装置,直到所述检测/治疗探针的所述孔口到达所述肿瘤组织的起点(如从所述数据输入66获得)。
为了执行所述检测/治疗探针的插入,通过所述控制器60启动一插入驱动马达mins63,首先产生所述检测/治疗探针的一总体运动,使其从所述外针组件显露,且还产生所述探针的多个预定的增量运动,以小心地将其推进穿过所述肿瘤区域。在所述插入程序的每个增量处,所述控制器60从所述检测器/治疗探针的所述检测器元件61接收多个输入。基于所述输入,所述控制器算法进行以下两个动作之一:
(i)如果所述检测输入指示所述探针前方为一病变体积,则其生成一指令,以在一预定的时间内启动所述检测/治疗探针的所述治疗元件62,所述时间已经根据使用的所述组织破坏方法以及所述输入功率预先校准,以确保完全破坏在所述检测器元件61前方的一体积中的所述组织;或
(ii)如果所述检测输入61指示为健康组织,则其向所述插入驱动马达mins63生成一指令,以将所述柔性针探针推进所述预定的增量距离,然后向所述检测/治疗探针的所述检测元件61生成一指令,以分析在所述探针新位置前方的所述组织的性质。
当所述控制器接收已经达到所述肿瘤组织的最大横向范围的一信号时,根据本揭示中用于解释所述控制系统的操作的示例性插入算法,应进行所述装置的所述方位角的改变。所述控制器首先命令所述插入驱动马达mins63完全地将所述柔性针探针缩回至所述外针组件内,使得不会因一不经意地突出的探针尖端而对健康组织造成损害,且一旦确定,所述控制器会向所述旋转马达mrot64产生一信号,以使所述整个装置旋转所述预定的增量角,然后重复执行用于在正在治疗的横向平面处感测以及治疗另一角度方向的例程。
最后,当所述算法指示已经感测以及治疗一整个旋转平面时,操作所述插入驱动马达mins63以将所述柔性针探针收回至所述外针组件内,以确保没有突出的探针长度,然后所述控制器启动所述插入驱动马达mext65,并将所述整个针装置向远端推进一预定的增量,以在所述受试者体内的一新横向平面处再次进行所述整个程序。所述控制器以这种方式继续进行,直到消除整个所述肿瘤体积。
现在参考图5至图6,其示出用于所述内部柔性或自组装针探针4的组合的检测/治疗尖端8的多个替代结构。
图5示意性地示出了一第一光学实施方式,其中使用一光纤光学地进行所述组织55的所述检测以及所述烧蚀治疗。图5中所示的所述实施方式是一内窥镜式的应用,使用一双包层(doubleclad)光纤50。当用于5-ala诱导的原卟啉ix(protoporphyrinix,ppix)荧光测试时,所述光纤芯51有利地用于紫外线照射(所述紫外线照射用于所述探针的所述检测模式),这是因为所述芯为单一模式,因此提供了最佳的光学分辨率。通常在高达440nm范围内的所述uv照明可以通过一透镜56聚焦在正在检查的所述组织上,且通过在频谱的620至640nm红色区域中激发特征性ppix荧光来显示多个癌性肿瘤细胞的存在。来自健康组织的向后散射的蓝光以及来自癌性脑组织的任何红色荧光可以聚焦返回所述光纤芯51下方至所述检测监视器(图中未示出),在此可以显示所述照明的区域的一图像,或在此光谱图像处理可以用于自动地确定所述照明的组织的性质,并指示所述组织烧蚀光学系统相应地开始烧蚀。这种烧蚀可以简单地通过沿所述双包层光纤的所述内包层52向下传输一高功率激光束来实现。所述激光束波长应优选地在不干扰所述光学荧光以及检测程序的一区域中,例如,在近红外中。撞击光束密度必须足够高才能成功地烧蚀所述组织。在图5中所示的实施例中,示出所述烧蚀光束穿过所述聚焦透镜56,使其在所述组织上达到一足够高的功率密度。在此实施方式中,假定局部加热在横向上充分地散布,以破坏不是直接在所述焦点处的组织。然而,如果一足够高密度的光束可以沿所述光纤向下传输,则所述烧蚀光束不需要聚焦透镜,其会破坏与所述光纤出口相对的所有组织。在这种情况下,所述聚焦透镜56可以足够小,使其仅聚焦所述成像探针光束。由于所述烧蚀光束的能量在理想情况下应通过所述脑组织吸收,因此很少有入射光束反射回至所述光纤,使其应不会过度干扰所述检测成像过程。
如图5中所示的所述双包层光纤的一替代方案,可以进行光学检测的功能,但是是使用具有一双芯的一光纤,其中一个芯用于激发所述荧光,而另一个芯用于成像由此激发的所述多个组织。在这种实施方式中,所述烧蚀光束既可以通过所述内包层传输,也可以通过一附加光纤传输,所述附加光纤穿过所述柔性探针中的一工作通道。
现在参考图6,其示意性地示出了用于组合的检测/治疗尖端70的一替代结构,其使用一微型超声探针71来确定通过超声成像的方式遇到的所述组织的性质,然后,使用一对电极72通过在它们之间的一rf电压激发来进行电烧蚀,以对任何需要移除的组织进行电烧蚀。
还可以使用超声检测以及光学烧蚀、或检测以及治疗工具的任何其他合适的组合来使用组合的检测/治疗尖端构造,其中检测是通过rf侵蚀的光学以及烧蚀,反之亦然。
本领域技术人员应理解,本发明不受上文已具体示出以及所述的内容限制。相反地,本发明的范围包含上文所述的各种特征的组合以及子组合,以及本领域技术人员在阅读以上描述时可能会发生的且不属于现有技术的多种变化以及修改。
- 还没有人留言评论。精彩留言会获得点赞!