硫酸葡聚糖的新用途的制作方法
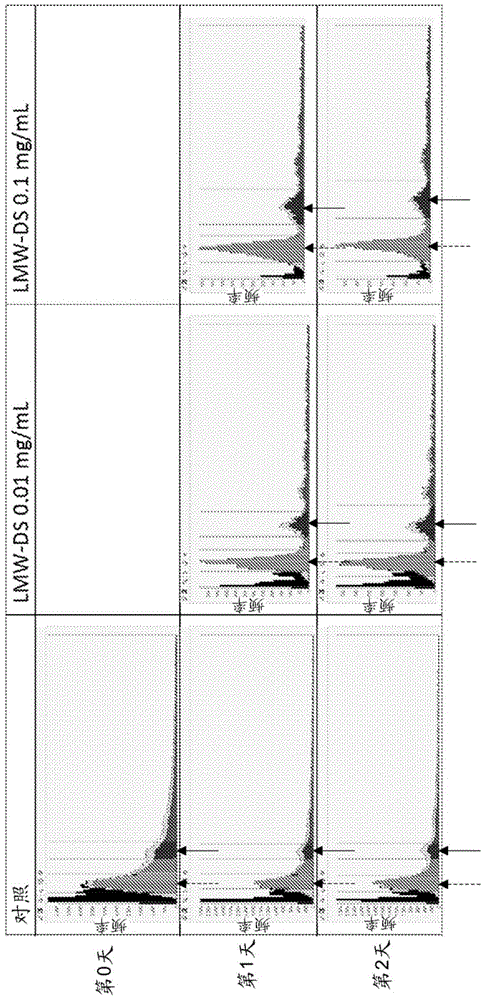
本实施方案整体涉及神经疾患和纤维化疾患,并且特别涉及硫酸葡聚糖在对抗此类疾患中的用途。
背景技术:
:在神经疾病(诸如阿尔茨海默氏病(alzheimer’sdisease)(ad)、帕金森病(parkinson’sdisease)(pd)、亨廷顿病(huntington’sdisease)(hd)、肌萎缩侧索硬化(als)和多发性硬化(ms))以及对中枢神经系统(cns)或外周神经系统(pns)的损害(诸如外伤性脑损伤(tbi)、中风和蛛网膜下腔出血(sah))中,神经元和胶质细胞(诸如少突胶质细胞和施旺氏(schwann)细胞)分化的丧失是第一疾病阶段之一,随后是细胞死亡。细胞的功能也受到损害,如代谢功能和线粒体能量代谢受损以及氧应激升高所见。受损的神经元还释放对附近神经元具有兴奋性毒性作用的谷氨酸,进而引起进一步的细胞损害和细胞死亡。因此,在神经疾病、病症和疾患中发生了许多有害机制。因此,通常需要有效对抗此类有害机制并因此对患有此类神经疾病、病症和疾患的患者有益的药物。us2011/0014701涉及多硫酸化多糖用于提高祖细胞存活力的用途。该美国专利申请还公开了多硫酸化多糖用于调节祖细胞分化的用途。测试了各种多硫酸化多糖。结论是多硫酸化多糖多硫酸葡聚糖(mw=5,000da)下调或遏制祖细胞的分化。技术实现要素:本发明的一般目的是提供一种用于患有神经疾患和/或纤维化疾患的患者的药物。通过如本文所定义的实施方案来满足该目的和其他目的。本发明在独立权利要求中限定。本发明的其他实施方案在从属权利要求中限定。本实施方案涉及对患有神经和/或纤维化疾病、病症或疾患的患者具有若干有利作用的硫酸葡聚糖或其药学上可接受的衍生物。硫酸葡聚糖或其药学上可接受的衍生物能够诱导胶质细胞和神经元的分化、减少神经元和胶质细胞中的氧化应激、减少谷氨酸兴奋性毒性、改善神经元和胶质细胞线粒体中的代谢功能和能量代谢并激活机体的内在修复机制等。硫酸葡聚糖或其药学上可接受的衍生物还能够通过抑制纤维发生因子如tgf-β并激活纤维蛋白溶解来防止纤维发生,从而溶解现有的瘢痕组织,诱导组织重塑和组织的可行愈合。硫酸葡聚糖或其药学上可接受的衍生物通过消退免疫或炎性响应,也对各种炎性疾患和自身免疫性疾患(包括神经炎性疾患)具有作用。附图说明通过参考以下结合附图的描述,可最好地理解本实施方案及其进一步的目的和优点,其中:图1示出了小鼠皮层神经元的碘化丙啶(pi)含量。用与dna结合的pi对细胞进行染色。基于dna含量,可将细胞分组到细胞周期的不同阶段。由于dna含量在细胞周期期间变化,pi染色可指示细胞周期进程。数据表明,大多数细胞保持在细胞周期的g1期(虚线箭头),但低分子量硫酸葡聚糖(lmw-ds)似乎增加了处于g2/m期(实箭头)的细胞数量。图2示出了人运动神经元的pi含量。数据表明,大多数细胞保持在细胞周期的g1期(虚线箭头),但lmw-ds似乎增加了处于g2/m期(实箭头)的细胞数量。图3示出了人施旺氏细胞的pi含量。数据表明,大多数细胞保持在细胞周期的g1期(虚线箭头),但lmw-ds似乎增加了处于g2/m期(实箭头)的细胞数量。图4是小鼠皮层神经元中βiii-微管蛋白表达的代表性图片。图5a和图5b示出了lmw-ds对小鼠皮层神经元中βiii-微管蛋白表达的作用。这些图表示出了阳性细胞的总强度(图5a)和平均大小(图5b)。图6a和图6b示出了lmw-ds对人运动神经元中βiii-微管蛋白表达的作用。这些图表示出了阳性细胞的总强度(图6a)和平均大小(图6b)。图7是人运动神经元中βiii-微管蛋白表达的代表性图片。图8a和图8b示出了lmw-ds对人施旺氏细胞中髓磷脂碱性蛋白(mbp)表达的作用。这些图表示出了阳性细胞的总强度(图8a)和平均大小(图8b)。图9是人施旺氏细胞中mbp表达的代表性图片。图10是示出在小鼠中诱导eae后对于阴性对照(媒介物)、阳性对照环孢霉素a(cyclo)和lmw-ds的平均实验性自身免疫性脑脊髓炎(eae)严重程度评分的图。图11是示出在小鼠中诱导eae后对于阴性对照(媒介物)和hgf的平均eae严重程度评分的图。箭头指示治疗的开始。图12是示出脑谷氨酸水平变化的图。图13a至图13d是示出作为线粒体磷酸化能力测量的腺嘌呤核苷酸(atp、adp、amp)水平和atp/adp比率变化的图。图14a至图14d是示出氧化型和还原型烟碱辅酶水平变化的图。图15a至图15c是示出代表氧化应激的生物标志物水平变化的图。图16是示出作为no介导的亚硝化应激测量的硝酸盐水平变化的图。图17a至图17c是示出n-乙酰天冬氨酸(naa)和其底物水平变化的图。图18示意性地示出了氧化应激对线粒体功能(障碍)的影响。图19示意性地示出了谷氨酸信号传导途径中涉及的分子。图20是示出就患有原发性开角性青光眼(poag)并用盐水对照或lmw-ds处理的受试者角度来说层粘连蛋白免疫反应性的变化的图。图21是示出就患有poag并用盐水对照或lmw-ds处理的受试者角度来说纤连蛋白免疫反应性的变化的图。图22示出了淀粉样蛋白-β单体和低聚体的制备。淀粉样蛋白-β(1-42)(a)或淀粉样蛋白-β-生物素(b)的低聚体(泳道1、2、5-7)或单体(泳道3和4)的制备。凝胶用50皮摩尔(泳道5)、100皮摩尔(泳道1、3和6)或200皮摩尔(泳道2、4和7)的相应肽制剂上样。在蛋白质印迹上出现的蛋白用抗淀粉样蛋白-β免疫标记。指示预测的低聚体和分子量标志物。图23示出了葡聚糖硫酸钠盐(dsss)和lmw-ds竞争淀粉样蛋白-β与prpc之间的蛋白-蛋白相互作用。图24示出了在不具有和具有外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在tbi后第2天处死的大鼠脱蛋白脑匀浆中测得的naa浓度。对照用假手术动物代表。值是12只动物的平均值。标准偏差用竖条代表。*与对照显著差异,p<0.01。**与stbi第2天显著差异,p<0.01。图25示出了在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的atp浓度。对照用假手术动物代表。值是12只动物的平均值。标准偏差用竖条代表。*与对照显著差异,p<0.01。**与stbi第2天显著差异,p<0.01。图26示出了在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的抗坏血酸浓度。对照用假手术动物代表。值是12只动物的平均值。标准偏差用竖条代表。*与对照显著差异,p<0.01。**与stbi第2天显著差异,p<0.01。图27示出了在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的谷胱甘肽(gsh)浓度。对照用假手术动物代表。值是12只动物的平均值。标准偏差用竖条代表。*与对照显著差异,p<0.01。**与stbi第2天显著差异,p<0.01。图28示出了在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的naa浓度。对照用假手术动物代表。值是12只动物的平均值。标准偏差用竖条代表。*与对照显著差异,p<0.01。**与stbi第2天显著差异,p<0.01。具体实施方式本实施方案整体涉及神经疾患和纤维化疾患,并且特别涉及硫酸葡聚糖在对抗此类疾患中的用途。神经病症是机体神经系统(即脑、脊柱和连接它们的神经)的任何病症。脑、脊髓或其他神经中的结构、生化或电学异常可导致一系列症状。虽然脑和脊髓被坚韧的膜包围,被包裹在颅骨和脊椎的骨中,并且被血脑屏障化学隔离,但如果受到损害,它们是非常敏感的。神经倾向于位于皮肤下的深层,但仍可能受到损害。单个神经元及其形成的神经网络和神经易受电化学和结构破坏的影响。神经再生可能发生在外周神经系统中,并且因此在某种程度上克服或处理损伤,但据认为这在脑和脊髓中很少见。神经问题的具体原因多种多样,但可能包括遗传病症、先天性异常或病症、感染、生活方式或环境健康问题,包括营养不良和脑损伤、脊髓损伤或神经损伤。该问题可能起始于与神经系统相互作用的另一机体系统。例如,脑血管病症涉及由于供给脑的血管(即心血管系统)的问题引起的脑损伤;自身免疫性病症涉及由机体自身的免疫系统引起的损害;溶酶体贮积病(诸如尼曼-皮克病(niemann-pickdisease))可能导致神经恶化。神经变性疾病、病症或疾患是引起神经元的结构和/或功能进行性丧失(包括神经元死亡)的疾病、病症或疾患。此类神经变性疾病、病症或疾患的非限制性示例包括阿尔茨海默氏病(ad)、帕金森病(pd)、亨廷顿病(hd)和肌萎缩侧索硬化(als)。ad的特征在于大脑皮层和皮层下区域中神经元和突触的丧失。ad中的典型神经病理学发现包括淀粉样蛋白斑、神经原纤维缠结以及突触和神经元细胞死亡。在神经病理学检查中ad中频繁出现白质病(wmd)。它被定义为伴有髓磷脂、轴突和少突胶质细胞减少以及星形细胞增多的次全组织丢失。pd是cns的神经变性疾病。pd的运动症状是由黑质中多巴胺生成细胞的死亡引起的。在患病的神经中,轴突周围的髓鞘开始受到侵蚀。神经炎症是pd的病理标志,并且特征在于神经元损伤部位的小胶质细胞激活和t细胞浸润。hd是影响肌肉协调并导致认知衰退和精神问题的神经变性病症。该疾病由称为huntingtin的基因中的常染色体显性突变引起的。该基因的一部分是称为三核苷酸重复的重复部分,其长度在个体之间不同。当该重复部分的长度达到某个阈值时,它将产生蛋白质形式的改变。huntingtin基因编码的蛋白(htt)与其他100多种蛋白相互作用,并具有多种生物学功能。htt的突变形式对某些细胞类型(尤其是脑中的细胞)有毒性。hd的特征在于对神经上髓鞘的损害。在hd患者中已经鉴别出外周血中增强激活的t细胞。als,也被称为卢·格里格氏疾病,是一种病因多种多样的衰竭性疾病,其特征在于快速进行性无力、肌肉萎缩和肌束震颤、肌肉痉挛状态、构音不良、吞咽困难和呼吸困难。als是最常见的运动神经元疾病(als、遗传性痉挛性截瘫(hsp)、原发性侧索硬化(pls)、进行性肌萎缩(pma)、进行性球麻痹(pbp)和假性球麻痹)。als病理学的主要特征是脊髓前角和脑干运动核中运动神经细胞的丧失。这导致相应肌肉的继发性萎缩(肌萎缩)。神经炎症是als的病理标志,并且特征在于神经元损伤部位的小胶质细胞激活和t细胞浸润。“侧索硬化”是指皮质脊髓束变性(脊髓中的侧面位置)。实际上,髓磷脂损失发生在皮质脊髓束中。als的硬化涉及侧柱或皮质脊髓束,并且是一种继发性现象。神经疾病、病症或症状可以是脱髓鞘疾病、病症或症状。脱髓鞘疾病、病症或疾患是其中神经元的髓磷脂被损伤的神经系统疾病。这种损伤危害受影响的神经中的信号传导,并从而引起依赖于损伤中所涉及的神经的感觉、运动、认知和其他功能的缺陷。此类脱髓鞘疾病、病症或疾患的非限制性示例包括多发性硬化(ms)、急性弥漫性脑脊髓炎(adem)、中枢神经系统(cns)神经病、脑桥中央髓鞘溶解(cpm)、脊髓病、白质脑病和脑白质营养不良(均影响cns)和格林巴利综合征(guillain–barrésyndrome)(gbs)、外周神经病和夏科-马利-杜斯病(charcot-marie-tooth,cmt)疾病(均影响外周神经系统(pns))。ms是一种炎性疾病,其中脑轴突和脊髓周围的脂肪髓磷脂受损,从而导致脱髓鞘和瘢痕形成以及广泛的体征和症状。ms涉及诱导针对脑和脊髓白质的免疫响应的t细胞。ms是一种髓磷脂疾病,而不是主要由神经细胞引起。由于髓磷脂遍布整个神经系统,因此病变可能且通常在多个部位。然而,该疾病仅影响中枢髓磷脂而不影响外周神经的髓磷脂。因此,症状具体是cns病症。adem是一种免疫介导的脑部疾病。它通常在病毒、细菌或寄生虫感染后发生,或甚至自发出现。adem攻击cns的神经并损伤它们的髓磷脂绝缘,其结果是破坏白质。由于它涉及自身免疫性脱髓鞘,因此它与ms类似,并且被认为是ms边缘疾病的一部分。adem在脑和脊髓中产生多种炎性病变,尤其是在白质中。adem涉及由髓磷脂反应性t细胞分泌的细胞因子。神经病,包括cns神经病和外周神经病,是影响神经的一组损害或疾病,取决于受影响的神经的类型,其可损害感觉、运动、腺体或器官功能或健康的其他方面。常见原因包括系统性疾病,诸如糖尿病或麻风病;维生素缺乏;药物,例如化疗或常用的处方抗生素;外伤性损伤;缺血;放射治疗;过量饮酒;免疫系统疾病;腹腔疾病;或病毒感染。神经病可能是或是急性的。急性神经病需要紧急诊断。控制肌肉的运动神经、感觉神经或控制自动功能(例如心率、体温和呼吸)的自主神经可能受到影响。可能同时影响多于一种类型的神经。cpm是一种由脑干(更确切地在称为脑桥的区域)中的神经细胞的髓鞘严重损害引起的神经疾病,主要是医源性病因。其特征在于急性麻痹、吞咽困难、构音不良和其他神经症状。脊髓病描述了与脊髓有关的任何神经缺陷。当由于外伤而引起时,通常称为脊髓损伤(sci),当为炎性时,通常称为脊髓炎,并且当疾病是血管性质的疾病时,通常称为血管脊髓病。人类脊髓病的最常见形式,颈椎脊髓病(csm)是由颈椎的关节炎变化(椎关节强硬)引起的,其导致椎管狭窄(脊髓狭窄),最终导致脊髓受压。白质脑病是脑白质营养不良样疾病的广义术语。它适用于所有脑白质疾病,无论其分子病因是否已知。白质脑病可具体地指这些疾病中的任何一种:进行性多灶性白质脑病、中毒性白质脑病、白质消融性白质脑病、神经轴索球性白质脑病、可逆性大脑后部白质脑病综合征、伴皮层下囊肿的巨脑性白质脑病。脑白质营养不良是一组以脑白质变性为特征的疾病之一。脑白质营养不良是由髓鞘的不完全生长或发育引起的,髓鞘是用作围绕神经纤维的绝缘体的脂肪覆盖物。当白质受到损害时,免疫响应可导致cns炎症和髓磷脂丢失。脑白质营养不良的特征在于包括运动功能降低、肌肉强直以及最终视力和听力退化的具体症状。脑白质营养不良症的具体类型包括肾上腺脊髓神经病、亚历山大病(alexanderdisease)、脑腱性黄瘤症、遗传性cns脱髓鞘疾病、克拉伯病(krabbedisease)、异染性脑白质营养不良、佩-梅氏病(pelizaeus–merzbacherdisease)、卡纳万病(canavandisease)、白质消融性白质脑病、肾上腺脑白质营养不良和雷弗素姆病(refsumdisease)。gbs,也称为landry麻痹或guillan-barré-strohl综合征,是一种影响pns的急性多发性神经病。在gbs中,免疫细胞攻击髓鞘—覆盖神经纤维的脂肪物质。上行性麻痹是常见症状。gbs被认为是一种免疫介导的疾病,涉及感染引起的异常t细胞响应。细胞和体液免疫机制可能在其发展中起作用。大多数患者在gbs发作前几周报告有传染病。据认为,许多已鉴别的传染原诱导与特定神经节苷脂和糖脂(诸如gm1和gd1b)交叉反应的抗体产生,这些神经节苷脂和糖脂分布在整个外周神经系统的髓磷脂中。cmt是遗传性运动感觉神经病之一,遗传性运动感觉神经病是特征在于肌肉组织和身体各个部位的触觉逐渐丧失的一组外周神经系统的各种遗传性病症。cmt先前被分类为肌肉发育不良的亚型。在神经病症中,神经元和胶质细胞(诸如少突胶质细胞和施旺氏细胞)分化能力的丧失是疾病进展的第一阶段之一。通常,该病症随后随着此类神经元和胶质细胞的细胞死亡而进展。因此,能够促进神经元和胶质细胞分化的药物将对患有神经疾病、病症或疾患的患者有益。此类诱导分化的药物可以是神经保护性的,并且可例如用于治疗神经疾病、病症或疾患。如本文所呈现的实验数据表明,本实施方案的硫酸葡聚糖能够诱导神经元和胶质细胞的分化。硫酸葡聚糖的这种作用在皮层神经元和运动神经元以及小鼠和人来源的神经元中都可见。相应地,硫酸葡聚糖能够诱导构成一种类型的胶质细胞的施旺氏细胞的分化。本实施方案的硫酸葡聚糖另外在cns的炎性脱髓鞘疾病的体内模型中显示出积极的作用,该模型是目前最广泛接受的ms和adem的动物模型。根据us2011/0014701的陈述,即硫酸葡聚糖(mw=5,000da)不诱导而是相反地下调或遏制祖细胞分化,关于通过本实施方案的硫酸葡聚糖诱导神经元和胶质细胞中的细胞分化的这些结果是非常令人惊讶的。因此,似乎本实施方案的硫酸葡聚糖的细胞分化能力可能是细胞类型特异性的,并且因此潜在地限于神经元和胶质细胞。现有技术数据显示,硫酸葡聚糖实际上对在上述美国专利申请中以祖细胞为代表的其他细胞类型具有相反的作用。神经元,也称为神经细胞,是通过电和化学信号处理和传输信息的可电激励的细胞。神经元之间的这些信号经由突触产生的,突触是与其他细胞的特殊连接。神经元可彼此连接以形成神经网络。神经元是脑和cns的脊髓以及pns的神经节的核心成分。神经元的特殊类型包括:对触摸、声音、光和所有其他影响感觉器官细胞的刺激作出响应的感觉神经元,所述感觉器官然后将信号发送到脊髓和脑;从脑和脊髓接收信号以引起肌肉收缩并影响腺输出的运动神经元,以及将神经元连接到脑同一区域内的其他神经元或神经网络中的脊髓的中间神经元。典型的神经元由细胞体(胞体)、树突和轴突组成。术语神经突用于描述树突或轴突,尤其是在其未分化阶段。树突是由细胞体形成的薄结构,通常延伸数百微米并分支多次,从而形成复杂的“树突树”。轴突,当有髓时也称为神经纤维,是一种特殊的细胞延伸,其在称为轴突小丘的部位处起源于细胞体并行进一段距离。神经纤维通常被束成束,并且在pns中,束状束构成神经。在大多数突触中,信号从一个神经元的轴突发送到另一个神经元的树突。神经元不经历细胞分裂。在大多数情况下,神经元是由特殊类型的干细胞产生的。星形胶质细胞是也已被观察到由于干细胞特有的多能性而转变成神经元的星状的胶质细胞。在人类中,神经发生在成年期基本停止;但在两个脑区域(海马和嗅球)中,有强有力的证据表明会产生大量的新神经元。本实施方案的硫酸葡聚糖能够诱导神经元中β-微管蛋白(特别是βiii-微管蛋白)表达的增加。βiii-微管蛋白,也称为iii类β-微管蛋白,是仅在神经元中表达的微管元件。微管细胞骨架对于神经元的发育和存活至关重要。微管由微管蛋白异二聚体组装而成,其包含不同的微管蛋白同种型。微管是极化的,并且在神经元中,它们的“负端”通常朝向细胞体中的中心体定向,而它们的‘正端’朝向轴突的尖端突出。微管极性在分化和成年神经元中都起着重要的作用。在分化期间,微管蛋白在细胞中增加并形成微管,其允许分化的神经元响应于导向信号延伸或收缩生长的轴突,以便维持朝向突触后靶的定向生长。它们的活性对于细胞迁移、轴突发育和导向是必不可少的,并且也是成年神经元的功能和存活力所必需的(biosciencereports(2010),30:319-330)。βiii-微管蛋白在神经元中的表达增加表明,本实施方案的硫酸葡聚糖充当这些细胞的分化因子。在一个实施方案中,神经元选自皮层神经元和运动神经元。运动神经元是一种神经细胞,其细胞体位于脊髓中,其轴突突出到脊髓外以直接或间接控制效应器官,主要是肌肉和腺体。运动神经元的轴突是传出神经纤维,其将信号从脊髓传送到效应器以产生效应。运动神经元疾病(mnd)是一种选择性影响运动神经元的神经病症。这些mnd是als、hsp、pls、pma、pbp、假性球麻痹、脊髓性肌萎缩(sma)和脊髓灰质炎后综合征(pps)。它们本质上是神经变性的,并导致残疾增加,并最终导致死亡。hsp,也称为遗传性痉挛性下肢无力、家族性痉挛性截瘫、法国定居病或strumpell-lorrain病,是一组以进行性步态病症为主要特征的遗传性疾病。该疾病表现为下肢进行性僵硬(痉挛)和收缩。该症状是脊髓中长轴突的功能异常的结果。受影响的细胞是主要的运动神经元,因此该疾病是上运动神经元疾病。hsp是由蛋白、结构蛋白、细胞维持蛋白、脂质和其他物质在细胞内的转运的缺陷引起的。pls是一种罕见的神经肌肉疾病,其特征在于随意肌中的进行性肌无力。pls仅影响上运动神经元。pma,也称为duchenne-aran肌萎缩症,是一种仅影响下运动神经元的罕见mnd亚型。pbp是一种攻击供应延髓肌的神经的疾病。这些疾病的特征是大脑皮层、脊髓、脑干和锥体束中运动神经元的变性。这具体涉及舌咽神经(ix)、迷走神经(x)和舌下神经(xii)。假性球麻痹是一种以不能控制面部运动(诸如咀嚼和说话)为特征并且由多种神经病症引起的医学疾患。患者经历咀嚼和吞咽困难,在舌和延髓区具有增加的反射和痉挛,并且表现出言语不清,有时也表现出不受控制的情绪爆发。该疾患通常由对脑干的神经元特别是皮质延髓束(上运动神经元管到颅神经运动核)的损害、双侧变性引起的。sma,也称为常染色体隐性近端脊髓性肌萎缩和5q脊髓性肌萎缩,是一种罕见的神经肌肉疾病,其特征在于运动神经元的丧失和进行性肌肉消瘦,通常导致早期死亡。该病症是由smn1基因的遗传缺陷引起的,该基因编码smn,一种在所有真核细胞中广泛表达的蛋白质,并且是运动神经元存活所必需的。较低水平的蛋白质会导致脊髓前角神经元细胞功能丧失,并随后导致骨骼肌的系统范围萎缩。pps,也称为脊髓灰质炎后综合征或脊髓灰质炎后后遗症,是一种影响约25%至40%先前在脊髓灰质炎(一种神经系统的病毒感染)最初感染的急性发作后存活的人的疾患。症状包括急性或增加的肌无力、肌肉疼痛和疲劳。同样的症状也可能在非麻痹性脊髓灰质炎(npp)感染数年后发生。导致pps的确切机制尚不清楚。它与慢性疲劳综合征共有许多特征,但与该病症不同,它倾向于进行性的,并且可引起肌肉强度损失。皮层神经元是脑中大脑皮层的细胞。脑能够进行思考、感知和自主运动的复杂活动中的大多数与皮层神经元的活动有关。皮层神经元损失发生在几种神经变性疾病诸如ad中。胶质细胞,有时也称为神经胶质细胞,是维持内稳态、形成髓磷脂并为cns和pns中的神经元提供支持和保护的非神经元细胞。胶质细胞具有四种关键功能;围绕神经元并将其保持在适当的位置,为神经元供应营养和氧,使神经元彼此绝缘,并且破坏病原体并清除死亡的神经元。cns或pns中存在许多类型的胶质细胞。cns中存在的胶质细胞类型包括星形胶质细胞、少突胶质细胞、室管膜细胞、放射状胶质细胞和小胶质细胞。pns中存在的胶质细胞类型包括施旺氏细胞、卫星细胞和肠胶质细胞。星形胶质细胞,也称为星形神经胶质,是cns中最丰富类型的大胶质细胞。星形胶质细胞具有许多将神经元锚定到其血液供应的投射。它们通过移除过量离子并回收突触传递期间释放的神经递质来调节神经元的外部化学环境。星形胶质细胞可通过产生代谢物具有血管活性的物质(诸如花生四烯酸)来调节血管收缩和血管舒张。少突胶质细胞是一种细胞,其细胞膜覆盖在cns中的轴突上,形成一种称为髓磷脂的特殊的膜分化,从而产生所谓的髓鞘。髓鞘为轴突提供绝缘,这允许电信号更有效地传播。室管膜的细胞,也称为室管膜细胞,排列在脊髓和脑室系统中。这些细胞参与脑脊液(csf)的产生和分泌,并击败其纤毛以帮助csf循环并构成血液-csf屏障。它们也被认为作为神经干细胞。放射状胶质细胞在神经发生开始后由神经上皮细胞产生。它们的分化能力比神经上皮细胞的分化能力更有限。在发育中的神经系统中,放射状胶质细胞既充当神经元祖细胞又充当新生神经元在其上迁移的支架。在成熟脑中,小脑和视网膜保留了特征性的放射状胶质细胞。在小脑中,这些是调节突触可塑性的伯格曼胶质(bergmannglia)。在视网膜中,放射状müller细胞是主要的胶质细胞,并参与与神经元的双向通讯。小胶质细胞是遍布脑和脊髓的一种神经胶质细胞。作为驻留的巨噬细胞,它们在cns中充当第一和主要形式的主动免疫防御。小胶质细胞是脑整体维护的关键细胞,它们不断清除cns中的斑块、受损或不必要的神经元和突触以及感染因子。施旺氏细胞在功能上与少突胶质细胞类似,但存在于pns中而不是cns中。因此,施旺氏细胞在pns中为轴突提供髓鞘形成。它们还具有吞噬活性并且清除细胞碎片,允许pns神经元再生长。卫星胶质细胞是围绕感觉、交感和副交感神经节中的神经元的小细胞。这些细胞有助于调节外部化学环境。它们对损伤和炎症高度敏感,并且似乎有助于病理状态,诸如慢性疼痛。肠胶质细胞发现于消化系统的内在神经节中。人们认为它们在肠道系统中具有许多作用,其中一些作用与内稳态和肌肉消化过程有关。本实施方案的硫酸葡聚糖还诱导胶质细胞中髓磷脂碱性蛋白(mbp)表达的增加。mbp是一种蛋白质,在神经系统中神经的髓鞘形成过程中很重要,并且是少突胶质细胞和施旺氏细胞的髓鞘的主要成分。mbp维持髓磷脂的正确结构,并与髓磷脂膜中的脂质相互作用。对mbp的兴趣集中在其在脱髓鞘疾病(特别是ms)中的作用。轴索髓鞘形成是脊椎动物cns正常功能的必不可少的过程。在pns中,髓磷脂是由施旺氏细胞的质膜分化形成的。神经损伤后发生的轴索接触的丧失导致髓磷脂基因表达的下调(progressinneurobiology(2000),61:267-304)。受损外周神经中施旺氏细胞的分化和mbp的增加对于损伤后的再生至关重要(frontiersinneuroscience(2015),9:article298,1-13)。胶质细胞中mbp表达的增加表明本实施方案的硫酸葡聚糖充当这些细胞的分化因子(physiologicalreviews(2001),81(2):871-927,journalofneurochemistry(2013),125(3):334-361)。在一个实施方案中,胶质细胞是髓鞘形成细胞,即产生包裹在相邻神经元的一个或多个轴突周围的髓鞘的细胞。因此,在一个具体的实施方案中,胶质细胞选自施旺氏细胞和少突胶质细胞。本实施方案的硫酸葡聚糖不仅诱导对神经疾病、病症和疾患有益的cns和pns细胞的分化。如本文所呈现的实验数据表明,本实施方案的硫酸葡聚糖在对抗在神经疾病、病症和疾患例(诸如外伤性脑损伤(tbi))中观察到的代谢改变方面具有积极作用。因此,许多神经疾病、病症和疾患的特征在于与细胞能量状态和线粒体功能相关的各种代谢物的改变。此外,在许多神经疾病、病症和疾患中可见到氨基酸代谢的改变。这些代谢改变是早期细胞信号,其影响指示病理组织响应的酶活性以及基因和蛋白质表达的变化。本实施方案的硫酸葡聚糖用于积极调节受损组织中的细胞代谢,从而抑制或至少抑制导致不良结果的酶活性以及基因和蛋白质表达中任何随后的改变。更详细地,本实施方案的硫酸葡聚糖能够降低谷氨酸兴奋性毒性水平并改善代谢止血的不利变化,从而有效保护线粒体功能并提供神经保护作用。本实施方案的硫酸葡聚糖对与能量代谢和线粒体功能有关的各种化合物产生积极作用。尤其感兴趣的是作为线粒体磷酸化能力测量的腺嘌呤核苷酸的浓度和atp/adp比率。本实施方案的硫酸葡聚糖还导致氧化应激的显著降低。特别地,作为主要水溶性脑抗氧化剂的抗坏血酸和作为主要细胞内巯基(sh)供体的谷胱甘肽(gsh)的水平显著提高。另外,丙二醛(mda)水平,作为膜磷脂的多不饱和脂肪酸的终产物,因此被认为是活性氧(ros)介导的脂质过氧化的标志物,在施用硫酸葡聚糖后显示出显著的降低。上述的氧化应激标志物均表明在硫酸葡聚糖处理后抗氧化状态的恢复有所改善。硫酸葡聚糖的施用还显著降低了神经疾病、病症和疾患的急性期和慢性期的硝酸盐浓度。因此,本实施方案的硫酸葡聚糖对no介导的亚硝化应激具有积极作用。n-乙酰天冬氨酸(naa)是脑特异性代谢物,是用于监测神经疾病、病症和疾患诸如tbi后的恶化或恢复的有价值的生化标志物。naa是由天冬氨酸和乙酰coa通过天冬氨酸n-乙酰转移酶在神经元中合成的。本实施方案的硫酸葡聚糖显示出naa水平的显著改善。因此,如本文所呈现的实验数据表明,本实施方案的硫酸葡聚糖由此可预防由于患病和受损的神经系统中的氧化应激和/或谷氨酸兴奋性毒性而发生的细胞损失。通过保护细胞代谢,本实施方案的硫酸葡聚糖可用作在许多变性疾患中的保护性治疗,在所述疾患中,细胞由于缺血、氧化或外伤性损伤而逐渐丧失,所述疾患例如中风、als、mnd、ms、痴呆、tbi、sci、视网膜损伤等。这些神经疾病、病症和疾患在所有病况中发生的神经元的死亡和神经元功能损害方面具有共同的联系。在这种神经元死亡的原因中存在共同点。特别相关的是由死亡神经元释放的高水平的神经递质谷氨酸引起的毒性。本实施方案的硫酸葡聚糖诱导胶质细胞中所释放的谷氨酸的清除,并因此防止神经元间隙中毒性量的谷氨酸的积累。这将在神经元正在死亡的所有急性和慢性神经变性疾病、病症和疾患中有用。兴奋性毒性是神经细胞被神经递质(特别是谷氨酸)过度刺激损伤或杀伤的病理过程。当兴奋性神经递质谷氨酸的受体(诸如n-甲基-d-天冬氨酸(nmda)受体和α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(ampa)受体)被谷氨酸能风暴过度激活时,或者当神经元受损或死亡从而释放其谷氨酸含量时,会发生这种情况。兴奋性毒性可能涉及sci、中风、tbi、听力损失(通过噪音过度暴露或耳毒性)和cns的神经变性疾病(诸如ms、ad、als、pd、酒精中毒或酒精戒断并且尤其是过快的苯二氮杂戒断)以及hs。引起神经元周围谷氨酸浓度过高的其他常见情况是低血糖症。在正常情况下,谷氨酸浓度可在突触间隙中增加至1mm,在毫秒时间后迅速降低。当突触间隙周围的谷氨酸浓度无法降低或达到较高水平时,神经元通过称为凋亡的过程杀死自己。这种病理现象也可能在脑损伤后发生,诸如在tbi和sci中。在损伤后几分钟内,病变部位内受损的神经细胞将谷氨酸溢出到细胞外空间,其中谷氨酸可刺激突触前谷氨酸受体以增强另外的谷氨酸的释放。脑外伤或中风可引起局部缺血,其中血流减少至不足的水平。缺血之后,谷氨酸在细胞外液中积累,导致细胞死亡,这种死亡由于缺乏氧和葡萄糖而加剧。由缺血引起并涉及兴奋性毒性的生化级联被称为缺血级联。由于缺血和谷氨酸受体激活所导致的事件,在脑损伤患者中可诱发深度化学昏迷,以降低脑的代谢速率、其对氧和葡萄糖的需要并节省能量以用于主动移除谷氨酸。此外,增加的细胞外谷氨酸水平导致髓鞘和少突胶质细胞上ca2+可渗透的n-甲基-d-天冬氨酸(nmda)受体激活,从而使少突胶质细胞易受ca2+流入和随后的兴奋性毒性的影响。胞质溶胶中过量钙的破坏性结果之一是通过裂解的半胱天冬酶加工引发凋亡。胞质溶胶中过量钙的另一个破坏性结果是线粒体通透性转换孔(当细胞器吸收过多钙时在线粒体膜中开放的孔)的开放。孔的开放可引起线粒体膨胀并释放活性氧物质和各种可导致凋亡的蛋白质。孔还可引起线粒体释放更多的钙。另外,三磷酸腺苷(atp)的产生可能停止,并且实际上atp合酶可能开始水解atp而不是产生它。由脑外伤引起的atp产生不足可消除某些离子的电化学梯度。谷氨酸转运蛋白需要维持这些离子梯度以从细胞外空间移除谷氨酸。离子梯度的丧失不仅导致谷氨酸摄取的停止,而且导致转运蛋白的逆转。神经元和星形胶质细胞上的na+-谷氨酸转运蛋白可逆转它们的谷氨酸转运,并开始分泌浓度能够诱导兴奋性毒性的谷氨酸。这导致谷氨酸的积累,并进一步破坏谷氨酸受体的激活。在分子水平上,钙内流不是导致兴奋性毒性诱导的凋亡的唯一因素。最近,已经注意到,由谷氨酸暴露或缺氧/缺血条件触发的突触外nmda受体激活激活了camp响应元件结合(creb)蛋白的关闭,这继而引起线粒体膜电位的丧失和凋亡。因此,通过本实施方案的硫酸葡聚糖激活胶质细胞中的谷氨酸转运蛋白以防止或至少抑制毒性水平的谷氨酸积累,将有效地保护周围神经元免于谷氨酸兴奋性毒性。结果,本实施方案的硫酸葡聚糖保护神经元免受损伤和细胞死亡,否则这是谷氨酸兴奋性毒性的结果。而且,当任何组织(包括cns和pns)以及对氧/能量供应的变化尤其敏感的脑受损或患病时,对细胞的能量供应受到损害。结果,组织(例如cns、pns或脑)中的细胞无法有效地发挥作用。因此,通过本实施方案的硫酸葡聚糖降低氧化应激,即保护线粒体能量供应,允许存活细胞更有效地发挥作用,并且还将保护受损的神经元免于因凋亡而死亡。因此,本实施方案的硫酸葡聚糖在恢复线粒体相关的能量代谢中是有效的,并对嘌呤和嘧啶核苷酸三磷酸的浓度具有积极作用,该线粒体相关的能量代谢在遭受脑损伤(诸如严重tbi(stbi))的受试者中严重失衡。特别地,atp水平仅比健康对照受试者的值低16%,而在未治疗的stbi受试者中发现35%的降低。值得注意的是,用硫酸葡聚糖处理的stbi受试者中的naa浓度仅比健康对照受试者的值低16%,而stbi受试者显示该化合物的值低48%。这一发现再次强有力地证实了naa的内稳态与正确的线粒体能量代谢之间的严格联系,并强调了能够对线粒体功能产生积极作用的药物干预措施的重要性。硫酸葡聚糖施用所产生的脑代谢的总体改善还涉及烟碱辅酶以及游离coa-sh和coa-sh衍生物的代谢。这意味着尽管遭受了stbi,硫酸葡聚糖治疗的受试者仍具有准正常的辅酶,以确保正确的氧化还原反应并允许tca循环的良好功能。脑代谢的上述改善进一步有助于其他显著的硫酸葡聚糖作用,即消除谷氨酸兴奋性毒性。另外,硫酸葡聚糖影响含硫氨基酸。这种作用可能与含有s原子的硫酸葡聚糖分子有关。增加此原子的生物利用度可能会导致这些氨基酸的生物合成净增加,其中之一(met)对于甲基化反应和所谓的甲基循环至关重要。所记录的进一步的积极作用是在接受硫酸葡聚糖施用的stbi受试者中抗氧化剂的增加和氧化/亚硝化应激的生化信号的减少。与此相关的是,硫酸葡聚糖的作用在stbi后第7天比在stbi后第2天更明显。这有力地表明,由硫酸葡聚糖施用引起的脑代谢的总体改善不是暂时现象。本实施方案的硫酸葡聚糖还具有竞争低聚淀粉样蛋白-β与prpc之间的蛋白-蛋白相互作用的亲和力,这将在患有ad、朊蛋白病或淀粉样变性的受试者中具有有益作用。本文所呈现的基因表达数据表明,本实施方案的硫酸葡聚糖在施旺氏细胞、神经元和人脐静脉内皮细胞(huvec)中具有以下作用:防止凋亡;诱导血管生成(在huvec中);增加细胞迁移和运动;增加细胞存活力和存活;以及诱导细胞分化。来自huvec细胞模型的结果表明,本实施方案的硫酸葡聚糖可防止细胞损伤并且诸如在中风或其他缺血性疾患之后促进受损或患病组织中新血管的发育。关键分子途径的分析表明,在施旺氏细胞中,硫酸葡聚糖降低了氧化应激对线粒体的影响并增加了有害性谷氨酸的摄取。因此,基因表达数据证实了在tbi的动物模型中看到的结果。特别令人感兴趣的是发现本实施方案的硫酸葡聚糖抑制复合物iii。复合物iii的抑制继而导致线粒体氧化应激的降低。此外,本实施方案的硫酸葡聚糖还诱导以下蛋白质复合物的表达:钙调蛋白(calm),其是多功能中间钙结合信使蛋白质;gβ-γ复合物(gβγ),其是由一个gβ和一个gγ亚基组成的紧密结合的二聚体g蛋白复合物;代谢型谷氨酸受体7(grm7);以及与c激酶-1(pick1)相互作用的蛋白质。这种蛋白质复合物继而抑制谷氨酸从突触前神经元的释放,如图19中示意性所示。施旺氏细胞中的结果表明,本实施方案的硫酸葡聚糖可防止由于与例如神经变性疾病和tbi相关的氧化应激和谷氨酸兴奋性毒性而在患病或受损神经系统中发生的细胞损失。来自神经元的结果表明,本实施方案的硫酸葡聚糖能够预防和抑制凋亡、预防淀粉样蛋白-β和路易氏体(lewybody)病及其对线粒体片段化和功能异常的负面作用以及随后的损害和抑制脂肪酸氧化。本实施方案的硫酸葡聚糖还改善线粒体功能,降低h2o2和活性氧物质的线粒体水平。对由硫酸葡聚糖调节的基因的上游调节因子的分析表明,本实施方案的硫酸葡聚糖增强了现有生长因子对细胞的作用。如表12至表14所示,本实施方案的硫酸葡聚糖能够通过增加几种生长因子的激活或通过降低它们的抑制来调节它们的作用。这意味着本实施方案的硫酸葡聚糖在其中这些生长因子的活性增加或抑制降低将对患者有益的疾病、病症或疾患中具有潜在用途。此类疾病、病症和疾患的非限制性示例包括als;中风;sci;抑郁症和其他精神病症,诸如情感病症和躁郁症;和代谢紊乱。一种假设是硫酸葡聚糖与生长因子分子结合并促进与其受体的结合。这一假说也得到了以下观察结果的支持:硫酸葡聚糖诱导的差异基因表达在其中正常对照培养基已经含有肝素的huvec中相比于在其中正常对照培养基不含肝素的施旺氏细胞中相对较小。这一作用机制也解释了为什么硫酸葡聚糖主要在tbi的急性期有效(此时存在生长因子),而在后期的初始修复尝试已减弱时作用较差。因此,本实施方案的硫酸葡聚糖的至少一些治疗作用可能取决于现有的修复机制,这种修复机制被其放大。在这种情况下,通常建议在任何神经变性疾病、病症或疾患中,在组织中存在足够的修复潜力时的疾病、病症或疾患的早期给予硫酸葡聚糖。通过保护细胞代谢,硫酸葡聚糖在细胞由于缺血、氧化或外伤性损伤而逐渐损失的许多变性疾患中可能是有用的保护性治疗。此类变性疾患的非限制性但例示性的示例包括中风、als、ms、痴呆、tbi、sci、视网膜损伤、ad等。本实施方案的硫酸葡聚糖可帮助受损组织恢复一些丧失的功能,因为它增强了残余的内在修复机制。因此,基因表达数据证实了本实施方案的硫酸葡聚糖通过促进血运重建、减少继发性组织损伤并促进修复在cns和pns受损状态中的潜在治疗用途,以及对神经变性疾病、病症或疾患的潜在治疗用途,其中它可促进神经元存活、分化和最终修复。本实施方案的硫酸葡聚糖的另一令人感兴趣的作用是其影响细胞粘附。细胞粘附主要在神经元和施旺氏细胞中受到影响,其中本实施方案的硫酸葡聚糖促进细胞脱离和运动。对细胞粘附的作用主要是由于金属蛋白酶型酶的表达。该发现还将解释本实施方案的硫酸葡聚糖的抗瘢痕形成作用。结果表明,通过激活降解酶,由本实施方案的硫酸葡聚糖介导的抗瘢痕形成作用有助于组织重塑并阻断受损组织中的纤维发生(瘢痕形成)信号。参见表10至表11,由本实施方案的硫酸葡聚糖激活的金属蛋白酶型酶通过溶解构成瘢痕的纤维分子而特异性地起作用。这些酶由迁移到受损组织中的细胞释放。因此,通过使这些细胞更具流动性、降低其粘附性,本实施方案的硫酸葡聚糖允许它们更好地迁移、释放瘢痕溶解酶并重塑组织以更好地修复。因此,本实施方案的硫酸葡聚糖的抗瘢痕形成作用表明了其在治疗纤维增生(瘢痕形成)疾患的潜在用途。这些包括例如青光眼、增生性玻璃体视网膜病变、脑和脊柱外伤性损伤、脑中蛛网膜下腔出血、侵入性手术程序、手术粘连、肩袖损伤、灼烧、重建手术、溃疡性疾患(糖尿病)等。其他纤维化疾病和疾患包括:肺中的纤维化,诸如肺纤维化、囊性纤维化、特发性肺纤维化、进行性大块纤维化和癌症治疗后的辐射诱导的肺损伤;肝脏中的纤维化,诸如肝硬化和胆管闭锁;心脏中的纤维化,诸如心房纤维化、心肌内膜纤维化、陈旧性心肌梗塞;脑中的纤维化,诸如胶质瘢痕;胰腺炎;关节纤维化;克罗恩氏病(crohn'sdisease);迪皮特朗氏挛缩症;瘢痕瘤;纵隔纤维化;骨髓纤维化;佩罗尼氏病(peyronie'sdisease);肾源性系统纤维化;腹膜后纤维化;硬皮病或系统性硬化。纤维化也可能与器官移植相关地发生,所述器官诸如肾、肺、肝、心脏等,以及与细胞疗法和细胞移植相关地发生,所述细胞诸如朗格汉斯岛细胞(isletoflangerhans)、肝细胞、胰岛素产生细胞、干细胞、祖细胞等。有趣的是,基因表达数据还显示,本实施方案的硫酸葡聚糖激活称为核心蛋白聚糖的天然瘢痕减少分子的产生,该分子通过“清除”刺激成纤维细胞产生瘢痕的生长因子而进一步阻断瘢痕产生。核心蛋白聚糖是平均分子量为90至140kd的糖蛋白。它属于富含亮氨酸的小蛋白聚糖(slrp)家族,并且由含有亮氨酸重复的蛋白质核心和由硫酸软骨素或硫酸皮肤素组成的葡糖胺聚糖(gag)链组成。它通过核心蛋白聚糖i型胶原结合区与i型胶原原纤维结合。核心蛋白聚糖充当转化生长因子β1或2(tgf-β1/2)拮抗剂并减少瘢痕形成。报告显示,在急性瘢痕形成中,核心蛋白聚糖的主要作用是通过中和tgf-β1/2抑制炎性纤维化来抗纤维发生。核心蛋白聚糖还直接与胶原结合,其功能之一是在伤口愈合期间影响胶原的组织。核心蛋白聚糖先前已被描述在脑病变、脑积水和慢性脊髓创伤模型中抑制瘢痕形成。核心蛋白聚糖还诱导青光眼模型中现有小梁网瘢痕的纤维蛋白溶解。综合考虑,本实施方案的硫酸葡聚糖的抗瘢痕形成作用表明了用于治疗瘢痕形成问题的所有临床疾患的潜力。硫酸葡聚糖应对老瘢痕和新瘢痕都有效。这在实验数据中得到证实,该实验数据显示本实施方案的硫酸葡聚糖能够诱导青光眼的小梁网中已经建立的瘢痕成分的溶解。这是本实施方案的硫酸葡聚糖的显著优点,因为它不仅科用于抑制或至少抑制纤维化和有害的瘢痕形成,而且可溶解已经形成的瘢痕。这意味着本实施方案的硫酸葡聚糖允许瘢痕溶解和组织重塑以更好地修复。在模拟复杂组织和疾病生物学以及一般组织生物学的一组基于人原代细胞的测定中评估硫酸葡聚糖。该测定的结果表明,硫酸葡聚糖在炎症和伤口愈合生物学的背景下在调节免疫激活和/或免疫消退响应中起作用。炎性标志物的调节表明硫酸葡聚糖在治疗多种慢性和急性炎性疾患和疾病(包括炎性成分,诸如als)中的效用。最初,在损伤后,先天/促炎性响应和获得性免疫响应的选定成分被上调,以维持针对外来病原体的防御、清除存在于损伤部位的组织碎片并且协调与伤口响应相关的组织重塑、细胞增殖和血管生成过程。然而,为了使伤口正常愈合,必须调节或关闭这种最初的炎性响应,以便允许基质重建、再细胞化和组织重塑。此类免疫消退活性由硫酸葡聚糖诱导,包括mmp-1、par-1和upar的激活,表明诱导的免疫消退在治疗由外伤(包括神经外伤)损伤的组织中具有效用,否则所述外伤将导致有害的纤维化形成。如实验数据所示,硫酸葡聚糖在炎症消退中的作用表明,硫酸葡聚糖将可用于预防、治疗或至少抑制自身免疫性疾病,并且特别是影响中枢和/或外周神经系统的自身免疫性疾病。硫酸葡聚糖的炎症消退在阻断纤维发生方面也是重要的。此外,从实验数据中看出,炎症的消退和小胶质细胞响应的抑制在神经变性疾病、病症或疾患中也是重要的。因此,硫酸葡聚糖或其药学上可接受的衍生物将可用于预防、治疗或至少抑制神经炎症和神经炎性疾患。此类神经炎性疾患的示例包括pd、als、ms、adem、脊髓炎和gds。总之,硫酸葡聚糖似乎使受伤或患病后组织中存在的炎症正常化并消退,并且这些结果由此与基因阵列和动物研究中所见的硫酸葡聚糖的作用一致。通常,神经系统的功能取决于神经细胞的数量、神经细胞的健康能量代谢以及神经细胞之间的健康连接。神经变性疾病和病症以及引起神经变性的损伤通常具有不同的触发因素和原因,但都导致相同的最终结果,即神经变性。此类疾病、病症或损伤的功能性作用通常仅在相对大量的神经细胞死亡后才能看到,而这些疾病或病症的触发因素可能在症状出现之前已存在数年。因此,需要一种新的方法来治疗或抑制神经变性。此类方法应涉及增强神经系统的可行功能,包括神经细胞的健康能量代谢以及神经细胞之间的健康连接。此外,应通过减少导致神经元死亡的触发因素来防止或至少减缓进一步的神经变性,并且即使在存在触发因素时防止进一步病理作用。此外,应增强神经系统的再生潜能。因此,存在神经元凋亡的多种触发因素,这些触发因素均促成神经变性和损伤期间的神经元损失。这些触发因素包括导致谷氨酸兴奋性毒性的神经递质调节异常和导致线粒体功能异常的氧化应激,从而限制向神经元的能量供应。此外,神经丝调节异常导致活动力降低和神经元存活所需因子的供应受限。进一步的触发因素包括引起继发性细胞损伤和瘢痕形成的炎性介质的释放。此外,血管缺陷在神经变性疾患中很常见。谷氨酸在神经元中产生,并且对于支持神经元中学习和记忆的信号传导机制至关重要。释放的过量谷氨酸在健康脑组织中被胶质细胞清除以防止毒性水平。硫酸葡聚糖诱导胶质细胞增加谷氨酸摄取,而神经元中的谷氨酸产生不被硫酸葡聚糖改变。因此,学习和记忆所需的谷氨酸不受硫酸葡聚糖施用的影响,而有害的毒性量谷氨酸被胶质细胞清除。因此,硫酸葡聚糖减弱导致谷氨酸兴奋性毒性的神经递质的调节异常。神经变性中的氧化应激导致线粒体功能异常,从而限制向神经元的能量供应。硫酸葡聚糖减少诱导氧化应激的分子(包括淀粉样蛋白-β和路易氏体)的产生,并降低氧化应激。因此,硫酸葡聚糖防止由氧化应激诱导的神经元死亡,并防止神经元中线粒体功能异常。这意味着硫酸葡聚糖在氧化应激存在下促进线粒体功能的正常化,并且在此类氧化应激存在下防止神经元中的能量危机。因此,硫酸葡聚糖减弱神经变性中的氧化应激,否则所述氧化应激将导致线粒体功能异常。神经变性的另一个触发因素是神经丝调节异常,这导致活动力降低和存活因子的供应受限。硫酸葡聚糖增强神经元中存在的生长因子的作用、增加神经细胞的迁移和运动、减少变性相关蛋白产物的产生并诱导细胞分化。因此,硫酸葡聚糖减弱了神经丝调节异常。神经变性还诱导引起继发性细胞损伤和瘢痕形成的炎性介质的释放。此类瘢痕形成是由炎性细胞因子(特别是tgf-β)驱动的。硫酸葡聚糖诱导金属肽酶表达、诱导天然抗瘢痕形成分子核心蛋白聚糖的表达并抑制tgf-β活性。此外,即使在存在过量tgf-β的情况下,硫酸葡聚糖也抑制免疫细胞粘附、细胞聚集、细胞激活和纤维化。因此,硫酸葡聚糖减弱了由释放炎性介质引起的负面作用,包括瘢痕形成。硫酸葡聚糖还起到抑制纤维发生以及激活纤维蛋白溶解的作用,这共同导致在硫酸葡聚糖减弱或甚至溶解瘢痕方面所见的有益作用。硫酸葡聚糖保护huvec免受凋亡、血管生成诱导和内皮细胞的迁移和运动增加。因此,硫酸葡聚糖增强由神经变性疾病、病症或损伤引起的低氧组织中的生理修复响应,但不影响正常健康脉管系统。因此,本实施方案的一个方面涉及一种诱导细胞分化的方法,该细胞选自由以下项组成的组:胶质细胞和神经元。该方法包括使细胞与硫酸葡聚糖或其药学上可接受的衍生物接触,以诱导细胞分化。在一个实施方案中,该方法是体外方法。在这种情况下,使细胞接触包括使细胞与硫酸葡聚糖或其药学上可接受的衍生物体外接触。因此,在体外用硫酸葡聚糖或其药学上可接受的衍生物处理细胞并与其相互作用。在一个实施方案中,神经元获自干细胞,即通过使干细胞分化成可用硫酸葡聚糖或其药学上可接受的衍生物处理和进一步分化的神经元。这种体外方法可能在研究和诊断中具有重要用途,在该领域中,神经元和/或胶质细胞在体外培养。可以将硫酸葡聚糖或其药学上可接受的衍生物添加到此类神经元或胶质细胞培养物中,例如添加到培养基中,以便如本文所述诱导细胞的分化。该方法也可以是离体方法,其中神经元和/或胶质细胞已经从受试者中提取并且在受试者体外与硫酸葡聚糖或其药学上可接受的衍生物接触。可将在上述体外或离体方法中用硫酸葡聚糖或其药学上可接受的衍生物处理以诱导分化的神经元和/或胶质细胞移植到受试者体内。然后分化的神经元和/或胶质细胞应在受试者体内发挥其期望的功能。在该方法中,受试者可能患有如本文进一步所述的神经疾病。在另选的实施方案中,将硫酸葡聚糖或其药学上可接受的衍生物施用于受试者,诸如患有神经疾病、病症或疾患的受试者。然后,硫酸葡聚糖或其药学上可接受的衍生物将与受试者体内的神经元和/或胶质细胞接触以诱导细胞分化。在该实施方案中,该方法是体内方法。本实施方案的另一方面涉及用于诱导选自由胶质细胞和神经元组成的组的细胞的分化的硫酸葡聚糖或其药学上可接受的衍生物。在一个实施方案中,所述硫酸葡聚糖或其药学上可接受的衍生物用于在患有神经疾病、病症或疾患的受试者中诱导细胞分化。在一个特定的实施方案中,所述硫酸葡聚糖或其药学上可接受的衍生物用于在患有神经疾病、病症或疾患的受试者中诱导细胞分化,该神经疾病、病症或疾患选自由以下项组成的组:神经变性疾病、病症或疾患;脱髓鞘疾病、病症或疾患;神经缺血性疾病、病症或疾患;神经肌肉疾病、病症或疾患;外伤性神经损伤和术后神经疾患。在一个实施方案中,受试者是患有选自由ad、pd、hd和als组成的组的神经变性疾病、病症或疾患的人受试者。在一个实施方案中,受试者是患有脱髓鞘疾病、病症或疾患的人受试者,该脱髓鞘疾病、病症或疾患选自由ms、adem、cns神经病、cpm、脊髓病、白质脑病、脑白质营养不良、gbs、周围神经病、夏科-马利-杜斯病组成的组,优选选自由ms、adem、cpm和gbs组成的组。硫酸葡聚糖或其药学上可接受的衍生物也可以或替代地用于在其他类型的神经疾病、病症或疾患中诱导细胞分化。此类其他类型的神经疾病、病症或疾患的非限制性示例包括:神经缺血性疾病,诸如中风、脑缺血性疾患和严重肢体缺血(cli);神经肌肉病症,诸如als、肉毒中毒、先天性肌无力综合征、先天性肌病、痉挛-肌颤综合征、脑性麻痹、肌酸激酶升高、肌束颤动、包涵体肌炎、兰伯特-伊顿综合征、线粒体肌病、运动神经元疾病、肌肉病症、肌营养不良、重症肌无力、强直性肌营养不良、神经肌肉接头病症、神经肌强直、周围神经病和多发性肌炎;外伤性神经损伤和术后神经疾患。本实施方案的另一方面涉及用于治疗、抑制或预防受试者中的谷氨酸兴奋性毒性的硫酸葡聚糖或药学上可接受的衍生物。在一个实施方案中,硫酸葡聚糖或其药学上可接受的衍生物在治疗、抑制或预防受试者的神经元中的谷氨酸兴奋性毒性方面是有效的。在一个具体的实施方案中,受试者患有如本文先前所述引起神经元的细胞损伤和/或细胞死亡的神经疾病、病症或疾患。该方面还涉及治疗、抑制或预防谷氨酸兴奋性毒性的方法。该方法包括向受试者施用硫酸葡聚糖或其药学上可接受的衍生物以治疗、抑制或预防谷氨酸兴奋性毒性本实施方案的其他方面涉及硫酸葡聚糖或其药学上可接受的衍生物,其用于保护神经元免受由神经疾病、病症或疾患引起的氧化应激,用于改善由神经疾病、病症或疾患引起的神经元中的代谢止血的不利变化,保护患有神经疾病、病症或疾患的受试者的神经元中的线粒体功能和线粒体能量代谢。因此,硫酸葡聚糖或其药学上可接受的衍生物可用于治疗、抑制或预防本文所述的神经疾病、病症或疾患。硫酸葡聚糖或其药学上可接受的衍生物也可用于治疗、抑制或预防对神经元和cns或pns的缺血、氧化或外伤性损害,诸如中风、als、mnd、ms、痴呆、tbi、sci、视网膜损伤等。另一个方面涉及硫酸葡聚糖或其药学上可接受的衍生物,其用于治疗、抑制或预防受试者中的纤维化,并且特别地用于治疗或抑制(诸如通过溶解)患有纤维化或纤维化疾病、病症或疾患的受试者中已形成的瘢痕。具有抗瘢痕形成作用的本实施方案的硫酸葡聚糖在伤口处理和其中需要溶解已形成的瘢痕以便伤口能够正确愈合的组织重塑中将是有效的。本实施方案的硫酸葡聚糖的这种抗瘢痕形成作用被认为是先前描述的硫酸葡聚糖作用机制包括例如抑制细胞粘附、诱导细胞运动、诱导金属蛋白酶和瘢痕溶解酶以及通过诱导核心蛋白聚糖抑制tgfβ(特别是tgfβ1)的结果。用本实施方案的硫酸葡聚糖获得的后一作用进一步与通过诱导核心蛋白聚糖防止或至少抑制纤维化和瘢痕形成有关。另一方面涉及用于治疗、抑制或预防受试者中(特别是患有引起神经炎症的神经疾病、病症或疾患的受试者中)的神经炎症的硫酸葡聚糖或其药学上可接受的衍生物。本实施方案的相关方面定义了硫酸葡聚糖或其药学上可接受的衍生物在制备用于本文所公开的各种医学应用(例如用于治疗、抑制或预防如本文所公开的疾病、病症或疾患中的任一种)的药物中的用途。其他方面涉及针对硫酸葡聚糖或其药学上可接受的衍生物的各种用途治疗、抑制或预防上述各种疾病、病症或疾患的方法。在此类方法中,将硫酸葡聚糖或其药学上可接受的衍生物施用于受试者以治疗、抑制或预防本文所公开的疾病、病症或疾患。在下文中,提及硫酸葡聚糖的(平均)分子量和硫含量也适用于硫酸葡聚糖的任何药学上可接受的衍生物。因此,硫酸葡聚糖的药学上可接受的衍生物优选具有如以下实施方案中所讨论的平均分子量和硫含量。在本实施方案的优选范围之外的硫酸葡聚糖被认为具有较差的作用和/或对细胞或受试者产生负面的副作用。例如,与具有较低平均分子量的硫酸葡聚糖相比,分子量超过10,000da(10kda)的硫酸葡聚糖通常具有较低的作用与副作用的关系。这意味着,与平均分子量在优选范围内的硫酸葡聚糖分子相比,对于较大的硫酸葡聚糖分子(>10,000da),可安全施用于受试者的硫酸葡聚糖的最大剂量更低。因此,当将硫酸葡聚糖体内施用于受试者时,此类较大的硫酸葡聚糖分子在临床应用中不太合适。硫酸葡聚糖是硫酸化的多糖,并且特别是硫酸化的葡聚糖,即由许多葡萄糖分子制成的多糖。如本文所定义的平均分子量指示单个硫酸化多糖可具有不同于该平均分子量的分子量,但该平均分子量代表硫酸化多糖的平均分子量。这进一步暗示,对于硫酸葡聚糖样品,在该平均分子量附近将存在分子量的自然分布。硫酸葡聚糖的平均分子量或更正确的重均分子量(mw)通常使用间接方法诸如凝胶排阻/渗透色谱、光散射或粘度来确定。使用此类间接方法确定平均分子量将取决于许多因素,包括色谱柱和洗脱液的选择、流速、校准程序等。重均分子量(mw):通常用于对分子大小而不是数值敏感的方法,例如光散射和尺寸排阻色谱法(sec)。如果假定为正态分布,则mw的每一侧上的重量相同,即样品中分子量低于mw的硫酸葡聚糖分子的总重量等于样品中分子量大于mw的硫酸葡聚糖分子的总重量。参数ni指示样品或批次中分子量为mi的硫酸葡聚糖分子的数量。在一个实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有等于或小于10,000da的mw。在一个具体实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有在2,000da至10,000da区间内的mw。在另一个实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有在2,500da至10,000da区间内、优选在3,000da至10,000da区间内的mw。在一个具体实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有在3,500da至9,500da区间内(诸如3,500da至8,000da区间内)的mw。在另一个具体实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有在4,500da至7,500da区间内(诸如4,500da至5,500da区间内)的mw。因此,在一些实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有等于或小于10,000da、等于或小于9,500da、等于或小于9,000da、等于或小于8,500da、等于或小于8,000da、等于或小于7,500da、等于或小于7,000da、等于或小于6,500da、等于或小于6,000da、或等于或小于5,500da的mw。在一些实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有等于或大于1,000da、等于或大于1,500da、等于或大于2,000da、等于或大于2,500da、等于或大于3,000da、等于或大于3,500da、等于或大于4,000da、或等于或大于4,500da的mw。这些实施方案中的任一者可与上文提出的限定mw上限的实施方案中的任一者组合,诸如与等于或小于10,000da的上限组合。在一个具体实施方案中,如上提出的硫酸葡聚糖或其药学上可接受的衍生物的mw是平均mw,并且优选地通过凝胶排阻/渗透色谱法、尺寸排阻色谱法、光散射法或基于粘度的方法确定。数均分子量(mn):通常通过端基测定法例如核磁共振(nmr)光谱法或色谱法得出。如果假定为正态分布,则在mn的每一侧可发现相同数量的硫酸葡聚糖分子,即样品中分子量低于mn的硫酸葡聚糖分子的数量等于样品中分子量高于mn的硫酸葡聚糖分子的数量。在一个实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有如通过nmr光谱法测量的在1,850至3,500da区间内的mn。在一个具体实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有如通过nmr光谱法测量的在1,850da至2,500da区间内、优选在1,850da至2,300da区间内(诸如在1,850da至2,000da区间内)的mn。因此,在一些实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有等于或小于3,500da、等于或小于3,250da、等于或小于3,000da、等于或小于2,750da、等于或小于2,500da、等于或小于2,250da、或等于或小于2,000da的mn。另外,硫酸葡聚糖或其药学上可接受的衍生物具有等于或大于1,850da的mn。在一个实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有在2.5至3.0区间内的平均硫酸根数/葡萄糖单元。在一个具体实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有在2.5至2.8区间内、优选在2.6至2.7区间内的平均硫酸根数/葡萄糖单元。在一个实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有在4.0至6.0区间内的平均葡萄糖单元数。在一个具体实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有在4.5至5.5区间内、优选在5.0至5.2区间内的葡萄糖单元的平均数。在一个实施方案中,硫酸葡聚糖或其药学上可接受的衍生物具有如通过nmr光谱法测量的在1,850至3,500da区间内的mn、在2.5至3.0区间内的平均硫酸根数/葡萄糖单元,并且硫酸葡聚糖的葡萄糖单元中c2位置的平均硫酸化度为至少为90%。在一个实施方案中,硫酸葡聚糖具有约5.1的葡萄糖单元的平均数、在2.6至2.7区间内的平均硫酸根数/葡萄糖单元以及在1,850da至2,000da区间内的mn。在一个实施方案中,硫酸葡聚糖的药学上可接受的衍生物是硫酸葡聚糖钠盐。在一个具体实施方案中,硫酸葡聚糖钠盐具有约5.1的葡萄糖单元平均数、在2.6至2.7区间内的平均硫酸根数/葡萄糖单元以及在2,100da至2,300da区间内的mn(包括na+抗衡离子)。在一个实施方案中,硫酸葡聚糖具有5.1的葡萄糖单元平均数、2.7的平均硫酸根数/葡萄糖单元、如通过nmr光谱法测得的约1,900至1,950da的不含na+的平均mn和如通过nmr光谱法测得的约2,200至2,250da的含na+的平均mn。根据本实施方案的硫酸葡聚糖可被提供为硫酸葡聚糖的药学上可接受的衍生物,诸如硫酸葡聚糖的药学活性衍生物。此类药学上可接受的衍生物包括硫酸葡聚糖的药学上可接受的盐和药学上可接受的溶剂化物,例如钠盐或钾盐。受试者优选为哺乳动物受试者,更优选为灵长类并且特别是人受试者。然而,硫酸葡聚糖或其药学上可接受的衍生物也可用于兽医应用。动物受试者的非限制性示例包括灵长类、猫、狗、猪、马、小鼠、大鼠。硫酸葡聚糖或其药学上可接受的衍生物优选通过向受试者注射并且特别是通过静脉内(i.v.)注射、皮下(s.c.)注射或(i.p.)腹膜内注射、优选i.v.或s.c.注射来施用。可使用的其他肠胃外施用途径包括肌内和关节内注射。替代地或另外地,硫酸葡聚糖或其药学上可接受的衍生物的注射可直接在例如将发生靶作用的受试者体内的组织或器官或其他部位中进行。替代地或另外地,硫酸葡聚糖或其药学上可接受的衍生物可鞘内施用。例如,可将硫酸葡聚糖或其药学上可接受的衍生物与合适的水性载体或溶液一起注射到椎管或蛛网膜下腔中以使其到达脑脊液(csf)。另一施用途径是眼内施用。本实施方案的硫酸葡聚糖或其药学上可接受的衍生物优选被配制成具有选定溶剂或赋形剂的注射水溶液。溶剂有利地是水性溶剂,并且特别是缓冲溶液。此类缓冲溶液的非限制性示例是柠檬酸缓冲液,诸如柠檬酸一水合物(cam)缓冲液或磷酸盐缓冲液。例如,可将本实施方案的硫酸葡聚糖溶解在盐水(诸如0.9%nacl盐水)中,并且随后任选地用75mmcam缓冲,并使用氢氧化钠将ph调节至约5.9。非缓冲溶液也是可能的,包括注射水溶液,诸如盐水,即nacl(水溶液)。此外,如果需要缓冲溶液,可使用cam以外的其他缓冲系统。本实施方案不限于注射,并且可替代地使用其他施用途径,包括口服、经鼻、经颊、经直肠、经皮肤、经气管、经支气管或局部施用。然后将活性化合物硫酸葡聚糖与根据特定施用途径选择的合适的赋形剂或载体一起配制。硫酸葡聚糖或其药学上可接受的衍生物的合适剂量范围可根据应用而变化,诸如体外对体内、受试者的大小和体重、受试者所治疗的疾患以及其他考量。特别是对于人受试者,可能的剂量范围可以是1μg/kg至100mg/kg体重,优选10μg/kg至50mg/kg体重。在优选的实施方案中,硫酸葡聚糖或其药学上可接受的衍生物被配制成以在0.05至50mg/kg受试者体重、优选0.05或0.1至40mg/kg受试者体重并且更优选0.05或0.1至30mg/kg、或0.1至25mg/kg或0.1至15mg/kg、或0.1至10mg/kg受试者体重范围内的剂量施用。硫酸葡聚糖或其药学上可接受的衍生物的施用不一定限于治疗或抑制本发明的疾病、病症或疾患,而是可替代地或另外地用于预防。换句话讲,可将硫酸葡聚糖或其药学上可接受的衍生物施用于将经历可能引起神经损伤或损害和/或纤维化的医疗程序(诸如手术)的受试者。硫酸葡聚糖或其药学上可接受的衍生物还可用于预防、抑制或减轻即将经历医疗程序(诸如手术)和/或纤维化的受试者的术后神经并发症和疾患。硫酸葡聚糖或其药学上可接受的衍生物可在单次施用场合诸如以单次推注的形式施用。该推注剂量可相当快地注射至受试者,但有利地随时间输注,使得硫酸葡聚糖溶液在几分钟的时间内(诸如在5至10分钟内)输注至患者。替代地,硫酸葡聚糖或其药学上可接受的衍生物可在治疗期间的多个(即至少两个)场合施用。硫酸葡聚糖或其药学上可接受的衍生物可与其他活性剂一起依次、同时或以包含硫酸葡聚糖或其药学上可接受的衍生物和至少一种其他活性剂的组合物的形式施用。该至少一种活性剂可选自用于上述疾病、病症或疾患中的任一种的任何试剂。该至少一种活性剂还可以是细胞疗法中的细胞形式,诸如干细胞,包括但不限于胚胎干细胞(esc)和间充质基质细胞(msc)。例如,已经对干细胞对(诸如帕金森病、ms、als和阿尔茨海默氏病中)脑变性动物模型的作用进行了研究。此外,已经对tbi病例中干细胞的使用进行了临床和动物研究。如实验数据所示,硫酸葡聚糖或其药学上可接受的衍生物对细胞具有体外有益作用。例如,硫酸葡聚糖或其药学上可接受的衍生物保护细胞免受氧化应激、恢复细胞中的代谢止血(这有益于细胞中的能量代谢)并且可充当细胞的分化因子。硫酸葡聚糖或其药学上可接受的衍生物的这些有益作用也可在其他类型的细胞疗法中使用,即不必限于干细胞疗法。此类其他类型的细胞疗法的非限制性但例示性的示例包括心肌细胞、肝细胞、结缔组织细胞、视神经细胞、淋巴细胞、巨噬细胞、胶质细胞、施旺氏细胞、神经元等。在此类情况下,在施用于受试者之前,细胞可用硫酸葡聚糖或其药学上可接受的衍生物体外处理。替代地或另外地,细胞可与硫酸葡聚糖或其药学上可接受的衍生物一起施用。此外,用硫酸葡聚糖或其药学上可接受的衍生物体外或离体处理组织和器官可用于受益于从本实施方案的硫酸葡聚糖的积极作用(例如保护免受氧化应激和恢复代谢止血)中获益。此外,在移植后,另外地或作为替代,用硫酸葡聚糖或其药学上可接受的衍生物处理细胞、组织和器官将是可能的。在一个实施方案中,有利地在引起疾病、病症或疾患的损伤(诸如tbi)后的早期或急性状态下,或在疾病、病症或疾患诊断后的早期或急性状态下,将硫酸葡聚糖或其药学上可接受的衍生物施用于受试者。这是特别有利的,因为如本实施方案的硫酸葡聚糖所看到的一些有益作用是其增强和放大cns和pns中内在修复机制的能力。这特别与神经疾病的治疗或抑制有关。然而,如通过从本实施方案的硫酸葡聚糖看到的抗瘢痕形成作用表明,硫酸葡聚糖在溶解已经存在的瘢痕组织和元件中也将是有效的。因此,对于纤维化和纤维化疾患,本实施方案的硫酸葡聚糖在晚期或慢性状态期间也将具有治疗作用。实施例在以下实施例中,使用硫酸葡聚糖钠盐,在本文中称为低分子量硫酸葡聚糖(lmw-ds)(tikomedab,sweden,wo2016/076780)。实施例1本研究的目的是使用两种浓度为0.01和0.1mg/ml的lmw-ds评价lmw-ds对三种细胞类型即大脑皮层神经元、运动神经元和施旺氏细胞的细胞存活和分化蛋白表达的作用。材料与方法细胞培养所有细胞均在适合该细胞类型的专门培养基中培养。用特定的粘附因子处理塑料器皿以改善细胞的粘附。表1-细胞规格细胞类型物种来源制造商皮层神经元小鼠胚胎脑lonzam-cx-400运动神经元人胚胎干细胞lonzafp-6051施旺氏细胞人肿瘤atcc-crl-2884神经元以40,000细胞/孔培养并且施旺氏细胞以3,000细胞/孔培养。24小时后处理细胞。每孔细胞的数量取决于生长表型、增殖能力等。组织培养板包被通过每孔添加100μl的50μg/ml聚-d-赖氨酸(sigma)于汉克氏平衡盐溶液(hbss,sigma)中的溶液并在37℃下黑暗中孵育过夜来包被96孔板。用细胞培养水(fisher)洗涤板,并在黑暗中风干30分钟。通过每孔添加75μl的在针对不同细胞类型的培养基中的15μg/ml层粘连蛋白(sigma)溶液并在37℃下黑暗中孵育1小时来包被板,所述培养基为用于皮层神经元(lonza)的pngmtm(主要神经元基础培养基,lonza)、用于运动神经元(lonza)的neuroblast(lonza)和用于施旺氏细胞(atcc)的高葡萄糖杜尔贝科氏改良伊戈尔培养基(dmem)(sigma)。在即将接种细胞之前从板上移除层粘连蛋白。皮层神经元pngm是通过将pngmsinglequots(lonza)添加到pnbm培养基并预热至37℃来制备的。将细胞在37℃水浴中解冻不超过2分钟,并轻轻转移到15ml管中。轻轻滴加5ml培养基。通过将试管小心翻转两次以混合细胞悬液。用cellometerautot4(nexcelombioscience)对细胞进行计数。将40,000个细胞/孔接种到预先包被的96孔板中。将细胞在37℃和5%co2下孵育。在2小时孵育后,移除80μl培养基,并用80μl新鲜培养基替换,并且在药物处理前使细胞沉降24小时。运动神经元将neuroblast预热至37℃。将细胞在37℃水浴中解冻不超过2分钟。轻轻滴加1ml培养基。将细胞重悬并转移到含有9ml培养基的15ml管中。将细胞在200相对离心力(rcf)下离心5分钟。将沉淀物重悬于5ml培养基中,并用cellometer对细胞进行计数。将40,000个细胞/孔接种到预先包被的96孔板中。将细胞在37℃和5%co2下孵育。在药物处理前使细胞沉降24小时。24小时后,用motorblast培养基(lonzo)替换neuroblast培养基。施旺氏细胞通过将10%胎牛血清(fbs,paa)添加到高葡萄糖dmem并预热至37℃来制备施旺氏细胞生长培养基。将细胞在37℃水浴中解冻不超过2分钟。将细胞轻轻转移到含10ml培养基的管,并在200rcf下离心5分钟。将沉淀物重悬于5ml培养基中,并用cellometer对细胞进行计数。将3,000个细胞/孔接种到预先包被的96孔板中。将细胞在37℃和5%co2下孵育。在药物处理前使细胞沉降24小时。药物处理和板设置在针对每种细胞系选择的培养基中制备lmw-ds,并以0.01和0.1mg/ml的剂量将其添加到相应孔。对于细胞存活测定,在24和48小时后以八个相同的孔/剂量/时间点对细胞进行分析。同样一式八份地,在48小时后分析分化和蛋白质表达测定。未调整pi直方图移位的pi和免疫染色将细胞固定在孔中。碘化丙啶用于存活力测定。对于免疫组织化学分析,将神经元用βiii-微管蛋白(一种对神经元具有特异性的微管蛋白)染色。对施旺氏细胞的髓磷脂碱性蛋白(mbp)进行染色。对于阴性对照,应用pbst(0.1%triton-x-100的pbs溶液)代替一抗。acumen细胞术acumen细胞仪允许直接对附着的细胞进行细胞术分析而无需在先脱离。因此,对细胞进行原位成像,并根据细胞周期不同阶段的dna含量(pi)对细胞进行分类,或将其视为凋亡或多倍体。也可直接测量细胞的蛋白质含量并将其表示为“总蛋白质含量”或“平均蛋白质含量”。统计数据数据表示为一式八份的平均值加标准偏差(sd)。组间比较使用学生t检验(双尾,相等方差;excel软件)进行。小于0.05的p值被认为是统计学上显著的(*p<0.05,**p<0.01,***p<0.001)。结果小鼠皮层神经元图1中的dna直方图显示,细胞的pi摄取改变,直方图向右移位,这指示lmw-ds处理对皮层神经元有作用。图中指示了开始分裂的细胞群(g2/m期)。用lmw-ds处理后,细胞数量显著降低。尽管凋亡细胞的比例略微增加,但这不是所有细胞损失的解释,而更可能是由于细胞脱离。人运动神经元运动神经元的数据与皮层神经元类似,pi摄取有移位(图2)并且在非常小的细胞群中增殖有小量增加。在这些培养物中也存在主要的细胞损失。对此的解释可能与对皮层神经元的解释相同。施旺氏细胞施旺氏细胞似乎不像神经元那样受lmw-ds的影响。存在类似的pi移位(图3)。与神经元相比,对施旺氏细胞的细胞数量和细胞脱离的作用并不明显。与神经元相反,用lmw-ds处理后凋亡细胞的比例减少。分化相关蛋白表达小鼠皮层神经元中的微管蛋白表达在经处理的培养物中,细胞的形态变化,并且细胞更圆且更大(图4)。微管蛋白是一类蛋白质,其是细胞的细胞骨架中的重要结构单元。βiii-微管蛋白仅由神经元表达。在用lmw-ds处理的细胞中,微管蛋白的强度显著增加(图5a)。对阳性细胞的分析表明,这些细胞比对照培养物中的阳性细胞要大(图5b)。人运动神经元中微管蛋白的表达lmw-ds显著增加了βiii-微管蛋白的表达(图6a)。lmw-ds显著改变了细胞形态。大多数阳性细胞比对照培养物小(图6b),尽管有些细胞变得非常大,具有延伸的神经突(图7)。人施旺氏细胞中mbp的表达在lmw-ds处理的施旺氏细胞培养物中,mbp的表达显著增加(图8a)。细胞大小的分析表明,与对照相比,lmw-ds处理后mbp阳性细胞更大(图8b和图9)。结论小鼠皮层神经元和人运动神经元细胞中βiii微管蛋白表达的增加和形态变化表明lmw-ds充当分化因子。对运动神经元的作用尤其显著。lmw-ds诱导的变化在小鼠和人类细胞中均很明显,表明这种作用与物种无关。lmw-ds处理导致培养物中明显的细胞损失。据信lmw-ds处理的这种作用不是由于毒性作用。lmw-ds更可能影响神经元附着。例如,即使对凋亡部分进行最大测量(在pi移位调整之后),迄今为止也无法解释培养物中细胞的损失,并且免疫染色制剂(更多洗涤)中的表观细胞损失比pi制剂中的大得多。人施旺氏细胞细胞中mbp表达的增加和形态变化表明lmw-ds在胶质细胞中充当分化因子。在分裂的施旺氏细胞中,由于lmw-ds处理引起的细胞脱离体征不像在神经元培养物中那样引人注目,但它们是可见的因此,lmw-ds似乎在极短的时间内(48小时)促进神经元和施旺氏细胞的分化。人们广泛接受的是,包括外伤相关的神经变性、ad、中风后痴呆的神经变性疾病与神经元中细胞周期相关现象的再激活有关。在本上下文中,已经提出分化诱导药物具有神经保护作用。支持施旺氏细胞分化的药物也将是治疗与脱髓鞘相关疾病的良好候选物。实施例2进行本研究以研究lmw-ds在小鼠实验性自身免疫性脑脊髓炎(eae)模型中的体内作用。eae,有时称为实验性变应性脑脊髓炎,是cns的炎性脱髓鞘疾病并且是cd4+t细胞介导的。小鼠中的eae模型是目前人类中最广泛接受的ms和adem的动物模型(annalsofneurology,60:12-21,2006)。通常,通过单次注射肽和蛋白质(包括用佐剂乳化的触发针对髓磷脂的免疫反应的髓磷脂少突胶质糖蛋白35-55(mog35-55))在小鼠中诱导eae。注射导致在注射后约一周eae的高度可再现发作。引起周围性麻痹的cns的炎性病变是小鼠eae的特征。在小鼠中的疾病进展之后,使用公认和经评价的评分系统(internationalimmunology,10:333-340,1998)每天评价疾病症状。材料和方法·不完全弗氏佐剂(ifa)(difco)·结核分枝杆菌(m.tuberculosis)h37ra(difco)·mog35-55啮齿动物(mdbioproducts)·百日咳毒素(sigmaaldrich)·汉克氏平衡盐溶液(hbss)(gibco/invitrogen)·杜尔贝科氏磷酸盐缓冲盐水(d-pbs)(lifetechnologies)·羟丙基甲基纤维素(hpmc)(sigmaaldrich)·0.9%盐水溶液(9mg/mlnacl,高压灭菌)(scharlau)·环孢霉素a(sigmaaldrich)·溶于0.9%盐水溶液中的lmw-ds·肝细胞生长因子(hgf)重组小鼠(r&dsystems)·isobavet3.5%(scheringploughanimalhealth)·甲基丁烷(sigmaaldrich)c57b1.6小鼠(雌性,8-10周)获自harlaneurope。将小鼠饲养在瑞典隆德大学的常规动物设施中,并在装有刨花的聚苯乙烯笼(iil型笼,每笼最多7只小鼠)中保持12h光照/黑暗周期,并随意用标准啮齿动物饲料和水喂养。疾病诱导和加强通过在第0天在侧腹s.c.注射含有150μgmog35-55和300μgh37ra的乳液(每只小鼠100μl体积)诱导eae。通过在冰上混合完全弗氏佐剂(cfa)(h37ra的ifa溶液,浓度为6mg/ml)和mog35-55(溶于pbs,浓度为3mg/ml)来制备乳液。在免疫期间麻醉小鼠以确定注射的正确位置。将百日咳毒素(ptx)以50μg/ml的浓度重悬于mqh2o中,并在pbs中稀释至1μg/ml的终浓度。小鼠在第0天和第2天接受200ngptxi.p.的加强注射。剂量制备在第0天和第14天制备第3组的lmw-ds稀释液。根据下表2中所述的剂量,将lmw-ds稀释在0.9%盐水溶液中,并通过0.2μm过滤器无菌过滤。所给予的媒介物是0.9%盐水溶液。重组hgf以25μg/ml的浓度复溶于1ml0.1%牛血清白蛋白(bsa)的pbs溶液中,并用pbs进一步稀释至1μg/ml。通过将50mg溶于1ml70%乙醇中来制备环孢霉素a并将其在hpmc中稀释至0.98mg/ml的终浓度。表2–剂量制备实验组和lmw-ds施用对于第2-3组,从第0天开始处理,在第2组中i.p.施用和在第3组中s.c.施用,每周三次。对于其余组,从第18天开始处理。第4组的动物每隔一天i.v.施用,总共三次注射。将处理组在笼内混合以避免笼效应和由不平等住房引起的系统误差。疾病评价通过实验跟踪疾病进展。在实验结束时(即疾病诱导后第28天)收集血浆。每天监测临床疾病,其中根据范围为0-8的量表对疾病进行分级。0=健康1=尾无力2=尾麻痹3=尾麻痹和轻度蹒跚4=尾麻痹和严重蹒跚5=尾麻痹和一只肢体麻痹6=尾麻痹和一对肢体麻痹7=四肢麻痹或三肢麻痹8=病前或死亡图表和统计数据使用针对macosx的prism5(graphpadsoftware,sandiego,ca,usa)进行图表和统计分析。所有统计数据均使用单尾非参数mann-whitney检验计算,其中p<0.05被认为是显著的*,#和**,##代表p值<0.01。结果和讨论图10示出了对照组(媒介物和环孢霉素a)和每周三次用lmw-dss.c.处理的组中小鼠的eae发展,其中与媒介物对照相比,环孢霉素a在第13、14、16、20、21和25-27天具有显著(*)更低的平均评分。与媒介物对照相比,每周三次用10mg/kg硫酸葡聚糖s.c.处理的动物在第13、14、16、17、19、21和26天具有显著(#)更低的平均评分。图11示出了媒介物和在第18天开始每隔一天用100ng/剂量的hgfi.v.处理持续五天的小鼠(见箭头)。与媒介物相比,hgf没有导致任何显著差异。因此,在eae模型中,lmw-ds导致与媒介物对照相比显著更低的平均评分。因此,结果表明,lmw-ds在cns的神经变性和脱髓鞘疾病(诸如ms和adem)中具有积极作用。实施例3通过高效液相色谱(hplc)分析冷冻脑样品,评价lmw-ds的每天皮下注射对大鼠严重外伤性脑损伤(stbi)后谷氨酸兴奋性毒性和线粒体功能的作用。结果表明,lmw-ds干扰线粒体功能以改善能量代谢,并且还降低谷氨酸兴奋性毒性。材料和方法stbi的诱导和药物施用方案根据国际动物护理标准和指南,本研究中使用的实验方案已获得罗马天主教大学伦理委员会(ethicalcommitteeofthecatholicuniversityofrome)的批准。在控制的环境中,向体重(b.w.)为300-350g的雄性wistar大鼠随意喂食标准实验室饮食和水。将它们分成三组:1)n=6只动物经受stbi,在30分钟后施用药物,并在tbi后第2天处死(急性1期)2)n=6只动物经受严重tbi,在30分钟后施用药物,并在tbi后第7天处死(急性2期)。3)n=6只动物经受严重tbi,在3天后施用药物,并在tbi后第7天处死(慢性期)。作为麻醉混合物,动物通过i.p.注射接受35mg/体重kg的氯胺酮和0.25mg/体重kg的咪达唑仑。根据“重量下落”撞击加速模型,通过将450g重物从2m高下落到已用预先固定在颅骨上的金属盘保护的大鼠头部上而诱导stbi(marmarou等人,anewmodelofdiffusebraininjuryinrats.parti:pathophysiologyandbiomechanics.jneurosurg.1994;80:291-300)。该研究排除了患有颅骨骨折、癫痫发作、鼻出血或在撞击下未存活的大鼠。在每个治疗期结束时,将大鼠再次麻醉,然后立即处死。药物处理为皮下注射0.5mllmw-ds(15mg/kg),并根据上述示意性方案施用。脑组织处理在麻醉期间,对所有动物进行体内颅骨切除术,在小心移除大鼠颅骨后,露出脑并用手术刮刀将其取下,并迅速放入液氮中。测定湿重(w.w.)后,如先前所公开的影响组织制备(tavazzi等人,cerebraloxidativestressanddepressionofenergymetabolismcorrelatewithseverityofdiffusebraininjuryinrats.neurosurgery.2005;56:582-589;vagnozzi等人,temporalwindowofmetabolicbrainvulnerabilitytoconcussions:mitochondrial-relatedimpairment-parti.neurosurgery.2007;61:379-388;tavazzi等人,temporalwindowofmetabolicbrainvulnerabilitytoconcussions:oxidativeandnitrosativestresses-partii.neurosurgery.2007;61:390-395;amorini等人,severityofexperimentaltraumaticbraininjurymodulateschangesinconcentrationsofcerebralfreeaminoacids.jcellmolmed.2017;21:530-542.)。简而言之,用7ml冰冷的氮饱和的由ch3cn+10mmkh2po4(ph7.40)(3:1;v:v)组成的沉淀溶液并使用设置为24,000rpm/min的ultra-turrax(janke&kunkel,staufen,germany)进行全脑均质化。在20,690×g、4℃下离心10分钟后,保留澄清的上清液,向沉淀物中补充3ml沉淀溶液,并如上所述再次均质化。进行第二次离心(20,690×g,4℃下10分钟),保留沉淀物,将上清液与先前获得的那些合并,通过用两倍体积的hplc级chcl3剧烈搅拌进行萃取,并如上离心。将含有水溶性低分子量化合物的上层水相收集,再用氯仿洗涤两次(该程序允许从缓冲组织提取物中移除所有有机溶剂和任何脂溶性化合物),用10mmkh2po4(ph7.40)调节体积,以最终得到10%的水性组织匀浆,并保存在-80℃下直至测定。嘌呤-嘧啶代谢物的hplc分析将每个脱蛋白组织样品的等分试样通过0.45μmhvmillipore过滤器进行过滤,并上样(200μl)到hypersilc-18、250x4.6mm、5μm粒径柱上,该柱配有其自身的保护柱(thermofisherscientific,rodano,milan,italy)并与hplc仪器连接,该hplc仪器由具有高度灵敏的二极管阵列检测器(配备5cm光路流通池)的surveyor系统(thermofisherscientific,rodano,milan,italy)组成并且波长设置在200至300nm。数据采集和分析由pc使用hplc制造商提供的chrom软件包进行。根据对现有离子配对hplc方法的细微修改,在单次色谱运行中分离属于嘌呤-嘧啶谱(列于下文)且与组织能量状态、线粒体功能以及相对于氧化-亚硝化应激相关的代谢物(lazzarino等人,single-samplepreparationforsimultaneouscellularredoxandenergystatedetermination.analbiochem.2003;322:51-59;tavazzi等人,simultaneoushighperformanceliquidchromatographicseparationofpurines,pyrimidines,n-acetylatedaminoacids,anddicarboxylicacidsforthechemicaldiagnosisofinbornerrorsofmetabolism.clinbiochem.2005;38:997-1008)。通过将保留时间、吸收光谱和峰面积与具有已知浓度的新鲜制备的超纯标准混合物的色谱运行峰的那些进行比较,在适当的波长(206、234和260nm)下进行组织提取物的色谱运行中目标化合物的分配和计算。化合物列表:胞嘧啶、肌酐、尿嘧啶、β-假尿苷、胞苷、次黄嘌呤、鸟嘌呤、黄嘌呤、胞苷二磷酸胆碱(cdp-胆碱)、抗坏血酸、尿苷、腺嘌呤、亚硝酸盐(-no2-)、还原型谷胱甘肽(gsh)、肌苷、尿酸、鸟苷、胞苷一磷酸(cmp)、丙二醛(mda)、胸腺嘧啶、乳清酸、硝酸盐(-no3-)、尿苷一磷酸(ump)、氧化型烟酰胺腺嘌呤二核苷酸(nad+)、腺苷(ado)、肌苷一磷酸(imp)、鸟苷一磷酸(gmp)、尿苷二磷酸葡萄糖(udp-glc)、udp半乳糖(udp-gal)、氧化型谷胱甘肽(gssg)、udp-n-乙酰基-葡萄糖胺(udp-glcnac)、udp-n-乙酰基-半乳糖胺(udp-galnac)、腺苷一磷酸(amp)、鸟苷二磷酸-葡萄糖(gdp-葡萄糖)、胞苷二磷酸(cdp)、udp、gdp、氧化型烟酰胺腺嘌呤二核苷酸磷酸(nadp+)、腺苷二磷酸-核糖(adp-核糖)、三磷酸胞苷(ctp)、adp、三磷酸尿苷(utp)、三磷酸鸟苷(gtp)、还原型烟酰胺腺嘌呤二核苷酸(nadh)、三磷酸腺苷(atp)、还原型烟酰胺腺嘌呤二核苷酸磷酸(nadph)、丙二酰coa、辅酶a(coa-sh)、乙酰coa、n-乙酰天冬氨酸(naa)。游离氨基酸和含氨基基团的化合物的hplc分析使用用邻苯二甲醛(opa)和3-巯基丙酸(mpa)的混合物对样品进行柱前衍生化,来同时测定初级游离氨基酸(faa)和含氨基基团的化合物(agcc)(列于下文),如在其他地方详细描述的(amorini等人,severityofexperimentaltraumaticbraininjurymodulateschangesinconcentrationsofcerebralfreeaminoacids.jcellmolmed.2017;21:530-542;amorini等人,metabolicprofileofamnioticfluidasabiochemicaltooltoscreenforinbornerrorsofmetabolismandfetalanomalies.molcellbiochem.2012;359:205-216)。简而言之,每天制备由25mmol/lopa、1%mpa、237.5mmol/l硼酸钠(ph9.8)组成的衍生混合物,并将其放入自动取样器中。在24℃下用opa-mpa对样品(15μl)进行自动柱前衍生,并将25μl衍生混合物上样到hplc柱(hypersilc-18,250x4.6mm,5μm粒度,恒温21℃)上用于随后的色谱分离。在谷氨酸的情况下,在衍生化程序和随后的注射之前,用hplc级h2o将脱蛋白脑提取物稀释20倍。使用合适的阶梯梯度,使用两种流动相(流动相a=24mmol/lch3coona+24mmol/lna2hpo4+1%四氢呋喃+0.1%三氟乙酸,ph6.5;流动相b=40%ch3oh+30%ch3cn+30%h2o)以1.2ml/min的流速进行opa-aa和opa-agcc的分离(amorini等人,severityofexperimentaltraumaticbraininjurymodulateschangesinconcentrationsofcerebralfreeaminoacids.jcellmolmed.2017;21:530-542;amorini等人,metabolicprofileofamnioticfluidasabiochemicaltooltoscreenforinbornerrorsofmetabolismandfetalanomalies.molcellbiochem.2012;359:205-216)。通过将保留时间和峰面积与具有已知浓度的新鲜制备的超纯标准混合物的色谱运行峰的那些进行比较,在338nm波长下进行全脑提取物的色谱运行中opa-aa和opa-agcc的分配和计算。faa和acgc化合物的列表:天冬氨酸(asp)、谷氨酸(glu)、天冬酰胺(asn)、丝氨酸(ser)、谷氨酰胺(gln)、组氨酸(his)、甘氨酸(gly)、苏氨酸(thr)、瓜氨酸(citr)、精氨酸(arg)、丙氨酸(ala)、牛磺酸(tau)、γ-氨基丁酸(gaba)、酪氨酸(tyr)、s-腺苷同型半胱氨酸(sah)、l-胱硫醚(l-cystat)、缬氨酸(val)、甲硫氨酸(met)、色氨酸(trp)、苯丙氨酸(phe)、异亮氨酸(ile)、亮氨酸(leu)、鸟氨酸(orn)、赖氨酸(lys)。统计分析使用kolmogorov-smirnov检验对正态数据分布进行检验。通过用于重复测量的双向anova来估计组间差异。fisher的受保护最小二乘方用作事后检验。只有小于0.05的双尾p值被认为是统计学上显著的结果在24种标准和非标准氨基酸以及含伯氨基基团的化合物的大脑值中,最明显的结果是lmw-ds处理对stbi诱导的谷氨酸(glu)增加具有显著的抑制作用(图12),因此必然会由于该化合物的过量而导致兴奋性降低。然而,这种作用只有在损伤后早期(stbi后30分钟)施用药物才可见,当在stbi后第3天注射lmw-ds时,对这种兴奋性毒性标志物没有效力。还值得强调的是,lmw-ds对参与所谓甲基循环的化合物(met、l-cystat、sah)具有显著的有益作用,参见表3。表3-脑化合物的浓度ap<0.01(与对照比较),bp<0.05(与对照比较),cp<0.01(与tbi第2天比较),dp<0.05(与tbi第2天比较),ep<0.01(与tbi第5天比较),fp<0.05(与tbi第5天比较),gp<0.01(与急性2期比较),hp<0.05(与急性2期比较),ip<0.01(与慢性期比较),jp<0.05(与慢性期比较)表3列出了以μmol/g(w.w.)计的化合物如表4所示,lmw-ds对与能量代谢和线粒体功能有关的各种化合物产生积极影响。尤其感兴趣的是作为线粒体磷酸化能力测量的腺嘌呤核苷酸的浓度和atp/adp比率(图13)。表4-能量代谢物的浓度ap<0.01(与对照比较),bp<0.05(与对照比较),cp<0.01(与tbi第2天比较),dp<0.05(与tbi第2天比较),ep<0.01(与tbi第5天比较),fp<0.05(与tbi第5天比较),gp<0.01(与急性2期比较),hp<0.05(与急性2期比较),ip<0.01(与慢性期比较),jp<0.05(与慢性期比较)表4列出了以nmol/g(w.w.)计的化合物还观察到了氧化和还原烟碱辅酶的显著变化(图14)。还测量了与氧化应激有关的参数,并且在施用lmw-ds后检测到氧化应激的显著降低。特别地,测量了作为主要水溶性脑抗氧化剂的抗坏血酸和作为主要细胞内sh供体的gsh。结果显示,lmw-ds施用后它们的水平显著改善,如表4和图15所示。另外,还测量了mda,其作为膜磷脂的多不饱和脂肪酸的终产物,因此被认为是ros-介导的脂质过氧化的标志物。施用lmw-ds后,mda水平显示显著降低。上述的氧化应激标志物均表明在用lmw-ds处理后抗氧化状态的恢复有所改善(图15)。还分析了no介导的亚硝化应激(亚硝酸盐和硝酸盐)的代表性指数。lmw-ds施用显著降低了stbi急性期和慢性期的硝酸盐浓度(图16)。naa是脑特异性代谢物,并且是用于监测tbi后的恶化或恢复的有价值的生化标志物。naa是由天冬氨酸和乙酰coa通过天冬氨酸n-乙酰转移酶在神经元中合成的。为了确保naa的周转,该分子必须在细胞区室之间移动以到达少突胶质细胞,在那里它被天冬氨酸酰基酶(aspa)降解为乙酸和天冬氨酸。为了补充底物天冬氨酸和乙酰coa的可用性,分解代谢酶aspa的上调和naa的降低是代谢损伤状态的指示。在该研究中,在stbi后测量naa及其底物,并且在lmw-ds施用后其显示出水平显著提高(图17)。当动物在损伤后早期(30分钟)接受lmw-ds施用时,这些作用对能量代谢物尤其明显。重要的是注意到,当在stbi后第2天处死动物时或在stbi后第7天处死时,观察到lmw-ds的总体有益作用。在这些动物组中,与agcc和能量代谢物相关的代谢的总体改善更明显,从而表明lmw-ds施用对脑代谢具有长期的积极作用。讨论tbi是生命前四十年中死亡和残疾的主要原因。据估计,仅英国每年的经济成本就高达80亿英镑,相比之下,这比中风造成的经济成本还要大。在美国,tbi的医疗保健和社会经济总成本估计每年超过600亿美元,这还不包括军事支出。此外,最近几年已经发现大西洋两岸对运动脑震荡的兴趣激增。尽管有明显的临床需求,但目前尚无批准的tbi药理治疗。尽管与tbi相关的原发性损伤(挫伤)可能适合手术治疗,但随后对周围脑组织(半影)的继发性非机械损伤的减少提供了更大的潜在治疗机会。使用已建立的以tbi的弥漫性轴索损伤为特征的严重外伤性脑损伤(stbi)的啮齿动物模型,先前已经显示严重损伤的动物具有与细胞能量状态和线粒体功能相关(vagnozzi等人,changesofcerebralenergymetabolismandlipidperoxidationinratsleadingtomitochondrialdysfunctionafterdiffusebraininjury.jneurotrauma.1999;16:903-913;signoretti等人,n-acetylaspartatereductionasameasureofinjuryseverityandmitochondrialdysfunctionfollowingdiffusetraumaticbraininjury.jneurotrauma.2001;18:977-993;tavazzi等人,cerebraloxidativestressanddepressionofenergymetabolismcorrelatewithseverityofdiffusebraininjuryinrats.neurosurgery.2005;56:582-589;vagnozzi等人,temporalwindowofmetabolicbrainvulnerabilitytoconcussions:mitochondrial-relatedimpairment-parti.neurosurgery.2007;61:379-388;tavazzi等人,temporalwindowofmetabolicbrainvulnerabilitytoconcussions:oxidativeandnitrosativestresses-partii.neurosurgery.2007;61:390-395)以及与氨基酸代谢相关(amorini等人,severityofexperimentaltraumaticbraininjurymodulateschangesinconcentrationsofcerebralfreeaminoacids.jcellmolmed.2017;21:530-542)的各种代谢物的长期修饰。在引起tbi诱导的脑损伤的复杂分子机制中,代谢修饰似乎是早期的细胞信号,其影响指示病理组织响应的酶促活性以及基因和蛋白质表达的变化(dipietro等人,potentiallyneuroprotectivegenemodulationinaninvitromodelofmildtraumaticbraininjury.molcellbiochem.2013;375:185-198;dipietro等人,themolecularmechanismsaffectingn-acetylaspartatehomeostasisfollowingexperimentalgradedtraumaticbraininjury.molmed.2014;20:147-157;dipietro等人,neuroglobinexpressionandoxidant/antioxidantbalanceaftergradedtraumaticbraininjuryintherat.freeradicbiolmed.2014;69:258-264;amorini等人,metabolic,enzymaticandgeneinvolvementincerebralglucosedysmetabolismaftertraumaticbraininjury.biochimbiophysactamolbasisofdis.2016;1862:679-687)。这意味着在受损组织中用于积极调节细胞代谢的试剂可能降低导致不良结果的酶活性以及基因和蛋白质表达的随后tbi相关改变。本文所呈现的数据表明,lmw-ds的早期施用通过保护线粒体功能降低了谷氨酸兴奋性毒性水平并改善了代谢内稳态的不良变化,表明该化合物在严重tbi后具有神经保护作用。因此,lmw-ds具有待用于治疗或抑制tbi(包括stbi)的潜力。实施例4在细胞系中研究由lmw-ds诱导的基因表达变化的分析。材料和方法实验设计对于每个细胞系,设置n=8x25cm2培养烧瓶。在处理当天(接种后24小时),收获针对每种细胞类型的两个烧瓶。这代表第0天时间点。从剩余的烧瓶,将三个烧瓶用对照培养基处理,并将三个烧瓶用含有lmw-ds的培养基(cm)处理,以得到0.01mg/ml的终浓度。48小时后收集来自经处理的烧瓶的细胞。因此,所收集的数据代表(a)未处理的细胞(第0天对照和第2天对照)和(b)用lmw-ds处理48小时(处理的第2天lmw-ds)的细胞。包被所有细胞的组织培养板通过向每个25cm2烧瓶中添加2ml的50μg/ml聚-d-赖氨酸于汉克氏平衡盐溶液(hbss)中的溶液并在37℃下黑暗中孵育过夜来包被烧瓶。用细胞培养水洗涤烧瓶,并在黑暗中风干30分钟。通过向每个烧瓶中添加1ml25μg/ml层粘连蛋白于磷酸盐缓冲盐水(pbs)中的溶液并在37℃下黑暗中孵育2小时来包被烧瓶。在涂铺细胞之前,用pbs洗涤层粘连蛋白烧瓶三次。人脐静脉内皮细胞(huvec)制备培养基200+大血管内皮细胞补充物(m200+lves)添加剂(1:50)并预热至37℃。将细胞在37℃水浴中解冻不超过2分钟,并轻轻转移到含有20ml杜尔贝科氏改良伊戈尔培养基营养混合物f-12(dmem-f12)的50ml管中。通过将管小心地翻转两次以混合细胞悬液。将细胞以400×g离心10分钟。移除上清液,并将细胞重悬于10ml培养基(m200+lves添加剂)中。用cellometer对细胞进行计数。将1,000,000个细胞/烧瓶接种到25cm2烧瓶(n=8)中,并将培养基加满至每个烧瓶总共5ml。将细胞在37℃和5%co2下孵育。在lmw-ds处理之前,使细胞沉降24小时。人施旺氏细胞通过将10%胎牛血清(fbs)添加到高葡萄糖dmem并预热至37℃来制备施旺氏细胞生长培养基。将细胞在37℃水浴中解冻不超过2分钟。将来自12个小瓶的细胞分别轻轻转移到含有10ml高葡萄糖dmem培养基的管,并在400相对离心场(rcf)下离心10分钟。将沉淀物重悬于培养基中。将来自12个小瓶的细胞混合并均匀分配到先前包被的25cm2烧瓶(n=8)中。将细胞在37℃和5%co2下孵育。在lmw-ds处理之前,使细胞沉降24小时。小鼠皮层神经元(lonza)通过向500mlneurobasal培养基中添加10mlb-27无血清补充物和2.5mlglutamaxtm-i补充物来制备培养基。将该培养基预热至37℃。将来自12个小瓶的细胞在37℃水浴中依次解冻不超过2分钟并轻轻转移到15ml管中。向每份中轻轻滴加9ml培养基。通过将管小心地翻转两次以混合细胞悬液。将细胞在200×g下离心5分钟。移除上清液(至最后0.5ml),并通过研磨将细胞温和地重悬。将来自12个小瓶的细胞混合并均匀分配到先前包被的25cm2烧瓶(n=8)中。将细胞在37℃和5%co2下孵育24小时。小鼠运动神经元(aruna)根据表5制备培养基。表5-培养基的制备将培养基(参见表5)预热至37℃。将细胞在37℃水浴中解冻不超过2分钟。轻轻滴加9ml培养基。通过将管小心地翻转两次以混合细胞悬液。用cellometer对细胞进行计数。将细胞在200×g下离心5分钟。移除上清液(至最后0.5ml),并通过研磨将细胞温和地重悬。混合来自8个小瓶的细胞,并将其平均分配到预先包被的25cm2烧瓶(n=8)中。在处理之前,将细胞在37℃和5%co2下孵育24小时。药物处理lmw-ds以20mg/ml的储备浓度提供,并保存在4℃的温度监测冰箱中。在无菌dmem-f12中制备新鲜的100xlmw-ds储备液(1.0mg/ml)。将浓缩的药物储备液无菌过滤并添加到相应的培养基(19.6mlcm和0.4mllmw-ds储备液)中。对照使用19.6mlcm和0.4mldmem-f12制备,并将lmw-ds和cm添加到相应的烧瓶(每瓶5ml),使每皿中lmw-ds的浓度达到0.01mg/ml,每皿中cm的总量为10ml。培养物收集和细胞裂解。将cm吸进干净且贴有标签的15mlfalcon管中。将烧瓶(无培养基)置于-80℃冰箱中30分钟。将falcon管中的cm以3000×g离心5分钟。移除上清液,并将该小量沉淀物在室温(rt,22℃)下重悬于2.5mltrizol:水(4:1)溶液中。将冷冻的烧瓶从冰箱中逐个取出,并将trizol-水从合适的管中移到烧瓶。将烧瓶在室温下放置5分钟,然后将内容物吸回15mlfalcon管中(用溶液彻底洗涤烧瓶底部后)。在显微镜下检查烧瓶,以确保完全移除细胞。将在15mlfalcon管中收集的裂解物置于-80℃冰箱中。rna提取从冰箱中取出含有匀浆的falcon管,并在rt下保存5分钟,以使核蛋白复合物完全解离。从每个样品中取出两等份1ml裂解物,并向每份中添加200μl氯仿(0.2ml氯仿/1ml在细胞裂解步骤中使用的trizol试剂),并剧烈摇动管。将样品在rt下保存2-3分钟,并且随后在4℃下以12,000×g离心15分钟。混合物分成三层:下层红色苯酚-氯仿相、中间相和无色上层水相。rna保留在顶部水相中,dna保留在白色中间(界间)相中,并且蛋白质保留在粉红色底部(有机)相中。将水相的顶部3/4转移到新的干净的eppendorf管。通过添加等量的100%乙醇将rna从水相中沉淀出来。将沉淀的rna固定在旋转筒上,洗涤两次并干燥。将rna在50μl不含rna酶的温水中洗脱。通过nanodrop测量纯化的rna的数量和质量。将rna保存在-80℃下,然后转移到sourcebioscience进行阵列分析。表达数据的分析计划将表达数据下载到针对每个细胞系的单独文件中。“背景校正”表达式是来自阵列“gprocessedsignal”的数据,该数据是从相关探针的实际信号中提取的背景信号的结果。这是阵列分析中最常用的变量。对所有样品的背景校正信号进行log2转换以用于统计分析。为了降低样品中的错误发现率,移除了低于‘表达水平’的信号。对于log2转换后的表达式值,将‘低表达’水平设置为5。统计分析基于对照探针在每个阵列上的表达模式,决定在分析前对所有阵列进行中值居中,以减少结果的可变性。将数据按细胞类型分组,并使用以下算法分析每种细胞类型:·d0对照与d2对照样品的比较-在正常培养物内的细胞中观察到的表达变化·d0对照与d2lmw-ds处理样品的比较-在lmd-ds处理培养物内的细胞中观察到的表达变化·d2对照与d2lmd-ds处理样品的比较-培养物中lmw-ds诱导的差异表达。进行初步分析以筛选出在三个数据集的任何组合之间没有差异表达的基因。进行简单的非严格anova(p<0.05)以寻找表达模式。消除了在三个数据集中没有变化的探针。使用火山图分析其余探针组的倍数变化和显著性。探针表达超过20%的变化(fc≥1.2或fc≤0.84)被认为在第一情况中是显著的,以允许检测表达模式。质量参数接种密度由从施旺氏细胞的细胞储备液中回收的细胞计数来计算。huvecs以其最佳密度接种。来自阵列服务提供商的附加质量控制表明,rna是高质量的(没有降解)并且量在来自安捷伦的低输入rna微阵列的参数范围内。对原始数据的分析表明,如所预期的,阵列之间存在显著差异。然而,这些差异(由所有阵列上包括的相同对照样品中的差异反映)容易通过标准化技术来消除。所选择的消除阵列-至-阵列差异的数据中值居中不影响代表不同rna浓度的对照之间预期看到的总体差异。施旺氏细胞的表达分析如前所述,在数据分析之前,移除在施旺氏细胞中不表达的基因。对于log2转换后的表达式值,将‘低表达’水平设置为5。这留下15,842种独特的探针用于在施旺氏细胞培养物中进行分析。在分析的下一步中,对三组数据(d0对照与d2对照样品的比较;d0对照与d2lmw-ds处理样品的比较;d2对照与d2lmd-ds处理样品的比较)进行分析以建立cm对细胞的作用以及由lmw-ds诱导的相对变化。当比较d0对照和d2对照样品时,585个基因在施旺氏细胞培养物中差异表达。受这些基因影响的分子功能涉及细胞运动(1.14e-07-2.49e-03);细胞形态(5.56e-07-2.36e-03);细胞发育(7.3e-06-2.48e-03);细胞生长和增殖(7.3e-06-2.48e-03);细胞组装和组织(1.23e-05-2.36e-03);细胞功能和维护(1.23e-05-2.47e-03);细胞死亡和存活(1.53e-05-2.51e-03);脂质代谢(8.14e-05-1.6e-03);小分子生物化学(8.14e-05-1.6e-03);分子转运(1.18e-04-2.29e-03);蛋白质运输(1.62e-04-1.6e-03);碳水化合物代谢(3.22e-04-1.78e-03);基因表达(3.98e-04-2.2e-03);细胞信号传导(4.39e-04-2.25e-03);细胞-至-细胞信号传导和相互作用(5.05e-04-2.48e-03);细胞损害(7.69e-04-1.58e-03);细胞周期(1.12e-03-1.8e-03);氨基酸代谢(1.6e-03-1.6e-03);以及核酸代谢(1.6e-03-1.6e-03)。上面给出的值是代表这些基因与不同途径的关联的统计学显著性的p值。两个p值代表观察到的统计学显著性的下限和上限(p<0.05为显著的)。lmw-ds诱导了1244个基因在施旺氏细胞培养物中的差异表达,如在比较d0对照与d2lmw-ds处理的样品时所评估的。受这些基因影响的分子功能涉及细胞形态(1.43e-08-8.39e-04);细胞运动(1.4e-07-9.6e-04);翻译后修饰(3.93e-07-6.71e-05);蛋白质合成(3.93e-07-1.08e-04);蛋白质运输(3.93e-07-1.26e-06);细胞死亡和存活(2.13e-06-8.65e-04);细胞组装和组织(7.46e-06-8.24e-04);dna复制、重组和修复(7.46e-06-7.46e-06);细胞功能和维护(9.53e-06-6.46e-04);基因表达(1.27e-05-4.92e-04);细胞发育(1.29e-05-9.06e-04);细胞生长和增殖(1.29e-05-9.06e-04);细胞-至-细胞信号传导和相互作用(1.97e-05-8.81e-04);氨基酸代谢(4.22e-05-8.24e-04);小分子生物化学(4.22e-05-8.24e-04);脂质代谢(4.81e-05-3.64e-04);分子转运(3.64e-04-3.64e-04);以及细胞周期(4.53e-04-4.86e-04)。lmw-ds诱导了700个基因在施旺氏细胞培养物中的差异表达,如在比较d2对照与d2lmw-ds处理的样品时所评估的。受这些基因影响的分子功能涉及细胞形态(1.49e-07-5.62e-03);细胞组装和组织(1.49e-07-5.95e-03);细胞运动(7.24e-07-6.06e-03);细胞死亡和存活(9.41e-06-5.95e-03);氨基酸代谢(2.56e-05-3.7e-03);翻译后修饰(2.56e-05-1.05e-03);小分子生物化学(2.56e-05-3.7e-03);细胞-至-细胞信号传导和相互作用(5.05e-05-5.76e-03);基因表达(7.18e-05-4.94e-03);细胞周期(1.06e-04-5.95e-03);细胞发育(1.06e-04-5.95e-03);细胞功能和维护(1.96e-04-5.95e-03);细胞生长和增殖(2.35e-04-5.95e-03);dna复制、重组和修复(2.75e-04-5.95e-03);细胞信号传导(5.92e-04-2.54e-03);细胞损害(6.26e-04-6.26e-04);脂质代谢(6.26e-04-1.85e-03);分子转运(6.26e-04-5.95e-03);蛋白质合成(1.05e-03-1.93e-03);细胞对治疗剂的响应(1.85e-03-1.85e-03);蛋白质运输(2.66e-03-5.95e-03);以及rna转录后修饰(4.32e-03-4.32e-03)。机制分子网络模型模拟由lmw-ds差异调节的分子的作用,使得能够评价这些变化的功能性结果。计算机模拟模型表明,lmw-ds抑制神经元细胞死亡;凋亡;和蛋白质合成并激活血管生成;细胞迁移;细胞存活力;细胞存活;细胞运动;细胞增殖;细胞分化;细胞内稳态;细胞周期进程;细胞转化;和rna的表达。表6汇总了培养的施旺细胞中基因表达变化的结果。表6-施旺氏细胞中基因表达变化的总体模式在两天内在对照培养物中表达发生改变的21个基因在相同的两天内在lmw-ds处理的培养物中根本没有显示出任何变化。在对照培养物中表达增加的1个基因在相同的两天内在lmw-ds处理的培养物中下调。在两天内在对照培养物中下调的13个基因在lmw-ds处理的培养物中上调。122个基因在培养基中被生长因子显著下调,并且这种下调在lmw-ds处理的培养物中甚至更强。在对照培养物中441个基因被上调,并且lmw-ds的添加使得这种上调显著更强。huvec的表达分析如前所述,在尝试进行任何分析之前,已移除了在huvec中不表达的基因。对于log2转换后的表达式值,将‘低表达’水平设置为5。这留下了15,239种独特的探针用于在huvec培养物中进行分析。在下一步中,分析了三组数据以建立cm对细胞中的基因表达的作用以及lmw-ds诱导的差异。进行初步分析以筛选出在三个数据集的任何组合之间没有差异表达的基因。进行简单的非严格anova(p<0.05)以寻找表达模式。消除了在三个数据集中没有变化的基因,总共留下了12,313个探针(10,368个基因)用于分析。当比较d0对照和d2对照样品时,1551个基因在huvec培养物中差异表达。受这些基因影响的分子功能涉及细胞组装和组织(2.55e-15-1.29e-03);细胞功能和维持(2.55e-15-1.29e-03);细胞周期(1.98e-11-1.32e-03);细胞形态(3.18e-10-1.29e-03);基因表达(1.05e-08-2.01e-04);细胞发育(1.66e-07-1.37e-03);细胞生长和增殖(1.66e-07-1.37e-03);dna复制、重组和修复(2.04e-07-9.84e-04);细胞死亡和存活(2.09e-07-1.3e-03);rna转录后修饰(4.86e-06-6.53e-04);细胞运动(9.9e-06-1.18e-03);翻译后修饰(1.92e-05-1.34e-03);细胞-至-细胞信号传导和相互作用(2.19e-05-9.1e-04);蛋白质合成(5.49e-05-1.14e-03);细胞损害(8.16e-05-8.16e-05);分子转运(6.27e-04-6.27e-04);蛋白质运输(6.27e-04-6.27e-04);细胞信号传导(8.86e-04-8.86e-04);细胞对治疗剂的响应(9.84e-04-9.84e-04);以及蛋白质降解(1.14e-03-1.14e-03)lmw-ds诱导了1779个基因在huvec培养物中的差异表达,如在比较d0对照与d2lmw-ds处理的样品时所评估的。受这些基因影响的分子功能涉及细胞组装和组织(4.14e-17-9.7e-04);细胞功能和维护(4.14e-17-8.05e-04);细胞周期(5.83e-14-9.85e-04);细胞形态(1.69e-10-7.48e-04);基因表达(7.99e-09-8.62e-04);细胞死亡和存活(2e-08-8.4e-04);细胞发育(1.28e-07-8.88e-04);细胞生长和增殖(1.28e-07-8.88e-04);dna复制、重组和修复(3.07e-07-9.7e-04);rna转录后修饰(1.13e-06-6.31e-04);细胞运动(1.42e-06-8.34e-04);翻译后修饰(3.4e-05-9.17e-04);细胞-至-细胞信号传导和相互作用(6.97e-05-9.56e-04);分子转运(7.43e-05-9.7e-04);蛋白质运输(7.43e-05-7.43e-05);rna运输(1.57e-04-5.72e-04);蛋白质合成(1.92e-04-9.02e-04);细胞损害(2.47e-04-6.28e-04);以及细胞信号传导(4.64e-04-9.02e-04)。lmw-ds诱导了76个基因在huvec培养物中的差异表达,如在比较d2对照与d2lmw-ds处理的样品时所评估的。受这些基因影响的分子功能涉及dna复制、重组和修复(9.62e-05-2.57e-02);细胞周期(1.22e-04-2.4e-02);细胞发育(1.59e-04-2.67e-02);细胞形态(4.64e-04-2.42e-02);细胞功能和维护(4.64e-04-2.57e-02);脂质代谢(9.49e-04-1.07e-02);分子转运(9.49e-04-1.61e-02);小分子生物化学(9.49e-04-1.87e-02);细胞损害(1.6e-03-2.62e-02);细胞死亡和存活(2.06e-03-2.67e-02);氨基酸代谢(2.7e-03-2.7e-03);碳水化合物代谢(2.7e-03-1.07e-02);细胞-至-细胞信号传导和相互作用(2.7e-03-2.4e-02);细胞组装和组织(2.7e-03-2.57e-02);细胞生长和增殖(2.7e-03-2.4e-02);细胞运动(2.7e-03-2.4e-02);能量生产(2.7e-03-2.7e-03);核酸代谢(2.7e-03-1.07e-02);翻译后修饰(2.7e-03-1.61e-02);基因表达(5.39e-03-2.36e-02);rna转录后修饰(5.39e-03-2.4e-02);药物代谢(8.07e-03-1.61e-02);维生素和矿物质代谢(8.07e-03-8.07e-03);蛋白质合成(1.07e-02-1.07e-02);rna运输(1.07e-02-1.07e-02);细胞对治疗剂的响应(1.24e-02-1.24e-02);以及自由基清除(1.43e-02-1.43e-02)。尽管第一手处理2天后,对照和lmw-ds处理的培养物之间的总体差异似乎并不大,但lmw-ds对基因表达变化的影响是显著的,特别是当考虑到lmw-ds对生长因子诱导的基因表达的调节时。使用机制分子网络模型,可模拟由lmw-ds差异调节的基因的作用,以寻找这些变化的功能性结果。计算机模拟模型表明,lmw-ds抑制神经元细胞死亡;凋亡;和蛋白质合成并激活血管生成;细胞迁移;细胞存活力;细胞存活;细胞运动;细胞增殖;细胞分化;细胞内稳态;细胞周期进程;细胞转化;和rna的表达。huvec对照培养物包含生长因子。在经处理的培养物中,将lmw-ds添加到已含有生长因子的培养基。表7汇总了培养的huvec中基因表达变化的结果。在两天内在对照培养物中表达发生改变的67个基因(在生长因子的作用下)在相同的两天内在lmw-ds处理的培养物中根本没有显示出任何变化。在相同的两天内,在具有生长因子的对照培养物中表达增加的4个基因在lmw-ds处理的培养物中被下调。在两天内,在对照培养物中被生长因子下调的11个基因在lmw-ds处理的培养物中被上调。120个基因被生长因子显著下调,并且这种下调在lmw-ds处理的培养物中甚至更强。在对照培养物中229个基因被上调,并且lmw-ds的添加使得这种上调显著更强。表7-huvec中基因表达变化的总体模式分析了lmw-ds对几种分子途径的影响,这些分子途径对于不同的疾病状况和治疗应用很重要。为了进行分析,将添加lmw-ds对基因表达的作用与在cm细胞中观察到的作用进行了比较,并且基于观察到的表达模式的变化预测了功能性作用。运动神经元的表达分析如前所述,在尝试任何分析之前,已移除了运动神经元中不表达的基因。对于log2转换后的表达式值,将‘低表达’水平设置为5。这留下了12,240种独特的探针,其中系列中的至少三个样品满足表达阈值。在下一步中,分析了三组数据以建立cm对细胞的作用以及lmw-ds诱导的差异。在正常培养条件下基因表达的变化模拟了运动神经元在从一组解离的细胞发育为运动神经元表型时的正常发育过程。正常培养基中的生长因子是这些细胞分化所必需的那些。这些培养物中存在的应激因子是氧化应激(组织培养条件正常)。当比较d0对照和d2对照样品时,485个基因在运动神经元培养物中差异表达。受这些基因影响的分子功能涉及细胞死亡和存活(1.99e-17-1.98e-04);细胞运动(1.14e-16-1.91e-04);细胞组装和组织(1.22e-16-1.93e-04);细胞功能和维持(1.22e-16-1.95e-04);细胞形态(6.46e-16-1.74e-04);细胞-至-细胞信号传导和相互作用(3.16e-12-1.95e-04);细胞发育(1.59e-10-1.93e-04);细胞生长和增殖(1.59e-10-1.9e-04);分子转运(4.27e-10-1.89e-04);蛋白质合成(9.85e-09-5.03e-05);脂质代谢(1.08e-08-1.61e-04);小分子生物化学(1.08e-08-1.89e-04);基因表达(8.45e-08-3.8e-05);细胞周期(4.55e-07-1.09e-04);自由基清除(7.12e-07-1.65e-04);细胞信号传导(1.23e-05-1.89e-04);维生素和矿物质代谢(1.23e-05-1.89e-04);蛋白质降解(3.07e-05-1.31e-04);碳水化合物代谢(3.32e-05-1.61e-04);药物代谢(4.16e-05-4.16e-05);翻译后修饰(7.1e-05-1.31e-04);以及蛋白质折叠(7.1e-05-7.1e-05)。lmw-ds诱导了315个基因在运动神经元中的差异表达,如在比较d0对照与d2lmw-ds处理的样品时所评估的。受这些基因影响的分子功能涉及细胞死亡和存活(6.54e-08-9.06e-03)、细胞运动(8.21e-08-5.42e-03);细胞组装和组织(8.36e-08-9.01e-03);细胞功能和维护(8.36e-08-9.01e-03);细胞形态(2.9e-06-8.75e-03);细胞发育(1.04e-05-9.01e-03);细胞生长和增殖(1.04e-05-7.83e-03);dna复制、重组和修复(2.79e-05-8.01e-03);细胞-至-细胞信号传导和相互作用(8.18e-05-7.11e-03);翻译后修饰(1.32e-04-7.56e-03);蛋白质降解(1.32e-04-4.35e-03);蛋白质合成(1.32e-04-5.09e-03);基因表达(1.9e-04-9.01e-03);细胞损害(3.58e-04-9.01e-03);细胞周期(6.08e-04-9.01e-03);自由基清除(7.41e-04-7.31e-03);氨基酸代谢(7.67e-04-6.61e-03);小分子生物化学(7.67e-04-9.01e-03);维生素和矿物质代谢(7.67e-04-1.13e-03);脂质代谢(1.05e-03-9.01e-03);分子转运(1.05e-03-9.01e-03);细胞信号传导(1.13e-03-5.09e-03);以及碳水化合物代谢(4.71e-03-4.71e-03)。lmw-ds诱导了425个基因在运动神经元中的差异表达,如在比较d0对照与d2lmw-ds处理的样品时所评估的。受这些基因影响的分子功能涉及细胞死亡和存活(2.87e-08-6.27e-03);细胞运动(4.73e-07-6.47e-03);细胞形态(4.95e-07-7.47e-03);细胞发育(1.02e-06-7.13e-03);细胞生长和增殖(1.02e-06-7.48e-03);细胞组装和组织(7.03e-06-7.47e-03);细胞功能和维护(7.03e-06-7.47e-03);基因表达(1.95e-05-6.18e-03);细胞周期(2.88e-05-7.48e-03);dna复制、重组和修复(3.39e-05-5.16e-03);氨基酸代谢(7.75e-05-4.68e-03);小分子生物化学(7.75e-05-4.68e-03);细胞损害(8.23e-05-4.61e-03);细胞-至-细胞信号传导和相互作用(3.27e-04-7.48e-03);维生素和矿物质代谢(3.27e-04-3.27e-04);蛋白质合成(8.94e-04-5.29e-03);翻译后修饰(9.67e-04-9.67e-04);分子转运(9.7e-04-4.68e-03);蛋白质运输(9.7e-04-9.7e-04);碳水化合物代谢(1.44e-03-1.92e-03);细胞对治疗剂的响应(1.92e-03-1.92e-03);以及脂质代谢(4.68e-03-4.68e-03)。表8–运动神经元中基因表达变化的总体模式皮层神经元的表达分析如前所述,在尝试任何分析之前,已移除了运动神经元中不表达的基因。对于log2转换后的表达式值,将‘低表达’水平设置为5。这留下了10,653种独特的探针,其中系列中的至少三个样品满足表达阈值。在下一步中,分析了三组数据以建立cm对细胞的作用以及lmw-ds诱导的差异。在正常培养条件下基因表达的变化模拟了皮层神经元在从一组解离的细胞发育为皮层神经元表型时的正常发育过程。正常培养基中的生长因子是这些细胞分化所必需的那些。这些培养物中存在的应激因子是氧化应激(对于组织培养条件是正常的)。当比较d0对照和d2对照样品时,1101个基因在运动神经元培养物中差异表达。受这些基因影响的分子功能涉及细胞组装和组织(3.57e-25-6.65e-04);细胞功能和维护(3.57e-25-6.65e-04);细胞形态(4.28e-22-6.36e-04);细胞发育(4.28e-22-6.53e-04);细胞生长和增殖(4.28e-22-6.6e-04);细胞-至-细胞信号传导和相互作用(2.16e-13-6.65e-04);分子转运(5.18e-12-4.95e-04);细胞运动(1.86e-11-6.65e-04);细胞死亡和存活(3.37e-11-6.41e-04);基因表达(1.27e-08-8.96e-05);蛋白质合成(3.84e-07-8.69e-05);小分子生物化学(6.65e-07-5.18e-04);细胞损害(7.12e-06-4.54e-04);蛋白质降解(1.62e-05-1.62e-05);氨基酸代谢(2.11e-05-4.25e-04);蛋白质运输(3.4e-05-3.4e-05);细胞信号传导(8.69e-05-3e-04);翻译后修饰(8.69e-05-2.15e-04);蛋白质折叠(2.15e-04-2.15e-04);细胞周期(2.69e-04-3.07e-04);dna复制、重组和修复(2.69e-04-4.77e-04);核酸代谢(2.69e-04-2.69e-04);脂质代谢(3.12e-04-5.18e-04);以及碳水化合物代谢(5.18e-04-5.18e-04)。lmw-ds诱导了609个基因在运动神经元中的差异表达,如在比较d0对照与d2lmw-ds处理的样品时所评估的。受这些基因影响的分子功能涉及细胞组装和组织(3.91e-15-1.83e-03);细胞功能和维护(3.91e-15-1.83e-03);细胞形态(2.53e-13-1.43e-03);细胞发育(2.53e-13-1.81e-03);细胞生长和增殖(2.53e-13-1.83e-03);细胞运动(4.95e-09-1.2e-03);细胞-至-细胞信号传导和相互作用(5.96e-09-1.47e-03);细胞死亡和存活(2.25e-08-1.77e-03);分子转运(7.08e-08-1.79e-03);dna复制、重组和修复(3.03e-06-1.71e-03);细胞损害(9.23e-06-7.65e-04);氨基酸代谢(1.75e-05-1.64e-03);细胞周期(1.75e-05-1.77e-03);小分子生物化学(1.75e-05-1.79e-03);蛋白质合成(2.77e-05-1.5e-03);蛋白质运输(2.77e-05-1.9e-04);细胞信号传导(7.65e-05-1.73e-03);翻译后修饰(3.01e-04-1.4e-03);基因表达(3.65e-04-1.15e-03);药物代谢(6.49e-04-6.49e-04);碳水化合物代谢(6.95e-04-7.69e-04);维生素和矿物质代谢(1.09e-03-1.09e-03);以及核酸代谢(1.44e-03-1.73e-03)。lmw-ds诱导了247个基因在运动神经元中的差异表达,如在比较d0对照与d2lmw-ds处理的样品时所评估的。受这些基因影响的分子功能涉及细胞形态(6.01e-08-1.01e-02);细胞发育(7.46e-08-1.01e-02);细胞生长和增殖(7.46e-08-1.01e-02);细胞死亡和存活(4.23e-07-1.01e-02);细胞运动(2.69e-06-9.91e-03);细胞组装和组织(1.57e-05-1.01e-02);细胞功能和维护(1.57e-05-1.01e-02);细胞周期(1.01e-04-1.01e-02);细胞-至-细胞信号传导和相互作用(1.01e-04-1.01e-02);脂质代谢(1.56e-04-1.01e-02);小分子生物化学(1.56e-04-1.01e-02);基因表达(2.28e-04-3.38e-03);rna损伤和修复(2.28e-04-2.28e-04);rna转录后修饰(2.28e-04-2.28e-04);分子转运(4.18e-04-8.32e-03);细胞损害(4.47e-04-2.2e-03);蛋白质合成(2.66e-03-7.29e-03);蛋白质运输(4.11e-03-8.32e-03);蛋白质降解(5.64e-03-7.29e-03);及dna复制、重组和修复(7.31e-03-1.01e-02)。表9-皮层神经元中基因表达变化的总体模式lmw-ds对线粒体中氧化应激途径的作用线粒体中发生的氧化应激途径不仅对癌症很重要,而且对衰老和年龄相关的变性疾病也很重要。正常的生长条件会触发细胞中一定量的氧化应激,这有助于体内和体外衰老过程。在正常条件下培养的施旺氏细胞中,图18中标记为a的复合物i(nadh脱氢酶)被抑制,而图18中标记为b的复合物iv(细胞色素c氧化酶)被激活。当将lmw-ds添加到培养物时,图18中标记为c)的复合物iii(细胞色素bc1)被抑制。复合物iii的抑制作用抑制了涉及癌症和神经疾病发病机理的氧化应激现象。复合物iii,有时称为辅酶q:细胞色素c-氧化还原酶或细胞色素bc1复合物,是电子传递链(ec1.10.2.2)中的第三个复合物,在atp的生化生成(氧化磷酸化)中起关键作用。复合物iii是由线粒体(细胞色素b)和核基因组(所有其它亚基)两者编码的多亚基跨膜蛋白。复合物iii存在于所有动物和所有好氧真核生物的线粒体以及大多数真细菌的内膜中。复合物iii的突变导致运动不耐受以及多系统病症。bc1复合物含有11个亚基,3个呼吸亚基(细胞色素b、细胞色素c1、rieske蛋白)、2个核心蛋白和6个低分子量蛋白。在用lmw-ds处理后,在huvec中没有检测到氧化应激对线粒体的作用的显著调节。在正常培养条件下,运动神经元似乎遭受显著的氧化应激。这导致一些凋亡机制的激活(在图18中标记为f),并涉及细胞色素c、aif、胱天蛋白酶3、8和9的激活。此外,运动神经元的特征在于细胞中淀粉样蛋白-β的产生(在图18中标记为e),从而进一步加剧了经由fias1的氧化应激和线粒体片段化以及脂肪酸的氧化(在图18中标记为g)。此外,复合物v(在图18中标记为d)被激活。向培养物中添加lmw-ds通过以下方式来减轻这些负面作用:通过关闭反应途径来防止和抑制凋亡(图18中标为f),防止淀粉样蛋白-β产生及其对线粒体片段化和功能异常的负面作用(图18中标为e)和随后的损伤,以及通过抑制脂肪酸氧化(图18中标为g)。lmd-ds还抑制了图18中标记为h的涉及trak1和pink1的反应路径,从而有助于改善线粒体功能。lmw-ds进一步降低了图18中i指示的h2o2的水平。进一步的作用是抑制htra2,在图18中标记为j,从而有助于抑制凋亡。在正常培养条件下,皮层神经元暴露于显著的氧化应激,从而导致淀粉样蛋白-β产生和路易氏体形成(在图18中标记为k),并且涉及突触核蛋白α激活和ros水平增加;凋亡,在图18中标记为f;线粒体片段化,在图18中标记为e;以及线粒体功能降低,在图18中标记为l,并且涉及c161。向培养物中添加lmw-ds能够预防和逆转这些有害作用中的大多数,诸如淀粉样蛋白-β积累和路易氏体发病(在图18中标记为e、k)、线粒体功能异常(在图18中标记为l)。一些凋亡(在图18中标记为f)的诱导机制仍然是活跃的,这可能是由于培养物中的强激活。lmw-ds对谷氨酸兴奋性毒性的作用谷氨酸是一种重要的兴奋性氨基酸,参与长期增强(ltp),即学习和记忆功能。然而,过多的谷氨酸也与兴奋性毒性相关,从而导致神经元死亡。假设这后一现象参与慢性神经变性疾患中触发的神经元死亡,但也参与tbi。参与谷氨酸信号传导的基因在huvec中不表达,但存在于本研究中使用的施旺氏细胞和神经元细胞系中,参见图19。谷氨酸产生受运动神经元培养物中的基线条件抑制。该抑制不受lmw-ds的影响。在基线时,皮层神经元中的谷氨酸产生升高。添加lmw-ds不改变这些细胞中的谷氨酸产生。向施旺氏细胞的cm中添加lmw-ds诱导蛋白质复合物(calm、gβγ、grm7、pick1)的表达,在图19中标记为a。更重要的是,lmw-ds增加了施旺氏细胞中谷氨酸转运蛋白并且特别是slc1a2/3的活性和/或水平,从而导致由突触前神经元产生和释放的谷氨酸的清除。因此,lmw-ds诱导施旺氏细胞从突触间隙移除毒性谷氨酸,从而防止其发挥其兴奋性毒性。slc1a3,溶质载体家族1(胶质高亲和力谷氨酸转运蛋白)成员3,是一种在人体中由slc1a3基因编码的蛋白质。slc1a3也常称为谷氨酸天冬氨酸转运蛋白(glast)或兴奋性氨基酸转运蛋白1(eaat1)。slc1a3主要在质膜中表达,从而使其从细胞外空间移除谷氨酸。它也作为苹果酸-天冬氨酸穿梭的一部分位于线粒体内膜中。slc1a3在体内作为同源三聚体发挥作用。slc1a3通过三个na+和一个h+阳离子的共转运以及一个k+阳离子的反向转运来介导谷氨酸和天冬氨酸的转运。这种共转运偶联(或协同转运)允许谷氨酸抵抗浓度梯度转运到细胞中。slc1a3在整个cns中表达,并在小脑的星形胶质细胞和bergmann胶质细胞中高度表达。在视网膜中,slc1a3在muller细胞中表达。slc1a3也在许多其它组织中表达,包括心肌细胞。slc1a2,溶质载体家族1成员2,也称为兴奋性氨基酸转运蛋白2(eaat2)和谷氨酸转运蛋白1(glt-1),是一种在人体中由slc1a2基因编码的蛋白质。slc1a2是蛋白溶质载体家族的家族成员。膜结合蛋白是从cns中的突触的细胞外空间清除兴奋性神经递质谷氨酸的主要转运蛋白。谷氨酸清除是适当突触激活和防止谷氨酸受体过度激活引起的神经元损伤所必需的。slc1a2负责超过90%的脑内谷氨酸再摄取。这些研究结果表明,在谷氨酸高细胞外水平有害的情况下,如tbi后,lmw-ds可能用于预防谷氨酸兴奋性中毒。lmw-ds对细胞黏附的作用lmw-ds的一个强烈的明显表型效应是对细胞粘附的作用,其是细胞类型特异性的。细胞粘附在神经元中受到最强的影响,其次是在施旺氏细胞中,而huvec不受影响。基因表达的分析表明,这是由于lmw-ds对调节细胞附着的酶(包括金属肽酶,也称为基质金属蛋白酶(mmp))的表达的作用,参见表10。这些分子对调节细胞运动和附着的途径的聚集作用在施旺氏细胞中(17个分子,参见表10)是使得细胞粘附受到抑制同时细胞运动被激活,而在huvec(1个分子,adam11)中,粘附不受影响但血管生成被激活。表10-施旺氏细胞中调节细胞运动和附着的途径的分子分析了在神经元中lmw-ds诱导的差别基因表达的作用。在运动神经元中,相同的金属肽酶依赖性途径可能是造成在施旺氏细胞中观察到的细胞脱离的原因,参见表11。表11-运动神经元中调节细胞运动和附着的途径的分子然而,没有发现mmp相关基因在皮层神经元中差异表达。这一发现导致对影响细胞附着和粘附相关分子的所有分子相互作用以及它们在四种不同培养物中对细胞附着的作用的重新评估。217种附着相关分子(197个基因和20种药物)的完整列表如下所示:ace2、acp1、adam15、adgrb1、adgre2、adipoq、ag490、ambn、angpt1、antxr1、arap3、arms2、巴马司他、bcam、bcap31、bcar1、苄氧羰基-leu-leu-leu-醛、bmp2、bmp4、btc、c1qbp、ca2+、ca9、cadm1、calr、花萼海绵诱癌素a、胱天蛋白酶、cbl、cd209、cd36、cd44、cd46、cdh13、西立伐他汀、氯霉素、硫酸软骨素、clec4m、秋水仙碱、i型胶原、一种或多种胶原、comp、crk、crp、csf1、csf2rb、ctgf、姜黄素、cxcl12、环状amp、dab2、dag1、dcn、ddr1、去铁外螯素772sm、dock2、dsg2、dsg4、多晶型磷灰石(durapatite)、efna、efna1、efnb、efnb1、egf、egfr、egr1、eln、eng、ep300、eph受体、epha8、ephb1、依替巴肽、乙二胺四乙酸、ets1、f11r、f3、fbln5、fbn1、fc受体、fcn2、fermt2、fes、fgf2、fgfr1、纤维蛋白、fn1、粘着斑激酶、fsh、fut3、fut6、fut7、fyn、hacd1、肝素、组蛋白h3、组蛋白h4、hras、hspg2、htn1、透明质酸、氢化可的松、过氧化氢、icam1、icam2、igf1r、igg、igg3、il1、il1b、il6、ilk、整联蛋白、整联蛋白α4β1、整联蛋白α、ipo9、itga1、itga2、itga3、itga5、itga6、itgb1、itgb2、itgb3、itgb5、jak2、jnk、kp-sd-1、lamc1、层粘连蛋白、层粘连蛋白1、左旋甲状腺素、lgals3、lif、脂多糖、lox、lrp1、lrpap1、mad1l1、甘露糖、mapk7、mbl2、mertk、甲硝唑、mgat5、mmp2、mn2+、nck、nedd9、nrg1、冈田酸、olr1、p38mapk、pdgfbb、磷脂酰肌醇、pkm、血小板激活因子、pld1、plg、pmp22、podxl、postn、prkcd、ptafr、pten、ptger2、ptk2、ptk2b、ptn、ptpn11、ptprz1、吡咯烷二硫代氨基甲酸酯、rac、ralb、ranbp9、rhoa、rhob、rpsa、sdc3、sele、选择素、sell、sema3a、辛伐他汀、sirpa、sparc、鞘氨醇-1-磷酸酯、spi1、spp1、spry2、src、stard13、swap70、tek、tfpi、tfpi2、tgfa、tgfb1、tgfbi、tgm2、thbs2、thy1、甲状腺激素、timp2、替罗非班、tln1、tln2、tnf、tp63、维a酸、vav1、vcam1、vcan、vegf、vhl、vtn、vwf和wrr-086。在调节细胞附着的197个基因中,没有一个在huvec中被lmw-ds差异调节。在施旺氏细胞培养物中,差异表达的17种分子导致总体上略微增加的附着。然而,在神经元中,表达模式导致这些细胞中细胞附着的显著抑制。结果解释了lmw-ds对细胞粘附的细胞类型特异性作用。该发现还与lmw-ds通过减少组织纤维化和免疫细胞粘附的信号而产生的抗瘢痕形成作用有关(参见实施例5)。受lmw-ds影响的上游调节因子途径在施旺氏细胞中,上游调节因子分析揭示,lmw-ds通过在系统中增加几种生长因子的激活或降低它们的抑制来调节它们的作用,如表12所示。表12-施旺氏细胞中上游调节因子的比较在huvec中,被lmw-ds增强作用的生长因子的数量相对较少,但仍高度显著,参见表13。表13-huvec中上游调节因子的比较在运动神经元中,上游调节因子分析揭示,lmw-ds影响几种生长因子的作用,即增加它们的激活或者减少系统中存在的抑制,如表14所示。表14-运动神经元中上游调节因子的比较在皮质神经元中,在正常培养条件下,大多数生长因子依赖性途径被正常培养基显著激活。在大多数情况下,lmw-ds不改变这种激活。然而,lmw-ds激活的分子是gdf7的下游效应物,表明lmw-ds增强了该生长因子的作用。由于gdf7是神经元的强有力的分化因子,并且这些生长因子的额外激活(对bdnf和nt3的激活)为培养物中这些细胞的增强分化提供了良好解释。讨论huvec的正常培养条件模拟组织缺氧和再灌注后的环境,该环境含有高营养内含物和生长因子,还补充有肝素。lmw-ds处理的培养物模拟了缺氧和再灌注24小时后添加的lmw-ds的作用。这涉及的现实生活场景是缺血性疾患(诸如中风)后的血管生成。在施旺氏细胞中,具有高营养内含物和葡萄糖的对照培养物重演了施旺氏细胞的激活。lmw-ds处理的培养物模拟了胶质细胞激活24小时后添加的lmw-ds的作用。这种重演的现实生活场景是神经系统损伤后(诸如tbi后)的胶质细胞激活。具有高营养内含物和生长因子的神经元(运动神经元和皮层神经元两者)的正常培养条件模拟了正常神经元分化期间的环境。这些培养物中唯一的负面作用是细胞遭受的氧化应激。这涉及的现实生活场景是在存在充足的生长和分化因子的情况下由氧化应激驱动的变性疾患。这对应于神经变性疾病或疾患的早期阶段,其中氧化应激起关键作用。从细胞类型可以清楚地看出,在施旺氏细胞和huvec中发现的分子效应支持lmw-ds在以下方面中的作用:针对凋亡的保护;诱导血管生成;增加细胞迁移和运动;增加细胞存活力和存活;以及诱导细胞分化。关键分子途径的分析表明,在神经元中,lmw-ds将降低氧化应激对线粒体的作用并将减少神经变性相关的分子,诸如淀粉样蛋白-β和路易氏体。因此,来自huvec细胞模型的结果表明,lmw-ds可保护其免于细胞损伤并诸如在中风后促进受损或患病组织中新血管的发育。施旺氏细胞的结果表明,lmw-ds可保护其免于患病或受损神经系统中的细胞损失,诸如由tbi或神经变性疾病引起的细胞损失。关键分子途径的分析表明,在施旺氏细胞中,lmw-ds降低了氧化应激对线粒体的作用并增加了谷氨酸的摄取。施旺氏细胞中的结果表明,lmw-ds可保护其免于由于与例如神经变性疾病和tbi有关的氧化应激和谷氨酸兴奋性毒性而在患病或受损的神经系统中发生的细胞损失。特别重要的是,lmw-ds增加了胶质细胞中谷氨酸的摄取,如施旺氏细胞所呈现的。然而,lmw-ds不改变神经元产生谷氨酸。这很重要,因为谷氨酸是ltp、学习和记忆所需的。因此,lmw-ds不改变神经元产生谷氨酸是有益的,因为这种谷氨酸是上述处理中正常神经传递所需的。然而,由于lmw-ds的作用,从受损或垂死细胞中释放的增加的谷氨酸水平将被周围的胶质细胞有效吸收。因此,lmw-ds引起的胶质细胞中谷氨酸转运蛋白的激活有效地移除了由受损或垂死的神经元从神经间隙中释放的谷氨酸。这继而防止谷氨酸发挥其兴奋性毒性并由此损伤另外的神经元。因此,lmw-ds诱导胶质细胞摄取潜在有害的神经毒性量的谷氨酸。因此,神经元中的结果证实了lmw-ds通过减少由氧化应激引起的继发性组织损伤、促进修复和减少变性相关蛋白积累在神经变性疾病、病症和疾患中的潜在治疗用途。综上所述,这些结果支持lmw-ds在一般保护免于凋亡并且特别是保护免于神经元细胞死亡、诱导血管生成、增加细胞迁移和运动、增加细胞存活力和存活、诱导细胞分化、降低氧化应激的作用、降低谷氨酸兴奋性毒性以及降低变性相关蛋白产物(诸如淀粉样蛋白-β和路易氏体)产生中的作用。细胞粘附主要在神经元和施旺氏细胞中受到影响,其中lmw-ds促进细胞脱离和运动。在huvec中,细胞粘附不受影响。对细胞粘附的作用主要是由于金属蛋白酶型酶的表达,但其他粘附分子的调节也有助于这种作用。这一发现也解释了如实施例5中所见的lmw-ds的抗瘢痕形成作用。结果表明,实施例5中所见的抗瘢痕形成作用是由lmw-ds激活降解酶介导的,该酶有助于受损组织中的组织重塑并阻断纤维发生(瘢痕形成)信号。作为病理反应的瘢痕形成是由tgfβ驱动的。tgfβ诱导171种分子的大的互连网络,引起免疫细胞粘附、细胞激活、细胞运动、细胞聚集、纤维化和tgfβ的诱导。lmw-ds的施用完全消除了免疫细胞粘附、细胞激活、细胞聚集、纤维化和tgfβ自激活中的tgfβ诱导作用。即使当tgfβ被激活时,即甚至在存在过量tgfβ的情况下,也观察到了lmw-ds在施旺氏细胞中对由tgfβ驱动的分子网络的这些失活作用。由基因表达数据揭示的作用支持在实施例1中所见的关于细胞附着以及分化和细胞存活的表型变化。因此,这些研究证实了lmw-ds通过促进血管再生、减少继发性组织损伤并促进修复在缺血后状态中的潜在治疗用途,以及对神经变性疾病、病症和疾患的潜在治疗用途,其中它可促进神经元存活、分化和最终修复。对受lmw-ds调节的基因的上游调节因子的分析表明,lmw-ds增强了现有生长因子对细胞的作用,与肝素的作用类似。一种假设是,lmw-ds与生长因子分子结合并促进与其受体的结合。这一假说也得到了以下观察结果的支持:lmw-ds诱导的差异基因表达在其中正常cm已经含有肝素的huvec中相比于在其中正常cm不含有肝素的施旺氏细胞中相对较小。这种作用机制也解释了为什么lmw-ds在tbi急性期有效(如实施例3中所见,此时存在生长因子),而在后期的初始修复尝试已减弱时效果较差。因此,lmw-ds的至少一些治疗效果可能取决于现有的修复机制,这种机制被其放大。在这种情况下,通常建议在任何神经变性疾患中,在组织中存在足够的修复潜力时的疾病或疾患的早期给予lmw-ds。通过保护细胞代谢,lmw-ds在细胞由于缺血、氧化或外伤性损伤而逐渐损失的许多变性疾患中可能是有用的保护性治疗。此类变性疾患的非限制性但例示性的实例包括中风、als、ms、痴呆、tbi、sci、视网膜损伤、ad等。lmw-ds可帮助那些受损组织恢复一些丧失的功能,因为它增强了残留的内在修复机制。lmw-ds的抗瘢痕形成作用表明了其在治疗纤维增生(瘢痕形成)疾患中的潜在用途。这些包括例如青光眼、增生性玻璃体视网膜病变、sah、脑和脊柱外伤性损伤、侵入性手术程序、手术粘连、肩袖损伤、灼烧、重建手术、溃疡性疾患(糖尿病)等。实验结果支持lmw-ds在预防纤维增生(瘢痕形成)疾患的发展和消退在此类纤维增生(瘢痕形成)疾患中已建立的纤维化瘢痕两者中的作用。实施例5本实验研究了lmw-ds对青光眼上小梁网(tm)瘢痕形成的作用材料和方法研究设计通过每周两次重复前房内(ic)注射转化生长因子-β(tgf-β)以增加眼内压(iop),在成年雄性spraguedawley大鼠中诱导青光眼。iop的持续增加(两周后)导致视网膜神经节细胞死亡(30-40%)。从实验开始以15mg/kg通过每天皮下注射来施用lmw-ds,以评估与对照相比的rgc保护。第1组n=12只大鼠;24只眼睛在第0天至第28天之间iop+ictgf-β(每周两次,持续28天)+从第14天至第28天每天皮下施用硫酸葡聚糖。第2组n=8只大鼠;16只眼在第0天至第28天之间iop+ictgf-β(每周两次,持续28天)+从第14天至第28天每天皮下施用媒介物(盐水)。第3组n=8只大鼠;每天8只眼睛iop+完整(未损伤的眼睛)并且8只眼睛iop+icpbs,持续28天。测量终点·iop,在从第0天至第28天的整个研究中每周两次;·免疫组织化学法用于对在第28天对脑特异性同源盒/pou结构域蛋白3a(brn3a)具有免疫反应性的视网膜神经节细胞(rgc)(rgc存活)进行计数;·层粘连蛋白和纤连蛋白的免疫组织化学法用于评价第1组和第2组中第28天小梁网中的瘢痕形成;·第28天进行眼前段和光学相干断层扫描(oct)成像以检查包含rgc轴突的视网膜神经纤维层的角度和厚度;以及·第28天的体重。动物与手术这些实验使用十六只8至10周龄的175-200gspraguedawley雄性大鼠(charlesriver,kent,uk),这些大鼠以自由获取食物和水的方式在12小时的暗/明循环下饲养。手术是根据1986年《动物法案》(英国)提出的内政部指南和arvo关于在眼科和视觉研究中使用动物的声明在伯明翰大学生物医学服务部门进行的。所有眼手术程序和iop测量在吸入麻醉下使用2-5%异氟烷/95%o2(nationalvetsupplies,stoke,uk)以1.5l/min的流速完成。密切监测所有大鼠的术后福利。在第0天,使用15°一次性刀片从角膜切入双眼的前房,形成一个自密封切口,使得能够通过使用自制的一次性无菌玻璃微量移液管(harvardapparatus,kent,uk)产生的通道,进行每周重复两次(每两周)3.5μlic注射(每星期一和星期四)活性人重组tgf-β1(5ng/μl;peprotech,london,uk),持续28天。免疫组织化学(ihc)的组织制备通过暴露于递增浓度的co2杀死大鼠,并用100ml磷酸盐缓冲盐水(pbs)进行透心灌注以洗去血液,然后用100ml4%多聚甲醛(pfa)的pbs溶液(ph7.4)进一步灌注。用于ihc的解剖眼通过在4℃下浸入4%pfa的pbs溶液中2小时进行后固定,然后通过在4℃下浸入递增浓度的蔗糖溶液(含10%、20%和30%蔗糖的pbs;均来自sigma,poole,uk)各24小时进行冷冻保护,然后包埋在剥离模具容器(agarscientific,essex,uk)中的最佳切割温度包埋介质(thermoshandon,runcorn,uk)中。将浸入最佳切割温度包埋介质中的眼在粉碎的干冰中迅速冷冻,然后储存在-80℃,随后在-22℃下使用bright恒冷切片机(bright,huntingdon,uk)穿过视神经头在旁矢状平面中切片,厚度为15μm。将切片封固在带正电荷的载玻片(superfrostplus;fisherscientific,pittsburgh,usa)上,在37℃放置2小时以干燥并保存在-20℃。免疫组织化学将冷冻切片解冻30分钟,然后在pbs中洗涤3×5分钟,接着用0.1%tritonx-100(sigma)透化20分钟。将切片在含0.5%牛血清白蛋白(bsa)和0.3%tween-20(均来自sigma)的pbs溶液中封闭30分钟,并在一抗(表11)中孵育过夜,然后在pbs中洗涤3x5分钟并在室温(rt;20-25℃)下用二抗(表11)孵育1h。然后将切片在pbs中洗涤3x5分钟,并封固在含有4',6-二脒基-2-苯基吲哚(dapi)的vectorchield封固介质(vectorlaboratories)中。仅与二抗一起孵育的对照组织切片均为阴性染色(未显示)。表11-免疫组织化学中使用的抗体免疫组织化学定量免疫荧光染色后,在zeissaxioplan2epi-荧光显微镜(carlzeissltd)上观察切片,并使用zeissaxiocamhrc对每种抗体使用相同的暴露时间捕获图像。根据先前描述的方法对ihc进行定量(hill等人,decorinreducesintraocularpressureandretinalganglioncelllossinrodentsthroughfibrolysisofthescarredtrabecularmeshwork.investophthalmolvissci.2015,56(6):3743-3757)。简而言之,用于tm纤维化定量的感兴趣区域由针对tm内所有眼睛/处理的相同规定大小的象限限定,并且在tm的该限定象限内对ecm沉积进行定量,并且使用imagej软件(nationalinstitutesofhealth,usa)计算在标准化背景阈值之上的免疫荧光像素%。对于每种抗体,使用完整的未处理的眼切片设定tm区域中的亮度阈值水平,以限定用于像素强度的测试组分析的参考水平。为图像分配随机数,以确保评估者在量化期间对处理组不知情。为了对视网膜切片中的rgc进行定量,在距视神经任一侧的神经节细胞层250μm线性部分的15μm厚的视网膜旁矢状切面中对rpbms+/dapi+rgc进行计数。定量对照组和处理组中每只眼睛的四个视网膜切片。为图像分配随机数,以确保评估者在量化期间对处理组不知情。统计数据所有统计分析均使用spss20(ibm,usa)进行。进行正态分布测试以确定最适当的统计分析来比较处理。统计学显著性确定为p<0.05。对于>2组比较±sem,使用学生t检验或单因素anova对tm纤维化进行显著性差异测试,并以平均值±sem的形式在正文中给出或以图表形式显示。结果lmw-ds处理显著减轻了tm瘢痕形成,如就免疫反应性层粘连蛋白(图20)和纤连蛋白(图21)的水平角度来说显著降低(p<0.001层粘连蛋白;p<0.01纤连蛋白)所证明的。讨论lmw-ds处理诱导已形成的tm瘢痕成分的溶解,因为就硫酸葡聚糖处理的大鼠角度来说层粘连蛋白和纤连蛋白的水平显著较低。lmw-ds的这种抗瘢痕形成作用由此表明该药物可用于溶解已形成的瘢痕,并从而在例如纤维化疾患的情况下能够使组织重塑和伤口愈合。实施例6阿尔茨海默氏病(ad)对于患者及其家庭是毁灭性的,并且是需要大量经济资源的医疗保健系统的主要负担。当前的策略试图给患者带来症状的微小且通常短暂的改善,但许多根本不能获益,几乎不能给患者提供治疗益处。疾病改善药物将改变治疗,并可能深入市场。ad的病理特征是存在由β-淀粉样蛋白组成的老年斑。β-淀粉样蛋白低聚以负面影响生理神经传递以及形成神经毒性复合物。低聚β-淀粉样蛋白的部分有害作用是经由与细胞朊病毒蛋白(prpc)的蛋白-蛋白相互作用来介导的。因此,抑制这种蛋白-蛋白相互作用的药理学策略具有作为疾病改善治疗的潜力。本研究研究了lmw-ds抑制低聚β-淀粉样蛋白与prpc之间的蛋白-蛋白相互作用的能力,以试图揭示治疗ad的治疗性疾病修饰潜力。材料与方法化学品和抗体链霉亲和素hrp来自biolegend;β-淀粉样蛋白-(1-42)-生物素来自innovagen;正常人细胞病朊病毒蛋白(prpc)来自merck;tmb来自ebioscience;1,1,1,3,3,3-六氟-2-丙醇(hfip)来自sigma;抗淀粉样蛋白β抗体克隆6e10来自biolegend;抗小鼠hrp来自cellsignaling;平均m.w.>500,000da的硫酸葡聚糖钠盐(dsss)来自sigma;葡聚糖(m.w.450,000–650,000da)来自sigma;maxisorp板来自sigma。淀粉样蛋白-β低聚体的制备β-淀粉样蛋白的低聚基于先前的方法进行优化的(stine等人,methodsmol.biol.2011,670:13-32;aimi等人,jneurochem.2015,134:611-617)。简言之,将淀粉样蛋白-β溶解于hfip中至终浓度为1.0mm,进行保护性超声处理并小心蒸发hfip。将产生的肽膜在-20℃下保存在密封容器中。使用前,将肽膜缓慢溶解于dmso中至终浓度为5.0mm,并进行保护性超声处理10分钟。为了制备低聚体,将dmso溶液在冰冷的dmem培养基中稀释至终浓度为100μm,并在37℃(β-淀粉样蛋白-生物素)孵育16小时。为了制备单体,将dmso溶液在冰冷的18mohm水中稀释至终浓度为100μm,并立即使用。淀粉样蛋白-β单体和低聚体的鉴别将经优化以生成淀粉样蛋白-β的单体或低聚体的制备物溶解于含有5%sds的非还原性凝胶样品缓冲液中。使用非还原mes运行缓冲液在15%bis-tris凝胶上跑蛋白质。将凝胶转移至pvdf,在10%脱脂乳中封闭,然后在4℃下与抗淀粉样蛋白-β抗体孵育过夜,并用抗小鼠hrp显影,然后进行ecl显影,并暴露于膜。定量低聚淀粉样蛋白-β与prpc之间的蛋白-蛋白相互作用的elisa方法将prpc在碳酸盐包被缓冲液中稀释至10x包被量(100μl;最终量为500ngprpc/孔),并施加到maxisorp板。然后将板密封并在4℃下放置过夜。将包被的板在pbs-tween20中小心地洗涤,并用含2%bsa的pbs溶液封闭。洗涤板,并将100μl低聚淀粉样蛋白-β-生物素肽制备物(终浓度200nm)与测试化合物小心混合,然后添加到每个孔。将板在室温下孵育60分钟,洗涤并用链霉亲和素-hrp处理,并且在进一步洗涤后,使用tmb显色(用2nh2so4终止反应)。在30分钟内在450nm处读取吸光度。所有条件一式三份地进行。如aimi等人,jneurochem.2015,134:611-617所述计算淀粉样蛋白-β-生物素与prpc的结合。曲线拟合通过迭代曲线拟合到浮动四参数逻辑方程进行定量药理学分析。结果淀粉样蛋白-β单体和低聚体的产生淀粉样蛋白-β单体和低聚体经由优化方案制备,并且与aimi等人,jneurochem.2015,134:611-617描述的结果相比,导致成功的低聚化至更大的表观效率(图22)。用于定量评估低聚淀粉样蛋白β与prpc之间的蛋白-蛋白相互作用的elisa方法的优化aimi等人,jneurochem.2015,134:611-617报告的方法没有指定elisa板上每孔要包被的蛋白质的量,而是暗示每孔50ngprpc。然而,当将该量包被在板上时,用低聚淀粉样蛋白-β没有明显的特异性结合信号。使用更有效的包被缓冲液重复实验,但仍然没有明显的信号。maxisorp板缺乏信号和已知的理论最大结合能力(600-650ng/cm2)表明,包被水平次佳。因此,评价了一系列的prpc包被水平;在每孔250ngprpc下,明显低聚淀粉样蛋白-β的信号相对较小,而在每孔500ngprpc的包被水平下,则显示出更稳健和可再现的信号。这种包被量根据已公开的文献(beringe等人,brain.2003,126:2065-2073使用500ng/孔;nakato等人,jimmunol.2012,189:1540-1544使用250ng/孔,以及souan等人,eurjimmunol.2001,31:2338-2346使用1.0μg/孔的各种朊病毒蛋白构建体)。dsss和lmw-ds竞争低聚淀粉样蛋白-β与prpc之间的蛋白-蛋白相互作用的能力dsss以浓度依赖性方式竞争低聚淀粉样蛋白β与prpc之间的蛋白-蛋白相互作用,lmw-ds也是如此(图23;表12)。定量药理学分析表明,lmw-ds显示出与dsss相当的整体亲和力,而在可竞争结合和希尔系数的并排水平上的明显差异表明了这两种化合物之间的差异相互作用(图23;表12)。与dsss和lmw-ds相反,葡聚糖未能可观地竞争低聚淀粉样蛋白-β与prpc之间的蛋白-蛋白相互作用。表12-竞争淀粉样蛋白-β与prpc之间的蛋白-蛋白相互作用的能力的定量药理学分析化合物竞争结合率(%)ic50(μg/ml)希尔系数dsss101±20.62±0.071.51±0.06lmw-ds85±40.42±0.161.00±0.21讨论先前已报告高分子量硫酸葡聚糖(dsss)可以低μg/ml范围的有效浓度竞争低聚淀粉样蛋白-β与prpc之间的蛋白-蛋白相互作用(aimi等人,jneurochem.2015,134:611-617)。在本研究中,相对于aimi等人的研究,该方法的优化导致产生明显更大比例的低聚淀粉样蛋白-β。蛋白-蛋白相互作用elisa的优化导致更大程度的特异性蛋白-蛋白相互作用;竞争的更大动态范围促进了竞争化合物之间相互作用的定量药理学分析。因此,本研究代表了对aimi等人报告的研究的改进。dsss和lmw-ds显示出竞争低聚淀粉样蛋白-β与prpc之间的蛋白-蛋白相互作用的相当的亲和力,分别产生0.62±0.07和0.42±0.16μg/ml的ic50值。竞争性质的希尔分析表明,与dsss相关的相对高的希尔系数相比,lmw-ds显示出较浅的竞争曲线,这为dsss与lmw-ds之间的差别药理学作用提供了证据。lmw-ds由此竞争低聚淀粉样蛋白-β与prpc之间的蛋白-蛋白相互作用,并且由此可用于防止或至少抑制这种蛋白-蛋白相互作用。如用lmw-ds所观察到的这种效应在涉及低聚淀粉样蛋白-β与prpc之间的蛋白-蛋白相互作用的疾病和疾患(诸如ad)中具有潜力。实施例7本研究的目的是评价lmw-ds对大鼠中闭合性脑弥漫性严重tbi(stbi)实验模型产生的生化、分子和组织解剖学损伤的潜在神经保护作用。在本研究中,通过hplc分析获得代表经处理动物的脑组织提取物中的能量代谢、氧化/亚硝化应激、抗氧化剂和游离氨基酸的低分子量代谢物的结果。材料和方法stbi的诱导和药物施用方案本研究中使用体重为300-350g的雄性wistar大鼠(n=160)。在受控环境中随意给它们喂食标准实验室饮食和水。作为可接受的麻醉混合物,动物通过肌肉内注射接受35mg/体重kg的氯胺酮和0.25mg/体重kg的咪达唑仑。根据marmarou等人j.neurosurg.1994,80:291-300建立的“重量下落”撞击加速模型诱导弥漫性stbi。该模型引起弥漫性轴索损伤,并且能够再现人体中弥漫性tbi的物理和机械特性。通过将450g重物从2米的高度掉落到由头盔(预先用牙科粘固剂固定在颅骨上的金属盘)保护的大鼠头上以将机械力均匀地分配到脑,从而诱导严重tbi。将大鼠俯卧放置在插入特殊容器中的特定聚氨酯泡沫床上;这种泡沫消散了大部分的势能(来自机械力),并防止动物在撞击后的可能产生脊柱损伤的任何回弹。研究排除了患有颅骨骨折、癫痫发作、鼻出血或在撞击下未存活的大鼠。自tbi诱导的2天或7天后,将大鼠再次麻醉,然后立即处死。这些时间点与最严重的生化紊乱相一致(2天),或者在轻度脑损伤的情况下,与完全的代谢恢复相一致(7天)。药物处理包括皮下注射0.5mllmw-ds(tikomed),并根据下述示意方案以3种不同浓度(1、5和15mg/kg体重)施用。假手术动物经历相同的麻醉程序,但不经历tbi,并用作对照组。实验设计将本研究中所用的大鼠分成4组,以便在tbi后两个不同时间对三种不同浓度lmw-ds的效力进行研究。如随后所述,根据下文所述的程序,在每组中存在经受特定处理以用于代谢分析的动物和旨在进行组织形态学研究的其他动物。组-1专门用于生化评价的对照(n=12)。另外四只动物用于组织形态学研究。该组中的大鼠总数:n=16组-2将经受stbi而未药理学处理的大鼠分成以下亚组:1.12只动物经受stbi,并在tbi后第2天处死2.12只动物经受stbi,并在tbi后第7天处死每个亚组中另外四只大鼠用于组织形态学研究。该组中的大鼠总数:n=32。组-3大鼠经受stbi并在tbi后30分钟后接受单次lmw-ds施用,在tbi后第2天处死。将动物分成以下亚组:1.12只动物经受stbi并用1mg/kgb.w.lmw-ds处理2.12只动物经受stbi并用5mg/kgb.w.lmw-ds处理3.12只动物经受stbi并用15mg/kgb.w.lmw-ds处理每个亚组中另外四只大鼠用于组织形态学研究。该组中的大鼠总数:n=48。组-4大鼠经受stbi并在tbi后30分钟后接受单次lmw-ds施用,在tbi后第7天处死。将动物分成以下亚组:1.12只动物经受stbi并用1mg/kgb.w.lmw-ds处理2.12只动物经受stbi并用5mg/kgb.w.lmw-ds处理3.12只动物经受stbi并用15mg/kgb.w.lmw-ds处理每个亚组中另外四只大鼠用于组织形态学研究。该组中的大鼠总数:n=48。组-5大鼠(n=12)经受stbi,并在tbi后30分钟、第3天和第5天接受最大剂量lmw-ds(15mg/kgb.w.)的重复施用,在tbi后第7天处死。另外四只大鼠用于组织形态学研究。该组中的大鼠总数:n=16用于生化和基因表达分析的脑组织处理为了使代谢物损失最小化,在麻醉期间在所有动物中进行体内颅骨切除术。小心移除大鼠颅骨,暴露脑,沿矢状裂隙锐性切开,并将两个半球分开。将专用于生化分析的半球用在液氮中预冷却的铝制舌片冷冻夹紧,然后浸入液氮中。引入冷冻-夹紧程序以加速组织的冷冻,从而使潜在的代谢物损失最小化。将用于分子生物学分析的剩余半球置于5-10体积的溶液(invitrogenlifetechnologies)中,是一种稳定rna并保护rna免于降解的rna稳定溶液。将脑样品在4℃下保存过夜以允许溶液完全渗透组织。如下所述进行用于代谢物分析的组织均质化。测定湿重(w.w.)后,将冷冻的半球置于7ml冰冷的、氮饱和的沉淀溶液(1:10w/v)中,该溶液由ch3cn+10mmkh2po4(ph7.40)(3:1;v:v)组成,并使用设置为24,000rpm/min的ultra-turrax均质器(janke&kunkel,staufen,germany)进行均质化。在20,690×g下于4℃离心10分钟后,保留澄清的上清液,向沉淀物中补充等分的10mmkh2po4,并且如上所述再次均质化并在-20℃保存过夜,以便从组织中完全回收水相。进行第二次离心(20,690×g,4℃下10分钟),并且通过用两倍体积的hplc级chcl3剧烈搅拌提取与先前获得的那些合并的上清液,并如上所述离心。收集上层水相(含有水溶性低分子量化合物),再用氯仿洗涤两次(该程序允许从缓冲的组织提取物中移除所有有机溶剂和任何脂溶性化合物),用10mmkh2po4(ph7.40)调节体积,以最终得到10%的含水组织匀浆,并保存在-80℃下直至测定。能量代谢物、抗氧化剂和氧化/亚硝化应激生物标志物的hplc分析将每个脱蛋白组织样品的等分试样通过0.45μmhvmillipore过滤器进行过滤,并将其上样(200μl)到hypersilc-18,250x4.6mm,5μm粒径的柱上,该柱配有其自身的保护柱(thermofisherscientific,rodano,milan,italy)并与hplc仪器连接,该hplc仪器由具有高度灵敏二极管阵列检测器(配备5cm光路流通池)的surveyor系统(thermofisherscientific,rodano,milan,italy)组成并设置在200和300nm波长之间。数据采集和分析由pc使用hplc制造商提供的chrom软件包进行。根据先前对现有离子配对hplc方法的细微修改,在单次色谱运行中分离与组织能量状态、线粒体功能抗氧化剂和代表氧化/亚硝化应激相关的代谢物(列于下文)(lazzarino等人,analbiochem.2003,322:51-59;tavazzi等人,clinbiochem.2005,38:997-1008)。通过将保留时间、吸收光谱和峰面积与具有已知浓度的新鲜制备的超纯标准混合物的色谱运行峰的那些值进行比较,在适当的波长(206、234和260nm)下进行组织提取物的色谱运行中感兴趣化合物的分配和计算。化合物列表:细胞嘧啶、肌酐、尿嘧啶、β-假尿苷、胞苷、次黄嘌呤、鸟嘌呤、黄嘌呤、cdp-胆碱、抗坏血酸、尿苷、亚硝酸盐(no2)、还原型谷胱甘肽(gsh)、肌苷、尿酸、鸟苷、cmp、丙二醛(mda)、硝酸盐(no3)、ump、nad+、ado、imp、gmp、udp-葡萄糖(udp-glc)、udp-半乳糖(udp-gal)、udp-n-乙酰-葡萄糖胺(udp-glcnac)、udp-n-乙酰-半乳糖胺(udp-galnac)、amp、gdp-葡萄糖、udp、gdp、nadp+、adp-核糖、ctp、adp、utp、gtp、nadh、atp、nadph、丙二酰coa、辅酶a(coa-sh)、乙酰coa、n-乙酰天冬氨酸(naa)。游离氨基酸和含氨基基团的化合物的hplc分析用opa和mpa的混合物对样品进行柱前衍生化,同时测定主要游离氨基酸(faa)和含氨基基团的化合物(agcc)(列于下文),如(amorini等人,jcellmolmed.2017,21(3):530-542;amorino等人,molcellbiochem.2012,359:205-216)中所述。简而言之,每天制备由25mmol/lopa、1%mpa、237.5mmol/l硼酸钠(ph9.8)组成的衍生混合物,并将其放入自动取样器中。在24℃下用opa-mpa对样品(15μl)进行自动柱前衍生,并将25μl衍生混合物上样到hplc柱(hypersilc-18,250×4.6mm,5μm粒度,恒温21℃)上用于随后的色谱分离。为了正确定量谷氨酸,在衍生化程序和随后的注射之前,用hplc级h2o将脱蛋白质的脑提取物稀释20倍。使用合适的阶梯梯度,使用两种流动相(流动相a=24mmol/lch3coona+24mmol/lna2hpo4+1%四氢呋喃+0.1%三氟乙酸,ph6.5;流动相b=40%ch3oh+30%ch3cn+30%h2o)以1.2ml/min的流速进行opa-aa和opa-agcc的分离。通过将保留时间和峰面积与具有已知浓度的新鲜制备的超纯标准混合物的色谱运行峰的那些值进行比较,在338nm波长下进行全脑提取物的色谱运行中opa-aa和opa-agcc的分配和计算。faa和agcc化合物的列表:天冬氨酸(asp)、谷氨酸(glu)、天冬酰胺(asn)、丝氨酸(ser)、谷氨酰胺(gln)、组氨酸(his)、甘氨酸(gly)、苏氨酸(thr)、瓜氨酸(citr)、精氨酸(arg)、丙氨酸(ala)、牛磺酸(tau)、γ-氨基丁酸(gaba)、酪氨酸(tyr)、s-腺苷同型半胱氨酸(sah)、l-胱硫醚(l-cystat)、缬氨酸(val)、甲硫氨酸(met)、色氨酸(trp)、苯丙氨酸(phe)、异亮氨酸(ile)、亮氨酸(leu)、鸟氨酸(orn)、赖氨酸(lys)。用于组织形态学分析的脑组织处理如(dipietro等人,scirep.2017,7(1):9189)中所述,将大鼠充分麻醉后进行穿心灌注。简而言之,进行胸廓切开术并将肝素溶液施用到门静脉中,以避免在所有手术期间血液凝结。之后,进行右心房切开,并将灌注针推进到升主动脉中。用100mlph7.4的磷酸盐缓冲液(pbs)进行灌注以便洗出血液,然后用100ml4%多聚甲醛(pfa)的ph7.4pbs溶液进一步灌注。从颅骨中快速取出后,通过在4℃下浸入4%pfa的pbs溶液中2小时将每个脑后固定。通过将整个脑在4℃下浸入富含递增蔗糖溶液(10%、20%和30%)的pbs中24小时,然后植入在剥离模具容器(agarscientific,essex,uk)中的最佳切割温度包埋介质(oct)(thermoshandon,runcorn,uk)中,来获得冷冻保护。将浸入oct中的脑在碎干冰中迅速冷冻,然后储存在-80℃下。统计分析通过学生t检验估计各组之间的差异。只有小于0.05的双尾p值被认为是统计学上显著的。结果stbi后第2天记录的生化数据汇总所测量的递增剂量的lmw-ds对脑能量代谢的作用表13汇总了涉及磷酸化的高能嘌呤和嘧啶化合物的值。尤其明显的是,由stbi引起的三磷酸核苷酸(atp、gtp、utp和ctp)的耗竭,其伴随着adp以及udp-葡萄糖(udp-glcnac)和udp-半乳糖(udp-galnac)的n-乙酰化衍生物的增加。在损伤后的这个时间点,用lmw-ds处理在改善细胞能量代谢方面仅部分有效:在所有测试的三种剂量的药物中,记录到高能磷酸(atp、gtp和ctp)的值显著更高。没有观察到对utp和adp浓度的作用。值得回顾的是,大鼠tbi后48小时代表脑代谢的关键时间点,与线粒体功能的最大改变(包括线粒体质量对照中的变化)相一致。在tbi的这个实验模型中,这个时间点可被认为是限定脑代谢恢复或没有恢复的“转折点”。表13-在不具有和具有脑外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在stbi后第2天处死的大鼠脱蛋白脑匀浆中测得的能量代谢物(磷酸化嘌呤和嘧啶)浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。在表13-31中,粗体指示与对照显著不同(p<0.05);带下划线的粗体指示与tbi显著不同(p<0.05);并且粗斜体指示与对照和tbi均显著不同异(p<0.05)。递增剂量的lmw-ds对烟碱辅酶的作用表14汇总了氧化型(nad+和nadp+)和还原型(nadh和nadph)烟碱辅酶的值。该表14还报告了适于评价多少代谢依赖于糖酵解或线粒体氧化磷酸化的nad+/nadh比的计算的无量纲值。如本文先前所观察到的,stbi引起nad+、nadp+以及nad+/nadh比的降低。在该时间点,用lmw-ds处理仅在对烟碱辅酶库产生显著保护并避免代谢向糖酵解转换的测试最大剂量(15mg/kgb.w.)下有效,从而间接表明总体上更好的线粒体功能。表14-在不具有和具有脑外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在stbi后第2天处死的大鼠脱蛋白脑匀浆中测得的烟碱辅酶浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。nad+/nadh比是无量纲的。递增剂量的lmw-ds对coa-sh衍生物的作用表15报告了涉及游离coa-sh和coa-sh衍生物的数据。特别地,乙酰coa是线粒体代谢的关键化合物,其允许三羧酸循环(tca循环)的正确发挥作用,从而确保电子传递链(etc)的持续电子供应。tca是还原型辅酶(nadh和fadh2)产生的主要细胞周期,还原型辅酶通过将电子分别转移到线粒体复合物i和ii,是etc和氧化代谢的燃料。所有化合物,尤其是乙酰coa,均受到stbi的显著影响。在5或15mg/kgb.w时,观察到该化合物的部分挽救。在损伤后30分钟向动物施用lwm-ds。表15-在不具有和具有脑外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在stbi后第2天处死的大鼠脱蛋白脑匀浆中测得的游离coa-sh和coa-sh衍生物(乙酰coa和丙二酰coa)的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。递增剂量的lmw-ds对抗氧化剂和氧化/亚硝化应激生物标志物的作用表16示出了主要水溶性脑抗氧化剂(抗坏血酸和gsh)以及氧化应激(mda)和亚硝化应激(-no2-和-no3-)的生物标志物的浓度。丙二醛(mda)源自膜磷脂的不饱和脂肪酸的分解,这是ros介导的脂质过氧化作用的结果。亚硝酸盐(-no2-)和硝酸盐(-no3-)是一氧化氮(no)代谢的稳定终产物,在病理条件下,其由诱导型一氧化氮合酶(inos)过量产生并通过与ros反应而产生活性氮(rns):在撞击后第二天,在经历stbi的大鼠中发生两种水溶性抗氧化剂均降低25-45%。还记录了氧化/亚硝化应激特征的随后增加。lwm-ds的施用显著改善了抗坏血酸和还原型谷胱甘肽(gsh)的浓度,明显减少了脑组织的亚硝酸盐和硝酸盐。当使用15mgkg/b.w.时,这些作用更显著。表15-在不具有和具有脑外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在tbi后第2天处死的大鼠脱蛋白脑匀浆中测得的抗氧化剂和氧化/亚硝化应激生物标志物的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。递增剂量的lmw-ds对去磷酸化嘌呤和嘧啶的作用表16中报告的大多数化合物源自嘌呤和嘧啶核苷酸的降解途径,并且与细胞能量代谢间接相关。接受stbi的大鼠大脑中所有这些化合物的浓度都较高,但cdp-胆碱除外,其中大多数受药物施用的积极影响。表16-在不具有和具有脑外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在tbi后第2天处死的大鼠脱蛋白脑匀浆中测得的去磷酸化嘌呤和嘧啶的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。递增剂量的lmw-ds对n-乙酰天冬氨酸(naa)的作用naa是哺乳动物脑中最丰富的n-乙酰化氨基酸,其浓度几乎等于人体内神经递质谷氨酸的那些。尽管naa的生物学作用还没有完全阐明,但我们在临床前和临床研究中已清楚地表明tbi降低naa浓度,并且其头部损伤后的时程变化与atp的那些类似。特别地,我们发现stbi引起naa内稳态的不可逆改变,naa是脑能代谢的良好替代标志物,并且在脑震荡后的运动员中,naa水平的降低和恢复比症状清除慢得多。因此,naa在tbi研究中具有特别的相关性。在撞击后两天,在stbi大鼠中观察到全脑naa降低40%(图24)。当以5或15mg/kgb.w.施用时,lmw-ds对naa浓度产生有益作用。尽管显著低于对照,但施用两种药物剂量中的任一种的大鼠中的naa显著高于在stbi大鼠中发现的值,其中在接受最高剂量lmw-ds的大鼠中发现最高的naa水平。递增剂量的lmw-ds对参与神经传递的游离氨基酸的作用表17中所列的化合物是直接(glu、gaba)或间接(gln、asp、asn、gly、ser、thr、ala)参与神经传递的氨基酸。特别地,glu是主要的兴奋性氨基酸,其作用被gaba抵消。glu的兴奋性毒性受ser、gly、thr和ala调节,并且它与涉及神经元和星形胶质细胞的glu-gln循环的功能有关。如先前的研究(16)所示,我们在此发现在损伤后两天这些氨基酸中的大多数在stbi大鼠中增加。当以5或15mg/kgb.w皮下输注药物时,用lmw-ds的单次施用处理动物部分有效。在大多数情况下,不同化合物的值均显著优于在未处理的stbi动物组中发现的那些,但不优于对照的那些。表17-在不具有和具有脑外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在tbi后第2天处死的大鼠脱蛋白脑匀浆中测得的具有神经递质功能的游离氨基酸的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。化合物对照仅tbilmw-ds1lmw-ds5lmw-ds15asp2.88±0.884.55±0.634.17±0.994.15±0.953.05±0.42glu9.92±0.8312.88±0.6012.52±0.9111.93±0.5511.79±0.55asn0.10±0.030.14±0.020.13±0.020.17±0.030.17±0.03ser0.64±0.170.82±0.070.91±0.070.91±0.070.76±0.06gln3.89±0.874.34±0.424.37±0.594.55±0.444.21±0.51gly0.78±0.131.38±0.271.35±0.261.43±0.281.18±0.23thr0.69±0.180.76±0.160.70±0.150.77±0.170.61±0.13ala0.41±0.110.58±0.060.76±0.080.79±0.080.68±0.07gaba1.36±0.221.93±0.171.87±0.171.99±0.181.58±0.14递增剂量的lmw-ds对参与甲基循环的游离氨基酸的作用表18中报告的游离氨基酸或者参与所谓的甲基循环,从而调节在细胞代谢中充当甲基供体的化合物的内稳态,或者参与半胱氨酸的形成,半胱氨酸是唯一具有游离-sh基团的氨基酸。严重的头部外伤导致这一重要代谢途径的主要参与者发生显著变化。通过任何测试剂量下的lwm-ds完成甲硫氨酸的恢复。药物处理在使其他氨基酸正常化方面部分有效。撞击后第7天l-胱硫醚(l-cystat)变化的评论将在相应的表中给出。表18-在不具有和具有脑外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在tbi后第2天处死的大鼠脱蛋白脑匀浆中测得的参与甲基循环以及-sh基团的内稳态的游离氨基酸的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。化合物对照仅tbilmw-ds1lmw-ds5(lmw-ds15sah0.03±0.010.07±0.010.07±0.020.07±0.020.06±0.02l-cystat0.15±0.030.31±0.060.25±0.050.31±0.060.41±0.08met0.03±0.010.02±0.010.04±0.010.05±0.010.03±0.01递增剂量的lmw-ds对参与一氧化氮(no)产生的游离氨基酸的作用表19示出了在由一氧化氮合酶(nos)催化的反应中直接参与no产生的游离氨基酸的浓度,nos是以三种同工型存在的酶家族:内皮nos(enos)、神经元nos(nnos)、诱导型nos(inos)。最后一种同工型(inos)是参与亚硝化应激的同工型。一氧化氮通过复杂的反应生成,其中精氨酸(arg)捐献氮原子,经历部分氧化并形成瓜氨酸(citr)和no。stbi后第2天的动物显示arg的伴随降低和citr的增加,与显示稳定的no终产物亚硝酸盐和硝酸盐增加的数据一致(表15)。当使用15mg/kgb.w.剂量时,lmw-ds的施用尤其有效。表19-在不具有和具有脑外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在tbi后第2天处死的大鼠脱蛋白脑匀浆中测得的参与一氧化氮形成的游离氨基酸的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。化合物对照仅tbilmw-ds1lmw-ds5lmw-ds15citr0.03±0.010.03±0.010.01±0.010.02±0.010.01±0.01arg0.17±0.030.11±0.030.13±0.030.13±0.030.16±0.04orn0.02±0.010.02±0.010.02±0.010.01±0.010.02±0.01递增剂量的lmw-ds对长链游离氨基酸的作用表20中报告的游离氨基酸代表可用于生成细胞用来补充tca循环的α-酮酸的碳骨架来源。在这些化合物中,只有异亮氨酸(ile)受到stbi的显著影响,并在接受药物处理的大鼠中恢复。表20-在不具有和具有脑外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在tbi后第2天处死的大鼠脱蛋白脑匀浆中测得的长链游离氨基酸的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。化合物对照仅tbilmw-ds1lmw-ds5lmw-ds15val0.07±0.020.06±0.030.07±0.030.08±0.030.06±0.03ile0.03±0.010.05±0.010.10±0.020.10±0.020.06±0.01leu0.04±0.010.04±0.010.09±0.020.10±0.020.04±0.01lys0.23±0.030.28±0.100.29±0.110.37±0.140.32±0.12递增剂量的lmw-ds对充当渗透剂的游离氨基酸以及芳族游离氨基酸的作用表21中汇总的结果清楚地表明,stbi引起所有这些游离氨基酸的浓度增加。特别地,牛磺酸(tau)的增加可能表明试图通过提高最重要的脑渗透剂之一的水平来抵消细胞水肿。不同地,芳族游离氨基酸的增加可能表明神经递质血清素(由色氨酸形成)和多巴胺(由首先苯丙氨酸和随后酪氨酸的生物转化产生)的生物合成减少。在撞击后的这个时间点没有观察到lmw-ds施用的显著作用。表21-在不具有和具有脑外伤诱导后30分钟进行的递增剂量的lwm-ds(1、5和15mg/kgb.w.)的单次施用的情况下在tbi后第2天处死的大鼠脱蛋白脑匀浆中测得的充当渗透剂的游离氨基酸以及芳族游离氨基酸的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。化合物对照仅tbilmw-ds1lmw-ds5lmw-ds15tau3.82±0.614.84±0.464.98±0.475.15±0.494.59±0.43hys0.05±0.010.06±0.010.08±0.010.11±0.020.10±0.01tyr0.13±0.030.17±0.030.18±0.030.20±0.030.17±0.03trp0.01±0.010.02±0.010.02±0.010.03±0.010.04±0.01phe0.03±0.010.05±0.010.07±0.030.07±0.030.06±0.01stbi后第7天记录的生化数据汇总所测量的递增剂量的lmw-ds对脑能量代谢的作用表22汇总了涉及磷酸化的高能嘌呤和嘧啶化合物的值。尤其明显的是,在stbi后第7天没有观察到三磷酸核苷酸(atp、gtp、utp和ctp)耗竭的改善。amp和adp的伴随增加伴随着udp衍生物(udp-glc、udp-gal、udp-glcnac和udp-galnac)浓度的显著变化。通常,应当强调的是,受伤后较长时间的特征通常是stbi诱导的生化、代谢、分子改变的恶化。在损伤后的这个时间,用lmw-ds处理产生了脑能量代谢的总体改善,当药物施用剂量高于1mg/kgb.w.时更为明显。尽管甚至在接受15mgkg/b.w.lwm-ds的重复施用的大鼠中也记录了与对照的差异,但在经药物处理的动物中发现核苷三磷酸的值显著更高。特别相关的是计算的无量纲值的atp/adp比率(其被认为是线粒体磷酸化能力的良好指示)的渐进性恢复,该比率通过增加施用给stbi动物的药物剂量而渐进性增加。表22-在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的能量代谢物(磷酸化嘌呤和嘧啶)的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。为了更好地表明药物作用与药物剂量有关,我们在图25中以图形方式报告了有关atp的结果。可以观察到,atp的增加在某种程度上与所施用的剂量有关,并且在任何测试剂量下,药物施用均会使得最重要的高能磷酸盐显著增加。递增剂量的lmw-ds对烟碱辅酶的作用表23汇总了氧化的(nad+和nadp+)和还原的(nadh和nadph)烟碱辅酶的值。表23还报告了适于评价多少代谢依赖于糖酵解或线粒体氧化磷酸化的nad+/nadh比的计算的无量纲值。如先前观察到的,在损伤后第7天,在stbi大鼠中记录了烟碱辅酶和nad+/nadh比大大降低。排除最低剂量,用lmw-ds处理使得烟碱辅酶浓度显著改善。特别地,单次和重复施用15mg/kgb.w.lmw-ds能够使nad+水平正常化,并恢复在对照动物中测定的正确的nad+/nadh比。表23-在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的烟碱辅酶浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。递增剂量的lmw-ds对coa-sh衍生物的作用表24报告了涉及游离coa-sh和coa-sh衍生物的数据。检测出5或15mg/kgb.w.的施用(该剂量作为单次和重复施用两者)对coa-sh和乙酰coa两者的显著积极作用,表明为tca循环的功能提供了更有利的代谢条件。表24-在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的游离coa-sh和coa-sh衍生物(乙酰coa和丙二酰coa)的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。递增剂量的lmw-ds对抗氧化剂和氧化/亚硝化应激生物标志物的作用表25示出了主要水溶性脑抗氧化剂(抗坏血酸和gsh)以及氧化应激(mda)和亚硝化应激(-no2-和-no3-)的生物标志物的浓度。在撞击后第7天,在经历stbi的大鼠中,两种水溶性抗氧化剂的浓度均未恢复。还记录了显著高水平的氧化/亚硝化应激的特征。施用单次和重复最高剂量的lwm-ds的作用尤其有益于挽救抗坏血酸和还原型谷胱甘肽(gsh)两者的浓度,同时明显减少脑组织亚硝酸盐和硝酸盐。当使用5mgkg/b.w.时,这些作用也是显著的。表25-在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的抗氧化剂和氧化/亚硝化应激生物标志物的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。为了更好地理解药物作用与药物剂量有关,我们在图26和图27中以图形方式报告了关于抗坏血酸和gsh的结果。递增剂量的lmw-ds对去磷酸化嘌呤和嘧啶的作用在损伤后第7天,在接受stbi的大鼠中观察到表26中报告的大多数化合物的进一步恶化,这些化合物源自嘌呤和嘧啶核苷酸的降解途径并且与细胞能量代谢间接相关。这些化合物中的大多数受药物施用的积极影响。表26-在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的去磷酸化嘌呤和嘧啶的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。递增剂量的lmw-ds对n-乙酰天冬氨酸(naa)的作用如前所提及,stbi导致naa内稳态的不可逆改变。即使在本研究中,我们发现在stbi后第7天,全脑naa比在对照大鼠中测量的低约50%,参见图28。有趣的是,在接受递增剂量的单次lmw-ds或重复施用的所测试的最大剂量的大鼠中检测到naa的剂量依赖性增加。递增剂量的lmw-ds对参与神经传递的游离氨基酸的作用表27中所列的化合物是直接(glu、gaba)或间接(gln、asp、aasn、gly、ser、thr、ala)参与神经传递的氨基酸。当与对照比较时,在损伤后第7天这些氨基酸中的大多数在stbi大鼠中仍然较高。从该表中可以明显看出,lmw-ds的施用是有效的,尤其是当药物以15mg/kgb.w.的剂量皮下输注(在单次或重复施用中)时。尤其相关的是glu的正常化,因此表明lmw-ds能够消除stbi后由glu过量释放引起的兴奋性毒性。表27-在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的具有神经递质功能的游离氨基酸的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。递增剂量的lmw-ds对参与甲基循环的游离氨基酸的作用如表28所示,与对照的相应值相比,在stbi大鼠中,在撞击后第7天,参与所谓的甲基循环或参与半胱氨酸形成的游离氨基酸的水平仍然不同。在接受最高剂量lwm-ds(作为单次或重复施用两者)的动物中观察到met的增加。如在损伤后第2天已经观察到的,这些药物水平使得l-胱硫醚(l-cystat)显著增加。由于该化合物是半胱氨酸(cys)产生的中间体,可设想假设l-cystat的增加可能使得cys产生相应增加。值得回想的是,cys的测定需要用与仲胺和cys反应的荧光化合物f-moc进行额外衍生化的特定的额外hplc分析。表28-在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的参与甲基循环和-sh基团内稳态的游离氨基酸浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。递增剂量的lmw-ds对参与一氧化氮(no)产生的游离氨基酸的作用表29示出了直接参与no产生的游离氨基酸的浓度。stbi后第7天的动物仍显示arg的伴随降低和citr的增加,与显示稳定的no终产物亚硝酸盐和硝酸盐增加的数据一致(表15)。当使用5或15mg/kgb.w.(单次和重复)时,lmw-ds的施用尤其有效。表29-在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的参与一氧化氮形成的游离氨基酸的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。递增剂量的lmw-ds对长链游离氨基酸的作用表30中报告的游离氨基酸(代表用于生成细胞用来补充tca循环的α-酮酸的碳骨架来源)在stbi后第7天和用感兴趣药物处理的任何其他动物组中实际上是正常的。表30-在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的长链游离氨基酸的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。递增剂量的lmw-ds对充当渗透剂的游离氨基酸以及芳族游离氨基酸的作用表31中汇总的结果清楚地表明,stbi在损伤后第7天引起牛磺酸(tau)浓度的增加。lmw-ds施用使tau浓度正常化并引起芳族氨基酸增加。表31-在不具有和具有递增剂量的lwm-ds施用(1、5和15mg/kgb.w.的单次施用和15mg/kgb.w.的重复施用)的情况下在stbi后第7天处死的大鼠脱蛋白脑匀浆中测得的充当渗透剂的游离氨基酸和芳族游离氨基酸的浓度。对照用假手术动物代表。值是每组12只动物的平均值±标准偏差,并且表示为nmol/gw.w。讨论tbi是最常见的神经变性疾病之一,并且代表西方国家45岁以下死亡的主要原因。它的发病率正在上升,并且到2020年,世界卫生组织估计tbi将成为全球残疾的最大原因。根据与tbi相关的症状的严重程度(由格拉斯哥昏迷量表评价),可鉴别出三种不同类型的tbi:轻度tbi(mtbi),中度tbi和重度tbi(stbi)。已经计算出mtbi与stbi的发生比率为约22比1。不幸的是,tbi的后果通常是使功能无效,并且可能导致认知、身体和社会心理功能的永久性或暂时性损伤,并伴有相关的意识状态的减弱或改变。因此,患者在一些重要方面受到影响,主要是独立、正确工作和维持社会关系的能力。tbi被认为是由直接诱导难以预测的继发性损伤的原发性损伤(作用在脑组织上的撞击力)组成、以导致脑细胞中严重线粒体功能障碍的生化、代谢和分子变化级联为特征的复杂的病理过程。损伤的严重程度取决于作用在脑组织上的撞击力;实际上,该事件引起轴索和神经元纤维的拉伸,从而触发了生化和分子事件,这与临床症状的发作并不同时发生。迄今为止,还没有令人满意的能够降低tbi患者死亡率和改善tbi患者恢复的药理学治疗。通常对推定的药理学治疗在干扰由原发性损伤触发的神经代谢级联方面的能力进行测试,该神经代谢级联诸如脑组织代谢发生的生化和分子改变以及与组织损伤严格相关的血管和血流变化。先前的研究已经证明,tbi的严重程度和与厌氧代谢的速率增加相关的能量缺乏、线粒体功能异常、活性氧(ros)和氮物质(rns)产生的增加以及兴奋性氨基酸释放的增强之间的显著相关性。此外,n-乙酰化氨基酸n-乙酰天冬氨酸(naa)是用于体内监测能量代谢状态的可靠的替代生物标志物。实际上,由于线粒体naa生物合成具有高间接能量消耗,naa脑内浓度的变化与一些参数的内稳态变化密切相关,所述参数与能量代谢(atp、gtp、adp、amp、乙酰-coa、coa-sh和nad+)和线粒体磷酸化能力(atp/adp)相关。该研究旨在评价递增剂量的lmw-ds对在损伤后的不同时间点经历stbi的大鼠中大量脑代谢物的作用,证明施用该化合物产生脑代谢的总体改善。lmw-ds在恢复在未经处理的stbi动物中严重失衡的与线粒体相关的能量代谢方面是有效的,对嘌呤和嘧啶核苷酸三磷酸的浓度具有积极作用。特别地,撞击后第7天的atp水平仅比对照值低16%,而在stbi大鼠中发现35%的降低(表21和图25)。值得注意的是,在相同时间点用lmw-ds处理的动物中naa浓度仅比对照值低16%,而stbi动物显示该化合物的值低48%。这一发现再次强有力地证实了naa的内稳态与正确的线粒体能量代谢之间的严格联系,并强调了能够对线粒体功能产生积极作用的药物干预的重要性。lmw-ds施用所产生的脑代谢的总体改善还涉及烟碱辅酶和游离coa-sh和coa-sh衍生物的代谢。这意味着尽管遭受了stbi,药物处理的动物仍具有准正常的辅酶,以确保正确的氧化还原反应并允许tca循环的良好功能。脑代谢的上述改善肯定有助于其他显著的药物作用,即消除glu兴奋性毒性。另外,药物影响含硫氨基酸。这种作用可能与含有s原子的药物分子有关。增加该原子的生物利用度可能会导致这些氨基酸的生物合成净增加,其中之一(met)对于甲基化反应和所谓的甲基循环至关重要。在该研究中记录的进一步的积极作用是在接受lmw-ds施用的stbi大鼠中抗氧化剂的增加和氧化/亚硝化应激的生化特征的减少。即使这种现象也可能与线粒体功能的正常化有关,因为功能异常的线粒体是ros和rns的主要细胞内来源。与此相关的是,lmw-ds的作用在stbi后第7天比第2天更明显。这有力地表明,由药物施用引起的脑代谢的总体改善不是暂时现象。同样,值得强调的是,在本实验条件下,药物作用通常与所施用的剂量有关,即使15mg/kgb.w的重复施用通常与相同剂量的单次施用类似。即,重复施用药物并不总是有利的。这种矛盾的结果可能具有以下解释:1)众所周知,stbi诱导血脑屏障(bbb)的破坏;2)在bbb改变/破坏期间,lmw-ds被脑组织摄取可能是高度有利的;3)如果点2)的假设是正确的,那么损伤后30分钟进行施用可能发生在bbb仍开放/改变时;4)如果点2)和点3)的假设是正确的,那么在bbb仍然开放/改变时的损伤后早期施用可能促进化合物在脑室内的通过,从而允许该药物能够激发其对脑代谢和功能的有益作用,包括bbb的正常化;5)如果点4)中所报告的是正确的,这意味着在stbi后30分钟施用15mg/kgb.w.lmw-ds除了开启脑代谢正常化之外,还引起bbb关闭,使得第二次(第3天)和第三次(第5天)药物施用在不利于脑区室内进一步显著通过的条件下发生,因此限制了用重复施用方案来获得附加作用的可能性。实施例8在该研究中,通过在diversityplus面板中进行谱分析来表征lmw-ds。面板由基于人原代细胞的系统组成,该系统被设计用于以体外形式对人体的不同方面进行建模。diversityplus面板中的12个系统(表32)允许在对各种人类疾病状态进行建模的广泛系统中以无偏方式表征测试剂。p系统由来自健康人供体的一种或多种原代细胞类型并添加以捕获在人组织或病理疾患中天然存在的相关信号传导网络的刺激物(诸如细胞因子或生长因子)构建而成。在th1(3c系统)和th2(4h系统)炎性环境以及动脉平滑肌细胞特有的th1炎性状态(casm3c系统)中对血管生物学进行建模。其他系统概括了全身免疫响应的各个方面,包括单核细胞驱动的th1炎症(lps系统)或t细胞刺激(sag系统)、巨噬细胞激活驱动的慢性th1炎症(lmphg系统)和生发中心发生的b细胞的t细胞依赖性激活(bt系统)。be3c系统(th1)和bf4t系统(th2)代表肺的气道炎症,而myof系统则模拟肌成纤维细胞-肺组织重塑。最后,在模拟th1皮肤炎症的kf3ct系统和模拟伤口愈合的hdf3cgf系统中阐述了皮肤生物学。每种测试剂生成一个特征谱,该谱是由在各个系统环境中蛋白质生物标志物读出的变化产生的。生物标志物读出(每个系统7-17个)被选择用于治疗和生物相关性,预测疾病的结果或特定的药物作用,并使用具有已知作用机制(moa)的试剂来进行验证。通过基于免疫的检测蛋白质的方法(例如elisa)或测量增殖和存活力的功能测定法来定量测量每个读出。读出是多样化的,并且包括细胞表面受体、细胞因子、趋化因子、基质分子和酶。总体而言,diversityplus面板包含捕获在具体系统的生理环境发生的生物学变化的148个生物标志物读出。材料和方法在eurofins的diversityplus面板中研究了四种浓度的lmw-ds(150nm、440nm、1.3μm、4μm)。diversityplus方法biomap系统中的人原代细胞在早期传代(第4代或更早)时使用,以使对细胞培养条件的适应性最小化并保留生理信号传导响应。所有细胞均来自多个供体库(n=2–6),其是商业购买的并且根据制造商的推荐进行处理。将人血液衍生的cd14+单核细胞在添加到/mphg系统之前在体外分化成巨噬细胞。缩写如下使用:人脐静脉内皮细胞(huvec)、外周血单核细胞(pbmc)、人新生真皮成纤维细胞(hdfn)、b细胞受体(bcr)、t细胞受体(tcr)和toll样受体(tlr)。在每个系统中使用的细胞类型和刺激如下:3c系统[huvec+(il-1β、tnfα和ifnγ)]、4h系统[huvec+(il-4和组胺)]、lps系统[pbmc和huvec+lps(tlr4配体)]、sag系统[pbmc和huvec+tcr配体]、bt系统[cd19+b细胞和pbmc+(α-igm和tcr配体)]、bf4t系统[支气管上皮细胞和hdfn+(tnfα和il-4)]、be3c系统[支气管上皮细胞+(il-1β、tnfα和ifnγ)]、casm3c系统[冠状动脉平滑肌细胞+(il-1β、tnfα和ifnγ)]、hdf3cgf系统[hdfn+(il-1β、tnfα、ifnγ、egf、bfgf和pdgf-bb)]、kf3ct系统[角质形成细胞和hdfn+(il-1β、tnfα、ifnγ和tgfβ)]、myof系统[分化的肺成肌纤维细胞+(tnfα和tgfβ)]和/mphg系统[huvec和m1巨噬细胞+酵母聚糖(tlr2配体)]。系统源自单细胞类型或共培养系统。在96或384孔板中培养贴壁细胞类型,直至融合,随后添加pbmc(sag和lps系统)。bt系统由与pbmc共培养并用bcr激活剂和低水平的tcr刺激物刺激的cd19+b细胞组成。在刺激前1小时,以指定浓度添加在dmso(小分子;终浓度≤0.1%)或pbs(生物制剂)中制备的测试剂,并在培养基中保持24小时或如另外指出的(48小时,myof系统;72小时,bt系统(可溶性读出);168小时,bt系统(分泌的igg))。每个板包含适用于每个系统的药物对照(例如,1.1μm的传统对照测试剂秋水仙碱)、阴性对照(例如,非刺激条件)和媒介物对照(例如,0.1%dmso)。直接elisa用于测量细胞相关靶标和细胞膜靶标的生物标志物水平。使用检测、基于珠粒的多重免疫测定或捕获elisa对来自上清液的可溶性因子进行定量。对于贴壁细胞,通过磺酰罗丹明b(srb)染色,并且对于悬浮液中的细胞,通过alamar还原,来检测测试剂对细胞增殖和存活力(细胞毒性)的明显副作用。对于增殖测定,在亚融合下培养单个细胞类型,并在针对每个系统优化的时间点进行测量(48小时:3c和casm3c系统;72小时:bt和hdf3cgf系统;96小时:sag系统)。在指定的时间点,通过srb测量对贴壁细胞的细胞毒性(24小时:3c、4h、lps、sag、bf4t、be3c、casm3c、hdf3cgf、kf3ct和/mphg系统;48小时:myof系统),并且通过alamarblue染色测量对悬浮液中的细胞的细胞毒性(24小时:sag系统;42小时:bt系统)。数据分析将经测试剂处理的样品中的生物标志物测量值除以对照样品(来自同一板的至少6个媒介物对照)的平均值,生成一个比率,然后对该比率进行log10转换。使用历史媒介物对照数据在95%的置信区间下计算显著性预测包络线。谱分析当2个或更多个连续浓度相对于媒介物对照在同一方向上变化,在显著性包络线之外且至少有一个浓度的效应大小>20%(|log10比率|>0.1),则对生物标志物的活性进行注释。如果生物标志物的关键活性在一些系统中增加而在其他系统中减少,则这些活性被描述为已调节。当总蛋白水平下降超过50%(srb或alamarblue水平的log10比率<-0.3)时,记录细胞毒性情况,并在x轴上方用细黑箭头指示。当在3个或更多个系统中检测到细胞毒性时,化合物被认为具有广泛的细胞毒性。具有可检测的广泛细胞毒性的测试剂的浓度被排除在生物标志物活性注释和下游基准分析、相似性搜索和聚类分析之外。抗增殖作用由来自以较低密度涂铺的细胞的srb或alamarbluelog10比率值<-0.1定义,并由x轴上方的灰色箭头指示。细胞毒性和抗增殖箭头仅需要一种浓度来满足用于谱注释的指示阈值。基准分析当两个谱的读出在显著性包络线之外且在同一方向上的效应大小>20%时,对常见的生物标志物读出进行注释。当一个谱具有在显著性包络线之外的读出且效应大小>20%,并且另一谱的读出要么在包络线之内要么在相反方向时,对区分的生物标志物进行注释。除非指定,否则测试剂和基准试剂两者的最高非细胞毒性浓度都包括在基准叠加分析中。相似性分析当两个谱的读出在显著性包络线之外且在同一方向上的效应大小>20%时,对常见的生物标志物读出进行注释。具有3个或更多个有可检测细胞毒性的系统的测试剂的浓度被排除在相似性分析之外。具有1至2个有可检测细胞毒性的系统的测试剂的浓度将被包括在相似性搜索分析中,以及将数据库匹配与测试剂的最高浓度叠加。随后将不含具有可检测细胞毒性的系统的下一最高浓度的测试剂和相应的数据库匹配另外叠加。为了确定在diversityplus面板中运行的化合物的谱之间的相似程度,我们已开发了一种定制相似性度量(biomapz-standard),其是一种与所测试的其他量度(包括皮尔逊(pearson)和斯皮尔曼(spearman)相关系数)相比在参考剂的机制分类方面具有改进性能的组合方法。该方法更有效地考虑了作为谱特征性特性的数据点、系统、活性生物标志物读出的数量中的变化和生物标志物读出变化幅度。首先生成一个皮尔逊相关系数(r),以测量基于关系的方向和幅度的相似性的两个谱之间的线性关联。由于皮尔逊相关性可受到任何生物标志物活性幅度的影响,所以每系统加权平均tanimoto度量被用作过滤器以解决不太稳健的系统的代表性不足。tanimoto度量不考虑生物标志物活性的幅度,而是根据每个系统的加权来确定读出的标识和数量是否相同。首先通过将每个谱标准化至单位向量(例如,),然后应用以下公式来计算实值tanimoto度量:其中,a和b是2个谱向量。然后,在该计算中将其合并到系统加权平均实值tanimoto度量中:该计算使用每个第i个系统的实值tanimoto评分(ti)和每个第i个系统的权重(wi)。用以下公式为每个系统计算wi:其中,lr是来自被比较的2个谱的比率的最大绝对值。基于参考化合物的最佳性能,如果皮尔逊相关系数(r)≥0.7,则将谱鉴别为具有机制上相关的相似性。最后,使用费希尔r到z变换来计算z评分,以将短尾分布转换为正态分布,如下所示:然后根据下式生成调整了常用读出(cr)数量的z-standard:较大的z-standard值对应于较高的置信水平,并且这是用于对相似性结果进行排序的度量。聚类分析聚类分析(功能相似性映射)使用成对相关分析的结果将试剂谱的“接近度”从多维空间投射到二维中。在该分析期间生成的试剂谱的功能聚类使用皮尔逊相关值对每种试剂在每种浓度下的谱进行成对比较,然后对成对相关数据进行多维标度。具有类似皮尔逊相关系数(r)≥0.7的谱通过线连接。不相互聚类的试剂被解释为机制上不同。该分析是针对具有3种或更多种测试剂的投射进行的。聚类分析排除细胞毒性浓度。机制热图分析机制热图分析提供了测试化合物和19种共有机制的可视化,从而允许比较所有化合物浓度下的生物标志物活性和共有机制。在机制热图分析中使用的合成共有谱是来自结构上不同的化学类别的多种化合物的平均值的代表性谱。通过对用于所选择的所有谱(不同浓度下的多种试剂)的每个生物标志物终点的值求平均来计算谱,以建立共有机制谱。当生物标志物活性相对于媒介物对照具有在显著性包络线之外的表达时,在共有机制和化合物的热图中对它们进行着色。红色代表增加的蛋白质表达,蓝色代表减少的表达,并且白色代表未改变或在过滤条件内的水平。深色阴影代表生物标志物活性相对于媒介物对照的更大变化。使用r和用于r的gplots软件包制作机制热图。测定验收标准测定包括由平台生成的针对在组成diversityplus面板的系统中测试的试剂的多参数数据集。测定包含适用于每个系统的药物对照(例如,传统对照测试剂秋水仙碱)、阴性对照(例如,非刺激条件)和媒介物对照(例如,dmso)。测定是基于板的,并且数据验收标准取决于板性能(媒介物对照孔的cv%)和该系统的历史对照之间的系统性能两者。qa/qc皮尔逊检验通过首先从历史阳性对照的参考数据集建立1%假阴性皮尔逊截止值来进行。该过程遍历阳性对照参考数据集中的系统生物标志物读出的每个谱,从而计算每个谱与数据集中其余谱的平均值之间的皮尔逊值。用于确定1%假阴性截止值的皮尔逊值的总数是参考数据集中存在的谱的总数。在所有计算值的一个百分位处的皮尔逊值是1%假阴性皮尔逊截止值。如果实验板的阴性对照或药物对照谱与参考数据集中的历史对照谱的平均值之间的皮尔逊值超过该1%假阴性皮尔逊截止值,则系统将通过。当每个单独的系统通过皮尔逊检验并且所有投射板中的95%具有<20%的cv%时,接受总体测定。结果如表32所示,diversityplus面板包含12个单独的基于人原代细胞的biomap共培养系统。表32-diversityplus面板当两个或更多个连续浓度相对于媒介物对照在同一方向上变化,在95%显著性包络线之外,且至少有一个浓度的效应大小>20%(|log10比率|>0.1)时,对生物标志物的活性进行注释。如果生物标志物的关键活性在一些系统中增加而在其他系统中减少,则这些活性被描述为已调节。lmw-ds具有活性,具有25个带注释的读出。在这项研究中所测试的浓度下,lmw-ds对任何人类原代细胞均无细胞毒性。lmw-ds介导的关键生物标志物活性变化包括与炎症相关的活性,其形式为减少的血管细胞粘附分子1(vcam-1)、单核细胞趋化蛋白1(mcp-1)、可溶性肿瘤坏死因子α(stnfα)、干扰素诱导性t细胞α趋化因子(i-tac)、γ干扰素诱导的单核因子(mig)、和γ干扰素诱导蛋白10(ip-10)以及增加的嗜酸细胞活化趋化因子3(eot3)和白介素8(il-8)。lmw-ds还具有免疫调节活性,其形式为减少的经分泌的免疫球蛋白g(sigg)和巨噬细胞集落刺激因子(m-csf)以及增加的可溶性il-17a(sil-17a)和分化簇69(cd69)。lmw-ds还显示出呈增加的基质金属蛋白酶-1(mmp-1)、纤溶酶原激活物抑制剂-1(pai-1)、尿激酶纤溶酶原激活物受体(upar)和表皮生长因子受体(egfr)形式的组织重塑活性以及呈增加的血栓调节蛋白(tm)形式的止血相关活性。表33汇总了lmw-ds对diversityplus面板中12种不同的人原代细胞的作用。表33–diversityplus结果汇总参考数据库包含>4,500种生物活性剂(生物制剂、批准药物、化学药品和实验制剂)的谱,并且可用于分类和鉴别最相似的谱。在从参考数据库无监督地搜索数学上相似的化合物谱时,lmw-ds(4m)与克赛(30μg/ml)最相似(皮尔逊相关系数,r=0.701)。克赛(依诺肝素钠)是一种低分子量肝素,是用于治疗深静脉血栓形成(dvt)的抗凝剂。在以下系统中注释了五种常见的活性:bt(sigg、sil-17a)、casm3c(mig)和hdf3cgf(vcam-1、ip-10)。讨论在研究中,通过在基于人原代细胞测定的diversityplus面板中进行谱分析来表征lmw-ds,该测定对器官(脉管系统、免疫系统、皮肤、肺)的复杂组织和疾病生物学以及一般组织生物学进行建模。diversityplus面板评价了lmw-ds在保留与体内结果相关的复杂串扰和反馈机制的条件下的生物学影响。在该研究中测试的浓度下,lmw-ds具有活性且无细胞毒性。lmw-ds仅在最高浓度(4μm)时对人原代内皮细胞是适度和选择性抗增殖的。lmw-ds谱具有指示调节免疫和炎症相关读出以及基质相关生物标志物的25个带注释的读出。比活性包括减少的炎症相关vcam-1、mcp-1、stnfα、i-tac、mig和ip-10以及增加的il-8。在bf4t系统中仅在较低浓度下观察到适度增加的嗜酸细胞活化趋化因子-3。免疫调节活性包括在bt系统中sigg和il-17a和il-17f降低,但对b细胞没有任何抗增殖作用。还鉴别出减少的m-csf和增加的cd69。lmw-ds还调节组织重塑生物标志物,包括增加的mmp-1、pai-1、upar、egfr和止血相关的tm。在casm3c和hdf3cgf系统中,包括mig、vcam、ip-10和itac的关键炎症生物标志物在所有测试浓度下均降低,而在多个系统中注意到趋化因子il-8的增加。这些数据一起表明,lmw-ds在炎症和伤口愈合生物学的背景下在调节免疫激活和/或免疫消退应答中起作用。炎性标志物的调节表明,lmw-ds在治疗多种慢性和急性炎性疾患和疾病(包括炎性成分,诸如als)中的效用。最初,在损伤后,先天/促炎性响应和获得性免疫响应的选定组分被上调,以维持针对外来病原体的防御、清除存在于损伤部位的组织碎片并且协调与伤口响应相关的组织重塑、细胞增殖和血管生成过程。然而,为了使伤口正常愈合,必须调节或关闭这种最初的炎性响应,以便允许基质重建、再细胞化和组织重塑。此类免疫消退活性由lmw-ds诱导,包括mmp-1、par-1和upar的激活,表明诱导的免疫消退在治疗由外伤(包括神经外伤)损伤的组织中具有效用,否则所述外伤将导致有害的纤维化形成。lmw-ds在hdf3cgf系统中调节了许多生物标志物活性,而在myof系统中仅调节了il-8。两种系统都包括成纤维细胞,但hdf3cgf模拟伤口愈合和与此类伤口愈合有关的基质重塑,而myof则更像是胶原沉积的纤维化模型。结果由此表明,lmw-ds具有免疫调节和组织重塑活性,但不诱导不期望的可导致有害纤维化沉积的胶原蛋白纤维化。总之,lmw-ds似乎使受伤或患病后组织中存在的炎症正常化并消退,并且这些结果因此与前述实施例中所见的lmw-ds的作用一致。实施例9本实施例的目的是使用基因表达研究,然后对差异调节基因进行功能分析,来确定不同剂量的lmw-ds(1、5和15mg/kg)在stbi中的神经保护作用。材料和方法stbi的诱导和药物施用方案根据国际动物护理标准和指南,本研究中使用的实验方案已获得罗马天主教大学伦理委员会的批准。在可控的环境中,给体重为300-350g的雄性wistar大鼠随意喂食标准实验室食物和水。作为麻醉剂混合物,动物通过i.p.注射接受35mg/体重kg的氯胺酮和0.25mg/体重kg的咪达唑仑。根据“重量下落”撞击加速模型,通过将450g重物从2m高度下落到已用预先固定在颅骨上的金属盘保护的大鼠头部上而诱导严重外伤性脑损伤(stbi)(marmarou等人,anewmodelofdiffusebraininjuryinrats.parti:pathophysiologyandbiomechanics.jneurosurg.1994;80:291-300)。该研究排除了患有颅骨骨折、癫痫发作、鼻出血或在撞击下未存活的大鼠。在每个治疗期结束时,将大鼠再次麻醉,然后立即处死。测试化合物lmw-ds(tikomedab)以20mg/ml的储备浓度提供,并在4℃下保存在温度监控的冰箱中。在递送单次皮下注射之前,将lmw-ds等分试样在无菌盐水中稀释至适当的给药浓度。急性1期在tbi后30分钟皮下施用三剂lmw-ds。在tbi后第2天处死动物。将动物分成以下亚组:1.n=4只经受stbi并接受皮下注射浓度为15mg/kg的0.5mllmw-ds的动物2.n=4只经受stbi并接受皮下注射浓度为5mg/kg的0.5mllmw-ds的动物3.n=4只经受stbi并接受皮下注射浓度为1mg/kg的0.5mllmw-ds的动物急性2期在tbi后30分钟皮下施用三剂lmw-ds。在tbi后第7天处死动物。将动物分成以下亚组:4.n=4只经受stbi并接受皮下注射浓度为15mg/kg的0.5mllmw-ds的动物5.n=4只经受stbi并接受皮下注射浓度为5mg/kg的0.5mllmw-ds的动物6.n=4只经受stbi并接受皮下注射浓度为1mg/kg的0.5mllmw-ds的动物7.n=4只经受stbi并接受三次重复皮下注射浓度为15mg/kg的0.5mllmw-ds的动物stbi–不处理8.n=4只仅接受stbi并在tbi后第2天处死的动物9.n=4只仅接受stbi并在tbi后第7天处死的动物假手术(健康对照)10.n=4只仅接受麻醉的动物。脑组织处理在麻醉期间对所有动物进行体内颅骨切除术。小心移除大鼠颅骨后,露出脑并用手术刮刀将其取下,然后迅速放入rnalater中并在4℃保存以进一步处理。rna提取和阵列分析rna提取和阵列处理通过sourcebioscience进行。所用的阵列是安捷伦大鼠表达阵列。统计分析在该模型中进行统计分析以定量stbi对脑的作用。后续分析使用不同的迭代和算法考察lmw-ds在该模型中的作用。使用metaboanalyst软件包进行统计分析。p<0.05的10%的基因表达变化被认为是显著的。结果stbi后2天观察到的差异基因表达在stbi的2天内,脑基因表达显著变化,其中相对少量的基因(221)被上调和下调。损伤后30分钟内施用1mg/kglmw-ds改变了372个基因中的tbi特异性基因表达,tbi后30分钟内施用5mg/kglmw-ds改变了702个基因中的tbi特异性基因表达,并且tbi后30分钟内施用15mg/kg在stbi的2天内改变了247个基因中的tbi特异性基因表达。经lmw-ds处理的动物与健康对照的不同之处在于209个基因(1mg/kglmw-ds)、258个基因(5mg/kglmw-ds)和47个基因(15mg/kglmw-ds)的表达。stbi后7天观察到的差异基因表达在stbi的7天内,脑基因表达显著变化,其中大量基因(2739)被上调和下调。损伤后30分钟内施用1mg/kglmw-ds改变了3602个基因中的tbi特异性基因表达,在tbi后30分钟内施用5mg/kglmw-ds改变了3852个基因中的tbi特异性基因表达,并在tbi后30分钟内施用15mg/kg,在stbi的7天之内改变了3901个基因中tbi特异性基因表达。经lmw-ds处理的动物与健康对照组区别在于282个基因(1mg/kglmw-ds)、398个基因(5mg/kglmw-ds)和158个基因(15mg/kglmw-ds)的表达。经lmw-ds处理的动物(3次重复剂量的15mg/kglmw-ds)与健康对照的不同之处在于234个基因的表达。用lmw-ds观察到的表达变化的比较分析在不同统计迭代中对显著受影响的基因进行的比较提供了有关lmw-ds如何改变tbi诱导的基因表达的信息。tbi后2天的比较表明,在由tbi失调的221个基因(2天)中,当分别给予1mg/kg、5mg/kg和15mg/kglmw-ds时,相对于健康对照动物,仅22个(10%)、51个(23%)和19个(8.5%)保持失调。tbi后7天的比较表明,在由tbi失调的2741个基因(7天)中,当分别给予1mg/kg、5mg/kg和15mg/kglmw-ds时,相对于健康对照动物,仅124个(4.5%)、169个(6.1%)和85个(3.1%)保持失调。相对于健康对照动物,对于3次重复剂量的15mg/kglmw-ds,相对于健康动物失调基因的剩余数量为116(4.25%)。途径分析和机制研究使用ingenuity途径分析包进行差异调节基因的途径分析。特别参考与神经变性疾病(包括痴呆、阿尔茨海默氏病、als、tbi和中风)以及与瘢痕形成和纤维化(包括青光眼和蛛网膜下腔出血后的正常压力性脑积水(nph))相关的途径和分子过程和疾病进行分析。尽管tbi在2天内诱导的作用相对较小,但许多神经变性和瘢痕形成相关的典型途径的改变却是显著的。在tbi的30分钟内给予的lmw-ds抵消了这些途径改变中的大多数(表34和表35)。与所述途径类似,在tbi的2天内受到显著影响的分子过程和疾病的数量也是适度的。然而,在损伤后30分钟给予lmw-ds大部分消除了tbi的作用(表36和表37)。表34-2天后受tbi影响的典型途径以及lmw-ds相对于对照的作用(p值和z评分)*歧义作用表35-2天后受tbi影响的典型途径和lmw-ds的作用*歧义作用表36-2天后受tbi影响的疾病和分子功能以及lmw-ds的作用(p值和z评分)*歧义作用表37-2天后受tbi影响的疾病和分子功能以及lmw-ds的作用*歧义作用tbi在7天内诱导的该效应是显著的,其中大量基因失调。因此,许多神经变性和瘢痕形成相关的典型途径中的改变是显著的。在tbi的30分钟内给予的ilb抵消了这些途径改变中的大多数(表38和表39)。与所述途径类似,在tbi的7天内受到显著影响的分子过程和疾病的数量很大,并且作用显著。然而,在损伤后30分钟给予的lmw-ds大部分消除了tbi的作用(表40和表41)。表38-7天后受tbi影响的典型途径以及lmw-ds相对于对照的作用(p值和z评分)*歧义作用表39-7天后受tbi影响的典型途径和lmw-ds的作用表40-7天后受tbi影响的疾病和分子功能以及lmw-ds的作用(p值和z评分)表41-7天后受tbi影响的疾病和分子功能以及lmw-ds的作用*歧义作用讨论lmw-ds能够在大多数途径和分子过程中抵消和逆转tbi的作用。数据表明,lmw-ds能够使tbi后的组织基因表达和功能正常化。所研究的功能和途径与神经变性疾病以及纤维化和瘢痕形成高度相关。从结果来看,很明显lmw-ds能够以一种有益的方式影响这些途径,即使是在破坏严重的情况下。上述实施方案应被理解为本发明的一些说明性示例。本领域技术人员将理解,在不脱离本发明的范围的情况下,可对本实施方案进行各种修改、组合和更改。特别地,在技术上可能的情况下,不同实施方案中的不同部分解决方案可以其他配置组合。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1