带瓣管道的制作方法
相关申请的交叉引用
本申请要求2018年9月12日提交的美国申请第16/129,673号的优先权,该申请要求2017年10月31日提交的临时申请第62/579,752号的权益,其全部内容为了所有目的而以参见的方式纳入本文。
本公开总体上涉及假体瓣膜,并且更具体地涉及包括其中具有瓣膜结构的管道的装置、系统和方法。
背景技术:
已经开发出试图模仿天然瓣膜的功能和性能的生物假体心脏瓣膜。柔性瓣叶可以机械地联接到支承瓣叶并在植入时提供尺寸稳定性的相对刚性的框架。虽然生物假体心脏瓣膜可以在短时间内提供优良的血液动力性能和生物力学性能,但是它们易于钙化和尖瓣撕裂,或其它失效模式,因此需要重新操作和更换。
瓣叶通常需要一些用于将瓣叶固定到支承结构的装置。在操作中,当上游流体压力超过下游流体压力时,瓣叶打开,并且当下游流体压力超过上游流体压力时,瓣叶闭合。瓣叶的瓣叶自由边缘在闭合假体心脏瓣膜的下游流体压力的影响下合紧,以防止下游血液逆行流过假体心脏瓣膜。
在瓣叶打开和闭合的重复载荷下的假体心脏瓣膜耐久性部分地取决于瓣叶和框架之间的载荷分布以及瓣叶到框架的附连。瓣叶的机械故障可能会发生在例如安装边缘处,在该边缘处,柔性瓣叶由相对刚性的框架支承。瓣叶打开和闭合的重复载荷会致使由于疲劳、蠕变或其它机制导致的材料失效,此失效部分地取决于瓣叶材料。
已经使用了许多制造技术来将瓣叶联接到管道的内部,但是,这些制造技术可能是劳动密集型的和/或易于失效的。另外,瓣叶的机械固定,例如美国公开号2016/00100939中所示,可能有助于血栓形成。结果,迫切需要一种带瓣管道,其包括管道和瓣膜结构,并且具有长的耐久性并且易于制造。
技术实现要素:
所描述的实施例涉及用于带瓣管道的装置、系统和方法。
根据一个示例(“示例1”),一种带瓣管道,包括具有内表面和外表面的管道;以及至少一个瓣叶,该至少一个瓣叶具有不机械地粘附到管道的外表面的外部部分和布置在管道的内表面内的内部部分,以减轻管道内血栓的形成。
根据相对于示例1更进一步的另一示例(“示例2”),至少一个瓣叶的外部部分通过粘合剂、热粘合或化学粘合而粘附到管道的外表面。
根据相对于示例1-2中任一项更进一步的另一示例(“示例3”),管道没有窦。
根据相对于示例1-2中任一项更进一步的另一示例(“示例4”),管道没有机械联接。
根据相对于示例1-4中任一项更进一步的另一示例(“示例5”),至少一个瓣叶的外部部分附连到管道的外表面,并且该附连是无缝合的(无缝线的)。
根据相对于示例1-5中任一项更进一步的另一示例(“示例6”),至少一个瓣叶的外部部分通过一层粘性膜粘附到管道的外表面。
根据相对于示例6更进一步的另一个示例(“示例7”),其中粘性膜围绕管道的周缘布置。
根据相对于示例6-7中任一项更进一步的另一个示例(“示例8”),还包括围绕所述管道和粘性膜的周缘布置的柔性膜。
根据相对于示例8更进一步的另一个示例(“示例9”),柔性膜包括膨胀型聚四氟乙烯(eptfe),并且粘性膜包括氟化乙烯丙烯(fep)。
根据相对于示例8-9中任一项更进一步的另一示例(“示例10”),还包括通过柔性膜联接到管道的支承框架。
根据相对于示例10更进一步的另一示例(“示例11”),支承框架由聚醚醚酮(peek)形成。
根据相对于示例1-11中任一项更进一步的另一示例(“示例12”),还包括在管道的外表面上与至少一个瓣叶相邻布置的至少一个不透射线的标记物。
根据相对于示例1-12中任一项更进一步的另一示例(“示例13”),管道的内表面在直径上恒定并且没有任何宏观的中断部。
根据相对于示例1-13中任一项更进一步的另一个示例(“示例14”),至少一个瓣叶在沿着管道的长度的纵向位置处定位在管道内,并且管道在至少一个瓣叶所定位的纵向位置处并且穿过管道的相邻的近侧和远侧部分在直径上恒定。
根据一个示例(“示例15”),一种带瓣管道,包括具有内表面、外表面、近侧部分和远侧部分的管道;瓣叶附连部分,瓣叶附连部分在管道的内表面和外表面之间具有开口;以及,至少一个瓣叶,该至少一个瓣叶具有附连部段,该附连部段附连到管道的外表面,而不机械改变管道的内表面或外表面,以减轻管道内血栓的形成。
根据相对于示例15更进一步的另一示例(“示例16”),至少一个瓣叶包括三个瓣叶,并且这三个瓣叶在管道内部通过间隙彼此分开。
根据相对于示例16更进一步的另一示例(“示例17”),管道包括连合间隙,其在每个瓣叶的附连部段处将瓣叶分隔开,以在管道内表面内的三个瓣叶之间形成间隙。
根据相对于示例15-17中任一项更进一步的另一示例(“示例18”),附连部段通过粘合剂、热粘合或化学粘合附连到管道的外表面。
根据相对于示例15-18中的任一项更进一步的另一示例(“示例19”),附连部段包括第一部分和第二部分,并且第一部分附连到管道的外表面的近侧部分,而第二部分附连到管道的外表面的远侧部分。
根据相对于示例15-19中任一项更进一步的另一示例(“示例20”),瓣叶附连部分是管道的一部分,并且瓣叶附连部分比管道的其余部分更致密。
根据相对于示例15-20中的任何一项更进一步的一个示例(“示例21”),带瓣管道还包括在管道外表面上的方向指示,以指示管道内血液流动的方向。
根据一个示例(“示例22”),一种用于减少由置换天然肺动脉瓣或先前植入的肺动脉带瓣管道引起的血栓形成的方法,在此期望部分地或完全地重建右心室流出道和/或主要肺动脉,该方法包括以下步骤:提供一种医疗设备,该医疗设备包括具有远端、近端、内部、外部和瓣叶附连部分的合成管道,以及具有位于管道外部的部分和位于管道内部的部分的至少一个柔性合成瓣叶;其中,位于管道外部的瓣叶部分在附连部分处附连到管道的外部,并且管道的附连部分没有穿孔;以及,以外科手术方式植入该医疗设备。
根据一个示例(“示例23”),一种用于置换天然肺动脉瓣或先前植入的肺动脉带瓣管道的方法,在此期望部分地或完全地重建右心室流出道和/或主要肺动脉,该方法包括以下步骤:提供一种医疗设备,该医疗设备包括合成管道和附连到该合成管道的至少一个柔性合成瓣膜瓣叶,该医疗设备已经在盐水中冲洗并且尚未预先凝结;以及,以外科手术方式植入该医疗设备。
根据一个示例(“示例24”),一种用于置换天然肺动脉瓣或先前植入的肺动脉带瓣管道的方法,在此期望部分地或完全地重建右心室流出道和/或主要肺动脉,该方法包括以下步骤:提供一种已在盐水中冲洗并且尚未预先凝结的医疗设备,其中,所述医疗设备包括非生物管道和附连到该非生物管道的至少一个柔性聚合非生物瓣膜瓣叶;识别医疗设备的流入和流出区域;相对于冠状动脉接近预定位置,以确保植入时不存在冠状动脉压缩的风险;可选地在适度张力下将流入和/或流出管道修剪至用于植入的适合长度;以及附连医疗设备。
根据一个示例(“示例25”),一种用于带瓣管道的包装插入物,该包装插入物包括:支承结构,其构造成折叠以形成一个或多个支承件并且插入在带瓣管道中,以支承带瓣管道内的一个或多个瓣叶。
前述示例仅仅是,而不应被理解为限制或以其它方式缩小本公开所提供的任何发明构思的范围。
附图说明
包括附图以提供对本公开的进一步理解,并包含在本说明书中并且构成其一部分、示出实施例,并且与描述一起用于阐释本公开的原理。
图1a是根据一实施例的示例性带瓣管道的图示;
图1b示出了如图1a所示的处于闭合构造的瓣膜结构的内部下游视图;
图2是根据一实施例的另一示例性带瓣管道的图示;
图3是根据一实施例的另一示例性带瓣管道的剖视图;
图4a是根据一实施例的在带瓣管道中使用的管道的示例性切割图案的图示;
图4b是根据一实施例的在带瓣管道中使用的管道的另一示例性切割图案的图示;
图4c是根据一实施例的在带瓣管道中使用的管道的又一示例性切割图案的图示;
图5是根据一实施例的可在带瓣管道中使用的示例性瓣叶的图示;
图6a是根据一实施例的将瓣叶附连到管道的示例性步骤的图示;
图6b是图6a中所示的瓣叶附连到管道的另一示例性步骤的图示;
图6c是图6a-b中所示的瓣叶附连到管道的又一示例性步骤的图示;
图7a是根据一实施例的用于处于展开构造的带瓣管道的示例性包装插入物的图示;
图7b是处于折叠状态的图7a所示的包装插入物的侧视图;
图7c是处于折叠状态的图7a-b所示的包装插入物的俯视图;以及
图8示出了与根据本公开的实施例的设备相比的现有技术设备的示例性血栓形成响应。
具体实施方式
本领域的技术人员将容易理解,本公开的各方面可通过构造成执行预期功能的任何数量的方法和装置来实现。还应注意的是,本文参考的附图不一定是按比例绘制,而有可能放大以说明本公开的各个方面,并且就此而言,附图不应理解为限制性的。
尽管本文的实施例可结合各种原理和理念来描述,但所描述的实施例不应受理论的限制。例如,本文结合假体带瓣管道描述了实施例。然而,在本公开的范围内的实施例可以应用于具有类似结构和/或功能的任何带瓣管道、瓣膜结构或机构。此外,本公开的范围内的实施例可以应用于非心脏应用。
本文的实施例包括用于管道的各种装置、系统和方法,该管道具有可作为假体瓣膜操作的瓣膜结构,该瓣膜结构可被用于,例如但不限于替换肺动脉瓣膜和相应肺动脉的一部分。瓣膜结构可包括可作为单向瓣膜操作的一个或多个瓣叶,其与管道限定管道内腔。一个或多个瓣叶打开以允许流动,而瓣叶闭合以阻塞管道内腔并响应于流体压力差而阻止流动。
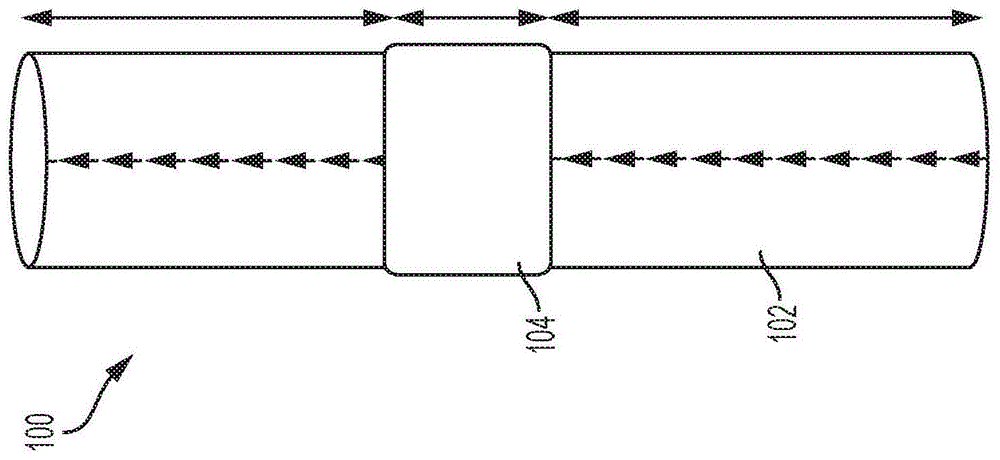
图1a是根据一实施例的示例性带瓣管道100的图示。带瓣管道100包括管道102,管道102具有布置在管道102内的瓣膜结构104。管道102可以包括上游端和下游端,使得瓣膜结构104允许在一个方向上的流动。
在非限制性示例中,带瓣管道100可以用作分流器,以在诺伍德(norwood)手术后将右心室连接肺动脉,如用于治疗左心发育不全综合征所经常操作的。在一个非限制性示例中,可以指示带瓣管道100以用于儿科患者的右心室流出道(rvot)的校正或重建。这种重建可用于先天性心脏病,比如法洛氏四联症(tetralogyoffallot),动脉干(truncusarterious)、大动脉右旋移位、完整心室膈膜的肺动脉闭锁或主动脉瓣膜疾病。还可以指示带瓣管道100用于替换先前植入的已变得功能失调或不足的带管道的瓣膜或同种移植物。另外,带瓣管道100可具有包括心脏的其它部位的广泛的心脏病的治疗应用。通常,在本公开中,术语“远侧”用于指代带瓣管道100的流出端(远端)或流出方向,而术语“近侧”又用于指代带瓣管道100的流入端,或者与主要流动通过带瓣管道100的方向相反的方向。
图1b示出了如图1a所示的处于闭合构造的瓣膜结构104的内部下游视图。瓣膜结构104包括瓣叶106,瓣叶106延伸到管道102的内部。尽管在图1b中示出了三个瓣叶106,但是瓣膜结构104可包括一个、两个、四个、五个、六个、七个、八个或更多数量的瓣叶106。如图1b所示,瓣叶106在闭合构造中朝向管道102的中心108闭合。在打开构造中,血液可流过瓣膜结构104,而瓣叶106被迫朝向管道102的内表面110。瓣叶106可联接到瓣膜结构104以及管道102,使得管道102的内表面110具有基本光滑的内部,并且具有基本一致的内径(例如,无窦和/或小于5%的厚度被添加到管道102的壁厚),如图1b所示。
管道102的基本光滑的内表面110不包括在管道102的流动表面(内表面110)内侧或外侧的隆起。管道102不包括窦。窦是管道所具有的内径大于周围区域的区域。如图1b所示,管道102不包括任何窦。
另外并且如参考图3-6进一步描述的,管道102的内表面110尚未被机械地改变以将瓣叶106附连到管道102。更具体地,管道102的内表面110不包括任何孔或其它穿孔,在其它设备中,其可以与用于瓣叶附连的缝线相关联。如参考图3-6进一步描述的,瓣叶106附连到管道102而不刺穿管道102或以其它方式机械地改变管道102以将瓣叶106附连到其上。有利地,管道102没有用于附连瓣叶102的机械方面的改变(例如,没有孔或缝线),这通过例如不改变通过管道102的血液流动来减少血栓形成的机会。
在某些实施例中,管道120的内表面110在直径上恒定,并且没有任何宏观的中断部,如图1b所示。另外,瓣叶106可以沿着管道102的长度在纵向位置处定位在管道102内(例如,如图1a所示),并且管道102在瓣叶106所定位的纵向位置处并穿过管道102的相邻近侧和远侧部分在直径上恒定。
如图1b所示,在每个瓣叶106之间存在间隙112。间隙112允许回流通过管道102。回流减少了可能导致血栓形成的血液在瓣叶106后面停滞(滞留)的机会。间隙112的尺寸定为使得回流导致的泄漏最小,并且不会以其它方式增加对患者心脏将血液泵送通过管道102的压力(应力)。间隙112与管道102中的间隙112相关联,如图4a-c中详细示出的。
没有窦、没有机械改变(例如,没有诸如通过缝合、铆钉、销、钉书钉或类似的附连机构的机械联接)、以及瓣叶106之间的间隙112单独地和组合地减少了形成的机会。例如,没有将瓣叶106联接到管道的机械改变(例如,没有缝线、铆钉、销、钉书钉或类似的附连机构)减少了通过管道102的血流紊乱(湍流)的机会,由此这减少了血栓形成的机会。另外,管道102中没有窦则减少了血液在管道102内停滞的机会,结果,这减少了血栓形成的机会。此外,瓣叶之间的间隙112允许回流清洗(洗去)管道102中可能使血液停滞的区域,结果,这减少了血栓形成的机会。
图2是根据一实施例的另一示例性带瓣管道100的图示。带瓣管道100包括管道102和瓣膜104。管道102包括流入部分212和流出部分214。如通过管道102上的箭头所指示的,瓣膜104构造成允许血液从流入部分212到流出部分214流过管道102。箭头可以是印制在管道102上的设计特征,以指示管道102内的血液流动方向,以使医师定向以进行适当的植入。箭头(方向指示)可以具有许多不同的形状、尺寸、长度、或包括其它考虑因素。
如以上参考图1所指出的,瓣膜104包括一个或多个瓣叶(未示出)。瓣叶可以联接或附连到瓣膜104。如本文所用,术语“联接”是指连结、连接、附连、粘附、固定或粘合。一个或多个瓣叶通过粘合剂、热粘合或化学粘合(例如,非机械地)粘附到管道102的外表面。这样,将一个或多个瓣叶附连或联接到管道102,而不会刺穿或以其它方式机械地改变一个或多个瓣叶或管道102的表面以进行附连。在某些情况下,瓣叶通过粘性膜216而附连、粘附、固定或粘合到管道102。此外,缝线可用于将一个或多个瓣叶附连到管道102的外表面,只要缝线部分地布置成穿过管道102(例如,不进入管道102的内腔)。
粘性膜216可以是围绕管道102的周缘缠绕的连续或不连续的层。粘性膜216可以在管道102的致密部分处和/或超出致密区域围绕管道102的周缘放置或缠绕(参考图3讨论),只要它在管道102的瓣膜区域350内,以将瓣叶106联接到管道102的外表面。在其它实施例中,粘性膜216可以放置在管道102的瓣膜区域350中并且也超出管道102的瓣膜区域350,并且在一些实施例中可以覆盖整个管道102。
通过例如粘合剂、热粘合或化学粘合将一个或多个瓣叶联接或附连到管道102的外表面可保持管道直径和有效瓣膜孔口面积(eoa),而不用长期抗凝治疗来防止血栓和/或组织沉积。另外,以这种方式将一个或多个瓣叶联接到管道102有助于抵抗钙化和矿化(无机化)并最小化血栓形成。
图3是根据一实施例的另一示例性带瓣管道100的剖视图。带瓣管道100包括具有内表面318、外表面320、近侧(或流入)部分212和远侧(或流出)部分214的管道102。管道102包括具有开口324的瓣叶附连部分322,开口324在管道102的内表面318与外表面320之间。瓣叶附连部分322可以是管道102的整体部分。
带瓣管道还包括瓣叶106,其延伸进入管道102中并朝向管道的中心108。如图3示,瓣叶106被粘附到管道102的外表面320。瓣叶106可以包括通过开口324布置在管道102外部的部分,和在管道102内的部分,图3所示。瓣叶106通过粘性膜216粘附到管道102的外表面320。粘性膜216可布置在瓣叶附连部分322的边界内。此外,瓣叶附连部分322与管道102的近侧(或流入)部分212和远侧(或流出)部分214相比可被致密化。
瓣叶附连部分322可以被致密和/或硬化,使得管道200在处理和使用期间保持其形状。致密化是指诸如通过加热和/或压力选择性地使材料在选定位置处更致密的过程。在某些实施例中,管道102由膨胀型聚四氟乙烯(eptfe)形成。对于可能是相对多孔的eptfe材料,致密化过程将减少孔隙率并使该区域更刚性(更硬)。
带瓣管道100还包括围绕管道102和粘性膜216的周缘布置的柔性膜326。在某些实施例中,柔性膜326可以包括一层或多层柔性膜326。柔性膜326可以围绕管道102和粘性膜216缠绕多次。柔性膜326可以根据需要缠绕,以增强管道102的强度和/或瓣叶106到管道102的附连。粘性膜216可以在管道102的瓣叶附连部分322处围绕管道102的周缘放置或缠绕(参考图3讨论),和/或超出瓣叶附连部分322(围绕管道的周缘放置或缠绕),只要它在管道102的瓣膜区域350内即可,以将瓣叶106联接到管道102的外表面320。在其它实施例中,粘合剂可以放置在管道102的瓣膜区域350中并且也超出管道102的瓣膜区域350,并且在一些实施例中可以覆盖整个管道102。
例如,柔性膜326通过向管道102增加柱强度(环形强度)来增强管道102的纵向拉伸强度,并确保瓣叶106被固定在管道102内。在某些实施例中并且如上所述,管道102可以是eptfe。具有拉伸/弹性特性的eptfe移植物特别合适,因为它们提供了可变的长度而不会损害表面的光滑度,包括提供不间断的内腔表面。在这方面,管道102的外表面320可以拉伸以符合解剖结构,而不会扭结管道102的内表面318(内腔流动表面)。柔性膜326也可以是eptfe,而粘性膜216是氟化乙烯丙烯(fep)。通过组合使用柔性膜326和粘性膜216,瓣叶106可以(例如,热)粘合到管道102。
在某些实施例中,带瓣管道100还可以包括通过柔性膜326联接到管道102的支承框架328。支承框架328可以防止压缩,或者以其它方式降低由解剖上的压缩力导致的管道102和瓣膜104的可压缩性(压缩率)。另外,在某些实施例中,支承框架328由聚醚醚酮(peek)形成。在这些情况下,支承框架328不是不透射线的,因此,与如果支承框架328由其它材料形成相比,允许医师更好地可视化瓣叶106和瓣叶附连部分322的位置。可视化瓣叶106和/或瓣叶附连部分322可以增强医师将管道102精确地定位和放置在目标位置的能力。在其它情况中,支承框架328由不透射线的材料形成。
支承框架328可以是不透射线的或可以不是不透射线的。在某些情况下,带瓣管道100可包括一个或多个不透射线的标记物330,以有助于在荧光镜下可视化过程后使管道102的瓣膜区域350可视化。一个或多个不透射线的标记物330可以在管道102的外表面320上邻近瓣叶106布置。在某些实施例中并且如图3所示,带瓣管道100可在瓣叶106和瓣叶附连部分322的纵向的任一侧上包括不透射线的标记物330。这样,医师具有标记物,以使瓣叶106和瓣叶附连部分322更具体地放置目标位置处。在某些实施例中,不透射线的标记330是围绕管道102的周缘缠绕的不透射线的材料(例如,金)的连续或不连续的条带。
图4a是根据一实施例的在带瓣管道中使用的管道102的示例性切割图案432的图示,其中使用单个管道部件。切割图案432包括多个分开的狭缝434(例如,形成图3中所示的开口324)。狭缝434对应于将联接到管道102的瓣叶(未示出)的数量。如更详细地示出的,例如,在图6a-c中,一个或多个瓣叶可以布置在狭缝434中,并且将瓣叶的一部分粘附至管道102。在图4a中,切割图案432中的狭缝434不是连接的。因此,管道102在组装期间不会被分成多件,并且利用了单个管道部件。尽管在图4a中示出了两个狭缝434,但是,切割图案432可以具有附加的缝隙(例如,用于三尖瓣的三个缝隙、四个缝隙等)。狭缝434可以通过激光切割、手工切割或其它类似方法形成。
狭缝434由间隙112分开。如上所述,狭缝434对应于将联接到管道102的瓣叶(未示出)的数量。间隙112对应于在管道102内的瓣叶之间的分隔(例如,在连合柱区域处)。当瓣叶闭合时(例如,瓣膜闭合),如图1所示,瓣叶之间存在空间。狭缝434和间隙112对应于将联接到管道102的瓣叶的数量。当瓣叶瓣膜闭合时,间隙112允许血液清洗(冲洗掉)瓣叶后面的区域。回流减少了可能导致血栓形成的血液在瓣叶后面停滞(滞留)的机会。间隙112的尺寸定为使得回流导致的泄漏最小,并且不会以其它方式增加对患者心脏将血液泵送通过管道102的压力(应力)。
图4b是根据一实施例的在带瓣管道中使用的管道102的另一示例性切割图案436的图示。切割图案436包括多个单独的(分开的)狭缝434,其中狭缝的数量对应于将联接到管道102的瓣叶(未示出)的数量。切割图案436还包括管道102中的侧向切口(横向切口)438,其允许管道102被分成两个用于组装的管道部件,如图4b中的102a和102b所示。侧向切口438布置在狭缝434的纵向部分的附近、与该纵向部分相邻或在它的中点处。侧向切口438和狭缝434可以通过激光切割、手工切割或其它类似方法形成。尽管在图4b中示出了两个狭缝434,但是,切割图案436可以具有附加的缝隙(例如,用于三尖瓣的三个缝隙、四个缝隙等)。
狭缝434和侧向切口438对应于将联接到管道102的瓣叶的数量。类似于图4a,狭缝434由间隙112分开。间隙112对应于在管道102内的瓣叶之间的分隔(例如,在连合柱区域处)。当瓣叶闭合时(例如,瓣膜闭合),如图1所示,瓣叶之间存在空间。当瓣叶瓣膜闭合时,间隙112允许血液清洗(冲洗掉)瓣叶后面的区域。回流减少了可能导致血栓形成的血液在瓣叶后面停滞(滞留)的机会。间隙112的尺寸定为使得回流导致的泄漏最小,并且不会以其它方式增加对患者心脏将血液泵送通过管道102的压力(应力)。
图4c是根据一实施例的在带瓣管道中使用的管道102的另一示例性切割图案440的图示。切割图案440包括多个单独的狭缝434,其中狭缝的数量对应于将联接到管道102的瓣叶(未示出)的数量。切割图案440还包括在管道102中切出的侧向切口438,其允许管道102被分成两个用于组装的管道部件,如图4c中的102a和102b所示。侧向切口438和狭缝434可以通过激光切割、手工切割或其它类似方法形成。尽管在图4c中示出了两个狭缝434,但是,切割图案440可以具有附加的缝隙(例如,用于三尖瓣的三个缝隙、四个缝隙等)。
如上所述,狭缝434和侧向切口438对应于将联接到管道102的瓣叶的数量。类似于图4a,狭缝434由间隙112分开。当瓣膜闭合时,间隙112对应于在管道102内的瓣叶之间的分隔(例如,当瓣膜闭合时,在连合柱区域处保持间隙112)。
图5是根据一实施例的可在带瓣管道中使用的示例性瓣叶106的图示;如图5所示,瓣叶106可以包括多个凸片542。可以通过切割瓣叶106的各部分以将瓣叶106分离成凸片542来形成凸片542。如进一步详细参考图6a-c所示的,凸片542可用于将瓣叶106粘附至管道(未示出)。
在某些实施例中,瓣叶106包括对准凸片544。对准凸片544以与凸片542相同的方式形成。当在瓣叶106中存在时,对准凸片544用于与管道102对接(交界),以帮助对准瓣叶106以附连到管道102。
根据一实施例,瓣叶106可以包括复合材料,该复合材料包括膨胀型含氟聚合物膈膜和弹性体、弹性体材料或非弹性体材料,膨胀型含氟聚合物膜包括在原纤维基质内的多个空间。应当理解,可以将多种类型的含氟聚合物膈膜和多种类型的弹性体或弹性体材料或非弹性体材料组合以形成复合材料,同时仍在本公开的范围内。还应当理解,弹性体或弹性体材料可包括多种弹性体和弹性体材料,多种类型的非弹性体组分,比如无机填充物、治疗剂、不透射线的标记物等,同时仍保持在本公开的范围内。在某些情况下,瓣叶106可以是聚合物非生物瓣膜,其包括eptfe和由四氟乙烯(tfe)和全氟甲基乙烯基醚(pmve)(tfe-共-pmve)组成的共聚物的复合物。
图6a是根据一实施例的将瓣叶106附连到管道102的示例性步骤的图示;为了便于说明,在图6a中示出了管道102的上游部分214,然而,如参考图4a所指出的,管道102和瓣叶106可以联接在一起而无需将管道102分成多个部段。
瓣叶106与管道102中的狭缝434对准。如上所述,多个瓣叶106可联接到管道102。为了便于说明,图6a-c示出了单个瓣叶106到管道102的附连。在某些实施例中,管道102包括沿着管道102纵向延伸的对准线646。对准线646有利于在管道102中对准瓣叶106。在某些实施例中,瓣叶106包括布置在对准线646内的对准凸片544,以确保瓣叶106在管道102内的几何形状和对准(定向)是适当的。对准线646可以是在管道102中的间隙,对准凸片544布置在该间隙中。
一旦瓣叶106与狭缝434对准,则凸片542可以向下折叠到管道102的外表面上。如图6b所示,对准凸片544可周向地向内折叠。
如图6c所示,凸片542可以在不同方向上折叠。例如,交替的凸片542可以折叠到管道102的近侧(或流入)部分212和远侧(或流出)部分214的外表面上。凸片542(和对准凸片544)可以是瓣叶106的附连部段,附连部段可以通过粘合剂、热粘合或化学粘合(例如,如以上参照图2-3详细描述的)粘附到管道102的外表面。瓣叶106的各部段在近侧(或流入)部分212和远侧(或流出)部分214之间延伸穿过管道102中的开口(例如,如图3中所示)。管道102内的瓣叶106的其余部分用作带瓣管道100中的瓣膜。
图7a是根据一实施例的用于处于展开构造的带瓣管道的示例性包装插入物700的图示。包装插入物700可与本文讨论的带瓣管道一起使用,以确保在带瓣管道的递送和/或储存期间带瓣管道不被损坏。包装插入物700可以布置在管道102的内腔中以保持一个或多个瓣叶106分开。
如图7a所示,包装插入物700包括展开构造。包装插入物700包括多个支承件702,其中支承件702等于带瓣管道中包括的瓣叶106的数量。支承件702包括刻痕线704,以利于支承件704从展开构造折叠。支承件702还可包括用于折叠对准的凹口706。为了过渡到图7b-c中所示的折叠构造,支承件702应沿着刻痕线704折叠并压褶。支承件702可以以角度708均等地间隔开。在包装插入物700包括三个支承件702的实施例中,角度708约为120度。
如图7b-c所示,包装插入物700在折叠构造中形成尖端710。在折叠构造中,瓣叶106可搁置在支承件702上以维持瓣叶106之间的分离。
本文讨论的管道可以是合成管道,其中至少一个柔性合成瓣膜瓣叶附连到合成管道。在植入之前,可以在盐水中冲洗合成瓣膜瓣叶和/或合成管道,并且不需要预先凝结。随后,可以通过外科手术植入合成瓣膜瓣叶和合成管道。合成瓣膜瓣叶和合成管道可以是天然肺动脉瓣或先前植入的肺动脉瓣管道的替代,在这些地方,期望部分地或完全地重建右心室流出道和/或主肺动脉。在某些情况下,合成瓣膜瓣叶和合成管道的安装包括识别管道的流入和流出区域,相对于冠状动脉接近预定位置,以确保植入时不存在冠状动脉压缩的风险,并可选地在适度张力下将流入和/或流出管道修剪至适合植入的长度。
在某些实施例中,本文讨论的管道包括由多孔eptfe膈膜制成的膨胀型含氟聚合物材料,例如,如授予bacino的美国专利第7,306,729号中所总体描述的。
用于形成所描述的膨胀型含氟聚合物材料的可膨胀含氟聚合物可以包括ptfe均聚物。在替代实施例中,可以使用ptfe、膨胀型改性ptfe和/或ptfe的膨胀型共聚物的混合物。例如,在授予branca的美国专利第5708044号、授予ballie的美国专利第6541589号、授予sabol等的美国专利第7531611号、ford的美国专利申请第11/906,877号和xu等的美国专利申请第12/410050号中描述了适合的含氟聚合物材料的非限制性示例。
膨胀型含氟聚合物膈膜可包含诸如孔之类的任何合适的微结构,以实现期望的瓣叶性能。其它适用于瓣叶的生物相容性聚合物包括但不限于聚氨酯、硅酮(有机聚硅氧烷)、硅-聚氨酯的共聚物、苯乙烯/异丁烯共聚物、聚异丁烯、聚乙烯-共-聚(乙酸乙烯酯)、聚酯共聚物、尼龙共聚物,氟化烃聚合物以及前述各项的共聚物或混合物。
在各种示例中,本文所述的任何瓣叶构造(例如,瓣叶构造)可由生物相容的合成材料(例如,包括eptfe和eptfe复合物,或根据期望的其它材料)形成。其它可适合用于合成瓣叶的生物相容的聚合物包括但不限于聚氨酯、硅酮(有机聚硅氧烷)、硅-聚氨酯共聚物、苯乙烯/异丁烯共聚物、聚异丁烯、聚乙烯-共-聚(乙酸乙烯酯)、聚酯共聚物、尼龙共聚物、氟化烃聚合物和前述每种的共聚物或混合物。
在其它示例中,这样的瓣叶构造由诸如重新调整用途的组织之类的天然材料形成,这样的组织包括牛组织、猪组织等。
如本文所用,术语“弹性体”是指具有拉伸至其原始长度的至少1.3倍并在释放时迅速缩回至其原始长度的能力的聚合物或聚合物的混合物。术语“弹性体材料”是指表现出类似于弹性体的拉伸和恢复特性的聚合物或聚合物混合物,不过不一定达到相同程度的拉伸和/或恢复。术语“非弹性体材料”是指表现出与弹性体或弹性体材料不同的拉伸和恢复特性的聚合物或聚合物混合物,即被认为不是弹性体或弹性体材料。
根据本文的一些实施例,瓣叶构造包括复合材料,该复合材料具有具有多个孔隙和/或空间的至少一个多孔合成聚合物膈膜层,以及填充至少一个合成聚合物膈膜层的孔隙和/或空间的弹性体和/或弹性体材料和/或非弹性体材料。根据其它示例,瓣叶构造还包括在复合材料上的弹性体和/或弹性体材料和/或非弹性体材料层。根据一些示例,复合材料包括按重量计在约10%至90%范围内的多孔合成聚合物膈膜。
多孔合成聚合物膈膜的示例包括膨胀型含氟聚合物膈膜,其具有限定孔隙和/或空间的节和原纤维结构。在一些示例中,膨胀型含氟聚合物膈膜是膨胀型聚四氟乙烯(eptfe)膈膜。多孔合成聚合物膈膜的另一示例包括微孔聚乙烯膈膜。
弹性体和/或弹性体材料和/或非弹性体材料的示例包括但不限于四氟乙烯和全氟甲基乙烯基醚的共聚物(tfe/pmve共聚物)、(全)氟烷基乙烯基醚(pave)、聚氨酯、硅酮(有机聚硅氧烷)、硅-聚氨酯共聚物、苯乙烯/异丁烯共聚物、聚异丁烯、聚乙烯-共-聚(乙酸乙烯酯)、聚酯共聚物、尼龙共聚物、氟化烃聚合物和前述每种的共聚物或混合物。在一些示例中,tfe/pmve共聚物是弹性体,其基本上由60至20重量百分比之间的四氟乙烯和40至80重量百分比之间的全氟甲基乙烯基醚构成。在一些示例中,tfe/pmve共聚物是弹性体材料,其基本上由67至61重量百分比之间的四氟乙烯和33至39重量百分比之间的全氟甲基乙烯基醚构成。在一些示例中,tfe/pmve共聚物是非弹性体材料,其基本上由73至68重量百分比之间的四氟乙烯和27至32重量百分比之间的全氟甲基乙烯基醚构成。tfe-pmve共聚物的tfe和pmve组分以重量%表示。作为参考,pmve的40、33-39和27-32的重量%分别对应于29、23-28和18-22的摩尔%。
在一些示例中,tfe-pmve共聚物呈现出弹性体、弹性特性和/或非弹性特性。
在一些示例中,复合材料还包括tfe-pmve共聚物的层或涂层,其包含约73至约68重量百分比的四氟乙烯以及对应地从约27至约32重量百分比的全氟甲基乙烯基醚。
在一些示例中,瓣叶构造是已吸收有tfe-pmve共聚物的膨胀型聚四氟乙烯(eptfe)膈膜,该tfe-pmve共聚物包含约60至约20重量百分比的四氟乙烯以及对应地约40至约80重量百分比的全氟甲基乙烯基醚,瓣叶构造还包括在血液接触表面上的tfe-pmve共聚物的涂层,该tfe-pmve共聚物包含约73至约68重量百分比的四氟乙烯以及对应地约27至约32重量百分比的全氟甲基乙烯基醚。
如上所述,弹性体和/或弹性体材料和/或非弹性体材料可与膨胀型含氟聚合物膈膜结合,使得弹性体和/或弹性体材料和/或非弹性体材料占据膨胀型含氟聚合物膈膜内的基本上所有空间或孔隙。
根据一实施例,复合材料可以包括由多孔eptfe膈膜制成的膨胀型含氟聚合物材料,例如,如通常在授予bacino的美国专利第7306729号中描述的。
用于形成所述的某些复合物的膨胀型含氟聚合物膈膜可以包括ptfe均聚物。在替代实施例中,可以使用ptfe、膨胀型改性ptfe和/或ptfe的膨胀型共聚物的混合物。例如,在授予branca的美国专利第5708044号、授予ballie的美国专利第6541589号、授予sabol等的美国专利第7531611号、ford的美国专利申请第11/906877号和xu等的美国专利申请第12/410050号中描述了适合的含氟聚合物材料的非限制性示例。
样品测试
根据w.l.戈尔及同仁股份有限公司(w.l.gore&associates,inc.)的armstrong等人于2015年10月12日提交的美国专利公开第2016/0100939号“带瓣管道”,带瓣管道(“对照瓣膜”)包括通过缝合附连的瓣叶,并且在管道的瓣膜区域处具有窦。可以根据本公开的实施例制造另一带瓣管道(“测试瓣膜”),并且包括非机械地附连的瓣叶,具有直径上恒定并且没有任何宏观的中断部的内表面,在管道的瓣膜区域处没有窦。图8示出了这种对照瓣膜和测试瓣膜在包括暴露于血液的模拟操作条件下的性能。如图8所示,与测试瓣膜相比,对照瓣膜显示出相对更大的血栓形成响应。如图所示,与测试瓣膜相比,对照瓣膜显示出显著更大的血栓形成响应。这样的测试说明了根据本公开的实施例可实现的血栓形成性的相对降低。
应该理解,尽管以下描述了某些方法和设备,但是可以替代地利用由本领域普通技术人员确定的其它方法或设备。
测试方法
用于评估此类带瓣管道的血栓形成响应的合适测试方法的非限制性示例包括利用体外、实验室闭合的血液环路(例如肝素化的猪血)以脉动性流动来使致动样品带瓣管道致动期望的时间(例如,大于一小时)。然后可以将样品带瓣管道从闭合的血液环路中取出并切开以进行目视检查和评估血栓形成。
上面已经一般性地并且关于特定实施例描述了本公开的发明特征。对于本领域技术人员将显而易见的是,在不脱离本公开的范围的情况下,可以对各实施例进行各种修改和变化。因此,旨在使各实施例覆盖本公开的修改和变型,只要它们落入所附权利要求及其等同物的范围内即可。
- 还没有人留言评论。精彩留言会获得点赞!