使用HBV包膜蛋白的HBVPreS1和/或PreS2和/或S-HBsAg区域的治疗乙型肝炎病毒(HBV)的疫苗的制作方法
交叉引用
本申请要求享有2017年11月16日提交的序列号为62/587051的美国临时专利申请的优先权,其全部内容通过引用合并于此。
政府权力声明
本发明是在美国国防部高级研究计划局(defenseadvancedresearchprojectsagency)授予的第hr0011-11-2-0007号拨款的政府支持下进行的,政府对本发明享有一定的权利。
背景技术:
尽管有预防性乙型肝炎病毒(hbv)疫苗供应,但在工业化国家和发展中国家,hbv感染仍然是一个非常重大的全球健康问题;它是仅次于烟草的致癌原因。对于慢性乙型肝炎(chb)患者,治疗性hbv疫苗的需求显然没有得到满足。10~30%的接种了市场上的hbv疫苗的人,由于遗传因素或不符合性(3次疫苗接种失败)而没有反应。只有37%的接种过一次许可的hbv疫苗的人得到了保护;即使接种了三次疫苗,这是很难实现的,许多人没有有效的反应。目前还没有有效的疫苗来治疗4亿慢性乙肝感染者,包括无症状的乙肝携带者。目前用于治疗慢性乙型肝炎患者的药物存在问题。持续的抗病毒反应很少实现,且目前可用的治疗方法在许多慢性乙型肝炎患者中可能导致病毒抵抗和产生副作用。
附图说明
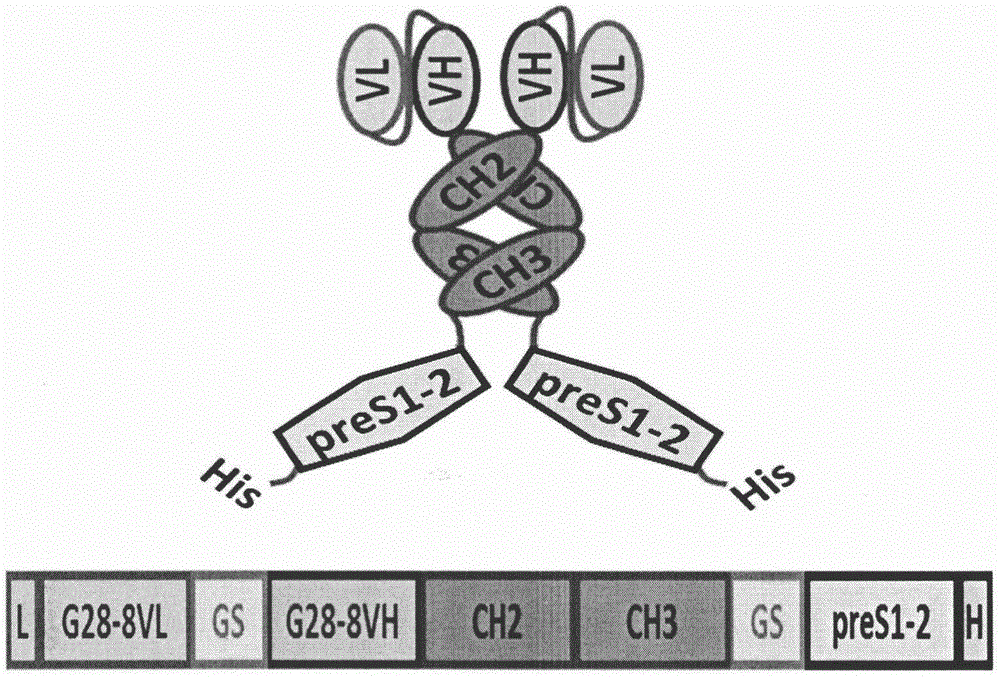
图1g28-8lh-scab-pres1-s2-his蛋白的方案设计;
图2重组g28-8lh-scab-pres1-s2-his的特性研究;g28-8lh-scab-pres1-s2-his在cho细胞中瞬时表达;培养上清通过ni2+亲和层析柱;用咪唑洗脱结合的g28-8lh-scab-pres1-s2-his;洗脱蛋白(e)通过还原sds-page和westernblotting方法,用anti-6x-his抗体进行表征;
图3重组g28-8lh-scab-pres1-s2-his与人b细胞的结合;使用fitc-anti-his单克隆抗体(粗黑线)直接与人门控cd20+扁桃体b细胞结合;仅限第二步(浅黑线);
图4重组g28-8lh-scab-pres1-s2-his激活人b细胞;富含b细胞的绵羊红细胞结合阴性血液单核细胞在37℃下仅用培养基(浅黑线)或用g28-8lh-scab-pres1-s2-his(粗黑线)孵育24小时;用流式细胞术检测门控样品中的cd20+细胞(太平洋蓝抗cd20)和cd40表达水平,作为活化的指标。图中显示的是门控cd20+b细胞的cd40的表达情况;
图5重组g28-8lh-scab-pres1-s2-his重组蛋白(cd180-hbv-pres1/s2)免疫增强猕猴的免疫应答。食蟹猴(macacafascularis)组(n=3)皮下接种:1)300μgg28-8lh-scab-pres1-s2(cd180-hbv-pres1/s2,黑圈);或2)300μgg28-8lh-scab-pres1-s2-his(αcd180-hbv-pres1/s2)加0.5mladdavaxtm(开放正方形);动物于第0和30天接种疫苗,并于初次免疫后第0、7、14和30天及二次免疫后第7、14和30天取血清及肝素化血样;(a)elisa检测hbv-pres1特异性igg抗体水平;每个时间点的平均光密度(o.d.)显示为±sem。(b)elispot法检测hbsag特异性的产ifn-γt细胞;在每一个时间点,使用标准差相等的样本进行未配对t检验,评估两组之间每次分析的统计比较;有显著性差异:*p=0.01,***p=0.006。对于所有其它时间点,各组之间的平均反应没有显著差异。
图6g28-8lh-scab-pres1-s2-his重组蛋白疫苗诱导中和抗体(abs)阻断hbv感染肝细胞中hbv-cccdna的产生;如图11所示,使用300ugg28-8lh-scab-pres1-s2-his(a57、a59和a60)或与100μg市售佐剂,addavaxtm(a55、a58和a68,图中用*表示)共同配制的300μgg28-8lh-scab-pres1-s2-his,对食蟹猴(macacafascicularis,n=3/组)进行启动和强化;第二次免疫后2周取血清进行中和抗体活性测定;(a)该方案说明了hbv接种物(每个细胞103geq)和血清样本(中和ab)的治疗方案;乙肝疫苗接种后hepg2-hntcp细胞用1∶1000稀释度(d)的预出血血清或来自猕猴的1∶300、1∶1000或1∶3000稀释度的免疫血清处理16h;在感染后1天(dpi),替换掉含有2.5%二甲基亚砜的培养基;在3dpi下提取cccdnas,并进行实时pcr分析;(b)将感染hbv的hepg2-hntcp细胞(103个geq/细胞)用所示的血清进行处理(1∶300d=原始血清按体积比稀释至1/300,1∶1000d=原始血清按体积比稀释至1/1000,1∶3000d=原始血清按体积比稀释至1/3000);将预出血血清(1/1000稀释度(体积/体积))作为对照;在3dpi时,用实时pcr方法分析cccdnas;在t5外切酶消化后,用特异性引物对cccdna进行特异性定量;cccdna按照相对于线粒体dna的比值标准化;代表性数据用量化表示(平均值±标准偏差)(n=2)。
具体实施方式
引用的所有参考文献均通过引用全文并入本文。在本申请中,除非另有说明,所使用的技术可在以下几个众所周知的参考文献中找到,例如:分子克隆:实验室手册(molecularcloning:alaboratorymanual)(sambrook等,1989年,coldspringharborlaboratorypress),基因表达技术(geneexpressiontechnology)(methodsinenzymology,第185卷,d.goeddel编辑,1991年。academicpress,sandiego,ca),酶学方法(methodsinenzymology)中的“蛋白质纯化指南(guidetoproteinpurification)”(m.p.deutshcer,ed.,(1990)academicpress,inc.);pcr方法:方法和应用指南(pcrprotocols:aguidetomethodsandapplications)(innis,等。1990年。academicpress,sandiego,ca),动物细胞培养:基本技术手册(cultureofanimalcells:amanualofbasictechnique),第2版(r.i.freshney。1987年。liss,inc.纽约,ny),基因转移和表达方法(genetransferandexpressionprotocols,第109-128页,编辑e.j.murray,humanapressinc.,clifton,n.j.,)和ambion1998目录(theambion1998catalog)(ambion,austin,tx)。
除非上下文另有明确规定,本发明使用的单数形式的“一”和“该”包括复数指代。除非另有明确规定,否则本发明使用的“和”可与“或”互换使用。
在本发明中,氨基酸残基缩写如下:丙氨酸(ala;a)、天冬酰胺(asn;n)、天冬氨酸(asp;d)、精氨酸(arg;r)、半胱氨酸(cys;c)、谷氨酸(glu;e)、谷氨酰胺(gln;q)、甘氨酸(gly;g)、组氨酸(his;h)、异亮氨酸(ile;i)、亮氨酸(leu;l)、赖氨酸(lys;k)、蛋氨酸(met;m),苯丙氨酸(phe;f)、脯氨酸(pro;p)、丝氨酸(ser;s)、苏氨酸(thr;t)、色氨酸(trp;w)、酪氨酸(tyr;y)和缬氨酸(val;v)。
除非上下文另有明确指示,本发明的任何方面的所有实施例都可以组合使用。
在第一方面,本发明提供了一种组合物,包括:
(a)cd180结合配体;和
(b)乙型肝炎病毒的hbv包膜蛋白的pre-s1和/或pre-s1区域(hbvpres1-s2ag)、或其抗原片段或突变体,附着于cd180结合配体上。
例如,本发明的组合物可用于在有hbv感染风险的个体中诱导预防性反应,以及在已经感染的个体和对标准疫苗反应不佳的免疫缺陷个体中诱导治疗性反应。本发明具有非常重要的意义,因为它为世界上主要的癌症和肝病病因之一:乙型肝炎病毒(hbv)提供了治疗性疫苗。无论是在工业化国家还是在发展中国家,hbv感染都是一个严重的全球性公共卫生问题。全球每年有1000~3000万人感染hbv,全球有20多亿人感染hbv。值得注意的是,未接种疫苗的个体对乙肝病毒产生有效免疫反应的能力与年龄相关。婴儿和幼儿尤其危险,因为90%的婴儿和高达50%的感染乙肝病毒的幼儿最终会发展成慢性感染。约有4亿人慢性感染乙肝病毒(chb),在美国约有140万chb感染者[5]。在美国,儿童hbv的患病率在下降,但在成人中几乎没有变化[11],因此成人慢性乙型肝炎的负担仍然很大[6];在一些人群中,这一比例高达1%。据估计,每年有100万人死于肝炎及其并发症,其中包括约5000美国人。在美国每年死于hbv相关疾病的5000人中,300人死于暴发性肝炎,3~4000人死于肝硬化,600~1000人死于原发性肝细胞癌(hcc)。在美国,每年约有400名卫生保健工作者受到感染,面临死于hbv相关疾病的风险[16]。
cd180结合配体可以是直接与b细胞、巨噬细胞或树突状细胞表面的cd180结合的任何分子。在各种非限制性实施例中,cd180结合配体可以是肽模拟物或抗体。
在特定实施例中,cd180结合配体是抗体或抗体片段。如本发明所使用的,“抗体”包括对以下任何一种全长和功能性片段的引用:与人cd180免疫反应(优选对cd180有选择性)的免疫球蛋白分子、诸如嵌合抗体(例如人源化鼠抗体)和杂合抗体(例如双特异性抗体)的基因工程形式、完全人源化抗体、人抗体、单链fv片段抗体(scfv)、二价或双特异性分子、双体、三体和四体、能够与抗原表位(如vh和vl)特异结合的单域分子和骆驼类。具有抗原结合活性的片段包括但不限于fab′、f(ab′)2、fab、fv和rigg,并且包括单克隆抗体。抗体存在多种同型,如igg1、igg2、igg3、igg4和其它ig,如igm、iga、ige等。该术语也包括二价和双特异性分子如以下文献所述:kostelny等.(1992)jimmunol148:1547,packandpluckthun(1992)biochemistry31:1579,hollinger等,1993,supra,gruberetal.(1994)jimmunol:5368,zhu等.(1997)proteinsci6:781,hu等.(1996)cancerres.56:3055,adams等.(1993)cancerres.53:4026,andmccartney,等.(1995)proteineng.8:301。还公开了各种抗原结合域融合蛋白,例如,在申请号为2003/0118592和2003/0133939的美国专利中使用的术语“抗体”包括在本申请内。
与人cd180免疫反应的抗体可通过重组方法产生,例如在噬菌体或类似载体中选择重组抗体文库,见,例如huse等,science246:1275-1281(1989);ward等,nature341:544-546(1989);andvaughan等,naturebiotech.14:309-314(1996),或用抗原或编码抗原的dna免疫动物。
在一个实施例中,cd180结合配体包含单链(sc)重组蛋白,其中sc重组蛋白包含:
(i)抗cd180抗体的重链可变(vh)区;以及
(ii)抗cd180抗体的轻链可变(vl)区。
在一个实施例中,cd180结合配体包含单域(sd)重组蛋白,所述sd重组蛋白包含来源于骆驼科动物的抗cd180抗体的重链可变(vhh)区。
vh和vl链区域可以来自抗人cd180抗体,例如抗人cd180单克隆抗体。商业上可使用vh和vl链的示例性cd180抗人单克隆抗体包括但不限于abdserotectm(“mhr73-11”)、bdbiosciences、thermoscientific、sigmaaldrich等公司出售的抗体(“g28-8”)和lifespantm(“200.1”)。在一个实施例中,单链重组蛋白不包括任何其他免疫球蛋白结构域(即:单链可变片段(scfv))。在另一实施例中,单链重组蛋白还包括:来自免疫球蛋白(ig)的ch2和ch3结构域,其中ig例如人类ig或其功能突变体,其中ch2和ch3结构域位于vh和vl结构域的c-末端。ch2和ch3结构域可来自任何被认为适合于组合物的预期用途的免疫球蛋白,包括但不限于iga1、iga2、igg1、igg2、igg3、igg4、igm等。在特定实施例中,sc重组蛋白包含来自igg1的ch2和ch3结构域,例如人类igg1或其功能突变体。在特定实施例中,此类“功能突变体”包括ch2和/或ch3结构域,其与人或动物fc受体fcγriib和/或人或动物补体蛋白结合受损(生物化学杂志(jbiolchem)276:6591-6604)。重组分子的fc结构域是一个改变了的人igg1fc结构域,有三种氨基酸变化(p238s,p331s,k322s),它们减少了分子与fc受体和c1q的结合。其它可以减少人igg1与各种fc受体结合的氨基酸替换包括但不限于e233p,l234v,l235a,g236缺失,p238a、d265a、n297a、a327q和p329a。这些氨基酸的替换减少了对所有fcγr的结合。d270a、q295a或a327s的替换减少了对fcγrii和fcγriiia的结合。在s239a、e269a、e293a、y296f、v303a、a327g、k338a和d376a处的替换减少了对fcγriiia的结合,但不减少对fcγrii的结合。在人igg1的fc结构域中,可以将两种以上的替换组合起来,以达到抑制cd180靶向疫苗和fcgr表达细胞之间fc-fcγr相互作用的预期效果。类似地,修改人类igg1的糖基化谱,例如,替换人igg1在asn-297处的n-连接糖基化位点,消除人igg1的n-连接糖基化,从而消除其与fc受体的结合以及补体固定功能(johns.axford(ed.),糖生物学和医学(glycobiologyandmedicine),27-43;2005springer)。
在本发明的组合物的这些不同实施例中,vl链区域可以位于vh链区域的n-末端,或者vh链区域可以位于vl链区域的n-末端,如下面的示例所示。
在一个实施例中,cd180抗体包括来自多种市售来源(bdbiosciences、thermoscientific、sigmaaldrich等)的单克隆抗体g28-8、单克隆抗体g28-8的f(ab′)2片段或具有g28-8的vl和vh结构域的单链重组蛋白,并且可选地还包括来自免疫球蛋白(ig)的ch2和ch3结构域,其中ig例如人类ig或其功能突变体。在另一个实施例中,cd180结合配体与单克隆抗体g28-8竞争性结合cd180。如本发明所使用的,竞争性cd180结合配体是这样的结合蛋白,即其结合与g28-8大约、基本上或本质相同,甚至相同的表位。竞争结合蛋白,例如竞争性抗体或其衍生物,包括具有重叠表位特异性的结合蛋白。因此,竞争结合蛋白能够有效地与g28-8抗体竞争,例如从thermoscientific获得的与cd180结合的g28-8抗体(“参考抗体(referenceantibody)”)。与参考g28-8抗体竞争性结合cd180的结合蛋白将能够有效或显著地减少(即:减少至少10%;优选减少至少20%、30%、40%、50%、60%、70%、80%、90%或更多)结合到cd180的参考g28-8抗体,结合标记的减少能够证明这一点。在一个实施例中,参考g28-8抗体在应用于cd180成分之前,与不同量(例如,1∶10、1∶100或1∶1000)的试验结合蛋白预混合一段时间。在其它实施例中,参考g28-8抗体和不同量的试验结合蛋白可在暴露于cd180成分期间简单地混合。通过使用种或同型二级抗体,人们将只能检测结合的参考g28-8抗体,其结合将因存在“竞争”结合的试验结合蛋白而减少。本发明提供了检测这种结合的实施例。由于竞争结合蛋白的鉴定是通过与参考的g28-8抗体进行比较来确定的,因此可以理解,为了鉴定竞争结合蛋白,实际上并不需要以任何方式确定结合蛋白所结合的表位。但是,如果需要的话,可以进行抗原表位鉴定。
在另一个实施例中,cd180结合配体激活抗原呈递细胞,例如增加cd40的表达,如下面的示例所示。
本发明所述组合物包括附在cd180结合配体上的乙型肝炎病毒包膜抗原pres1和/或pre-s2区域(hbvpres1/s2ag)、s-hbsag或其抗原片段或突变体(统称为hbvpres1/s2ag或s-hbsag)。因此,所述组合物可包含一个或多个hbvpres1/s2ags和/或s-hbsags。在所有实施例中,单链重组蛋白的n-末端或c-末端可能存在一个或多个hbvpres1/s2ags和/或s-hbsags。pres1和pres2存在于乙型肝炎表面抗原l-hbsag和m-hbsag中,因此hbvpres1/s2ag可能包含分离的pres1和/或pres2,也可能包含乙型肝炎表面抗原l-hbsag或m-hbsag。hbvpres1/s2ag、l-hbsag、m-hbsag和s-hbsag可来自任何hbv基因型、血清型、变异株、突变株或分离株。
在各种实施例中,所述组合物可包括hbvpres1/s2ag或s-hbsag,其与以下一种或多种氨基酸序列在长度上至少有90%一致性:
pres1/pres2
pres1
pres2
l-hbsag
m-hbsag
s-hbsag
p31873乙型肝炎病毒a1亚型adw2(南非分离株/cai)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
p03141a2型乙型肝炎病毒adw2亚型(rutter1979株)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
q4r1r8乙型肝炎病毒a3基因型(cameroon分离株/cmr711/1994)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
q8jxb9乙型肝炎病毒b1基因型(日本分离株/ry30/2002)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
q9pww3乙型肝炎病毒b2基因型(越南分离株/16091/1992)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
q76r62乙型肝炎病毒c基因型ayr亚型(人分离株/日本/冈本/-)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
p03138乙型肝炎病毒d基因型ayw亚型(法国分离株/tiollais/1979)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
q69603乙型肝炎病毒e基因型ayw4亚型(kou分离株)gn=spe=1sv=2
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
q99hs3型乙型肝炎病毒f1基因型(阿根廷分离株/sa11/2000)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
q99hr4型乙型肝炎病毒f2基因型(阿根廷分离株/sa16/2000)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
q9ibi3乙型肝炎病毒g型(分离株ig29227/2000)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
q8jmy6乙型肝炎病毒h基因型(美国分离株/las2523/2002)
pres1
pres2
s-hbsag
m-hbsag
l-hbsag
在各种进一步实施例中,所述组合物可包含与上述氨基酸序列在长度上至少有91%、92%、93%、94%、95%、96%、97%、98%、99%或100%一致性的hbvpres1/s2ag或s-hbsag多肽。在各种实施例中,还可包括hbvpres1/s2ag突变体(单独或组合)。这些突变体可能包括但不限于pres1s98t替换(plosone9:e110012,2014)、pres1f53l替换(jmedvirol85:1698,2013)或pres1a39r和pres1s96a/t替换(临床微生物感染(clinmicrobiolinfect)18:e412,2012)。
在所有这些实施例中,所述组合物可进一步包含位于cd180结合配体与hbvpres1/s2ag或s-hbsag之间的氨基酸连接物。根据预期用途,所述连接物可以具有任何合适的长度和氨基酸组成。在一个实施例中,所述连接物的长度约在2~40个氨基酸之间。在其它实施例中,所述连接物的长度可在10~30或15~25个氨基酸之间。在另一个实施例中,所述连接物可以是富含甘氨酸和丝氨酸残基的连接物。在一个特定实施例中,连接物可包含氨基酸序列ggggsggggsggggsggggs(序列idno:69)。
在各种进一步实施例中,所述组合物可包括或由多肽组成,所述多肽与以下g28-8lh-scab-pres1-s2-his蛋白(表达)的氨基酸序列在长度上至少有90%的一致性:
氨基酸1-20:先导(可选)
氨基酸21-129:g28-8vl(粗体)
氨基酸130-149:gly-ser连接物
氨基酸150-269:g28-8vh(粗体和下划线)
氨基酸270-503:hing-ch2-ch3
氨基酸504-533:gly-ser连接物
氨基酸534-697:pres1/pres2
氨基酸698-703:6xhis
括号中的残基是可选的
本发明的任一实施例或者实施例的组合中的组合物可以作为单独的成分提供,或者可以作为分子骨架的一部分提供。在各种实施例中,所述组合物可附着在分子骨架上。可以使用任何合适的骨架,包括但不限于vnar单域抗体(鲨鱼可变新抗原受体)、七鳃鳗可变淋巴细胞受体、im7(大肠杆菌素免疫7蛋白)、抗盐(脂蛋白转运蛋白)、fn3(纤维连接蛋白3)单体、darpin(设计的锚蛋白重复蛋白)、一种附加体(蛋白质a的z结构域)、一种单域抗体,例如从骆驼类或抗体库中分离出来的,以及具有cd180结合多肽环的适体等。
在另一实施例中,本发明的任一实施例或实施例的组合中的组合物还包括佐剂。虽然不需要佐剂来诱导hbvpres1/s2ag或s-hbsag的快速激活,但是当在本发明的方法中使用所述组合物时,向所述组合物添加佐剂可导致免疫应答的额外增强。本发明可使用任何合适的佐剂,包括但不限于无机化合物(氢氧化铝、磷酸铝、氢氧化钙、铍等)、矿物油、洗涤剂、细胞因子、toll样受体激动剂、弗氏完全佐剂、弗氏不完全佐剂、角鲨烯等。在优选实施例中,所述佐剂包括toll样受体4(tlr4)激动剂、toll样受体7(tlr7)激动剂、toll样受体8(tlr8)激动剂、toll样受体9(tlr9)激动剂、含明矾的佐剂、单磷酸脂a、水包油乳剂和水包油乳剂中的α-生育酚、角鲨烯和聚山梨酯80,或由它们组成。根据所使用的佐剂,佐剂可以作为未连接组分或连接组分存在于该组合物中。
在另一个实施例中,可以修饰本发明的组合物以延长半衰期,例如通过将至少一个分子附加到组合物上来延长血清半衰期,所述至少一个分子包括但不限于聚乙二醇(peg)基团、血清白蛋白、血清白蛋白结合结构域、转铁蛋白,转铁蛋白受体或其转铁蛋白结合部分,或其组合。如本发明所用,“附加”一词是指共价或非共价共轭物质。这种结合可以通过基因工程或化学手段实现。
本发明的成分可以存储在任何合适的缓冲溶液中。
在第二方面,本发明提供了编码本发明第一方面的任一实施例的组合物的分离核酸。所分离核酸的序列可包含rna或dna。这种分离核酸的序列可以包括有助于促进编码蛋白的表达和/或纯化的附加序列,包括但不限于polya序列、修饰的kozak序列、编码表位标签、输出信号和分泌信号、核定位信号,以及质膜定位信号的序列。在一个非限制性实施例中,分离核酸编码本发明所述公开的多肽。在其它实施例中,所述分离核酸包含或由如下所示的核苷酸序列组成。
5′端hindiii和3′端bamhi位点定向克隆到合适的表达载体中
kozak共识,gccacc,5′atg起始密码子之前
在5′端hindiii位点之后一个5′帧内终止密码子
在3′端bamhi位点前的两个帧内终止密码子
在第三方面,本发明提供包含本发明第二方面的分离核酸的核酸载体。“重组表达载体”包括操作性地将核酸编码区或基因连接到能够影响基因产物表达的任何启动子的载体。用于驱动本发明所述核酸序列在哺乳动物系统中表达的启动子序列可以是组成性的(由多种启动子中的任何一种驱动,包括但不限于cmv、sv40、rsv、actin、ef)或诱导性的(由包括但不限于四环素、蜕皮激素、激素敏感型的任何一种诱导性启动子驱动)。表达载体必须是可在宿主生物体内复制的,要么作为附加体,要么通过整合进到宿主染色体dna中。在优选实施例中,表达载体包含质粒。然而,本发明旨在包括提供等效功能的其他表达载体,例如病毒载体。
本发明的核酸和载体不仅可用于生产本发明的大量组合物,还可用于通过基因枪或其他方法施用的核酸(例如dna)疫苗。
在第四方面,本发明提供包含本发明第三方面的核酸载体的重组宿主细胞。宿主细胞可以是原核细胞,也可以是真核细胞。细胞可以瞬时或稳定转染。将表达载体转染原核和真核细胞(包括但不限于中国仓鼠卵巢(cho)细胞)可以通过任何合适的方法完成,包括但不限于细菌转化、磷酸钙共沉淀、电穿孔或脂质体介导的,deae-葡聚糖介导的,多阳离子介导或病毒介导的转染。
重组宿主细胞可用于制备抗体的方法(当结合蛋白为抗体时),包括:
(a)在适于表达核酸编码抗体成分的条件下培养本发明的重组宿主细胞;以及
(b)从培养细胞中分离抗体成分。
本领域技术人员可以基于本文的教导和所使用的特定宿主细胞和载体来确定核酸编码抗体组成的适当表达条件。
术语“重组”,如用于例如细胞或核酸、蛋白质或载体时,表示该细胞、核酸、蛋白质或载体已通过引入异源核酸或蛋白质或改变原生核酸或蛋白质而被修饰,或者这个细胞是从一个经过如此修饰的细胞中衍生出来的。因此,例如,重组细胞表达在细胞的原生(非重组)形式中未发现的基因,或表达在其他方面异常表达、表达不足或根本未表达的原生基因。本文中的术语“重组核酸”是指最初在体外形成的核酸,通常通过操纵核酸(例如使用聚合酶和核酸内切酶)以自然界中通常不存在的形式形成。以这种方式,实现了不同序列的可操作连接。因此,为了本发明的目的,线性形式的分离核酸或通过连接通常不连接的dna分子在体外形成的表达载体都被认为是重组的。据了解,一旦重组核酸被制备并重新引入宿主细胞或生物体,它将以非重组的方式复制,即使用宿主细胞的体内细胞机制,而不是体外操作;然而,这种核酸一旦重组产生,尽管随后以非重组方式复制,但就本发明的目的而言仍被视为重组。
在第五方面,本发明提供药物组合物,包括:
(a)本发明公开的任一实施例或实施例组合的组合物、分离核酸或重组表达载体;以及
(b)药物学上可接受的载体。
在本实施例中,本发明的组合物存在于药物制剂中。在本实施例中,所述组合物与药物学上可接受的载体结合。能够形成此类盐的适宜酸包括无机酸,例如盐酸、氢溴酸、高氯酸、硝酸、硫氰酸、硫酸、磷酸等;以及有机酸,例如甲酸、乙酸、丙酸、乙醇酸、乳酸、丙酮酸、草酸,丙二酸、丁二酸、马来酸、富马酸、邻氨基苯甲酸、肉桂酸、萘磺酸、磺胺酸等。能够形成这种盐的适宜碱包括无机碱,例如氢氧化钠、氢氧化铵、氢氧化钾等;有机碱,例如单、二、三烷基和芳基胺(例如三乙胺、二异丙胺、甲胺、二甲胺等)和任选取代的乙醇胺(例如,乙醇胺、二乙醇胺等)。
除了本发明的成分外,所述药物组合物还可包括(a)冻干保护剂;(b)表面活性剂;(c)膨松剂;(d)张力调节剂;(e)稳定剂;(f)防腐剂和/或(g)缓冲液。在一些实施例中,药物组合物中的缓冲液是tris缓冲液、组氨酸缓冲液、磷酸盐缓冲液、柠檬酸盐缓冲液或醋酸盐缓冲液。所述药物组合物还可包括冻干保护剂,例如蔗糖、山梨醇或海藻糖。在某些实施例中,药物组合物包括防腐剂,例如苯扎氯铵、苯乙铵、氯己定、苯酚、间甲酚、苯甲醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯丁醇、邻甲酚、对甲酚、氯甲酚、硝酸苯汞、硫柳汞、苯甲酸及其各种混合物。在其他实施例中,所述药物组合物包括膨胀剂,如甘氨酸。在另外的实施例中,药物组合物包括表面活性剂,例如聚山梨酸-20、聚山梨酸-40、聚山梨酸-60、聚山梨酸-65、聚山梨酸-80、聚山梨酸-85、泊洛沙姆-188、山梨醇酐单月桂酸酯、山梨醇酐单月桂酸酯、山梨醇酐单硬脂酸酯、山梨醇酐单油酸酯、山梨醇酐三月桂酸酯、山梨醇酐三月桂酸酯,或它们的组合。所述药物组合物还可包括张力调节剂,例如使所述制剂与人血基本上等渗或等渗的化合物。示例性的张力调节剂包括蔗糖、山梨醇、甘氨酸、蛋氨酸、甘露醇、葡萄糖、肌醇、氯化钠、精氨酸和精氨酸盐酸盐。在其他实施例中,所述药物组合物还包括稳定剂,例如,当与感兴趣蛋白质结合时,所述分子实质上防止或减少感兴趣蛋白质在冻干或液体形式下的化学和/或物理不稳定性。示例性稳定剂包括蔗糖、山梨醇、甘氨酸、肌醇、氯化钠、蛋氨酸、精氨酸和精氨酸盐酸盐。
可以在任何合适的配方中制备本发明的药物组合物,优选在适合通过注射给药的配方中制备。例如,此类药物组合物可用于用作疫苗、预防剂或治疗剂的方法中。
所述药物组合物可包含被认为适合于给定用途的任何其他成分,例如附加疗法或疫苗成分。在一个实施例中,药物组合物还包括toll样受体4(tlr4)激动剂、toll样受体7(tlr7)激动剂、toll样受体8(tlr8)激动剂、toll样受体9(tlr9)激动剂、含明矾佐剂、单磷酸脂a、水包油乳剂和在水包油乳液中的α-生育酚,角鲨烯和聚山梨酯80。
在第六方面中,本发明提供治疗或限制hbv感染或hbv相关病症发展的方法,包括为了治疗或限制病症发展,向需要的个人提供有效量的本发明的任一实施例或实施例的组合的组合物、分离核酸、重组表达载体或药物组合物或其药物盐。在一个实施例中,所述组合物预防性地用作疫苗以限制hbv感染疾病的发展/传染病的严重性,例如在未接触传染媒介但有接触该传染媒介风险的个体中。在其它实施例中,所述方法可用于治疗暴露于hbv或慢性感染hbv的人。
本发明的方法靶向cd180抗原,即,一种表达于b细胞、巨噬细胞和树突状细胞上的表面蛋白,在没有t细胞共刺激(如cd40缺乏)或完全没有t细胞(如tcrβ/δ缺乏)的情况下产生抗原特异性igg。因此,该方法可用于乙肝病毒感染或疫苗接种的任何治疗或预防性治疗。例如,这种方法也适用于新生儿、老年人、免疫受损和免疫功能低下者,特别是针对富含不发达或其他缺陷免疫系统的细胞群,并通过改善对需要连锁识别的抗原(碳水化合物表位等)的反应。
如本发明所用,“治疗”是指在已患有病症或已暴露于引起病症的物质/病原体的个人中完成以下一项或多项:(a)降低病症的严重程度;(b)限制或防止正在治疗的病症的症状发展(例如:癌症患者或其他患者的免疫缺陷)正在接受化疗和/或放疗);(c)抑制正在治疗的病症的症状恶化;(d)限制或防止先前患有病症的患者的病症复发;和(e)限制或防止以前有症状的病人的症状复发。
如本发明所使用的,“限制”或“限制发展”是指在病症未被限制的个体中完成以下一项或多项:(a)预防该病症;(b)降低该病症的严重程度;和(c)限制或防止该病症特有症状的发展。
如本发明所使用,“有效量”是指有效治疗和/或限制相关病症的组合物的量。虽然本发明的方法不需要使用佐剂,但所述方法还可包括施用可能额外增强免疫反应的佐剂,可使用任何合适的佐剂,包括但不限于toll样受体4(tlr4)激动剂、toll样受体7(tlr7)激动剂、toll样受体8(tlr8)激动剂、toll样受体9(tlr9)激动剂、含明矾的佐剂、单磷酸脂a、水包油乳剂和水包油乳剂中的α-生育酚、角鲨烯和聚山梨酯80。
个体可以是任何合适的个体,包括但不限于哺乳动物。个体优选是人。在一个实施例中,个体具有t细胞缺陷和/或b细胞和t细胞之间的共同刺激缺陷,或因慢性感染或因急性或慢性服用免疫抑制药物治疗自身免疫性疾病或其他炎症性疾病而免疫受损。在另一实施例中,个体小于一个月大或是老年人(即:至少65岁)。
在各种其它实施例中,个体具有乙型肝炎相关疾病,例如肝炎、肝炎相关疾病、暴发性肝炎、肝硬化和/或肝细胞癌,并且所述方法用于治疗乙型肝炎相关疾病,例如肝炎、肝炎相关疾病、暴发性肝炎、肝硬化,和/或肝细胞癌。
实施例1
g28-8lh-scab-pres1-s2-hiss重组蛋白分子的制备与鉴定。
g28-slh-scab-pres1-s2-his蛋白(表达)
氨基酸1-20:先导(可选)
氨基酸21-129:g28-8vl(粗体)
氨基酸130-149:gly-ser连接物
氨基酸150-269:g28-8vh(粗体和下划线)
氨基酸270-503:hing-ch2-ch3
氨基酸504-533:gly-ser连接物
氨基酸534-697:pres1/pres2
氨基酸698-703:6xhis
括号中的残基是可选的
g28-8(抗人cd180)-scab-pres1/s2重组蛋白分子。发明者已经证明,对于特异性抗cd180抗体,g28-8,vlvh-人igg1fc形式的单链抗体(scab)保留了其亲本g28-8igg的有效结合和生物学特性。利用g28-8lhscab构建g28-8lh-scab-pres1-s2-his重组蛋白。预计由其他抗cdl80抗体产生的单链抗体可在vlvh、vhvl或仅在vhvl构型中保留抗体特性。
重组g28-8lh-scab-pres1-s2-his蛋白的制备。
将编码g28-8lh-scab-pres1-s2-his重组蛋白(图1,g28-8lh-scab-pres1-s2-his蛋白)的互补dna(cdnas)克隆到哺乳动物表达载体ptt5中,该载体含有cmv启动子以驱动蛋白表达。用lipofectaminetm试剂(invitrogen-carlsbad,ca)或聚乙烯亚胺(pei)将这些质粒瞬时转染中国仓鼠卵巢(cho)细胞。在脂质体试剂中按照5%、20%和80%的比例采用表达质粒进行小规模转染优化,以确定用于大规模表达的质粒与脂质体试剂的最佳比例。一旦建立了优化的转染条件,将对用于重组蛋白生产的每个质粒进行大规模的转染。镍亲和层析,例如使用hispurni-ntatm树脂(thermofisherscientificinc.,rockfordil)纯化重组蛋白。g28-8lh-scab-hbv-pres1/s2蛋白的cdna序列预测多肽大小约为75kda。所述重组蛋白的表达二聚体形式的分子量预计为150kda。
图2显示了2升表达运行的结果。编码g28-8lh-scab-pres1-s2-his蛋白的质粒在cho细胞中瞬时表达8天。收集培养上清(~2升),离心去除细胞碎片。然后将澄清培养上清液上样到含有hispurni-ntatm树脂的柱上。用洗涤缓冲液(50mm磷酸盐缓冲液,ph7.0,300mmnacl,1mm咪唑)洗涤柱后,用洗脱缓冲液(50mm磷酸盐缓冲液,ph7.0,300mmnacl,150mm咪唑)洗脱结合重组蛋白。收集在280nm处检测到吸收率的蛋白质组分、汇集并在ph7.0的磷酸盐缓冲液中透析。纯化后的g28-8lh-scab-pres1-s2-his和hispurni-ntatm色谱中的未结合流在经考马斯蓝染色的sds-page(还原条件下为4~15%梯度)上进行分析。图2,左侧板显示一条主要蛋白带在~85kdamw处迁移,表明g28-8lh-scab-pres1-s2-his蛋白实际上是由cho细胞表达为完整蛋白并分泌到培养上清液中的。然后将复制的凝胶转移到尼龙膜上,用抗6x-his抗体免疫印迹。在相同的mwg28-8lh-scab-pres1-s2-his迁移到考马斯蓝染色凝胶上(图2,左侧板),仅在~85kda(图2,右侧板)处观察到强烈的抗6xhis信号。
实施例2
g28-8lh-scab-pres1-s2-his的表征
图3显示,人cd20+扁桃体b细胞(106)在96孔圆形底板中仅用pbsa(pbsw/0.2%bsa+0.2%nan3)培养基(灰色)或含有g28-8抗人cd180(lh)g28-8lh-scab-pres1-s2-his(黑色)轻链和重链的his标记重组蛋白孵育,在冰上孵育40min后,将细胞洗涤两次(以1200rpm离心,4min)。然后将100μlpbsa+5μl荧光素(fitc)结合抗6xhis(fitc-6x-hisepitopetagthermoscientificma1-81891)加入到孔中,在冰上孵育40min后,清洗细胞两次,并用流式细胞仪测量荧光水平,如横坐标(对数刻度)所示。未着色的细胞显示为黑色。所示的重组蛋白与b细胞的结合高于fitc对照,显示与b细胞上表达的cd180的结合。
在b细胞上连接cd180可以上调cd40的表达[51]。然后测试g28-8lh-scab-pres1-s2-his上调cd40表达的能力,以评估其功能活性(图4)。在37℃下,用培养基(灰色线)或10μg/ml的g28-8lh-scab-hbv-pres1/s2-his(黑色线)孵育富集为b细胞的er-血单个核细胞24小时。用pbsa两次洗涤样品,用cd20(pacificbluebiolegendtm)和cd40(fitcbdbiosciences)特异性单克隆抗体染色,并用流式细胞术评估cd40和cd20的表达。图示门控cd20+b细胞cd40的表达。g28-8lh-scab-pres1-s2-his上调cd40表达,证实了g28-8lh-scab-pres1-s2-his具有功能活性(图4)。
实施例3
g28-8lh-scab-pres1-s2-his重组蛋白诱导猕猴产生pres1-s2特异性igg抗体
在食蟹猴(macacafascicularis)的免疫实验中,检测了g28-8lh-scab-pres1-s2-his诱导体液和细胞免疫应答的能力。每组猕猴(n=3)皮下接种:1)300μgg28-8lh-scab-pres1-s2-his(αcd180-hbv-pres1/s2)1ml;或2)300μgg28-8lh-scab-pres1-s2-his与100μg市售佐剂addavaxtm(invivogen,sandiego,ca)共1ml共同配制。动物在第0和30天接种,第0、7、14、30天(第一次给药后时间点)、37、44、60天(第二次给药后时间点)取血清和肝素化血样。如下所示,用elisa法检测血清样本中igg抗体对hbv-pres1的反应:a)用200ng/纯化的重组pres1肽(115个氨基酸,cosmobio.japancat#bcl-ags1-01)包被96孔板;b)加入血清样品的系列稀释液(100μl在tbs中稀释+0.05%吐温-20),从1∶1000稀释度开始,然后洗涤并加入hrp抗猕猴igg第二次(rockland,1∶5000稀释)。两组免疫后均产生igg(图5a)。抗体滴度每升高一次就升高。在第二次免疫后的两个时间点,与未给予addavaxtm的组相比,接受addavaxtm佐剂的重组蛋白组有更高的igg抗体反应。
实施例4
g28-8lh-scab-pres1-s2-his诱导猕猴hbv特异性t细胞应答
为了确定猕猴接种后hbv-pres1/s2特异性、细胞内产生细胞因子的t细胞的频率,从免疫猕猴前后获得的肝素化血样中分离外周血单个核细胞(pbmcs),如实施例3所示。用梯度离心法分离pbmcs,用hbsag肽池(11个氨基酸重叠15mers)体外刺激18h。用配对抗猕猴ifn-γ单克隆抗体(u-cytech-bv)检测hbs特异性t细胞分泌ifn-γ。用带ctlimmunospottm专业软件(cellulartechnologyltd.)的immunospottm分析仪对斑点形成细胞(sfc)进行计数。图5b所示的结果是每100万pbmc时间点的平均sfc±sem。试验在重复孔中进行。所示的净反应是通过从同一动物的dmso刺激的对照孔中减去斑点数来确定的。在每个时间点,使用标准差相等的样本进行未配对t检验,并在规定浓度下(约120万个细胞/条件)在生长培养基中重新悬浮,评估两组之间每次分析的统计比较。单用g28-8lh-scab-pres1-s2-his一次免疫后14天内,hbsag特异性的产ifn-γt细胞数量增加,而添加addavaxtm佐剂并没有增加hbsag特异性t细胞水平。
实施例5
g28-8lh-scab-pres1-s2-his诱导猕猴产生hbv特异性中和抗体(abs)
为确定猕猴接种后乙肝病毒中和抗体(abs)的频率,如实施例3所述,血清来自在第二次免疫前(出血前)和第二次免疫后14天的猕猴。从hepad38细胞培养上清中提取hbv颗粒作为hbv生产细胞系。对于hbv感染,将表达hbvntcp受体的hepg2肝细胞(hepg2-hntcp细胞)接种于60mm培养皿或包被有1型胶原的6孔板中。1天后,在含4%聚乙二醇(peg)8000的dmem中以103个基因组当量(geq)接种hbv病毒,持续16h,然后在含2.5%dmso的dmem中维持细胞几天。对于病毒中和实验,如图6a所示,在接种期间(16h)添加正在测试中和abs的血清。
为分析hbvcccdnas,采用hirt提取法分离病毒cccdnas,从hbv感染细胞中提取无蛋白dna。简而言之,60mm培养皿中的细胞在含有50mmtrishcl(ph7.4)、150mmnacl、10mmedta和1%十二烷基硫酸钠的1ml裂解缓冲液中裂解。在室温下孵育1h后,将裂解物转移到2-ml管中,然后添加0.25ml2.5mkcl,然后在4℃下孵育过夜。裂解液经离心澄清,苯酚氯仿萃取。dna经异丙醇沉淀过夜,溶于无核酸酶水中。提取的dna经质粒安全的atp依赖性dnase处理进行southern杂交分析或经t5外切酶处理进行实时pcr。实时pcr采用dneasytmblood&tissuekit(qiagen)从感染细胞中纯化总dnas。cccdna水平按线粒体dna的标准化比率表达,并用特异性pcr引物检测cccdna。
检测中和抗体活性的血清包括每只动物的出血前对照(1∶1000稀释度)和第14天第二次免疫后从免疫猕猴获得的血清。免疫血清在1∶300稀释度(d)、1∶1000d或1∶3000d下进行中和ab活性试验。来自免疫猕猴的三份血清(第14天增强)具有中和ab活性,阻止hbv在体外肝细胞中表达cccdna,来自组1的两只动物和来自组2的一只动物(图6b)。第一组:g28-8lh-scab-pres1-s2-his(300ug)猴编号:a16157、a16159、a16160。第二组:g28-8lh-scab-pres1-s2-his(300μg)+addavax(100μg)猴子编号:a16155、a16158、a16168。
参考文献
1.bertolettia,ferraric.adaptiveimmunityinhbvinfection.jhepatol.2016.64:s71-83.
2.chappellcp,giltiaynv,dreschc,clarkea.controllingimmuneresponsesbytargetingantigenstodendriticcellsubsetsandbcells.intimmunol.2014.26:3-11.
3.kimh.n.,etal.,hepatitisbvaccinationinhiv-infectedadults:currentevidence,recommendationsandpracticalconsiderations.internationaljournalofstd&aids,2009.20:595-600.
4.kubba,a.k.,etal.,non-responderstohepatitisbvaccination:areview.communicablediseaseandpublichealth/phls,2003.6:106-12.
5.ott,j.j.,etal.,globalepidemiologyofhepatitisbvirusinfection:newestimatesofage-specifichbcagseroprevalenceandendemicity.vaccine2012.30:2212-9.
6.weinbaumcm,williamsi,mastee,etal.recommendationsforidentificationandpublichealthmanagementofpersonswithchronichepatitisbvirusinfection.centersfordiseasecontrolandprevention(cdc).mmwrrecommrep.2008.57(rr-8):1-20.
7.wasleya,kruszon-morand,kuhnertw,etal.theprevalenceofhepatitisbvirusinfectionintheunitedstatesintheeraofvaccination.jinfectdis.2010.202:192-201.
8.mitchellt,armstronggl,hudj,wasleya,painterja.theincreasingburdenofimportedchronichepatitisb-unitedstates,1974-2008.plosone.2011.6:e27717.
9.hepatitisbvaccines.releveepidemiologiquehebdomadaire/sectiond′hygienedusecretariatdelasocietedesnations=weeklyepidemiologicalrecord/healthsectionofthesecretariatoftheleagueofnations,2004.79:255-63.
10.perzjfetal.,thecontributionsofhepatitisbvirusandhepatitiscvirusinfectionstocirrhosisandprimarylivercancerworldwide.jhepatol2006.45:529-38.
11.lavanchy,d.,hepatitisbvirusepidemiology,diseaseburden,treatment,andcurrentandemergingpreventionandcontrolmeasures.jviralhep2004.11:97-107.
12.kimwr,epidemiologyofhepatitisbintheunitedstates.hepatology,2009.49:s28-34.
13.wangl,zouzq,liucx,linxz.immunotherapeuticinterventionsinchronichepatitisbvirusinfection:areview.jimmunolmethods.2014may;407:1-8.
14.thaih,campods,laraj,etal.convergenceandcoevolutionofhepatitisbvirusdrugresistance.natcommun.2012.3:789.
15.menéndez-ariasl,alvarezm,pachecob.nucleoside/nucleotideanaloginhibitorsofhepatitisbvirespolymerase:mechanismofactionandresistance.curropinvirol.2014.8c:1-9.
16.wiegandj,van
17.luckhauptse,calvertgm.deathsduetobloodborneinfectionsandtheirsequelaeamonghealth-careworkers.amjindmed.2008.51:812-24.
18.beck,j.andm.nassal,hepatitisbvirusreplication.worldjgastroenterolwjg,2007.13:48-64.
19.brussv.hepatitisbvirusmorphogenesis.worldjgastroenterol.2007.13:65-73.
20.gerlichwh.prophylacticvaccinationagainsthepatitisb:achievements,challengesandperspectives.medmicrobiolimmunol.2015.204:39-55.
21.engnf,bhardwajn,mulliganr,diaz-mitomaf.thepotentialof1018issadjuvantinhepatitisbvaccines:heplisavtm.humvaccinimmunother.2013.9:1661-72.
22.jilgw.novelhepatitisbvaccines.vaccine.1998.16suppl:s65-8.
23.madalinskik,sylvansp,
24.rendi-wagnerp,shouvald,gentonb,etal.comparativeimmunogenicityofapres/shepatitisbvaccineinnon-andlowresponderstoconventionalvaccine.vaccine.2006.24:2781-9.
25.niy,lemppfa,mehrles,etal.hepatitisbanddvirusesexploitsodiumtaurocholateco-transportingpolypeptideforspecies-specificentryintohepatocytes.gastroenterology.2014apr;146(4):1070-83.
26.liw.ntcpisreceptorforhbvthehepatitisbvirusreceptor.annurevcelldevbiol.2015;31:125-47.
27.chisw,kimj,yigs,honghj,ryuse.broadlyneutralizinganti-hbvantibodybindstonon-epitoperegionsofpres1.febslett.2009.583:3095-100.
28.ferraric,pennaa,bertolettiaetal.thepres1antigenofhepatitisbvirusishighlyimmunogenicatthetcelllevelinman.jclininvest.1989.84:1314-9.
29.krawczyka,ludwigc,jochumcetal.inductionofarobustt-andb-cellimmuneresponseinnon-andlow-responderstoconventionalvaccinationagainsthepatitisbbyusingathirdgenerationpres/svaccine.
vaccine.2014.32:5077-82.
30.dions,bourginem,godono,levillayerf,michelml.adeno-associatedvirus-mediatedgenetransferleadstopersistenthepatitisbvirusreplicationinmiceexpressinghla-a2andhla-dr1molecules.jvirol.2013may;87(10):5554-63.
31.biany,zhangz,sunzetal.vaccinestargetingpres1domainovercomeimmunetoleranceinhbvcarriermice.hepatology.2017apr26.doi:10.1002/hep.29239.[epubaheadofprint]
32.valentinema,clarkea,shugl,norrisna,ledbetterja.antibodytoanovel95-kdasurfaceglycoproteinonhumanbcellsinducescalciummobilizationandbcellactivation.jimmunol.1988.140:4071-8.
34.miyake,k.,etal.,murinebcellproliferationandprotectionfromapoptosiswithanantibodyagainsta105-kdmolecule:unresponsivenessofx-linkedimmunodeficientbcells.jexpmed1994.180:1217-24.
34.miyake,k.,etal.,rp105,anovelbcellsurfacemoleculeimplicatedinbcellactivation,isamemberoftheleucine-richrepeatproteinfamily.jimmunol1995.154:3333-40.
35.alvingcr,peachmankk,raom,reedsg.adjuvantsforhumanvaccines.curtopinimmunol.2012.24:310-5.
36.shimazu,r.,etal.,md-2,amoleculethatconferslipopolysaccharideresponsivenessontoll-likereceptor4.jexpmed1999.189:1777-82.
37.hebeis,b.,etal.,vavproteinsarerequiredforb-lymphocyteresponsestolps.blood,2005.106:635-40.
38.hebeis,b.j.,etal.,activationofvirus-specificmemorybcellsintheabsenceoftcellhelp.jexpmed2004.199:593-602.
39.yazawa,n.,etal.,cd19regulatesinnateimmunitybythetoll-likereceptorrp105signalinginblymphocytes.blood,2003.102:1374-80.
40.chaplin,j.w.,etal.,anti-cd180(rp105)activatesbcellstorapidlyproducepolyclonaligviaatcellandmyd88-independentpathway.jimmunol,2011.187:4199-209.
41.schultzte,blumenthala.therp105/md-1complex:molecularsignalingmechanismsandpathophysiologicalimplications.jleukocbiol.2017jan;101(1):183-192.
42.ohtou,miyakek,shimizut.crystalstructuresofmouseandhumanrp105/md-1complexesrevealuniquedimerorganizationofthetoll-likereceptorfamily.jmolbiol.2011nov4;413(4):815-25
43.yoonsi,hongm,wilsonia.anunusualdimericstructureandassemblyfortlr4regulatorrp105-md-1.natstructmolbiol.2011aug21;18(9):1028-35.
45.chaplin,jw,chappellcp,clarkea.targetingantigenstocd180rapidlyinducesantigen-specificigg,affinitymaturationandimmunologicmemory.2013.jexpmed210:2135-46.
46.ramos,h.j.andm.gale,jr.,rig-ilikereceptorsandtheirsignalingcrosstalkintheregulationofantiviralimmunity.curropinvirol,2011.1:67-76.
47.maxoner,siegristca.thenextdecadeofvaccines:societalandscientificchallenges.lancet.2011.378:348-59.
48.liangyetal.,predictorsofrelapseinchronichepatitisbafterdiscontinuationofanti-viraltherapy.alimentpharmacolther,2011.34:344-52.
49.sutharms,diamondms,galem,jr.westnilevirusinfectionandimmunity.2013.natrevmicrobiol11:115-128.
50.coffmanrl,shera,sederra.vaccineadjuvants:puttinginnateimmunitytowork.immunity.2010.33:492-503.
51.clarkea,shugl,lüscherb,draveske,banchereauj,ledbetterja,valentinema.activationofhumanbcells.comparisonofthesignaltransducedbyil-4tofourdifferentcompetencesignals.jimmunol.1989.143:3873-80.
loudonpt,yagerej,lynchdt,narendrana,stagnarc,franchiniam,fullerjt,whitepa,nyuandij,wileyca,murphey-corbm,fullerdh.gm-csfincreasesmucosalandsystemicimmunogenicityofanh1n1influenzadnavaccineadministeredintotheepidermisofnon-humanprimates.plosone.2010.5:e11021.
toitar,kawanot,kangjh,muratam.applicationsofhumanhepatitisbviruspresdomaininbio-andnanotechnology.worldjgastroenterol.2015jun28;21(24):7400-11.
cheny,baiy,guox,wangw,etal.selectionofaffinity-improvedneutralizinghumanscfvagainsthbvpres1fromcdr3vh/vlmutantlibrary.biologicals.2016jul;44(4):271-5.
- 还没有人留言评论。精彩留言会获得点赞!