登革病毒疫苗组合物的制剂的制作方法
本发明涉及登革病毒疫苗的制剂,其包含至少一种活减毒登革病毒或活减毒嵌合黄病毒、缓冲剂、糖、纤维素衍生物、糖醇或二醇、和任选地氨基酸和碱金属或碱土金属盐;和登革病毒疫苗的制剂,其包含至少一种活减毒登革病毒或活减毒嵌合黄病毒、缓冲剂、至少150mg/ml的糖、载体以及任选地碱金属或碱土金属盐、或者碱金属或碱土金属盐和氨基酸。
背景技术:
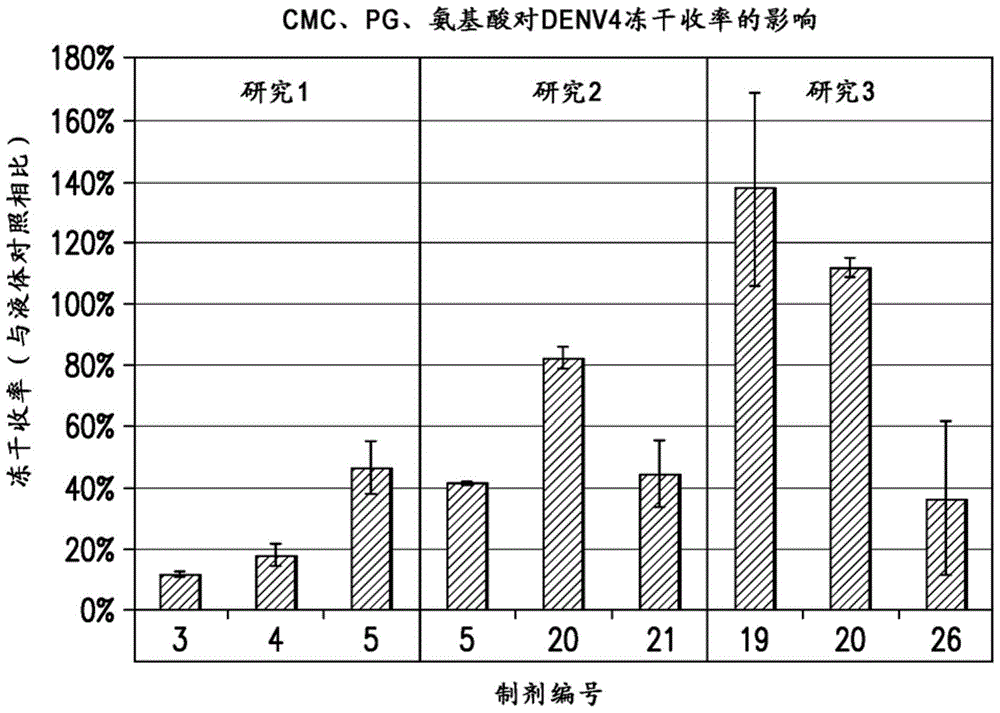
:黄病毒(flaviviridae)科包括原型黄热病毒(yf)、四种血清型的登革病毒(denv-1、denv-2、denv-3和denv-4)、日本脑炎病毒(je)、蜱传脑炎病毒(tbe)、西尼罗病毒(wn)、圣路易斯脑炎病毒(sle)和约70种其他引起疾病的病毒。黄病毒(flaviviruses)是含有单一正链rna基因组的小的包膜病毒。十种基因产物由单一开放阅读框编码且翻译为以如下顺序组织的多蛋白:衣壳(c),“膜前体”(premembrane,prm,其在病毒粒子从细胞释放前才被加工成“膜”(m)),“包膜”(e),随后为非结构(ns)蛋白ns1、ns2a、ns2b、ns3、ns4a、ns4b和ns5(综述于chambers,t.j.等人,annualrevmicrobiol(1990)44:649-688;henchal,e.a.和putnak,j.r.,clinmicrobiolrev.(1990)3:376-396)。然后,通过由宿主以及病毒编码的蛋白酶介导的精确加工事件产生各个黄病毒蛋白。黄病毒的包膜源自宿主细胞膜且含有病毒编码的膜锚定的膜(m)和包膜(e)糖蛋白。e糖蛋白是最大的病毒结构蛋白且含有负责细胞表面附着和内体-内融合(intra-endosomalfusion)活性的功能结构域。其也是宿主免疫系统的主要目标,诱导病毒中和抗体的产生,这与保护性免疫相关。登革病毒通过伊蚊属的蚊子:主要是埃及伊蚊(a.aegypti)和白纹伊蚊(a.albopictus)传播给人。登革病毒的感染导致各种临床表现,范围为从不明显的或轻度的发热疾病,经典型登革热(df),到登革出血热/登革休克综合征(dhf/dss)。登革热特征在于高烧、头痛、关节和肌肉疼痛、皮疹、淋巴结病和白细胞减少(gibbons,r.v.和d.w.vaughn,britishmedicaljournal(2002)324:1563-1566)。dhf/dss是更常见于儿童中的更严重的感染形式,标志为血管通透性和/或严重出血表现,范围为从存在瘀点和瘀斑至自发性严重出血和深度休克。在没有诊断和及时医疗干预的情况下,如果不治疗,dhf/dss的突然发病和快速进展可以是致命的。在全球发病率和死亡率的方面,登革病毒是最显著的一组的节肢动物传播病毒,估计每年发生一亿例登革感染,包括至少3600万例登革热和250,000至500,000例dhf/dss(gubler,d.j.,clin.microbiol.rev.(1998)11:480-496;gibbons,同上)。随着全球人口的增加,人口的城市化(特别是在整个热带地区),和持续蚊子控制措施的缺乏,登革的蚊子载体已经将它们的分布扩散遍及热带、亚热带和一些温带地区,给超过一半世界人口带来了登革感染的风险。现代飞机旅行和人类迁徙已经促进了登革血清型的全球分布,使得多种登革血清型现在在许多地区是地方性流行的。在过去20或更多年,已存在登革流行频率和dhf/dss发病率的增加。例如,在东南亚,dhf/dss是儿童中住院和死亡的主要因素(gubler,同上;gibbons和vaughn,同上)。迄今为止,黄病毒疫苗的开发成败参半(mixedsuccess)。为了产生保护免于由黄病毒引起的疾病的候选疫苗,已经实施了4种基本方法:活减毒病毒、灭活的完整病毒、重组亚单位蛋白和基于dna的疫苗。用于黄热病毒的活减毒疫苗已经使用了数十年,并且更近地,用于日本脑炎的活减毒疫苗已在世界多国得到注册。对于tbe和je病毒,已经证明了灭活的完整病毒疫苗的使用,并且几种注册产品是可用的。heinz等人flavivirusandflavivirusvaccines.vaccine30:4301-06(2012)。尽管上文着重介绍的yf、je、和tbe疫苗取得了成功,但使用活减毒病毒和灭活的病毒方法来开发登革病毒的疫苗已经遇到了显著挑战。存在四种血清型的登革病毒(denv1、denv2、denv3和denv4)且发现各血清型的毒株传播遍及整个世界的登革流行地区。自然感染为感染的血清型赋予持久的免疫力,但对非其他登革血清型则没有。当一种血清型的登革病毒感染继之以另一种血清型的第二次感染时,在第二次登革感染后最经常发生更严重形式的疾病(dhf/dss)。已经假设dhf和dss与第二次登革感染的更频繁关联是由于一种病毒类型感染诱导的非中和抗体增强第二种登革病毒类型的感染性(抗体依赖性增强-ade)。迄今为止,临床测试的大多数疫苗是活减毒疫苗。非复制型疫苗候选物的使用也在探索中。例如,ivy等人(美国专利6,432,411)公开了包含den1-480%e(对应于denv-2包膜多肽的氨基酸1-395的den1-4的肽区域)蛋白的四价亚单位疫苗。ivy等人(同上)还报道了包含denv1-480%e和佐剂的组合物。coller等人(wo2012/154202)公开了包含den1-4的den1-480%e的四价制剂。灭活的病毒也可以用作潜在的疫苗候选物或用作有效疫苗的组分(putnak等人vaccine23:4442–4452(2005),us6190859,us6254873和sterner等人wo2007/002470)。国际专利申请号pct/us14/042625(wo/2014/204892)中公开了包含活减毒登革病毒疫苗和非复制型登革疫苗的组合物。由于其能够产生体液和细胞免疫应答,因而全病毒是在若干疫苗产品中常用的抗原之一。含有全病毒的疫苗产品在稳定性方面存在挑战,因为其对加热、冷冻/融化和其他加工压力(stresses)敏感,导致显著的效价损失。这些产品通常冷冻(低于-20℃)或以干燥粉末形式保存。冷冻产品不容易存储和分发,因为其有严格的冷链要求以防止效价损失。由于干燥过程中遇到的冷冻和干燥压力,因而全病毒(特别是包膜病毒)的干燥通常会导致效价显著损失。因此,本领域需要生产登革病毒的稳定制剂。技术实现要素:本发明提供了活减毒登革疫苗的稳定制剂。加入纤维素衍生物和糖醇或二糖改善了干燥后的稳定性和/或收率。或者,加入至少150mg/ml糖改善了微波干燥后的稳定性和/或收率。在一个方面中,本发明提供了一种制剂,其包含活减毒登革疫苗,所述疫苗包含至少一种活减毒登革病毒(lav)或至少一种活减毒嵌合黄病毒(lacv)、ph约6.5至8.5的缓冲剂、糖、二醇或糖醇、和选自下述的纤维素衍生物:羧甲基纤维素、羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc)、2-羟乙基纤维素(2-hec)、交联羧甲基纤维素和甲基纤维素或其药学上可接受的盐;任选地碱金属或碱土金属盐、和任选地选自下述的氨基酸:ala、asp、his、leu、lys、gln、pro或glu、或其组合。在一个实施方式中,缓冲剂选自下述:琥珀酸盐、组氨酸、磷酸盐、tris、bis-tris、mes、mops、hepes、乙酸盐和柠檬酸盐、或其组合。在另一个实施方式中,碱金属或碱土金属盐是氯化镁、氯化钙、氯化钾、氯化钠、或其组合。在进一步的实施方式中,糖是海藻糖或蔗糖。在一个实施方式中,纤维素衍生物是羧甲基纤维素的药学上可接受的盐。在另一个实施方式中,二醇选自下述:丙二醇、聚丙二醇、乙二醇、聚乙二醇和聚乙二醇单甲醚。在进一步的实施方式中,糖醇是甘油。在另一个方面中,制剂包含活减毒登革疫苗,所述疫苗包含约100-10,000,000pfu/ml的至少一种活减毒登革病毒(lav)或至少一种活减毒嵌合黄病毒、ph约6.5至8.5的缓冲剂、约50-300mg/ml糖、约2.5-10.0mg/ml丙二醇(pg)或甘油、和约0.3-10mg/ml羧甲基纤维素钠(cmc钠)、任选地约10-150mmnacl、和任选地约10-100mm选自下述的氨基酸:ala、asp、his、leu、lys、gln、pro或glu、或其组合;约100-100,000pfu/ml的活减毒登革疫苗、约5-300mmph约7.0至8.0的组氨酸、tris、bis-tris或磷酸盐缓冲剂或其组合、约50-300mg/ml糖、约3-10mg/ml丙二醇或甘油、和约3-10mg/ml羧甲基纤维素钠、任选地约15-75mmnacl、和任选地约10-75mm选自下述的氨基酸:ala、asp、his、leu、lys、gln、pro或glu、或其组合;约600-20,000pfu/ml活减毒登革疫苗、约5-300mmph约7.0-8.0的磷酸钾缓冲剂、约60-120mg/ml蔗糖或海藻糖或其组合、约3-7mg/ml丙二醇或甘油、和约3-7mg/ml平均分子量约90,000的羧甲基纤维素钠、和约30-90mmnacl、和任选地约10-75mm氨基酸leu、lys或glu、或其组合;约600-20,000pfu/ml活减毒登革疫苗、约11mmph约7.0-8.0的磷酸钾缓冲剂、约90mg/ml蔗糖、约5mg/ml丙二醇或甘油、约5mg/ml平均分子量约90,000的羧甲基纤维素钠、和约75mmnacl;约600-20,000pfu/ml活减毒登革疫苗、约11mmph约7.0-8.0的磷酸钾缓冲剂、约90mg/ml蔗糖、约5mg/ml丙二醇、约5mg/ml平均分子量约90,000的羧甲基纤维素钠、约50mmnacl、和约25mmleu;约600-20,000pfu/ml活减毒登革疫苗、约11mmph约7.5的磷酸钾缓冲剂、约90mg/ml蔗糖、约5mg/ml丙二醇、约5mg/ml平均分子量约90,000的羧甲基纤维素钠、和约30mmnacl。在前述实施方式的一个方面中,制剂还包含约90-200mg/ml海藻糖。在本发明的一个优选实施方式中,制剂包含活减毒登革疫苗,所述疫苗包含约600-20,000pfu/ml的至少一种活减毒登革病毒(lav)或至少一种活减毒嵌合黄病毒、约11mmph约7.5-8的磷酸钾缓冲剂、约90mg/ml蔗糖、约110mg/ml海藻糖、约5mg/ml丙二醇、约5mg/ml平均分子量约90,000的羧甲基纤维素钠、约50mmnacl、和约25mmleu。在前述实施方式的一个方面中,制剂还包含约0.0001至5%w/v选自下述的表面活性剂:泊洛沙姆188和泊洛沙姆407。本发明还提供了一种制剂,其包含活减毒登革疫苗,所述疫苗包含约100-10,000,000pfu/ml的至少一种活减毒登革病毒(lav)或至少一种活减毒嵌合黄病毒、ph约6.5至8.5的缓冲剂、约150-300mg/ml糖、选自下述的载体:聚乙烯吡咯烷酮(pvp)、羧甲基纤维素、羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc)、2-羟乙基纤维素(2-hec)、交联羧甲基纤维素、甲基纤维素、或其药学上可接受的盐、人血清白蛋白(hsa)和明胶;任选地约5-100mm碱金属盐或碱土金属盐;任选地氨基酸gln、pro或glu、或其组合。在一个实施方式中,缓冲剂选自下述:琥珀酸盐、组氨酸、磷酸盐、tris、bis-tris、mes、mops、hepes、乙酸盐和柠檬酸盐、或其组合。在另一个实施方式中,碱金属或碱土金属盐是氯化镁、氯化钙、氯化钾、氯化钠或其组合。在进一步的实施方式中,糖是海藻糖或蔗糖、或其组合。在一个实施方式中,蔗糖与海藻糖的比率是在1:1至1:4之间。在另一个实施方式中,载体是羧甲基纤维素钠、hpmc、has或明胶。在进一步的方面中,本发明提供了活减毒登革疫苗制剂,其包含约200-100,000pfu/ml的至少一种活减毒登革病毒(lav)或至少一种活减毒嵌合黄病毒、ph约6.5-8.0的缓冲剂、约150-300mg/ml以蔗糖和海藻糖组合形式的糖、约0.3至40mg/mlcmc钠、has、hpmc或明胶、任选地约10-100mm碱金属或碱土金属盐、和任选地约5-25mm谷氨酸;约600-20,000pfu/ml活减毒登革疫苗、约5-300mmph约7.0至8.0的组氨酸、tris或磷酸盐缓冲剂或其组合、约50-100mg/ml蔗糖、约90-200mg/ml海藻糖、约0.3-10mg/mlcmc钠或约10-40mg/ml明胶、和约30-90mm碱金属或碱土金属盐;约600-20,000pfu/ml活减毒登革疫苗、约5-20mmph约7-8的磷酸钾、约75mg/ml蔗糖、约175mg/ml海藻糖、约5mg/ml平均分子量约90,000的cmc钠、和约30mmnacl;约600-20,000pfu/ml活减毒登革疫苗、约5-20mmph约7.0-8.0的磷酸钾、约75mg/ml蔗糖、约175mg/ml海藻糖、约25mg/ml明胶、和约30mmnacl;约600-20,000pfu/ml活减毒登革疫苗、约5-20mmph约7.0-8.0的磷酸钾、约250mg/ml蔗糖、和约50mg/mlpvpk12。在前述实施方式的一个方面中,制剂还包含约0.0001至5%w/v选自下述的表面活性剂:泊洛沙姆188和泊洛沙姆407。在前述实施方式的某些方面中,制剂还包含铝佐剂。上述制剂可以是冷冻的或冻干的、或是在溶液中重构的。在一个实施方式中,使用约0.5-1.0ml盐水溶液、水或注射用抑菌水(bwfi)和任选地包含铝佐剂的稀释剂进行重构。在另一个实施方式中,在冻干或微波真空干燥之前,制剂是水溶液。在一个实施方式中,活减毒登革疫苗包含四价活减毒登革病毒或活减毒嵌合黄病毒。在另一个实施方式中,lav或lacv包含病毒基因组,所述病毒基因组含有对应于3’非翻译(utr)区的tl-2茎环结构的约30个核苷酸的缺失;其降低病毒的复制能力。在进一步的实施方式中,活减毒登革病毒是lav,其包含病毒基因组,所述病毒基因组包含对应于3’非翻译(utr)区的tl-2茎环结构的约30个核苷酸的缺失,和针对登革血清型3具有免疫原性,其中所述lav的病毒基因组还包含对应于3’utr的tl-3结构的δ30缺失上游的核苷酸缺失。在本发明的优选实施方式中,活减毒登革病毒是活减毒四价疫苗,其包含den1δ30病毒、den2/4δ30病毒(在den4骨架上的den2δ30lacv)、den3δ30病毒和den4δ30病毒。在另一个优选的实施方式中,活减毒登革病毒是lav,其包含rden1δ30-1545、rden2/4δ30(me)-1495,7163、rden3δ30/31-7164和rden4δ30-7132,7163,8308。附图说明图1:cmc钠、pg、氨基酸对den4制剂的denv4冻干收率的影响。图2:cmc钠、pg、氨基酸对den4制剂的denv4稳定性的影响。由于在25℃下储存后滤饼塌陷,因而未对制剂26(*)进行检测。图3:糖醇对den4制剂的denv4冻干收率的影响。图4:糖醇对den4制剂的denv4稳定性的影响。图5:ph对den4制剂的denv4冻干收率的影响。图6:ph对den4制剂的denv4稳定性的影响。图7:缓冲剂对den4制剂的denv4冻干收率的影响。图8:缓冲剂对den4制剂的denv4稳定性的影响。图9:nacl浓度对den4制剂的denv4冻干收率的影响。图10:nacl浓度对den4制剂的denv4稳定性的影响。图11:丙二醇和甘油对登革血清型的冻干收率的影响。图12:丙二醇和甘油对登革血清型的稳定性的影响。图13:l-15浓度对冷冻、微波干燥(mvd)和冻干(lyo)den1制剂的相对效价的影响。图14:l-15浓度对冷冻、微波干燥(mvd)和冻干(lyo)den2制剂的相对效价的影响。图15:l-15浓度对冷冻、微波干燥(mvd)和冻干(lyo)den3制剂的相对效价的影响。图16:l-15浓度对冷冻、微波干燥(mvd)和冻干(lyo)den4制剂的相对效价的影响。图17:冷冻、微波干燥(mvd)和冻干(lyo)den1制剂的相对效价。图18a-b:a)在37℃下1周后四价制剂的稳定性。b)在25℃下1个月后四价制剂的稳定性。图19a-d:在2-8℃下每3个月检测一次进行长达18个月的四价制剂(den1-den4)的稳定性。具体实施方式如说明书通篇和所附权利要求中所使用,单数形式“一个/一种(a/an)”和“所述/该(the)”包括复数的指代,除非上下文另外明确指出。除非上下文明确指明所示可能性之一,提及“或”表明任一或两种可能性。在一些情况下,“和/或”用于突出任一或两种可能性。当修饰物质或组合物的量(例如,mm或m),制剂组分的百分比(v/v或w/v),溶液/制剂的ph,或者表征方法中步骤的参数的值等等时,术语“约”指例如通过物质或组合物的制备、表征和/或使用中涉及的典型测量,处理和取样程序;通过在这些程序中的仪器误差;通过制备或使用组合物或实施程序所使用的成分的生产、来源或纯度差异等等而可能发生的数量变化。在某些实施方式中,“约”可以表示±0.1%、0.5%、1%、2%、3%、4%、5%或10%的变化。术语“填充剂”包括提供冻干产品结构的试剂。用作填充剂常见实例包括甘露醇、甘氨酸和乳糖。除了提供药学上精致的饼(pharmaceuticallyelegantcake)以外,填充剂也可对于改善塌陷温度、提供冻-融保护和增强长期储存下的蛋白稳定性给予有用的质量。这些试剂也可以作为张力调节剂。“登革病毒参照样品”与登革病毒制剂检测样品具有相同登革病毒制剂组分,并且指在与登革病毒制剂检测样品相同条件下干燥登革病毒制剂后立即的固体组合物(即,冻干、微波干燥、冻干球干燥),或者在无登革病毒的感染性损失或使得该损失最小化的条件下储存的此前干燥的固体组合物(即,储存在-70℃或更低温度下);或在-70℃下冷冻的固体登革病毒制剂。“二醇”指具有两个羟基的化学化合物。“感染性损失”指使用本领域公知的方法将登革病毒检测样品与登革病毒参照样品的病毒复制损失进行比较。在一个实施方式中,使用登革相对感染性测定测量感染性损失。在另一个实施方式中,使用噬斑测定测量感染性损失。术语“冻干”、“冻干的”和“冷冻干燥”指一种方法,通过该方法将待干燥的材料冷冻,然后通过在真空环境中升华除去冰或冷冻的溶剂。可以在预冻干制剂中包含赋形剂以增强冻干产品在储存时的稳定性。如在本文中所使用的,“冻干球”指干燥冷冻单一体,其包含基本为球形或卵形的治疗活性剂。在一些实施方式中,冻干球的直径从约2至约12mm,优选地从2至8mm,如从2.5至6mm或2.5至5mm。在一些实施方式中,冻干球的体积从约20至550μl,优选地从20至100μl,如从20至50μl。在其中冻干球基本上不是球形的实施方式中,可以使用其长宽比描述冻干球的尺寸,其是长径与短径之比。冻干球的长宽比可以从0.5至2.5,优选地从0.75至2,如从1至1.5。如在本文中所使用的,“微波真空干燥”指利用微波辐射(也称为辐射能或非电离辐射)通过升华方式形成疫苗制剂的干燥疫苗产品(优选地,水分<6%)的干燥方法。在某些实施方式中,如在us2016/0228532中所述进行微波干燥。在一个实施方式中,微波辐射是行波形式。“重构溶液”是通过将固体形式(如冻干饼)的干燥病毒溶解在稀释剂中以使病毒分散在重构溶液中而制备的溶液。重构溶液适于施用(例如,肌内施用),并且可以任选地适于皮下施用。如在本文中所使用的,“盐”指与无机和/或有机酸形成的酸性盐,以及与无机和/或有机碱形成的碱性盐。尽管也可以使用其他盐,但是药学上可接受的(即,无毒性、生理上可接受的)盐是优选的。示例性碱性盐包括铵盐,碱金属盐(如钠、锂和钾盐),碱土金属盐(如钙和镁盐),锌盐,与有机碱(例如,有机胺)(如n-me-d-葡糖胺、胆碱、三甲胺、二环己胺、叔丁胺)形成的盐以及与氨基酸(如精氨酸、赖氨酸)形成的盐等。“糖醇”指来源于糖的多元醇,其具有通式hoch2(choh)nch2oh,n=1、2、3、4、5、6、7、8、9或10。实例包括但不限于甘露醇、山梨糖醇、赤藓糖醇、木糖醇和甘油。如在本文中所使用的,“x%(w/v)”等于xg/100ml(例如,5%w/v等于50mg/ml)。本文中也称为“lav”的术语“活减毒登革病毒”意指与野生型登革病毒相比登革病毒引起疾病的能力降低。本领域技术人员将理解,病毒在培养、传代或繁殖时可能发生突变。除了为克隆目的引入的突变以外,lav还可以包含这些天然存在的突变。lav可以是同源或异源群体,其不具有或具有一个或多个这些突变。术语“活减毒嵌合病毒”(或者“活减毒嵌合黄病毒”)或“lacv”是指活减毒嵌合病毒,其中病毒基因组包含第一黄病毒的骨架(包括c、ns1、ns2a、ns2b、ns3、ns4a、ns4b和ns5基因)和第二黄病毒的前膜(prm)和包膜(e)基因,其中第二黄病毒选自denv1、denv2、denv3或denv4。第一黄病毒可以是不同的登革血清型或另一黄病毒,诸如黄热病毒。术语“δ30lav”是指活减毒den1、den2、den3或den4病毒,其中lav包含病毒基因组,其含有对应于从约nt143至约nt172的3’非翻译(utr)区域的tl2茎-环结构的约30个核苷酸(nt)的缺失,这降低病毒的复制能力(参见wo03/092592和whitehead等人,美国专利号8,337,860)。术语“δ30lacv”是指来自denv1-4的活减毒嵌合黄病毒(lacv),其中lacv包含病毒基因组,其含有对应于从约nt143至约nt172的3’utr区域的tl2茎-环结构的约30nt的缺失,这降低病毒的复制能力(参见wo03/092592和whitehead等人,美国专利号8,337,860)。术语“δ30/δ31lav”是指活减毒den1、den2、den3或den4病毒,其中病毒基因组包含3’utr的tl2茎-环结构的约30nt的缺失,并且进一步包含3’utr的约nt258-228处约31nt的单独、不连续的上游缺失,其缺失直到且包括tl-3同源结构的序列,使得缺失延伸远至登革3’utr的tl-3同源结构的5’边界。参见whitehead等人,美国专利号8,337,860。在本发明的优选实施方式中,den3lav包含δ30/δ31突变。术语“δ30/δ31lacv”是指如上所述的活减毒嵌合den1、den2、den3或den4病毒,其中嵌合病毒的病毒基因组包含3’utr的tl2茎-环结构的30nt缺失,并且进一步包含使tl-3结构缺失的3’utr的单独、不连续的上游31nt缺失,如上所述。术语“latv”或“活减毒四价登革病毒”或“latv疫苗”是指包含有效量的den1lav或lacv、den2lav或lacv、den3lav或lacv,和den4lav或lacv的疫苗。在一个实施方式中,登革lav或lacv中的至少一种包含3’utr中的tl-2结构的δ30突变,如上文和wo03/092592中所述。在一些优选的实施方式中,latv包含以下特征:(1)rden1δ30,其为denv1lav,其中denv1病毒基因组包含对应于3’utr中的tl2茎-环结构的30nt缺失;(2)rden2/4δ30,其为在denv4骨架上包含denv2prm和e基因的denv2lacv,其中den4骨架包含对应于3’utr中的tl2茎-环结构的30-nt缺失;(3)rden3δ30/δ31,其为denv3lav,其中denv3病毒基因组包含对应于3’utr中的tl2茎-环结构的30nt缺失和对应于3’utr的tl-3结构的单独、不连续的上游31nt缺失;和(4)rden4δ30,其为denv4lav,其中denv4病毒基因组包含对应于3’utr中的tl2茎-环结构的30nt缺失(参见wo2016106107的图1)。“非复制型疫苗”是指用于预防或治疗登革病毒感染或其临床症状的登革病毒疫苗,其选自重组亚单位疫苗、灭活疫苗、缀合物疫苗或dna疫苗。“灭活疫苗”是指包含有效量的杀灭的或无活性的完整登革病毒和药学上可接受的载体的疫苗,其中所述病毒通过任何方式(包括用化学品、热或辐射)灭活。灭活疫苗在灭活之后具有低残余感染性,例如灭活之后的<5个噬斑形成单位(pfu)/ml。在优选的实施方式中,在灭活之后存在非常少量的残余感染性,例如≤4个pfu/ml、≤3个pfu/ml、或≤2个pfu/ml、<1个pfu/ml、≤0.5个pfu/ml、或≤0.1个pfu/ml。特定疫苗的pfu可以,例如,通过使用噬斑测定、免疫染色测定或本领域中已知用于检测病毒感染性的其他方法来测定。“缀合物疫苗”是指包含共价连接至载体蛋白的登革抗原的疫苗。“dna疫苗”是包含编码登革蛋白抗原(包括登革蛋白、登革蛋白片段和登革融合蛋白及其变体)的核苷酸序列的疫苗。dna疫苗包含质粒(例如,dna或病毒质粒),其含有可操作连接至启动子的编码感兴趣抗原的核苷酸序列。“亚单位疫苗”是指包括一种或多种登革抗原成分(但不是完整登革病毒),诸如登革免疫原性表位、登革蛋白、登革抗原融合蛋白(包括不同登革血清型抗原的融合体)或登革蛋白片段的疫苗。如本文所使用的亚单位疫苗可以是单价的(包含单一登革抗原)或多价的(包含多于一种抗原组分)。在优选的实施方式中,亚单位疫苗是四价的。术语“初免-强化”是指这样的治疗方案,其包括(1)向有此需要的患者施用第一登革病毒疫苗组合物,其中所述组合物包含(a)至少一种活减毒登革病毒(lav)或活减毒嵌合黄病毒(lacv),和(b)药学上可接受的载体;(2)等待经过预定量的时间;和(3)向患者施用第二登革病毒疫苗组合物或非复制型登革疫苗。第二登革病毒疫苗组合物可以与第一登革病毒疫苗组合物相同或不同。在一个实施方式中,第二登革病毒疫苗是活减毒登革疫苗或重组登革亚单位疫苗。本发明的组合物中使用的登革病毒疫苗可用于在人患者中诱导针对同源登革病毒的病毒中和抗体应答。术语“治疗”是指治疗性治疗和预防或防止措施。“需要”治疗的个体或患者包括已经具有登革感染的那些,无论是否表现任何临床症状,以及处于登革感染的风险中的那些。用本发明的登革疫苗组合物治疗患者包括以下的一种或多种:在患者中诱导/增加针对登革的免疫应答,诱导针对一种或多种登革病毒的病毒中和抗体应答,在已经被登革感染的患者中预防、改善、消除或降低登革病的临床表现的可能性,预防或降低发生登革热、dhf、或dss和/或与登革感染相关的其他疾病或并发症的可能性,降低登革感染和/或与登革相关的其他疾病或并发症的临床症状的严重性或持续时间,和预防或降低登革感染的可能性。术语“药学上有效量”或“有效量”意指将足够的疫苗组合物引入患者以产生期望效果,包括,但不限于:在患者中诱导/增加针对登革的免疫应答,在患者中诱导/增加针对登革的病毒中和抗体应答,预防或降低登革感染的可能性,预防或降低登革反复感染的可能性,在已经感染登革病的患者中预防、改善或消除登革感染的临床表现,预防登革热、dhf和/或dss,或降低与登革相关的疾病的严重性或持续时间。本领域技术人员认识到该水平可以变化。术语“免疫应答”是指细胞介导的(t-细胞)免疫应答和/或抗体(b细胞)应答。术语“患者”是指待接受本文所述的登革疫苗组合物的能够被登革病毒(如den1、den2、den3或den4)感染的哺乳动物,包括具有免疫活性的和免疫低下的个体。在优选实施方式中,患者是人。如本文所定义,“患者”包括已经感染登革病的那些,无论是通过自然感染或接种,或者可能随后暴露的那些。“iscom样佐剂”是包含免疫刺激复合物(iscom)(其由皂苷、胆固醇和磷脂构成,其一起形成特征性的笼状颗粒)的佐剂,其具有促成其功能的独特球形、笼状结构(对于综述,参见barr和mitchell,immunologyandcellbiology74:8-25(1996))。该术语既包括iscomtm佐剂(其用抗原产生并且在iscomtm颗粒内包含抗原),还包括iscomtm基质佐剂(其是在没有抗原的情况下产生的中空的iscom型佐剂)。在本文提供的组合物和方法的优选实施方式中,iscom型佐剂是iscomtm基质颗粒佐剂,如iscomatrixtm,其在没有抗原的情况下制造(iscomtm和iscomatrixtm是csllimited,parkville,australia的注册商标)。名称“rden1δ30-1545”是指重组登革1病毒,其中病毒基因组包含(1)3’utr的tl2茎-环结构的30nt缺失和(2)在核苷酸位置1545变为g的取代,其在病毒适应于在vero细胞中生长之后发生。名称“rden2/4δ30(me)-1495,7163”是指重组嵌合登革2/4病毒,其中病毒基因组包含:(1)登革4骨架(c、ns1、ns2a、ns2b、ns3、ns4a、ns4b、ns5基因),其包含(i)3’utr的tl2茎-环结构的30nt缺失和(ii)在核苷酸位置1495变为u和7163变为c的取代,其在病毒适应于在vero细胞中生长之后发生,和(2)登革2prm和e基因。名称“rden3δ30/31-7164”是指重组登革3病毒,其中病毒基因组包含:(1)3’utr的tl2茎-环结构的30nt缺失,(2)δ30突变上游的3’utr中的单独的31nt缺失,其缺失tl-3结构,和(3)在核苷酸位置7164变为c的取代,其在病毒适应于在vero细胞中生长之后发生。名称“rden4δ30-7132,7163,8308”是指重组登革4病毒,其中病毒基因组包含:(1)3’utr的tl2茎-环结构的30nt缺失和(2)在核苷酸位置7132变为u、7163变为c和8308变为g的取代,其在病毒适应于在vero细胞中生长之后发生。“v180”是指由来自4种登革病毒血清型(denv1、denv2、denv3和denv4)的每一种的截短的包膜糖蛋白(den-80e)构成的四价亚单位疫苗,其中所述e蛋白各自构成从野生型e的n-末端的氨基酸残基1开始的野生型e的长度的约80%,使得所述e蛋白当在宿主细胞中重组表达时可分泌至生长培养基中。参见coller等人,wo2012/154202。以下缩写在本文中使用,且具有以下含义:c是登革衣壳基因,den(或denv)是登革病毒,df是登革热,dhf是登革出血热,dss是登革休克综合征,h是小时,gmt是几何平均滴度,im是肌内,imx是iscomatrixtm,je是日本脑炎,lav是活减毒病毒,ns(用于ns1-ns5中)是非结构的,nt是核苷酸,pfu是噬斑形成单位,prm是登革前膜基因,sc是皮下,tbe是蜱传脑炎,utr是非翻译区域,wn(或wnv)是西尼罗病毒,yf(或yfv)是黄热病毒,和wt是野生型。活减毒登革病毒疫苗如上所示,本发明的登革病毒疫苗组合物包含活减毒登革疫苗,其包含选自登革病毒1型(den1)、登革病毒2型(den2)、登革病毒3型(den3)和登革病毒4型(den4)的至少一种lav,或lacv。在一个实施方式中,lav或lacv包含含有3’utr中的tl-2δ30修饰的病毒基因组,且其中lav或lacv:诱导针对登革的免疫应答,诱导针对登革的病毒中和抗体应答,保护免于感染或降低感染的可能性或降低其临床表现的严重度或持续时间。在本发明的实施方式中,活减毒登革疫苗是单价、二价、三价或四价的,即分别诱导针对den血清型1-4中的一种、两种、三种或四种或保护免于den血清型1-4中的一种、两种、三种或四种的免疫应答。在本发明的优选实施方式中,活减毒登革疫苗是四价的,即诱导针对den血清型1-4或保护免于den血清型1-4的免疫应答,并且包含den1、den2、den3和den4组分,其中每种组分是lav或lacv。在本发明的其他实施方式中,活减毒登革疫苗是四价lav或“latv”(即,包含如本文定义的,来自denv1-4的活减毒登革病毒,或来自denv1-4的活减毒嵌合黄病毒,或其组合,其中lav或lacv的至少一种是δ30lav或δ30lacv)。在本发明的其他实施方式中,活减毒登革疫苗是四价的,且包含至少一种嵌合黄病毒;其中所述嵌合黄病毒包含病毒基因组,所述病毒基因组包含编码单一登革病毒血清型的prm和e蛋白的核苷酸序列和编码不同黄病毒衣壳和非结构蛋白的核苷酸序列,其中所述嵌合黄病毒是减毒的。在本发明的一些实施方式中,嵌合黄病毒的衣壳和非结构蛋白来自于prm和e蛋白不同的登革血清型。在本发明的一些实施方式中,本发明的latv的每一种lav或lacv组分包含活减毒病毒,其独立地是减毒嵌合黄病毒或减毒登革病毒,其包含在病毒基因组的3’utr中的tl-2δ30修饰。登革病毒的减毒通过tl-2δ30修饰实现。然而,在疫苗的一种或多种组分中也可以包括额外的减毒突变,包括但不限于:在位置1495、1545、7132、7163、7164和8308的突变。减毒突变可以通过不同的技术来实现,包括本领域中已知的方法,诸如通过组织培养物上的连续传代或通过更多定义的遗传操作。可用于减毒登革病毒和嵌合登革病毒的突变是本领域中已知的。参见例如,wo02/095075、wo2006/44857、美国专利号7,189,403、美国专利号8,337,860、wo2003/103571、wo2000/014245和wo2008/022196。已知的减毒登革毒株也可以用于本文组合物中,诸如wo06/134433、wo2006/134443、wo2007/141259、wo96/40933、wo2000/057907、wo2000/057908、wo2000/057909、wo2000/057910和wo2007/015783中描述的毒株。本发明的组合物的优选实施方式包含四价活减毒登革疫苗(latv)。此四价活减毒疫苗可以包含四种减毒登革病毒(lav)、三种lav和一种减毒嵌合黄病毒毒株(lacv)、两种登革lav和两种lacv、一种登革lav和三种lacv,或四种lacv。在优选的实施方式中,latv包括以下特征:(1)rden1δ30,其为denv1lav,其中denv1病毒基因组包含对应于3’utr中的tl2茎-环结构的30nt缺失;(2)rden2/4δ30,其为在denv4骨架上包含denv2prm和e基因的denv2lacv,其中den4骨架包含对应于3’utr中的tl2茎-环结构的30-nt缺失;(3)rden3δ30/δ31,其为denv3lav,其中denv3病毒基因组包含对应于3’utr中的tl2茎-环结构的30nt缺失和对应于3’utr的tl-3结构的单独、不连续的上游31nt缺失;和(4)rden4δ30,其为denv4lav,其中denv4病毒基因组包含对应于3’utr中的tl2茎-环结构的30nt缺失。在本发明包含嵌合黄病毒的实施方式中,各嵌合黄病毒包含病毒基因组,其包含编码单一登革病毒血清型的prm和e蛋白的核苷酸序列和编码不同黄病毒衣壳和非结构蛋白(即“骨架”)的核苷酸序列,其中各嵌合黄病毒是减毒的。用于构建重组活减毒黄病毒毒株的方法可以包括使用已知减毒毒株作为基础,其中所述方法包括用来自相关感兴趣病毒的适当基因(prm和e)取代基础病毒的等同基因。例如,该方法已用于wnv,其中所述嵌合病毒是类型间嵌合的,基于减毒den-4毒株包含wnv的prm和e基因(bray,m.等人,j.virol.(1996)70:4162-4166;chen,w.等人,j.virol.(1995)69:5186-5190;;bray,m.和lai,c.-j.,proc.natl.acad.sci.usa(1991)88:10342-10346;lai,c.j.等人,clin.diagn.virol.(1998)10:173-179)。另一种方法是使用yf17d减毒黄热病毒株作为基础来开发重组嵌合疫苗,其先前用于je病毒、den病毒和wn病毒。可以通过将编码来自任何黄热病毒株(例如,yfv17d)的prm和e蛋白的基因替换为登革血清型的那些而构建包含黄热病骨架的嵌合黄热病疫苗。dna克隆之后,转录rna且转染入vero细胞,以获得具有yfv17d复制机器和相关登革病毒的外壳(externalcoat)的嵌合病毒。参见,guirakhoo等人,journalofvirology,74(12):5477–5485(2000);guy等人,vaccine28:632–649(2010);monatht.p.advvirusres(2003)61:469-509;monath等,proc.natl.acad.sci.usa(2006)103:6694;和wo98/37911。因此,在本发明的一些实施方式中,活减毒登革疫苗包含(1)包含单一登革血清型的prm和e蛋白和黄热病骨架的至少一种嵌合黄病毒和(2)至少一种包含病毒基因组的lav或lacv,所述病毒基因组包含3’utr的tl-2茎-环结构的30-核苷酸缺失。可用于本发明的组合物中的嵌合活减毒黄病毒也可以包含登革嵌合病毒,其中病毒基因组包含单一登革病毒血清型的prm和e基因和不同的登革病毒血清型的衣壳和非结构基因。在其中嵌合病毒包含来自第二登革血清型的骨架的实施方式中,登革骨架包含对应于tl-2茎-环结构的3’utr的约30个核苷酸的缺失,并且可以任选地包含另外的减毒突变。通过将tl-2茎-环结构的30-核苷酸缺失引入减毒登革骨架或野生型登革病毒骨架,任何减毒登革病毒或野生型登革病毒都可以用作嵌合病毒的骨架。可以通过连续传代、通过引入定义的基因突变或通过使用已知的减毒登革毒株来实现登革病毒骨架的减毒。登革嵌合疫苗描述于,例如,whitehead等人,wo03/092592中。在本发明的一些实施方式中,活减毒疫苗包含嵌合黄病毒,其中衣壳和非结构蛋白来自与prm和e蛋白不同的登革血清型。本发明的登革病毒疫苗组合物包含有效量的活减毒病毒疫苗。在本发明的一些实施方式中,活减毒登革疫苗的效价是从10至约1x107个噬斑形成单位(pfu)。在替代实施方式中,活减毒登革疫苗的效价是从约1x102至约1x106个pfu。在其他实施方式中,活减毒登革疫苗的效价是从约1x103至约1x105个pfu。病毒噬斑测定确定病毒样品中的噬斑形成单位(pfu)数量。简言之,在登革免疫噬斑测定中,使用不同稀释度的登革病毒感染宿主细胞(例如,vero细胞)的融合单层,并用含有甲基纤维素的半固体覆盖培养基覆盖,以防止病毒感染肆意播散。被病毒感染的细胞将裂解并将感染传播到邻近细胞,在其中重复进行感染至裂解循环。被感染的细胞将形成噬斑(被未感染细胞包围的一组被感染的vero细胞),在固定并使用登革血清型特异性单克隆抗体(mab)免疫染色后其可以目测可见。对噬斑计数,并将结果与稀释因子结合起来,用于计算样品中每ml的噬斑形成单位数(pfu/ml)。登革效价结果(以pfu/ml计)表示样品中的感染性颗粒数量,并基于以下假设:所形成的每个噬斑代表一个感染性病毒颗粒。登革亚单位疫苗在本发明的一些实施方式中,制剂还包含重组登革亚单位疫苗,其包含一种或多种登革抗原蛋白。在本发明这一方面的优选实施方式中,重组登革亚单位疫苗包含一种或多种登革蛋白、融合蛋白或其一种或多种片段。在进一步优选的实施方式中,重组登革亚单位疫苗包含登革包膜或e蛋白或其片段。在进一步优选的实施方式中,重组登革亚单位疫苗是四价的,即靶向针对所有四种登革血清型的免疫应答。重组登革亚单位疫苗可以包含四种重组登革蛋白或少于四种重组登革蛋白,例如重组den1蛋白、重组den2蛋白和重组den3/4融合蛋白。在一些实施方式中,重组登革亚单位疫苗包含den1-4的登革病毒包膜糖蛋白或其片段(例如,den1-80e、den2-80e、den3-80e、den4-80e或den4-80ezip),其使用重组表达系统产生和分泌。所述亚单位疫苗可以任选地包含佐剂,如下面更充分地描述。在本发明这一方面的一些实施方式中,重组登革亚单位疫苗包含一种或多种纯化的登革病毒包膜(“e”)蛋白、药学上可接受的赋形剂,其中所述e蛋白各自构成从野生型e的n-末端的氨基酸残基1开始的野生型e的长度的约80%,使得所述e蛋白当在宿主细胞中重组表达时可被分泌到生长培养基中,且其中所述组合物在人受试者中诱导中和抗体的产生。在本发明的一些实施方式中,重组登革亚单位疫苗进一步包含有效量的佐剂。在本发明的一些实施方式中,den-4e蛋白是二聚体(“den4-80ezip”),如在us6,749,857和wo2012/154202中所描述的。在本发明这一方面的一些实施方式中,上述组合物中的e蛋白在昆虫宿主细胞中重组产生和表达。在进一步优选的实施方式中,e蛋白在黑腹果蝇(drosophilamelanogaster)schneider2(s2)宿主细胞中重组产生和表达。本发明的重组登革病毒e蛋白可以借助使用果蝇schneider2(s2)细胞的细胞培养表达系统产生。该系统已经表明产生维持天然样结构的重组登革包膜蛋白(cuzzubbo等人,clin.diagn.lab.immunol.(2001)8:1150-55;modis等人,proc.natl.acad.sci.(2003)100:6986-91;modis等,nature(2004)427:313-9;zhangetal.,structure(2004)12(9):1607-18)。也已经显示该表达系统表达来自其他黄病毒诸如西尼罗病毒、日本脑炎病毒、丙型肝炎病毒和蜱传脑炎病毒的其他重组包膜蛋白。重组登革包膜蛋白可以在c-末端截短,剩下80%的天然包膜蛋白(“80e”)。因此,80e被定义为从e蛋白的n-末端的氨基酸1开始的e蛋白的连续氨基酸的约前80%。如上所示,本发明这一方面的一些实施方式包括截短的80e蛋白,其由从野生型e的n-末端的氨基酸残基1开始的野生型e的长度的约80%组成。本发明的一些实施方式中使用的e蛋白缺失该蛋白的膜锚定部分(e的羧基末端的约最后10%)。换言之,本发明的具体实施方式中使用的截短80e蛋白由从e的n-末端的氨基酸1开始的e的连续氨基酸的至多前90%组成,因此允许其被分泌至细胞外培养基,以便于回收。截短可以进一步缺失连接80e部分与膜锚定部分的e蛋白的“茎”部分;茎部分不含显著的抗原表位且因此不包括在优选的抗原den1-80e、den2-80e、den3-80e、den4-80e或den4-80ezip中。可克隆和分泌超过90%,但少于100%的e蛋白,即该蛋白可为90%+的长度,羧基端截短的,并且可以包括跨膜结构域的部分,只要截短的e蛋白可分泌。“可分泌”意指能够被分泌,且通常从表达系统中的转化细胞分泌。因此,本领域技术人员将意识到,可用于本发明的组合物和方法中的登革e蛋白可以与本文例举的80%不同,只要该蛋白是可分泌的。在本发明各方面的优选实施方式中,dene蛋白为约80%的长度,从包膜蛋白的n-末端氨基酸开始且在第393至第401氨基酸的范围内的氨基酸结束,例如,为从登革病毒2型的氨基酸1至氨基酸395。在本发明各方面的替代实施方式中,登革e蛋白可以是从e的n-末端的氨基酸1开始的e的连续氨基酸的约75%、约85%、约90%、约95%、或约98%。在本发明各方面的示例性实施方式中,dene蛋白是从e蛋白的n-末端的氨基酸1开始的e蛋白的连续氨基酸的约80%;诸如如seqidno:1中所示的den1-80e,如seqidno:2中所示的den2-80e,如seqidno:3中所示的den3-80e和如seqidno:4中所示的den4-80e。分泌的e蛋白可以进一步含有促进二聚化的结构域,诸如在den4-80ezip蛋白中,使得进一步增强重组蛋白的免疫原性。示例性den4-80ezip蛋白包含如seqidno:5中所示的氨基酸序列。在本发明这一方面的一些实施方式中,组合物中包括的den1、den2和den380e抗原是单体的,且den480e抗原是二聚的。在本发明这一方面的替代实施方式中,组合物中的den1-80e、den2-80e、den3-80e和den4-80e蛋白是单体。在这样的实施方式中,den4成分存在的量是den1、den2、和den3蛋白的个别量的约1.5至约3倍,优选den1、den2、和den3成分(蛋白)的量的约2倍。在本发明这一方面的优选实施方式中,组合物中的den1:den2:den3:den4抗原的比率是约1:1:1:2。在本发明包含登革e蛋白的实施方式中,组合物中各e蛋白的量是从约0.5μg至约500μg。在替代实施方式中,各e蛋白的量是从约0.5μg至约450μg、0.5μg至约400μg、0.5μg至约350μg、0.5μg至约300μg、0.5μg至约250μg、0.5μg至约200μg、0.5μg至约150μg、0.5μg至约100μg、0.5μg至约50μg、5.0μg至约500μg、5.0μg至约450μg、5.0μg至约400μg、5.0μg至约350μg、5.0μg至约300μg、5.0μg至约250μg、5.0μg至约200μg、5.0μg至约150μg、5.0μg至约100μg、5.0μg至约50μg、10μg至约500μg、10μg至约450μg、10μg至约400μg、10μg至约350μg、10μg至约300μg、10μg至约250μg、10μg至约200μg、10μg至约150μg、10μg至约100μg、10μg至约50μg、25μg至约500μg、25μg至约450μg、25μg至约400μg、25μg至约350μg、25μg至约300μg、25μg至约250μg、25μg至约200μg、25μg至约150μg、25μg至约100μg或25μg至约50μg。在进一步优选的实施方式中,组合物中各e蛋白的量是从约1.0μg至约100μg。在又进一步的实施方式中,组合物中各e蛋白的量选自约10、20、30、40、50、60、70、80、90、100、150、200、250、300、350、400、450或500μg。灭活登革疫苗本文的灭活登革疫苗包含一种或多种完整灭活的登革病毒和/或一种或多种灭活登革嵌合病毒。在本发明这一方面的一些实施方式中,灭活登革疫苗是四价的,且包含完整灭活的den1、den2、den3和den4。在替代实施方式中,灭活疫苗包含四种灭活嵌合登革病毒。在又其他实施方式中,灭活疫苗是四价的,并且包含一种或多种完整灭活的登革病毒和一种或多种灭活的登革嵌合病毒,例如灭活的完整den1病毒、灭活的完整den2病毒、灭活的den3嵌合病毒和灭活的den4嵌合病毒。本领域技术人员意识到,灭活的完整或嵌合的den病毒的任何组合可以用于本发明的四价组合物和方法中,只要所述疫苗组合物靶向所有四种登革血清型即可。可用于本发明的组合物和方法中的灭活登革疫苗描述于putnak等人,vaccine23:4442–4452(2005),us6190859,us6254873和sterner等人wo2007/002470中。或者,可以通过本领域中已知的方法,例如,用化学品、热或辐射来灭活登革病毒毒株和嵌合登革毒株/嵌合黄病毒毒株,以用于本发明的组合物。因此,本发明还涉及包含有效量的活减毒登革疫苗和非复制型登革疫苗的上述制剂,其中所述活减毒登革疫苗包含至少一种或减毒登革病毒(lav)或至少一种活减毒嵌合黄病毒(lacv),其中lav或lacv包含病毒基因组,所述病毒基因组包含在3’utr中tl-2茎环结构的30个核苷酸缺失。在本发明的一些实施方式中,本发明登革病毒疫苗组合物的非复制型登革疫苗选自重组登革亚单位疫苗或灭活登革疫苗。在一个实施方式中,制剂被冻干、冷冻、微波干燥或具有冻干球,具有有效量的活减毒登革疫苗和非复制型登革疫苗。在另一个实施方式中,使用液体溶液重构活减毒登革疫苗制剂,所述液体溶液包含非复制型登革疫苗,例如v180。在本发明的优选实施方式中,活减毒和非复制型登革疫苗是四价的(即,包含den1、den2、den3和den4组分或诱导针对den1、den2、den3和den4的免疫应答)。佐剂已经广泛地研究了疫苗与可增强针对感兴趣抗原的免疫应答的化合物(称为佐剂)的共同施用。除了增强针对感兴趣抗原的免疫应答以外,一些佐剂可以用于降低引发期望的免疫应答所必需的抗原的量,或降低临床方案中诱导持久的免疫应答且提供免于疾病的保护所需要的注射次数。为此,本发明的登革病毒疫苗制剂可以采用佐剂。本文描述的制剂的佐剂可以是如上所述行使期望功能且不灭活或显著影响组合物的lav或lacv的滴度的任何佐剂。超过60年前,确定基于铝的化合物具有佐剂活性(综述参见lindblad,e.b.immunol.andcellbiol.82:497-505(2004);baylor等,vaccine20:s18-s23(2002))。当以适当剂量使用时,通常认为铝佐剂是安全的。在全世界内,监管机构已经批准了许多铝佐剂用于施用于人。因此,基于铝的化合物诸如氢氧化铝(al(oh)3)、羟基磷酸铝(alpo4)、无定形羟基磷酸铝硫酸盐(aahs)或所谓的“明矾”(kal(so4)·12h2o)(参见klein等,analysisofaluminumhydroxyphosphatevaccineadjuvantsbyalmasnmr.,j.pharm.sci.89(3):311-21(2000)),可以与本文提供的组合物组合。在本文提供的本发明的示例性实施方式中,铝佐剂是羟基磷酸铝或aahs。在替代实施方式中,铝佐剂是磷酸铝佐剂,本文中称为“apa”。在其他实施方式中,佐剂是氢氧化铝。本领域技术人员将能够确定铝佐剂的最佳剂量,所述最佳剂量既安全又有效增加针对靶登革病毒的免疫应答。对于铝的安全性概况以及fda批准的疫苗中包括的铝的量的讨论,参见baylor等人,vaccine20:s18-s23(2002)。通常,铝佐剂的有效且安全的剂量在50μg至1.25mg元素铝/剂量(100μg/ml至2.5mg/ml浓度)范围变化。因此,本发明的具体实施方式包括包含活减毒登革病毒疫苗的组合物,并进一步包含铝佐剂。在本发明的实施方式中,登革组合物包含含有约50μg至约1.25mg元素铝/剂量疫苗的佐剂。在其他实施方式中,铝佐剂/剂量疫苗组合物包含范围为以下量的元素铝:从约100μg至约1.0mg、从约100μg至约900μg、从约100μg至约850μg、从约100μg至约800μg、从约100μg至约700μg、从约100μg至约600μg、从约100μg至约500μg、从约100μg至约400μg、从约100μg至约300μg、从约100至约250μg、从约200μg至约1.25mg、从约200μg至约1.0mg、从约200μg至约900μg、从约200μg至约850μg、从约200μg至约800μg、从约200μg至约700μg、从约200μg至约600μg、从约200μg至约500μg、从约200μg至约400μg、从约200μg至约300μg、从约300μg至约1.25mg、从约300μg至约1.0mg、从约300μg至约900μg、从约300μg至约850μg、从约300μg至约800μg、从约300μg至约700μg、从约300μg至约600μg、从约300μg至约500μg、从约300μg至约400μg、从约400μg至约1.25mg、从约400μg至约1.0mg、从约400μg至约900μg、从约400μg至约850μg、从约400μg至约800μg、从约400μg至约700μg、从约400μg至约600μg、从约400μg至约500μg、从约500μg至约1.25mg、从约500μg至约1.0mg、从约500μg至约900μg、从约500μg至约850μg、从约500μg至约800μg、从约500μg至约700μg、从约500μg至约600μg、从约600μg至约1.25mg、从约600μg至约1.0mg、从约600μg至约900μg、从约600μg至约850μg、从约600μg至约800μg或从约600μg至约700μg。可以与本发明的登革病毒疫苗组合物结合使用的其他佐剂包括但不限于含有cpg寡核苷酸,或作用于toll样受体诸如tlr4和tlr9的其他分子的佐剂(关于综述,参见daubenberger,c.a.,curr.opin.mol.ther.9(1):45-52(2007);duthie等人,immunologicalreviews239(1):178-196(2011);hedayat等人,medicinalresearchreviews32(2):294-325(2012)),所述分子包括脂多糖、单磷酰脂质a和氨基烷基氨基葡糖苷4-磷酸酯。可用于本发明的组合物中的另外的佐剂包括免疫刺激性寡核苷酸(imo;参见例如,u.s.7,713,535和u.s.7,470,674);t-辅助表位、脂质a及其衍生物或变体、脂质体、磷酸钙、细胞因子(例如,粒细胞巨噬细胞集落刺激因子(gm-csf)il-2、ifn-α、flt-3l)、cd40、cd28、cd70、il-12、热休克蛋白(hsp)90、cd134(ox40)、cd137、covaccineht、非离子型嵌段共聚物、不完全弗氏佐剂、趋化因子、霍乱毒素;大肠杆菌不耐热肠毒素;百日咳毒素;胞壁酰二肽、胞壁酰二肽类似物、mf59,saf、免疫刺激复合物、生物可降解的微球、聚磷腈;合成多核苷酸。用于与本文所述的组合物一起使用的另外的佐剂是以iscom(“immunestimulatingcomplex”,关于综述,参见barr和mitchell,immunologyandcellbiology74:8-25(1996);以及skene和sutton,methods40:53-59(2006))的特征形式,含有单独或与胆固醇和磷脂组合的皂苷(例如,qs21)的佐剂。此类佐剂在本文中称为“基于皂苷的佐剂”。在本文组合物的具体实施方式中,突变毒素和/或毒素蛋白与iscom型佐剂或“iscom”组合,所述“iscom”是iscom基质颗粒佐剂,诸如在没有抗原的情况下制造的iscomatrixtm(iscomtm和iscomatrixtm是csllimited,parkville,australia的注册商标)。制剂本发明的制剂或组合物包含活减毒登革疫苗,所述疫苗包含至少一种活减毒登革病毒(lav)或至少一种活减毒嵌合黄病毒(lacv)、ph约6.5至8.5的缓冲剂、糖、二醇或糖醇、和选自下述的纤维素衍生物:羧甲基纤维素、羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc)、2-羟乙基纤维素(2-hec)、交联羧甲基纤维素和甲基纤维素或其药学上可接受的盐;任选地碱金属或碱土金属盐、和任选地选自下述的氨基酸:ala、asp、his、leu、lys、gln、pro或glu、或其组合。在本发明的另一个方面中,制剂包含活减毒登革疫苗,所述疫苗包含约20-200,000,00pfu/ml的至少一种活减毒登革病毒(lav)或至少一种活减毒嵌合黄病毒、ph约6.5至8.5的缓冲剂、约150-300mg/ml糖、选自下述的载体:聚乙烯吡咯烷酮(pvp)、羧甲基纤维素、羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc)、2-羟乙基纤维素(2-hec)、交联羧甲基纤维素、甲基纤维素、或其药学上可接受的盐、人血清白蛋白(hsa)和明胶;任选地约5-100mm碱金属盐或碱土金属盐;和任选地氨基酸gln、pro或glu、或其组合。在一个实施方式中,活减毒登革疫苗在制剂中的浓度是100-10,000,000pfu/ml、100-100,000pfu/ml或600-20,000pfu/ml。在另一个实施方式中,活减毒登革疫苗在制剂中的浓度是200-200,000pfu/ml、600-200,000pfu/ml或600-100,000pfu/ml。在优选的实施方式中,纤维素衍生物是阴离子和形成盐,例如在活减毒登革疫苗制剂中含约0.3-10mg/ml、1-10mg/ml、3-7mg/ml或5mg/ml的羧甲基纤维素钠或钾。可用的羧甲基纤维素的盐是平均分子量约700,000的高粘度形式;平均分子量约250,000的中粘度形式;和平均分子量约90,000的低粘度形式。在一个实施方式中,纤维素衍生物是在活减毒登革疫苗制剂中约为0.3-1.5mg/ml的平均分子量约700,000的羧甲基纤维素的盐。在另一个实施方式中,纤维素衍生物是约1-4mg/ml的平均分子量约250,000的羧甲基纤维素的盐。在进一步的实施方式中,纤维素衍生物是约3-7或3-10mg/ml平均分子量约90,000的羧甲基纤维素的盐。在更进一步的实施方式中,纤维素衍生物是约0.3-10mg/ml平均分子量约50,000至1,000,000的羧甲基纤维素的盐。在一个实施方式中,缓冲剂选自下述:磷酸盐、琥珀酸盐、组氨酸、tris、mes、mops、hepes、乙酸盐和柠檬酸盐,约为5-300mm、5-20mm、10-12mm或11mm。碱金属或碱土金属盐可以提供稳定作用,并且可以选自下述:约为10-150mm、10-100mm、15-75mm、30-90mm、75mm、50mm或30mm的氯化镁、氯化钙、氯化钾、氯化钠或其组合。氨基酸可以选自下述:为10-100、10-75、10-50、20-30或25mmval、ile、ala、asp、his、leu、lys、gln、pro或glu、或其组合。在另一个实施方式中,氨基酸可以选自下述:10-100、10-75、10-50、20-30或25mm的ala、asp、his、leu、lys、gln、pro或glu、或其组合。在一个实施方式中,氨基酸是lys、leu或glu。在另一个实施方式中,氨基酸是leu和glu。在另一个实施方式中,氨基酸是leu、lys、glu或ala。在另一个实施方式中,氨基酸是leu。糖和二醇或糖醇可以作为冷冻保护剂或稳定赋形剂。在一个实施方式中,糖的浓度为50-300mg/ml。在另一个实施方式中,糖是约60-120mg/ml、90-110mg/ml或80-100mg/ml的海藻糖或蔗糖或其组合。在一个实施方式中,蔗糖与海藻糖的比率为在1:1至1:4之间。在另一个实施方式中,蔗糖是90mg/ml和海藻糖是90-200mg/ml,和优选地110mg/ml。在另一个实施方式中,二醇是丙二醇,和糖醇是甘油或山梨糖醇,约为2.5-7.5mg/ml、3-7mg/ml或5mg/ml。可以通过本领域技术人员公知的一种或多种方法,如胃肠外、跨粘膜、透皮、肌内、静脉内、皮内、鼻内、皮下、腹膜内向受试者施用本发明的组合物,并据此制剂。在一个实施方式中,本发明的组合物通过液体制剂的表皮注射、肌内注射、静脉内、动脉内、皮下注射或呼吸内粘膜注射施用。用于注射的液体制剂包含溶液等。本发明的组合物可以配制成单剂量小瓶,多剂量小瓶或预填充注射器。在另一个实施方式中,本发明的组合物可以口服施用,因此可以制成适合口服施用的形式,即制成固体或液体制剂。固体口服制剂包括片剂、胶囊剂、丸剂、颗粒剂、小药丸等。液体口服制剂包括溶液、混悬剂、分散剂、乳剂、油剂等。在本发明的一个方面中,制剂是通过冻干、冷冻、微波干燥或通过制备冻干球制备的固体干燥制剂。在一个实施方式中,通过实施例7中所述的微波干燥过程可以获得或生产固体干燥制剂。制剂可以储存在-70℃、-20℃、2-8℃下或在室温下(25或37℃)。可以根据单位剂量小瓶中组分的重量表示干燥的制剂,但是对于不同剂量或小瓶大小这会有所不同。或者,本发明的干燥制剂可以以组分的量表示为组分的重量与相同样品(例如,小瓶)中原料药(ds)的重量之比。该比率可以以百分比表示。这种比率反映了本发明干燥制剂的固有性质,其与小瓶大小、剂量和重构方案无关。在其他实施方式中,制剂是冻干球。在本发明的另一个方面中,制剂是重构溶液。干燥的固体制剂可以以不同浓度重构,其取决于临床因素,如施用途径或剂量。例如,如果需要皮下施用,则可以以高浓度(即,在较小体积中)重构干燥的制剂。如果对于特定受试者需要高剂量,特别是如果在必需使注射量最小化的皮下施用的情况下,则也可能需要高浓度。然后,可以用水或等渗缓冲液进行随后的稀释,以容易地将药品稀释至较低浓度。如果在较低药品浓度下需要等渗性,则可以将干燥的粉末在标准的少量水中重构,然后用等渗性稀释剂(如0.9%的氯化钠)进一步稀释。重构通常在约25℃下进行以确保完全水化,但是也可以根据需要使用其他温度。重构所需的时间将取决于例如稀释剂类型、一种或多种赋形剂的量和病毒或蛋白。示例性稀释剂包括无菌水、注射用抑菌水(bwfi)、ph缓冲溶液(例如,磷酸盐缓冲盐水)、无菌盐水溶液、林格氏溶液或右旋糖溶液。重构体积可以是约0.5-1.0ml,优选0.5ml或0.7ml。在一个实施方式中,单剂量的体积为0.5ml。在另一个方面中,本发明提供了一种制备液体制剂的方法,其包括使用如上文所述的稀释剂重构本发明制剂的步骤。在本发明的另一个实施方式中,在冻干、冷冻、微波干燥或产生冻干球之前,制剂是水溶液。制备冻干球的过程在美国专利申请公开号us20140294872中公开了用于制备冻干球的过程,其公开的全部内容通过引用并入本文。该方法包括将至少一个具有大体上球形的液滴分配到固体平坦的表面上(即,没有任何样品孔或腔),将液滴冻结在表面上而不使液滴与低温物质接触,并且冻干冷冻的液滴以产生基本上为球形的干燥小球。美国专利号9,119,794也公开了用于形成冻干球的过程,其公开的全部内容通过引用并入本文。在包含腔的固体元件上形成包含水性介质混合物的单一体积。将固体元件冷却至混合物的冷冻温度以下,将混合物填充到空腔中,并且将混合物固化,同时使其存在于空腔中以形成单一形式。真空干燥单一形式以提供冻干球。在其他实施方式中,形成的冻干球是基本上球形的,通过在平坦的固体表面(特别是不具有任何腔的表面)上冷冻期望的生物材料液体组合物的液滴,随后冻干单一形式制备冻干球。美国专利申请公开号us2014/0294872中公开了用于形成冻干球的类似过程,其公开的内容通过引用并入本文。简言之,在一些实施方式中,该过程包括将至少一个具有大体上球形的液滴分配到固体平坦的表面上(即,没有任何样品孔或腔),将液滴冻结在表面上而不使液滴与低温物质接触,并且冻干冷冻的液滴以产生基本上为球形的干燥小球。该过程可以以高通量模式使用,以通过将期望数量的液滴同时分配到平坦的固体表面上,冷冻液滴并冻干冷冻液滴来制备多个干燥的小球。通过该过程由液体制剂制备的小球可以具有高浓度的生物材料(如蛋白质治疗剂),并且可以组合成一组干燥的小球。在一些实施方式中,固体平坦表面是金属板的顶表面,该金属板包括与散热器物理接触的底表面,该散热器适于将金属板的顶表面保持在-90℃或更低的温度。由于金属板的顶表面温度远低于液体制剂的凝固点,因此液滴基本上瞬间冷冻,并且液滴的底表面接触金属板的顶表面。在其他实施方式中,固体平坦表面是疏水性的,并且包括在分配步骤中保持在0℃以上的顶表面薄膜。通过将薄膜冷却至低于制剂冷冻温度的温度将分配的液滴冷冻。冻干过程本发明的冻干制剂是通过将预冻干溶液冻干(冷冻干燥)而形成的。冷冻干燥是通过将制剂冷冻并且随后在适于一次干燥的温度下升华水来完成的。在这一条件下,产品温度低于制剂的低共熔点或塌陷温度。通常,一次干燥的搁板温度将在约-50至25℃范围内(在一次干燥期间所提供的产品仍是冷冻的),且在范围通常在约30至250mtorr的适宜压力下。制剂、盛放样品容器的尺寸和类型(例如,玻璃小瓶)以及液体的体积将决定干燥所需时间,其可以在数小时至几天范围内(例如,40-60hr)。二次干燥阶段可以在约0-40℃下进行,这主要取决于容器的类型和尺寸以及所用蛋白质的类型。二次干燥时间取决于产品中所需的残留水分含量,通常需要至少约5小时。通常,冻干制剂的水分含量低于约5%,和优选地低于约3%。压力可以与一次干燥步骤中所用压力相同。冷冻干燥条件可以根据制剂、小瓶尺寸和冻干托盘而变化。在一些情况下,在进行重构的容器中冻干或微波干燥制剂可能是理想的,以避免转移步骤。在这种情况下,容器可以是例如2、3、5、10或20ml的小瓶。使用方法本发明的实施方式还包括一种或多种本文所述的登革疫苗组合物或制剂,其(i)用于以下,(ii)用作用于以下的药物或组合物,或(iii)用于制备用于以下的药物:(a)治疗(例如,人体);(b)药物;(c)抑制登革病毒复制,包括den1、den2、den3和/或den4;(d)诱导针对den1、den2、den3和/或den4中的一种或多种的免疫应答或保护性免疫应答;(e)诱导针对一种或多种登革类型的病毒中和抗体应答;(f)治疗或预防登革病毒的感染;(g)预防登革病毒感染的复发;(h)降低与登革病毒感染相关的病理症状的进展、发作或严重性和/或降低登革病毒感染的可能性,或(i)治疗、预防或延迟登革相关疾病的发作、严重性或进展,所述登革相关疾病包括但不限于:登革热、登革出血热、登革休克综合征。在这些用途中,登革疫苗组合物可以任选地与一种或多种佐剂(例如,本文所述的aahs、磷酸铝、氢氧化铝诸如或其他铝盐佐剂、基于皂苷的佐剂诸如iscomatrixtm(csl,ltd.)、tlr激动剂、或脂质纳米颗粒)组合应用。预防性治疗可以使用本发明的登革病毒疫苗组合物来进行,如本文所述。本发明的组合物可以施用于一般群体或处于增加的登革感染风险的那些人,例如住在或将旅行至伊蚊属蚊子流行的世界地区的那些人。“需要治疗”的那些包括已经具有登革感染(例如,被den1、den2、den3或den4中的一种或多种感染)的那些,以及倾向于具有任何感染的那些或期望感染可能性降低的任何人。本发明的登革病毒疫苗组合物可以使用本领域众所周知的技术配制且施用于患者。通常的药物施用的指南提供于例如vaccines编辑,plotkin和orenstein,w.b.sanderscompany,1999;remington'spharmaceuticalsciences第20版,编辑gennaro,mackpublishing,2000;和modernpharmaceutics第2版,编辑banker和rhodes,marceldekker,inc.,1990。因此,本发明提供了用于在患者中诱导针对登革感染的保护性免疫应答的方法,其包括向患者施用免疫有效量的本文所述的任何登革病毒疫苗组合物的步骤。在一个实施方式中,登革病毒疫苗组合物与其他疫苗联合共同施用,用于治疗或预防寨卡、麻疹、腮腺炎和风疹或水痘等。本发明还提供了用于治疗登革感染或用于治疗与登革感染相关的任何病理状态的方法,这样的治疗包括预防感染,和降低临床症状的严重性,延缓或预防疾病的进展,和/或降低感染或其临床症状的可能性;所述方法包括向患者施用免疫有效量的任何本文所述的疫苗组合物的步骤。本发明的另外的实施方式包括在初免/加强方案中向患者施用两种或更多种本发明的组合物。因此,本发明涉及预防或降低有此需要的患者中的登革感染的可能性的方法,其包括以下步骤:(a)向患者施用本发明的第一登革病毒疫苗组合物;(b)步骤(a)之后等待预订量的时间经过;(c)向患者施用本发明的第二登革病毒疫苗组合物;和(d)任选地重复步骤(b)和(c);由此在患者中预防登革感染或降低被登革感染的可能性。在上述方法的实施方式中,本发明的登革病毒疫苗组合物是冷冻液体形式。在替代实施方式中,登革病毒疫苗组合物被冻干或微波干燥,并且在向患者施用之前使用无菌稀释剂重构。第一剂本发明登革病毒疫苗组合物和第二剂本发明登革病毒疫苗组合物或其后任何剂之间的时间量是约2周至约2年。在本发明的优选实施方式中,在多次施用之间允许经过2个月至12个月的时间。在本发明这一方面的替代实施方式中,疫苗组合物各剂的各次施用之间的时间量独立地选自2周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、13个月、14个月、15个月、16个月、17个月、18个月、19个月、20个月、21个月、22个月、23个月和24个月。在本发明的一些实施方式中,第一和第二登革病毒疫苗组合物是相同的。在替代实施方式中,第一和第二登革病毒疫苗组合物是不相同的。本发明的登革病毒疫苗组合物可以通过不同的途径施用。在本发明的优选实施方式中,本发明的组合物胃肠外施用,即通过皮内、皮下或肌内注射。皮下和肌内施用可以使用,例如,针或喷射注射器来进行。本文所述的组合物可以以与剂量制剂相容的方式且以免疫有效的量进行施用,以治疗和/或降低登革感染的可能性。在本发明的上下文中,施用于患者的剂量应足以随着时间在患者中实现有利应答,诸如登革病毒水平的降低,或降低被登革感染的可能性。待施用的登革病毒疫苗的量可以取决于待治疗的对象,包括其年龄、性别、体重和总体健康情况。在这方面,需要施用的疫苗的精确量将取决于从业者的判断。在待针对登革感染的治疗或预防中施用的疫苗的有效量的确定中,医师可以评估循环血浆水平、疾病进展和抗登革抗体的产生。在任何情况下,本发明的免疫原性组合物的适宜剂量可以由本领域技术人员容易地决定。适宜的给药方案优选考虑本领域众所周知的因素进行确定,包括患者的年龄、重量、性别和医学状况;施用途径;期望的效应;和采用的具体组合物。给药的时机取决于本领域众所周知的因素且范围可以为2周至24个月。在最初施用之后,可以施用一个或多个另外的剂量,以维持和/或加强抗体滴度。本发明还涉及用于预防登革感染或预防或改善其症状的方法,其包括以下步骤:向登革感染或其症状待预防或改善的患者施用登革病毒疫苗组合物。本发明这一方面进一步的实施方式包括允许在施用登革病毒疫苗组合物之后经过预定的时间,并施用第二剂登革病毒疫苗组合物。在上述方法中,第一登革疫苗是优选四价的,且包含den1、den2、den3和den4组分,其中各组分包含活减毒登革病毒或活减毒嵌合黄病毒,如本文所述。在示例性实施方式中,活减毒登革疫苗包含四种嵌合黄病毒;其中各嵌合黄病毒包含单一登革病毒血清型的prm和e蛋白和不同黄病毒的衣壳和非结构蛋白,其中各嵌合黄病毒是减毒的。在某些实施方式中,四种嵌合黄病毒的衣壳和非结构蛋白来自黄热病毒。在替代实施方式中,四种嵌合黄病毒各自的衣壳和非结构蛋白来自与prm和e蛋白不同的登革血清型。在本发明这一方面的一些实施方式中,第二登革疫苗是四价重组登革亚单位疫苗,其包含来自den1、den2、den3和den4的登革e蛋白或其片段。本文描述了可用于本发明的该方法中的亚单位疫苗。在优选的实施方式中,e蛋白各自构成den1、den2、den3和den4的野生型e从其n-末端的氨基酸残基1开始的长度的约80%。实施例在这些研究中使用的活减毒登革病毒序列的实例是rden1-rden1δ30-1545pmvs(seqidno:6);rden2-rden2/4δ30(me)-1495,7163pmvs(seqidno:7);rden3-rden3δ30/31-7164pmvs(seqidno:8);和rden4-rden4δ30-7132,7163,8308pmvs(seqidno:9)。表1:pmvsdenv1序列变化的总结*出于稳定和克隆目的而引入表2:pmvsdenv2序列变化的总结表3:pmvsdenv3序列变化的总结表4:pmvsdenv4序列变化的总结上表中的denv1、2、3和4野生型和原始cdna克隆对应于在whitehead,s.s.等,jvirol77:1653-1657(2003);blaney,j.e.等,theamericanjournaloftropicalmedicineandhygiene71:811-821(2004);blaney,j.e.,jr.等,bmcinfectdis4:39(2004);durbin,a.p.等,theamericanjournaloftropicalmedicineandhygiene65:405-413(2001)中所述的登革病毒血清型。在下述实施例中,将活减毒登革病毒的上述形式称为denv1或den1、denv2或den2、denv3或den3和denv4或den4。对于实施例1-6,每种denv1、denv2、denv3或denv4制剂的效价均为2x105pfu/ml。对于实施例7-10,每种den1、den2、den3或den4制剂的效价均为1.5x105pfu/ml。实施例1cmc、pg和氨基酸(与制剂比较)对denv4的影响进行了三项独立的研究,以考察多种赋形剂对denv4的冻干收率和稳定性的影响。制剂列于表5中。表5:制剂组成*无酚红leibovitzl-15培养基是由hyclonelaboratories,inc生产的溶液。研究1:在11mm磷酸钾、90mg/ml蔗糖和75mmnacl(制剂3)中配制denv4,添加5mg/ml羧甲基纤维素钠(cmc钠)(制剂4)或添加5mg/mlcmc钠和5mg/ml丙二醇(制剂5)。研究2:针对比较制剂对制剂5进行检测,比较制剂包含25mm亮氨酸(制剂20)或25mm脯氨酸(制剂21)以及11mm磷酸钾、90mg/ml蔗糖、50mmnacl、5mg/mlcmc钠和5mg/ml丙二醇。研究3:针对比较制剂对制剂20进行检测,比较制剂包含11mm磷酸钾、90mg/ml蔗糖、50mmnacl、5mg/mlcmc钠、和5mg/ml丙二醇、和25mm谷氨酸(制剂19)以及制剂(制剂26),其由37.5mg/ml山梨糖醇、75mg/ml蔗糖、55mg/ml海藻糖、25mg/ml尿素、6mmtris、15mg/ml氨基酸混合物组成。对于所有研究,将样品冷冻,一部分在-70℃下储存作为冷冻液体对照,和一部分冻干。冻干后,将一些样品储存在-70℃下作为对照,剩余部分在25℃下放置1周。孵育后,将25℃样品冷冻并与冷冻液体对照和冷冻冻干对照一起进行登革相对感染性测定(dria)检测。每个样品检测两个单独的小瓶。dria是一种基于细胞的相对感染性测定法,用于根据包膜蛋白的表达来测量登革病毒制剂样品的感染性。将vero细胞接种于96孔微量滴定板中,孵育24小时,然后用den1、den2、den3和/或den4参照标准品系列稀释物和对待检测血清型具有特异性的阳性对照以及待测物感染细胞。将感染细胞孵育48小时,随后用稀甲醛溶液固定细胞。然后,透化固定细胞,之后将一抗(兔抗-den血清型特异性mab)加入板中并孵育过夜。洗板后,向孔中加入二抗(与驴nl637-缀合的抗家兔igg,r&dsystems),并在室温下孵育>2hr。洗板后,将pbs加入孔中,以准备使用minimax成像系统(minimaximagingreader)(moleculardevices)进行图像分析。利用softmaxpro软件(moleculardevices),使用降低的4参数logistic曲线拟合,计算样品的相对效价(%rp)(相对于参照标准品)。通过将冻干的感染性结果除以冷冻液体对照的感染性结果来计算冻干收率。为计算在25℃下储存1周后的对数损失,将感染性值转换为对数标度,并从每种制剂的-70℃冻干对照结果中减去在25℃下1周的对数结果。观察到cmc钠和丙二醇的组合具有协同作用,提高了冻干收率和稳定性。添加亮氨酸进一步提高收率和稳定性。与dengvaxia制剂相比,包含cmc钠、丙二醇和亮氨酸或谷氨酸的制剂可提高冻干收率。见图1-2。由于在25℃下储存后滤饼(cake)塌陷,因而未检测制剂26在25℃下1周的稳定性时间点。实施例2糖醇对denv4的影响:在基本制剂11mm磷酸钾、90mg/ml蔗糖、75mmnacl、5mg/mlcmc钠,ph7.5中加入5mg/ml丙二醇(制剂5)、5mg/ml甘油(制剂22)或25mg/ml山梨糖醇(制剂13)作为糖醇配制denv4。将样品冷冻,一部分在-70℃下储存作为冷冻液体对照,和一部分冻干。冻干后,将一些样品储存在-70℃下,剩余部分在25℃下放置1周。孵育后,将25℃样品冷冻并与冷冻液体对照和冷冻冻干对照一起进行登革相对感染性测定检测。每个样品检测两个单独的小瓶。通过将冻干的感染性结果除以冷冻液体对照的感染性结果来计算冻干收率。为计算在25℃下储存1周后的对数损失,将感染性值转换为对数标度,并从每种制剂的-70℃冻干对照结果中减去在25℃下1周的对数结果。该实施例表明,与山梨糖醇相比,丙二醇和甘油两者提高denv4的冻干收率和稳定性(见图3和4)。实施例3ph对denv4的影响:在制剂22(11mm磷酸钾、90mg/ml蔗糖、75mmnacl、5mg/mlcmc钠、5mg/ml甘油,ph7.0、7.5或8.0)中配制denv4。将样品冷冻,一部分在-70℃下储存作为冷冻液体对照,和一部分冻干。冻干后,将一些样品储存在-70℃下,剩余部分在25℃下放置1周。孵育后,将25℃样品冷冻并与冷冻液体对照和冷冻冻干对照一起进行登革相对感染性测定检测。每个样品检测两个单独的小瓶。通过将冻干的感染性结果除以冷冻液体对照的感染性结果来计算冻干收率。为计算在25℃下储存1周后的对数损失,将感染性值转换为对数标度,并从每种制剂的-70℃冻干对照结果中减去在25℃下1周的对数结果。图5和图6表明denv4可在ph7.0至ph8.0的制剂22中配制。实施例4缓冲剂对denv4的影响:在研究1中,在基本制剂90mg/ml蔗糖、75mmnacl、5mg/mlcmc钠和5mg/ml甘油中配制denv4,使用替代缓冲系统调整至ph7.5。除了基本制剂以外,制剂22包含11mm磷酸钾和制剂25包含11mmtris。在研究2中,在基本制剂90mg/ml蔗糖、75mmnacl、5mg/mlcmc钠和5mg/ml丙二醇中配制denv4,使用替代缓冲系统调整至ph7.5。除了基本制剂以外,制剂5包含11mm磷酸钾和制剂57包含5.5mm组氨酸和5.5mmtris的组合。将样品冷冻,一部分在-70℃下储存作为冷冻液体对照,和一部分冻干。冻干后,将一些样品储存在-70℃下,剩余部分在25℃下放置1周。孵育后,将25℃样品冷冻并与冷冻液体对照和冷冻冻干对照一起进行登革相对感染性测定检测。每个样品检测两个单独的小瓶。通过将冻干的感染性结果除以冷冻液体对照的感染性结果来计算冻干收率。为计算在25℃下储存1周后的对数损失,将感染性值转换为对数标度,并从每种制剂的-70℃冻干对照结果中减去在25℃下1周的对数结果。图7和图8表明denv4可以在ph7.5下的多种缓冲系统中配制,包括磷酸钾、tris或组氨酸和tris的组合。实施例5nacl对denv4的影响:在基本制剂11mm磷酸钾、90mg/ml蔗糖、5mg/mlcmc钠和5mg/ml丙二醇,以及浓度范围为15-75mm的nacl中配制denv4。将样品冷冻,一部分在-70℃下储存作为冷冻液体对照,和一部分冻干。冻干后,将一些样品储存在-70℃下,剩余部分在25℃下放置1周。孵育后,将25℃样品冷冻并与冷冻液体对照和冷冻冻干对照一起进行登革相对感染性测定检测。每个样品检测两个单独的小瓶。通过将冻干的感染性结果除以冷冻液体对照的感染性结果来计算冻干收率。为计算在25℃下储存1周后的对数损失,将感染性值转换为对数标度,并从每种制剂的-70℃冻干对照结果中减去在25℃下1周的对数结果。图9和图10表明,当nacl浓度范围为15-75mm时,denv4在25℃下1周的冻干收率和稳定性相似。实施例6丙二醇和甘油对所有登革血清型的影响:在ph7.5下,在制剂5(11mm磷酸钾、90mg/ml蔗糖、75mmnacl、5mg/mlcmc、5mg/ml丙二醇)、制剂20(11mm磷酸钾、90mg/ml蔗糖、50mmnacl、5mg/mlcmc、5mg/ml丙二醇和25mm亮氨酸)和制剂22(11mm磷酸钾、90mg/ml蔗糖、75mmnacl、5mg/mlcmc、5mg/ml甘油)中制备denv1、denv2、denv3和denv4作为单价药品。将样品冷冻,一部分在-70℃下储存作为冷冻液体对照,和一部分冻干。冻干后,将一些样品储存在-70℃下,剩余部分在25℃下放置1周。孵育后,将25℃样品冷冻并与冷冻液体对照和冷冻冻干对照一起进行登革相对感染性测定检测。每个样品检测两个单独的小瓶。通过将冻干的感染性结果除以冷冻液体对照的感染性结果来计算冻干收率。为计算在25℃下储存1周后的对数损失,将感染性值转换为对数标度,并从每种制剂的-70℃冻干对照结果中减去在25℃下1周的对数结果。图11和图12表明,丙二醇和甘油与蔗糖、氯化钠和cmc钠组合可稳定所有四种血清型。实施例7将spg(蔗糖、磷酸钾、谷氨酸)制成10x溶液,其浓度见表6。表6蔗糖(晶体)746.2mg/mlkh2po4(一元碱,无水)5.17mg/mlk2hpo4(二元碱,无水)12.54mg/mll-谷氨酸(一钠盐,一水合物)11.2mg/ml还制备了下述其他溶液:650mg/ml蔗糖、650mg/ml海藻糖(二水合物)、200mg/ml明胶、150mg/ml精氨酸和20mg/ml人血清白蛋白(hsa)。使用pes0.22μmstericup滤器过滤spg、蔗糖、海藻糖、明胶、精氨酸和hsa。将溶液、leibovitzl-15和den1组合在一起,以获得如下所示的最终制剂。表7将制剂以0.5ml灌装量灌装到2r玻璃小瓶中,并在-115℃下冷冻15分钟。一旦冷冻,将小瓶在微波真空干燥器(mvd)中干燥。一旦干燥,将一些小瓶在25℃下稳定放置1周。然后,使用登革相对感染性测定(dria)将小瓶进行效价检测。微波真空干燥过程将在微波真空干燥器(mvd)中待干燥的物料快速冷冻,并立即将其装入干燥室中。迅速将真空室的真空抽至100mtorr以下。一旦达到真空设定点,就选择磁控管(即,磁控管的数量和功率输出),以开始干燥物料。在扫描模式下运行微波(以行波形式施加辐射),其算法为每30秒打开和关闭选定的磁控管(例如,共计4个磁控管中的2个磁控管)循环一次,以实现均匀的功率分配。此外,装置顶部的水负载允许微波单次通过样品,从而将来自反射微波的任何干扰将至最低,从而实现受控的升华。在整个干燥周期中增加功率以达到最终的终末温度为30-45℃。一旦干燥,解除真空室的真空,并将物料密封。表8确定所有制剂的冻/融(f/t)收率、干燥收率和在25℃下1周的对数损失。通过报告的相对效价除以在-70℃下冷冻对照的预期相对效价计算冻/融(f/t)收率。通过干燥物料的相对效价除以冷冻对照的相对效价计算干燥收率。通过log10计算,通过将干燥物料t0时间点和在25℃下1周稳定性物料的相对效价转换成对数来计算对数损失。将数值转换成对数后,从t0时间点减去稳定性时间点,以确定在25℃下1周的对数损失。制剂2、4、5和12显示出f/t收率、干燥收率和在25℃下1周对数损失的最佳组合。所有四种这些制剂均含有≥25%的二糖(蔗糖和/或海藻糖)。表9:表7中的制剂赋形剂范围的总结赋形剂量(每0.5ml剂量)蔗糖37.5mg-75mg磷酸钾(一元碱,无水)~0.26mg磷酸钾(二元碱,无水)~0.63mgl-谷氨酸(一钠盐,一水合物)0.56mg海藻糖37.5mg-87.5mg人血清白蛋白(hsa)1.25mg精氨酸20mg明胶12.5mg实施例8根据实施例7制备spg(蔗糖、磷酸钾、谷氨酸)。还制备了下述其他溶液:650mg/ml蔗糖、650mg/ml海藻糖、5m氯化钠(nacl)和10mg/ml羧甲基纤维素钠(cmc钠)。使用pes0.22μmstericup滤器过滤所有溶液。将溶液和登革病毒den1或den4组合在一起,以获得在结果表中所示的最终制剂。将制剂以0.5ml灌装量灌装到2r玻璃小瓶中,并在-115℃下冷冻15分钟。一旦冷冻,将小瓶在微波真空干燥器(mvd)中干燥。一旦干燥,将一些小瓶在25℃下稳定放置1周。然后,使用登革相对感染性测定(dria)将小瓶进行效价检测。表10通过log10计算,通过将干燥物料t0时间点和在25℃下1周稳定性物料的相对效价转换成对数计算对数损失。将数值转换成对数后,从t0时间点减去稳定性时间点,以确定在25℃下1周的对数损失。结果表明,对于含有≥25%二糖的den1制剂,在25℃下1周观察到最低对数损失。具有≥15%二糖和30mm盐的den4制剂在25℃下1周具有最低对数损失。对于含有≥15%二糖和盐的制剂,加入cmc钠有助于减少残留水分。表11:表10中的制剂赋形剂范围总结赋形剂量(每0.5ml剂量)蔗糖0mg-37.5mg磷酸钾(一元碱,无水)~0.26mg磷酸钾(二元碱,无水)~0.63mgl-谷氨酸(一钠盐,一水合物)0.56mg海藻糖37.5mg-87.5mg羧甲基纤维素钠2.5mg氯化钠0.88mg实施例9制剂为1xspg(11mm磷酸钾、6mml-谷氨酸、0.22m蔗糖),具有不同量的l-15(90%、45%和25%)以及den1、den2、den3或den4。leibovitzl-15的主要成分是nacl(137.39mm)。因此,90%l-15相当于123.65mmnacl,45%l-15相当于61.83mmnacl和25%l-15相当于34.35mmnacl。将制剂以0.5ml灌装量灌装到2r玻璃小瓶中,并在-115℃下冷冻15分钟。一旦冷冻,将小瓶在微波真空干燥器(mvd)中干燥。然后,使用登革相对感染性测定(dria)将小瓶进行效价检测。在mvd中快速干燥的制剂比在冻干条件下较慢干燥的制剂更稳定(见图13-16)。在上述制剂中,盐浓度≥61.83mmnacl似乎改善了干燥期间den4的稳定性,但在其他三种类型(den1、den2和den3)中没有观察到。实施例10还制备了下述其他溶液:500mg/ml蔗糖、250mg/ml海藻糖、1m氯化钠(nacl)、和10mg/ml羧甲基纤维素钠(cmc钠)、100mg/ml聚乙烯吡咯烷酮(pvp)、100mm磷酸钾、500mg/ml丙二醇和无菌水。使用pes0.22μmstericup滤器过滤所有溶液。将溶液和登革病毒(den1)组合在一起,以获得下述制剂:11mm磷酸钾、90mg/ml蔗糖、5mg/mlcmc钠、5mg/mlpg;11mm磷酸钾、200mg/ml蔗糖、50mg/mlpvpk12;11mm磷酸钾、75mg/ml蔗糖、175mg/ml海藻糖、30mmnacl、5mg/mlcmc。将制剂以0.5ml灌装量灌装到2r玻璃小瓶中,并在-115℃下冷冻15分钟。一旦冷冻,将小瓶在微波真空干燥器(mvd)或冷冻干燥器(lyo)中干燥。然后,使用登革相对感染性测定(dria)将小瓶进行效价检测。图17显示了在微波真空干燥器中干燥制剂的小瓶的相对效价大于或等于在冷冻干燥器中干燥的那些。表12:图17中的制剂赋形剂范围的总结赋形剂量(每0.5ml剂量)蔗糖37.5mg-100mg磷酸钾(一元碱,无水)~0.26mg磷酸钾(二元碱,无水)~0.63mg海藻糖87.5mg羧甲基纤维素钠2.5mg氯化钠0.88mgpvpk1225mg丙二醇2.5mg实施例11将denv1、denv2、denv3和denv4的四价制剂(制剂20)冻干,并在37℃下储存1周(图18a),在25℃下储存1个月(图18b)和在2-8℃下储存18个月(图19a-d)。在每个时间点,通过噬斑测定(如本文前面所述)分析效价。在每个稳定性时间点进行的相同测定中,通过噬斑测定对在-70℃下储存的对照样品进行检测。通过从-70℃对照样品的对数结果中减去稳定性样品的对数结果计算每个时间点的对数损失。图18a-b和图19a-d显示了在四价制剂20中的每种血清型随着时间推移的对数损失。误差线表示在每个时间点计算的对数损失平均值的两个标准误差。如分别在1周、1个月和18个月观察到的最小效价损失所证明的,制剂20在37℃、25℃和2-8℃下为四价疫苗中的所有四种登革血清型提供了热稳定性。实施例12高通量噬斑测定高通量噬斑测定“微噬斑(up)”测定是在96孔微孔板中进行的自动化、小型化登革噬斑测定。简言之,以每孔40,000个细胞,将vero细胞接种到加入含2%l-谷氨酰胺的optiprosfm的黑壁、透明底部组织培养板中。使细胞在37℃、5%pco2、>90%rh下贴壁过夜。在optimem低血清培养基中预先稀释病毒,然后在超低吸附培养板中的培养基中进一步按1:2系列稀释。使用温和抽吸从细胞培养板中除去接种(plant)培养基,并将25μl/孔接种体(incolum)从系列稀释板转移至细胞培养板中。在37℃、5%pco2、>90%rh下进行4小时病毒吸附过程。吸附孵育后,向所有孔中添加175μl/孔覆盖培养基,以抑制病毒分泌和播散。根据血清型,在上述孵育条件下,持续感染2或3天。感染孵育后,除去覆盖培养基并使用含3.7%甲醛的pbs固定细胞。使用含0.5%tritonx-100的pbs透化培养板,然后使用含1%bsa的pbs封闭。先将类型特异性家兔单克隆抗体,随后将抗-兔alexafluor488用于荧光染色病毒噬斑。使用perkinelmerensight对板进行成像,并通过自动计数算法对荧光噬斑计数。使用下面的公式从含有在计数标准(取决于类型)内的有效目标计数的孔中确定滴度:进行了两项研究,其中将denv1、denv2、denv3和denv4四价制剂在表13中详述的制剂中冻干并在25℃下储存1周。每种制剂含有9%蔗糖、11mm磷酸钾、50mmnacl、25mmleu,ph7.5,以及可变量的cmc或pg。在每个时间点通过如上文所述的高通量噬斑测定分析效价。在测定中还检测在-70℃下储存的对照样品。通过从-70℃对照样品的对数结果减去稳定性样品的对数结果计算每个时间点的对数损失。表14a和14b显示了在各种四价制剂中每种血清型随着时间推移的对数损失。各种组合的浓度为0.2%-1%cmc或pg,表现出彼此相似的稳定性,并且与没有该组合的制剂相比,稳定性更高。表13:四价制剂表14a:cmc和pg浓度对25℃下稳定性的影响表14b:cmc和pg浓度对25℃下稳定性的影响为了描述和公开可能与本发明结合使用的方法和材料,本文提及的所有出版物均通过引用并入本文。已经参考附图在本文中描述了本发明的不同实施方式,应当理解的是,本发明不限于那些精确的实施方式,并且本领域技术人员在不脱离由所附权利要求定义的本发明范围或主旨的前提下,可以在其中进行各种改变和修改。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1