可实现目标释放曲线的剂型及其设计和制备方法与流程
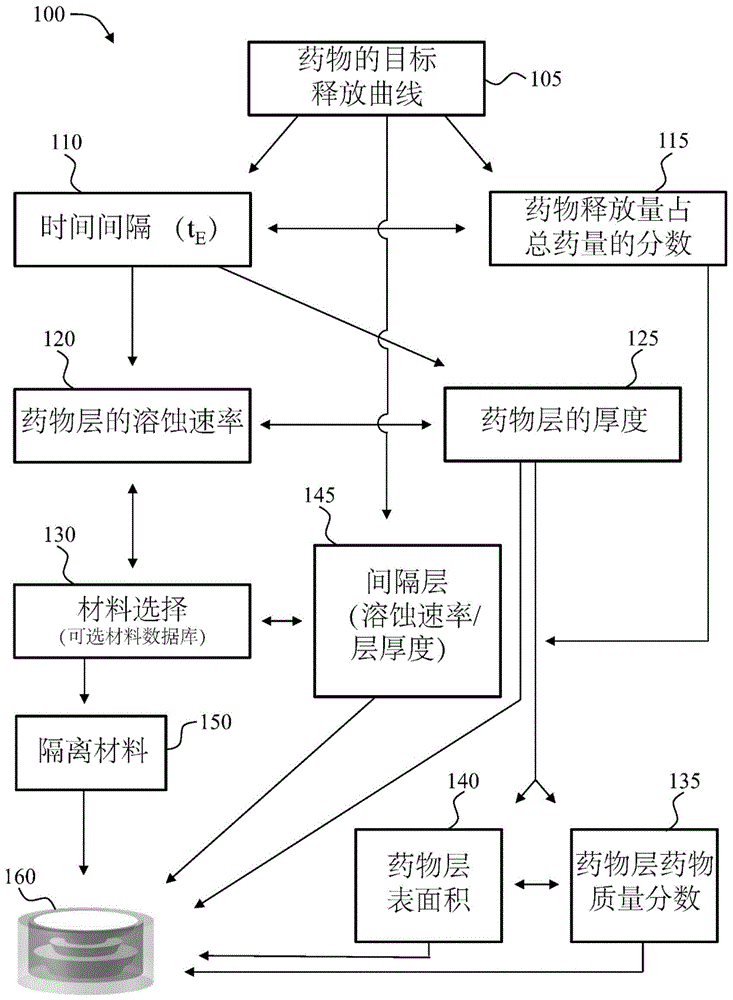
相关申请的交叉引用根据美国专利法第365条(a)款,本申请要求2018年1月9日提交的题为“可实现目标释放曲线的剂型及其设计和制备方法”的申请号为pct/cn2018/071967的国际申请的优先权,通过引用将其全部内容合并于此用于所有目的。在一些方面,本公开提供了可实现目标释放曲线的剂型,例如药物剂型,所述剂型包括多层结构,所述多层结构包括多个与药物或试剂混合的第一溶蚀材料层,其中所述第一溶蚀材料嵌入不与化合物(例如药物)或试剂混合的第二材料。在其他方面,本公开提供了可实现目标释放曲线的剂型的设计和制备方法,例如3d打印。
背景技术:
:随着对药物和试剂的使用、功效和毒性的机制的理解越来越深入,药物和试剂在定位和时间上精确传递显得十分重要。为了改善使用、功效和安全性,特定的药物和试剂(例如药物组合)可能需要复杂的给药方案或释放曲线以控制一种或多种药物或试剂组分的释放,以实现目标的吸收、分布、代谢、排泄曲线。然而,实现一致地精确药物传递的需求与通过简单的给药方式(如一天一次的药丸)以确保正确服用和患者依从性常常相悖。三维(3d)打印通过在基底上对材料的精确放置,将计算机生成的设计转换为三维结构。例如,在3d打印生产药物剂型的应用中,先通过3d打印一个阴模,随后,将与药物混合的溶蚀材料倒入阴模,于是,与药物混合的溶蚀材料形成特定形状(wo2017010938)。所述模制的与药物混合的溶蚀材料之后通过手动装配形成最终的药物剂型。然而,这样的技术具有局限性,例如,有限的生产量、使用模具的过程中需要额外的生产步骤、以及由于模制过程导致药物剂型设计能力/灵活性的局限。所有参考文献(包括专利申请和公开)之全文以引用的方式并入本文中。技术实现要素:本公开提供了可用于实现目标释放曲线的剂型,及其设计和制备方法。尽管本申请大部分讨论了药物剂型,例如口服药物剂型,但是本领域普通技术人员将很容易理解,本公开还涉及并教导了可用于实现如一个化合物的目标释放曲线的其他剂型,如植入药物剂型或包含试剂(试剂剂型)的剂型。一方面,本公开提供了三维打印剂型(如药物剂型,具体如口服药物剂型)的方法,该方法用于实现目标释放曲线,例如药物的目标释放曲线,包括:打印与化合物(例如药物)混合的第一溶蚀材料,和不与化合物(例如药物)混合的第二材料,以形成多层的结构,所述多层结构包括多个第一溶蚀材料层,其中所述第一溶蚀材料嵌入第二材料,其中所述第一溶蚀材料的每层都有一个预定的表面积、厚度和质量分数(例如药物质量分数),其中所述预定的表面积、厚度和/或药物质量分数与目标释放曲线相关,并且当其暴露于体液(例如胃肠液)时,化合物(例如药物)根据目标释放曲线释放。在一些实施方案中,所述方法进一步包括在打印步骤之前提供目标释放曲线,例如药物的目标释放曲线。在一些实施方案中,所述方法进一步包括在打印步骤之前,创建剂型的虚拟图像。在一些实施方案中,所述方法进一步包括在打印步骤之前,建立包含预定参数的计算机模型。在一些实施方案中,所述方法进一步包括在打印步骤之前,将预定的参数输入到3d打印机。在一些实施方案中,第一溶蚀材料与化合物(例如药物)混合,第二材料不与化合物(例如药物)混合,两者分别打印。在一些实施方案中,第一溶蚀材料与化合物(例如药物)混合,第二材料不与化合物(例如药物)混合,两者依次打印。在一些实施方案中,至少两层的第一溶蚀材料层的表面积不同。在一些实施方式中,多个第一溶蚀材料层中每一层的厚度相同。在一些实施方式中,至少两层的第一溶蚀材料层的厚度不同。在一些实施方式中,多个第一溶蚀材料层中每一层的质量分数(例如药物质量分数)相同。在一些实施方式中,至少两层的第一溶蚀材料层的质量分数(例如药物质量分数)不同。在一些实施方式中,第二材料是第二溶蚀材料。在一些实施方式中,第一溶蚀材料与第二溶蚀材料不同。在一些实施方式中,第一溶蚀材料与第二溶蚀材料相同。在一些实施方式中,第二材料对于体液(例如胃肠液)来说是不可渗透的隔离材料,其中所述隔离材料在体液和至少一部分多层结构之间形成屏障。在一些实施方式中,进一步包括打印隔离材料的方法,所述隔离材料对于体液(例如胃肠液)来说不可渗透,其中所述隔离材料在体液和至少一部分多层结构之间形成屏障。在一些实施方式中,第一溶蚀材料与第二材料用不同的打印头打印。在一些实施方式中,第一溶蚀材料、第二材料和隔离材料用不同的打印头打印。在一些实施方式中,三维打印通过熔融沉积成型(fdm)的方式实现。在一些实施方式中,fdm是非线材的fdm。在一些实施方式中,fdm是线材的fdm。在一些实施方式中,三维打印通过将热熔挤出结合三维打印技术(例如fdm)的方式实现。在一些实施方式中,第一溶蚀材料与第二材料的溶蚀速率相同。在一些实施方式中,每层的厚度不超过约0.2毫米。在一些实施方式中,所述方法进一步包括打印不与药物混合的间隔材料,其中所述间隔材料在两层或更多层第一溶蚀材料层之间形成间隔层。在一些实施方式中,所述间隔材料与第一溶蚀材料或第二材料相同。在一些实施方式中,所述方法进一步包括打印不与药物混合的间隔材料,其中所述间隔材料在两层或更多层第一溶蚀材料层之间形成间隔层。在一些实施方式中,所述间隔材料与第一溶蚀材料相同。在一些实施方案中,化合物(例如药物)以增加的速率释放。在一些实施方案中,化合物(例如药物)以减小的速率释放。在一些实施方案中,化合物(例如药物)以先增加、后减小的速率释放,反之亦可。在一些实施方案中,化合物(例如药物)以振荡模式(例如交替模式)释放。在一些实施方式中,剂型(例如药物剂型),进一步包括例如第二药物。在一些实施方式中,例如第二药物与第一溶蚀材料混合。在一些实施方式中,所述方法进一步包括打印与例如第二药物混合的第三溶蚀材料,其中所述多层结构进一步包括多个第三溶蚀材料层,其中所述第三材料嵌入在第二材料中。在一些实施方式中,第三溶蚀材料的每一层具有预先确定的表面积、厚度和质量分数(例如药物质量分数),其中所述预先确定的表面积、厚度和/或质量分数与第二目标释放曲线相关联,并且当暴露于体液例如胃肠液时,根据第二目标释放曲线释放例如第二药物。在一些实施方案中,第三溶蚀材料与第一溶蚀材料相同。在一些实施方案中,第一溶蚀材料的溶蚀是ph依赖型的。在一些实施方案中,第三溶蚀材料的溶蚀是ph依赖型的。在一些实施方式中,所述药物剂型是口服药物剂型。在一些实施方式中,所述体液是胃肠液。另一方面,本公开提供剂型(例如药物剂型)的设计方法,以实现目标释放曲线(例如药物的目标释放曲线),其中所述剂型包含多层结构,所述多层结构包括多个与化合物(例如药物)混合的第一可溶蚀材料层,其中所述第一溶蚀材料嵌入不与化合物(例如药物)混合的第二材料中,所述方法包括:(a)选择用于形成多层结构的第一溶蚀材料和第二材料;(b)获得第一溶蚀材料的溶蚀速率;和(c)基于化合物(例如药物)的释放速率和目标释放曲线,确定每层的厚度、表面积和/或质量分数(例如药物质量分数)。在一些实施方式中,所述方法进一步包括获得目标释放曲线,例如药物的目标释放曲线。在一些实施方案中,所述方法还进一步包括按照所确定的厚度、表面积和/或质量分数(如药物质量分数)打印与化合物(例如药物)混合的第一溶蚀材料和不与化合物(例如药物)混合的第二材料。在一些实施方式中,所述方法进一步包括获得目标释放曲线,例如药物的目标释放曲线。在一些实施方式中,所述多层结构进一步包括多个由与例如第二药物混合的第三溶蚀材料形成的第二层,其中所述方法进一步包括:确定例如第二药物从第三溶蚀材料中释放的速率;并且基于例如第二药物的释放速率和目标释放曲线,来确定每个第二层的厚度、表面积和/或质量分数(例如药物质量分数)。在一些实施方式中,所述方法进一步包括基于确定的厚度、表面积和/或质量分数(例如药物质量分数),打印与例如第二药物混合的第三溶蚀材料。一方面,本公开提供了三维(“3d”)打印剂型(诸如药物剂型)的方法,所述剂型被用于实现目标释放曲线,例如药物的目标释放曲线,其中所述剂型包括多层结构,所述多层结构包括多个与化合物(例如药物)混合的第一溶蚀材料层,其中所述第一溶蚀材料嵌入未与所述化合物(例如所述药物)混合的第二材料中,所述方法包括:(a)基于化合物(例如药物)的释放速率和目标释放曲线,确定每层的厚度、表面积和/或质量分数(例如药物质量分数);和(b)基于确定的厚度、表面积和/或质量分数(例如药物质量分数),打印与化合物(例如药物)混合的第一溶蚀材料和不与化合物(例如药物)混合的第二材料。在一些实施方式中,第一溶蚀材料的层的厚度(h)是由与药物混合的第一溶蚀材料的溶蚀速率(ve)、以及药物释放曲线上两个不同数据点的时间间隔(te)计算得出:h=te*ve。在一些实施方式中,在第一溶蚀材料中的质量分数(mf),例如药物质量分数,是由溶蚀材料层中所混合化合物(例如药物)在药物剂型的化合物(例如药物)总量中所占的百分数(以小数形式)(%l)、药物剂型中化合物(例如药物)的总质量(mdtot)、与化合物(例如药物)混合溶蚀材料的密度(ρ)、以及溶蚀材料层的体积(vvol)确定,其中:在一些实施方式中,暴露于体液(例如胃肠液)的第一溶蚀材料层的总表面积(st),是由质量分数(mf),例如药物质量分数,以及第一溶蚀材料层的厚度确定,其中:在一些实施方案中,所述方法进一步包括:(i)确定所产生的剂型的释放曲线,例如药物释放曲线;(ii)比较剂型的释放曲线与目标释放曲线;和(iii)通过改变以下一种或多种参数来调整剂型的设计:第一溶蚀材料、第二材料、一个或多个第一溶蚀材料层的表面积、一个或多个第一溶蚀材料层的厚度、一个或多个第一溶蚀材料层中化合物(例如药物)的质量分数。在一些实施方案中,提供了用于口服药物剂型的三维(“3d”)打印的方法,所述口服药物剂型被配制和配置为提供药物目标释放曲线,其中所述药物剂型包括多层结构,所述多层结构包括多个具有预定的药物质量分数(mf)的混合有药物的第一溶蚀材料层,其中第一溶蚀材料嵌入未混合有所述药物的第二材料中,所述方法包括:(a)将药物目标释放曲线划分为多个时间间隔(tn),每个时间间隔对应于多层结构中的一层;(b)计算每个时间间隔内待释放药物的百分比(%l);(c)基于第一溶蚀材料的溶蚀速率(v)计算多层结构的各层的厚度(hn),其中hn=tn*v;(d)基于%l、hn、mf、口服药物剂型中的药物总量(mdtot)和第一溶蚀材料的密度(ρ)计算各层的表面积,其中:(e)基于所确定各层的hn和sn,打印混合有所述药物的第一溶蚀材料,从而打印所述多层结构;以及(f)在步骤(e)之前、之后或之中,打印未混合有所述药物的第二材料。在一些实施方案中,3d打印方法还包括在所述多层结构的顶部上打印未混合有所述药物的顶部溶蚀材料以形成顶层,其中所述顶层的表面积与紧邻所述顶层之下的所述多层结构的所述第一层相同或较大。在一些实施方案中,所述顶层的厚度基于所述药物从所述多层结构释放所需的延迟时间确定。在一些实施方案中,所述顶部溶蚀材料与所述第一溶蚀材料相同。在一些实施方案中,所述顶部溶蚀材料与所述第一溶蚀材料不同。在根据以上描述的任何一种3d打印方法的一些实施方案中,所述第二材料是可溶蚀的,并且可具有与所述第一溶蚀材料相同或不同的溶蚀速率。在其他实施方案中,所述第二材料是不能渗透体液的隔离材料,其中所述隔离材料在体液与多层结构的至少一部分之间形成屏障。在根据以上描述的任何一种3d打印方法的一些实施方案中,所述方法还包括打印不能渗透体液的隔离材料,其中所述隔离材料在体液与多层结构的至少一部分之间形成屏障。在根据以上描述的任何一种3d打印方法的一些实施方案中,所述方法还包括打印未混合有所述药物的中间材料,其中所述中间材料在两层或多层第一溶蚀材料之间形成一层或多层中间层。在一些实施方案中,所述中间与所述第一溶蚀材料相同。在一些实施方案中,所述中间层与所述第一溶蚀材料不同。在根据以上描述的任何一种3d打印方法的一些实施方案中,其中所述三维打印是通过诸如非线材fdm的熔融沉积成型(fdm)实现。在一些实施方案中,所述第一溶蚀材料和所述第二材料由不同的打印头打印。在一些实施方案中,所述第一溶蚀材料和所述顶部溶蚀材料由不同的打印头打印。在一些实施方案中,所述第一溶蚀材料、所述第二溶蚀材料(如果有的话)和隔离材料由不同的打印头打印。以上描述的任何一种3d打印方法,其进一步包括:i)确定通过以上描述的任何一种3d打印方法生产的所述口服药物剂型的药物释放曲线;ii)将所述口服药物剂型的药物释放曲线与药物目标释放曲线进行比较;iii)调整一个或多个参数,所述参数选自:所述第一溶蚀材料、所述第二材料、所述第一溶蚀材料的一层或多层的表面积、所述第一溶蚀材料的一层或多层的厚度、和所述第一溶蚀材料的一层或多层中所述药物的质量分数;以及iv)基于调整后的参数三维打印第二口服药物剂型。在根据以上描述的任何一种3d打印方法的一些实施方案中,其中所述口服药物剂型或第二药物口服剂型的释放曲线与基于chow’s方法或相似因子计算方法的目标释放曲线相同。在根据以上描述的任何一种3d打印方法的一些实施方案中,所述方法还包括在打印步骤之前创建药物剂型的虚拟图像,在打印步骤之前创建包含预定参数的计算机模型,和/或在打印步骤之前将预定参数输入到三维打印机。在根据以上描述的任何一种3d打印方法的一些实施方案中,所述多层结构中的所述第一溶蚀材料的多个层中的各层的表面积从所述口服剂型的表面到内部依序减小,其中当所述口服剂型暴露于体液时,所述多个层以顺序的方式暴露于体液,其中具有最大表面积的层首先暴露于体液。在根据以上描述的任何一种3d打印方法的一些实施方案中,所述口服药物剂型包括两个或多个多层结构。在一些实施方案中,提供了用于口服药物剂型的三维(“3d”)打印的方法,所述口服药物剂型被配制和配置为提供第一药物目标释放曲线和第二药物目标释放曲线,其特征在于,所述口服药物剂型包括第一多层结构和第二多层结构,所述第一多层结构包括多个具有预定的药物质量分数mf的混合有药物的第一溶蚀材料层,其中所述第一溶蚀材料嵌入未混合有第一药物的第二材料中,所述第二多层结构包括多个具有预定的药物质量分数的混合有第二药物的第三溶蚀材料,其中所述第三溶蚀材料嵌入未混合有所述药物的第四材料中,所述方法包括:(a)将各个药物目标释放曲线划分为多个时间间隔(tn),每个时间间隔对应于相应多层结构中的一层;(b)计算每个时间间隔内待释放药物的百分比(%l);(c)基于第一溶蚀材料或第三溶蚀材料的溶蚀速率(v)计算多层结构的各层的厚度(hn),其中hn=tn*v;(d)基于%l、hn、mf、口服药物剂型中的药物总量(mdtot)和第一或第一溶蚀材料的密度(ρ)计算各层的表面积,其中:(e)基于所确定的各层的hn和sn,打印混合有所述第一药物的第一溶蚀材料和混合有所述第二药物的第三溶蚀材料,从而打印两个多层结构;以及(f)在步骤(e)之前、之后或之中,打印未混合有药物的第二材料和第四材料。在一些实施方案中,所述第一溶蚀材料和所述第三溶蚀材料是相同的。在一些实施方案中,所述第二材料和所述第四材料是相同的。在一些实施方案中,所述第一药物和所述第二药物是相同的。在一些实施方案中,所述第一药物和所述第二药物是不同的。在其他方面,本公开提供的剂型,例如口服剂型,可根据本文所述任何一种方法制备。在一些实施方式中,该剂型例如药物剂型,进一步的包括肠溶包衣。本公开中的这些或其他方面的优势将在随后的说明书和所附权利要求中明显体现。本公开中所述的各种实施方式中一个、一些或全部特征可以组合形成其他的实施方式。附图说明图1示出了示例性示意图100,用于设计可实现药物的目标释放曲线105的药物剂型160。图2a-2c显示用于实现药物的目标释放曲线的示例性药物剂型200、240、265。图2a示出了示例性剂型200的横截面图。图2b和图2c示出了具有图2a中所示横截面的示例性药物剂型240、265的外部视图。图3a-3b显示了示例性的药物剂型300。图3a显示示例性药物剂型300的外部视图,其具有半透明图示的组件以清楚显示药物剂型的内部特征。图3b显示了示例性药物剂型300的横截面图。图4a-4c显示用于实现药物的目标释放曲线的示例性药物剂型400、425。图4a示出了示例性剂型400的横截面图。图4b示出了示例性剂型425的横截面图。图4c示出了具有图4b中所示横截面的示例性药物剂型425的外部视图。图5显示用于实现药物的目标释放曲线的示例性药物剂型500的横截面图。图6显示用于实现药物的目标释放曲线的示例性药物剂型600的横截面图。图7示出了用于调整与药物混合的溶蚀材料层的技术方案的示意图。图8a-8b显示了示例性的药物剂型800。图8a显示示例性药物剂型800的外部视图,其具有半透明图示的组件以清楚显示药物剂型的内部特征。图8b示出了示例性剂型800的横截面图。图9a-9b显示示例性药物剂型900。图9a显示示例性药物剂型900的外部视图,其具有半透明图示的组件以清楚显示药物剂型的内部特征。图9b示出了示例性剂型900的横截面图。图10显示的是一例药物的目标释放曲线图(药物释放(%)对时间(小时))的图。具体实施方式本申请提供了例如药物剂型的三维打印的制造方法,所述方法包含多层结构,所述多层结构包含多个与药物混合的第一溶蚀材料层,其中所述与药物混合的第一溶蚀材料的溶蚀与药物从药物剂型释放的速率相关。使用本文公开的方法,可以基于控制各种参数使药物剂型(例如口服药物剂型或植入药物剂型)实现任何的药物目标释放曲线,所述参数包括与药物混合的第一溶蚀材料层的厚度、第一溶蚀材料层的表面积和第一溶蚀材料层的药物质量分数。可实现一种或多种药物的目标释放曲线的药物剂型可以容易地使用三维打印技术来设计和打印。这样的药物剂型可以设计成例如改善治疗功效、降低毒性和增加患者依从性。本文还提供了基于溶出曲线(诸如体外溶出曲线)进行校准(例如调整)的方法,以提高实验得出的释放曲线与目标释放曲线的相似性。尽管本申请的许多内容讨论了药物剂型,例如口服药物剂型或植入药物剂型,但是本领域普通技术人员将容易理解,本公开内容也适用于并且涉及被配置和配制为用于提供任何化合物的目标释放曲线的其他剂型,例如,经配置和配制以提供目标试剂释放曲线的包含试剂(reagent)的剂型(即试剂剂型)。因此,在某些方面,本发明提供了剂型,例如药物剂型或试剂剂型,其被配置为提供化合物(例如,药物)或试剂的目标释放曲线,以及其设计方法和3d打印的方法,其中剂型包括多层结构,所述多层结构包括多个混合有化合物(例如,药物)或试剂的第一溶蚀材料层,其中第一溶蚀材料嵌入未混合有化合物(例如药物)或试剂的第二材料中。定义在本文中,术语“包括”及其语法上的同义词用于表示其他组分、成分、步骤等也是选择性存在的。例如,一个“包括”组分a、b和c的物件可以由(即仅由)a、b和c组成,也可以除了a、b和c还含有一种或多种其他组分。“包括”及其语法上同义词包括了“由……组成”和“主要由……组成”。当提供了数值的范围时,应当理解的是,该范围的上限和下限之间的每个居间值(除非上下文明确地另有说明,否则直至下限单位的十分之一),和位于该指定的范围内的任何其它指出的值或居间值,都包含在本公开内,受到所述范围内任何特定排除的限值的约束。在该指定范围包括一个或两个限值的情况下,排除任一个或两个那些包括的限值的范围也包含在本公开内。本文中提及“约”某个数值或参数包括(并描述)针对该数值或参数本身的变化。例如,提及“约x”的描述包括对“x”的描述。如本文和所附权利要求中所使用的,单数形式“一个”,“或”和“该”包括复数指代物,除非上下文另有明确指示。本文所用术语“个体”指哺乳动物,包括但不限于人类、牛科动物、马科动物、猫科动物、犬科动物、啮齿类动物或灵长类动物。在一些实施方式中,个体指人类。本文在多层结构的上下文中描述的术语“层”是指所述多层结构中的多个层之一,在剂型设计过程中确定或预先确定层的厚度。在逐层3d打印过程中,多层结构中的层的厚度可以与单元沉积层的厚度相同或不同。在本文的实施例中,使用特定的数学方程不希望对药物剂型或其材料的特征的确定有所限制,并且应认识到其他手段也可用于设计实现目标释放曲线的药物剂型,例如通过数学方程、或变量来获得药物剂型或其材料的参数。设计剂型的方法本公开提供了设计可实现化合物(例如药物)的目标释放曲线的剂型(例如口服药物剂型、植入剂型或试剂剂型)的方法,其中剂型包括多层结构,所述多层结构包含多个与化合物(例如药物)混合的第一溶蚀材料层,其中所述第一溶蚀材料嵌入未与化合物(例如药物)混合的第二材料中。如图1的示意图100所示,设计可实现目标释放曲线的剂型(例如口服药物剂型)的多个步骤和途径。本文公开的方法可以通过可能的设计限制来指导,例如,预先选择与药物混合的第一溶蚀材料130,或预先选择与药物混合的第一溶蚀材料层的厚度125(图1)。基于本文中的公开内容,本领域普通技术人员可理解步骤之间的关系,并且在一系列情况下,理解设计可实现药物的目标释放曲线的方法。在一些实施方案中,可实现目标释放曲线的剂型(例如口服药物剂型)包含多层结构,所述多层结构包含多个与化合物(例如药物)混合的第一溶蚀材料层,其中所述第一溶蚀材料嵌入不与药物混合的第二材料中,设计该剂型的方法包括:(a)选择所述第一溶蚀材料和所述第二材料以形成所述多层结构;(b)获得第一溶蚀材料的溶蚀速率;和(c)基于化合物(例如药物)的释放速率和目标释放曲线,确定每层的厚度、表面积和/或质量分数(例如药物质量分数)。在一些实施例中,所述多层结构进一步包括多个由与例如第二药物混合的第三溶蚀材料形成的第二层,其中所述方法进一步包括:确定第二药物从第三溶蚀材料中释放的速率;并且基于第二药物的释放速率和目标释放曲线,来确定每个第二层的厚度、表面积和/或质量分数(例如药物质量分数)。如图1所示,在一些实施方案中,设计可实现药物的目标释放曲线的药物剂型的方法包括,获得(例如,选择)药物的目标释放曲线105。在一些实施方案中,所述方法包括将药物的目标释放曲线分成时间间隔110(例如,基于药物剂型中与药物混合的第一溶蚀材料的层数),然后确定在所述时间间隔内总药物的释放分数115。在一些实施例中,该方法包括通过所述时间间隔以及选择与药物混合的第一溶蚀材料130,来确定与药物混合的第一溶蚀材料的溶蚀速率120以及与药物混合的第一溶蚀材料层的厚度125。在一些实施例中,该方法包括通过时间间隔内释放的总药物分数以及与药物混合的第一溶蚀材料层的厚度,来确定与药物混合的第一溶蚀材料层的表面积140和与药物混合的第一溶蚀材料层的药物质量分数135。在一些实施例中,该方法还包括确定间隔层的厚度和表面积145。在一些实施例中,该方法还包括选择隔离材料150。在一些实施方案中,本文所述的方法可用于设计包含多层结构的药物剂型,所述多层结构包含多个与药物混合的第一溶蚀材料层,其中所述第一溶蚀材料嵌入第二材料,其中所述多个层包括第一层和第二层,其中所述第一层将先于所述第二层暴露于体液,并且其中所述第一层的表面积大于所述第二层的表面积(例如图2a)。在一些实施例中,第二层放在适当的位置,使得当第一层溶蚀后,第二层的完整表面区域暴露于体液(例如图2a,220)。在一些实施方案中,药物剂型可以包含两个或更多个由与药物混合的第一溶蚀材料形成的多层,其中每个多层包含第一层和第二层,其中第一层将先于第二层暴露于体液,并且其中第一层的表面积大于第二层(例如图4a)。在一些实施方式中,本公开所述的口服药物剂型的设计方法可全部或部分地在计算机系统上进行。在一些实施方式中,所述计算机系统包含用户界面。在一些实施方式中,所述方法包含将口服药物剂型的一个或多个参数输入到计算机系统中。在一些实施方式中,所述计算机系统用于计算口服药物剂型的参数以实现药物的目标释放曲线。在一些实施方式中,所述计算机系统包含三维绘图软件。在一些实施方式中,所述计算机系统基于口服药物剂型的预定参数来创建口服药物剂型的三维图。在一些实施方式中,所述计算机系统包含切片软件。在一些实施方式中,所述计算机系统用于将口服药物剂型的三维图转换成三维打印代码,例如g代码。在一些实施方式中,所述计算机系统执行三维打印代码,从而打印出口服药物剂型。a.目标释放曲线本文公开的对于可实现化合物(例如药物)的目标释放曲线的剂型(例如口服药物剂型)的设计方法,可用于设计实现任意释放曲线的剂型。在一些实施方案中,药物的目标释放曲线包括,给药后或药物开始从药物剂型(例如,肠溶包衣的口服药物剂型)释放后,在对应时间点药物从药物剂型中释放的分数或百分数(即,累积百分数)。在一些实施方案中,药物的目标释放曲线包括药物从释放介质释放的实际量或浓度。在一些实施方案中,可实现药物的目标释放曲线的药物剂型包含多层结构,所述多层结构包含多个与药物混合的第一溶蚀材料层,其中所述第一溶蚀材料嵌入不与药物混合的第二材料中,设计该剂型的方法包括获得或选择药物剂型的药物目标释放曲线。在一些实施方案中,药物的目标释放曲线是预先设定的。在一些实施方案中,药物剂型包含两种或更多种药物,诸如约5种或更多、约10种或更多、约20种或更多、约30种或更多、或约50种或更多中的任何一种,其中每种药物皆有目标释放曲线。在一些实施方案中,药物剂型包含两种或更多种药物,其中至少两种药物的目标释放曲线不同。在一些实施方案中,一旦将包含药物的第一溶蚀材料层暴露于溶液(诸如体液,具体例如胃肠(gi)液)中,药物将开始从药物剂型中释放。在一些实施方案中,药物剂型的药物目标释放曲线是指从口服给药起、直到药物剂型中所包含的药物完全释放的时间段。在一些实施方案中,药物的目标释放曲线包括在药物目标释放时间段之前有一段初始延迟释放时间,其中初始延迟释放时间是患者特异性时间段或估计的时间段,例如由于使用肠溶性包衣的口服剂型导致的延迟释放。在一些实施方案中,药物剂型的药物目标释放曲线包括零级释放曲线、一级释放曲线、延迟释放曲线、脉冲释放曲线、多个脉冲释放曲线、速释曲线、缓释曲线中的一种或者组合。在一些实施方案中,剂型的目标释放曲线的总时间为约1小时至约12个月。在一些实施方案中,剂型的目标释放曲线的总时间大于约1小时、6小时、12小时、24小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、20天、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月或12个月中的任何一个。在一些实施方案中,剂型的目标释放曲线的总时间为约1小时、6小时、12小时、24小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、20天、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月或者12个月中的任何一个。在一些实施方案中,药物剂型的药物目标释放曲线的总时间为约1小时至约72小时,例如约1小时至约6小时、约1小时至约12小时、约1小时至约18小时、约1小时至约24小时、约1小时至约30小时、约1小时至约36小时、约1小时至约42小时、约1小时至约48小时、约1小时至约54小时、约1小时至约60小时或约1小时至约66小时中的任何一个。在一些实施方案中,药物剂型的药物目标释放曲线的总时间为约1小时、2小时、3小时、6小时、8小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时、24小时、26小时、28小时、30小时、32小时、34小时、36小时、40小时、42小时、44小时、46小时、48小时、50小时、52小时、54小时、56小时、58小时、60小时、62小时、64小时、66小时、68小时、70小时或72小时中的任何一个。在一些实施方案中,药物剂型的药物目标释放曲线的总时间大于或约6小时、大于或约12小时、大于或约18小时、大于或约24小时、大于或约30小时、大于或约36小时、大于或约42小时、大于或约48小时、大于或约54小时、大于或约60小时、大于或约66小时、大于或约72小时。在一些实施方案中,药物剂型的药物目标释放曲线的总时间小于或约6小时、小于或约12小时、小于或约18小时、小于或约24小时、小于或约30小时、小于或约36小时、小于或约42小时、小于或约48小时、小于或约54小时、小于或约60小时、小于或约66小时、小于或约72小时。如图1的示意图100所示,药物的目标释放曲线105可以提供关于药物目标释放曲线的一个或多个时间间隔(te)110以及在每个时间间隔内药物释放量占的总药量的分数或百分数115的信息。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括:获得或选择一个或多个时间点,在药物目标释放曲线的至少一部分时间内形成一个或多个时间间隔;从而在每个时间间隔内获得对应的从药物剂型释放的总药物分数。本文公开的方法中使用的时间点可以具有任何合适的单位,例如秒、分钟和/或小时。在一些实施方案中,在药物目标释放曲线的时间内的一个或多个时间点是基于均匀的时间间隔(例如,在给药后或药物开始释放后的1小时、2小时和3小时)、非均匀的时间间隔(例如,在给药后或药物开始释放后1、2、4和8小时)或其组合。在一些实施方案中,药物目标释放曲线的时间内的时间点在约5分钟、10分钟、15分钟、20分钟、30分钟、45分钟、60分钟、90分钟、120分钟、180分钟、240分钟、300分钟或360分钟中的任一种。在一些实施方案中,药物目标释放曲线的时间内的时间点约为15分钟、30分钟、45分钟、60分钟、90分钟、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时或24小时中的任一种。在一些实施例中,时间点的数量以及时间间隔是基于药物剂型中与药物混合的第一溶蚀材料层的层数。在一些实施方案中,时间点或时间间隔的数量在约1至约100之间,诸如在约1至约5、约5至约10、约10至约15、约5至约20、约10至约20、约15至约20、约5至约50、或约10至约100中的任一种。在一些实施方案中,时间点或时间间隔的数目约为1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、25个、30个、35个、40个、45个、50个、75个或100个中的任一个。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括:获得或选择一个或多个在药物目标释放曲线期间从药物剂型释放的总的药物分数;随后获得与每个总的药物释放分数相对应的药物目标释放曲线上的时间点和/或时间间隔。在本文公开的方法中使用的一个或多个释放的药物总量的分数或百分数可以是任何合适的大小,例如十分之一或整数值。在一些实施方案中,释放的总药物的分数或百分比基于均匀分数或百分比(例如,所有百分比是单一值)、非均匀分数或百分比(例如,包括增加百分比值)或其组合。在一些实施方案中,所述一个或多个分数或百分数的数目基于药物剂型中的与药物混合的第一可溶蚀材料层的层数。在一些实施方案中,一个或多个分数或百分数的数量在约1至约100之间,例如在约1至约5、约5至约10、约10至约15、约5至约20、约10至约20、约15至约20、约5至约500、或约10至约100的任一个。在一些实施方案中,一个或多个部分的分数或百分数的数目是约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、75或100中的任一个。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括评估药物剂型的体外溶出速率。在一些实施方式中,药物剂型的药物目标释放曲线与该药物剂型的体外溶出速率相似,比如等同或生物等效。在一些实施方式中,药物剂型的药物目标释放曲线与该药物剂型的体内药物释放曲线相似,比如等同或生物等效。在一些实施方案中,药物剂型的体内药物释放曲线基于评估药物剂型的体外溶出速率。在一些实施方案中,药物剂型的药物目标释放曲线与参比药物释放曲线相似,比如等同或生物等效。体外溶出试验和溶出相似性评价的方法在本行业众所周知,美国食品和药品管理局针已针对这些方法提供了行业指导(见行业指导;速释口服固体制剂溶出度测定;cder;1997年8月)。用于体外溶出测试的方法包括对数曲线法、概率单位法、指数模型法、weibull法和gompertz法。用于确定两种溶出曲线(例如实验确定的溶出曲线和药物目标释放曲线)的溶出相似性的统计分析方法包括回归分析、anova、相似因子方法、变异系数方法、splitpolt方法和chow's方法。在一些实施方案中,采用相似因子法评估溶出相似性。在一些实施方案中,使用chow's方法评估溶出相似性。b.与化合物混合的第一溶蚀材料本公开提供了剂型(例如口服药物剂型)的设计方法,所述剂型包含多层结构,该多层结构包含多个与化合物(例如药物或试剂)混合的第一溶蚀材料层,其中所述剂型可实现所述化合物(例如药物或试剂)的目标释放曲线。在一些实施方案中,与药物混合的第一溶蚀材料层的溶蚀与药物从药物剂型的释放速率相关。在一些实施方案中,对于可用于实现药物的目标释放曲线的药物剂型的设计包括控制与药物混合的第一溶蚀材料层的各种参数,例如第一溶蚀材料(其具有诸如溶蚀速率的特点)的种类、与药物混合的第一溶蚀材料层的厚度、与药物混合的第一溶蚀材料层的表面积、以及与药物混合的第一溶蚀材料层的药物质量分数。如图1的示意图100所示,以下参数存在关系:与药物混合的第一溶蚀材料层溶蚀一层的时间间隔(te)110,与药物混合的溶蚀材料层的溶蚀速率120和与药物混合的溶蚀材料层的厚度125。在一些实施方案中,所述关系可以用式i表示:其中ve是溶蚀材料(例如一层与药物混合的第一溶蚀材料)溶蚀一层的速率,h是溶蚀材料层的厚度,按照首先暴露于溶出介质的表面开始溶蚀的方向进行测量,te是溶蚀可溶蚀材料层的时间间隔。如图1的示意图100所示,设计可实现药物目标释放曲线的药物剂型可以包括以下不同的途径:选择与药物混合的第一溶蚀材料(其具有溶蚀速率120)130、以及与药物混合的第一溶蚀材料层的厚度125。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括:基于一层与药物混合的第一溶蚀材料层的假设溶蚀速率或合适的假设溶蚀速率范围(例如根据药物剂型尺寸大小特征来决定),来选择与药物混合的第一溶蚀材料。在一些实施方案中,与药物混合的溶蚀材料的厚度是依据所选择的与药物混合的第一溶蚀材料的溶蚀速率。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括:基于与药物混合的第一溶蚀材料层的假设厚度或合适的假设厚度的范围(诸如预先设定的厚度或厚度范围),来选择与药物混合的第一溶蚀材料。在一些实施方案中,与药物混合的溶蚀材料的厚度是依据所选择的与药物混合的第一溶蚀材料的溶蚀速率。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括:基于预先确定与药物混合的第一材料,来确定与药物混合的第一材料层的厚度,其中所述与药物混合的第一材料具有溶蚀速率。在一些实施方式中,对于可实现药物目标释放曲线的药物剂型的设计方法包括:基于与药物混合的第一溶蚀材料的溶蚀速率和/或与药物混合的第一溶蚀材料层的厚度,来调整与药物混合的第一溶蚀材料层溶蚀的时间间隔。i.第一溶蚀材料本公开提供了设计剂型(例如口服药物剂型)的方法,所述剂型包含多层结构,该多层结构包含多个与化合物(例如药物)混合的第一溶蚀材料层。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择与药物混合的第一溶蚀材料。在一些实施方案中,需预先确定与药物混合的第一溶蚀材料。在一些实施方案中,所述可溶蚀材料包含一种热塑性材料。在一些实施方案中,所述可溶蚀材料是一种热塑性材料。在一些实施方案中,所述可溶蚀材料是可食用的(如个体可消化)。在一些实施方案中,所述可溶蚀材料是生物相容性的(如适用于植入剂)。在一些实施方案中,所述热塑性材料选自亲水性聚合物、疏水性聚合物、可溶胀聚合物、非溶胀聚合物、多孔聚合物、无孔聚合物、可溶蚀聚合物(例如可溶解聚合物)、ph敏感聚合物,天然聚合物(例如虫胶)、蜡状材料中的一种或组合。在一些实施方案中,所述热塑性材料选自聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物57/30/13、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(pvp-va)、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(pvp-va)60/40、聚乙烯基吡咯烷酮(pvp)、聚乙酸乙烯酯(pvac)和聚乙烯基吡咯烷酮(pvp)80/20、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(va64)、聚乙二醇-聚乙烯醇接枝共聚物25/75、kollicoatir-聚乙烯醇60/40、聚乙烯醇(pva或pv-oh)、聚(乙酸乙烯酯)(pvac)、聚(任选烷基-、甲基-或乙基-)丙烯酸酯、甲基丙烯酸酯共聚物、乙基丙烯酸酯共聚物、甲基丙烯酸丁酯-甲基丙烯酸(2-二甲基氨基乙基)酯-甲基丙烯酸甲酯共聚物1:2:1、甲基丙烯酸二甲基氨基乙酯-甲基丙烯酸酯共聚物、丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酸三甲基铵乙酯氯化物共聚物、丙烯酸甲酯-甲基丙烯酸甲酯-甲基丙烯酸共聚物7:3:1、甲基丙烯酸-甲基丙烯酸甲酯共聚物1:2、甲基丙烯酸-乙基丙烯酸酯共聚物1:1、甲基丙烯酸-甲基丙烯酸甲酯共聚物1:1、聚环氧乙烷(peo)、聚乙二醇(peg)、超支化聚酰胺酯、羟丙基甲基纤维素邻苯二甲酸酯、羟丙甲纤维素邻苯二甲酸酯、羟丙基甲基纤维素或羟丙甲纤维素(hmpc)、羟丙基甲基纤维素乙酸琥珀酸酯或羟丙甲纤维素琥珀酸酯(hpmcas)、丙交酯-乙交酯共聚物(plga)、卡波姆、乙烯-乙酸乙烯酯共聚物、聚乙烯(pe)和聚己内酯(pcl)、纤维素或纤维素衍生物、羟丙基纤维素(hpc)、聚氧乙烯40氢化蓖麻油、甲基纤维素(mc)、乙基纤维素(ec)、泊洛沙姆、邻苯二甲酸羟丙基甲基纤维素(hpmcp)、泊洛沙姆、氢化蓖麻油和大豆油、棕榈酸硬脂酸甘油酯、巴西棕榈蜡、聚乳酸(pla)、聚乙醇酸(pga)、乙酸丁酸纤维素(cab)、胶体二氧化硅、糖类、葡萄糖、聚醋酸乙烯邻苯二甲酸酯(pvap)、蜡、蜂蜡、水凝胶、明胶、氢化植物油、聚乙烯缩乙醛二乙胺醋酸酯(aea)、石蜡、虫胶、海藻酸钠、邻苯二甲酸醋酸纤维素(cap)、脂肪油、阿拉伯树胶、黄原胶、单硬脂酸甘油酯、硬脂酸中的一种或组合。在一些实施方案中,所述可溶蚀材料包含一种非热塑性材料。在一些实施方案中,所述溶蚀材料是一种非热塑性材料。在一些实施方案中,所述非热塑性材料选自淀粉、预胶化淀粉、羟基乙酸淀粉钠(cms-na)、蔗糖、糊精、乳糖、微晶纤维素(mcc)、甘露醇、硬脂酸镁(ms)、粉末状硅胶、海藻酸钠、二氧化钛、甘油、糖浆、卵磷脂、大豆油、茶油、乙醇、丙二醇、甘油、吐温、动物脂肪、硅油、可可脂、脂肪酸甘油酯、凡士林、壳聚糖、鲸蜡醇、硬脂醇中的一种或组合。在一些实施方案中,所述可溶蚀材料包含一种增塑剂。在一些实施方案中,所述增塑剂包含聚氧乙烯-聚氧丙烯嵌段共聚物、维生素e聚乙二醇琥珀酸酯、羟基硬脂酸酯、聚乙二醇(诸如peg400)、聚乙二醇十六十八烷基醚12、聚乙二醇20十六十八醇醚、聚山梨醇酯20、聚山梨醇酯60、聚山梨醇酯80、醋精、乙酰化柠檬酸三乙酯、柠檬酸三丁酯、乙酰化柠檬酸三丁酯、柠檬酸三乙酯、聚氧乙烯15羟基硬脂酸酯、聚乙二醇-40氢化蓖麻油、聚氧乙烯35蓖麻油、癸二酸二丁酯、邻苯二甲酸二乙酯、甘油、4-羟基苯甲酸甲酯、丙三醇、蓖麻油、油酸、甘油三乙酸酯或聚亚烷基二醇。在一些实施方案中,当药物剂型在个体中时,与药物混合的第一溶蚀材料基本溶蚀(基本完全溶蚀或基本完全溶解)。在一些实施方案中,当药物剂型在个体中时,与药物混合的第一溶蚀材料基本上全部溶蚀。在一些实施方案中,当药物剂型在个体中时,与药物混合的第一溶蚀材料在目标时间范围内基本上全部溶蚀。在一些实施方案中,在药物剂型中与药物混合的第一溶蚀材料在小于约72小时内基本上全部溶蚀,例如小于约66小时、60小时、54小时、48小时、42小时、36小时、30小时、24小时、18小时、12小时、10小时、9小时、8小时、7小时、6小时、5小时、4小时、3小时、2小时、1小时或30分钟中的任何一个。在一些实施方案中,在药物剂型中与药物混合的第一溶蚀材料在约72小时内基本上全部溶蚀,例如约66小时、60小时、54小时、48小时、42小时、36小时、30小时、24小时、18小时、12小时、10小时、9小时、8小时、7小时、6小时、5小时、4小时、3小时、2小时、1小时或30分钟中的任何一个。在一些实施方案中,与药物混合的第一溶蚀材料的溶蚀速率在约0.1毫米/小时至约4毫米/小时之间。在一些实施方案中,与药物混合的第一溶蚀材料的溶蚀速率大于约0.1毫米/小时,例如大于约0.2毫米/小时、0.3毫米/小时、0.4毫米/小时、0.5毫米/小时、0.6毫米/小时、0.7毫米/小时、0.8毫米/小时、0.9毫米/小时、1.0毫米/小时、1.1毫米/小时、1.2毫米/小时、1.3毫米/小时、1.4毫米/小时、1.5毫米/小时、1.6毫米/小时、1.7毫米/小时、1.8毫米/小时、1.9毫米/小时、2.0毫米/小时、2.1毫米/小时、2.2毫米/小时、2.3毫米/小时、2.4毫米/小时、2.5毫米/小时、2.6毫米/小时、2.7毫米/小时、2.8毫米/小时、2.9毫米/小时、3.0毫米/小时、3.1毫米/小时、3.2毫米/小时、3.3毫米/小时、3.4毫米/小时、3.5毫米/小时、3.7毫米/小时、3.8毫米/小时、3.9毫米/小时或4.0毫米/小时中的任何一个。在一些实施方案中,与药物混合的第一溶蚀材料的溶蚀速率小于约0.1毫米/小时,例如小于约0.2毫米/小时、0.3毫米/小时、0.4毫米/小时、0.5毫米/小时、0.6毫米/小时、0.7毫米/小时、0.8毫米/小时、0.9毫米/小时、1.0毫米/小时、1.1毫米/小时、1.2毫米/小时、1.3毫米/小时、1.4毫米/小时、1.5毫米/小时、1.6毫米/小时、1.7毫米/小时、1.8毫米/小时、1.9毫米/小时、2.0毫米/小时、2.1毫米/小时、2.2毫米/小时、2.3毫米/小时、2.4毫米/小时、2.5毫米/小时、2.8毫米/小时、2.9毫米/小时、3.0毫米/小时、3.1毫米/小时、3.2毫米/小时、3.3毫米/小时、3.4毫米/小时、3.5毫米/小时、3.7毫米/小时、3.8毫米/小时、3.9毫米/小时或4.0毫米/小时中的任何一个。在一些实施方案中,与药物混合的第一溶蚀材料的溶蚀速率为约0.1毫米/小时、0.2毫米/小时、0.3毫米/小时、0.4毫米/小时、0.5毫米/小时、0.6毫米/小时、0.7毫米/小时、0.8毫米/小时、0.9毫米/小时、1.0毫米/小时、1.1毫米/小时、1.2毫米/小时、1.3毫米/小时、1.4毫米/小时、1.5毫米/小时、1.6毫米/小时、1.7毫米/小时、1.8毫米/小时、1.9毫米/小时、2.0毫米/小时、2.1毫米/小时、2.2毫米/小时、2.3毫米/小时、2.4毫米/小时、2.5毫米/小时、2.6毫米/小时、2.7毫米/小时、2.8毫米/小时、2.9毫米/小时、3.0毫米/小时、3.1毫米/小时、3.2毫米/小时、3.3毫米/小时、3.4毫米/小时、3.5毫米/小时、3.7毫米/小时、3.8毫米/小时、3.9毫米/小时或4.0毫米/小时中的任何一个。在一些实施例中,第一溶蚀材料适合与药物混合。在一些实施例中,第一溶蚀材料与药物不发生化学反应。在一些实施方案中,溶蚀材料的选择是基于其与药物的混合的适合性。在一些实施例中,第一溶蚀材料的选择是基于其与药物不发生化学反应。ii.溶蚀速率在一些实施方案中,对于可实现目标释放曲线(例如药物的目标释放曲线)的剂型(例如口服药物剂型)的设计方法包括获得(例如确定)可溶蚀材料(例如与药物混合的第一溶蚀材料)的溶蚀速率(ve)。可以通过本领域已知的方法或者例如本文公开的方法获得(诸如测定或测量)溶蚀材料的溶蚀速率。在一些实施方案中,可以使用式i获得可溶蚀材料(例如与药物混合的第一溶蚀材料层)的溶蚀速率(ve)。在一些实施方案中,获得与药物混合的第一溶蚀材料的溶蚀速率(ve)包括使用染料如亚甲蓝粉末来指示特定厚度的第一溶蚀材料何时被溶蚀,从而释放染料进入溶液(如溶出介质)。在一些实施方案中,溶出介质复制了体内条件。在一些实施方案中,溶出介质选自盐酸缓冲液、酸性邻苯二甲酸缓冲液、中性邻苯二甲酸缓冲液、磷酸盐缓冲液、碱性硼酸盐缓冲液、乙酸盐缓冲液、模拟肠液、模拟胃液中的一种以及组合。在一些实施方案中,溶出介质被搅拌或搅动。在一些实施方案中,溶出介质维持在约37℃的温度。例如,如果与药物混合的第一溶蚀材料一层厚度为1毫米(按照从暴露于溶出介质的可溶蚀材料顶表面直至含有染料的底的方向进行测量),其在2小时内溶蚀并释放染料到溶出介质中,则与药物混合的第一溶蚀材料的溶蚀速率(ve)为0.5毫米/小时。在一些实施方式中,获得与药物混合的第一溶蚀材料的溶蚀速率包括获得与替代药物混合的第一材料的溶蚀速率。在一些实施方案中,替代药物和药物具有一种或多种相似的化学性质,例如分子量、亲水性、疏水性、官能团和/或核心结构。在一些实施方案中,式i可用于获得与药物混合的第一溶蚀材料的溶蚀速率(ve),其中药物与溶蚀材料均匀混合。在一些实施方案中,式i可用于获得与药物混合的第一溶蚀材料的溶蚀速率(ve),其中相对于溶蚀材料的厚度,药物形成基本上与溶蚀材料的厚度一致的梯度。在一些实施方案中,与药物混合的第一溶蚀材料的溶蚀速率(ve)可以通过式ii,从第一时间点(t1)和随后的第二时间点(t2)中获得:其中h是溶蚀材料在溶蚀前的厚度,%t1是在t1时药物在溶液中的百分数(以小数形式),%t2是在t2时药物在溶液中的百分数(以小数形式)。在一些实施方案中,在一个时间点取出一定体积的溶出介质以测定药物在溶液中的量之后,会加入溶出介质以补充因取样损失的溶液体积。在一些实施方案中,式ii可以用于获得与药物混合的第一溶蚀材料的溶蚀速率(ve),其中药物与第一溶蚀材料混合均匀。在一些实施方案中,与药物和/或另一种非药物试剂混合的第一溶蚀材料与未与药物混合的第一溶蚀材料相比,溶蚀速率发生改变。例如,相比于未与药物混合的第一溶蚀材料,与第一溶蚀材料混合的药物性质和/或药物质量(例如高药物质量分数)可能改变与药物混合的第一溶蚀材料的溶蚀速率。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括获得(例如确定或测量)混合有多种药物量的第一材料的溶蚀速率。在一些实施例中,与药物混合的第一溶蚀材料的溶蚀速率与未与药物混合的第一溶蚀材料相同。在一些实施例中,与药物混合的第一溶蚀材料的溶蚀速率与未与药物混合的第一溶蚀材料不同。在一些实施方案中,获得溶蚀材料(例如与药物混合的第一溶蚀材料)的溶蚀速率包括对溶蚀材料进行多次评估,例如以不同厚度、相同和不同溶出介质进行评估。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括创建包含与药物混合的第一溶蚀材料的至少一个性质(例如溶蚀速率)的数据库。在一些实施方案中,所述至少一种性质包括与药物混合的第一溶蚀材料的溶蚀速率。在一些实施方案中,可以从本领域技术或数据库中获得与药物混合的第一溶蚀材料的溶蚀速率。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括从数据库获得与药物混合的第一溶蚀材料的溶蚀速率(ve)。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括从数据库中选择与药物混合的第一溶蚀材料。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择与药物混合的第一溶蚀材料,其中第一溶蚀材料的选择基于第一溶蚀材料的性质或与药物混合的第一溶蚀材料的性质。在一些实施例中,选择与药物混合的第一溶蚀材料是基于与药物混合的第一溶蚀材料的溶蚀速率。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括基于与药物混合的第一溶蚀材料层的假设溶蚀速率或假设溶蚀速率的范围来选择与药物混合的第一溶蚀材料。在一些实施例中,与药物混合的第一溶蚀材料的假设溶蚀速率或假设溶蚀速率范围是基于可实现药物目标溶出曲线的适宜溶蚀速率。在一些实施方案中,与药物混合的第一溶蚀材料的假设溶蚀速率或假设溶蚀速率范围是基于使溶蚀速率与药物剂型的尺寸大小相关联。在一些实施方案中,与药物混合的第一溶蚀材料的假设溶蚀速率或假设溶蚀速率范围是基于使溶蚀速率根据药物剂型的尺寸大小(例如药物剂型的最大尺寸)满足式i。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括从具有满足假设的目标特性的属性的多种与药物混合的溶蚀材料中,选择与药物混合的第一溶蚀材料。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括使用预先确定的与药物混合的第一溶蚀材料。iii.厚度在一些实施方案中,对于可实现目标释放曲线(例如药物的目标释放曲线)的剂型(例如药物剂型)的设计方法包括获得(例如确定)溶蚀材料(例如与药物混合的第一种溶蚀材料)的厚度。在一些实施方案中,基于式i,溶蚀材料层(例如与药物混合的第一溶蚀材料)的厚度(h)可通过式iii得到:h=te×ve,式iii,其中所述te是溶蚀材料层的总溶蚀时间,所述ve是溶蚀材料的溶蚀速率。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括基于与药物混合的第一材料确定与药物混合的第一材料层的厚度,其中所述与药物混合的第一材料具有溶蚀速率。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括基于预先确定的与药物混合的第一材料来确定与药物混合的第一材料层的厚度,其中与药物混合的第一材料具有溶蚀速率。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括基于与药物混合的第一可溶蚀材料层的假设厚度或合适的假设厚度的范围(例如预定的厚度或厚度范围)来选择与药物混合的第一溶蚀材料。在一些实施例中,与药物混合的第一溶蚀材料层的假设厚度被用来获得与药物混合的第一溶蚀材料的假设溶蚀速率。在一些实施方案中,假设溶蚀速率随后被用来选择与药物混合的第一溶蚀材料,其中所述与药物混合的第一溶蚀材料具有溶蚀速率。在一些实施例中,与药物混合的第一溶蚀材料的假设溶蚀速率和溶蚀速率相同。在一些实施例中,与药物混合的第一溶蚀材料的假设溶蚀速率和溶蚀速率不同。在一些实施方案中,与药物混合的第一溶蚀材料的溶蚀速率随后被用来获得与药物混合的第一可溶蚀材料的厚度。在一些实施例中,与药物混合的第一溶蚀材料的假设厚度和厚度相同。在一些实施例中,与药物混合的第一溶蚀材料的假设厚度和厚度不同。在一些实施例中,与药物混合的第一溶蚀材料层的假设厚度或假设厚度的范围是基于药物剂型的尺寸大小、药物剂型中的层数、药物剂型中的层的可打印分辨率(例如最小可打印厚度)、药物剂型的药物目标释放曲线中的一种或者组合。在一些实施例中,与药物混合的第一溶蚀材料层的假设厚度或假设厚度范围是基于使厚度满足式i。图2a示出了含有三层与药物混合的第一溶蚀材料层215、220、225的药物剂型200,其中所述层220的厚度(如235所示)按照溶蚀方向230进行测量。在一些实施例中,当具有已知溶蚀速率的与药物混合的第一溶蚀材料被选择(例如预先选择)的时候,可以根据式iii计算与药物混合的可溶蚀材料层220的厚度235(图2a)。在一些实施例中,基于第一模型药物剂型200的假设厚度或假设厚度的范围,可被用来选择具有溶蚀速率的与药物混合的第一溶蚀性材料,根据式iii,其中与药物混合的第一溶蚀材料的溶蚀速率可被用来计算与药物混合的第一溶蚀材料层220的厚度235(图2a)。iv.与化合物混合的第一溶蚀材料层的质量分数和表面积如图1的示意图100所示,以下参数存在关系:剂型(例如药物剂型)中与化合物、化合物(例如药物)或试剂混合的第一溶蚀材料层的质量分数(诸如药物质量分数)135,以及该与化合物(例如药物)或试剂混合的第一溶蚀材料层的表面积140。在一些实施方案中,与药物混合的溶蚀材料层中所含药物的质量分数(mf)可通过式iv获得:其中md是与药物混合的溶蚀材料层中药物的质量,其中mtot是与药物混合的溶蚀材料层的总质量。在一些实施方案中,基于例如式iv,与药物混合的第一溶蚀材料层所含药物的质量分数和与药物混合的第一溶蚀材料层的体积(vvol)有关,其关系可通过式v表达:其中所述mf是与药物混合的第一溶蚀材料层中药物的质量分数,%l是溶蚀材料层中所混合药物占药物剂型中总药物的百分数(以小数形式),mdtot是药物剂型中药物的总质量,ρ是与药物混合的溶蚀材料层的密度。在一些实施方案中,数学上等同的术语可以替代式v中所述的术语。例如,在一些实施方案中,当与药物混合的第一溶蚀材料层的形状可以是例如圆柱体时,vvol可以用与药物混合的第一溶蚀材料层的厚度(h)乘以与药物混合的第一溶蚀材料层的表面积(s)来代替。在一些实施方案中,当药物剂型中药物的总质量、与药物混合的溶蚀材料层中药物占总药物的百分比、以及与药物混合的溶蚀材料层的厚度在第一层和第二层保持恒定,如果所述第一层药物的mf高于第二层,第一层比第二层的表面积小,那么第一层和第二层有可能具有相同的药物目标释放曲线。如图1的示意图100所示,对于可实现药物目标释放曲线的药物剂型的设计方法可以包括通过通过不同方法确立与药物混合的第一溶蚀材料层的药物质量分数135以及与药物混合的第一溶蚀材料层的表面积140。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括获得(例如确定或选择)与药物混合的第一溶蚀材料层的假设表面积或假设表面积范围。在一些实施方案中,与药物混合的第一溶蚀材料层的假设表面积或假设表面积的范围是基于药物剂型的尺寸大小,例如药物剂型的最大和最小尺寸。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括基于与药物混合的第一溶蚀材料层假想表面积或假想表面积的范围,获得与药物混合的第一溶蚀材料层的假设药物质量分数或假设药物质量分数范围。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括基于与药物混合的第一溶蚀材料层中的假设药物质量分数或者假设药物质量分数的范围,获得(例如选择)与药物混合的第一溶蚀材料层的药物质量分数。在一些实施例中,与药物混合的第一溶蚀材料层的药物质量分数,是基于与药物混合的第一溶蚀材料的特性(例如溶蚀速率)来选择。在一些实施方案中,第一溶蚀材料的溶蚀速率与混合有药物的第一材料的溶蚀速率相同,其中药物以选定的药物质量分数存在于与药物混合的第一溶蚀材料中。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括基于与药物混合的第一溶蚀材料中所选的药物质量分数,获得与药物混合的第一可溶蚀层的表面积。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括获得(例如确定或选择)与药物混合的第一溶蚀材料的假定药物质量分数或假设药物质量分数范围。在一些实施方案中,与药物混合的第一溶蚀材料层的假定药物质量分数或假设药物质量分数范围是基于与药物混合的第一溶蚀材料的性质,例如溶蚀速率。在一些实施方案中,第一溶蚀材料的溶蚀速率与混合有药物的第一材料的溶蚀速率相同,其中所述药物以假想药物质量分数或假设药物质量分数的范围存在于与药物混合的第一溶蚀材料中。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括基于与药物混合的第一溶蚀材料层的假设药物质量分数或假设药物质量分数的范围,获得与药物混合的第一溶蚀材料层的假设表面积或假设表面积范围。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括基于与药物混合的第一溶蚀材料层的假设表面积或假设表面积的范围,获得(例如选择)与药物混合的第一溶蚀材料层的表面积。在一些实施方案中,与药物混合的第一溶蚀材料层的表面积,是基于药物剂型的性质(例如尺寸)来选择。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括基于与药物混合的第一溶蚀材料的所选的表面积,获得与药物混合的第一溶蚀材料层的药物质量分数。如本文所公开的,对于可实现目标释放曲线(如药物的目标释放曲线)的剂型(如药物剂型)的设计方法,可以具有适合3d打印剂型的任意形状的与化合物(例如药物)混合的第一溶蚀材料层表面。例如,图2b中所示的药物剂型240可以具有与图2c所示的药物剂型265相同的药物目标释放曲线。其中在图2b的药物剂型240中的第一溶蚀材料层255的表面是圆形,而图2c的药物剂型265中第一溶蚀材料层280的表面是一个正方形。如图3a和图3b所示,可实现药物目标释放曲线的药物剂型300包含多层结构,所述多层结构包含多个与药物混合的第一溶蚀材料层315,其中第一溶蚀材料嵌入不与药物混合的第二材料310中,所述多层结构可以包括多个相似的表面区域形状和/或锥体层。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括隔开(例如分割)与药物混合的第一溶蚀材料层的获得的表面区域。在一些实施方案中,与药物混合的第一溶蚀材料层的表面是连续的。在一些实施方案中,与药物混合的第一种溶蚀材料层的表面是不连续的。例如,图4a-4c的示例性口服剂型显示了包含多个与药物混合的第一溶蚀材料层的多层结构,其中嵌入第二材料的第一溶蚀材料可能有多个与药物混合的第一溶蚀材料层同时暴露于溶液,例如体液,具体如胃肠(gi)液。如图4a所示,药物剂型400包括由多个与药物混合、并嵌入不与药物混合的第二材料420的第一溶蚀材料层形成的多层结构,所述药物剂型包含6层与药物混合的第一溶蚀材料层402、404、406、412、414、416,其中至少第一层406和第二层416在服用后同时暴露于溶液。如图4b-4c所示,药物剂型425包括由多个与药物混合、并嵌入不与药物混合的第二材料429的第一溶蚀材料层形成的多层结构,所述药物剂型包括18层与药物混合的第一溶蚀材料层(12层在图4b中显示:426-428、431-439),如图4c中所标记的,其中包括第一层428、第二层433和第三层441在内的6层在服用后同时暴露于溶液。在一些实施方案中,与药物混合的第一溶蚀材料层的表面被设计成控制暴露于溶液(例如体液,具体如胃肠(gi)液)的表面积。在一些实施例中,与相同尺寸的平面表面相比,与药物混合的第一溶蚀材料层的表面被设计成增加暴露于溶液的表面积。在一些实施例中,与药物混合的第一溶蚀材料层的表面是平面的(例如图2a-4c)。在一些实施例中,与药物混合的第一溶蚀材料层的表面是弯曲的(例如图5和图6)。在一些实施方案中,与药物混合的第一溶蚀材料层的表面包含至少一个突出部分,例如绒毛。为了用于式v,在一些实施方案中,可通过式vi得到可溶蚀材料层的密度(ρ),无论其是否与药物混合:其中当溶蚀材料不与药物混合时,所述m是不与药物混合的溶蚀材料层的总质量;其中当溶蚀材料与药物混合时,所述m是与药物混合的溶蚀材料层的总质量(包括药物的质量)。其中所述vvol是该溶蚀材料层的体积。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括调节某一层与药物混合的第一溶蚀材料层的预定参数,例如表面积、厚度、药物质量分数,从而为该层创建新的参数,使得在层的溶蚀时间内从先前的层参数和调整后的层参数中药物释放量相等。在一些实施方案中,所述层是药物剂型的多层结构的某一层。在一些实施方案中,所述层是药物剂型的多层结构的顶层。在一些实施例中,需调整层的体积。在一些实施例中,层的体积增加。在一些实施例中,多层结构的顶层的体积增加。在一些实施方案中,调节后层中药物相对每单位材料的量小于调节前。例如,如图7所示,原始层参数提供了包含与药物混合的第一溶蚀材料的层,所述第一溶蚀材料与嵌入未与药物混合的第二溶蚀材料中。在一些实施方案中,调节原始层参数以增加原始层的厚度,其中调节后层中的药物的相对量(层包括第一溶蚀材料和第二溶蚀材料)与层调整之前比减小。在一些实施例中,调整原始层参数以增加未与药物混合的第二溶蚀材料的体积。在一些实施方案中,通过添加一个或多个未与药物混合的第二溶蚀材料形成的附加层来调节包含与药物混合的第一溶蚀材料的层。例如,如图7所示,可以在包含与药物混合的第一溶蚀材料的层的顶部或下方添加另一层未与药物混合的第二溶蚀材料层。在一些实施方案中,在多层结构中包含与药物混合的第一溶蚀材料的顶层上方添加未与药物混合的第二溶蚀材料层。在一些实施方案中,在多层结构中包含与药物混合的第一溶蚀材料的顶层下方添加未与药物混合的第二溶蚀材料层。在一些实施方案中,通过选择替代溶蚀材料来调整包含与药物混合的第一溶蚀材料的层,其中根据替代溶蚀材料的溶蚀速率来调整该层的参数。在一些实施例中,替代溶蚀材料具有比第一溶蚀材料更慢的溶蚀速率。在一些实施例中,替代溶蚀材料具有比第一溶蚀材料更快的溶蚀速率。在一些实施方案中,通过选择与药物混合的替代溶蚀材料来调整多层结构中包含与药物混合的第一溶蚀材料的顶层。在一些实施方案中,通过选择与药物混合的替代溶蚀材料来调整多层结构中包含与药物混合的第一溶蚀材料的顶层,其中替代溶蚀材料具有比第一溶蚀材料更慢的溶蚀速率。在一些实施例中,通过选择与药物混合的替代溶蚀材料来调整多层结构中包含与药物混合的第一溶蚀材料的顶层,其中替代溶蚀材料具有比第一溶蚀材料更快的溶蚀速率。在一些实施方案中,多层结构的前n层的层数通过将前n层合并成单层来调整,该单层的参数将满足前n层的药物目标释放曲线。本领域技术人员将理解,本文提供的方法还包括基于本文讨论的一个或多个调整参数的打印方法和设计方法。c.未与化合物混合的第二溶蚀材料本公开内容提供了对于可实现目标释放曲线(如药物的目标释放曲线)的剂型(如药物剂型)的设计方法,其中所述剂型包括多层结构,该多层结构包括多个与化合物、化合物(例如药物)或试剂混合的第一溶蚀材料层,其中第一溶蚀材料嵌入未与化合物(例如药物)或试剂混合的第二材料中。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择未与药物混合的第二材料。在一些实施方案中,未与药物混合的第二材料是预先确定的。在一些实施例中,第二材料包括热塑性材料。在一些实施例中,第二材料是热塑性材料。在一些实施例中,第二材料是可食用的(如个体可消化)。在一些实施例中,第二材料是生物相容的(如适用于植入剂)。在一些实施方案中,所述热塑性材料选自亲水性聚合物、疏水性聚合物、可溶胀聚合物、非溶胀聚合物、多孔聚合物、无孔聚合物、可溶蚀聚合物(例如可溶解聚合物)、非溶蚀聚合物、ph敏感聚合物、天然聚合物(例如虫胶)、蜡状材料中的一种或组合。在一些实施方案中,所述热塑性材料选自亲水性聚合物、疏水性聚合物、可溶胀聚合物、非溶胀聚合物、多孔聚合物、无孔聚合物、可溶蚀聚合物(例如可溶解聚合物)、ph敏感聚合物、天然聚合物(例如虫胶)、蜡状材料中的一种或组合。在一些实施方案中,所述热塑性材料选自聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物57/30/13、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(pvp-va)、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(pvp-va)60/40、聚乙烯基吡咯烷酮(pvp)、聚乙酸乙烯酯(pvac)和聚乙烯基吡咯烷酮(pvp)80/20、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(va64)、聚乙二醇-聚乙烯醇接枝共聚物25/75、kollicoatir-聚乙烯醇60/40、聚乙烯醇(pva或pv-oh)、聚(乙酸乙烯酯)(pvac)、聚(任选烷基-、甲基-或乙基-)丙烯酸酯、甲基丙烯酸酯共聚物、乙基丙烯酸酯共聚物、甲基丙烯酸丁酯-甲基丙烯酸(2-二甲基氨基乙基)酯-甲基丙烯酸甲酯共聚物1:2:1、甲基丙烯酸二甲基氨基乙酯-甲基丙烯酸酯共聚物、丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酸三甲基铵乙酯氯化物共聚物、丙烯酸甲酯-甲基丙烯酸甲酯-甲基丙烯酸共聚物7:3:1、甲基丙烯酸-甲基丙烯酸甲酯共聚物1:2、甲基丙烯酸-乙基丙烯酸酯共聚物1:1、甲基丙烯酸-甲基丙烯酸甲酯共聚物1:1、聚环氧乙烷(peo)、聚乙二醇(peg)、超支化聚酰胺酯、羟丙基甲基纤维素邻苯二甲酸酯、羟丙甲纤维素邻苯二甲酸酯、羟丙基甲基纤维素或羟丙甲纤维素(hmpc)、羟丙基甲基纤维素乙酸琥珀酸酯或羟丙甲纤维素琥珀酸酯(hpmcas)、丙交酯-乙交酯共聚物(plga)、卡波姆、乙烯-乙酸乙烯酯共聚物、聚乙烯(pe)和聚己内酯(pcl)、纤维素或纤维素衍生物、羟丙基纤维素(hpc)、聚氧乙烯40氢化蓖麻油、甲基纤维素(mc)、乙基纤维素(ec)、泊洛沙姆、邻苯二甲酸羟丙基甲基纤维素(hpmcp)、泊洛沙姆、氢化蓖麻油和大豆油、棕榈酸硬脂酸甘油酯、巴西棕榈蜡、聚乳酸(pla)、聚乙醇酸(pga)、乙酸丁酸纤维素(cab)、胶体二氧化硅、糖类、葡萄糖、聚醋酸乙烯邻苯二甲酸酯(pvap)、蜡、蜂蜡、水凝胶、明胶、氢化植物油、聚乙烯缩乙醛二乙胺醋酸酯(aea)、石蜡、虫胶、海藻酸钠、邻苯二甲酸醋酸纤维素(cap)、脂肪油、阿拉伯树胶、黄原胶、单硬脂酸甘油酯、硬脂酸中的一种或组合。在一些实施方案中,所述第二材料包含一种非热塑性材料。在一些实施方案中,所述第二材料是一种非热塑性材料。在一些实施方案中,所述非热塑性材料选自淀粉、预胶化淀粉、羟基乙酸淀粉钠(cms-na)、蔗糖、糊精、乳糖、微晶纤维素(mcc)、甘露醇、硬脂酸镁(ms)、粉末状硅胶、海藻酸钠、二氧化钛、甘油、糖浆、卵磷脂、大豆油、茶油、乙醇、丙二醇、甘油、吐温、动物脂肪、硅油、可可脂、脂肪酸甘油酯、凡士林、壳聚糖、鲸蜡醇、硬脂醇中的一种或组合。在一些实施方案中,所述第二材料包含一种增塑剂。在一些实施方案中,所述增塑剂包含聚氧乙烯-聚氧丙烯嵌段共聚物、维生素e聚乙二醇琥珀酸酯、羟基硬脂酸酯、聚乙二醇(诸如peg400)、聚乙二醇十六十八烷基醚12、聚乙二醇20十六十八醇醚、聚山梨醇酯20、聚山梨醇酯60、聚山梨醇酯80、醋精、乙酰化柠檬酸三乙酯、柠檬酸三丁酯、乙酰化柠檬酸三丁酯、柠檬酸三乙酯、聚氧乙烯15羟基硬脂酸酯、聚乙二醇-40氢化蓖麻油、聚氧乙烯35蓖麻油、癸二酸二丁酯、邻苯二甲酸二乙酯、甘油、4-羟基苯甲酸甲酯、丙三醇、蓖麻油、油酸、甘油三乙酸酯或聚亚烷基二醇。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择未与药物混合的第二材料。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方包括选择:(a)与药物混合的第一溶蚀材料;和(b)不与药物混合的第二材料。在一些实施方式中,与药物混合的第一溶蚀材料和不与药物混合的第二材料相同。在一些实施例中,未与药物混合的第二材料是溶蚀材料,例如第二溶蚀材料。在一些实施例中,与药物混合的第一溶蚀材料和不与药物混合的第二材料相同,其中所述第二材料是第二溶蚀材料。在一些实施例中,与药物混合的第一溶蚀材料和不与药物混合的第二材料不同,其中第二材料是第二溶蚀材料。在一些实施方案中,未与药物混合的第二材料(其中所述第二材料是第二溶蚀材料)是一种可以在药物剂型位于个体内的期间被溶蚀(例如,完全溶蚀或经历完全溶解)的材料。在一些实施方案中,未与药物混合的第二材料(其中第二材料是第二溶蚀材料)是一种在药物剂型位于个体内的期间不能完全被溶蚀的材料。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择未与药物混合的第二材料,其中所述第二材料是第二溶蚀材料,并且其中所述第二溶蚀材料是基于第二溶蚀材料的特性进行选择。在一些实施例中,选择未与药物混合的第二材料(其中第二材料是第二溶蚀材料)是基于第二溶蚀材料的溶蚀速率。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择:(a)与药物混合的第一溶蚀材料;和(b)不与药物混合的第二材料,其中所述第二材料是第二溶蚀材料,并且其中所述第二材料的选择是基于第一溶蚀材料的溶蚀速率。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择:(a)与药物混合的第一溶蚀材料;和(b)不与药物混合的第二材料,其中所述第二材料是第二溶蚀材料,并且其中所述第一溶蚀材料的选择是基于所述第二溶蚀材料的溶蚀速率。在一些实施方案中,通过选择未与药物混合的第二材料(其中所述第二材料是第二溶蚀材料)的溶蚀速率,来控制与药物混合的第一溶蚀材料层暴露于溶出介质。在一些实施例中,与药物混合的第一溶蚀材料和未与药物混合的第二材料(其中所述第二材料是第二溶蚀材料)的溶蚀速率相同。在一些实施例中,与药物混合的第一溶蚀材料和未与药物混合的第二材料(其中所述第二材料是第二溶蚀材料)的溶蚀速率不同。在一些实施例中,与药物混合的第一溶蚀材料的溶蚀速率比未与药物混合的第二材料快,其中所述第二材料是第二溶蚀材料。在一些实施例中,与药物混合的第一溶蚀材料的溶蚀速率比不与药物混合的第二材料慢,其中所述第二材料是第二溶蚀材料。例如,在图2a所示的药物剂型200中,可基于第二材料的溶蚀速率来选择未与药物混合的第二材料210,其中与药物混合的第一溶蚀材料的每一层215、220、225皆以目标表面积暴露于溶液中,以实现药物的目标释放曲线,例如,对于与药物混合的第一溶蚀材料的第二层220,仅当与药物混合的第一溶蚀材料的第一层215溶解之后,220的顶部表面区域(而不是侧面,如标示的厚度235)才暴露于溶液。在一些实施例中,第二材料是肠溶材料。在一些实施例中,第一溶蚀材料嵌入第二材料中,其中第二材料是肠溶材料,并且其中所述第二材料包封第一材料。如本文所述,术语“包封”包括其中第二材料完全包封(例如,包围)第一材料的实施方式和其中第二材料部分包封第一材料(例如,通过包含第二材料的塞子)的实施方式。在一些实施例中,第一溶蚀材料嵌入第二材料中,其中所述第二材料是肠溶材料,并且其中所述第二材料完全包封第一材料。在一些实施例中,第一溶蚀材料嵌入第二材料中,其中所述第二材料是肠溶材料,并且其中所述第二材料部分地包封第一材料。在一些实施例中,第一溶蚀材料嵌入第二材料中,其中所述第二材料是肠溶材料,并且其中第二材料形成塞子。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括设计一层由未与药物混合的第二材料形成的凸缘,其中凸缘形成空间,并且该空间位于由多个与药物混合的第一溶蚀材料层形成的多层结构的顶部。多层结构的顶部是指口服给药时首先与体液如胃肠液接触的与药物混合的第一溶蚀材料层。例如,如图8a所示,示例性药物剂型800包括在多层结构的顶部上方由第二材料形成的凸缘805,所述多层结构包括多个与药物混合的第一溶蚀材料层810。凸缘形成如图8a所示的空间815。在一些实施例中,该空间未被材料填充。在一些实施例中,该空间填充另一种可溶蚀材料,例如与不同药物混合的另一溶蚀材料。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括获得(例如选择)由未与药物混合的第二材料形成的凸缘的厚度(按照溶蚀的方向从多层结构的顶部至凸缘的最外表面测量)。在一些实施方案中,凸缘的厚度为至少约0.01毫米,诸如至少约0.05毫米、0.1毫米、0.15毫米、0.2毫米、0.25毫米、0.3毫米、0.35毫米、0.4毫米、0.45毫米、0.5毫米、0.55毫米、0.6毫米、0.65毫米、0.7毫米、0.75毫米、0.8毫米、0.85毫米、0.9毫米、0.95毫米或1毫米中的任何一个。在一些实施方案中,凸缘的厚度为约0.01毫米、0.05毫米、0.1毫米、0.15毫米、0.2毫米、0.25毫米、0.3毫米、0.35毫米、0.4毫米、0.45毫米、0.5毫米、0.55毫米、0.6毫米、0.65毫米、0.7毫米、0.75毫米、0.8毫米、0.85毫米、0.9毫米、0.95毫米或1毫米中的任何一个。在一些实施方案中,凸缘的厚度为约0.52毫米。d.不与化合物混合的间隔材料本公开内容提供了对于可实现目标释放曲线(如药物的目标释放曲线)的剂型(如药物剂型)的设计方法,其中所述剂型包括多层结构,所述多层结构包括多个与化合物、化合物(例如药物)或试剂混合的第一溶蚀材料层,其中第一溶蚀材料嵌入未与化合物(例如药物)或试剂混合的第二材料中,并且由一种不与化合物(例如药物)或试剂混合的间隔材料在第一溶蚀材料的两层或更多层之间形成间隔层。在一些实施例中,间隔材料是溶蚀材料。在一些实施例中,间隔材料是溶蚀材料,其中所述间隔材料形成塞子。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择未与药物混合的间隔材料,其中间隔材料是溶蚀材料。在一些实施例中,未与药物混合的间隔材料是预先确定的,其中所述间隔材料是溶蚀材料。在一些实施方案中,所述间隔材料包含一种热塑性材料。在一些实施方案中,所述间隔材料是一种热塑性材料。在一些实施方案中,所述间隔材料是可食用的(如个体可消化)。在一些实施方案中,所述隔离材料是生物相容性的(如适用于植入剂)。在一些实施方案中,所述热塑性材料选自亲水聚合物、疏水聚合物、可溶胀聚合物、不可溶胀聚合物、多孔聚合物、无孔聚合物、溶蚀聚合物(例如可溶解聚合物)、非溶蚀性聚合物、ph敏感性聚合物、天然聚合物(例如虫胶)、蜡状材料中的一种及其组合。在一些实施方案中,所述热塑性材料选自亲水性聚合物、疏水性聚合物、可溶胀聚合物、非溶胀聚合物、多孔聚合物、无孔聚合物、可溶蚀聚合物(例如可溶解聚合物)、ph敏感聚合物、天然聚合物(例如虫胶)、蜡状材料中的一种或组合。在一些实施方案中,所述热塑性材料选自聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物57/30/13、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(pvp-va)、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(pvp-va)60/40、聚乙烯基吡咯烷酮(pvp)、聚乙酸乙烯酯(pvac)和聚乙烯基吡咯烷酮(pvp)80/20、聚乙二醇-聚乙烯醇接枝共聚物25/75、kollicoatir-聚乙烯醇60/40、聚乙烯醇(pva或pv-oh)、聚乙酸乙烯酯(pvac)、聚(任选烷基-、甲基-或乙基-)丙烯酸酯、甲基丙烯酸酯共聚物、乙基丙烯酸酯共聚物、甲基丙烯酸丁酯-甲基丙烯酸(2-二甲基氨基乙基)酯-甲基丙烯酸甲酯共聚物1:2:1、甲基丙烯酸二甲基氨基乙酯-甲基丙烯酸酯共聚物、丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酸三甲基铵乙酯氯化物共聚物、丙烯酸甲酯-甲基丙烯酸甲酯-甲基丙烯酸共聚物7:3:1、甲基丙烯酸-甲基丙烯酸甲酯共聚物1:2、甲基丙烯酸-乙基丙烯酸酯共聚物1:1、甲基丙烯酸-甲基丙烯酸甲酯共聚物1:1、聚环氧乙烷(peo)、聚乙二醇(peg)、超支化聚酰胺酯、羟丙基甲基纤维素邻苯二甲酸酯、羟丙甲纤维素邻苯二甲酸酯、羟丙基甲基纤维素或羟丙甲纤维素(hmpc)、羟丙基甲基纤维素乙酸琥珀酸酯或羟丙甲纤维素琥珀酸酯(hpmcas)、丙交酯-乙交酯共聚物(plga)、卡波姆、乙烯-乙酸乙烯酯共聚物、聚乙烯(pe)和聚己内酯(pcl)、纤维素或纤维素衍生物、羟丙基纤维素(hpc)、聚氧乙烯40氢化蓖麻油、甲基纤维素(mc)、乙基纤维素(ec)、泊洛沙姆、邻苯二甲酸羟丙基甲基纤维素(hpmcp)、泊洛沙姆、氢化蓖麻油和大豆油、棕榈酸硬脂酸甘油酯、巴西棕榈蜡、聚乳酸(pla)、聚乙醇酸(pga)、纤维素或纤维素衍生物、乙酸丁酸纤维素(cab)、胶体二氧化硅、糖类、葡萄糖、聚醋酸乙烯邻苯二甲酸酯(pvap)、蜡、蜂蜡、水凝胶、明胶、氢化植物油、聚乙烯缩乙醛二乙胺醋酸酯(aea)、石蜡、虫胶、海藻酸钠、邻苯二甲酸醋酸纤维素(cap)、脂肪油、阿拉伯树胶、黄原胶、单硬脂酸甘油酯、硬脂酸中的一种及其组合。在一些实施方案中,所述间隔材料包含一种非热塑性材料。在一些实施方案中,所述材料是一种非热塑性材料。在一些实施方案中,所述非热塑性材料选自淀粉、预胶化淀粉、羟基乙酸淀粉钠(cms-na)、蔗糖、糊精、乳糖、微晶纤维素(mcc)、甘露醇、硬脂酸镁(ms)、粉末状硅胶、海藻酸钠、二氧化钛、甘油、糖浆、卵磷脂、大豆油、茶油、乙醇、丙二醇、甘油、吐温、动物脂肪、硅油、可可脂、脂肪酸甘油酯、凡士林、壳聚糖、鲸蜡醇、硬脂醇中的一种或其组合。在一些实施方案中,所述间隔材料包含一种增塑剂。在一些实施方案中,所述增塑剂包含聚氧乙烯-聚氧丙烯嵌段共聚物、维生素e聚乙二醇琥珀酸酯、羟基硬脂酸酯、聚乙二醇(诸如peg400)、聚乙二醇十六十八烷基醚12、聚乙二醇20十六十八醇醚、聚山梨醇酯20、聚山梨醇酯60、聚山梨醇酯80、醋精、乙酰化柠檬酸三乙酯、柠檬酸三丁酯、乙酰化柠檬酸三丁酯、柠檬酸三乙酯、聚氧乙烯15羟基硬脂酸酯、聚乙二醇-40氢化蓖麻油、聚氧乙烯35蓖麻油、癸二酸二丁酯、邻苯二甲酸二乙酯、甘油、4-羟基苯甲酸甲酯、丙三醇、蓖麻油、油酸、甘油三乙酸酯或聚亚烷基二醇。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择未与药物混合的间隔材料。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择:(a)与药物混合的第一溶蚀材料;(b)不与药物混合的第二材料;和(c)不与药物混合的间隔材料。在一些实施例中,未与药物混合的间隔材料与和与药物混合的第一溶蚀材料和/或未与药物混合的第二材料相同。在一些实施例中,未与药物混合的间隔材料不同于与药物混合的第一溶蚀材料和/或未与药物混合的第二材料。在一些实施方案中,未与药物混合的间隔材料是溶蚀材料。在一些实施例中,未与药物混合的间隔材料是一种可以在药物剂型位于个体内的期间被溶蚀(例如,完全溶蚀或经历完全溶解)的材料。在一些实施方案中,对于可实现药物目标释放曲线的药物剂型的设计方法包括选择未与药物混合的间隔材料,其中所述间隔溶蚀材料是基于间隔溶蚀材料的性质来选择。在一些实施方案中,选择未与药物混合的间隔材料是基于间隔溶蚀材料的溶蚀速率。在一些实施方案中,选择未与药物混合的间隔材料是基于口服剂型的药物目标释放曲线。在一些实施方案中,选择未与药物混合的间隔材料是基于药物剂型的药物目标释放曲线,其中所述间隔材料的厚度可以用于控制药物从药物剂型中释放的速率,例如暂停或减少药物从药物剂型的释放。在一些实施例中,基于式iii获得间隔材料层的厚度。e.隔离材料本公开内容提供了对于可实现目标释放曲线(如药物的目标释放曲线)的剂型(如药物剂型)的设计方法,其中所述剂型包含多层结构,所述多层结构包括多个与化合物(例如药物)混合的第一溶蚀材料层,其中所述第一溶蚀材料嵌入未与化合物(例如药物)混合的第二材料中,其中所述剂型包含对于体液(例如胃肠液)来说不可渗透的隔离材料,并且其中隔离材料在体液与多层结构的一部分之间形成屏障。在一些实施例中,第二材料是隔离材料。在一些实施例中,第二材料不是隔离材料。在一些实施方案中,所述方法进一步包括设计具有未与药物混合的间隔材料的药物剂型,其中所述间隔材料在两层或更多层与药物混合的第一溶蚀材料层之间形成间隔层。在一些实施方案中,隔离材料在体液如胃肠液和与药物混合的第一溶蚀材料层的一部分之间形成屏障。在一些实施例中,隔离材料在体液如胃肠液和未与药物混合的第二材料的一部分之间形成屏障,其中所述第二材料为第二溶蚀材料。在一些实施例中,隔离材料在体液(例如胃肠液)和包含多个与药物混合的第一溶蚀材料层的多层结构的一部分之间形成屏障,其中所述第一溶蚀材料嵌入不与药物混合的第二种材料中,其中所述第二材料是第二溶蚀材料。在一些实施例中,隔离材料在体液如胃肠液和多层结构的一部分之间形成屏障,该多层结构包含多个与药物混合的第一溶蚀材料层以及未与药物混合的间隔溶蚀材料层,其中所述第一溶蚀材料嵌入未与所述药物混合的第二材料中,并且其中所述第二材料是第二溶蚀材料。在一些实施方案中,所述隔离材料包含一种热塑性材料。在一些实施方案中,所述隔离材料是一种热塑性材料。在一些实施方案中,所述隔离材料是可食用的(如个体可消化)。在一些实施方案中,所述隔离材料是生物相容性的(如适用于植入剂)。在一些实施方式中,隔离材料选自于纤维素醚类、纤维素酯类和丙烯酸树脂类。在一些实施方式中,所述隔离材料选自乙基纤维素、羟丙基甲基纤维素、羟丙基纤维素、羟甲基纤维素、聚甲基丙烯酸及其衍生物,例如其适合用作热塑性材料的盐、酰胺或酯。在一些实施方式中,所述隔离材料选自十二碳至三十碳脂肪酸的甘油单酯或甘油二酯、十二碳至三十碳脂肪醇、和蜡中的一种或其组合。在一些实施方案中,所述隔离材料包含一种非热塑性材料。在一些实施方案中,所述隔离材料是一种非热塑性材料。在一些实施方案中,所述非热塑性材料选自乙基纤维素(ec)、聚甲基丙烯酸酯、无毒聚氯乙烯、聚乙烯、乙烯-乙酸乙烯酯共聚物、硅橡胶中的一种及其组合。在一些实施例中,隔离材料是不溶蚀的材料。在一些实施方案中,隔离材料在施用后至少约36小时内基本上不会溶蚀,例如至少约42小时、48小时、54小时、60小时、66小时或72小时中的任何一个。在一些实施例中,隔离材料的选择是基于隔离材料的溶蚀性质,例如,在特定ph下的溶蚀。三维打印剂型的方法本公开提供了对于用来实现目标释放曲线(如药物的目标释放曲线)的剂型(如药物剂型)的打印方法,所述方法包括:打印与化合物(例如药物)混合的第一溶蚀材料,和不与化合物(例如药物)混合的第二材料,以形成多层的结构,所述多层结构包括多个第一溶蚀材料层,其中所述第一溶蚀材料嵌入第二材料,其中所述第一溶蚀材料的每层都有一个预定的表面积、厚度和质量分数(例如药物质量分数),其中所述预定的表面积、厚度和/或药物质量分数与目标释放曲线相关,并且当其暴露于体液(例如胃肠液)时,药物根据目标释放曲线释放。本公开所使用的“打印”、“三维打印”、“3d打印”、“增材制造”或其同义词是指采用数字设计通过层层叠加制备三维物体(例如药物剂型)的工艺。3d打印的基本工艺已经在美国专利5204055;5260009;5340656;5387380;5503785和5633021中进行描述。与3d打印相关的其他美国专利和专利申请包括:美国专利号5490962;5518690;5869170;6530958;6280771;6514518;6471992;8828411;美国公开号2002/0015728;2002/0106412;2003/0143268;2003/0198677;2004/0005360。上述美国专利和专利申请之全文以引用的方式并入本文中。在一些实施方式中,本公开采用一种增材制造技术制备所述的药物剂型。在一些实施方式中,本公开采用一种层层叠加技术制备所述的药物剂型。在原材料、设备和固化方面已经开发了用于药物剂型制造的不同3d打印方法。这些3d打印方法包括粘合剂沉积(参见gibson等,增材制造技术:3d打印,快速成型和直接数字制造,第2版,springer,纽约,2015;katstra等,三维打印制造口服药物剂型,jcontrolrelease,66,2000;katstra等人,通过三维打印制造复杂的口服给药剂型,材料科学与工程学位论文,麻省理工学院,2001;lipson等人,制造:3d打印新世界,johnwiley&sons,inc.,2013;jonathan,karim3d药物打印:用于设计定制药物递送系统的新工具,intjpharm,499,2016)、材料喷射(参见jonathan,karim,制药领域的3d打印:用于设计定制药物输送系统的新工具,intjpharm,499,2016)、挤出(参见gibson等,增材制造技术:3d打印,快速成型和直接数字制造,第2版,springer,纽约,2015)、和光聚合作用(参见melchels等人,立体光刻技术及其在生物医学工程中的应用综述,生物材料,31,2010)。在一些实施方式中,使用挤出法将本文公开的药物剂型3d打印。在一些实施方式中,3d打印的方法包含使用双螺杆挤出方法。在挤出过程中,材料从机械驱动的打印头通过打印喷嘴挤出。与需要粉末床的粘合剂沉积不同,挤出方法可以在任何基材上进行打印。多种材料可挤出用于三维打印,包括本文公开的热塑性材料、糊剂和胶体悬浮液、硅酮和其他半固体。一种常见的挤出打印是熔融沉积成型,其使用固体聚合物拉丝进行打印。在熔融沉积成型中,齿轮系统将丝材驱动到用于挤出的加热喷嘴组件中(参见gibson等,增材制造技术:3d打印,快速成型和直接数字制造,第2版,springer,纽约,2015)。在一些实施例中,本文公开的3d打印方法包括连续进料方法。在一些实施例中,本文公开的3d打印方法包括批量进料方法。本文公开的用于3d打印药物剂型的方法可以以多种方式生成指令,包括直接编码、从实体cad模型导出、或者通过特定的其他手段到3d打印机的计算机接口和应用软件。这些指令可能包括有关液滴数量和空间位置以及一般3d打印参数的信息,如每个线性尺寸(x,y,z)的液滴间距以及每个液滴的液体体积或质量。对于给定的一组材料,可以调整这些参数以改进所创建结构的质量。所产生的结构的整体分辨率是粉末颗粒尺寸、流体液滴尺寸、打印参数和材料特性的函数。因为3d打印可以处理一系列药物材料并且局部控制组成和结构,所以3d打印非常适合于根据本发明制造具有复杂几何形状和组成的药物剂型。使用3d打印方法制造药物剂型也有助于个性化药物。个性化药物是指基于生物标志物对患者人群进行分层以帮助治疗决策和个性化剂型设计。修改数字设计比修改物理设备更容易。而且,自动化的小型三维打印可能具有可忽略的操作成本。因此,3d打印可以使多个小型、个性化的批次在经济上可行,并且可以实现旨在提高依从性的个性化剂型。个性化药物剂型允许基于患者的体重和代谢调整递送的药物的量。3d打印剂型可确保成长期儿童的准确剂量,并允许高效药物的个性化剂量给药。个性化剂型还可以将患者的所有的药物组合成单一日剂量,从而改善患者对药物的依从性和治疗依从性。本申请中公开的药物剂型可以商业化规模打印。例如,在一些实施方案中,本文公开的方法可用于每小时3d打印10000到100000片某一药物剂型的药片。在一些实施方案中,本文公开的方法可用于每小时3d打印10000至100000个药物剂型。在一些实施方式中,对于用来实现药物目标释放曲线的药物剂型的3d打印方法包括:打印与药物混合的第一溶蚀材料,和不与药物混合的第二材料,以形成多层的结构,所述多层结构包含多个第一溶蚀材料层,其中所述第一溶蚀材料嵌入第二材料。在一些实施方式中,其中所述第一溶蚀材料的每层都有一个预定的表面积、厚度和药物质量分数,其中所述预定的表面积、厚度和/或药物质量分数与目标药物释放曲线相关,并且当其暴露于体液(例如胃肠液)时,药物释放与目标释放曲线一致。在一些实施方案中,至少两层第一溶蚀材料层的表面积彼此不同。在一些实施方案中,至少两层第一溶蚀材料层的表面积相同。在一些实施例中,多个第一溶蚀材料层的每一层的厚度相同。在一些实施例中,至少两层第一溶蚀材料层的厚度彼此不同。在一些实施例中,多个第一溶蚀材料层的每一层中的药物质量分数相同。在一些实施方案中,至少两层第一溶蚀材料层中的药物质量分数彼此不同。在一些实施例中,第二材料是第二溶蚀材料。在一些实施例中,第一溶蚀材料和第二溶蚀材料彼此不同。在一些实施例中,第一溶蚀材料和第二溶蚀材料相同。在一些实施例中,第二材料是对于体液(例如胃肠液)来说不可渗透的隔离材料,其中隔离材料在体液与多层结构的一部分之间形成屏障。在一些实施例中,隔离材料是非溶蚀的。在一些实施例中,对于用来实现药物目标释放曲线的药物剂型的3d打印方法还包括打印隔离材料,所述隔离材料对于体液(例如胃肠液)是不可渗透的,其中所述隔离材料在体液与多层结构的一部分之间形成屏障。在一些实施例中,第一溶蚀材料和第二材料由不同的打印头打印。在一些实施例中,第一溶蚀材料、第二材料和隔离材料由不同的打印头打印。在一些实施方式中,3d打印通过熔融沉积成型(fdm)来实现。在一些实施方式中,3d打印通过非线材fdm实现。在一些实施方式中,3d打印通过喷墨打印实现。在一些实施方案中,3d打印通过选择性激光烧结(sls)实现。在一些实施例中,3d打印通过立体光刻(sla或sl)实现。在一些实施例中,3d打印通过polyjet、多喷射打印系统(mjp)、perfactory、固体物体紫外激光打印机、bioplotter、3d生物打印、快速冷冻原型、熔融沉积成型(fdm)、台式系统、选择性沉积层压(sdl)、层压objet制造(lom)、超声波固结、colorjet打印(cjp)、eosint系统、激光工程网成型(lens)和喷雾系统、电子束熔化(ebm)、激光选择性激光熔化(slm)、phenixpxtm系列、微切割、数字部件实现(dpm)或vx系统来实现。在一些实施方案中,3d打印通过将热熔挤出结合三维打印技术(例如fdm)来实现。在一些实施例中,第一溶蚀材料和第二材料具有相同的溶蚀速率,其中所述第二材料是第二溶蚀材料。在一些实施方案中,每一层的厚度不大于约22毫米,例如不大于约21毫米、20毫米、19毫米、18毫米、17毫米、16毫米、15毫米、14毫米、13毫米、12毫米、11毫米、10毫米、9毫米、8毫米、7毫米、6毫米、5毫米、4毫米、3毫米、2毫米、1毫米、0.9毫米、0.8毫米、0.7毫米、0.6毫米、0.5毫米、0.4毫米、0.3毫米、0.2毫米、0.1毫米、0.09毫米、0.08毫米、0.07毫米、0.06毫米、0.05毫米、0.04毫米、0.03毫米、0.02毫米或0.01毫米中的任何一个。在一些实施方案中,某一层的厚度不大于约22毫米,例如不大于约21毫米、20毫米、19毫米、18毫米、17毫米、16毫米、15毫米、14毫米、13毫米、12毫米、11毫米、10毫米、9毫米、8毫米、7毫米、6毫米、5毫米、4毫米、3毫米、2毫米、1毫米、0.9毫米、0.8毫米、0.7毫米、0.6毫米、0.5毫米、0.4毫米、0.3毫米、0.2毫米、0.1毫米、0.09毫米、0.08毫米、0.07毫米、0.06毫米、0.05毫米、0.04毫米、0.03毫米、0.02毫米或0.01毫米中的任何一个。在一些实施方案中,某一层的厚度为约22毫米、21毫米、20毫米、19毫米、18毫米、17毫米、16毫米、15毫米、14毫米、13毫米、12毫米、11毫米、10毫米、9毫米、8毫米、7毫米、6毫米、5毫米、4毫米、3毫米、2毫米、1毫米、0.9毫米、0.8毫米、0.7毫米、0.6毫米、0.5毫米、0.4毫米、0.3毫米、0.2毫米、0.1毫米、0.09毫米、0.08毫米、0.07毫米、0.06毫米、0.05毫米、0.04毫米、0.03毫米、0.02毫米或0.01毫米中的任何一个。在一些实施方案中,对于用来实现药物目标释放曲线的药物剂型的3d打印方法还包含打印不与药物混合的间隔材料,其中所述间隔材料在两层或更多层的第一溶蚀材料层之间形成间隔层。在一些实施方案中,所述间隔材料与第一溶蚀材料和/或第二材料相同。一些实施方案中,所述间隔材料与第一溶蚀材料和/或第二材料不同。在一些实施方案中,对于用来实现药物目标释放曲线的药物剂型的3d打印方法还包含打印不与药物混合的间隔材料,其中所述间隔材料在两层或更多层的第一溶蚀材料层之间形成间隔层。在一些实施方案中,所述间隔材料与第一溶蚀材料和/或第二材料相同。在一些实施方案中,通过本文公开的3d打印方法形成的药物剂型还包含第二药物。在一些实施方案中,所述第二药物与第一溶蚀材料混合。在一些实施方案中,所述第二药物与一个隔离材料混合,其中所述第二药物从所述隔离材料中释放。在一些实施方案中,对于用来实现药物目标释放曲线的药物剂型的3d打印方法还包含打印与第二药物混合的第三溶蚀材料,所述多层结构还包含多个嵌入在第二材料中的第三溶蚀材料层。在一些实施方案中,所述第三溶蚀材料的每层都有一个预定的表面积、厚度和药物质量分数,其中所述预定表面积、厚度和/或药物质量分数与第二种药物目标溶出曲线相关,并且当其暴露于体液例如胃肠液时,第二药物的释放与第二种药物目标释放曲线一致。在一些实施方案中,所述第三溶蚀材料与所述第一溶蚀材料和/或第二材料相同。在一些实施例中,第一溶蚀材料的溶蚀是ph依赖型的。在一些实施例中,第三溶蚀材料的溶蚀是ph依赖型的。本公开所述3d打印方法包括允许按任意顺序打印物料以获得本文公开所述的药物剂型。在一些实施方式中,三维打印所述药物剂型的方法包含打印隔离材料以形成特定厚度的结构,并将一个多层结构打印到隔离材料结构的内部。在一些实施方式中,三维打印所述药物剂型的方法进一步包含打印隔离材料以形成特定厚度的结构,并将其打印到之前打印的隔离材料结构的上部。在一些实施方式中,三维打印所述药物剂型的方法包含在打印第一溶蚀材料和/或第二材料后打印隔离材料。在一些实施方案中,三维打印所述药物剂型的方法包含打印第一溶蚀材料和打印第二材料,其中所述第一溶蚀材料和第二材料分别通过不同的打印头打印。在一些实施方案中,三维打印所述药物剂型的方法包含打印第一溶蚀材料、打印第二材料和打印隔离材料,其中所述第一溶蚀材料、第二材料和隔离材料分别通过不同的打印头打印。在一些实施方式中,本公开所述的药物剂型的设计方法可全部或部分地在计算机系统上进行。在一些实施方式中,所述方法包含将目标药物释放曲线和/或药物剂型的参数输入到计算机系统中。在一些实施方式中,所述方法包含提供药物剂型的一个或多个参数,例如层表面积、厚度、药物质量分数、溶蚀速率。在一些实施方式中,所述方法包含提供目标药物释放曲线。在一些实施方式中,所述方法包含创建药物剂型的虚拟图像。在一些实施方式中,所述方法包含创建含有预定参数的计算机模型。在一些实施方式中,所述方法包含将预定参数提供到三维打印机,并且根据这样的预定参数打印药物剂型。在一些实施方式中,所述方法包含基于药物剂型的预定参数创建该药物剂型的三维图,其中所述三维图在计算机系统上创建。在一些实施方式中,所述方法包含将口服药物剂型的三维图转换(例如切片)为三维打印代码,例如g代码。在一些实施方式中,所述方法包含使用计算机系统执行三维打印代码,从而打印本文所述的药物剂型。在一些实施方案中,提供了用于口服药物剂型的三维打印(例如通过fdm(诸如非线材fdm)的三维打印)的方法,所述药物剂型被配制和配置为提供药物目标释放曲线,其中所述口服药物剂型包括多层结构,所述多层结构包括多个具有预定的药物质量分数(mf)的混合有药物的第一溶蚀材料层,其中第一溶蚀材料嵌入未混合有所述药物的第二材料中,所述方法包括:(a)将药物目标释放曲线划分为多个时间间隔(tn),每个时间间隔对应于多层结构中的一层;(b)确定(或计算)每个时间间隔内待释放药物的百分比(%l);(c)基于第一溶蚀材料的溶蚀速率(v)确定(或计算)多层结构的各层的厚度(hn),其中hn=tn*v;(d)基于%l、hn、mf、口服药物剂型中的药物总量(mdtot)和第一溶蚀材料的密度(ρ)确定(或计算)各层的表面积,其中:(e)基于所确定各层的hn和sn,打印(或沉积)混合有所述药物的第一溶蚀材料,从而打印所述多层结构;以及(f)在步骤(e)之前、之后或之中,打印未混合有所述药物的第二材料。在一些实施方案中,所述口服药物剂型的释放曲线与基于chow’s方法或相似因子计算方法的目标释放曲线相同。在一些实施方案中,所述方法还包括在打印步骤之前创建药物剂型的虚拟图像。在一些实施方案中,所述方法还包括在打印步骤之前创建包含预定参数的计算机模型。在一些实施方案中,所述方法还包括在打印步骤之前将预定参数输入到三维打印机。在一些实施方案中,将顶层打印在所述多层结构的顶部。可以在所述多层结构之前或之后打印所述顶层。例如,在一些实施方案中,提供了用于口服药物剂型的三维打印(例如通过fdm(诸如非线材fdm)的三维打印)的方法,所述药物剂型被配制和配置为提供药物目标释放曲线,其中所述口服药物剂型包括多层结构,所述多层结构包括多个具有预定的药物质量分数(mf)的混合有药物的第一溶蚀材料层,其中第一溶蚀材料嵌入未混合有所述药物的第二材料中,所述方法包括:(a)将药物目标释放曲线划分为多个时间间隔(tn),每个时间间隔对应于多层结构中的一层;(b)确定(或计算)每个时间间隔内待释放药物的百分比(%l);(c)基于第一溶蚀材料的溶蚀速率(v)确定(或计算)多层结构的各层的厚度(hn),其中hn=tn*v;(d)基于%l、hn、mf、口服药物剂型中的药物总量(mdtot)和第一溶蚀材料的密度(ρ)确定(或计算)各层的表面积,其中:(e)基于所确定各层的hn和sn,打印(或沉积)混合有所述药物的第一溶蚀材料,从而打印所述多层结构;(f)在所述多层结构的顶部上打印(或沉积)未混合有所述药物的顶部溶蚀材料以形成顶层,其中所述顶层的表面积与紧邻所述顶层之下的所述多层结构的所述第一层相同或较大;以及(g)在步骤(e)之前、之后或之中,打印未混合有所述药物的第二材料。在一些实施方案中,所述顶层的厚度基于所述药物从所述多层结构释放的所需的延迟时间确定。在一些实施方案中,所述顶部溶蚀材料与所述第一溶蚀材料相同。在一些实施方案中,所述顶部溶蚀材料与所述第一溶蚀材料不同。在一些实施方案中,所述口服药物剂型的释放曲线与基于chow’s方法或相似因子计算方法的目标释放曲线相同。在一些实施方案中,所述方法还包括在打印步骤之前创建药物剂型的虚拟图像。在一些实施方案中,所述方法还包括在打印步骤之前创建包含预定参数的计算机模型。在一些实施方案中,所述方法还包括在打印步骤之前将预定参数输入到三维打印机。在一些实施方案中,所述方法还包括打印不能渗透体液的隔离材料,其中所述隔离材料在体液与多层结构的至少一部分之间形成屏障。在一些实施方案中,所述方法还包括打印未混合有所述药物的中间材料,其中所述中间材料在两层或多层第一溶蚀材料之间形成一层或多层中间层。在一些实施方案中,提供了用于口服药物剂型的三维打印(例如通过fdm的三维打印,诸如非线材fdm)的方法,所述药物剂型被配制和配置为提供药物目标释放曲线,其中所述口服药物剂型包括多层结构,所述多层结构包括多个具有预定的药物质量分数(mf)的混合有药物的第一溶蚀材料层,其中第一溶蚀材料嵌入未混合有所述药物的第二材料中,所述方法包括:(a)将药物目标释放曲线划分为多个时间间隔(tn),每个时间间隔对应于多层结构中的一层;(b)确定(或计算)每个时间间隔内待释放药物的百分比(%l);(c)基于第一溶蚀材料的溶蚀速率(v)确定(或计算)多层结构的各层的厚度(hn),其中hn=tn*v;(d)基于%l、hn、mf、口服药物剂型中的药物总量(mdtot)和第一溶蚀材料的密度(ρ)确定(或计算)各层的表面积,其中:(e)基于所确定各层的hn和sn,打印(或沉积)混合有所述药物的第一溶蚀材料,从而打印所述多层结构;(f)在所述多层结构的顶部上打印(或沉积)未混合有所述药物的顶部溶蚀材料以形成顶层,其中所述顶层的表面积与紧邻所述顶层之下的所述多层结构的所述第一层相同或较大;(g)在步骤(e)之前、之后或之中,打印未混合有所述药物的第二材料;(h)确定通过步骤(a)-(g)产生的口服药物剂型的药物释放曲线;(i)将口服药物剂型的药物释放曲线与药物目标释放曲线进行比较;(j)调整选自以下的一个或多个参数:第一溶蚀材料、第二材料、第一溶蚀材料的一层或多层的表面积,第一溶蚀材料的一层或多层的厚度,和在第一溶蚀材料的一层或多层中药物的质量分数;以及(k)基于调整后的参数三维打印第二口服药物剂型。在一些实施方案中,所述口服药物剂型的释放曲线与基于chow’s方法或相似因子计算方法的目标释放曲线相同。在一些实施方案中,所述方法还包括在打印步骤之前创建药物剂型的虚拟图像。在一些实施方案中,所述方法还包括在打印步骤之前创建包含预定参数的计算机模型。在一些实施方案中,所述方法还包括在打印步骤之前将预定参数输入到三维打印机。在一些实施方案中,提供了用于口服药物剂型的三维打印(例如通过fdm的三维打印,诸如非线材fdm)的方法,所述口服药物剂型被配制和配置为提供药物目标释放曲线,其中所述口服药物剂型包括多层结构,所述多层结构包括多个具有预定的药物质量分数(mf)的混合有药物的第一溶蚀材料层,其中第一溶蚀材料嵌入未混合有所述药物的第二材料中,所述方法包括:(a)确定原始口服药物剂型的药物释放曲线;(b)将口服药物剂型的药物释放曲线与药物目标释放曲线进行比较;(c)调整选自以下的一个或多个参数:第一溶蚀材料、第二材料、第一溶蚀材料的一层或多层的表面积,第一溶蚀材料的一层或多层的厚度,和在第一溶蚀材料的一层或多层中药物的质量分数;以及(d)基于调整后的参数三维打印口服药物剂型。在一些实施方案中,所述口服药物剂型的释放曲线与基于chow’s方法或相似因子计算方法的目标释放曲线相同。在一些实施方案中,所述方法还包括在打印步骤之前创建药物剂型的虚拟图像。在一些实施方案中,所述方法还包括在打印步骤之前创建包含预定参数的计算机模型。在一些实施方案中,所述方法还包括在打印步骤之前将预定参数输入到三维打印机。在一些实施方案中,提供了用于口服药物剂型的三维打印(例如通过fdm的三维打印,诸如非线材fdm)的方法,将所述口服药物剂型配制和配置为提供药物目标释放曲线,其中所述药物剂型包括多层结构,所述多层结构包括多个具有预定厚度和预定表面积的混合有药物的第一溶蚀材料层,其中第一溶蚀材料嵌入未混合有所述药物的第二材料中,其中所述多层结构中的所述第一溶蚀材料的多个层中的各层的表面积从所述口药物服剂型的表面到内部依序减小,其中当所述口服剂型暴露于体液时,所述多个层以顺序的方式暴露于体液,其中具有最大表面积的层首先暴露于体液,所述方法包括:(a)基于所确定各层的hn和sn,打印(或沉积)混合有所述药物的第一溶蚀材料,从而打印所述多层结构;(b)在步骤(a)之前、之后或之中,打印未混合有所述药物的第二材料。在一些实施方案中,所述方法还包括在所述多层结构的顶部上打印未混合有所述药物的顶部溶蚀材料以形成顶层,其中所述顶层的表面积与紧邻所述顶层之下的所述多层结构的所述第一层相同或较大。在一些实施方案中,所述顶层的厚度基于所述药物从所述多层结构释放的所需的延迟时间确定。在一些实施方案中,所述方法还包括在打印步骤之前创建包含预定参数的计算机模型。在一些实施方案中,所述方法还包括在打印步骤之前将预定参数输入到三维打印机。在一些实施方案中,口服药物剂型包括两个或多个多层结构,并且任选地通过本文描述的任何方法依序地或同时地产生各个多层结构。因此,例如,在一些实施方案中,提供了用于口服药物剂型的三维打印的方法,将所述口服药物剂型配制和配置为提供第一药物目标释放曲线和第二药物目标释放曲线,其中所述药物剂型包括第一多层结构,所述第一多层结构包括多个具有预定的药物质量分数(mf)的混合有药物的第一溶蚀材料层,其中第一溶蚀材料嵌入未混合有所述药物的第二材料中,和第二多层结构包括多个具有预定药物的质量分数的混合有第四药物的第三溶蚀材料层,其中所述第三溶蚀材料嵌入未混合有所述药物的第四材料中,所述方法包括:(a)将各个药物目标释放曲线划分为多个时间间隔(tn),每个时间间隔对应于相应多层结构中的一层;(b)计算每个时间间隔内待释放药物的百分比(%l);(c)基于第一溶蚀材料或第三溶蚀材料的溶蚀速率(v)计算多层结构的各层的厚度(hn),其中hn=tn*v;(d)基于%l、hn、mf、口服药物剂型中的药物总量(mdtot)和第一或第一溶蚀材料的密度(ρ)计算各层的表面积,其中:(e)基于所确定各层的hn和sn,打印混合有所述第一药物的第一溶蚀材料和混合有所述第二药物的第三溶蚀材料,从而打印所述两个多层结构;(f)在步骤(e)之前、之后或之中,打印未混合有所述药物的第二材料和第四材料。在一些实施方案中,所述第一溶蚀材料和所述第三溶蚀材料是相同的。在一些实施方案中,所述第二材料和所述第四材料是相同的。在一些实施方案中,所述第一药物和所述第二药物是相同的。在一些实施方案中,所述第一药物和所述第二药物是不同的。剂型本申请还提供了通过本文所描述的3d打印方法生产的任何剂量要求。本公开内容提供了对于可实现目标释放曲线(如药物的目标释放曲线)的剂型(如药物剂型),其中所述剂型通过本公开任意的方法设计或3d打印,其中所述剂型包含多层结构,所述多层结构包含多个与化合物(例如药物)混合的第一溶蚀材料层,其中所述第一溶蚀材料嵌入不与化合物(例如药物)混合的第二材料中。在一些实施方案中,药物剂型的材料(例如与药物混合的第一溶蚀材料、不与药物混合的第二材料、间隔材料、隔离材料)被一体化(例如,不形成可能很容易分开的组件)。在一些实施方案中,第一溶蚀材料的多个层的层数在约5层至约2500层之间,例如在约10层至约2500层、约25层至约100层、约50层至约200层、约100层至约200层、约150层至约250层、约200层至约250层、约500层至约1000层、或约2000层至约2400层中的任何一个。在一些实施例中,至少两层第一溶蚀材料层的表面积彼此不同。在一些实施例中,至少两层第一溶蚀材料层的表面积相同。在一些实施例中,多个第一溶蚀材料层的每一层的厚度相同。在一些实施例中,至少两层第一溶蚀材料层的厚度彼此不同。在一些实施例中,多个第一溶蚀材料层的每一层中的药物质量分数相同。在一些实施方案中,至少两层第一溶蚀材料层中的药物质量分数彼此不同。在一些实施例中,第二材料是第二溶蚀材料。在一些实施例中,第一溶蚀材料和第二溶蚀材料彼此不同。在一些实施例中,第一溶蚀材料和第二溶蚀材料相同。在一些实施例中,第二材料是对于体液(例如胃肠液)来说不可渗透的隔离材料,其中所述隔离材料在体液与多层结构的一部分之间形成屏障。在一些实施例中,隔离材料是非溶蚀的。在一些实施方案中,药物剂型还包含对于体液(例如胃肠液)来说不可渗透的隔离材料,其中所述隔离材料在体液和多层结构的一部分之间形成屏障。在一些实施例中,第一溶蚀材料和第二材料具有相同的溶蚀速率,其中所述第二材料是第二溶蚀材料。在一些实施方案中,每一层的厚度为不大于约22毫米,例如不大于约21毫米、20毫米、19毫米、18毫米、17毫米、16毫米、15毫米、14毫米、13毫米、12毫米、11毫米、10毫米、9毫米、8毫米、7毫米、6毫米、5毫米、4毫米、3毫米、2毫米、1毫米、0.9毫米、0.8毫米、0.7毫米、0.6毫米、0.5毫米、0.4毫米、0.3毫米、0.2毫米、0.1毫米、0.09毫米、0.08毫米、0.07毫米、0.06毫米、0.05毫米、0.04毫米、0.03毫米、0.02毫米或0.01毫米中的任何一个。在一些实施方案中,某一层的厚度为不大于约22毫米,例如不大于约21毫米、20毫米、19毫米、18毫米、17毫米、16毫米、15毫米、14毫米、13毫米、12毫米、11毫米、10毫米、9毫米、8毫米、7毫米、6毫米、5毫米、4毫米、3毫米、2毫米、1毫米、0.9毫米、0.8毫米、0.7毫米、0.6毫米、0.5毫米、0.4毫米、0.3毫米、0.2毫米、0.1毫米、0.09毫米、0.08毫米、0.07毫米、0.06毫米、0.05毫米、0.04毫米、0.03毫米、0.02毫米或0.01毫米中的任何一个。在一些实施方案中,某一层的厚度为约22毫米、21毫米、20毫米、19毫米、18毫米、17毫米、16毫米、15毫米、14毫米、13毫米、12毫米、11毫米、10毫米、9毫米、8毫米、7毫米、6毫米、5毫米、4毫米、3毫米、2毫米、1毫米、0.9毫米、0.8毫米、0.7毫米、0.6毫米、0.5毫米、0.4毫米、0.3毫米、0.2毫米、0.1毫米,0.09毫米、0.08毫米、0.07毫米、0.06毫米、0.05毫米、0.04毫米、0.03毫米、0.02毫米或0.01毫米中的任何一个。在一些实施方案中,药物剂型还包含未与药物混合的间隔材料,其中间隔材料在两层或更多层第一溶蚀材料层之间形成间隔层。在一些实施例中,间隔材料与第一溶蚀材料和/或第二材料相同。在一些实施例中,间隔材料不同于第一可溶蚀材料和/或第二材料。本文所述的药物剂型可以包含任何数量的药物。在一些实施方案中,药物剂型包含两种或更多种药物,例如3、4、5、6、7、8、9或10种药物中的任一种。在一些实施方案中,药物剂型还进一步包含第二药物。在一些实施方案中,第二药物与第一溶蚀材料混合。在一些实施例中,第二药物与隔离材料混合,其中所述第二药物从隔离材料释放。在一些实施方案中,药物剂型还包含与第二药物混合的第三溶蚀材料,其中多层结构还包含嵌入第二材料中的多个第三溶蚀材料层。在一些实施例中,每一层第三溶蚀材料层具有预定的表面积、厚度和药物质量分数,其中预定的表面积、厚度和/或药物质量分数与第二种药物目标释放曲线相关,并且当暴露于体液例如胃肠液时,第二药物的释放与第二种药物目标释放曲线一致。在一些实施例中,第三溶蚀材料与第一溶蚀材料和/或第二材料相同。在一些实施方案中,溶蚀材料的溶蚀是ph依赖型的。在一些实施例中,第一溶蚀材料的溶蚀是ph依赖型的。在一些实施方案中,第二溶蚀材料的溶蚀是ph依赖型的。在一些实施方案中,第三溶蚀材料的溶蚀是ph依赖型的。在一些实施例中,间隔材料的溶蚀是ph依赖型的。在一些实施方案中,可溶蚀材料的溶蚀发生ph在约5.5以上至约7。在一些实施方案中,可溶蚀材料的溶蚀发生在ph约5.5、约6、约6.5或约7以上。在一些实施例中,可溶蚀材料是肠溶包衣。在一些实施方式中,所述剂型(如口服药物剂型)通过例如嵌入、包裹或附着的形式覆膜或包衣(例如糖衣或明胶层包衣)。在一些实施方案中,药物剂型中药物的总质量在约1500毫克至约0.01毫克之间。在一些实施方案中,药物剂型中药物的总质量小于约1500毫克,例如小于约1400毫克、1300毫克、1200毫克、1100毫克、1000毫克、900毫克、800毫克、700毫克、600毫克、500毫克、450毫克、400毫克、350毫克、300毫克、250毫克、200毫克、150毫克、100毫克、75毫克、50毫克、45毫克、40毫克、35毫克、30毫克、25毫克、20毫克、15毫克、10毫克、5毫克、4毫克、3毫克、2毫克、1毫克、0.75毫克、0.5毫克、0.25毫克或0.1毫克中的任何一个。在一些实施方案中,药物剂型中药物的总质量为约1500毫克,例如约1400毫克、1300毫克、1200毫克、1100毫克、1000毫克、900毫克、800毫克、700毫克、600毫克、500毫克、450毫克、400毫克、350毫克、300毫克、250毫克、200毫克、150毫克、100毫克、75毫克、50毫克、45毫克、40毫克、35毫克、30毫克、25毫克、20毫克毫克、15毫克、10毫克、5毫克、4毫克、3毫克、2毫克、1毫克、0.75毫克、0.5毫克、0.25毫克或0.1毫克中的任何一个。在一些实施方案中,药物剂型中一个药物的质量在约1500毫克至约0.01毫克之间。在一些实施方案中,药物剂型中一个药物的质量小于约1500毫克,例如小于约1400毫克、1300毫克、1200毫克、1100毫克、1000毫克、900毫克、800毫克、700毫克、600毫克、500毫克、450毫克、400毫克、350毫克、300毫克、250毫克、200毫克、150毫克、100毫克、75毫克、50毫克、45毫克、40毫克、35毫克、30毫克、25毫克、20毫克、15毫克、10毫克、5毫克、4毫克、3毫克、2毫克、1毫克、0.75毫克、0.5毫克、0.25毫克或0.1毫克中的任何一个。在一些实施方案中,药物剂型中一个药物的质量为约1500毫克,例如约1400毫克、1300毫克、1200毫克、1100毫克、1000毫克、900毫克、800毫克、700毫克、600毫克、500毫克、450毫克、400毫克、350毫克、300毫克、250毫克、200毫克、150毫克、100毫克、75毫克、50毫克、45毫克、40毫克、35毫克、30毫克、25毫克、20毫克毫克、15毫克、10毫克、5毫克、4毫克、3毫克、2毫克、1毫克、0.75毫克、0.5毫克、0.25毫克或0.1毫克中的任何一个。在一些实施方案中,本文所述药物剂型的材料(包括第一溶蚀材料、第二材料、第二溶蚀材料、间隔材料、间隔溶蚀材料和隔离材料)还进一步包含另一种试剂。在一些实施方案中,其他试剂是一种辅料。在一些实施方案中,其他试剂是一种填充剂。在一些实施方案中,另一种试剂是遮光剂,例如不透明剂(opacifier)。在一些实施方案中,药物剂型适用于口服给药。本发明的药物剂型可以是适合特定患者(例如儿童和成人)口服的任何尺寸、形状或重量。在一些实施方案中,药物剂型适合于口服给予个体,其中药物剂型的大小、形状或重量的选择基于个体的属性。在一些实施例中,个体的属性是身高、体重或年龄中的一个或多个。在一些实施方案中,药物剂型的尺寸小于约22毫米,例如小于约21毫米、20毫米、19毫米、18毫米、20毫米、17毫米、16毫米、15毫米、14毫米、13毫米、12毫米、11毫米、10毫米、9毫米、8毫米、7毫米、6毫米、5毫米、4毫米、3毫米、2毫米或小于约1毫米。在一些实施方案中,药物剂型的尺寸为约1毫米至约22毫米,例如约21毫米、20毫米、19毫米、18毫米、17毫米、16毫米、15毫米、14毫米、13毫米、12毫米、11毫米、10毫米、9毫米、8毫米、7毫米、6毫米、5毫米、4毫米、3毫米或约2毫米。在一些实施方案中,药物剂型对于其预期用途(例如植入剂)具有合适的尺寸和形状。在一些实施方案中,药物剂型的总重量为约50-600毫克,例如约50-100、100-150、150-200、200-250、250-300、300-350、350-400、400-450、450-500、500-550或550-600毫克中的任一种。在一些实施方案中,药物剂型具有约50-400毫克的总重量。在一些实施方案中,药物剂型具有约75-300毫克的总重量。在一些实施方案中,药物剂型具有约100-200毫克的总重量。在一些实施方案中,药物剂型的总重量小于约600毫克、550毫克、500毫克、450毫克、400毫克、350毫克、300毫克、250毫克、200毫克、150毫克、100毫克、75毫克、或50毫克。图2b示出了用来实现药物目标释放曲线的示例性药物剂型240,其包括多层结构,该多层结构包括多个与药物混合的第一溶蚀材料层255,其中第一溶蚀材料嵌入不与药物混合的第二材料250。示例性药物剂型240还包括包围了除顶面之外的所有表面的隔离材料245。与药物混合的第一溶蚀材料的溶蚀方向由箭头260表示。未与药物混合的第二材料250可以选择是第二溶蚀材料。图2c显示了用来实现药物目标释放曲线的示例性药物剂型265,其包含多层结构,该多层结构包含多个与药物混合的第一溶蚀材料层280,其中第一溶蚀材料嵌入不与药物混合的第二材料275。示例性药物剂型265还包括包围了除顶面之外的所有表面的隔离材料270。与药物混合的第一溶蚀材料的溶蚀方向由箭头285表示。未与药物混合的第二材料275可以选择是第二溶蚀材料。图3a示出了用来实现药物目标释放曲线的示例性药物剂型300,其包括多层结构,该多层结构包括多个与药物混合的第一溶蚀材料层315,其中第一溶蚀材料嵌入不与药物混合的第二材料305(图示为半透明材料以允许其他组分清楚显示)。示例性药物剂型300还包括包围了除顶面之外的所有表面的隔离材料305。与药物混合的第一溶蚀材料的溶蚀方向由箭头320指示。未与药物混合的第二材料305可以选择是第二溶蚀材料。图4c显示了用来实现药物目标释放曲线的示例性药物剂型425,其包含多个多层结构,所述多层结构包含多个与药物混合的第一溶蚀材料层428、433、441,其中第一溶蚀材料被嵌入不与药物混合的第二材料429中。示例性药物剂型还包括隔离材料430,所述隔离材料用于控制每个包含多个与药物混合的第一溶蚀材料层的多层结构暴露于体液如胃肠液(也参见图4b)。未与药物混合的第二材料429可以选择是第二溶蚀材料。图5显示了用来实现药物目标释放曲线的示例性药物剂型500的横截面图,其包含多层结构,所述多层结构包含多个与药物混合的第一溶蚀材料层505、510、515,其中所述第一溶蚀材料嵌入未与药物混合的第二材料520中。未与药物混合的第二材料520可以选择是第二溶蚀材料。图6显示了用来实现药物目标释放曲线的示例性药物剂型600的截面图,其包含多层结构,所述多层结构包含多个与药物混合的第一溶蚀材料层612-618、622-628、632-638、642-648,其中所述第一溶蚀材料嵌入未与药物混合的第二材料610、620、630、640中。不与药物混合的第二材料610、620、630、640中的一种或多种可以选择是第二溶蚀材料。图8a示出了用来实现药物目标释放曲线的示例性药物剂型800,其包括多层结构,所述多层结构包括多个与药物混合的第一溶蚀材料层810,其中第一溶蚀材料嵌入未与药物混合的第二材料820(图示为半透明材料以允许其他组分清楚显示)。药物剂型800包括由未与药物混合的第二材料形成的凸缘805,其中凸缘在多层结构的顶部形成空间815(图8a)。药物剂型800的横截面在图8b中示出。通过箭头825指示与药物混合的第一溶蚀材料810的溶蚀方向(图8b)。图9a示出了用来实现药物目标释放曲线的示例性药物剂型900,其包括多层结构,该多层结构包括多个与药物混合的第一溶蚀材料层910,其中第一溶蚀材料嵌入不与药物混合的第二材料920(被描绘为半透明材料以允许其他组分清楚显示)。药物剂型还包含与另一种药物混合的第三溶蚀材料层925,其中与另一种药物混合的第三溶蚀材料层被嵌入未与药物混合的第二材料中(图9a)。药物剂型900包括由未与药物混合的第二材料905形成的凸缘,其中凸缘在多层结构的顶部形成空间915(图9a)。药物剂型900的横截面图在图9b中示出。用箭头930指示与药物混合的第一溶蚀材料910的溶蚀方向,并且用箭头935(图9b)指示与另一药物混合的第三溶蚀材料925的溶蚀方向。附加的示例性实施方案实施方案1.一种用于药物剂型的三维打印的方法,所述药物剂型被配制和配置为提供药物目标释放曲线,包括打印混合有药物的第一溶蚀材料和未混合有所述药物的第二材料以产生多层结构,所述多层结构包括多个第一溶蚀材料层,其中第一溶蚀材料嵌入第二材料中,其中第一溶蚀材料的各层具有预定的表面积、厚度和药物质量分数,其中所述预定的表面积、厚度和/或药物质量分数与药物目标释放曲线相关,并且其中当暴露于体液时,根据药物目标释放曲线释放药物。实施方案2.根据实施方案1所述的方法,所述方法进一步包括在打印步骤之前提供所述药物目标释放曲线。实施方案3.根据实施方案1或2所述的方法,所述方法进一步包括在打印步骤之前创建药物剂型的虚拟图像。实施方案4.根据实施方案1-3中任一项所述的方法,所述方法进一步包括在打印步骤之前创建包含预定参数的计算机模型。实施方案5.根据实施方案1-4中任一项所述的方法,所述方法进一步包括在打印步骤之前将所述预定参数输送到所述三维打印机。实施方案6.根据实施方案1-5中任一项所述的方法,其中混合有所述药物的第一溶蚀材料和未混合有所述药物的第二材料分别打印。实施方案7.根据实施方案1-6中任一项所述的方法,其中混合有所述药物的第一溶蚀材料和未混合有所述药物的第二材料依序打印。实施方案8.根据实施方案1-7中任一项所述的方法,其中所述第一溶蚀材料的表面积在至少两个层中彼此不同。实施方案9.根据实施方案1-8中任一项所述的方法,其中所述多个第一溶蚀材料层中的每一层的厚度相同。实施方案10.根据实施方案1-8中任一项所述的方法,其中所述多个第一溶蚀材料层中至少两层的厚度彼此不同。实施方案11.根据实施方案1-10中任一项所述的方法,其中所述多个第一溶蚀材料层中的各个层中的药物质量分数相同。实施方案12.根据实施方案1-10中任一项所述的方法,其中所述第一溶蚀材料层中至少两层的药物质量分数彼此不同。实施方案13.根据实施方案1-12中任一项所述的方法,其中所述第二材料是第二溶蚀材料。实施方案14.根据实施方案13所述的方法,其中所述第一溶蚀材料和所述第二溶蚀材料彼此不同。实施方案15.根据实施方案13所述的方法,其中所述第一溶蚀材料和所述第二溶蚀材料相同。实施方案16.根据实施方案1-12中任一项所述的方法,所述第二材料是不能渗透体液的隔离材料,其中所述隔离材料在体液与多层结构的至少一部分之间形成屏障。实施方案17.根据实施方案13-15中任一项所述的方法,所述方法进一步包括打印不能渗透体液的隔离材料,其中所述隔离材料在体液和多层结构的至少一部分之间形成屏障。实施方案18.根据实施方案1-17中任一项所述的方法,其中所述第一溶蚀材料和第二材料由不同的打印头打印。实施方案19.根据实施方案17所述的方法,其中所述第一溶蚀材料、第二材料和隔离材料由不同的打印头打印。实施方案20.根据实施方案1-19中任一项所述的方法,其中所述三维打印通过熔融沉积成型(fdm)来实现。实施方案21.根据实施方案20所述的方法,其中所述fdm是非线材fdm。实施方案22.根据实施方案1-15中任一项所述的方法,其中所述第一溶蚀材料和第二材料具有相同的溶蚀速率。实施方案23.根据实施方案1-22中任一项所述的方法,其中所述每层的厚度不大于约0.2毫米。实施方案24.根据实施方案1-15和17-23中任一项所述的方法,所述方法进一步包括打印未混合有所述药物的间隔材料,其中所述间隔材料在两层或更多层第一溶蚀材料层之间形成间隔层。实施方案25.根据实施方案24所述的方法,其中所述间隔材料与所述第一溶蚀材料或第二材料相同。实施方案26.根据实施方案16所述的方法,所述方法进一步包括打印未混合有所述药物的间隔材料,其中所述间隔材料在两层或更多层第一溶蚀材料层之间形成间隔层。实施方案27.根据实施方案26所述的方法,其中所述间隔材料与所述第一溶蚀材料相同。实施方案28.根据实施方案1-27中任一项所述的方法,其中所述药物以增加的速率释放。实施方案29.根据实施方案1-27中任一项所述的方法,其中所述药物以降低的速率释放。实施方案30.根据实施方案1-27中任一项所述的方法,其中所述药物以先增加后降低的速率释放,反之亦可。实施方案31.根据实施方案1-27中任一项所述的方法,其中所述药物将以振荡模式释放。实施方案32.根据实施方案1-31中任一项所述的方法,其中所述药物剂型进一步包含第二药物。实施方案33.根据实施方案32所述的方法,其中第一溶蚀材料混合有第二药物。实施方案34.根据实施方案1-33中任一项所述的方法,所述方法进一步包括打印混合有第二药物的第三溶蚀材料,其中所述多层结构进一步包括多层第三溶蚀材料,其中所述第三材料被嵌入在第二材料中。实施方案35.根据实施方案34所述的方法,其中所述每一层第三溶蚀材料层具有预定的表面积、厚度和药物质量分数,其中所述预定表面积、厚度和/或药物质量分数与第二期望的药物释放曲线相关,并且当暴露于体液时,其中所述第二药物的释放与第二药物目标释放曲线一致。实施方案36.根据实施方案34或35所述的方法,其中所述第三溶蚀材料与所述第一溶蚀材料相同。实施方案37.根据实施方案1-36中任一项所述的方法,其中所述第一溶蚀材料的溶蚀是ph依赖型的。实施方案38.根据实施方案34-37中任一项所述的方法,其中所述第三溶蚀材料的溶蚀是ph依赖型的。实施方案39.根据实施方案1-38中任一项所述的方法,其中所述药物剂型是口服药物剂型。实施方案40.根据实施方案1至39中任一项所述的方法,其中所述体液是胃肠液。实施方案41.一种设计药物剂型的方法以提供药物目标释放曲线,其中所述药物剂型包含多层结构,其中所述多层结构包含多个混合有所述药物的第一溶蚀材料层,其中所述第一溶蚀材料嵌入未混合有所述药物的第二材料中,所述方法包括:(a)选择第一溶蚀材料和第二材料以形成多层结构;(b)获得第一溶蚀材料的溶蚀速率;和(c)基于药物的释放速率和药物目标释放曲线确定各层的厚度、表面积和/或药物质量分数。实施方案42.根据实施方案41所述的方法,所述方法进一步包括获得药物目标释放曲线。实施方案43.根据实施方案41或42所述的方法,所述方法进一步包括基于确定的厚度、表面积和/或药物质量分数打印混合有所述药物的第一溶蚀材料和未混合有所述药物的第二材料。实施方案44.根据实施方案41-43中任一项所述的方法,其中所述多层结构进一步包括混合有第二药物的第三可溶蚀材料的多个第二层,并且其中所述方法还包括:确定第三溶蚀材料中的第二药物的药物释放速率;并且基于第二药物的释放速率和药物目标释放曲线确定各个第二层的厚度、表面积和/或药物质量分数。实施方案45.根据实施方案44所述的方法,所述方法进一步包括基于所确定的厚度、表面积和/或药物质量分数来打印混合有第二药物的第三溶蚀材料。实施方案46.一种药物剂型的三维打印方法,将所述药物剂型配制和配置为提供目标释放曲线,其中所述药物剂型包含多层结构,所述多层结构包含多个混合有所述药物的第一溶蚀材料层,其中所述第一溶蚀材料嵌入未混合有所述药物的第二材料中,所述方法包括:(a)基于药物的释放速率和药物目标释放曲线确定各层的厚度、表面积和/或药物质量分数;和(b)基于所确定的厚度、表面积和/或药物质量分数打印混合有所述药物第一溶蚀材料和未混合有所述药物的第二材料。实施方案47.根据实施方案41-46中任一项所述的方法,其中所述第一溶蚀材料层的厚度(h)是由混合有所述药物的第一溶蚀材料的溶蚀速率(ve)和药物释放曲线上的两个不同的数据点的时间间隔(te)来确定,其中h=te*ve。实施方案48.根据实施方案47所述的方法,其中所述第一溶蚀材料中的药物质量分数(mf),是由溶蚀材料层中所混合药物在药物剂型的药物总量中所占的百分数(以小数形式)(%l)、药物剂型中药物的总质量(mdtot),混合有所述药物的溶蚀材料的密度(ρ)以及溶蚀材料层的体积(vvol)来确定,其中实施方案49.根据实施方案48所述的方法,其中同时暴露于体液的所述第一溶蚀材料层的总表面积(st)由所述药物质量分数(mf)和第一溶蚀材料层的厚度来确定,其中。实施方案50.根据实施方案1-40和46-49中任一项所述的方法,其中所述方法进一步包括:i)确定所生产药物剂型的药物释放曲线;ii)将所述药物剂型的药物释放曲线与药物目标释放曲线进行比较;以及iii)通过改变以下中的一个或多个参数来调整药物剂型的设计:第一溶蚀材料、第二材料、一层或多层第一溶蚀材料层的表面积、一层或多层第一溶蚀材料层的厚度、一层或多层第一溶蚀材料层中的药物的质量分数。实施方案51.根据实施方案1-50中任一项所述的方法生产的药物剂型。实施方案52.根据实施方案51所述的药物剂型,其中所述药物剂型进一步包含肠溶衣。实施方案1’.一种用于口服药物剂型的三维打印的方法,将所述口服药物剂型配制和配置为提供药物目标释放曲线,其中所述药物剂型包括多层结构,所述多层结构包括混合有所述药物的多个第一溶蚀材料层,其中所述第一溶蚀材料嵌入未混合有所述药物的第二材料中,并且其中所述第二材料是体液不可渗透的绝缘材料,并且其中所述隔离材料在体液和所述多层结构中至少一部分之间形成屏障,所述方法包括:(a)在各层中提供厚度和药物质量分数;(b)根据所述药物的释放速率和药物目标释放曲线确定各层的表面积;(b)根据所提供的厚度和药物质量分数以及所确定的厚度打印混合有所述药物的第一溶蚀材料;(c)在步骤(b)之前、之后或之中打印未混合有所述药物的第二材料。实施方案2’.根据实施方案1’所述的方法,其中在所述多层结构中的第一溶蚀材料的各层上的表面积是连续的。实施方案3’.根据实施方案1’所述的方法,其中在所述多层结构中的第一溶蚀材料的各层上的表面积是不连续的。实施方案4’.根据实施方案1’所述的方法,其中所述方法进一步包括基于所述剂型中的第一溶蚀材料的层数,将药物目标释放曲线划分为所述药物释放曲线上两个不同数据点之间的时间间隔(te)。实施方案5’.根据实施方案4’所述的方法,其中所述第一溶蚀材料层的厚度(h)是基于混合有所述药物的第一溶蚀材料的溶蚀速率(ve)和时间间隔(te),其基于h=te*ve。实施方案6’.根据实施方案5’所述的方法,其中所述第一溶蚀材料中的药物质量分数(mf),是由溶蚀材料层中所混合药物在药物剂型的药物总量中所占的百分数(%l)、药物剂型中药物的总质量(mdtot),混合有所述药物的溶蚀材料的密度(ρ)以及溶蚀材料层的体积(vvol)来确定,其中实施方案7’.根据实施方案6’所述的方法,其中同时暴露于体液的所述第一溶蚀材料层的总表面积(st)由药物质量分数(mf)和第一溶蚀材料层的厚度来确定,其中实施方案8’.根据实施方案1’-7’中任一项所述的方法,所述方法进一步包括i)确定所生产药物剂型的药物释放曲线;ii)将所述药物剂型的药物释放曲线与药物目标释放曲线进行比较;iii)通过改变以下一个或多个参数来调整药物剂型的设计:第一溶蚀材料、第二材料、第一溶蚀材料的一层或多层的表面积,第一溶蚀材料的一层或多层的厚度,和第一溶蚀材料的一层或多层中的药物质量分数。实施方案9’.根据实施方案1’-8’中任一项所述的方法,所述方法进一步包括打印混合有第二药物的第三溶蚀材料和未混合有所述第二药物的第二材料以生产第三溶蚀材料的结构,其中第三溶蚀材料嵌入在所述第二材料中,并且其中当暴露于体液时,根据第二药物目标释放曲线释放所述第二药物。实施方案10’.根据实施方案1’-9’中任一项所述的方法,所述方法进一步包括在确定各层的厚度、表面积和药物质量分数之前,选择用于形成多层结构的第一溶蚀材料和第二材料并且获得第一溶蚀材料的溶蚀速率。实施方案11’.根据实施方案1’-10’中任一项所述的方法,所述方法进一步包括在所述确定步骤之前提供药物目标释放曲线。实施方案12’.根据实施方案1’-11’中任一项所述的方法,所述方法进一步包括在打印步骤之前,根据所确定的参数创建药物剂型的虚拟图像。实施方案13’.根据实施方案1’-12’中任一项所述的方法,其中将混合有所述药物的第一溶蚀材料和未混合有所述药物的第二材料分别打印。实施方案14’.根据实施方案1’-13’中任一项所述的方法,其中各层的厚度不超过约0.2mm。实施方案15’.根据实施方案1’-14’中任一项所述的方法,其中所述多层结构中的多个层的第一溶蚀材料的每一层的表面积从所述口服药物剂型的表面到内部依序减小,其中当所述口服药物剂型暴露于体液时,所述多个层以依序的方式暴露于体液中,其中具有最大表面积的层首先暴露于体液。实施方案16’.根据实施方案1’-15’中任一项所述的方法,其中三维打印是通过熔融沉积成型(fdm)来实现。实施方案17’.根据实施方案16’所述的方法,其中所述fdm是非线材fdm。实施方案18’.根据实施方案1’-17’中任一项所述的方法,其中所述目标释放曲线是脉冲释放曲线。实施方案19’.根据实施方案1’-17’中任一项所述的方法,其中所述药物以一级释放曲线释放。实施方案20’.根据实施方案1’-19’中任一项所述的方法生产的口服药物剂型。实施方案21’.一种设计口服药物剂型以提供药物目标释放曲线的的方法,其中所述药物剂型包括多层结构,所述多层结构包含混合有所述药物的多层第一溶蚀材料,其中所述第一溶蚀材料嵌入未混合有所述药物的第二种材料中,所述方法包括:(a)选择第一溶蚀材料和第二材料以形成包含多层结构的口服药物剂型;(b)获得第一溶蚀材料的溶蚀速率;以及(c)根据药物的释放速率和药物目标释放曲线确定各层的厚度、表面积和药物质量分数。实施方案22’.根据实施方案24所述的方法,所述方法进一步包括基于所确定的厚度、表面积和药物质量分数,打印混合有所述药物的第一溶蚀材料和未混合有所述药物的第二材料。实施方案1”.一种用于口服药物剂型的三维打印的方法,将所述口服药物剂型配制和配置为提供药物目标释放曲线,其中所述药物剂型包括多层结构,所述多层结构包括混合有所述药物的多个第一溶蚀材料层,其中所述第一溶蚀材料嵌入未混合有所述药物的第二材料中,并且其中所述第二材料是体液不可渗透的绝缘材料,并且其中所述隔离材料在体液和所述多层结构中至少一部分之间形成屏障,所述方法包括:(a)根据药物的释放速率和药物目标释放曲线确定各层的厚度、表面积和药物质量分数;(b)基于所确定的厚度、表面积和药物质量分数打印混合有所述药物的第一溶蚀材料;(c)在步骤(b)之前、之后或之中打印未混合有所述药物的第二材料。实施方案2”.根据实施方案1”所述的方法,其中所述第二材料是第二溶蚀材料。实施方案3”.根据实施方案1”所述的方法,其中所述第二材料是体液不可渗透的隔离材料,并且其中所述隔离材料在体液和多层结构的至少一部分之间形成屏障。实施方案4”.根据实施方案1”-3”中任一项所述的方法,其中多层结构中的第一溶蚀材料的各层的厚度和药物分数是恒定的,并且各层的表面积与药物目标释放曲线相关。实施方案5”.根据实施方案4”所述的方法,其中所述第一溶蚀材料的表面积在至少两个层中彼此不同。实施方案6”.根据实施方案1”-5”中任一项所述的方法,其中在所述多层结构中的第一溶蚀材料的各层上的表面积是连续的。实施方案6”.根据实施方案1”-5”中任一项所述的方法,其中在所述多层结构中的第一溶蚀材料的各层上的表面积是不连续的。实施方案7”.根据实施方案1”-6”中任一项所述的方法,其中所述方法进一步包括基于所述剂型中的第一溶蚀材料的层数,将药物目标释放曲线划分为所述药物释放曲线上两个不同数据点之间的时间间隔(te)。实施方案8”.根据实施方案7”所述的方法,其中所述第一溶蚀材料层的厚度(h)是基于混合有所述药物的第一溶蚀材料的溶蚀速率(ve)和时间间隔(te),其基于h=te*ve。实施方案9”.根据实施方案8”所述的方法,其中所述第一溶蚀材料中的药物质量分数(mf),是由溶蚀材料层中所混合药物在药物剂型的药物总量中所占的百分数(以小数形式)(%l)、药物剂型中药物的总质量(mdtot),混合有所述药物的溶蚀材料的密度(ρ)以及溶蚀材料层的体积(vvol)来确定,其中实施方案10”.根据实施方案9”所述的方法,其中同时暴露于体液的所述第一溶蚀材料层的总表面积(st)由药物质量分数(mf)和第一溶蚀材料层的厚度来确定,其中实施方案11”.根据实施方案1”-10”中任一项所述的方法,所述方法进一步包括i)确定所生产药物剂型的药物释放曲线;ii)将所述药物剂型的药物释放曲线与药物目标释放曲线进行比较;iii)通过改变以下一个或多个参数来调整药物剂型的设计:第一溶蚀材料、第二材料、第一溶蚀材料的一层或多层的表面积,第一溶蚀材料的一层或多层的厚度,和第一溶蚀材料的一层或多层中的药物质量分数。实施方案12”.根据实施方案1”-11”中任一项所述的方法,所述方法进一步包括打印混合有第二药物的第三溶蚀材料和未混合有所述第二药物的第二材料以生产第三溶蚀材料的结构,其中第三溶蚀材料嵌入在所述第二材料中,并且其中当暴露于体液时,根据第二药物目标释放曲线释放所述第二药物。实施方案13”.根据实施方案1”-12”中任一项所述的方法,所述方法进一步包括在确定各层的厚度、表面积和药物质量分数之前,选择用于形成多层结构的第一溶蚀材料和第二材料并且获得第一溶蚀材料的溶蚀速率。实施方案14”.根据实施方案1”-13”中任一项所述的方法,所述方法进一步包括在所述确定步骤之前提供药物目标释放曲线。实施方案15”.根据实施方案1”-14”中任一项所述的方法,所述方法进一步包括在打印步骤之前,根据所确定的参数创建药物剂型的虚拟图像。实施方案16”.根据实施方案1”-15”中任一项所述的方法,其中将混合有所述药物的第一溶蚀材料和未混合有所述药物的第二材料分别打印。实施方案17”.根据实施方案1”-16”中任一项所述的方法,其中各层的厚度不超过约0.2mm。实施方案18”.根据实施方案1”-17”中任一项所述的方法,其中所述多层结构中的多个层的第一溶蚀材料的每一层的表面积从所述口服药物剂型的表面到内部依序减小,其中当所述口服药物剂型暴露于体液时,所述多个层以依序的方式暴露于体液中,其中具有最大表面积的层首先暴露于体液。实施方案19”.根据实施方案1”-18”中任一项所述的方法,其中三维打印是通过熔融沉积成型(fdm)来实现。实施方案20”.根据实施方案19”所述的方法,其中所述fdm是非线材fdm。实施方案21”.根据实施方案1”-20”中任一项所述的方法,其中所述目标释放曲线是脉冲释放曲线。实施方案22”.根据实施方案1”-20”中任一项所述的方法,其中所述药物以一级释放曲线释放。实施方案23”.根据实施方案1”-22”中任一项的所述的方法生产的口服药物剂型。实施方案24”.一种设计口服药物剂型以提供药物目标释放曲线的的方法,其中所述药物剂型包括多层结构,所述多层结构包含混合有所述药物的多层第一溶蚀材料,其中所述第一溶蚀材料嵌入未混合有所述药物的第二种材料中,所述方法包括:(a)选择第一溶蚀材料和第二材料以形成包含多层结构的口服药物剂型;(b)获得第一溶蚀材料的溶蚀速率;以及(c)根据药物的释放速率和药物目标释放曲线确定各层的厚度、表面积和药物质量分数。实施方案25”.根据实施方案24”所述的方法,所述方法进一步包括基于所确定的厚度、表面积和药物质量分数,打印混合有所述药物的第一溶蚀材料和未混合有所述药物的第二材料。实施方案1”’.提供了用于口服药物剂型的三维打印的方法,所述口服药物剂型被配制和配置为提供药物目标释放曲线,其中所述药物剂型包括多层结构,所述多层结构包括多个具有预定的药物质量分数(mf)的混合有药物的第一溶蚀材料层,其中第一溶蚀材料嵌入未混合有所述药物的第二材料中,所述方法包括:(a)将药物目标释放曲线划分为多个时间间隔(tn),每个时间间隔对应于多层结构中的一层;(b)计算每个时间间隔内待释放药物的百分比(%l);(c)基于第一溶蚀材料的溶蚀速率(v)计算多层结构的各层的厚度(hn),其中hn=tn*v;(d)基于%l、hn、mf、口服药物剂型中的药物总量(mdtot)和第一溶蚀材料的密度(ρ)计算各层的表面积,其中:(e)基于所确定各层的hn和sn,打印混合有所述药物的第一溶蚀材料,从而打印所述多层结构;以及(f)在步骤(e)之前、之后或之中,打印未混合有所述药物的第二材料。实施方案2”’.根据实施方案1”’所述的方法,所述方法进一步包括在所述多层结构的顶部上打印未混合有所述药物的顶部溶蚀材料以形成顶层,其中所述顶层的表面积与紧邻所述顶层之下的所述多层结构的所述第一层相同或较大。实施方案3”’.根据实施方案2”’所述的方法,其中所述顶层的厚度基于所述药物从所述多层结构释放所需的延迟时间确定。实施方案4”’.根据实施方案2”’或3”’所述的方法,其中所述顶部溶蚀材料与所述第一溶蚀材料相同。实施方案5”’.根据实施方案2”’或3”’所述的方法,其中所述顶部溶蚀材料与所述第一溶蚀材料不同。实施方案6”’.根据实施方案1”’-5”’中任一项所述的方法,其中所述第二材料是可溶蚀的。实施方案7”’.根据实施方案6”’所述的方法,其中所述第一溶蚀材料与所述第二材料具有相同的溶蚀速率。实施方案8”’.根据实施方案1”’-5”’中任一项所述的方法,其中所述第二材料是不能渗透体液的隔离材料,其中所述隔离材料在体液与多层结构的至少一部分之间形成屏障。实施方案9”’.根据实施方案1”’-8”’中任一项所述的方法,所述方法进一步包括打印不能渗透体液的隔离材料,其中所述隔离材料在体液与多层结构的至少一部分之间形成屏障。实施方案10”’.根据实施方案1”’-9”’中任一项所述的方法,所述方法还包括打印未混合有所述药物的中间材料,其中所述中间材料在两层或多层第一溶蚀材料之间形成一层或多层中间层。实施方案11”’.根据实施方案10”’所述的方法,其中所述中间材料与所述第一溶蚀材料相同。实施方案12”’.根据实施方案10”’所述的方法,其中所述中间层与所述第一溶蚀材料不同。实施方案13”’.根据实施方案1”’-12”’中任一项所述的方法,其中所述三维打印是通过熔融沉积成型(fdm)来实现。实施方案14”’.根据实施方案13”’所述的方法,其中所述fdm是非线材fdm。实施方案15”’.根据实施方案1”’-14”’中任一项所述的方法,其中所述第一溶蚀材料和所述第二材料由不同的打印头打印。实施方案16”’.根据实施方案2”’-15”’中任一项所述的方法,其中所述第一溶蚀材料和所述顶部溶蚀材料由不同的打印头打印。实施方案17”’.根据实施方案9”’-16”’中任一项所述的方法,其中所述第一溶蚀材料、第二材料和隔离材料由不同的打印头打印。实施方案18”’.根据实施方案1”’-17”’中任一项所述的方法,所述方法进一步包括:i)确定通过实施方案1”’-17”’中任一项所述的方法生产的所述口服药物剂型的药物释放曲线;ii)将所述口服药物剂型的药物释放曲线与药物目标释放曲线进行比较;iii)调整一个或多个参数,所述参数选自:所述第一溶蚀材料、所述第二材料、所述第一溶蚀材料的一层或多层的表面积、所述第一溶蚀材料的一层或多层的厚度、和所述第一溶蚀材料的一层或多层中所述药物的质量分数;以及iv)基于调整后的参数三维打印第二口服药物剂型。实施方案19”’.根据实施方案1”’-18”’中任一项所述的方法,其中所述口服药物剂型或第二口服药物剂型的释放曲线与基于chow’s方法或相似因子计算方法的目标释放曲线相同。实施方案20”’.根据实施方案1”’-19”’中任一项所述的方法,所述方法进一步包括在打印步骤之前创建药物剂型的虚拟图像。实施方案21”’.根据实施方案1”’-20”’中任一项所述的方法,所述方法进一步在打印步骤之前创建包含预定参数的计算机模型。实施方案22”’.根据实施方案1”’-21”’中任一项所述的方法,所述方法进一步包括在打印步骤之前将预定参数输入到三维打印机。实施方案23”’.根据实施方案1”’-22”’中任一项所述的方法,其中所述多层结构中的所述第一溶蚀材料的多个层中的各层的表面积从所述口服药物剂型的表面到内部依序减小,其中当所述口服药物剂型暴露于体液时,所述多个层以顺序的方式暴露于体液,其中具有最大表面积的层首先暴露于体液。实施方案24”’.根据实施方案1”’-23”’中任一项所述的方法,其中所述口服药物剂型包括两个或多个多层结构。实施方案25”’.提供了用于口服药物剂型的三维(“3d”)打印的方法,所述口服药物剂型被配制和配置为提供第一药物目标释放曲线和第二药物目标释放曲线,其特征在于,所述口服药物剂型包括第一多层结构和第二多层结构,所述第一多层结构包括多个具有预定的药物质量分数mf的混合有药物的第一溶蚀材料层,其中所述第一溶蚀材料嵌入未混合有第一药物的第二材料中,所述第二多层结构包括多个具有预定的药物质量分数的混合有第二药物的第三溶蚀材料,其中所述第三溶蚀材料嵌入未混合有所述药物的第四材料中,所述方法包括:(a)将各个药物目标释放曲线划分为多个时间间隔(tn),每个时间间隔对应于相应多层结构中的一层;(b)计算每个时间间隔内待释放药物的百分比(%l);(c)基于第一溶蚀材料或第三溶蚀材料的溶蚀速率(v)计算多层结构的各层的厚度(hn),其中hn=tn*v;(d)基于%l、hn、mf、口服药物剂型中的药物总量(mdtot)和第一或第一溶蚀材料的密度(ρ)计算各层的表面积,其中:(e)基于所确定的各层的hn和sn,打印混合有所述第一药物的第一溶蚀材料和混合有所述第二药物的第三溶蚀材料,从而打印两个多层结构;以及(f)在步骤(e)之前、之后或之中,打印未混合有药物的第二材料和第四材料。实施方案26”’.根据实施方案25”’所述的方法,其中所述第一溶蚀材料和所述第三溶蚀材料是相同的。实施方案27”’.根据实施方案25”’或26”’所述的方法,其中所述第二材料和所述第四材料是相同的。实施方案28”’.根据实施方案25”’-27”’中任一项所述的方法,其中所述第一药物和所述第二药物是相同的。实施方案29”’.根据实施方案25”’-28”’中任一项所述的方法,其中所述第一药物和所述第二药物是不同的。实施方案30”’.根据实施方案1”’-29”’中任一项所述的方法生产的口服药物剂型。本领域技术人员还将理解,可以在不脱离本公开的范围的情况下对本文所描述的实施方式的形式和细节进行改变。另外,虽然已经参照各种实施方式描述了各种优点、方面和目的,但是本公开的范围不应该通过参考这些优点、方面和目的来进行限制。相反,应该参照所附权利要求来确定本公开的范围。通过以下实施例进一步说明本公开,所述实施例不应被解释为将本公开的范围或精神限制于其中描述的特定程序。实施例实施例1设计可实现药物目标释放曲线的口服药物剂型本实施例展示了设计包含adhd非兴奋剂(可乐定,0.1毫克)和adhd兴奋剂(右哌甲酯,2.5毫克)的口服药物剂型,其中所述adhd非兴奋剂具有缓释曲线而adhd兴奋剂具有速释曲线。为可乐定的缓释曲线选择药物目标释放曲线(参见图10)。adhd非兴奋剂的药物目标释放曲线分为六个时间段。给药后的时间(小时)与给药后从药物剂型中释放的可乐定的累积百分比参见列表(表1)。表1.服药后可乐定释放的累积百分比服药后时间(小时)可乐定累计释放百分数(%)125240465680109512100使用该信息,每个时间段从药物剂型释放的总可乐定的百分比参见列表(表2)。如表2所示,每个时间段对应于药物剂型的多层结构中的一层。表2.每层中可乐定释量放占总可乐定质量的百分比根据表2的信息,通过适用于3d打印的口服药物剂型的假定的层厚度范围来计算多层结构中溶蚀材料层的假设溶蚀速率(例如,对于可打印的口服剂型,例如最小总体尺寸大于2毫米,但对于口服给药不宜太大,例如小于25毫米)。从可提供目标溶蚀速率的可能溶蚀材料的数据库中,与柠檬酸三乙酯(tec)混合的羟丙基纤维素(hpc)(hpc:tec的重量比为79.68:19.92)被选择作为多层结构的溶蚀材料(溶蚀速率为0.13毫米/小时)。经证实,当与合适范围的量的可乐定混合时,与tec混合的hpc的溶蚀速率不会改变。使用与tec混合的hpc的溶蚀速率和表2中的信息,多层结构中六层的每一层的厚度可由式iii计算获得。表3列出了六层中的每一层的厚度。表3.每一层的厚度接下来,多层结构中每层的表面积和药物化合物(例如药物)质量分数的量可由式v计算获得。对于与可乐定混合的hpc:tec中的单一药物质量分数的选择,是考虑到装有该含有可乐定的溶蚀材料的打印头被用来制备口服药物剂型。使用该信息,多层结构的层被选择为圆柱形,并且符合计算得到的每层表面积和厚度的多层结构被绘制出以用于3d打印。adhd兴奋剂右旋哌甲酯的快速释放曲线(例如即时释放曲线或速释曲线),选择是可在口服给药15分钟内至少释放80%的右旋哌甲酯总量。与tec混合的乙烯基吡咯烷酮-乙酸乙烯酯共聚物(va64)(va64:tec的重量比为79.2:8.10)被选择作为与右旋哌甲酯(2.5毫克)混合的溶蚀材料。va64:tec:右旋哌甲酯混合材料的总重量为25毫克。然后测定va64:tec:右旋哌甲酯混合材料的密度和体积。使用该信息,va64:tec:右旋哌甲酯混合材料的结构被绘制出以用于3d打印(具有0.52毫米厚度和6.8毫米直径的圆柱形结构)。使用含有可乐定的多层结构的参数的和含有右旋哌甲酯的单层圆片的参数,通过将所述结构嵌入隔离材料(即rspo(rspo))中来组成口服药物剂型,其中所述多层结构和单层圆片用隔离材料分开(如图9b所示)。口服药物剂型使用非线材fdm打印(右旋哌甲酯用盐酸普萘洛尔替代用于初始打印和测试)。使用体外溶出测试(相似因子(f2)测试被用于统计分析)口服药物剂型。据测试,多层结构的顶层(第1层)以比预期的速率溶蚀更快。为了改善口服药物剂型中可乐定的释放曲线,将前三层(第1-3层;表2)合并成具有满足药物目标释放曲线参数的单层。此外,调整原始顶层的表面积,使其相较原始层而言表面积减小。调整后的口服药物剂型使用非线材fdm打印(右旋哌甲酯用盐酸普萘洛尔替代用于初始打印和测试),并且进行体外溶出测试以证明符合药物的目标释放曲线。采用相似因子(f2)统计分析,调整后打印的口服药物剂型的体外溶出释放曲线显示了统计学相似性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1