Spy1基因及其表达蛋白在治疗肌萎缩侧索硬化中的用途的制作方法
本发明涉及一种基因治疗肌萎缩侧索硬化的方法,特别涉及spy1基因及其表达蛋白在治疗肌萎缩侧索硬化中的用途,本发明属于神经生物技术领域。
背景技术:
肌萎缩侧索硬化(amyotrophiclateralsclerosis,als),又称“渐冻人症”,是一种致命性的神经退行性疾病。主要累及上、下运动神经元,表现为进行性的肌无力和萎缩,平均生存期3-5年。最新的流行病学统计显示,als的患病率约为每年每十万分之五。大约有20%的家族性als与sod1基因突变密切相关。目前研究认为,als的发病机制主要与rna代谢紊乱、蛋白质稳态异常、线粒体功能障碍、氧化应激、兴奋性氨基酸毒性、dna损伤、胶质细胞病变及细胞内核质运输障碍等有关。最新研究预计到2040年,全球als患者将在2015年(222801人)的基础上增加69%。
尽管als已经对人类的健康产生了越来越大的威胁,并给家庭和社会带来了沉重的负担,但到目前为止仍然没有控制疾病的有效手段。fda批准的第一个口服药物利鲁唑(riluzole),价格昂贵,且仅能延长患者生命约3-4个月;2017年fda最新批准的自由基清除药物依达拉奉(edaravone),早期临床研究仍存在争议,且目前研究提示依达拉奉似乎不适用于所有类型的als患者。由于rna或蛋白介导的毒性是als最常见的致病机制,因此通过基因治疗的手段减少毒性的rna或蛋白并通过调控基因表达来起到保护运动神经元的作用已经成为了目前研究的前沿。虽然人类的基因治疗仍然处在初始阶段,但一系列早期临床试验已经证实了这种治疗手段的安全性和有效性。目前对于als的基因治疗研究主要基于反义寡核苷酸(asos)、腺病毒(aav)/慢病毒(lv)载体以及间充质干细胞慢病毒载体系统。asos靶向sod1的最新研究已经进入了i期临床阶段,研究表明sod1als患者在鞘内给予3mgisis333611没有显示出毒性和严重的不良反应;然而对isis33611的i期试验发现突变sod1蛋白的含量并没有减少,而改良的sod1aso(biib067或ionis-sod1rx)的i期临床试验目前正处于研究阶段。在als/ftd患者ipsc(可诱导的多能干细胞)诱导的神经元中用asos靶向扩增的c9orf72减少了毒性rna的聚集和谷氨酸的毒性。最新研究表明,给予c9orf72als小鼠侧脑室注射asos靶向c9orf72重复扩增片段能够减少rna聚集和二肽重复蛋白并改善了与衰老相关的行为学表现。目前鞘内给予靶向c9orf72的asos的1期临床试验(nct03626012)正处于募集受试者阶段。在als中以腺病毒/慢病毒为载体的基因治疗目前主要以动物研究为主。多个研究小组的研究证实应用aav/lv载体投递shrna能够通过敲减sod1延长alsg93a大鼠模型的生存期。肌内给予以aav/lv为载体的神经营养因子(gdnf、igf-1和vegf),能够延缓alssod1-g93a大鼠的发病,改善其行为和运动功能并延长生存期,而通过直接靶向中枢神经系统的给药方式,如侧脑室注射、椎管内注射或小脑注射投递这些以病毒为载体的神经营养因子也起到了部分挽救疾病表型和延长als大鼠生存期的作用。体外实验以lv为载体在细胞中表达抗氧化基因能够减少氧化应激的水平促进细胞的存活。在alstdp43小鼠模型中以aav为载体给予hupf1基因治疗能够改善大鼠的前肢功能。此外,间充质干细胞治疗方式也受到研究者的普遍关注,研究表明在sod1-g93a大鼠中移植用lv载体表达gdnf的人间充质干细胞,能够对alssod1-g93a大鼠的骨骼肌、运动神经元和神经肌肉接头起到神经保护作用,并增加存活。另一项研究应用lv载体系统在人间充质干细胞中过表达vegf和gdnf,能够延长sod1-g93aals大鼠的生存期,维持脊髓前角运动神经元和神经肌肉接头的功能。除此之外,在运动神经元疾病中基因治疗已经取得突破性的进展,一种反义寡核苷酸药物——spinraza,目前已经获得了fda的批准用于治疗脊肌萎缩症(sma)。
综上,尽管目前在基因治疗领域的研究已经受到了越来越多的关注,但基因治疗仍然面临很多挑战:无效的给药方式以及血脑屏障的阻碍严重影响了治疗效果,如反义寡核苷酸不能通过血脑屏障(bbb)而只能通过鞘内注射的方式给药;仍然缺乏靶向中枢神经系统特定部位或者细胞亚型的给药方式;以及生产用于临床的大量病毒载体需要昂贵的成本,此外病毒载体不仅可以激活宿主的免疫系统,还能诱导免疫记忆的产生影响后期再应用病毒载体的疗效。
纳米载体(nano-vectors)是近年来研究的一类安全、高效、理想的新型基因治疗载体,它是以纳米微粒为载体,将目的基因包含于微粒内部或吸附于表面,利用纳米微粒的小尺寸效应、比表面效应、界面效应等性质将目的基因转移到靶细胞内部,释放目的基因,从而达到基因治疗的最终目的。与病毒载体相比,纳米载体通过将质粒dna压缩成纳米级微粒,不但可以避免核酸降解,而且可以高效的介导dna向细胞内转染,同时也避免了应用病毒载体带来的细胞毒性、免疫原性及潜在的致瘤性等缺点,更重要的是,利用不同的表面修饰,纳米载体能够有效决定外源基因在体内的走向、定位传递以及高效表达,从而表现出优越的靶向性。因此纳米载体的出现,将在很大程度上改善中枢神经系统给药生物利用度低以及无法通过血脑屏障(bbb)等的情况,但是到目前为止,尽管在阿尔茨海默病(ad)和帕金森病(pd)领域已经有很多基于纳米载体给药系统的研究,但在als治疗领域的研究仍非常有限。早期研究表明,通过共价连接将利鲁唑与碳纳米管(cnts)结合没有影响利鲁唑的药物活性,对细胞也无毒性作用。用固体脂质纳米颗粒(slns)包裹利鲁唑制成88nm带负电荷的化合物,通过腹腔注射途径给药,显示出比普通利鲁唑更高的脑组织靶向性和更低的非特异性生物分布。体内实验在alssod1g93a小鼠中通过侧脑室注射的给药方式,将用脂多糖修饰的包裹抗炎药物(米诺环素)的脂质体直接靶向小胶质细胞的tlr4受体,增加了药物的摄取率并减缓了疾病的进展。最新研究表明,磷酸钙脂质纳米颗粒配方包裹sod1aso在显微镜下注射在斑马鱼体内,成功的在其脑组织、脊髓和血液中检测到纳米颗粒,证实磷酸钙脂质纳米颗粒是一种安全有效基因载体,改善了aso到运动神经元的给药途径。将具有抗氧化特性的氧化铈纳米颗粒通过尾静脉注射途径注入alssod1g93a小鼠中,延长了als小鼠的平均生存期。目前对于纳米基因载体靶向治疗als的相关研究尚未见报道。
最近很多研究以狂犬病毒糖蛋白(rabiesvirusglycoprotein,rvg)作为靶向脑组织的配体并在传递sirna载体的表面进行修饰,如三甲烯壳聚糖,甘露糖醇-聚乙烯亚胺,外泌体,以及通过全身注射的方式将sirna传递到脑组织中。然而,仅仅传递基因穿越血脑屏障是不够的,中枢神经系统中有多种细胞亚型,因此为了确保基因传递的安全性和有效性,我们需要能够靶向神经元的纳米传递基因系统。一个研究小组的最新研究表明,噬菌体展示l肽tgnykalhphng(tgn)能够使peg-plga(聚乙二醇-聚乳酸羟基乙酸共聚物)纳米颗粒易于穿过血脑屏障,因此构建了新型脑靶向药物传递系统,该系统包载蛋白多肽药物后可以保护其不受体内环境降解,提高稳定性,是一种有效、低毒性的脑靶向药物传递系统。另一个研究小组在此研究的基础上,合成tgn的反向异构体cgn肽(d-cgnhphlakyngt),并证实cgn比tgn显示出更高的脑靶向性。并且该研究小组构建了一种双功能的纳米复合体应用血脑屏障靶向配体-cgn和神经元靶向配体-tet1双重修饰。tet1(hlnilstlwkyr),通过体外噬菌体展示鉴定的肽,与在神经元上高表达的gt1b神经节苷脂鞘磷脂结合。聚乙二醇-聚甲基丙烯酸n,n-二甲氨基乙酯(peg-pdmaema)具有低毒性,高缓冲能力和高转染效率是一个理想的纳米载体,因此该研究组以此peg-pdmaema为核心包装目的基因,再以穿过血脑屏障和靶向神经元配体双重修饰,将cgn-peg-pdmaema和tet1-peg-pdmaema按照重量比1:1混合,显示出在血液中很好的稳定性,不导致溶血。纳米基因复合体能够通过网格蛋白介导的内吞作用和微饱饮现象进入神经元,而小凹蛋白介导的内吞作用在其进入脑毛细血管内皮细胞中起到重要的作用。此纳米颗粒复合体能够成功的逃脱溶酶体的溶解,直接进入神经元的细胞质中,实现基因的有效转染。
很多流行病学研究报道,在肿瘤患者中神经变性疾病的发病率有所降低,最新研究表明,肿瘤和神经变性疾病中很多基因、蛋白以及信号通路调控障碍呈现出相反的情况,这引起了我们极大的兴趣,本发明发明人通过前期研究发现,与肿瘤生长密切相关的原癌基因spy1在alssod1g93a小鼠脊髓前角运动神经元中表达明显下降,且与als的发生和发展密切相关,这种原癌基因与als之间的关系尚未见报道。
spy1是非洲爪蟾属细胞周期调节基因在人类中对应基因,是speedy/ringo家族中的一员。该家族成员都含有speedy/ringobox结构域,是细胞周期依赖蛋白激酶(cyclindependentkinases,cdks)的活化因子。spy1已在多种肿瘤中被证实与肿瘤发生发展密切相关,还有研究表明spy1在神经系统的发育和损伤中也发挥着重要的作用。
技术实现要素:
本发明的目的在于提供spy1基因及其表达蛋白在治疗肌萎缩侧索硬化中的新用途。
为了达到上述目的,本发明采用了以下技术手段:
首先,本发明提出了细胞周期调节基因spy1及其表达蛋白在制备治疗肌萎缩侧索硬化药物中的用途。
其中,所述的细胞周期调节基因spy1的核苷酸序列如seqidno.1所示。
其中,优选的,所述的药物通过抑制dna损伤应答途径和增加神经元的存活,用于改善由sod1g93a突变导致的肌萎缩侧索硬化。
其中,优选的,所述的药物为通过纳米载体结合spy1基因制备得到的纳米颗粒、凝胶或乳剂,所述纳米颗粒包含但不限于聚合物纳米颗粒、脂质纳米颗粒、碳纳米颗粒、金属纳米颗粒。
进一步的,本发明还提出了细胞周期调节基因spy1及其表达蛋白的增效剂在制备治疗肌萎缩侧索硬化药物中的用途。
其中,优选的,所述的药物通过抑制dna损伤应答途径和增加神经元的存活,用于改善由sod1g93a突变导致的肌萎缩侧索硬化。
其中,优选的,所述的增效剂为细胞周期调节基因spy1及其表达蛋白的激动剂、上调剂或稳定剂。
其中,优选的,所述的增效剂是指任何可提高spy1基因或蛋白的活性、提高spy1基因或蛋白的稳定性、上调spy1基因或蛋白的表达、增加spy1基因或蛋白有效作用时间的物质,所述的增效剂为化合物、化学小分子或生物分子。
其中,优选的,所述的生物分子可以是dna或rna,或是调控spy1基因或蛋白表达的病毒产品。
更进一步的,本发明还提出了一种用于治疗肌萎缩侧索硬化的聚合物纳米颗粒,通过以下方法制备得到:
(1)合成二嵌段共聚物mal-peg-pdmaema;
(2)将合成的二嵌段共聚物mal-peg-pdmaema与巯基cgn肽或tet1肽在磷酸盐缓冲液中按摩尔比1:1的比例与室温下作用4小时,反应液用mwco5ka的透析袋进行透析,透析液为双蒸水,冷冻干燥后获得cgn-peg-pdmaema和tet1-peg-pdmaema产品;
(3)将cgn-peg-pdmaema以及tet1-peg-pdmaema分别于depc水中溶解,然后与spy1基因按n/p为1-10:1的比例混合,涡旋30秒,再在室温中培养20分钟后得到所述的聚合物纳米颗粒。
所述的聚合物纳米颗粒在制备治疗肌萎缩侧索硬化药物中的用途,其中,优选的,所述的聚合物纳米颗粒通过抑制dna损伤应答途径和增加神经元的存活,用于改善由sod1g93a突变导致的肌萎缩侧索硬化。
给药方式包括侧脑室、鞘内注射、静脉注射和鼻腔给药。受试者包括哺乳动物和人。
本发明的提出为肌萎缩侧索硬化的预防和治疗提供了新的技术手段。
附图说明
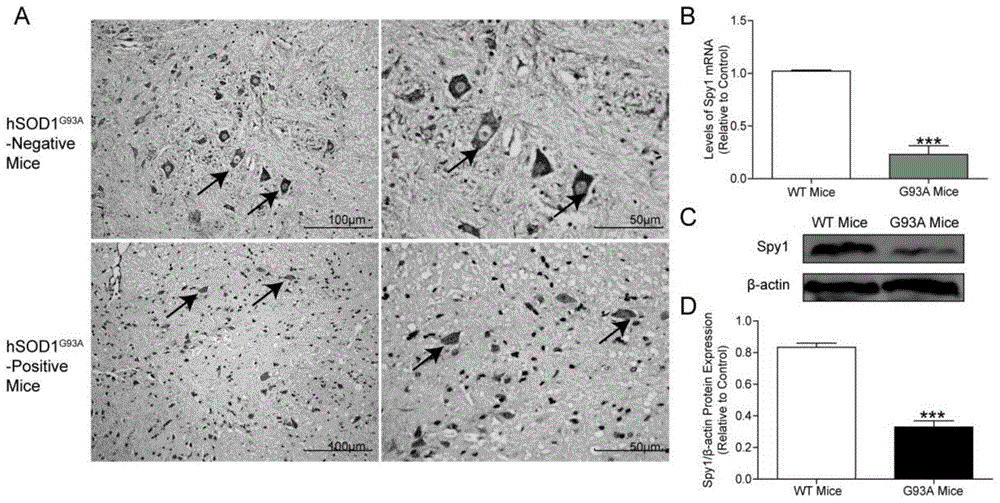
图1为hsod1g93a转基因小鼠及野生型小鼠脊髓前角运动神经元spy1免疫组化染色及定量分析结果;
其中:(a)免疫组化显示与野生型小鼠相比在als小鼠的前角运动神经元spy1表达下降。低倍视野:标尺=100μm,高倍视野:标尺=50μm;(b)qrt-pcr检测hsod1g93a转基因小鼠中spy1mrna水平与野生型小鼠相比有所降低;(c、d)westernblotting显示spy1蛋白表达水平在hsod1g93a转基因小鼠中也明显减少。
图2为在nsc34细胞系中稳定转染msod1组中spy1的表达有所下降;
其中:(a)在msod1细胞系中spy1(红)的荧光强度明显下降,标尺=25μm;(b、c)westernblotting分析及定量:在msod1细胞系中spy1的蛋白表达也有明显下降;(d)qrt-pcr检测显示spy1的mrna水平在msod1细胞系中也有所下降。*p<0.05,***p<0.001;
图3为dna损伤应答通路相关分子在nsc34、plv、wtsod1和msod1细胞系中的表达;
其中:(a)westernblotting结果提示p-atm,p-atr,p-chk1,p-chk2和p53的表达在msod1组与其它三组相比有显著的增加;(b)a结果的定量分析;(c)qrt-pcr显示p53mrna水平在msod1组有所增加,*p<0.05,**p<0.01,***p<0.001;(d)定量分析显示8-ohdg在msod1组水平增加,(e)免疫荧光染色显示8-ohdg(红)荧光强度增加;
图4为在msod1细胞系中下调spy1负调控dna损伤应答途径;
其中:(a、b)westernblotting检测并定量结果显示沉默spy1后p-atm,p-atr,p-chk1,p-chk2和p53的蛋白水平有所增加;(c)qrt-pcr检测spy1和p53mrna表达水平;(d)在msod1细胞系中沉默spy1流式分析检测细胞凋亡情况,显示沉默spy1后凋亡率增加25%;(e)d结果的定量分析。*p<0.05,**p<0.01,***p<0.001;
图5为过表达spy1增加了msod1细胞系的活性;
其中:(a)在msod1细胞系中转染mcherry标签的spy1。48小时候用westernblotting检测spy1和cdk2的表达。(b)westernblotting结果显示过表达spy1导致p-atm,p-atr,p-chk1,p-chk2和p53蛋白表达水平显著下降。(c)定量分析dna损伤应答通路相关蛋白在spy1过表达后的水平。**p<0.01,***p<0.001;(d)mtt法检测细胞活性,g93a突变的sod1导致nsc34细胞的活性降低,而这种情况可以部分被过表达spy1所逆转。**p<0.01,***p<0.001;(e)qrt-pcr法检测spy1和p53mrna的表达水平;
图6为高浓度的人sod1g93a突变蛋白导致spy1的表达下调。
其中:(a)应用westernblotting检测spy1,sod1和β-actin的蛋白表达水平;(b)应用mtt法检测细胞的活性,sod1g93a突变降低了nsc34细胞的活性。*p<0.05,***p<0.001;(c、d)定量分析转染hsod1g93a质粒后spy1和sod1蛋白表达水平。spy1蛋白表达水平明显下降。**p<0.01,***p<0.001.(e)在转染hsod1g93a质粒后spy1的mrna水平应用qrt-pcr检测,结果显示spy1的mrna水平有所下降。*p<0.05,**p<0.01,***p<0.001。
具体实施方式
下面结合附图对本发明提供的具体实施方式做详细说明。本领域的普通技术人员可考虑到多种可进行的改进和调整,而不改变本发明的精神或范围。这种改进和调整包括在本发明的范围内。下述实施例不以任何方式限制本发明。
实施例1
一、方法和材料
1、实验动物及试剂
1.1转基因c57bl/6jhsod1g93a基因型阳性小鼠6只,c57bl/6j野生型小鼠6只,雌雄各半,购自美国jacksonlaboratory公司,在中国农业科学院哈尔滨兽医研究所繁殖扩增及基因鉴定。
1.2nsc34细胞系购自加拿大cedarlanecorporation,液氮中保存。
plentiviral-nsc34细胞系,wtsod1-nsc34细胞系以及hsod1g93ansc34稳定转染细胞系由广州艾游生物有限公司构建,筛选并稳定传代,于dmem培养基中培养。原代神经元细胞取自胎鼠皮层神经元,neurobasal培养基培养。
1.3主要试剂
蛋白电泳marker美国thermoforma公司
western及ip蛋白裂解液北京碧云天公司
sds裂解液北京碧云天公司
pmsf北京碧云天公司
loddingbuffer(5×)北京碧云天公司
牛血清白蛋白(bsa)美国sigma-aldrich公司
anti-β-actin抗体小鼠抗小鼠多抗北京中杉金桥公司
anti-spy1抗体兔抗小鼠多抗美国novus公司
anti-cdk2抗体小鼠抗小鼠武汉博士德公司
anti-atm抗体美国cellsignaling公司
anti-p-atm抗体美国cellsignaling公司
anti-atr抗体美国cellsignaling公司
anti-p-atr抗体美国cellsignaling公司
anti-chk1抗体美国cellsignaling公司
anti-p-chk1抗体美国cellsignaling公司
anti-chk2抗体美国cellsignaling公司
anti-p-chk2抗体美国cellsignaling公司
anti-p53抗体美国abcam公司
anti-sod1抗体美国santacruz公司
anti-map2抗体北京博奥森公司
anti-8-ohdg抗体兔抗小鼠美国santacruz公司
兔igg北京碧云天公司
鼠igg北京碧云天公司
irdye800耦联山羊抗小鼠igg美国rockland公司
irdye800耦联山羊抗兔igg美国rockland公司
dapi染色液美国sigma-aldrich公司
proteina/gplus-agarose美国santacruz公司
trizol(总rna抽提试剂)美国invitrogen公司
一步法荧光染料pcr定量试剂盒大连宝生物公司
pe-anexinv/7-aad凋亡检测试剂盒美国abnova公司
lipofectamine2000美国invitrogen公司
opti-mem美国invitrogen公司
mtt粉末上海华舜生物工程有限公司
嘌呤霉素美国sigma-aldrich公司
spy1sirna合成上海吉玛公司
mcherry-spy1-pez-m95质粒合成广州复能基因公司
egfp-sod1g93a-pcdna3.1质粒合成广州艾游生物科技有限公司
qrt-pcr配对引物
胎牛血清(fbs)澳大利亚nqbb公司
dmem美国invitrogen公司
neurobasalmedium(1x)美国invitrogen公司
b-27添加剂美国invitrogen公司
l-谷氨酰胺美国invitrogen公司
1.4引物
qrt-pcr配对引物
mousespy1(forward):5′-aagggaccaactctgggaca-3′
mousespy1(reverse):5′-actgtgatgcacagaccgct-3′
msod1(forward):5′-gggaagctgttgtcccaag-3′
msod1(reverse):5′-caaggggaggtaaaagagagc-3′
mousep53(forward):5′-taccaccatccactacaag-3′
mousep53(reverse):5′-aaacacgaacctcaaagc-3′
mouseβ-actin(forward):5′-ccagccttccttgggtat-3′
mouseβ-actin(reverse):5′-tgctggaaggtggacagtgag-3′
转基因小鼠基因型鉴定配套引物(美国jacksonlab)
目的基因sod1(forward):catcagccctaatccatctga
目的基因sod1(reverse):cgcgactaacaatcaaagtga
内参il-2(forward):ctaggccacagaattgaaagatct
内参il-2(reverse):gtaggtggaaattctagcatcatcc
spy1sirna合成(上海吉玛公司)
spy1sirna(si-spy1)(forward):5′-ccagagggccuugucuaautt-3′
spy1sirna(si-spy1)(reverse):5′-auuagacaaggcccucuggtt-3′
spy1sirnanegativecontrol(si-nc)(forward):5′-uucuccgaacgugucacgutt-3′
spy1sirnanegativecontrol(si-nc)(reverse):5′-acgugacacguucggagaatt-3′
5%bsa封闭液,10%水合氯醛,4%多聚甲醛溶液,0.1mol/l磷酸盐缓冲液,dab试剂盒,去离子蒸馏水,青霉素,链霉素等由中国农业科学院哈尔滨兽医研究所提供。
1.5溶液配制
0.1mpbs(ph=7.4):过滤后高压蒸汽灭菌分装保存。
4%多聚甲醛固定液:多聚甲醛4g溶于0.1mol/lpbs100ml中,加温至60℃搅拌溶解,4℃保存。
75%乙醇:无水乙醇和depc水按照1:3配制,放于-20℃保存备用。
青霉素、链霉素溶液的配制:青霉素0.48g/瓶(即80万单位),溶解于4ml灭菌双蒸水。链霉素1g/瓶(即100万单位),溶解于5ml灭菌双蒸水。两种溶液浓度均为每毫升20万单位。将5瓶青霉素溶液与4瓶链霉素溶液混匀,即可达到每毫升各10万单位青霉素、链霉素混合溶液。
10%细胞培养液配制:将50ml胎牛血清fetalbovineserum(fbs)加入450mldulbecco’smodifiedeagle’smedium(dmem)中,再加入配制好的青霉素、链霉素溶液5ml,4℃分装保存。
原代神经元培养液配制:在neurobasalmedium(1x)中加入10mlb27添加剂,再加入配制好青霉素、链霉素溶液5ml,4℃分装保存。
westernblot所用溶液配制
电泳液:将tris-base6g,甘氨酸36g,sds5g,溶解于蒸馏水500ml,为5×母液,使用时需加蒸馏水稀释五倍即可。
洗膜液(tbst):将tris-base6g,氯化钠20g溶解于500ml蒸馏水中,配制成5×母液,使用时将100ml母液,0.5ml吐温,0.5ml冰盐酸溶解于400ml蒸馏水,配制成500mltbst溶液,4℃保存。
封闭液:用配好的tbst溶解配制5%脱脂奶粉封闭液或者5%bsa封闭液,4℃保存。
2、方法
2.1nsc34细胞实验分组
nsc34细胞培养,通过构建质粒,慢病毒转染质粒,筛选并稳定转染,获得传代的plentiviral-nsc34细胞系、野生型sod1-nsc34细胞系以及hsod1g93a-nsc34稳定转染细胞系。实验共分为四组,分别命名为空白对照组(nsc34组)、空病毒组(plv组)、野生型组(wtsod1组)以及变异型组(msod1组)。
2.2als小鼠实验分组
动物分为两组:一组为als转基因小鼠组(hsod1g93a-positive小鼠组),一组为野生对照组(hsod1g93a-negative小鼠组),每组各5只。行为评估后,取脊髓组织,经4%多聚甲醛浸泡固定,石蜡包埋,切片,进行免疫组化染色以及免疫荧光染色。
2.3nsc34细胞系培养
nsc34细胞系的复苏
将水浴锅预热至37℃,将冻存管从液氮罐中取出后,快速置入水浴锅,需注意冻存管的密封管口,不停地晃动,待管中液体融化后,将冻存管中液体吸出,放入含有细胞培养液的离心管中,离心5min(750rpm/min),弃掉上清液。重新加入细胞培养液配成细胞悬液,将细胞悬液吹打均匀后,加入培养瓶中,放入细胞培养箱中培养,24后更换细胞培养液。
nsc34细胞的培养与传代
使用75%酒精擦拭经过紫外线照射的超净工作台,点燃酒精灯,准备好将要使用的消毒后的空培养瓶,取出预热好的细胞培养液及pbs溶液。从细胞培养箱中取出细胞瓶,经75%酒精喷射后,酒精灯轻烧瓶外口,消毒灭菌后,将瓶盖打开,并烧灼瓶盖内口,倒掉瓶内旧培养液,用预热的pbs清洗一次,倒掉pbs后,加入预热的细胞培养液,将细胞从瓶壁吹下来,吹打至均匀后,将细胞悬液分装至三个新培养瓶中,每瓶装中再加入4ml细胞培养液。使用酒精灯轻烧瓶口,及培养瓶盖,旋紧瓶口,将培养瓶放入细胞培养箱中继续培养。
慢病毒转染构建稳定转染、筛选细胞系
发明人前期实验已经成功构建稳定转染的plentiviral-nsc34细胞系、野生型sod1-nsc34细胞系,以及hsod1g93a-nsc34细胞系,通过嘌呤霉素(200μg/ml)筛选后,进行后续实验。
nsc34细胞的冻存
从细胞培养箱中取出细胞瓶,弃掉上清液,加入新的细胞培养液,使用滴管将贴壁细胞轻轻吹打至细胞悬液,放入离心管中,离心5分钟(750rpm/min),弃掉上清液,加入配制好的含有10%dmso的细胞冻存液中,细胞吹打均匀后分装至冻存管中,将冻存管放入梯度降温的冻存盒中,-80℃短期保存,过夜后移置液氮罐中长期保存。
2.4msod1细胞系培养及sirna干扰
转染前24小时,使用无抗生素的细胞培养液将贴壁的msod1细胞洗涤重悬,每孔2×105细胞加入6孔板中进行培养,次日进行转染。首先,准备转染试剂:按照说明书操作,用opti-mem稀释spy1sirna及lipofectamine2000,室温放置5分钟。将上述两种转染试剂混合,室温并轻轻振动放置25分钟,形成转染试剂与spy1sirna混合物后加入细胞板中,6小时后更换细胞液为含10%血清的细胞培养液。48小时后提取细胞rna,使用qrt-pcr检测干扰效率。
2.5质粒转化、扩增、抽提
mcherry-spy1-pez-m95质粒购于广州复能基因公司,egfp-sod1g93a-pcdna3.1质粒实验组前期购于广州艾游生物科技有限公司。
2.5.1质粒的转化
将dh5α感受态冰浴至溶化,分别加入上述质粒,移液器轻轻混匀,共同冰浴30分钟,经热休克(42摄氏度热激90秒,冰浴3分钟),然后迅速加入900μl无抗性lb培养基,放入振荡培养箱中,37℃振荡(220rpm)摇菌45分钟。4500rpm离心5分钟,弃掉上层液体,剩余100微升,轻轻将菌体吹起,均匀涂布于含有氨苄青霉素抗性(amp+)的lb琼脂板上,静置5分钟。37℃培养箱过夜培养。然后,选取单个饱满独立的菌落置于装有5mllb液体培养基(amp+)的试管中,37℃振荡(220rpm)摇菌,过夜培养。
2.5.2质粒的提取
参照omega公司e.z.n.a.
2.6质粒瞬时转染
质粒瞬时转染使用lipofectamine2000试剂进行转染。转染前24小时,msod1细胞或nsc34细胞以每孔1×106个细胞种于6孔板。msod1细胞瞬时转染含有spy1基因的质粒,mcherry-spy1-pez-m95质粒以每孔2μg稀释于200μlopti-mem中,同时,使用200μlopti-mem稀释lipofectamine2000试剂(每孔4μl),室温静置5分钟。然后,将上述两种试剂混合形成lipofectamine2000/dna复合物,室温静置20分钟,加入细胞培养板,培养箱中培养6小时后,更换培养液为含10%血清的细胞培养液,继续培养42小时。nsc34细胞梯度瞬时转染含有sod1g93a的质粒,egfp-sod1g93a-pcdna3.1质粒以每孔0μg,1μg,2μg,3μg,4μg的浓度使用lipofectamine2000进行转染,转染48小时后进行荧光显微镜检测以及进行后续实验。
2.7细胞凋亡率检测
(1)将msod1细胞以每孔5×105细胞的量种于六孔板中,待细胞生长到60%~70%时,转染spy1干扰序列,6小时后更换细胞液为10%血清细胞培养液,继续培养42小时,进行annexin-pe/7-aad细胞凋亡试剂盒检测早期凋亡;
(2)细胞使用新的培养液重悬,4℃750rpm离心5min,收集细胞;
(3)用4℃预冷的pbs洗涤细胞2次,750rpm离心5min,收集细胞;
(4)配制1×bindingbuffer:用去离子水4倍稀释4×bindingbuffer;
(5)加入250微升的1×bindingbuffer重悬细胞,调节器浓度1×106细胞/ml;
(6)取100微升细胞悬液于5ml流式管中,加入5微升pe标记的annexinv和10微升7-aad,轻轻混匀;
(7)避光,室温反应15min;
(8)加入400微升的1×bindingbuffer,混匀,流式细胞仪分析;
(9)荧光补偿调节:使用未经凋亡诱导处理的正常细胞,作为对照进行荧光补偿调节出去光谱重叠和设定十字门的位置;
(10)annexinv-pe为橙红色荧光,激发波长ex=488nm,发射波长为em=578nm,annexinv-pe可以与凋亡早期细胞的细胞膜结合,7-aad为红色荧光,激发波长ex=546nm,发射波长为em=647nm,7-aad不能透过正常细胞或早期凋亡细胞的完整的细胞膜,但可以穿透晚期凋亡细胞或坏死细胞并与其内的dna结合;
(11)流式细胞仪分析,以annexinv-pe为横坐标,7-aad为纵坐标。活细胞:annexinv-pe阴性/7-aad阴性;早期凋亡细胞:annexinv-pe阳性/7-aad阴性;晚期凋亡细胞和坏死细胞:annexinv-pe阳性/7-aad阳性。
2.8mtt检测
mtt溶液的配制:将10mgmtt粉末加入2ml溶剂混匀,配制成浓度为5mg/ml的mtt溶液,避光配制。
加入mtt溶液:在相应的时间点,对96孔板中的贴壁细胞进行检测,每孔加入20微升mtt溶液,5%co2、37摄氏度培养4小时,终止培养,小心吸取并弃去培养液。
呈色:每孔加入150微升二甲基亚砜,轻微振荡10分钟,使结晶物充分溶解。
比色:将96孔板放入酶标仪,选择540nm波长,测量各孔光吸收值,记录结果。同时设置调零孔及相应的对照孔.
2.9胎鼠原代皮层神经元培养
2.9.1多聚赖氨酸包被
多聚赖氨酸包被液适量,滴入准备培养神经元的培养板中,包被30分钟,吸干晾过夜,次日用pbs清洗两次,晾干备用。
2.9.2原代皮层神经元培养
取胎鼠脑组织:将c57bl/6j野生型雌性小鼠与hsod1g93a转基因型雄性小鼠合笼,观察雌性小鼠阴栓,待雌鼠孕18-21天,处死孕鼠后,75%酒精浸泡消毒1分钟,置于无菌培养皿中,置于冰上。于超净台内,在冰上取出胚胎,解剖、分离脑组织,同时留取部分组织进行后续基因型鉴定(详见转基因鼠基因型鉴定部分)。
分离大脑皮层:去除软脑膜、血管,取大脑皮层置于少量dmem中,用眼科剪将皮层反复剪切成碎块。
消化:加入2mg/ml木瓜蛋白酶及适量dna酶,37摄氏度消化25~30分钟,每五分钟稍微摇动一次,取等量完全培养基中止消化。
将细胞悬液转移至15ml离心管中,轻轻吹打15~20次,使用200目灭菌不锈钢纱网过滤。将获取的细胞悬液离心,800rpm,3分钟,取沉淀,加入完全培养基,吹打成细胞悬液。取10微升混匀的细胞悬液滴于细胞计数板上进行细胞计数。使用完全培养基调整细胞密度为4~5×106/ml,接种至多聚赖氨酸包被过的培养板中,接种密度为4~5×105/cm2,添加完全培养基至最小培养体积。将接种的细胞置于37摄氏度培养箱中培养。6~8小时后显微镜下观察细胞贴壁后,更换细胞培养液为神经元培养基(neurobasala+b27+l-谷氨酰胺)。以后2~3天半量换液,培养至一周左右,进行神经元特异性免疫荧光染色检定合格后,再进行后续实验。
2.10免疫组化染色
(1)石蜡切片6μm厚,梯度脱蜡,酒精脱水。
(2)3%h2o2,室温10分钟,0.1mpbs冲洗5分钟,重复三次。
(3)滴加5%bsa封闭液,室温20分钟。
(4)滴加稀释的一抗spy1(1:500)4℃孵育过夜。0.1mpbs冲洗5分钟,重复三次。
(5)滴加生物素化标记二抗,37℃孵育20分钟。0.1mpbs冲洗5分钟,重复三次。
(6)滴加辣根酶标记链霉卵白素,37℃孵育20分钟。0.1mpbs冲洗5分钟,重复三次。
(7)使用dab显色剂室温显色。
(8)苏木素复染,封片。
(9)显微镜下观察,采集图像。
2.11免疫组织荧光双重染色
(1)石蜡切片6μm厚,梯度脱蜡,酒精脱水。
(2)3%h2o2,室温10分钟,0.1mpbs冲洗5分钟,重复三次。
(3)滴加5%bsa封闭液,室温10分钟。
(4)加入一抗孵育,使用一抗稀释液稀释兔抗spy1抗体(1:200)和山羊抗map2抗体(1:200)混匀后加到标本上。4℃过夜。
(5)切片用0.1mpbs冲洗10分钟,重复三次,加入荧光标记二抗,alexa
(6)切片用0.1mpbs冲洗10分钟,重复三次,使用防荧光淬灭封片剂封片。
(7)显微镜下观察,采集图像。
2.12细胞免疫荧光检测
(1)取相应生长时间点细胞,用0.1mpbs洗三次,每次10分钟。
(2)4%的多聚甲醛室温固定30分钟。
(3)用0.1mpbs洗三次,每次10分钟。
(4)使用0.1%tritonx-100透膜2分钟。
(5)用0.1mpbs洗三次,每次10分钟。
(6)5%bsa室温封闭30分钟。
(7)加相应一抗,4℃过夜。
(8)用0.1mpbs洗三次,每次10分钟。
(9)加相应荧光二抗,封闭30分钟。
(10)用0.1mpbs洗三次,每次10分钟。
(11)用dapi染色3分钟。
(12)用0.1mpbs洗三次,每次10分钟。
(13)显微镜下观察,采集图像。
2.13酶联免疫吸附试验法检测8-羟基脱氧鸟苷(8-ohdg)
2.13.1试剂准备
(1)使用前将所有试剂盒标本缓慢均衡至室温
(2)标准本制备:将每瓶标准品加入标准品稀释液1ml,盖好后室温静置10分钟,同时轻轻摇动(避免起泡),其浓度为6000pg/ml,准备5个稀释标准品的ep管,每个ep管中加入600μl的标准品稀释液,依次三倍稀释成6000pg/ml,2000pg/ml,666.67pg/ml,222.22pg/ml,74.07pg/ml。标准品稀释液(0pg/ml)直接作为空白孔。
(3)检测溶液a及检测溶液b:检测溶液a及检测溶液b在使用前,少时离心处理,以使管壁或瓶盖的液体沉积到管底。临用前分别以检测稀释液a或b以1:100的比例稀释,充分混匀。
(4)浓洗涤液:用580ml蒸馏水或去离子水将20ml浓洗涤液稀释至600ml,进行30倍稀释。
(5)底物溶液:用灭菌的移液器吸头吸取所需体积的tmb底物至另一干净溶液中使用。
2.13.2操作步骤
(1)加样:分别设标准孔、待测样品孔、空白孔。设标准孔5孔,以此加入50μl不同浓度的标准品。空白孔加50μl标准品稀释液,余孔加待测样品50μl,然后立即每孔加检测溶液a工作液50μl,轻轻振动,混匀,注意避免气泡产生,酶标板加上覆膜,37℃温育1小时。
(2)弃去孔内液体,每孔用300μl的洗涤液洗涤,浸泡1~2分钟,在吸水纸上轻拍酶标板来移除孔内所有液体。重复洗板3次,最后一次洗涤后,吸取或倒出剩余的洗涤缓冲液,将酶标板倒扣在吸水纸上,将残留在孔内的液体全部吸干。
(3)每孔加检测溶液b工作液100μl,加上覆膜,37℃温育30分钟。
(4)弃去孔内液体,甩干,洗板5次。
(5)每孔加底物溶液90μl,酶标板加上覆膜,37℃避光显色,反应时间20分钟左右,当标准孔的后面3孔有明显的梯度蓝色,前3孔梯度不明显时,即可终止。
(6)每孔加终止溶液50μl,终止反应,此时蓝色转为黄色。终止液的加入顺序应尽量与底物溶液的加入顺序相同。
(7)在确保酶标板底无水滴及孔内无气泡后,立即用酶标仪在450nm波长测量各孔的光密度(od值)。
2.14qrt-pcr检测
2.14.1nsc34细胞及als小鼠脊髓组织总rna提取
(1)将六孔板中的细胞使用pbs清洗一遍,弃pbs,然后每孔加入1mltrizol,吹打裂解均匀后,加入1.5mlep管中,振荡30秒。组织匀浆:取出高温高压消毒后的研钵,切取50mg~100mg冰冻组织置于研钵内,倒入液氮,研碎。每50mg~100mg匀浆组织标本中加入1mltrizol,将以上匀浆标本转移到1.5mlep管中,在室温下放置5分钟。
(2)每管加入200微升三氯甲烷,颠倒振荡混匀后,置于室温静置3分钟,于4℃下,13000rpm,离心15分钟。
(3)吸取上层无色水相,移入另一个ep管中(约400微升)。
(4)在新的ep管中加入400微升异丙醇(即与上一步吸取的上层液体等体积),-20℃放置30分钟以上。
(5)于4℃下13000rpm,离心15分钟。
(6)倒掉液体,加入预先使用depc水配制的75%乙醇1ml,进行洗涤沉淀,颠倒振荡。
(7)于4℃下10000rpm,离心10分钟。
(8)倒掉液体,将ep管倒扣于滤纸上,吸取残液,于室温风干约10分钟。
(9)加入50微升depc水溶解沉淀,留取适量液体进行测浓度,完整性鉴定。
(10)将rna分装后,放于-80℃保存。
rna浓度计算(μg/ml)=[od260-od310]×40×稀释倍数
rna完整性的检测:甲醛变性琼脂糖电泳,确定抽提rna完整性和dna污染情况。
2.14.2qrt-pcr检测
rna逆转录合成dna(qrt-pcr一步法)
预先将实验所需试剂冰上解冻,贮备好仪器及超净工作台,提前打开pcr以预热,配制如下表1的反应体系:
表1
将配好的反应体系加入pcr八连管中,轻轻地短暂离心后,放入罗氏定量pcr仪器中进行逆转录及扩增反应。
反应程序如下:
hold
42℃5分钟
95℃10秒钟
pattern2:定量反应
cycle:40
95℃5分钟
60℃30秒
pattern3:解离
反应后记录扩增曲线,读取ct值。
2.15westernblot检测
2.15.1单层贴壁细胞总蛋白的提取
将培养瓶中的培养液倒掉,使用预冷的pbs清洗细胞三次,弃掉pbs。在冰上迅速将贴壁细胞刮下收集到1.5mlep管中,短暂离心,弃掉pbs,每瓶细胞加入100μl含有pmsf的western及ip裂解液,吹打均匀,于冰上裂解30分钟,每隔10分钟涡旋10秒钟。细胞裂解充分后,于4℃下13000rpm,20分钟。取上清,为总蛋白。取2μl检测浓度,将所有样品调整到相同浓度,加入四倍体积的5×loadingbuffer,煮沸,分装。放入-80℃冰箱保存,避免反复冻融。
2.15.2sds-page电泳
(1)将玻璃板对齐后,放入夹中卡紧,准备灌胶
(2)配制10%分离胶,加入temed后立即混匀后即可灌胶,然后在胶上加一层水,液封后,加快胶凝固。当水和胶之间形成一条分离线时,用吸水纸将水吸干。
(3)配制5%的浓缩胶,加入temed后立即混匀灌胶,将梳子插入浓缩胶中。
(4)加入电泳液后准备上样。
(5)电泳至溴酚蓝至胶最下面终止电泳,进行转膜。
2.15.3转膜
(1)预先将6张滤纸和1张硝酸纤维素膜在转移液中浸泡10分钟。
(2)三层滤纸、一张硝酸纤维素膜、凝胶、三层滤纸制成三明治。使用玻璃棒去除其中的气泡。
(3)将三明治制品放入转移仪中,膜在正极,胶在负极。在电流50ma条件下,转膜1.5小时。
(4)将转印好的硝酸纤维素膜卸下,观察marker是否完全从胶上转移到膜上,置于封闭液中室温摇晃孵育1小时。
从封闭液中将硝酸纤维素膜取出后,使用tbst清洗三次后,每次10分钟。
将硝酸纤维素膜置于稀释的一抗抗体溶液中,4℃过夜。预先将特定的一抗抗体按照比例进行稀释:spy1(1:500)、cdk2(1:400)、atm(1:1000)、p-atm(1:1000)、atr(1:500)、p-atr(1:500)、chk1(1:500)、p-chk1(1:500)、chk2(1:1000)、p-chk2(1:1000)、p53(1:500)、sod1(1:200)、β-actin(1:1000)。
将硝酸纤维素膜取出后,室温摇床上使用tbst清洗三次,每次10分钟,将洗过的膜置于稀释的荧光二抗溶液中(按照1:4000配制),37℃摇床孵育1小时。
将膜使用tbst洗膜后,扫膜获取条带图像。
2.16免疫共沉淀实验
(1)将生长良好的msod1细胞培养至融合度达到70%左右,在msod1细胞中瞬时转染spy1质粒,继续培养48小时后。弃培养液,使用预冷pbs漂洗三次,弃净pbs。
(2)加入预冷的ip细胞裂解液,冰上裂解5分钟,使用细胞刮将细胞从培养皿中刮下来,移至ep管中。
(3)在冰上继续缓慢摇动30分钟,使其充分裂解。在4℃以13000rpm离心10分钟,取上清置于新的ep管中,用于免疫共沉淀实验。
(4)准备proteina/gagarose,使用pbs洗两遍珠子,然后使用pbs配制成浓缩为50%的混合液。
(5)每1ml总蛋白中加入100μl的proteina/gagarose,于4℃缓慢摇晃4小时,以去除非特异性杂蛋白,降低背景。
(6)于4℃,12000rpm离心15分钟,将上清液转移至新的ep管中,弃掉沉淀。
(7)使用bca方法测定蛋白浓度,然后使用pbs将总蛋白稀释到1mg/ml,加入spy1抗体以及proteina/gagarose做免疫沉淀,cdk2进行westernblot检测。同时加入与抗体先沟通来源的igg作为对照。缓慢摇动抗体抗原混合物,于4℃过夜。
(8)于4℃以300rpm离心5分钟,加入1mlip细胞裂解液,重复五次。
(9)取适量的5×上样缓冲液将proteina/gagarose–抗原抗体复合物悬起,轻轻混匀。
(10)将上样样品100℃煮10分钟,以游离proteina/gagarose、抗体、抗原,13000rpm离心5分钟,取上清进行电泳。
2.17als转基因模型鼠的繁育及鉴定
2.17.1als转基因模型鼠的配种繁殖及饲养
根据模型鼠说明书中规定的繁殖培育进行繁育,将购买的c57bl/6jhsodg93a转基因阳性半合子雄鼠与c57bl/6j阴性雌鼠交配。小鼠在恒温恒湿通气的灭菌培养箱中饲养,将一只c57bl/6jhsodg93a转基因阳性半合子雄鼠与两只c57bl/6j阴性雌鼠合笼48小时以上,将雌鼠取出单放一笼,观察雌鼠是否怀孕,阳性雄鼠空笼后,继续进行下一轮合笼交配。新生小鼠至四周龄时,提取其dna进行基因鉴定,并且每只小鼠做好标记。
2.17.2als转基因模型鼠子代基因型鉴定
基因组dna提取(按照天根基因组dna提取试剂盒说明书进行)
(1)小鼠出生后30天剪取0.5cm的尾尖组织,置于ep管中,将其彻底粉碎,室温下12000rpm离心1分钟弃上清,加入200μl缓冲液ga,充分振荡混匀。
(2)加入20μl蛋白酶k,充分混匀。60℃水浴或干置,直至组织细胞悬液完全溶解,若ep管内壁有水珠应进行简短离心。
(3)加入200μl的gb缓冲液,充分颠倒混匀并剧烈振荡片刻,于75℃热置10分钟,此时溶液外观应清透,ep管内壁的水珠用短暂离心去除。
(4)取100%乙醇200μl加入,充分颠倒混匀,并剧烈振荡片刻,若管盖内壁有水珠应进行简短离心。
(5)将吸附柱cb3放入收集管中,将所得混合液全部吸出加入吸附柱中,室温13000rpm离心1分钟,取出cb3弃除管中废液,再将cb3放回。
(6)向吸附柱cb3中滴加500μl的gd缓冲液,室温13000rpm离心60秒,取出cb3弃除管中废液,再将cb3放回。
(7)向吸附柱cb3中滴加600μl的pw漂洗液,室温13000rpm离心60秒,取出cb3弃除管中废液,再将cb3放回。
(8)重复上一操作。
(9)再一次离心,室温13000rpm离心2分钟,取出cb3弃除管中废液。将cb3室温放置数分钟至彻底晾干。
(10)将吸附柱cb3放入洁净的1.5mlep管中,加入100μl的te洗脱,室温下静置约5分钟,以溶解dna,然后室温13000rpm离心2分钟,将溶液收集到ep管中。
(11)将所得dna溶液分装冷冻保存,并留取5μl检测样本浓度。
pcr反应
(1)于冰上将下述试剂按照表2相应的配比进行配制pcr反应体系;
表2
(2)设置pcr反应条件:
95℃预变性5分钟,95℃变性45秒,58℃退火30秒,72℃延伸,30个循环,72℃延伸5分钟。
(3)将配制好的反应体系加入pcr小管中放入pcr仪进行扩增反应。
pcr产物鉴定
(1)制备琼脂糖凝胶,0.4g琼脂糖加入20ml的tbe缓冲液(0.5×),加入微波炉中加热约5分钟至完全熔化。
(2)将终浓度为2%的琼脂糖凝胶液体从微波炉拿出冷却片刻。
(3)用枪头沾取少量溴乙啶(0.5mg/ml)浸入到凝胶液体中,振荡摇匀。
(4)将凝胶混合液倒入配胶槽,插好梳子,冷却到室温凝固。
(5)拔出样本梳,取下凝胶放入水平电泳槽,浸入电泳液中。
(6)上样10μl,进行电泳,120v电泳至条带位于凝胶的2/3处,取出胶置入全自动凝胶成像分析系统扫描。
2.18统计学分析
所有数据均采用均数±标准差(±sd),使用软件系统进行统计。细胞实验部分采用单因素的方差分析,两两比较对相应数据进行统计学处理,动物实验部分组间对比采用anova分析及独立样本t检验。p<0.05认为具有统计学显著性差异。
2.19合成pdmaema衍生物
peg-pdmaema和mal-peg-pdmaema(mpeg-pdmaema)二嵌段共聚物按照之前的文献合成(y.qian,y.zha,b.feng,z.pang,b.zhang,x.sun,j.ren,c.zhang,x.shao,q.zhang,x.jiang,pegylatedpoly(2-(dimethylamino)ethylmethacrylate)/dnapolyplexmicellesdecoratedwithphage-displayedtgnpeptideforbrain-targetedgenedelivery,biomaterials.34(2013)2117-2129.)。mal-peg-pdmaema载体与巯基cgn肽(d-cgnhphlakyngt)或tet1肽(hlnilstlwkyr)在磷酸盐缓冲液中(pbs,ph7.0)按1:1(mol/mol)比例与室温下作用4小时。反应液用双蒸水(mwco5ka)透析,冷冻干燥后获得cgn-peg-pdmaema和tet1-peg-pdmaema产品。
2.20制备聚合物纳米颗粒
pdmaema衍生物,包括mpeg-pdmaema(m),cgn-peg-pdmaema(c),tet1-peg-pdmaema(ct,1:1,w/w)分别于depc水中溶解,然后与spy1按不同n/p比例(1:1,2:1,5:1或10:1)混合,先涡旋30秒,再在室温中培养20分钟后得到。聚合物纳米颗粒的颗粒大小和zeta电位应用动态光散射技术(dls)在n/p=10测定。纳米基因复合体的形态应用投射电子显微镜(tem)进行观察。tem样品准备是通过吸取一滴复合物溶液在一个标准的网格铜栅上并使它在空气中自然干燥。这些网格用磷钨酸(2%,w/v)负染并在检测前干燥。高分子聚合物浓缩spy1的能力通过琼脂糖凝胶电泳进行评估,并用紫外照明在302nm检测并用氟化学成像系统拍照。
3、实验结果
3.1spy1在hsod1g93a转基因als小鼠模型运动神经元以及hsod1g93a稳定转染神经元细胞模型中表达量降低
为了研究spy1在als动物模型以及细胞模型中表达情况,我们选用hsod1g93a转基因小鼠为als动物模型,hsod1g93a稳定转染nsc34细胞系为als细胞模型,通过免疫组织化学染色、免疫荧光双染、westernblotting以及荧光定量pcr等方法检测spy1表达水平。首先,通过pcr方法鉴定hsod1g93a阳性转基因小鼠,将携带hsod1g93a转基因小鼠进行培养,同时期同窝野生型阴性小鼠做为对照组,观察小鼠生长发育情况,对其功能进行评分,待小鼠130天龄后,常规麻醉小鼠,将其固定,生理盐水灌注,多聚甲醛灌流固定,取小鼠脊髓组织固定。石蜡包埋切片,进行免疫组织化学染色,结果如图1所示,结果显示在终末期hsod1g93a转基因小鼠的脊髓前角中,spy1在神经元胞浆内呈棕褐色,与野生型阴性小鼠相比较,在hsod1g93a转基因小鼠前角运动神经元中spy1阳性染色明显减少。为了进一步明确单个运动神经元中,spy1表达情况,使用imageproplus6.0软件对单个神经神经元内阳性染色进行分析,以积分光密度值(intergratedopticaldensity,iod)作为衡量spy1表达强度的指标进行统计学分析。该结果显示,在hsod1g93a转基因小鼠的脊髓前角运动神经元中,spy1表达量较野生型小鼠明显减少。为了进一步明确spy1在hsod1g93a转基因小鼠脊髓前角运动神经元中表达情况,通过免疫荧光双染方法,使用map-2染色对神经元进行标记呈红色荧光,spy1阳性染色呈绿色荧光,spy1阳性染色主要在脊髓运动神经元胞浆中,在hsod1g93a转基因小鼠前角运动神经元spy1阳性染色(即绿色荧光)强度明显低于对照组荧光强度(图1a)。采用westernblotting以及实时荧光定量pcr(qrt-pcr)方法,检测spy1在hsod1g93a转基因小鼠脊髓组织中表达情况。从蛋白水平比较,hsod1g93a转基因小鼠中spy1蛋白含量明显低于野生型阴性小鼠,具有统计学意义(图1c、d)。从mrna水平进行比较,hsod1g93a转基因小鼠脊髓组织spy1mrna表达水平明显减少,与对照组相比具有统计学意义(图1b)。
为了进一步证实,我们提取胎鼠的皮层神经元进行原代培养,同时对胎鼠进行基因型鉴定。原代神经元培养至第7天时,首先采用map-2荧光染色鉴定神经元纯度,然后进行后续实验。采用免疫荧光染色方法,hsod1g93a转基因阳性小鼠的皮层神经元中,spy1绿色荧光染色强度与野生型阴性小鼠相比明显减少。最后我们再次用hsod1g93a-nsc34细胞系进行验证,通过免疫荧光染色、westernblotting以及qrt-pcr方法比较spy1表达情况。结果如图2所示,通过免疫荧光染色可见,与nsc34细胞系、plv细胞系、wtsod1细胞系相比,msod1细胞系中spy1荧光强度明显减弱(图2a)。从蛋白水平比较,msod1细胞系中spy1蛋白含量明显低于对照组,并具有统计学意义(图2c、d)。从mrna水平上比较,spy1mrna在msod1细胞系表达水平明显低于对照组,并具有统计学意义(图2b)。
3.2hsod1g93a稳定转染nsc34细胞系als细胞模型中存在核dna损伤以及dna损伤反应呈激活状态
以往研究发现als病理过程中存在dna损伤,可能是由于超氧化物歧化酶-1(superoxidedismutase-1,sod1)功能异常导致的,为了进一步探讨hsod1g93a在dna损伤作用,检测hsod1g93a稳定转染nsc34细胞系中8-ohdg的含量以及dna损伤反应通路相关蛋白的表达水平。以往的研究发现在hsod1g93a转基因als小鼠模型存在氧化应激dna损伤,8-ohdg是研究dna损伤最为敏感的指标之一。研究发现8-ohdg在hsod1g93a转基因als小鼠模型脊髓组织与野生型阴性小鼠比较呈高表达。因此,本研究首先通过免疫荧光染色方法,观察hsod1g93a稳定转染nsc34细胞系中8-ohdg的表达情况,在msod1细胞系中,8-ohdg阳性染色数量较多并集中分布在细胞核周围,呈高荧光强度,而在nsc34细胞系、plv细胞系、wtsod1细胞系中呈低荧光强度。为了进一步明确8-ohdg在msod1细胞系含量增加,通过酶联免疫吸附试验法检测四种细胞系细胞裂解物中8-ohdg含量水平。结果如图3所示,结果显示,四种细胞系中,msod1细胞系8-ohdg浓度较对照组明显增高,并具有统计学意义。综合上述两种实验结果,提示在hsod1g93a稳定转染nsc34细胞系als神经元模型中存在核dna氧化应激损伤。提取细胞蛋白进行westernblotting检测dna损伤反应通路蛋白的改变情况。结果显示,与nsc34细胞、plv细胞、wtsod1细胞相比,msod1细胞系中磷酸化蛋白p-atm、p-atr、p-chk1、p-chk2以及p53表达量明显增加,并具有统计学意义,而非磷酸化蛋白atm、atr、chk2、chk1无明显变化(图3a、b)。从mrna水平上比较,qrt-pcr显示p53mrna水平在msod1组有所增加,并具有统计学意义(图3c)。定量分析显示8-ohdg在msod1组水平增加(图3d),免疫荧光染色显示8-ohdg(红)荧光强度增加(图3e)。因此在hsod1g93a稳定转染nsc34细胞系als细胞模型中,dna损伤反应是处于激活状态的。
3.3敲除spy1导致msod1细胞细胞活力降低,并可进一步激活dna损伤反应,促进凋亡
为了研究spy1与神经元活性之间的作用,选取特异性针对spy1的rna干扰序列sirna-spy1,通过lipofectamine2000转染试剂转染,降低msod1细胞中spy1的表达水平,检测其细胞活性,以及dna损伤途径中相关蛋白的表达改变。将msod1细胞于含有10%胎牛血清的dmem完全培养基中培养,将细胞分为三组,分别为msod1细胞组(control组)、阴性rna干扰组(si-nc组)以及特异性spy1干扰组(si-spy1组),当细胞融合至60%~70%时,使用lipofectamine2000对细胞进行瞬时转染,转染48小时后,收集细胞进行,使用annexin-pe/7-aad细胞凋亡试剂盒检测凋亡,流式细胞仪分析。结果如图4所示,结果显示,敲除spy1明显地促进凋亡的发生,以早期凋亡为主。通过统计学分析,在si-spy1组细胞凋亡率为77.70%,而在si-nc组,凋亡率为4.27%,具有明显的统计学差异(图4d、e)。为了进一步检测spy1敲除影响细胞的存活性与dna损伤有关。在msod1细胞中转染48小时后,收集细胞提取rna以及细胞蛋白,进行后续实验,通过qrt-pcr以及westernbloting方法,检测spy1以及dna损伤途径中相关蛋白表达水平。结果表明,转染spy1sirna干扰序列后,在msod1细胞中,spy1mrna表达水平明显减少,p53mrna表达水平明显增加(图4c)。dna损伤途径中,磷酸化蛋白p-atm、p-atr、p-chk1、p-chk2以及p53表达量明显增加,而非磷酸化蛋白atm、atr、chk2、chk1无明显变化(图4a、b)。因此,干扰spy1后进一步激活dna损伤反应。
3.4在msod1细胞中过表达spy1增强细胞活力,抑制dna损伤反应
通过降低spy1在msod1细胞的表达水平,细胞活性下降,dna损伤反应进一步激活,促进了凋亡发生。那么,通过过表达外源性spy1的表达水平,应用mtt方法检测spy1过表达对msod1细胞活性的影响,以及应用westernblotting方法检测对dna损伤途径的相关蛋白的表达水平,通过qrt-pcr检测spy1与p53表达水平的变化。mcherry-spy1-pez-m95质粒瞬时转染使用lipofectamine2000试剂进行转染。培养48小时后,进行荧光显微镜检测明确转染效率。结果如图5所示,与对照组(nsc34细胞、plv细胞、wtsod1细胞)相比,msod1细胞的活性明显降低,通过瞬时转染spy1质粒后,在转染的msod1细胞中spy1呈高表达状态,采用mtt方法检测可见,过表达spy1可以部分扭转由于hsod1g93a转染导致的细胞活性降低。过表达48小时后收集细胞,提取其蛋白,采用westernblotting方法检测对dna损伤途径中,磷酸化蛋白p-atm、p-atr、p-chk1、p-chk2的表达水平与对照组相比明显下降,并具有统计学意义(图5a),而非磷酸化蛋白atm、atr、chk1、chk2表达水平无明显变化,并且p53蛋白、mrna水平明显减少(图5b、c、e)。mtt法检测细胞活性,g93a突变的sod1导致nsc34细胞的活性降低,而这种情况可以部分被过表达spy1所逆转(图5d)。以往研究发现,spy1促进细胞增殖作用,以及参与dna损伤作用时,是通过与cdk2结合,并激活cdk2的活性而发挥作用的,并且在spy1介导的抑制凋亡过程中,spy1与cdk2形成spy1/cdk2复合物。那么在als细胞模型中,spy1是否与cdk2相互作用而发挥抑制凋亡作用。通过免疫共沉淀方法检测,结果显示在msod1细胞以及瞬时转染spy1质粒的msod1细胞中,spy1均与cdk2共沉淀作用,继而说明在alsmsod1细胞模型中,spy1是与cdk2相互作用而发挥抑制凋亡作用。
3.5在nsc34细胞中过表达hsod1g93a基因,抑制spy1的表达水平
在前期实验可见,与nsc34细胞、plv细胞、wtsod1细胞相比,msod1细胞中spy1的表达水平降低,为了进一步明确是由于过表达hsod1g93a基因后抑制了spy1基因的表达,nsc34细胞梯度瞬时转染含有hsod1g93a的质粒,将egfp-sod1g93a-pcdna3.1质粒以每孔0μg,1μg,2μg,3μg,4μg的浓度使用lipofectamine2000进行转染,转染48小时后进行荧光显微镜检测其转染效率。收集细胞,提起细胞蛋白及mrna。结果表明,随着不断增加突变的hsod1g93a基因后,spy1的mrna及蛋白表达水平不断降低(图6a、c、d、e),并且通过mtt法检测细胞活性可见,细胞活性随着转染hsod1g93a基因浓度增加而降低(图6b)。因此,明确转染hsod1g93a基因可以降低spy1的表达水平(图6)。
在上述实施例的基础上,将已制备的spy1聚合物纳米颗粒通过尾静脉注射的方式(80μg/只)注入sod1g93aals小鼠体内,每五天注射一次,连续四次,在最后一次注射两天后对sod1g93aals小鼠和对照组小鼠进行发病时间、生存期观察和行为学实验(悬尾实验、体重和转棒实验)(wangp,zhengx,guoq,yangp,pangx,qiank,luw,zhangq,jiangx.systemicdeliveryofbace1sirnathroughneuron-targetednanocomplexesfortreatmentofalzheimer'sdisease.jcontrolrelease.279(2018):220-233.),在上述实施例的实验数据基础上,我们认为这三种聚合物纳米颗粒能够起到推迟als小鼠的发病时间,延长生存期及改善行为功能的作用。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
序列表
<110>哈尔滨医科大学
<120>spy1基因及其表达蛋白在治疗肌萎缩侧索硬化中的用途
<130>klpi181067
<160>1
<170>patentinversion3.3
<210>1
<211>933
<212>dna
<213>human
<400>1
atgcggcataatcagatgtattgtgagacaccacctactgtcactattcatgtaaaatca60
ggctcaaataggtcacatcaaaccagaaaacctattagtctgaaacgtcctattcttaaa120
gatagttgggaagcatctgaaaacaatgctcagaataacaaatctaagcggcccagaggg180
ccttgtctaatcatacagcgccaggaaatgactgctttctttaaattatttgatgatgat240
ttaattcaagatttcttgtggatggactgctgctgcaagattgcagacaagtatcttttg300
gctatgacctttgtttatttcaagagagctaaatttactataaatgagcataccaggata360
aatttctttattgctctgtatctggctaatacggttgaagaagatgaagaagaagccaag420
tatgaaatttttccatgggctttagggaaaaactggagaaaactgttccctaatttctta480
aagttaagggaccaactctgggacagaattgactatagggctattgtaagcaggcgatgc540
tgtgaagaggtcatggccattgcgccaacccattacatctggcaacgagagcggtctgtg600
catcacagtggagctgttaggaactacaacagagatgaggttcacctgcccaggggacct660
agtgccacaccagtggattgctcactgtgtggtaaaaaaggaagatacgtgagactggga720
ctgtcttcatcctcatcttcctccagtgacacaggagagctaatggaaaaagattctcag780
gaactacacagtgcattctcagtggacacggcaggtgaccctcctcatacctattctcaa840
gtagccaatgaccatcaatcaaacaaagaaaatgaaactaattttgtgaagaaaaacaaa900
tccgtggaatggtttgcagagagtgaagaatga933
- 还没有人留言评论。精彩留言会获得点赞!