一种单胺氧化酶A、B抑制剂中药组合物的制作方法
本发明属于医药领域,尤其涉及一种单胺氧化酶a、b抑制剂中药组合物。
背景技术:
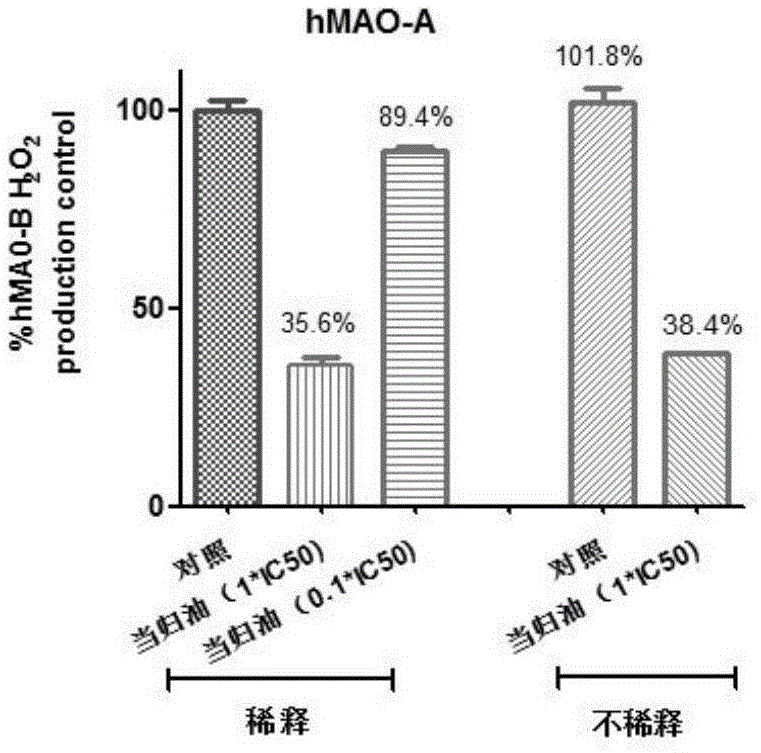
:单胺氧化酶(mao)是一种微粒酶,位于多巴胺能神经元的线粒体膜上,是催化单胺氧化脱氨反应的酶。mao是去单胺类物质(如去甲肾上腺素、酪胺等)的重要灭活酶,主要存在于大脑、肠道、肝脏和其他组织中,已经确定有两种亚型,即单胺氧化酶a(monoamineoxidase,mao-a)和单胺氧化酶b(monoamineoxidase,mao-b)。两者均以一个黄素腺嘌呤二核苷酸辅酶以共价键链接到活性中心区域的半胱氨酸残基上,能催化氧化生物体内的各种胺类物质,最终产生醛和双氧水参与细胞氧化。mao-a对血清素和去甲肾上腺素有较大的亲和力,而mao-b则优先使苄胺和苯乙胺脱氨基化。其中,mao-a主要存在于胃肠道、肝脏、肾脏、肺脏、大脑等器官的肾上腺素能神经元内,主要与5-羟色胺(5-ht)、去甲肾上腺素、多巴胺和酪胺结合。研究表明,因mao-a在神经组织中堆积而产生的过量的胺类代谢产物是引发各类精神疾病的重要原因。采用正电子发射断层扫描(pet)显示脑内高水平的mao-a与人格障碍、神经系统疾病和精神疾病有很大的关系,而mao-a抑制剂可有效地治疗多种精神障碍,主要有抑郁症(尤其是非典型及难治性抑郁症)、产后抑郁、更年期抑郁、边缘人格障碍、疼痛障碍、社交恐怖、焦虑症、创伤后应激障碍等。近年来发现,mao-a在前列腺癌、经典的霍奇金淋巴瘤和乳腺癌组织中高表达,因此,运用mao-a抑制剂对上述肿瘤可以产生良好的影响。mao-b主要存在于外周的血小板以及脑内5-ht能神经元和神经胶质细胞中。而maois是一类选择性抑制体内mao活性的药物,可以非选择性或选择性地抑制这两种同分异构体,但认为抑制mao-a对于抗抑郁药物效应是必要的,而抑制mao-b对于治疗帕金森病(pd)是有效的。研究人员发现大鼠mao-a与人类mao-b都是二聚体结构,而人类mao-a晶体是单体结构,这主要是由于151位置的一个氨基酸的差异引起的—大鼠mao-a有一个谷氨酸残基,而人类mao-a有一个赖氨酸残基。人类和大鼠mao-a活性位点的差异影响一些抑制剂的相互作用。例如,当不可逆抑制剂司来吉兰结合大鼠mao-a时有一个展开的构象,但是与人类mao结合时表现出更多的折叠构象。这种由于物种不同所带来的差异表明将一个物种中获得的结果推及另一个物种可能是有问题的,如用大鼠mao-a作为开发人类药物的模型还值得商榷。因此,用人单胺氧化酶(hmao-a)筛选抑制剂,对于发现有效的单胺氧化酶抑制剂具有重要的科学意义、社会价值和科学价值。当归,别名干归、秦哪,为伞行科植物当归angelicasinensis(oliv.)diele的根。性温,归心、肝经,具有补血活血,调经止痛,润肠通便的功效,为血家之圣药。现代研究表明当归含有挥发油部分和非挥发油部分。其中挥发油成份中主要包括洋川芎内酯,3-双藁本内酯,z-藁本内酯,苯酞类新化合物等多种化学成分。当归非挥发油中主要含有有机酸类和多糖类化合物。有机酸类化合物有机酸类化合物的主要成分为阿魏酸、烟酸、茴香酸、丁二酸等有机酸类化合物。还含有当归多糖以及黄豆素、黄酮及维生素a等物质。现代药理研究当归及其提取物对心、脑血管具有良好的保护作用,同时还具有平喘、舒张平滑肌、促进皮肤渗透、改善胃肠道功能、镇痛抗炎作用等。技术实现要素:本发明的目的是提供一种具有抑制单胺氧化酶活性的中药组合物,对单胺氧化酶a型具有稍好的选择性,对a、b的抑制作用均是可逆性的,属于竞争性抑制剂。本发明的目的是通过以下技术方案实现的,一种单胺氧化酶a、b抑制剂中药组合物,以当归或当归提取物为有效药用成分,与药物中可以接受的辅助添加成分共同组成。进一步地,所述的辅助添加成分是崩解剂、赋形剂、润滑剂或粘合剂。进一步地,所述的当归是打粉入药或者饮片入药。进一步地,所述当归提取物是0~100%乙醇水提取物。进一步地,所述当归提取物是当归挥发油,其藁本内酯的含量不得低于20%。进一步地,阿魏酸不得低于0.1%,藁本内酯不得低于5%。进一步地,所述的中药组合物为口服型药物制剂或外用制剂。与现有技术相比,本发明具有以下有益效果:该中药组合物适用于多种单胺氧化酶a、b活性升高的疾病的防治,如抑郁症、前列腺癌、经典的霍奇金淋巴瘤、乳腺癌、老年性痴呆以及帕金森综合征等,具有广阔的应用前景。附图说明图1为当归挥发油对hmao-a作用的可逆性;图2为当归挥发油对hmao-a作用的恢复曲线;图3为当归挥发油对hmao-b作用的可逆性;图4为当归挥发油对hmao-b作用的恢复曲线;图5为hmao-alineweaver-burk双倒数作图;图6为hmao-blineweaver-burk双倒数作图。具体实施方式以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。实施例1取当归药材,粉碎,过100目筛,分装,制备成散剂。实施例2取当归药材,粉碎,加入8倍量70%乙醇,浸泡过夜,加热回流提取3次,合并滤液,回收酒精,浓缩,干燥,测定其藁本内酯含量为31.2%,阿魏酸的质量含量为2.3%。然后打粉加入适量糊精等赋形剂,压片制备成0.5g的片剂。实施例3取当归药材,粉碎,加入8倍量10%乙醇,浸泡过夜,加热回流提取3次,合并滤液,回收酒精,浓缩,干燥,测定其藁本内酯含量为23.8%,阿魏酸的质量含量为2.5%。然后打粉,加入适量糊精等赋形剂,装入胶囊,制备成0.4g的胶囊剂。实施例4取当归药材,粉碎,加入8倍量蒸馏水,浸泡过夜,加热提取,并通过冷凝收集挥发油。将药渣回流提取3次,合并滤液,浓缩,干燥,加入挥发油,打粉,测定其藁本内酯含量为15.8%,阿魏酸2.1%。也可将上述两种提取加入月桂酸钠等乳化剂,制备成乳剂。实施例5市场购买当归挥发油,藁本內酯含量50%。按常规制成滴丸,备用。实施例6市场购买当归挥发油,采用分子蒸馏技术,分离、纯化后使其藁本內酯含量80.5%。按常规制备成软胶囊。实施例体外对hmao-a半数抑制浓度(ic50)测定。1.1实验药物实施例1-6的制备如前所述。异丙烟肼磷酸盐;临用前先用适量dmso(终浓度低于2.0%)溶解,用磷酸钾缓冲液分别稀释为5×10-5m,1×10-5m,2×10-6m,4×10-7m用于检测hmao-a活性。1.2实验试剂人单胺氧化酶a(humanmonoamineoxidasea,hmao-a),sigma出品,批号slbw9211,200u/mgprot,kynuraminedihydrobromide(sigma,批号mkbz2673v,结晶体;二甲亚砜(dmso),ar,成都市科隆化学品有限公司,批号2018050801;磷酸二氢钾·三水,ar,成都市科龙化工试剂厂,批号2015012101;磷酸氢二钾(ar),成都市科龙化工试剂厂,批号20130808;氯化钾(ar),成都市科龙化工试剂厂,批号20090205;氢氧化钠,ar,成都长联化工试剂有限公司,批号20130410。1.3实验仪器分析天平(德国赛多利斯公司生产,型号bp211d,e=0.1mg,d=0.01mg),涡旋仪(上海青浦沪西仪器厂,型号xw-80a),96孔板(corning,黑色),电热鼓风干燥箱(成都特斯特仪器有限公司,型号tst101a-1b),全波长多功能酶标仪(美国thermo公司,型号varioskanflash)。1.4试剂的配制磷酸钾缓冲液(0.1m):称取磷酸氢二钾·三水7.031g,磷酸二氢钾2.647g,溶解于500ml双蒸水中,再加入氯化钾0.757g。用磷酸氢二钾·三水调节ph至7.4。hmao-a溶液。取5mgprot/mlhmao-a5μl加磷酸钾缓冲液稀释为2ml,浓度为12.5μgprot/ml。犬尿胺:用0.1m(ph7.4)磷酸钾缓冲液分别配成225μm或150μm,分装备用。氢氧化钠溶液:称取naoh1.607g,加双蒸水20ml溶解为2m。1.5实施例5对hmao-a活性的影响酶活性测定方法根据参考文献略加修改,在黑色96孔板中,每孔分别加入不同浓度的样品10μl、hmao-a溶液30μl,混匀;37℃恒温孵育30min,然后加入225μm犬尿胺溶液10μl/孔,混匀,继续在37℃条件下恒温孵育30min。孵育完成后加入2m氢氧化钠溶液40μl/孔和双蒸水100μl/孔,终止反应,于激发波长310nm,发射波长400nm处测定其荧光强度,记录荧光值ifia。阴性对照组用10μl缓冲液代替化合物溶液做平行实验,荧光值记录为ifca,空白组以10μl+30μl+10μl缓冲液分别代替样品+hmao-a+犬尿胺做平行实验,荧光值if0a。计算公式:样品对hmao-a的抑制率(%)=100-(ifia-if0a)/(ifca-if0b)。1.6实施例5对hmao-b的抑制作用的测定在96孔板中加入不同浓度的当归挥发油(终浓度为60、30、15、7.5、3.3μg/ml)溶液25μl/孔,5.6u/mlhmao-b溶液50μl/孔,混匀后在37℃恒温培养箱中放置20min,再加入0.5mm酪胺和显色剂(1mm香草酸、500μm4-氨基安替比林和4u/mlⅱ型辣根过氧化物酶(hrp)为显色剂)的混合液(1:1混合)50μl/孔,混匀,然后放入37℃恒温培养箱反应120min后用酶标仪在490nm处下测吸光度值。空白组用25μl的ph=7.6的0.2m磷酸钾缓冲液代替样品溶液,阳性对照采用不同浓度雷沙吉兰(终浓度为1.69×10-1、3.38×10-2、6.67×10-3、1.35×10-3μg/ml),代替了25μl的样品溶液,各组的本底组均用ph=7.6的0.2m磷酸钾缓冲液代替了底物溶液,每浓度平行3孔,取平均值。计算其抑制率,抑制率=[(空白对照组-空白本底)-(药物组-药物本底)]/(空白对照组-空白本底)。1.7其他实施例对hmao-a活性的影响实施例1检测样品的制备,由于该实施例不能直接用于检测hmao-a活性,故采用动物血清样本进行检测,方法是:取体重为250~300g的雄性sd大鼠10只,随机分为两组,一组灌胃实施例10原生药g/kg,每天两次,连续7次,末次给药后1小时,腹主动脉取血,分离血清用于hmao-a活性检测。另一组灌胃等体积蒸馏水,末次给药后1小时,腹主动脉取血,分离血清用于hmao-a活性检测的样品稀释。hmao-a活性检测与1.5相同。其余实施例检测方法如1.5。1.8实施例5对mao-a、mao-b的可逆性测定1.8.1实施例5对hmao-a的可逆性测定将实验分成两类进行:1)需稀释:实验在200μl的无酶离心管中进行,分别加入当归挥发油100×ic50(3771.00μg/ml),10×ic50(377.10μg/ml);异丙烟肼磷酸盐10×ic50(6.07×10-1μg/ml)或磷酸钾缓冲液各5μl/管,再加入560u/mlhmao-a5μl/管,用磷酸钾缓冲液代替药物做空白对照,混匀,室温反应40分钟;然后加磷酸钾缓冲液190μl/管(20倍稀释),此时,所有的反应体系体积均为200μl/管,混匀,吸取50μl,加入96孔板中,再加入终浓度为0.5mm酪胺和显色剂(1mm香草酸、500μm4-氨基安替比林和4u/mlⅱ型辣根过氧化物酶(hrp)为显色剂)的混合液(显色剂:底物:磷酸缓冲液=1:1:1)75μl/孔,药物本底及空白本底孔加入含有同样量显色剂本底液混合液(显色剂:底物:磷酸缓冲液=1:0:2)。振荡器摇匀,490nm检测,每隔15min一次,连续3h。每浓度平行三孔,取平均值。graphphdprism5分析作图。2)不需稀释:将磷酸钾缓冲液95μl加入到含有5μl浓度为5.6u/mlhmao-a的离心管中,混匀,各管再分别加入100μl的5×ic50(188.55μg/ml)当归挥发油混匀。用磷酸钾缓冲液代替药物做空白对照,混匀,室温反应40分钟。吸取50μl,加入96孔板中,再加入0.5mm酪胺和显色剂(1mm香草酸、500μm4-氨基安替比林和4u/mlⅱ型辣根过氧化物酶(hrp)为显色剂)的混合液(显色剂:底物:磷酸缓冲液=1:1:1)75μl/孔,药物本底及空白本底孔加入含有同样量显色剂本底液混合液(显色剂:底物:磷酸缓冲液=1:0:2)。振荡器摇匀,490nm检测,每隔15min一次,连续3h。每浓度平行三孔,取平均值。graphphdprism5分析作图。1.8.2实施例5对hmao-b的可逆性测定将实验分成两类进行:1)需稀释:实验在200μl的无酶离心管中进行,分别加入当归挥发油100×ic50(6279.00μg/ml),10×ic50(627.90μg/ml);雷沙吉兰10×ic50(2.42×10-1μg/ml)或磷酸钾缓冲液5μl/管,再加入350u/mlhmao-b5μl/管,用磷酸钾缓冲液代替药物做空白对照,混匀,室温反应40分钟;然后在所有反应体系加磷酸钾缓冲液190μl/管(20倍稀释),此时,所有的反应体系体积均为200μl/管,混匀,吸取50μl,加入96孔板中,再加入终浓度为3mm苄胺和显色剂(1mm香草酸、500μm4-氨基安替比林和4u/mlⅱ型辣根过氧化物酶(hrp)为显色剂)的混合液(显色剂:底物:磷酸缓冲液=1:1:1)75μl/孔,药物本底及空白本底孔加入含有同样量显色剂本底液混合液(显色剂:底物:磷酸缓冲液=1:0:2)。振荡器摇匀,490nm检测,每隔15min一次,连续3h。每浓度平行三孔,取平均值。graphphdprism5分析作图。2)不需稀释:将磷酸钾缓冲液95μl加入到含有5μl浓度为3.5u/mlhmao-b的离心管中,混匀,各管再分别加入100μl的5×ic50(313.95μg/ml)当归挥发油混匀。用磷酸钾缓冲液代替药物做空白对照,混匀,室温反应40分钟。吸取50μl,加入96孔板中,再加入3mm苄胺和显色剂(1mm香草酸、500μm4-氨基安替比林和4u/mlⅱ型辣根过氧化物酶(hrp)为显色剂)的混合液(显色剂:底物:磷酸缓冲液=1:1:1)75μl/孔,药物本底及空白本底孔加入含有同样量显色剂本底液混合液(显色剂:底物:磷酸缓冲液=1:0:2)。振荡器摇匀,490nm检测,每隔15min一次,连续3h。每浓度平行三孔,取平均值。graphphdprism5分析作图。1.9实施例5作用于hmao的酶动力学探究1.9.1实施例5作用于hmao-a的酶动力学探究在96孔板中,分别加入终浓度为0、0.5×ic50、1×ic50、2×ic50当归挥发油(即0、18.855、37.71、75.42μg/ml)25μl/孔,再加入5.6u/mlhmao-a50μl/孔,混匀后37℃恒温培养箱中放置20min,然后在每个当归挥发油浓度水平下均分别加入不同浓度的hmao-a底物酪胺(0、0.03125、0.0625、0.125、0.25、0.5、1mm)与显色剂(1mm香草酸、500μm4-氨基安替比林和4u/mlⅱ型辣根过氧化物酶为显色剂)的混合液(显色剂:底物=1:1)50μl/孔,混匀,37℃恒温培养箱中放置120min后490nm波长下测定吸光度值。graphphdprism5分析,采用lineweaver-burk双倒数作图。1.9.2实施例5作用于hmao-b的酶动力学探究在96孔板中,分别加入终浓度为0、0.5×ic50、1×ic50、2×ic50当归挥发油(即0、31.395、62.79、125.58μg/ml)25μl/孔,再加入3.5u/mlhmao-b50μl/孔,混匀后在37℃恒温培养箱中放置20min,然后在每个当归挥发油浓度水平下均分别加入不同浓度的hmao-b底物苄胺(0、0.1875、0.375、0.75、1.5、3、6mm)与显色剂(1mm香草酸、500μm4-氨基安替比林和4u/mlⅱ型辣根过氧化物酶(hrp)为显色剂)的混合液(显色剂:底物=1:1)50μl/孔,混匀,37℃恒温培养箱中放置120min后490nm波长下测定吸光度值。graphphdprism5分析,采用lineweaver-burk双倒数作图。2结果采用das3.2.8统计软件进行统计学分析,计算半数抑制浓度。2.1实施例5对hmao-a的ic50测得实施例5对hmao-a有一定的抑制作用,结果见表1,对于hmao-a,测得ic50=37.71μg/ml;测得阳性药异丙烟肼磷酸盐对hmao-a的抑制作用,ic50=6.07×10-2μg/ml。表1实施例5及西药阳性药对hmao-a活性的影响2.2实施例5对hmao-b的抑制作用的测定结果测得当归挥发油对hmao-b有一定的抑制作用,结果见表2,对于hmao-b,测得ic50=62.79μg/ml;测得阳性药雷沙吉兰对hmao-b的抑制作用,ic50=2.42×10-2μg/ml。表2实施例5及西药阳性药对hmao-b活性的影响2.3实施例对hmao-a的ic50表3部分实施例对hmao-a的ic50样品名称ic50(μg/ml)实施例163.7μl/ml实施例243.8实施例345.4实施例447.2实施例631.4从表3可见,实施例1、2、3、4、6对hmao-a活性均有较好的抑制作用。2.4实施例5对hmao-a、hmao-b作用的可逆性测定结果当归挥发油对hmao-a、hmao-b的可逆性检测是先让高浓度当归挥发油与酶反应,然后再稀释到正常浓度,把它与正常浓度当归挥发油以及阳性药同酶反应的进行比较。2.4.1实施例5对hmao-a作用的可逆性测定结果从图1中可以看出,稀释后浓度为1×ic50,0.1×ic50的当归挥发油药物与hmao-a反应后,有一定量的h2o2产生。由此说明,当归挥发油对于hmao的抑制是可逆的,如图2的恢复性曲线更清楚的展现了,随着时间的推移,稀释后浓度为1×ic50,0.1×ic50的当归挥发油药物组均同对照组一样od值逐渐增大(即不断的有hmao-a与底物反应生成h2o2),而不是hmao-a完全失活产生的平行水平轴的直线。综上均可说明,当归挥发油对于hmao-a的抑制是可逆的。2.4.2实施例5对hmao-b作用的可逆性测定结果从图3中可以看出,稀释后浓度为1×ic50,0.1×ic50的当归挥发油药物与hmao-b反应后,有一定量的h2o2产生。由此说明,当归挥发油对于hmao-b的抑制是可逆的,如图4的恢复性曲线更清楚的展现了,随着时间的推移,稀释后浓度为1×ic50,0.1×ic50的当归挥发油药物组均同对照组一样od值逐渐增大(即不断的有hmao-b与底物反应生成h2o2),而不是hmao-b完全失活产生的平行水平轴的直线。综上均可说明,当归挥发油对于hmao-b的抑制是可逆的。2.5实施例5酶动力学研究结果根据一般酶动力学的研究方法,在不同底物浓度下,就当归挥发油对hmao-a、hmao-b的抑制类型进行探究,反应速度v通过h2o2产生的速度来表示,用graphphdprism5分析,采用lineweaver-burk双倒数作图,结果分别如图5、图6所示。当归挥发油对hmao-a呈竞争型抑制km=0.24mm;当归挥发油hmao-b也呈竞争型抑制km=0.40mm。上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属
技术领域:
中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1