一种分叉血管模型及其制备方法与流程
本发明属于组织工程中的人工器官和器官芯片的领域,具体涉及一种具有分叉血管模型及其制备方法。
背景技术:
目前市面上销售的人造血管一般采用化学材料如合成聚合物来制作(如eptef材料,polyethyleneterephthalatefibre),这些材料所制作的人造血管模型,通常用于少量替代病患体内部份血管,通常是较大血管(6mm直径以上)。然而,这些人造血管是由化学材料制作的,所以人造血管中并不含有细胞和活体物质,因此具有很少的生物功能性,只是作为一段血管的通道。
现有采用生物材料制备人造血管系采用生物材料支架法,如:通过对材料(如pcl)的塑形制作支架结构,以制作血管支架。然后部分工作中,对该材料表面种植细胞,使其生成表面覆盖有细胞的人造血管,这些细胞在长期的培养过程中(几个月的周期)可以逐渐溶解生物材料并再生。该方法的缺点是细胞生长在生物材料的内外表面,需要很长的时间才能生长并形成具有较好的生物结构的血管,该血管的生物功能性较差,不具有包括收缩和舒张在内的血管的功能性。
最近报道的采用3d打印技术制作的人造血管,采用甲基丙烯酸修饰的明胶(gelma)材料或者pegda材料,通过3d打印机进行打印,与此同时经过紫外光交联生成特定的结构。部分3d打印过程中可将细胞混入gelma或pegda水凝胶,从而得到含有细胞的3d打印人造血管。然而该方法具有显著的缺点是,3d打印材料中因为添加了光敏基团用于紫外光交联,而这些光敏基团的单体往往存在细胞毒性,因此对血管的功能性有害;同时这些3d打印材料经过光交联将生成致密的化学键网络,将细胞完全包裹在凝胶中,细胞虽然仍然可以部分存活,但是其活性和功能性受到严重影响。因此,采用3d打印技术制作的人造血管由于材料学的缺陷,具有一定的毒性,且细胞功能性不足。
最近报道的具有生物功能性的人造血管,其制备采用细胞片层法。具体做法是将细胞培养在二维平面基底上,形成细胞片层后,将细胞片层经过蜷曲,生成管状人造血管。然而采用细胞片层法制备人造血管模型的制作工艺复杂,制作周期很长,制作一个成熟的人造血管模型通常需要1个半月以上。另外,该方法还具有的显著缺点是该方法只能制作结构较为简单的直的人造血管。而人体真实的血管形状复杂,但细胞片层法难以制作这些具有复杂结构的人造血管。
此外,还有使用混有细胞的水凝胶成型法制作直形的人造血管模型的报道。然而,在制备人造血管模型的过程中,由于人造血管模型在生物医学方面的特殊用途,导致对制备材料在尺寸、温度、无毒、纯净方面的要求非常严格,又由于人造血管模型本身的脆弱性,导致在制备、安装、拆卸方面的严格要求,使得目前人造血管模型的制备研发没有获得进一步的突破,无法制作复杂血管结构,不能满足组织工程领域对生物模型及疾病模型进一步提升的要求。
技术实现要素:
为了解决上述问题,本发明提出一种分叉血管模型及其制备方法,具体技术方案如下:
一种分叉血管模型,所述分叉血管模型包括主支血管管路和至少一个分支血管管路,所述分叉血管模型的材质包括生物水凝胶,可增殖的平滑肌细胞或可分化为平滑肌细胞的平滑肌细胞前体细胞和间充质干细胞,所述平滑肌细胞或平滑肌细胞前体细胞的含量为1*10^6至10^7个细胞每克生物水凝胶的,所述间充质干细胞的含量为1*10^5至5*10^6个细胞每克生物水凝胶,所述血管的内壁表面包括可增殖的内皮细胞层。
在本发明中,分叉血管模型同时具有平滑肌细胞以及相配合的间充质干细胞。平滑肌细胞构成分叉血管内壁的主要成分之一,实现血管收缩和舒张的功能;间充质干细胞在分叉血管中分泌细胞外基质,填补血管中的缺陷,并响应外界刺激,在血管受损时扩增并分化,进行血管修复,同时间充质干细胞的繁殖和分化还进一步提高了血管壁的致密性和平滑肌细胞的收缩功能。
进一步地,主支血管管路包括直形管路部10和弧形管路部9,所述至少一个分支血管管路11位于所述直形管路部10和/或弧形管路部9上。
在本发明中,分叉血管模型具有弧形结构和分叉结构,由于分叉和弧形结构造成了在这些区域的血流方向和强度的变化,可以用于模拟生成病理学上动脉粥样硬化斑块。
进一步地,分叉血管模型的材质所包括的生物水凝胶可以是i型胶原蛋白和iv型胶原蛋白中的一种或组合。
进一步地,生物水凝胶中的胶原成分含量优选在2mg/ml至5mg/ml之间,在增加血管强度的同时,为平滑肌细胞增长提供足够的空间。
作为进一步优选,生物水凝胶的成分扩展还包括层海藻多糖(alginate),海藻多糖(alginate)与生物水凝胶质量百分比为0.5%-2%,加入该分量的alginate可进一步提升血管的弹性。
进一步地,所述可增殖的平滑肌细胞或可分化为平滑肌细胞的平滑肌细胞前体细胞与生物水凝胶的含量比例在2*10^6至10^7个细胞每克生物水凝胶,这样既可以保证平滑肌细胞的数量,又不会因平滑肌细胞过多而造成水凝胶的脆性增加。
进一步地,所述可增殖的内皮细胞层是经过灌注附着在血管的内壁表面生成内皮层,用于灌注的灌注液中内皮细胞的数量在5*10^6到2*10^7/ml;用于灌注的内皮细胞的数量在5*10^6到2*10^7/ml为适宜,即可保证内皮细胞的数量可以覆盖血管壁,又不会应为数量过多而产生内皮细胞堆积过密从而造成内皮细胞的死亡。
本发明还提出一种分叉血管模型的制备方法,包括以下步骤:
生成模具的配置:配置生成模具形成分叉血管模型的主支血管管路和至少一个分支血管管路,包括可拆卸连接分叉占位组件用于限定所述主支血管管路和至少一个分支血管管路的血管内壁,所述分叉占位组件包括直形占位组件和/或弧形占位组件;还包括可拆卸连接血管壁盖组件,用于形成所述主支血管管路和至少一个分支血管管路的血管壁生成腔;所述占位组件设置在所述血管壁生成腔中;所述生成模具上设置灌注入口和气体出口;
生成材料的配置:所述生成材料包括生物水凝胶前聚体,可增殖的平滑肌细胞或可分化为平滑肌细胞的平滑肌细胞前体细胞和间充质干细胞。作为优选,生成材料中可增殖的平滑肌细胞或可分化为平滑肌细胞的平滑肌细胞前体细胞与生物水凝胶前聚体比例优选为2*10^6至10^7个细胞每克生物水凝胶前聚体。所述间充质干细胞的含量为1*10^5至5*10^6个细胞每克生物水凝胶,间充质干细胞的数量进一步优选为平滑肌细胞数量的十分之一。
血管模型的灌注成型:向生成模具中灌注所述生成材料,经固化成型,获得具有雏形的分叉血管模型;
血管内皮层的灌注成型:拆除生成模具,向具有雏形的分叉血管模型中灌入血管培养液,所述血管培养液中包含内皮细胞悬液,经粘附培养,生成血管内皮层,获得成型的分叉血管模型。
进一步地,上述固化成型是指经过温度诱导固化和化学诱导固化中的一种或组合,所述化学诱导是指采用ph或盐离子诱导的中的一种或组合。固化成型优选经过20-37摄氏度以及化学诱导固化,半个小时左右的时间内,生物水凝胶预聚体中胶原蛋白以及其他组分(优选加入质量百分比为0.5%-2%alginate)聚合生成了具有一定机械强度的水凝胶,作为人造血管的血管壁。
进一步地,血管内皮层的灌注成型的步骤中,在拆除生成模具后配置灌流模块,包括在具有雏形的分叉血管模型的血管端口连接灌流,所述向具有雏形的分叉血管模型中灌入血管培养液是指经灌流管向具有雏形的分叉血管模型中灌注血管培养液。
进一步地,上述血管内皮层的灌注成型步骤之后之后还包括分叉血管模型的灌流成熟:向成型的分叉血管模型中灌流培养液,灌流对于血管内皮层产生的剪切力促使血管内皮层的成熟,经成熟培养周期,获得成熟的分叉血管模型。
进一步地,在上述在血管内皮层的灌注成型步骤之前还包括分叉血管模型的生物培养:向灌流模块中加入培养液,将所述具有雏形的分叉血管模型在培养液培养24-48小时,以使得平滑肌细胞稳定地生长在分叉血管模型的血管壁之内。
本发明的有益效果是:本发明所提出的分叉血管不仅具有真实血管的生物特性,更具有真实血管的分叉结构;通过该分叉血管建立起的生物模型以及疾病模型,能够满足疾病的病理研究以及治疗性药物的体外筛选的需要。同时该人造分叉血管也为在未来实现人造血管对于人体内血管分叉部分的替代提供了技术基础和可能。
【附图说明】
图1为本发明一个实施例中分叉血管和占位组件连接的结构示意图;
图2为本发明一个实施例中占位组件连接拆分示意图;
图3为本发明一个实施例中分叉血管的结构示意图;
图4为本发明一个施例中生成模具结构示意图。
【具体实施方式】
下面通过具体实施方式结合附图1至附图4对本发明作进一步详细说明,以便能够更好地理解本发明的方案以及其各方面的优点。在以下的实施例中,提供以下具体实施方式的目的是便于对本申请公开内容更清楚透彻的理解,而不是对本发明的限制。其中上、下、左、右等指示方位的字词仅是针对所示结构在对应附图中位置而言。
实施例1
参见图1-3,本发明提出的一种分叉血管模型。
人体血管是血液流过的一系列管道,遍布人体全身,按照构造功能不同,可分为动脉、静脉、毛细管三种。由于现有技术中只能制备直的血管,或者生物功能性低,为了满足医学建模的需要,本发明提出了一种分叉血管模型,包括主支血管管路和至少一个分支血管管路,该分叉血管模型包括生物水凝胶,可增殖的平滑肌细胞或可分化为平滑肌细胞的平滑肌细胞前体细胞和间充质干细胞,所述血管的内壁表面包括可增殖的内皮细胞层。其中,平滑肌细胞或平滑肌细胞前体细胞的含量为1*10^6至10^7个细胞每克生物水凝胶,间充质干细胞的含量为1*10^5至5*10^6个细胞每克生物水凝胶。一般情况下,血管分支管路的截面直径小于血管主支血管管路的截面直径。
分叉血管模型包括主血管(也称为主支血管管路)和位于主血管上的至少一个分支血管(也称为分支管路),分支血管上也可以包括再分支血管。主血管可以为直的管路,也可以具有一定的弧度,也可以是一定弧度与直形相结合,其中弧度部分的最大幅度支持半圆弧度;分支血管管路可以为直,也可以具有一定的弧度,最大支持半圆弧度。
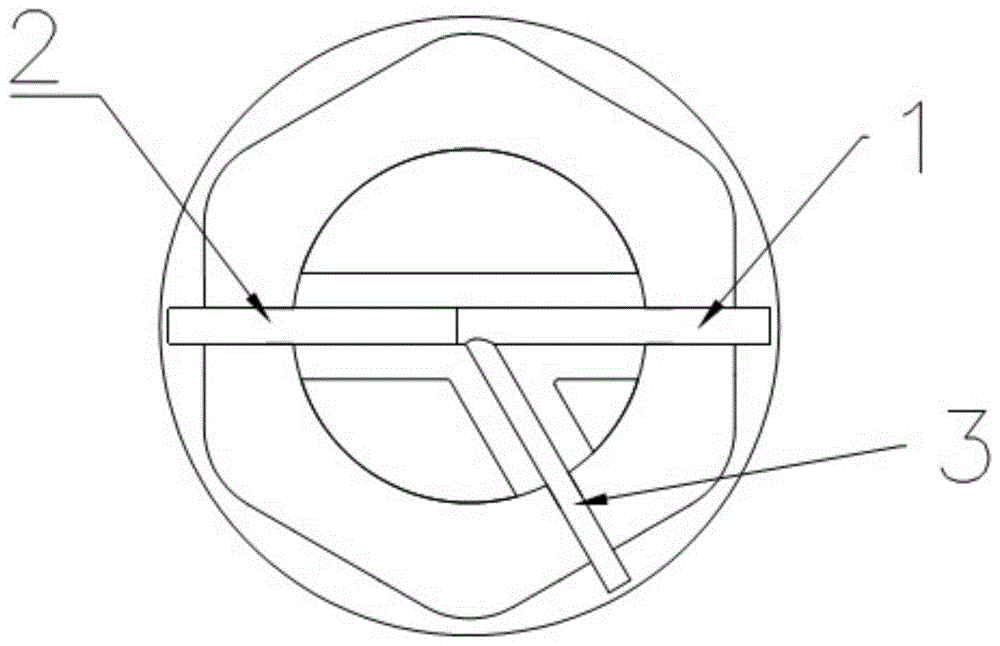
在本发明的一个实施例中,参见图1-2,分叉血管模型主支血管管路可以包括两个直形管路部,一个分支管路位于一个直形管路部上,有多个分支管路时,可以位于直形管路部的不同部位。制备时,该两个直形管路的内部设置形状匹配的两个占位组件,即第一占位组件1、第二占位组件2,且该两个占位组件“可拆卸”连接。每一个分支管路内部均设置形状匹配的一个占位组件;分支管路内部的一个占位组件3“可拆卸”连接于主支直形管路内的一个占位组件上;其拆卸分解结构如图2中4所标识。
在本发明中“可拆卸”连接是指占位组件和占位组件之间例如通过卡接、拼插、斜孔等设计的连接方式,如此,既能便于占位组件相互之间的连接,又能在血管成型之后,方便占位组件的拆除。
在本发明的另一个实施例中,参见图3,主支血管管路包括直形管部10和弧形管路部9,一个或多个分支管路11位于直形管路部10和/或弧形管路部9上。其中弧形管路部最大支持半圆弧度。制备时,主支直形管路部10、主支冠状弧形管路部9和每一个分支管路11分别设置形状匹配的一个占位组件。占位组件之间呈“可拆卸”连接。
在本发明的另一个实施例中,主支血管管路也可以包括曲线管路部。
在制备分叉血管模型的过程中,配置血管生成材料。为了使所制备的分叉血管模型具有更好的生物性能,本发明的生物水凝胶和平滑肌混合层中平滑肌的浓度优选在2*10^6细胞/mg水凝胶~10^7细胞/mg水凝胶,更优选5*10^6细胞/mg水凝胶。间充质干细胞的含量为1*10^5至5*10^6个细胞每克生物水凝胶,间充质干细胞的数量进一步优选为平滑肌细胞数量的十分之一。
其中所述生物水凝胶为i型胶原蛋白,iv型胶原蛋白中的一种或组合,所述生物水凝胶中的胶原成分含量在2mg/ml至5mg/ml之间;所述生物水凝胶中还可以包括alginate,alginate与生物水凝胶质量百分比为0.5%-2%,加入该分量的alginate可进一步提升血管的弹性;所述生物水凝胶中的可增殖的平滑肌细胞或可分化为平滑肌细胞的平滑肌细胞前体细胞的含量在2*10^6至10^7个细胞每克生物水凝胶,这样既可以保证平滑肌细胞的数量,又不会因平滑肌细胞过多而造成水凝胶的脆性增加。所述可增殖的内皮细胞层是经过灌注附着在血管的内壁表面生成内皮层,用于灌注的内皮细胞的数量在5*10^6至2*10^7/ml。
本发明的血管内壁表面的内皮细胞层,具有感知血管内流体的流速以及方向的能力(内皮细胞的生物功能性的反应);血管壁中平滑肌细胞可感受刺激作用(如肾上腺素,苯肾上腺素等产生收缩;或咖啡因等产生舒张;或流体情况所导致的内皮细胞信号);血管壁中间充质干细胞在分叉血管中分泌细胞外基质,填补血管中的缺陷,并响应外界刺激,在血管受损时扩增并分化,进行血管修复,同时间充质干细胞的繁殖和分化还进一步提高了血管壁的致密性和平滑肌细胞的收缩功能。
实施例2
本发明提出一种分叉血管模型的制备方法,具体地,包括如下步骤:
1.配置生成模具:
本发明分叉血管模型的制备主要利用灌注成型的原理和方法,因此,首先是准备灌注成型的血管生成模具。在该步骤中,主要包括连接血管壁盖组件和连接分叉占位组件。分叉占位组件与分叉血管壁盖组件相匹配形成主支血管管路和至少一个分支血管管路。该生成模具可用于设计为直形的分叉血管结构,也可以用于设计复杂血管的结构,例如可以包括一定的曲度或弧度;参见图3。
生成模具的配置:配置生成模具形成分叉血管模型的主支血管管路和至少一个分支血管管路,包括可拆卸连接直形占位组件和/或曲形和/或弧形占位组件,用于限定所述主支血管管路和至少一个分支血管管路的血管内壁;还包括可拆卸连接血管壁盖组件,用于形成所述主支血管管路和至少一个分支血管管路的血管壁生成腔;所述占位组件设置在所述血管壁生成腔中;所述生成模具上设置灌注入口和气体出口。
(1)连接分叉占位组件。
分叉占位组件用于限定所述主支血管管路和至少一个分支血管管路的血管内壁。分叉占位组件包括直形占位组件和/或曲形占位组件和/或弧形占位组件,需要连接的分叉占位组件的个数等于分叉血管模型的端口数量的总和。连接分叉占位组件后提供了分叉血管模型内壁形状的依据。
例如:一根主支血管管路包括主支直形管路和主支弧形管路,且该主支弧形管路上分叉一个直形分支管路时,分叉血管模型共3个端口,则分叉占位组件的总个数为3个,其中,主支直形管路内包括1个直的占位组件,主支弧形管路内包括1根弧形站位组件,分支管路内的内腔内包括1个直的占位组件。
作为本发明的一个优选实施例,主支血管管路内的占位组件之间优选采用卡接设计的连接方式。如图2所示,本发明中主支血管管路内的占位组件之间采用通过卡接设计的连接方式。
作为本发明的另一个优选实施例,分支血管管路内的占位组件优选采用斜孔设计的连接方式。如图2所示,本发明中,分支管路内的占位组件与主支血管管路内的占位组件之间采用斜孔设计的连接方式。
分叉占位组件的材料为生物相容性材料,比如生物陶瓷或者金属或者有机材料等。
(2)连接血管壁盖组件。
该血管壁盖组件用于形成所述主支血管管路和至少一个分支血管管路的血管壁生成腔,提供了分叉血管模型的血管外壁形状的依据。
在本发明的一个实施例中,参见图4,该血管壁盖组件包括上盖5,与上盖5相互配合的基座7。在基座7中形成有容纳占位组件的腔体,占位组件通过形成在基座7上的固定孔8固定,密封固定孔8的同时固定腔体内的分叉占位组件。
该分叉血管壁盖组件上分叉血管模型的近端口位置设置血管生成材料的灌注入口6和气体出口,便于凝胶的灌入和原空腔管道中的气体被排出。
该血管壁盖组件材料可以为任何生物相容性材料,优选采用pmma材料或玻璃材料制作血管的模具。
2.生成材料的配置
血管生成材料包括生物水凝胶前聚体,可增殖的平滑肌细胞或可分化为平滑肌细胞的平滑肌细胞前体细胞和间充质干细胞。其中生物水凝胶前聚体可以是i型胶原蛋白和iv型胶原蛋白中的一种或组合;生物水凝胶前聚体中的胶原成分含量优选在2mg/ml至5mg/ml之间,在增加血管强度的同时,为平滑肌细胞增长提供足够的空间;生物水凝胶前聚体的成分扩展还包括层alginate,alginate与生物水凝胶前聚体质量百分比为0.5%-2%,加入该分量的alginate可进一步提升血管的弹性;水凝胶中的平滑肌细胞的含量优选在2*10^6至10^7个细胞每克生物水凝胶前聚体之间,这样既可以保证平滑肌细胞的数量,又不会因平滑肌细胞过多而造成水凝胶的脆性增加。间充质干细胞的含量为1*10^5至5*10^6个细胞每克生物水凝胶,间充质干细胞的数量进一步优选为平滑肌细胞数量的十分之一。
3.血管模型的灌注成型
在生成模具拼接完毕并密封后,通过灌注上述生成材料。经过固化成型,例如室温或37度或化学诱导固化(如ph,盐离子等)和半小时左右的时间内,胶原蛋白聚合生成了具有一定机械强度的水凝胶作为人造血管的血管壁,生物水凝胶成型。这时,在生成模具中,按照血管壁盖组件和连接分叉血管内腔占位组的形状制作生成了具有雏形的分叉血管模型。
生成模具中,具有至少一个灌注入口和一个气体出口。优选在分叉血管模型的每一个端口位置附近设置一个口用作灌注入口或气体出口。
具有雏形的分叉血管模型也可以直接进行后续血管内皮层的灌注成型,可以经过培养后再进行后续血管内皮层的灌注成型;
4.血管内皮层的灌注成型
为了使分叉血管模型获得含有内皮细胞的内皮层,对上述获得的雏形分叉血管模型分叉血管模型进行生物培养。在本发明中,例如通过向人造血管模型中灌注含有内皮细胞的培养液进行粘附培养。培养液中,内皮细胞的数量在5*10^6至2*10^7/ml。
在本发明中优选在拆除生成模具后配置灌流模块,包括在具有雏形的分叉血管模型的血管端口连接灌流管。然后再经灌流管向具有雏形的分叉血管模型中灌注血管培养液。
在本发明中进一步优选在拆除生成模具时,拆除的占位组件直接连接雏形分叉血管模型的端口作为灌流管。
作为本发明中进一步优选,拆除的占位组件称为灌流模块的部件使用,例如断开和抽出的占位组件连接具有雏形的分叉血管模型的血管端口,从而作为灌流管。
作为本发明中进一步优选,所述灌流模块包括灌流培养腔,灌流培养腔的组件包括灌流培养腔上盖,灌流培养腔下盖,以及用于固定灌流管的腔体壁;所述用于固定灌流管的腔体壁和上述用于固定占位组件的腔体壁是同一部件。
5.分叉血管模型的灌流成熟
分叉血管模型可以经过培养后,再进行灌流,也可以直接进行灌流。
所谓灌流,即提供生理条件下类似血流的流体环境以促使分叉血管模型的成熟。
向成型的分叉血管模型中灌流培养液,灌流对于血管内皮层产生的剪切力促使血管内皮层的成熟,经成熟培养周期,获得成熟的分叉血管模型。
在不同的分支分别灌流入流体,或灌流出流体,以实现血管的灌流。此处应保持分叉血管中流入的流体计量的总和和流出的流体计量的总和计量相匹配(即血液净通过血管的体积为零)。这样通过控制流入和流出的量,我们就可以实现分叉血管的灌流。
该灌流流体为动物血液或者人体血液模拟流体。
由此,本发明制得了具有好的生物特性的分叉血管模型,具有真实血管的性能和结构,通过该分叉血管建立起的生物模型以及疾病模型,能够满足疾病的病理研究以及治疗性药物的体外筛选的需要。同时该分叉血管模型分叉血管模型也为在未来实现人造血管对于人体内血管分叉部分的替代提供了技术基础和可能。
以上所述的仅是本发明的实施方式,在此应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出改进,但这些均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!