负载吲哚菁绿的介孔二氧化硅包裹上转换纳米颗粒的制备方法与流程
本发明属于生物技术和医药技术领域,具体涉及一种负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法。
背景技术:
吲哚菁绿(icg)是一种在近红外光谱范围内有较强吸收、毒性小、不参与体内生物转化、排泄迅速的荧光染料,是目前唯一被美国fda批准的临床使用的近红外光学成像对比增强剂。同时icg也可用于光动力治疗,在近红外光照射下,利用其高荧光效率,在较低剂量时可选择性的杀死肿瘤组织。然而icg的水不稳定性、光降解性、热降解性和易于与脂蛋白结合导致体内快速被清除等缺点,限制了其在pdt肿瘤治疗中的应用。
上转换纳米材料具有良好的化学稳定性、光稳定性。其在近红外光的照射下能持续稳定的发光,而且能将长波长的光转换为短波长的光,生物材料干扰小,更好地用于体内示踪。介孔二氧化硅纳米粒(msn)因其特有的介孔结构,能保证药物分子以扩散的形式进入到孔径;且其具有载药量高、表面易修饰等特点。因此,构建稳定有效体内长时间循环的光动力纳米材料成为了急需解决的问题。
技术实现要素:
本发明所要解决的技术问题在于提供一种负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法。
为解决上述技术问题,本发明的技术方案是:
一种负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法,具体步骤如下:
(1)制备上转换纳米颗粒:分别配置六水合氯化钇、六水合三氯化镱、六水合三氯化铥溶液,将液体加入干净的三口烧瓶中,调节转子转速,用较小转速将溶液混合均匀,将三口烧瓶加热至瓶内液体变为白色粉末后停止加热,但不停止磁力搅拌转子的转动,降温到50-60℃后加入油酸和十八烯,继续升温,颜色由乳白色变为黄色(约一小时),降温到甲醇的沸点(六十四点七度),加入含氟化钠的甲醇溶液,升温至液面无气泡后连接气路,抽真空半小时,通氮气升温加热一小时,用乙醇和环己烷离心收集颗粒;
(2)介孔二氧化硅包裹上转换纳米颗粒:将上转换与表面活性剂同时加入到环己烷溶液,磁力搅拌数小时加入氨水继续搅拌两小时,加入原硅酸四乙酯(teos)搅拌,用甲醇终止反应,用乙醇和环己烷洗涤数次分散在水里,将该溶液加到有十六烷基三甲基溴化铵和三乙胺的水溶液中,搅拌数小时后加入原硅酸四乙酯,升温继续搅拌,乙醇洗涤离心,萃取除去十六烷基三甲基溴化铵后“表面保护热水蚀刻”方法进行蚀刻;
(3)将icg负载到介孔二氧化硅包裹上转换的纳米颗粒上:将icg与ucmsn纳米颗粒溶液混合均匀,避光磁力搅拌6-12小时,离心收集,沉淀用双蒸水重悬,得到负载icg的ucmsn纳米颗粒。
优选的,上述负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法,所述步骤(1)中将溶液配制成1mm,其中,六水合氯化钇、六水合三氯化镱、六水合三氯化铥溶液按体积比700-800:100-200:10-40的比例混匀后加热温度为100℃-120℃。
优选的,上述负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法,所述步骤(1)中油酸的加入量为2-10ml,十八烯的加入量为10-40ml,并且在加入油酸和十八烯后加热温度控制在140℃-180℃。
优选的,上述负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法,所述步骤(1)中含氟化钠的甲醇溶液中氟化钠的浓度为0.5-10m。
优选的,上述负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法,所述步骤(1)中通氮气后的加入温度为260℃-400℃。
优选的,上述负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法,所述步骤(2)中在上转换与表面活性剂在环己烷中混合均匀后加入100-200μl氨水,并且之后以200μl每小时的速率将100-500μl原硅酸四乙酯(teos)注入系统,混合物密封并保持搅拌20-48小时。
优选的,上述负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法,所述步骤(2)中十六烷基三甲基溴化铵和三乙胺质量比在100:1-10:10,逐滴加入100-600μl原硅酸四乙酯(teos),并将体系在80℃-90℃搅拌1-2小时;并在室温下用30ml含有氯化钠的甲醇,萃取3-6小时以除去模板ctab。
优选的,上述负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法,所述步骤(2)中用10-50mlpvp(0.25g,mw=40,000)的水溶液,将混合物搅拌0.5-3小时,然后加热至95℃,在蚀刻3-6小时后,然后将系统冷却至室温。将得到的ucmsn产物用乙醇和水洗涤数次,最后分散在10ml去离子水中。
优选的,上述负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法,所述步骤(3)中避光磁力搅拌速度是400-800转/分钟,10000-15000转每分钟离心10-15分钟,离心收集,沉淀用双蒸水重悬定量至1-5毫克每毫升,得到负载吲哚菁绿的ucmsn纳米颗粒。
本发明结构有如下有益效果:
上述负载吲哚菁绿(icg)的介孔二氧化硅包裹上转换纳米颗粒的制备方法,制备出具有800nm发射峰的上转换纳米颗粒,在上转换外部包裹介孔二氧化硅,将icg负载到颗粒内部,颗粒大小80-200nm,细胞吞入后的成活率80%,用共聚焦显微镜观察颗粒进入细胞,对细胞进行成功标记,噻唑蓝反应测激光照射细胞杀伤实验效果明显。
附图说明
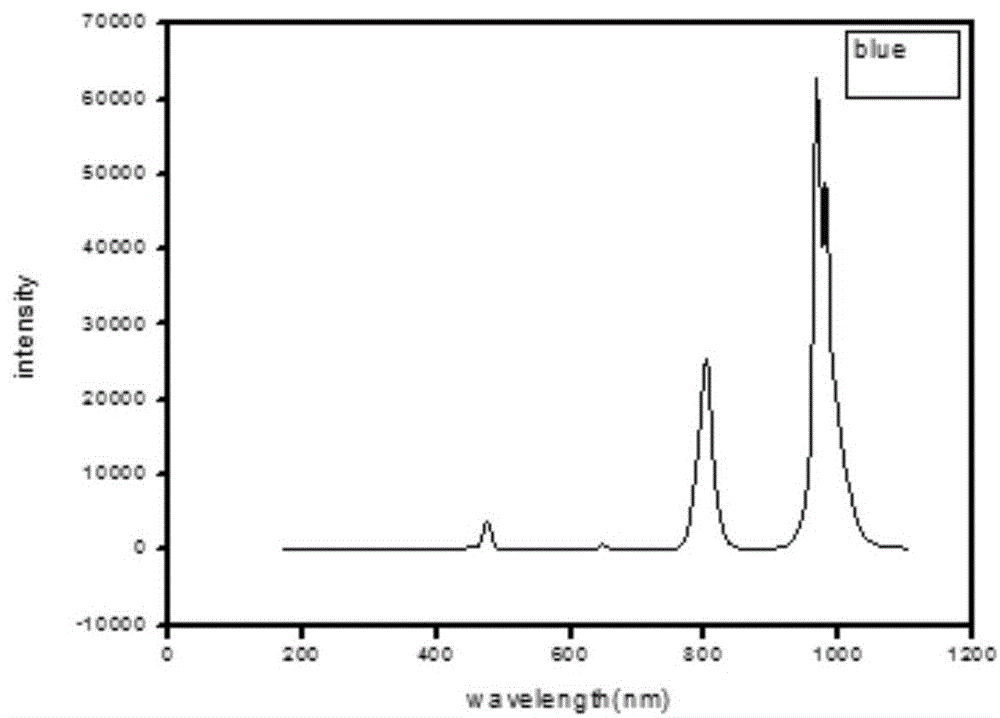
图1:上传换的发射光光谱。
图2:介孔二氧化硅包覆上转换颗粒的透射电镜相貌图。
图3:包载icg的纳米颗粒颗粒对海拉细胞毒性的结果。
图4:包载icg的纳米颗粒颗粒进入hela细胞的共聚焦图。
图5:包裹icg的纳米颗粒在激光照射后,杀伤肿瘤细胞的结果。
具体实施方式
为进一步说明本发明,现通过具体实施实例对本发明进行详细阐述。
实施例1
将六水合氯化钇、六水合氯化镱、六水合氯化铥溶液按比例体积比700:100:10混合混匀,110℃加热15分钟至变成白色粉末,停止加热不停旋转,提升烧瓶,降热到50℃,加入2ml油酸和10ml十八烯,升温到140℃,颜色由乳白色变为黄色(约一小时),降温至甲醇的沸点(64.7℃)。称取0.5m氟化钠的甲醇溶液,逐滴加入三口瓶内,升温到110℃,待液面无气泡时连接气路。抽真空半个小时后通氮气,升温到260℃,反应一小时后结束。等体积乙醇离心,8000转每分钟离心10min收集沉淀,加入20ml环己烷,2000转每分钟离心5min,收集上清,重复上述步骤一次,最后将产物保存在20ml玻璃瓶中。
根据o/w反相微乳液法,将1mligepalco-520(np-5)分散在20ml环己烷中。将在环己烷溶液(2ml,50mm)中的油酸封端的ucnp加入到环己烷/np-5混合物中,磁力搅拌3小时后,逐滴加入100μl氨(30%),搅拌2小时。以200μl/h的速率将100μl原硅酸四乙酯(teos)注入系统。将混合物密封并保持搅拌36小时,然后加入甲醇以终止反应。将得到的ucnp@sio2产物用乙醇和环己烷洗涤数次以除去过量的np-5,并最终分散在5ml去离子水中。将十六烷基三甲基溴化胺ctab(2g)和三乙胺tea(0.01g)在20ml去离子水中搅拌1.5小时。随后加入10ml含有ucnp@sio2的去离子水并继续搅拌1.5小时。逐滴加入100μl原硅酸四乙酯(teos),并将体系在80℃下搅拌1小时。将产生的ucnp@sio2@msio2产物用乙醇洗涤数次,并在室温下用30ml(1wt%)nacl的甲醇溶液,萃取3小时以除去模板ctab。萃取进行数次,最终的ucnp@sio2@msio2产物分散在10ml去离子水中。将10ml去离子水中制备的ucnp@sio2@msio2加入到含有10mlpvp(0.25g,mw=40,000)去离子水的烧瓶中。将混合物搅拌0.5小时,然后加热至95℃。蚀刻3小时后,然后将系统冷却至室温。将得到的ucmsn产物用乙醇和水洗涤数次,最后分散在10ml去离子水中。
将icg与ucmsn纳米颗粒溶液混合均匀,避光磁力搅拌8小时,10000转每分钟离心10分钟收集,沉淀用双蒸水重悬,得到负载icg的ucmsn纳米颗粒。
实施例2
将六水合氯化钇、六水合氯化镱、六水合氯化铥溶液按体积比800:200:40,混匀120℃加热15分钟至变成白色粉末,停止加热不停旋转,提升烧瓶,降热到50℃,加入10ml油酸和40ml十八烯,升温到180℃,颜色由乳白色变为黄色(约一小时),降温至甲醇的沸点(64.7℃)。称取2.5mm氟化钠的甲醇,逐滴加入三口瓶内,升温到110℃,待液面无气泡时连接气路。抽真空半个小时后通氮气,升温到400℃,反应一小时后结束。等体积乙醇离心,8000转每分钟离心10min收集沉淀,加入20ml环己烷,2000转每分钟离心5min,收集上清,重复上述步骤一次,最后将产物保存在20ml玻璃瓶中。
根据o/w反相微乳液法,将1mligepalco-520(np-5)分散在20ml环己烷中。将在环己烷溶液(2ml,50mm)中的油酸封端的ucnp加入到环己烷/np-5混合物中,磁力搅拌3小时后,逐滴加入200μl氨(30%),搅拌2小时。以200μl/h的速率将200μl原硅酸四乙酯(teos)注入系统。将混合物密封并保持搅拌36小时,然后加入甲醇以终止反应。将得到的ucnp@sio2产物用乙醇和环己烷洗涤数次以除去过量的np-5,并最终分散在5ml去离子水中。将ctab(2g)和tea(0.02g)在20ml去离子水中搅拌1.5小时。随后加入10ml含有ucnp@sio2的去离子水并继续搅拌1.5小时。逐滴加入600μl原硅酸四乙酯(teos),并将体系在80℃下搅拌1小时。将产生的ucnp@sio2@msio2产物用乙醇洗涤数次,并在室温下用30ml(1wt%)nacl的甲醇溶液,萃取3小时以除去模板ctab。萃取进行数次,最终的ucnp@sio2@msio2产物分散在10ml去离子水中。将10ml去离子水中制备的ucnp@sio2@msio2加入到含有50mlpvp(0.25g,mw=40,000)去离子水的烧瓶中。将混合物搅拌3小时,然后加热至95℃。蚀刻6小时后,然后将系统冷却至室温。将得到的ucmsn产物用乙醇和水洗涤数次,最后分散在10ml去离子水中。
将icg与ucmsn纳米颗粒溶液混合均匀,避光磁力搅拌9小时,10000转每分钟15分钟离心收集,沉淀用双蒸水重悬,得到负载icg的ucmsn纳米颗粒。
实施例3
将六水合氯化钇、六水合氯化镱、六水合氯化铥溶液按体积比780:200:20混合均匀,110℃加热20分钟至变成白色粉末,停止加热不停旋转,提升烧瓶,降热到50℃,加入6ml油酸和15ml十八烯,升温到150℃,颜色由乳白色变为黄色(约一小时),降温至甲醇的沸点(64.7℃)。称取0.168g氟化钠,溶解于4ml甲醇,逐滴加入三口瓶内,升温到110℃,待液面无气泡时连接气路。抽真空半个小时后通氮气,升温到300℃,反应一小时后结束。等体积乙醇离心,8000转每分钟离心10min收集沉淀,加入20ml环己烷,2000转每分钟离心5min,收集上清,重复上述步骤一次,最后将产物保存在20ml玻璃瓶中。
根据o/w反相微乳液法,将1mligepalco-520(np-5)分散在20ml环己烷中。将在环己烷溶液(2ml,50mm)中的油酸封端的ucnp加入到环己烷/np-5混合物中,磁力搅拌3小时后,逐滴加入140μl氨(30%),搅拌2小时。以200μl/h的速率将200μl原硅酸四乙酯(teos)注入系统。将混合物密封并保持搅拌36小时,然后加入甲醇以终止反应。将得到的ucnp@sio2产物用乙醇和环己烷洗涤数次以除去过量的np-5,并最终分散在5ml去离子水中。将ctab(2g)和tea(0.2g)在20ml去离子水中搅拌1.5小时。随后加入10ml含有ucnp@sio2的去离子水并继续搅拌1.5小时。逐滴加入300μl原硅酸四乙酯(teos),并将体系在80℃下搅拌1小时。将产生的ucnp@sio2@msio2产物用乙醇洗涤数次,并在室温下用30ml(1wt%)nacl的甲醇溶液,萃取3小时以除去模板ctab。萃取进行数次,最终的ucnp@sio2@msio2产物分散在10ml去离子水中。将10ml去离子水中制备的ucnp@sio2@msio2加入到含有10mlpvp(0.25g,mw=40,000)去离子水的烧瓶中。将混合物搅拌0.5小时,然后加热至95℃。蚀刻3小时后,然后将系统冷却至室温。将得到的ucmsn产物用乙醇和水洗涤数次,最后分散在10ml去离子水中。
将icg与ucmsn纳米颗粒溶液混合均匀,避光磁力搅拌12小时,12000转每分钟离心收集,沉淀用双蒸水重悬,得到负载icg的ucmsn纳米颗粒。
实施例4
将实施例3中制备的上转换纳米颗粒溶于环己烷溶液中,加入到四面通透的石英皿中,用980nm激光进行照射,用光纤光谱收集信号,得到所制备的上转换的发射光光谱(如图1所示),如图可知所制备的上转换纳米颗粒在800nm处有明显是发射峰。将实例3中的纳米颗粒进行稀释,滴加在碳支持膜上,用透射电子显微镜进行形貌观察(如图2所示),颗粒大小比较均一,包裹效果正常。
实施例5
mtt法测试制备的不同浓度纳米颗粒对海拉细胞的毒性:
(1)种植海拉细胞8000个/孔至96孔培养板,24小时后,细胞达到70%-90%的汇合率时,将孔内的培养基更换为100微升dmem培养基,对细胞进行饥饿处理6小时。
(2)将颗粒用含血清的dmem培养基稀释至0.025毫克每毫升、0.0125毫克每毫升、0.00625毫克每毫升、0.003125毫克每毫升和0.00625毫克每毫升五个浓度,加入孔中以替代原不含血清培养基。在37℃,5%co2培养箱环境下孵育24小时后,向每个孔中加入10微升mtt溶液,继续放回培养箱环境下继续孵育4小时后,吸取每孔培养基,向每孔内加入100微升dmso,室温摇床震荡反应10分钟。使用酶联免疫检测仪在570纳米波长处检验每孔样品吸光值,按下面公式计算细胞存活率,每组设8个平行,计算其平均值。
(3)细胞存活率(%)=实验组细胞吸光值(a2)/空白组细胞吸光值(a1)*100%(如图3所示)。
实施例6
种植海拉细胞8000个/孔至共聚焦小皿,24小时后,细胞达到70%-90%的汇合率时,将孔内的培养基更换为200微升dmem培养基,对细胞进行饥饿处理4小时。将实施例3中制备的纳米颗粒用含血清的dmem培养基稀释至0.0100毫克每毫升,加入孔中以替代原不含血清培养基。在37℃,5%co2培养箱环境下孵育4小时后,固定并用hochest染料将细胞核染色,在荧光倒置显微镜(560纳米通道观察icg素标记的纳米颗粒显示为红色,405纳米通道观察hochest染料显示为蓝色)观察制备的纳米颗粒对细胞的吞噬情况(如图4所示)。
本发明涉及的纳米颗粒的细胞杀伤能力的评价如下:
(1)种植hela细胞至24孔培养板,细胞密度10000个/孔,待细胞达到70%-90%的汇合率时,将孔内的培养基吸出,更换为200μldmem培养基,对细胞进行饥饿处理6-8小时。
(2)将负载icg的介孔二氧化硅包裹上转换的纳米颗粒用含血清的dmem培养基稀释至0.00625-0.0500毫克每毫升,加入孔中以替代原不含血清培养基。
(3)4个小时后用激光照射细胞。
(4)在37℃,5%co2培养箱环境下孵育24小时后,加入十比一稀释的mtt与无血清培养基,孵育四个小时以后,去上清加入100微升的二甲基亚,用酶标仪检测各个空洞在570nm波长光下的吸收强度,并进行统计学分析细胞杀伤效率如图5。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!