一种柳氮磺胺吡啶片及其制备方法与流程
本发明属于医药技术领域,涉及一种药物制剂及其制备方法,具体涉及一种柳氮磺胺吡啶片及其制备方法。
背景技术:
柳氮磺胺吡啶为磺胺类抗菌药,属口服不易吸收的磺胺药。于二十世纪五十年代问世,如表1所示,目前日本有pfizer、teva等公司上市销售本品,;美国市场有vintage和pharmaciaandupjohn两家企业拥有本品批文;欧洲仅丹麦上市本品。1996年北京双鹤药业率先在国内上市本品,当前本品国内批文规格均为0.25g。美国于1983年批准辉瑞子公司法玛西亚普强的500mg肠溶片上市。
柳氮磺胺吡啶临床上用于治疗:①溃疡性结肠炎治疗轻至中度的溃疡性结肠炎;在重度溃疡性结肠炎中可作为辅助疗法。亦可用于溃疡性结肠炎缓解期的维持治疗。②crohn‘s病:用于治疗活动期的克隆病,特别是那些累及结肠炎的患者。③类风湿性关节炎:对水杨酸类或其他非甾体类抗炎药疗效不显著的类风湿性关节炎和幼年类风湿性关节炎(多关节型)。
表1柳氮磺胺吡啶上市时间、厂家、规格及适应症对照表
柳氮磺胺吡啶口服后在小肠被细菌水解为磺胺吡啶(sp)和5-氨基水杨酸(5-asa)。5-氨基水杨酸与肠壁结缔组织络合后较长时间停留在肠壁组织中起到抗菌消炎和免疫抑制作用,如减少大肠埃希菌和梭状芽孢杆菌,同时抑制前列腺素的合成以及其他炎症介质白三烯的合成。原型药物的生物利用度15%,肠道代谢物磺胺吡啶的生物利用度60%左右(结肠吸收),5-氨基水杨酸的生物利用度约为10-30%。
柳氮磺胺吡啶存在羧基,pka1为2.4,在低ph条件下溶解度很低。存在磺胺基,pka2为8.3,随着ph增加溶解度增加明显,尤其在ph6.0可能是转折点。口服药物进入人体消化系统,一般经过依次胃、十二指肠、小肠、大肠最终排出。胃下部ph1.5-4.0,十二指肠ph4.2-7.5,小肠ph5.5-7.5,大肠中盲肠、右半结肠ph5.5-7.5,左半结肠、直肠ph6.5-7.5,从胃到肠,ph基本呈现上升趋势。基于柳氮磺胺吡啶本身性质与人体ph环境,其口服制剂在胃液中基本被不吸收,在肠道内吸收、分解发挥药理作用。
柳氮磺胺吡啶原料药在ph6.8条件下溶解度为0.56mg/ml,ph6.0条件下溶解度为0.42mg/ml。国内制剂产品研究中一般采用900ml溶液模拟体液,以此估算ph6.8环境下溶解柳氮磺胺吡啶500mg,以此估算ph6.0环境下溶解柳氮磺胺吡啶378mg。规格500mg的普通柳氮磺胺吡啶口服制剂在ph6.8情况下100%释放,ph6.0情况下应该75%释放。在偏碱性的肠道环境中,柳氮磺胺吡啶会快速溶解释放,药物进入机体的吸收速率过快。为了减少给药所呈现血药浓度的峰谷现象,使血药浓度保持在比较平稳持久的有效范围内,提高了药物的安全性,需要通过制剂处方或者工艺改进,达到对柳氮磺胺吡啶释药速率进行控制的目的。
技术实现要素:
为解决上述现有技术问题,本发明提供了一种柳氮磺胺吡啶片及其制备方法,本发明的柳氮磺胺吡啶片能够缓慢释放,ph6.0介质中释放率在50%左右,同时,本发明片剂硬度提高,保障可压性,易于包衣。
本发明的第一个目的提供一种柳氮磺胺吡啶普通片。
一种柳氮磺胺吡啶普通片,包含原料药:柳氮磺胺吡啶,辅料:填充剂、粘合剂润滑剂、崩解剂、肠溶材料,通过制粒压片步骤制成片剂,所述制粒步骤得到的颗粒粒度分布范围为30-40目、40-50目、50目以下颗粒比例为0.2:1:(2.0~1.5)之间。
控制颗粒粒度分布范围,可以得到硬度适宜,压片、包衣较为顺利,溶出可控的片芯。片芯能够与理想型的标准曲线高度拟合,介质在ph6.0条件下,最终释放率为50%左右,介质在ph6.8条件下,最终释放率在90%左右。
优选的,最终颗粒粒度选分布范围为:30-40目、40-50目、50目以下颗粒比例为0.2:1:(1.8~1.6)。
颗粒粒径配比可以制备过程中控制,可以采用但是不限于摇摆制粒机、离心制粒机、研磨机、振荡筛等筛分工艺实现。
上述组成成分中柳氮磺胺吡啶所占比例较大,原料药的物理性质对片剂的可压性起着重要作用,由于原料药堆密度较小,故其静电较大,故对原料药或者与内加辅料进行第一次制粒处理,得到密度、流动性均较好的颗粒,可以再进行1次、2次或者更多次制粒以制得最终颗粒。经过研究发现其最终颗粒的粒径分布及配比会显著影响其在ph6.0、6.8等不同溶出介质条件下的溶出行为和溶出曲线。
优选的,柳氮磺胺吡啶普通片,还包括释放阻滞剂。
优选的,一种柳氮磺胺吡啶普通片,包含以下重量份的组成:
根据上述柳氮磺胺吡啶普通片,还包括释放阻滞剂,释放阻滞剂的质量份数为10~45。
所述填充剂为淀粉、糊精、微晶纤维素中的一种或者多种。
所述粘合剂为聚维酮k30、聚维酮k90、羟丙甲基纤维素、羟丙基纤维素、甲基纤维素、预胶化淀粉中的一种或者多种。
所述释放阻滞剂为羟丙甲基纤维素k200m,羟丙甲基纤维素k100m,羟丙甲基纤维素k35m、硬脂酸中的一种或者多种。
所述润滑剂为滑石粉、二氧化硅、硬脂酸镁、山嵛酸甘油酯、胶态二氧化硅中的一种或者多种。
所述崩解剂为交联羧甲基纤维素钠、交联羧甲基纤维素钙中的一种或者多种。
所述肠溶材料为醋酸羟丙甲纤维素琥珀酸酯(hpmcas)、羟丙甲纤维素邻苯二甲酸酯(hpmcp)和邻苯二甲酸乙酸纤维素(cap)中的一种或者多种,具体的可以为hpmcp-55。
进一步优选的处方方案如下:重量份的组成:
本发明第二个目的,提供一种柳氮磺胺吡啶肠溶片,所述肠溶片通过上述柳氮磺胺吡啶普通片作为片芯包衣后制得。包衣材料包括肠溶性成膜剂、增塑剂。肠溶性成膜剂、增塑剂制成的包衣膜,不影响肠溶片的溶出终点,能够达到在ph6.0介质中,溶出终点<60%的溶曲预设目标。
所述成膜剂为醋酸羟丙甲纤维素琥珀酸酯(hpmcas)、羟丙甲纤维素邻苯二甲酸酯(hpmcp)和邻苯二甲酸乙酸纤维素(cap)中的一种或者多种,具体的可以为hpmcp-55。
所述增塑剂可选用丙二醇、甘油、聚乙二醇、邻苯二甲酸酯、蓖麻油中的一种或多种。
优选的,所述柳氮磺胺吡啶肠溶片还包括抛光剂,所述抛光剂为巴西棕榈蜡。所述柳氮磺胺吡啶肠溶片还包括附加成分,所述附加成分可以是二氧化钛、滑石粉、硬脂酸镁、色素、增溶剂等。
本发明的柳氮磺胺吡啶肠溶片包衣膜重占片芯总重的1~12%(w/w),优选2~8%(w/w),更优选2~6%(w/w)。
本发明第三个目的,提供一种制备柳氮磺胺吡啶普通片的制备方法,包括如下步骤:
1)原料药首次制粒,所得颗粒中加入内加辅料继续制粒一次或多次;或者原料药与内加辅料混合进行首次制粒,所得颗粒混合后继续制粒一次或者多次。
2)筛分颗粒,取不同目数颗粒,使得颗粒粒度分布范围为30-40目、40-50目、50目以下颗粒比例为0.2:1:(2.0~1.5)之间;
3)经筛分后的颗粒加入外加辅料混合压片。进一步的,所述制粒通过摇摆机法、高剪切制粒法、热熔挤出法、槽式混合机与研磨机配合法、流化床制粒与挤出滚圆配合法。
优选的,所述继续制粒经过2-3次制粒。
所述步骤1)中内加辅料为填充剂、粘合剂、润滑剂、肠溶材料,步骤3)中外加辅料为填充剂、粘合剂、润滑剂和崩解剂,所述步骤1)中内加辅料称取量为40%~60%填充剂,55%-65%粘合剂,40%-50%润滑剂。
可以采用湿法制粒、干法制粒或者挤出滚圆制粒后(以上述不同原理的制粒机反复制粒次数在1-3次)后压片,具体步骤如下:称取物料混合均匀,以干法制粒机或者加入润湿剂后湿法制粒、干燥、整粒后再加入胶态二氧化硅、硬脂酸镁、交联羧甲基纤维素钠等外加辅料混合均匀后,使用压片机压片得到普通片。
所述湿法制粒或者挤出滚圆制粒过程中可以分别采用纯水、k30、k90、hpmcp-55或者硬脂酸或者巴西棕榈蜡等一种或者几种作为复合粘合溶液或者单独粘合溶液进行不同次数的制粒,其所用溶媒包括纯水、30-90%不同浓度的乙醇等。本发明第四个目的,提供一种制备氮磺胺吡啶肠溶片的制备方法,在普通片制备方法后包括步骤4),压片后对片剂进行包衣。
进一步的,具体包衣程序:①配制包衣液,将肠溶性成膜剂分散于溶剂中,至溶液澄清;再将增塑剂加至溶液中,搅拌备用。
②片剂包衣,包衣参数设置为:进风温度:60℃,控制排风温度在35~40℃。
有益效果:
经研究发现最终颗粒粒径配比对片剂的可压性和溶出曲线起着重要作用,本发明中普通片、肠溶片控制制粒过程中最终颗粒30-40目、40-50目、50目以下颗粒比例为0.2:1:(2.0~1.5)之间,使得柳氮磺胺吡啶片剂在ph6.0条件下释放50%左右,ph6.8条件下释放90%左右。
在偏碱性的肠道环境中,有效避免柳氮磺胺吡啶给药所呈现血药浓度的峰谷现象,使血药浓度保持在比较平稳持久的有效范围内,提高了药物的安全性。
由于柳氮磺胺砒啶的规格较大,原料药为片剂的主要成分。柳氮磺胺砒啶原料药堆密度较小、静电较大、可压性较差,片剂制备过程中容易出现裂片,生产过程中不合格产品概率将会提升。薄膜包衣对于片剂的硬度也有一定要求,若片剂硬度较低包衣过程中会出现掉粉或者包衣片不平整等问题。本发明通过控制制粒颗粒粒径,能够得到硬度在80~110n片芯,有效避免上述问题。硬度在100n以上的片芯更能保证包衣顺利进行。
另一方面,优选方案中辅料采用聚维酮、预胶化淀粉、淀粉共同作用,生产出的片芯硬度更高,同时崩解和溶出不受影响。
本发明的肠溶片较坚固,不易开裂,对抗外界物理力强。同时含有增塑剂避免了包衣膜的破裂,增加了药物的稳定性。同时该薄膜膜不影响药物的崩解和溶出。因此,从临床角度及病人顺应性考虑,提供了一种服用方便,疗效确切,稳定性高,质量有保证的制剂。
附图说明
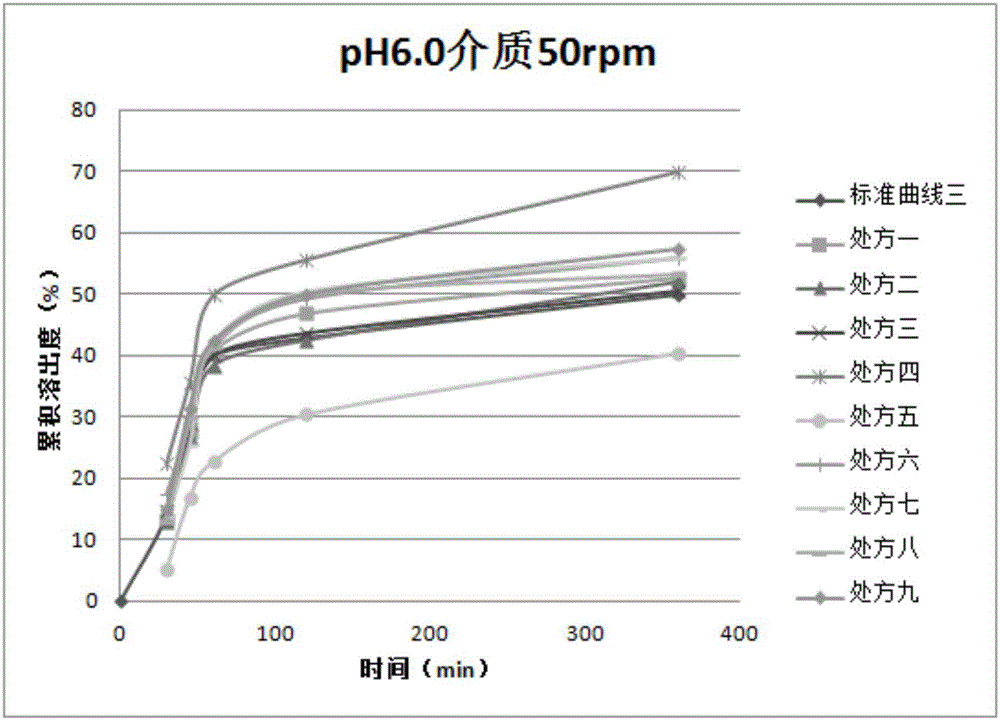
图1为处方1-9样品在介质ph6.0、转速50rpm的溶出曲线图,(试验条件:采用桨法,介质为ph6.0磷酸盐,体积900ml,温度37℃±0.5℃,转速50rpm);图2为处方1-9样品在介质ph6.0、转速100rpm的溶出曲线图,(试验条件:采用桨法,介质为ph6.0磷酸盐,体积900ml,温度37℃±0.5℃,转速100rpm);
图3为处方1-9样品在介质ph6.8、转速50rpm的溶出曲线图,(试验条件:采用桨法,介质为ph6.8磷酸盐,体积900ml,温度37℃±0.5℃,转速50rpm)。
具体实施方式
下面结合具体的实施例,对本发明作详细描述。
实施例1
挤出滚圆法制粒(处方1-5)
处方组成如下:
1、粘合溶液配制:以70%的乙醇为溶媒,配制8%hpmcp-55,作为粘合溶液。
2、预处理:胶态二氧化硅过80目筛;
3、混合:将上述内加辅料和原料药加入湿法制粒机中,搅拌5r/s,剪切15r/s,混合10min。
4、制软材:搅拌8r/s,剪切23r/s,匀速加粘合溶液1-1.5min,中途停机刮料后,继续搅拌1min
5、挤出滚圆:板厚度2mm,孔径1mm,挤出制粒,形成颗粒;颗粒再次挤出制粒。
6、干燥:50℃干燥,控制水分小于2%;
7、整粒:整粒机0.7mm筛网整粒,整粒过后颗粒用30目、40目、50目筛网进行筛分,颗粒根据粒径分成30目以上、30-40目、40-50目、50以下4组粒径。
8、总混:物料称重,计算回收率分,按照30-40目、40-50目、50目以下颗粒如下比例混合,
①0.2:1:2.0、
②0.2:1:1.8、
③0.2:1:1.5、
④0.2:1:2.5、
⑤0.2:1:1.2。
9、外加辅料:折算加入外加量的交联羧甲基纤维素钠、淀粉、预胶化淀粉、胶态二氧化硅、硬脂酸镁。加硬脂酸镁前混合5min,加硬脂酸镁混合15min。
10、压片:采用18*10mm椭圆形冲模(500mg),压片硬度80~110n,理论片重686mg。
11、包衣:包衣增重7.0-8.0%。
称取一定量的95%乙醇或者无水乙醇,将hpmcp-55分散于溶剂中,搅拌至混合均匀(类乳白色);向溶液中加入处方量纯水(最终相当于80%乙醇),边加边搅拌,至溶液完全澄清;再将柠檬酸三乙酯加至溶液中,搅拌60min,备用。
包衣参数:进风温度:60℃,控制排风温度在35~40℃,包衣时,能明显看到片面湿润但不黏连为宜。
制粒颗粒比例不同,制得5批肠溶片,分别记为处方1(颗粒粒径比为0.2:1:2.0);处方2(颗粒粒径比为0.2:1:1.8);处方3:(颗粒粒径比为0.2:1:1.5);处方4:(颗粒粒径比为0.2:1:2.5);处方5:(颗粒粒径比为0.2:1:1.2)。
实施例2:
高剪切制粒法(处方6)
处方组成:
原料药:
柳氮磺胺吡啶500.00g
内加辅料:
外加辅料:
包衣辅料:
柠檬酸三乙酯2.2g
hpmcp-5522.00g
制成1000片
制剂工艺:
1.预处理:胶态二氧化硅过80目筛;
2.将柳氮磺胺吡啶加入湿法制粒机中,雾化加入加1-10%的k90粘合溶液(纯化水为溶剂)15-25ml制粒(雾化加液时间30-40s),不够的以纯水30-40ml作为润湿剂搅拌8r/s,剪切35r/s,制粒3min。
3.30目摇摆制粒机制粒;60℃干燥1小时(水份<1%)。称量加入外加辅料混合3min(5,15r/s)。
4.以10%的k30(纯化水为溶剂)粘合溶液40-46ml制粒(雾化加液时间30-40s),搅拌8r/s,剪切35r/s,制粒2min,不够以纯水6ml作为润湿剂;
5.30目摇摆制粒机制粒;60℃干燥1小时(水份<1%)。
6.以5-18%的hpmcp-55(80%乙醇)40-46ml制粒(雾化加液时间30-40s),搅拌8r/s,剪切35r/s,制粒2min,不够的以纯水6ml作为润湿剂;
7.30目摇摆制粒机制粒;60℃干燥2小时(水份<1%)。
8.1.3m离心整粒机整粒,颗粒根据粒径分成30目以上、30-40目、40-50目、50以下4组粒径。30-40目、40-50目、50目以下颗粒比例为0.2:1:1.6。
9.称量加入处方量的外加辅料,总混后,进行压片,测量得到平均片芯重约620mg。
10.包衣。
包衣液:hpmcp-55:柠檬酸三乙酯=10:1,包衣液中hpmcp-55含量为8%(w/w)。称取一定量的95%乙醇或者无水乙醇,将hpmcp-55分散于溶剂中,搅拌至混合均匀(类乳白色);向溶液中加入一定量纯水(相当于80%乙醇),边颊边搅拌,至溶液完全澄清;将柠檬酸三乙酯加至溶液中,搅拌60min,备用。
包衣参数:进风温度:60℃,控制排风温度在35~40℃,包衣时,能明显看到片面湿润但不黏连为宜。
实施例3
槽式混合机+研磨机配合制粒(处方7)
处方组成如下:
原料药:
柳氮磺胺吡啶500.00g
内加辅料:
外加辅料:
包衣辅料:
柠檬酸三乙酯2.2g
hpmcp-5522.00g
制成1000片
制剂工艺:
1.预处理:胶态二氧化硅过80目筛;
2.将柳氮磺胺吡啶加入槽式混合机中,加入加1-10%的k90粘合溶液15-25ml制粒,不够的以纯水30-40ml作为润湿剂搅拌,搅拌频率15-30hz,制粒3min,得到较为湿粘的团块状物料。
3.60℃干燥0.5小时。
3.以行星式研磨机或者螺杆式研磨机低速研磨后(5-50hz),过0.7mm-1.4mm高速离心整粒机整粒。
4.称量加入外加辅料混合3min(5,15r/s)。
5.以1-10%的k30粘合溶液40-46ml制粒,搅拌8r/s,制粒2min,不够的以纯水6ml作为润湿剂;
6.16目摇摆制粒机制粒;60℃干燥1小时(水份<1%)。
7.以5-18%的hpmcp-55(80%乙醇)40-46ml制粒,搅拌8r/s,制粒2min,不够的以纯水6ml作为润湿剂;
8.16目摇摆制粒机制粒;60℃干燥1小时(水份<1%)。
9.1.3m离心整粒机整粒,颗粒根据粒径分成30目以上、30-40目、40-50目、50以下4组粒径。30-40目、40-50目、50目以下颗粒比例为0.2:1:1.5。
10.称量后加入处方量的外加辅料,总混后,进行压片,测量得到平均片芯重约620mg。
11.包衣。
包衣液:hpmcp-55:柠檬酸三乙酯=10:1,包衣液中hpmcp-55含量为8%(w/w)。称取一定量的95%乙醇或者无水乙醇,将hpmcp-55分散于溶剂中,搅拌至混合均匀(类乳白色);向溶液中加入一定量纯水(相当于80%乙醇),边加边搅拌,至溶液完全澄清;将柠檬酸三乙酯加至溶液中,搅拌60min,备用。
包衣参数:进风温度:60℃,控制排风温度在35~40℃,包衣时,能明显看到片面湿润但不黏连为宜。
实施例4
流化床+挤出滚圆法制粒(处方8)。
处方组成如下:
原料药:
柳氮磺胺吡啶500.00g
内加辅料:
外加辅料:
包衣辅料:
柠檬酸三乙酯2.2g
hpmcp-5522.00g
制成1000片
制剂工艺:
1.预处理:胶态二氧化硅过80目筛;
2.将柳氮磺胺吡啶加入流化床制粒机中,雾化加入加1-10%的k90粘合溶液15-25ml制粒,风机频率为1200-2000hz,雾化压力1.0-2.5bar,顶喷制粒,制粒后干燥15-30min干燥1小时(水份<2%)。
3.30目摇摆制粒机整粒;称重。
4.称量折算损耗后按照处方配比后加入内加辅料,在高速湿法制粒机内,混合3min(5,15r/s)。
5.以10%的k30粘合溶液40-46ml制粒(雾化加液时间30-40s),搅拌8r/s,剪切35r/s,制粒2min,不够的以纯水6-10ml作为润湿剂;
6.30目摇摆制粒机制粒;60℃干燥1小时(水份<1%)。
7.以5-18%的hpmcp-55(80%乙醇)40-46ml制粒(雾化加液时间30-40s),搅拌8r/s,剪切35r/s,制粒2min,不够的以纯水6ml作为润湿剂;
8.30目摇摆制粒机制粒;60℃干燥2小时(水份<1%)。
9.1.3m离心整粒机整粒,颗粒根据粒径分成30目以上、30-40目、40-50目、50以下4组粒径。30-40目、40-50目、50目以下颗粒比例为0.2:1:1.7。
10.称量后加入处方量的外加辅料,总混后,进行压片,测量得到平均片芯重约620mg。
11.包衣。
包衣液:hpmcp-55:柠檬酸三乙酯=10:1,包衣液中hpmcp-55含量为8%(w/w)。称取一定量的95%乙醇或者无水乙醇,将hpmcp-55分散于溶剂中,搅拌至混合均匀(类乳白色);向溶液中加入一定量纯水(相当于80%乙醇),边颊边搅拌,至溶液完全澄清;将柠檬酸三乙酯加至溶液中,搅拌60min,备用。
包衣参数:进风温度:60℃,控制排风温度在35~40℃,包衣时,能明显看到片面湿润但不黏连为宜。
实施例5
热熔挤出法(处方9)。
处方组成如下:
原料药:
柳氮磺胺吡啶500.00g
内加辅料:
外加辅料:
包衣辅料:
柠檬酸三乙酯2.2g
hpmcp-5522.00g
制成1000片
制剂工艺
1、粘合剂配制:以70%的乙醇为溶媒,配制8%hpmcp-55,作为粘合溶液。
2、预处理:胶态二氧化硅过80目筛;
3、混合:将上述原料药、k90混合均匀后加入热熔挤出制粒机中,控制温度80-105℃,挤出频率10-20hz。挤出孔径:板厚度2mm,孔径1mm,挤出2-3次.
4、研磨机粉碎后,离心整粒机0.7-1.4mm筛网整粒。
5、干燥:75℃℃干燥,控制水分小于0.5%。
6、称量折算后加入内加处方量的淀粉、预胶化淀粉、胶态二氧化硅,在高速湿法制粒机内,混合3min(5,15r/s)。
7、以10%的k30粘合溶液(纯化水为溶剂)40-46ml制粒(雾化加液时间30-40s),搅拌8r/s,剪切35r/s,制粒2min,不够的以纯水6-10ml作为润湿剂;
8、30目摇摆制粒机制粒;60℃干燥1小时(水份<1%)。
9、以5-18%的hpmcp-55(80%乙醇)40-46ml制粒(雾化加液时间30-40s),搅拌8r/s,剪切35r/s,制粒2min,不够的以纯水6ml作为润湿剂;
10、30目摇摆制粒机制粒;60℃干燥2小时(水份<1%)。
11、1.3m离心整粒机整粒,颗粒根据粒径分成30目以上、30-40目、40-50目、50以下4组粒径。30-40目、40-50目、50目以下颗粒比例为0.2:1:1.9。
12、称量后折算加入处方量的外加辅料,交联羧甲基纤维素钠、淀粉、预胶化淀粉、胶态二氧化硅、硬脂酸镁等。加硬脂酸镁前混合5min,加硬脂酸镁混合15min;
13、压片:采用18*10mm椭圆形冲模(500mg),压片硬度80~110n,理论片重666mg。
14、包衣增重7.0-8.0%。
hpmcp-55:柠檬酸三乙酯=10:1,包衣液中hpmcp-55含量为8%(w/w)。称取一定量的95%乙醇或者无水乙醇,将hpmcp-55分散于溶剂中,搅拌至混合均匀(类乳白色);向溶液中加入处方量纯水(最终相当于80%乙醇),边加边搅拌,至溶液完全澄清;再将柠檬酸三乙酯加至溶液中,搅拌60min,备用。
包衣参数:进风温度:60℃,控制排风温度在35~40℃,包衣时,能明显看到片面湿润但不黏连为宜。
实施例6
试验方案
随机抽取处方1-9批次样品各6片,使用片剂硬度检测仪(天津鑫洲xzhyd-35)检测每片硬度,检测数据记录如下表2。
表2片剂物理形态记录表
试验结论
处方4、5的样品硬度大部分集中于80~90n,基本上符合包衣的要求。处方1-3、6-9的样品硬度大部分超过100n,硬度较高,不易裂片,易于包衣。
实施例7
处方1-9样品溶出曲线测定:
取本发明处方1-9样品,进行溶出曲线试验,采用桨法,介质分别为ph6.0和6.8的磷酸盐,体积900ml,温度37℃±0.5℃,转速50rpm和100rpm,试验结果如图1、图2、图3所示,溶曲的f2值如表3所示。
具体实验条件:
ph6.8溶曲检测:ph6.8磷酸缓冲液(jp),溶出试验第二法(浆法),50rpm,分别于15,30,45,60,120min分别取液10ml以上液体,取完立即等体积补液,滤液0.5μm以下孔径滤膜过滤。弃3ml以上初滤液,精密取续滤液2ml,用溶出介质定容至50ml。uv法,360nm。
ph6.0介质:ph6.0磷酸缓冲液(jp),溶出试验第二法(浆法),50rpm或者100rpm,分别于30,45,60,120,360min取液10ml以上液体,取完立即等体积补液,滤液0.5μm以下孔径滤膜过滤。弃3ml以上初滤液,精密取续滤液2ml,用溶出介质定容至50ml。uv法,360nm。
表3处方1-9样品溶曲f2值
(f2≥50为合格,f2越大代表与标准曲线越相似)。
结论:
处方1、2、3、6、7、8、9的溶出曲线在ph=6.0释放量为50%左右,ph6.8释放量为90%左右,并且随时间推进缓慢释放。与目标标准曲线相比较,f2均大于50,符合标准。大颗粒多的处方4,溶出速率明显偏慢,小颗粒多的处方5,溶出速率明显偏慢,且f2均不合格。
以上仅是本发明的优选实施方式,并不用以限制本发明,对于本领域技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进、润饰、等同替换,均应包含在本发明保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!