一种酶-还原双响应性透明质酸-聚硫化丙烯共聚物纳米胶囊的制备方法与流程
本发明属于药物制备领域,特别涉及一种新型酶-还原双响应性透明质酸-聚硫化丙烯共聚物纳米胶囊的制备方法及其作为化疗药物阿霉素和舒尼替尼靶向载体的应用。
背景技术:
癌症患者死亡的主要原因之一是肿瘤转移,因此,在癌症治疗中,有效抑制癌症转移意义重大。目前,临床上治疗癌症的手段主要有三种:手术切除、放射治疗和化学疗法。癌症在发病早期阶段,可采用手术切除;一旦转移,可采用放疗,但是,有的癌细胞对放疗不敏感,放疗期间也会产生不良作用和并发症。这种情况下,化疗成为治疗癌症的首选方法。
传统抗癌药物选择性低,给药后会通过血液循环系统分布到全身各处,在杀死肿瘤细胞的同时严重损伤了正常细胞,毒副作用巨大,药物利用率降低,为了达到治疗效果,多次给药又易导致癌细胞产生耐药性。因此,开发新型的药物输送系统,使抗癌药物能在血液中稳定运输,靶向性地到达肿瘤部位发挥作用。许多智能药物载体被构建用于抗癌药物的投递,它们对肿瘤组织微环境(ph、酶、氧化还原等)或外界环境(光等)刺激非常敏感,这些刺激能控制被封装药物的释放。
目前,依靠单一方法治疗肿瘤效果不理想,联合治疗是一种有前途的治疗方式,可以提高治疗效率,减小副作用。结合不同治疗方式和不同药物治疗癌症具有许多的优点,如协同效应和抗耐药性。
舒尼替尼是一种新型小分子多靶点酪氨酸激酶抑制剂,能够阻断血管内皮生长因子受体(vegfr-1、vegfr-2和vegfr-3)、血小板衍生生长因子受体(pdgfr-α和pdgfr-β)、干细胞因子受体(c-kitr)、fms样酪氨酸激酶-3(fms-liketyrosinekinase-3,flt-3)、ι型集落刺激因子受体(colony-stimulatingfactor,csf-1r)和神经胶质细胞系衍生的神经营养因子受体等的功能,具有很强的抑制肿瘤细胞
增殖和抗血管生成的双重作用。舒尼替尼分子式为c22h27fn4o2,其结构如下:
盐酸阿霉素(doxorubicinhydrochloride,dox·hcl)是一种蒽环类抗癌抗生素,具有抗肿瘤谱广、抗瘤活性强的特点,临床上广泛应用于治疗多种恶性肿瘤。dox可直接与dna结合,阻碍dna复制,使癌细胞的生长受到抑制;也可通过介导活性氧自由基的生成来损伤dna等生物大分子,从而杀伤癌细胞。也有报道dox可诱导肿瘤细胞发生细胞自噬从而达到抗癌效果。盐酸阿霉素分子式为
c27h29no11·hcl,其结构式如下:
利用具有靶向作用分子的高分子材料作为载体,化学结合或物理包裹抗肿瘤药物,靶向递送抗肿瘤药物直达病灶,并通过药物扩散、药物结合链断裂或聚合物降解,药物以一定速率缓慢释放,因此可以减少给药次数,提高药物的生物利用度,从而降低药物对全身的毒副作用。
技术实现要素:
本发明的目的是建立一种新型酶-还原双响应性透明质酸-聚硫化丙烯共聚物纳米胶囊的制备方法及其作为化疗药物阿霉素和舒尼替尼靶向载体的应用,该方法操作简单,不仅可以实现对阿霉素和舒尼替尼纳米药物胶囊结构和表面的精确控制,还能实现阿霉素和舒尼替尼在体内的高效靶向递送。
为实现上述目的,本发明采用的技术方案为一种新型酶-还原双响应性透明质酸-聚硫化丙烯共聚物纳米胶囊的制备方法,该制备方法包括如下步骤,
s1提供二硫吡啶为封端基的季戊四醇四巯基乙酸乙酯接枝聚硫化丙烯共聚物ptm-g-pps-s-s-pdt和巯基化透明质酸ha-sh;
s2将适量的舒尼替尼、盐酸阿霉素和ptm-g-pps-s-s-pdt在室温下溶解于二甲基亚砜dmso中,配制得到的药物溶液中舒尼替尼的浓度为1mg/ml,盐酸阿霉素的浓度为5mg/ml和ptm-g-pps-s-s-pdt的浓度为40mg/ml,药物溶液中再加入适量三乙胺tea去除盐酸;
s3将适量的ha-sh在室温下溶解于含有5mmedta的pbs中,浓度为4mg/ml,将其作为反溶剂,pbs中的ph=8.0;
s4按照药物溶液与反溶剂体积比1/10的比例,将s2中的药物溶液加入到s3中的反溶剂中充分混合搅拌反应,ptm-g-pps-s-s-pdt和ha-sh在溶液体系中通过巯基与二硫键的置换反应,形成的靶向聚合物载体ptm-g-pps-s-s-ha会包载在舒尼替尼和阿霉素药物上,在舒尼替尼和阿霉素药物周围形成一层聚合物壳层,从而得到舒尼替尼和阿霉素药物纳米胶囊悬浮液;
s5收集s4中制得的舒尼替尼和阿霉素药物纳米胶囊悬浮液,经过透析、冷冻干燥得到舒尼替尼和阿霉素药物纳米胶囊。
磷酸缓冲盐溶液pbs为150mm,ph8.0。
由于舒尼替尼不具有荧光特性和阿霉素荧光与动物体自体荧光的波长类似,难以通过小动物活体光学成像系统(ivis)观察与检测药物纳米胶囊在动物体内分布,所以本发明使用吲哚菁绿代替舒尼替尼和阿霉素制备药物纳米胶囊用于检测药物纳米胶囊在动物体内分布,制备步骤与s1-s5步骤相同。
ptm-g-pps-s-s-pdt的分子结构如下:
二硫吡啶为封端基的季戊四醇四巯基乙酸乙酯接枝聚硫化丙烯共聚物(ptm-g-pps-s-s-pdt)是通过如下步骤合成的:
s1.1将一定量的季戊四醇四巯基乙酸乙酯ptm放入100ml的三口圆底烧瓶中并抽真空后干燥30min,然后加入80ml的四氢呋喃thf溶解ptm,用电磁搅拌器搅拌;
s1.2向三口圆底烧瓶中通入氩气排出氧气,在氩气氛围保护下加入一定质量的催化剂二氮杂二环dbu到圆底烧瓶中,在室温25℃下搅拌反应聚合30min,再用注射器加入一定量的硫化丙烯ps,室温25℃下反应12h;然后再称取一定量的封端剂二硫二吡啶(pdt),用2mlthf溶解后,通过注射器加入反应系统,在室温25℃下搅拌反应30min;
s1.3收集s1.2中的产物,用400ml的甲醇沉降、离心(5000rpm,5min),再用5ml的thf重新溶解,用200ml的甲醇沉降、离心(8000rpm,5min),冷冻干燥即可得产品ptm-g-pps-s-s-pdt。
ha-sh的分子结构如下:
巯基化透明质酸ha-sh是通过如下步骤合成的:
s2.1准确称量一定量的透明质酸(ha,60000da),完全溶解于400ml水中,按照一定比例加入己二酸二酰肼(adh),溶解完全,使用hcl调节ph值为4.75,加入一定量的催化剂1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc),保持ph值为4.75直到稳定。室温反应12h,使用去离子水连续透析5天(mw=8000da),然后冷冻干燥获的ha-adh。
s2.2准确称量一定量的ha-adh,溶解于5ml含有5mmedta的pbs(ph=8.0)中,然后按照一定比例称取2-亚氨基硫杂环戊烷盐酸盐(traut试剂),溶解于1ml含有5mmedta的pbs(ph=8.0)中,以每次200μl的量滴加入ha-adh溶液中,反应8h后,用超纯水透析(mw=8000da)四次,冷冻干燥得到ha-sh。
由该制备方法制得的同时包载舒尼替尼和阿霉素的药物纳米胶囊,舒尼替尼和阿霉素形成的药物核心(1)的表面有一层由共聚物ptm-g-pps-s-s-ha形成的聚合物壳层(2);纳米药物胶囊的平均粒径在100nm~200nm,分散性好;溶出速率和溶出度大。
与现有技术相比,本发明具有如下有益效果。
采用本发明的方法,可通过改变共聚物ptm-g-pps-s-s-ha的用量,能够得到平均粒径较小、分散均匀、溶出速率较快和溶出度较大等性能更优的纳米药物胶囊。
该药物胶囊的结构为舒尼替尼和阿霉素药物的表面有一层靶向聚合物载体ptm-g-pps-s-s-ha,在聚合物链段上含有二硫键和ha的结构,它们可以被生物体内的谷胱甘肽还原和被hanase酶分解,链段上的ha结构同时可以对细胞表面的cd44有靶向作用;同时包载舒尼替尼和阿霉素纳米药物胶囊的平均粒径在100nm~200nm,分散性较好,溶出速率和溶出度大。
附图说明
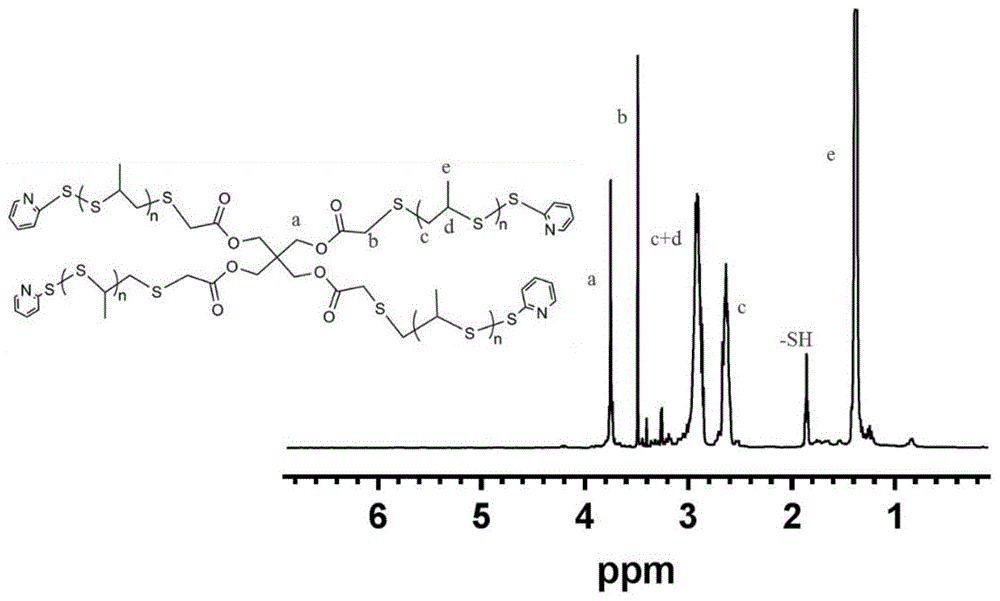
图1是实施例1中制得的ptm-g-pps-s-s-pdt的核磁氢谱图。
图2是实施例1中制得的ptm-g-pps-s-s-pdt的凝胶渗透色谱分子量积分分布图。
图3是实施例3中制得的同时包载舒尼替尼和阿霉素纳米药物胶囊的(a)透射电镜照片和(b)dls粒径图。
图4是实施例3中制得的同时包载舒尼替尼和阿霉素纳米药物胶囊在不同条件下释放(a)dox和(b)sunitinib的曲线图。
图5是实施例3中制得的同时包载舒尼替尼和阿霉素纳米药物胶囊,利用激光共聚焦扫描显微镜和流式细胞术进行观察与检测人乳腺癌mda-mb-231细胞对纳米药物胶囊摄取实验图,(a)激光共聚焦扫描显微镜结果图,(b)和(c)流式细胞术结果图。
图6是实施例3中制得的同时包载舒尼替尼和阿霉素纳米药物胶囊对人乳腺癌mda-mb-231细胞体外毒性实验图。
图7是实施例3中制得的同时包载舒尼替尼和阿霉素纳米药物胶囊,利用激光共聚焦扫描显微镜进行观察与检测纳米药物胶囊对人乳腺癌mda-mb-231细胞体外毒性实验图。
图8是实施例3中制得的同时包载舒尼替尼和阿霉素纳米药物胶囊,利用流式细胞术进行观察与检测纳米药物胶囊对人乳腺癌mda-mb-231细胞体外毒性实验图。
图9是实施例3中制得的同时包载舒尼替尼和阿霉素纳米药物胶囊对人乳腺癌mda-mb-231细胞的体外抑制细胞迁移实验图,(a)划痕实验结果图,(b)transwell小室迁移实验图。
图10是实施例4中制得的包载icg纳米药物胶囊,利用小动物活体光学成像系统(ivis)观察与检测纳米药物胶囊在荷载人乳腺癌mda-mb-231细胞肿瘤balb/c小鼠体内的分布图,(a)ivis检测小鼠体内纳米药物胶囊荧光分布照片,(b)量化小鼠肿瘤部位荧光强度随时间变化曲线图,(c)ivis检测小鼠主要器官纳米药物胶囊荧光分布照片,(d)量化小鼠主要器官24h的荧光强度图。
图11是实施例3中制得的同时包载舒尼替尼和阿霉素纳米药物胶囊抑制荷载人乳腺癌mda-mb-231细胞肿瘤balb/c小鼠的肿瘤生长实验图,(a)14天治疗后,各组小鼠肿瘤组织照片,(b)14天治疗期间各组小鼠肿瘤生长体积曲线图,(c)14天治疗后,各组小鼠抑瘤率,(d)14天治疗期间各组小鼠体重变化曲线图。
图12是实施例3中制得的同时包载舒尼替尼和阿霉素纳米药物胶囊抑制荷载人乳腺癌mda-mb-231细胞肿瘤balb/c小鼠的肿瘤生长实验,14天治疗后,各组小鼠肿瘤组织切片的h&e染色,cd31蛋白染色,caspase-3蛋白染色和tunel染色分析照片。
图13是实施例3中制得的同时包载舒尼替尼和阿霉素纳米药物胶囊制荷载人乳腺癌mda-mb-231细胞肿瘤balb/c小鼠的肿瘤生长实验,14天治疗后,各组小鼠的脑,心,肝,脾,肺和肾器官组织切片的h&e染色分析照片。
图14是本制备方法的路程示意图,(a)表示二硫吡啶为封端基的季戊四醇四巯基乙酸乙酯接枝聚硫化丙烯共聚物(ptm-g-pps-s-s-pdt)的化学合成线路,(b)表示巯基化透明质酸(ha-sh)的化学合成线路,(c)是具有酶-还原双响应性透明质酸-聚硫化丙烯共聚物包载化疗药物阿霉素和舒尼替尼的过程示意。图。
具体实施方式
实施例1
将0.278g(0.643mmol)的季戊四醇四巯基乙酸乙酯(ptm)放入100ml的三口圆底烧瓶中并抽真空后干燥30min,然后加入80ml的四氢呋喃(thf)溶解ptm,用电磁搅拌器搅拌;向三口圆底烧瓶中通入氩气排出氧气,在氩气氛围保护下加入0.448ml(3mmol)的催化剂二氮杂二环(dbu)到圆底烧瓶中,在室温25℃下搅拌反应聚合30min,再用注射器加入4ml(51.44mmol)的硫化丙烯(ps),室温25℃下反应12h;然后再称800mg(3mmol)的封端剂二硫二吡啶(pdt),用2mlthf溶解后,通过注射器加入反应系统,在室温25℃下搅拌反应30min;最后收集产物,用400ml的甲醇沉降、离心(5000rpm,5min),再用5ml的thf重新溶解,用200ml的甲醇沉降、离心(8000rpm,5min),冷冻干燥即可得产品ptm-g-pps-s-s-pdt。
如图1所示,该图是ptm-g-pps-s-s-pdt的核磁氢谱图,通过积分计算得到嵌段聚合物的疏水段ps单元的数目范围是8-12。
如图2所示,该图是ptm-g-pps-s-s-pdt的凝胶渗透色谱分子量积分分布图,通过计算得到嵌段聚合物的疏水段ps单元的数目范围是6-10。
实施例2
准确称量2g(含有5.28mmol羧酸)的透明质酸(ha,60000da),完全溶解于400ml水中,再加入25g(143.5mmol)己二酸二酰肼(adh),溶解完全,使用hcl调节ph值为4.75,加入4g(20mmol)的催化剂1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc),保持ph值为4.75直到稳定。室温反应12h,使用去离子水连续透析5天(mw=8000da),然后冷冻干燥获的ha-adh。
准确称量24mg的ha-adh,溶解于5ml含有5mmedta的pbs(ph=8.0)中,然后称取1.4mg的2-亚氨基硫杂环戊烷盐酸盐(traut试剂),溶解于1ml含有5mmedta的pbs(ph=8.0)中,以每次200μl的量滴加入ha-adh溶液中,反应8h后,用超纯水透析(mw=8000da)四次,冷冻干燥得到ha-sh。
实施例3
将0.4mg的舒尼替尼、2mg的盐酸阿霉素和16mg的ptm-g-pps-s-s-pdt在室温下溶解于0.4ml的二甲基亚砜(dmso)中,药物溶液中再加入4.5μl三乙胺(tea)去除盐酸阿霉素分子上的盐酸;将16mg的ha-sh在室温下溶解于4ml的pbs(含有5mmedta,ph=8.0)中,将其作为反溶剂;按照药物溶液与反溶剂体积比1/10的比例,将药物溶液加入到反溶剂中充分混合搅拌反应30min,ptm-g-pps-s-s-pdt和ha-sh在溶液体系中通过巯基进行聚合反应,形成的共聚物ptm-g-pps-s-s-ha会包载在舒尼替尼和阿霉素药物上,在舒尼替尼和阿霉素药物周围形成一层聚合物壳层,从而得到同时包载舒尼替尼和阿霉素药物纳米胶囊悬浮液;收集制得的同时包载舒尼替尼和阿霉素药物纳米胶囊悬浮液,经过超纯水透析(mw=3500)4次、冷冻干燥得到同时包载舒尼替尼和阿霉素药物纳米胶囊。
如图3所示,该图是同时包载舒尼替尼和阿霉素纳米药物胶囊的(a)透射电镜照片和(b)dls粒径图,表明纳米胶囊为圆球形纳米胶囊,平均粒径为190±10nm。
如图4所示,该图是同时包载舒尼替尼和阿霉素纳米药物胶囊在不同条件下释放(a)dox和(b)sunitinib的曲线图,紫外可见分光光度计检测结果表明,药物纳米胶囊的溶出实验中胶囊能够对氧化还原分子谷胱甘肽响应释放dox达92%,释放sunitinib达94%;对hanase酶响应释放dox达97%,释放sunitinib达98%。
如图5所示,该图是同时包载舒尼替尼和阿霉素纳米药物胶囊,利用激光共聚焦扫描显微镜和流式细胞术进行观察与检测人乳腺癌mda-mb-231细胞对纳米药物胶囊摄取实验图,(a)激光共聚焦扫描显微镜结果图,(b)和(c)流式细胞术结果图。加入游离dox后,细胞可以观察到红色荧光信号,但是相较于dsncs组荧光较弱,因为细胞摄取游离dox仅靠被动自由扩散作用,摄取dsncs时既有被动扩散作用,又有主动靶向作用,载体中ha链段可与癌细胞表面cd44蛋白特异性结合,提高纳米胶囊摄取率,更好的发挥作用。预先ha半小时后,阿霉素的荧光强度平均值明显降低为144,而不加ha组平均值为302,结果证明纳米胶囊具有靶向性。
如图6所示,该图是同时包载舒尼替尼和阿霉素纳米药物胶囊对人乳腺癌mda-mb-231细胞体外毒性实验图。采用标准mtt对联合治疗效果进行确认和量化,在加入不同浓度的纳米胶囊孵育12h后,dsncs组对mda-mb-231细胞有明显的细胞毒性和增殖抑制作用。
如图7所示,该图是同时包载舒尼替尼和阿霉素纳米药物胶囊,利用激光共聚焦扫描显微镜进行观察与检测纳米药物胶囊对人乳腺癌mda-mb-231细胞体外毒性实验图。药物纳米胶囊作用4h后,与空白对照相比,dsncs组绿色荧光基本消失,出现大量红色荧光,表明引起了严重细胞死亡。
如图8所示,该图是同时包载舒尼替尼和阿霉素纳米药物胶囊,利用流式细胞术进行观察与检测纳米药物胶囊对人乳腺癌mda-mb-231细胞体外毒性实验图。在流式细胞仪分析前用annexinv-fitc和pi双重标记mda-mb-231细胞,实验结果表明dsncs组总凋亡细胞(晚期凋亡和坏死细胞)比例最高~25.18%,远高于对照组~3.62%。
如图9所示,该图是同时包载舒尼替尼和阿霉素纳米药物胶囊对人乳腺癌mda-mb-231细胞的体外抑制细胞迁移实验图,(a)划痕实验结果图,(b)transwell小室迁移实验图。细胞划痕结果表明空白对照24h后划痕完全愈合,dsncs组抑制细胞迁移最为明显。同样在细胞侵袭实验中,与对照组比较,dsncs组细胞迁移数目最少,表明大大降低了细胞迁移能力。因此纳米胶囊dsncs能够有效抑制三阴性乳腺癌细胞mda-mb-231的迁移。
如图11所示,该图是同时包载舒尼替尼和阿霉素纳米药物胶囊抑制荷载人乳腺癌mda-mb-231细胞肿瘤balb/c小鼠的肿瘤生长实验图,(a)14天治疗后,各组小鼠肿瘤组织照片,(b)14天治疗期间各组小鼠肿瘤生长体积曲线图,(c)14天治疗后,各组小鼠抑瘤率,(d)14天治疗期间各组小鼠体重变化曲线图。各组实验小鼠的原位瘤图片和肿瘤生长曲线结果表明,dsncs组在治疗14天后效果明显。各组动物体重没有明显差异,表明在给药剂量下,药物纳米胶囊的系统毒性低。
如图12所示,该图是同时包载舒尼替尼和阿霉素纳米药物胶囊抑制荷载人乳腺癌mda-mb-231细胞肿瘤balb/c小鼠的肿瘤生长实验,14天治疗后,各组小鼠肿瘤组织切片的h&e染色,cd31蛋白染色,caspase-3蛋白染色和tunel染色分析照片。肿瘤部位的he实验结果表明,dsncs组药效明显抑制肿瘤生长,癌细胞数明显减小。染色肿瘤部位血管蛋白cd31,其为红色,图中可以看出加入免疫药物sunitinib后,红色荧光很弱,证明dsncs与游离sunitinib有同样效果,抑制肿瘤血管细胞生成,有效抑制肿瘤生长。染色肿瘤部位蛋白caspase-3,其为红色,荧光越强证明凋亡细胞越多,相较于其他组,dsncs组有大量凋亡细胞。同样,肿瘤部位的tunel实验结果表明,dsncs组绿色荧光最强,死亡细胞最多。
如图13所示,该图是同时包载舒尼替尼和阿霉素纳米药物胶囊制荷载人乳腺癌mda-mb-231细胞肿瘤balb/c小鼠的肿瘤生长实验,14天治疗后,各组小鼠的脑,心,肝,脾,肺和肾器官组织切片的h&e染色分析照片。病理切片分析结果表明脑、心、肝、脾、肺、肾器官没有受到明显损害,证明在给药剂量下,药物纳米胶囊毒性小。
实施例4
将4mg的吲哚菁绿(icg)和16mg的ptm-g-pps-s-s-pdt在室温下溶解于0.4ml的二甲基亚砜(dmso)中;将16mg的ha-sh在室温下溶解于4ml的pbs(含有5mmedta,ph=8.0)中,将其作为反溶剂;按照药物溶液与反溶剂体积比1/10的比例,将药物溶液加入到反溶剂中充分混合搅拌反应30min,ptm-g-pps-s-s-pdt和ha-sh在溶液体系中通过巯基进行聚合反应,形成的聚合物载体ptm-g-pps-s-s-ha会包载在icg药物上,在icg药物周围形成一层聚合物壳层,从而得到icg药物纳米胶囊悬浮液;收集制得的icg药物纳米胶囊悬浮液,经过超纯水透析(mw=3500)4次、冷冻干燥得到icg药物纳米胶囊。
如图10所示,该图是使用包载icg纳米药物胶囊,利用小动物活体光学成像系统(ivis)观察与检测纳米药物胶囊在荷载人乳腺癌mda-mb-231细胞肿瘤balb/c小鼠体内的分布图,(a)ivis检测小鼠体内纳米药物胶囊荧光分布照片,(b)量化小鼠肿瘤部位荧光强度随时间变化曲线图,(c)ivis检测小鼠主要器官纳米药物胶囊荧光分布照片,(d)量化小鼠主要器官24h的荧光强度图。实验结果表明,预加ha半小时后,小鼠肿瘤部位早期荧光强度较强,但是在实验24h后,肿瘤部位荧光消失,远低于incs组。给药24h后,incs主要分布在肝、脾和肿瘤部位,incs组在肿瘤部位分布远高于对照组。
- 还没有人留言评论。精彩留言会获得点赞!