基于共轭聚合物的热敏型载药纳米粒子及其制备方法与流程
本发明属于药物递送技术领域,具体涉及一类基于共轭聚合物的热敏型载药纳米粒子,以及该纳米粒子的制备方法。
背景技术:
癌症一直是人类生命的主要威胁之一,目前治疗癌症的方法除了手术干预,主要依赖于化疗和放疗,在许多情况下手术并不能完全切除人体中的所有癌细胞,而化学疗法和放射疗法因对癌细胞的特异性有限,在杀死癌细胞的同时会使健康组织和器官遭受严重的毒副作用,极大地影响了治疗效果。因此,迫切的期望开发更为高效的疗法,能够克服生理障碍,区分恶性和良性细胞,选择性地靶向癌变组织,智能响应肿瘤内异质、复杂的微环境,按需释放最佳剂量范围内的治疗药物。
纳米医学,即纳米技术在医学上的应用,有望实现上述目标,经过几十年纳米技术的发展,基于纳米粒子的药物递送体系显示出巨大的潜力。近几年发展起来的纳米药物载体主要有脂质体纳米药物载体(如阿霉素脂质体、柔红霉素脂质体和阿糖胞苷脂质体等)、基于聚合物的纳米载体(如聚合物胶束、聚合物囊泡、聚合物纳米粒子、纳米凝胶、纳米纤维等)、无机纳米粒子药物载体(如介孔硅纳米粒子、碳纳米管、贵金属纳米结构等)。在这些纳米载体中,有部分体系如阿霉素脂质体、白蛋白结合紫杉醇等已经被批准用于临床肿瘤治疗,还有更多的体系正在进行临床试验或临床评估。与传统的化疗相比,纳米药物输送体系有更多吸引人的优点,包括:(1)改进了疏水药物的输送,并且将治疗药物以更高的剂量输送到癌细胞中;(2)更好地保护药物在到达靶点之前免受肿瘤环境的影响,从而延长药物在体循环中的血浆半衰期;(3)以细胞或组织特异性的方式靶向给药,使治疗效果最大化,同时减轻全身副作用;(4)可以通过刺激响应体系实现药物的可控释放或以精确的剂量释放药物;(5)可同时输送多种药物和(或)诊断试剂来进行结合治疗以克服多药耐性并实时显示治疗效果。基于此,人们普遍认为,纳米技术在药物输送中的应用将显著改善肿瘤相关疾病的治疗效果。
技术实现要素:
本发明的目的是提供一种基于共轭聚合物的热敏型载药纳米粒子,以及该纳米粒子的制备方法。
针对上述目的,本发明所采用的基于共轭聚合物的热敏型载药纳米粒子将包覆抗肿瘤药物的共轭聚合物和热敏性聚合物通过疏水作用,形成的以包覆抗肿瘤药物的共轭聚合物为内核、热敏性聚合物为外壳的纳米球。
上述共轭聚合物的结构式如下所示:
其中,a、b各自独立的选自1~20的整数,p的取值为0.1~0.9,r选自-n+(ch3)3cl-、-n+(ch3)3i-、-n+(ch3)3br-、-n+(ch2ch3)3cl-、-n+(ch2ch3)3i-、-n+(ch2ch3)3br-中任意一种,n代表聚合度,该共轭聚合物的数均分子量为8000~50000。
上述共轭聚合物的结构式中,优选a、b各自独立的选自6~10的整数。
上述共轭聚合物的数均分子量优选10000~20000。
上述的热敏性聚合物为结构式如下的p(niaam-co-bma)、pedaam、pnipam中任意一种:
式中y代表聚合度。
上述的抗肿瘤药物为阿霉素、木犀草素、喜树碱、10-羟基喜树碱、紫杉醇等。
本发明基于共轭聚合物的热敏型载药纳米粒子的制备方法由下述步骤组成:
1、在氮气条件下,将式i化合物、式ii化合物、式iii化合物、磷酸三对甲苯基酯、醋酸钯、三乙胺加入n,n-二甲基甲酰胺中,90~110℃反应12~24小时,反应产物经透析得到共轭聚合物。
式ii、式iii中的x代表i或br。
2、将共轭聚合物、热敏性聚合物及抗肿瘤药物溶解于甲醇中,然后在超声和冰浴条件下快速注入超纯水中,超声15~30min后,鼓氮气并加热除去甲醇,得到基于共轭聚合物的热敏型载药纳米粒子。
上述步骤1中,所述式i化合物与式ii化合物、式iii化合物的摩尔比为1:p:(1-p),其中p的取值为0.1~0.9,所述式i化合物与醋酸钯、磷酸三对甲苯基酯的摩尔比为1:0.03~0.1:0.1~0.2,三乙胺用来调节体系ph为8~10。
上述步骤2中,所述共轭聚合物与热敏性聚合物、抗肿瘤药物的质量比为1:0.1~0.8:0.1~1。
本发明的有益效果如下:
本发明的基于共轭聚合物的热敏型载药纳米粒子是以包覆药物的共轭聚合物为内核、热敏性聚合物通过疏水作用在其表面形成外壳,最终得到球形纳米粒子。本发明纳米粒子具有良好的生物相容性、光稳定性以及多重功能。首先,该纳米粒子在热敏性聚合物的低临界相变温度下,通过其侧链由亲水到疏水的转变,能够缩短颗粒间距、加速疏水内壳中药物的运动,从而实现有效可控的药物释放。其次,该纳米粒子在白光的照射下能够产生大量的活性氧,因此在药物释放的同时还可以进行光动力疗法的协同治疗。此外,该纳米粒子由于具有优异的荧光特性也可用于细胞成像和药物释放追踪。
附图说明
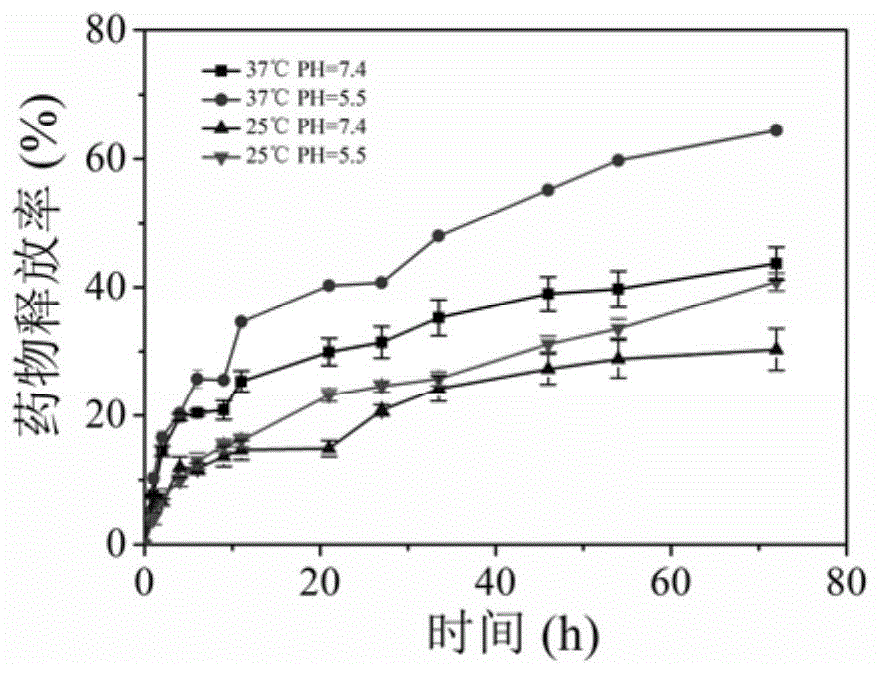
图1是实施例1制备的基于共轭聚合物的热敏型载阿霉素纳米粒子在体外的药物释放图。
图2是实施例1制备的基于共轭聚合物的热敏型载阿霉素纳米粒子对mcf-7(人乳腺癌细胞)的细胞毒性。
图3是实施例1制备的基于共轭聚合物的热敏型载阿霉素纳米粒子对a549(人非小细胞肺癌细胞)的细胞毒性。
图4是实施例1制备的基于共轭聚合物的热敏型载阿霉素纳米粒子在白光照射下的活性氧产率。
图5是实施例1制备的基于共轭聚合物的热敏型载阿霉素纳米粒子对mcf-7细胞的激光共聚焦成像图。
具体实施方式
下面结合附图和实施例对本发明的技术方案进行进一步说明,但是本发明的保护范围不仅限于这些实施例。
实施例1
1、在氮气条件下,向25ml圆底烧瓶中加入66.24mg(0.1mmol)式i-1化合物、18.72mg(0.08mmol)对二碘苯、10.78mg(0.02mmol)式iii-1化合物、1.0ml二甲基甲酰胺、0.5ml三乙胺、1.12mg(0.005mmol)醋酸钯、6.94mg(0.023mmol)磷酸三对甲苯基酯,在90℃下搅拌反应24h后,冷却至室温,经透析、冷冻干燥,得到共轭聚合物1。经凝胶渗透色谱测试,共轭聚合物1的mn=16600,mw=18816,pdi=1.13。
2、将0.1mg共轭聚合物1、0.025mg数均分子量为20000~40000的pnipam、0.05mg阿霉素溶解在5ml甲醇中,在超声和冰浴条件下,将所得溶液快速倒入装有20ml超纯水的烧瓶中,超声20min。超声完成后,恢复至室温,用针头鼓氮气并加热除去混合溶液中的甲醇和部分超纯水,使溶液浓缩至5ml,得到基于共轭聚合物的热敏型载阿霉素纳米粒子。
实施例2
1、按照实施例1步骤1的方法制备共轭聚合物1。
2、将0.1mg共轭聚合物1、0.05mg数均分子量为20000~40000的pnipam、0.05mg阿霉素溶解在5ml甲醇中,在超声和冰浴条件下,将所得溶液快速倒入装有20ml超纯水的烧瓶中,超声20min。超声完成后,恢复至室温,用针头鼓氮气并加热除去混合溶液中的甲醇和部分超纯水,使溶液浓缩至5ml,得到基于共轭聚合物的热敏型载阿霉素纳米粒子。
实施例3
1、按照实施例1步骤1的方法制备共轭聚合物1。
2、将0.1mg共轭聚合物1、0.015mg数均分子量为20000~40000的pnipam、0.05mg阿霉素溶解在5ml甲醇中,在超声和冰浴条件下,将所得溶液快速倒入装有20ml超纯水的烧瓶中,超声20min。超声完成后,恢复至室温,用针头鼓氮气并加热除去混合溶液中的甲醇和部分超纯水,使溶液浓缩至5ml,基于共轭聚合物的热敏型载阿霉素纳米粒子。
实施例4
1、在氮气条件下,向25ml圆底烧瓶中加入77.5mg(0.1mmol)式i-2化合物、11.7mg(0.05mmol)对二溴苯、22.6mg(0.05mmol)式iii-2化合物、1.0ml二甲基甲酰胺、0.5ml三乙胺、1.12mg(0.005mmol)醋酸钯、6.94mg(0.023mmol)磷酸三对甲苯基酯,在90℃下搅拌反应24h后,冷却至室温,经透析、冷冻干燥,得到共轭聚合物2。
2、将0.1mg共轭聚合物2、0.025mg数均分子量为10000~30000的pedaam、0.05mg喜树碱溶解在5ml甲醇中,在超声和冰浴条件下,将所得溶液快速倒入装有20ml超纯水的烧瓶中,超声20min。超声完成后,恢复至室温,用针头鼓氮气并加热除去混合溶液中的甲醇和部分超纯水,使溶液浓缩至5ml,基于共轭聚合物的热敏型载喜树碱纳米粒子。
为了证明本发明的有益效果,发明人对实施例1制备的基于共轭聚合物的热敏型载阿霉素纳米粒子(以下简称载药纳米粒子)进行了各种性能测试,具体试验如下:
1、体外药物释放
用移液枪向活化好的透析袋中加入2.5ml载药纳米粒子,夹紧夹子后将透析袋放入盛有30mlpbs(ph7.4;ph5.5)缓冲溶液的烧杯中,置于恒温磁力搅拌器上并调节好转速及水浴温度(25℃;37℃)。在特定的时间间隔,吸取2ml透析液测量其中阿霉素在560nm处的荧光强度并记录透析液总体积,最后利用阿霉素发射标准曲线计算阿霉素的释放率,释放结果见图1。(注:实验数据均为3次重复试验的平均值。)
由图1可见,首先,37℃时,阿霉素的释放率均高于同ph条件下25℃时的释放率,证明该载药纳米粒子确实具有热响应性。另外,ph5.5时阿霉素的释放率要高于同等温度条件下ph7.4时的释放率,这是由于阿霉素在低ph条件下发生了质子化,由疏水转变为亲水,更有利于药物的释放。综上,该载药纳米粒子在37℃、ph5.5时,药物释放率较高,此条件与肿瘤细胞的微环境一致,因此有望实现在肿瘤细胞中的药物释放。
2、体外抗肿瘤(mtt)
本实验中所用细胞为mcf-7(人乳腺癌细胞)和a549(人非小细胞肺癌细胞),全培养基为含10%胎牛血清(fbs)的高糖培养基(dmem),培养氛围是含5%co2的空气氛围,培养温度为37℃。
收集对数期的细胞,用胰酶消化好后,配成浓度为50个/μl的细胞悬浮液。以每孔5000个细胞的标准将细胞种在96孔板中,板的四周用无菌水水封,设置阴性对照组和空白对照组,种好板的细胞放置于二氧化碳培养箱中37℃贴壁生长24h后,吸出培养基,更换为100μl含有不同浓度载药纳米粒子(0、0.5、1.0、2.0、8.0、10μg/ml)的全培养基。继续在二氧化碳培养箱中培养72h后,取出96孔板,每孔加入10μl事先配制好的5mg/ml的无菌mtt,培养4h将细胞取出,小心的吸去上清液后,每孔加入100μldmso,待所有蓝色结晶溶解后,放入酶标仪中测每孔在570nm处的吸收值。最后根据测得的吸收值计算细胞的存活率。细胞毒性结果见图2(a549细胞)和图3(mcf-7细胞)。
由图2、图3可见,该载药纳米粒子对两种肿瘤细胞的毒性基本一致,细胞毒性随着载药纳米粒子浓度的增加而增大,当载药纳米粒子的浓度达到10μg/ml时,对a549细胞和mcf-7细胞的毒性分别高达70%和80%。结果表明,该载药纳米粒子具有良好的抗肿瘤能力,在药物输送领域具有很好的应用前景。
3、活性氧产率
将10μl载药纳米粒子加入到2.00ml40μm的2',7'-二氯荧光黄(dcfh)储备液中,混合均匀后放置在比色皿中,在5mw/cm2白光照射下,分别测定0、1、2、3、4和5min时溶液在525nm处荧光强度值,激发波长为488nm。实验结果见图4。
由图4可见,该载药纳米粒子在5min内能够产生大量的活性氧,相比于空白组的dcfh,在525nm处荧光强度增强了7.5倍,说明该载药纳米粒子也可以作为一种良好的光动力治疗试剂。
4、细胞成像
收集对数期的mcf-7细胞,用胰酶消化好后,接种在直径为15mm的激光共聚焦培养皿中,在二氧化碳培养箱中贴壁生长24h。吸去上清液后,用全培养基清洗2次,加入事先配制好的含5.0μg/ml载药纳米粒子的全培养基,培养24h。取出培养皿,吸去上清液后,用dmem培养基清洗2次,加入含有细胞核染料hoechst33342和溶酶体染料lysotrackerreddnd99的dmem培养基继续培养30min。取出培养皿,吸去上清液后,再用dmem培养基(无酚红)清洗3次,最后加入1mldmem培养基(无酚红),用激光共聚焦显微镜成像,结果见图5。
分别对图5中细胞核、溶酶体、载药纳米粒子、阿霉素以及叠加场通道进行观察,从明亮的绿色荧光我们可以清晰地看到载药纳米粒子进入到了细胞内,而且与溶酶体很好的重叠在一起;通过阿霉素和叠加通道我们可以发现,阿霉素得到了释放,并且进入了溶酶体和细胞核。这些结果表明该载药纳米粒子能够实现细胞有效着色和光学监测。
- 还没有人留言评论。精彩留言会获得点赞!