胡黄连素二聚体类似物衍生物在制备防治帕金森病的药物或保健品中的应用的制作方法
本发明属于医药
技术领域:
,涉及一种胡黄连素二聚体类似物衍生物在制备防治帕金森病的药物或保健品中的应用,特别涉及一种胡黄连素二聚体类似物衍生物或其药学上可接受的盐在制备防治帕金森病的药物或保健品中的应用。
背景技术:
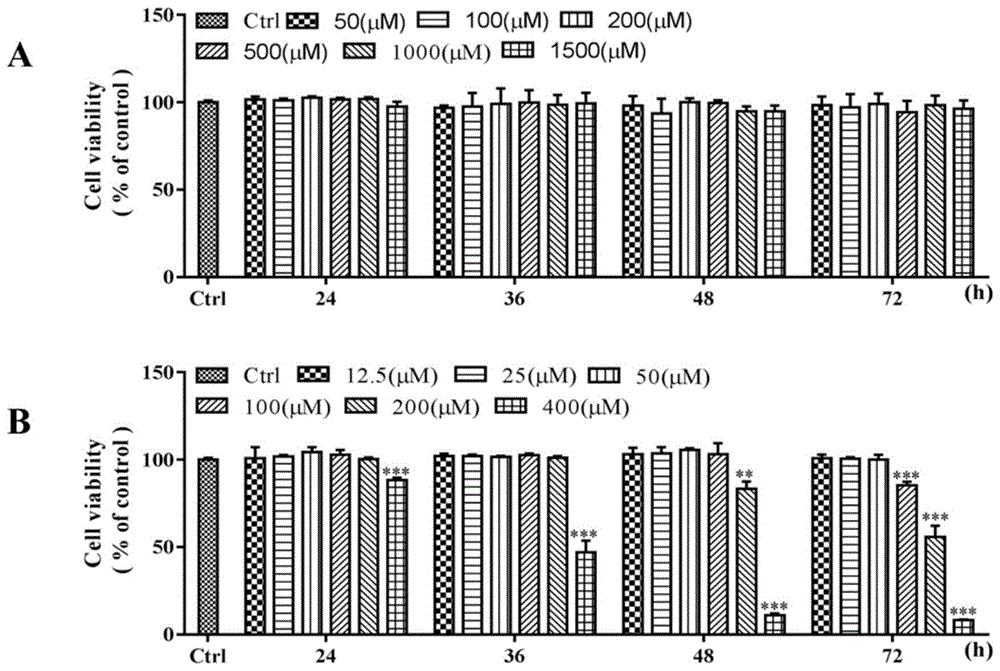
:帕金森病(parkinson’sdisease,pd)又称“震颤麻痹”,是一种常见的神经系统变性疾病,老年人多见,平均发病年龄为60岁左右,40岁以下起病的青年帕金森病较少见,我国65岁以上人群pd的患病率大约是1.7%。帕金森病是临床上难以治愈的疾病,对患者身心健康和社会经济压力都带来很大的影响。帕金森病最主要的病理特征就是中脑黑质的多巴胺(dopamine,da)能神经元的变性死亡,伴随着α-突触核蛋白(α-synuclein)为主要成分的路易小体的形成。中脑黑质致密部多巴胺能神经元的大量丢失,可导致纹状体da水平显著减少而乙酰胆碱水平相对增多,打破两者之间的平衡,从而出现pd的临床症状。至今,pd的发病机制仍不十分明确,氧化应激、炎症反应、遗传因素、年龄老化等都可能涉及到pd的发生发展,其中从氧化应激与炎症反应水平来探究pd的发病机制仍是目前的研究热点。众所周知,线粒体作为细胞的能量生产场所,为机体提供大量的atp。当神经元细胞中的线粒体受到损伤之后,无法为神经元提供足够多的能量而导致神经细胞的变性死亡。同时,线粒体呼吸链功能紊乱也会导致大量的活性氧(reactiveoxygenspecies,ros)产生,爆发氧化应激。细胞内大量的ros会使细胞产生大量的神经毒性物质,比如炎症因子tnf-α、白介素、凋亡蛋白等,这些毒性物质都会促使神经元细胞变性死亡。在pd病人中,多巴胺能神经元内的α-突触核蛋白水平显著增高,α-突触核蛋白是路易小体的重要组成部分。α-突触核蛋白的异常聚集会促进神经元发生炎症和氧化应激,而炎症和氧化应激也会进一步地导致该蛋白的异常聚集,很难被细胞降解,使情况恶化。目前治疗帕金森病最主要的治疗手段是药物治疗,临床用药主要有如下几大类:多巴胺替代治疗、多巴胺受体激动剂、抗胆碱能药物、单胺氧化酶b抑制剂、儿茶酚-氧位-甲基转移酶抑制剂等。多巴胺替代药物,补充脑内多巴胺的不足,其代表药物有左旋多巴。多巴胺受体激动剂,刺激突触后膜的多巴胺受体发挥效用,其代表药物有溴隐亭。单胺氧化酶b(mao-b)抑制剂,抑制黑质纹状体中的mao-b,阻止多巴胺的降解,增加脑内多巴胺的浓度,其代表药物有司来吉兰。儿茶酚-氧位-甲基转移酶抑制剂(comti),抑制左旋多巴在外周的代谢,增加脑内多巴胺的含量,其代表药物有恩他卡朋。抗胆碱能药物,维持患者脑内多巴胺与乙酰胆碱的平衡,其代表药物有苯海索。这些药物主要通过改变脑内多巴胺、乙酰胆碱的水平来实现对帕金森病症状的改善,不直接针对脑内氧化应激与炎症反应的状况,难以治愈疾病,同时长期服用还会出现副作用。因此,研制治疗帕金森病的特效药一直是国内、国际大型制药企业和科研机构关注的热点。胡黄连素(apocynin,化学名为3-甲氧基-4-羟基-苯乙酮,分子式为c9h10o3)是从中药胡黄连的根部分离得到的一个活性成分,也广泛存在于多种植物中。胡黄连素能选择性抑制人中性粒细胞ros的释放,多年来一直用于抗炎、抗氧化药物的研究中,但其活性不太理想。由于目前多种严重威胁人类健康的疾病,如糖尿病、哮喘、急性肺损伤、关节炎、缺血损伤、肿瘤、帕金森病、老年痴呆症等均发现与氧化应激、炎症相关,而nadph氧化酶激活是人体内产生ros的主要途径之一,因此nadph氧化酶抑制作为药物研究靶点颇受重视。胡黄连素,一种经典的nadph氧化酶抑制剂,虽活性不够理想,但一直作为抗炎、抗氧化药物在这些病症治疗研究中备受关注。目前对胡黄连素进行结构改造以提高其活性的研究并不多。本领域研究人员前期针对胡黄连素的结构修饰公开了专利“胡黄连素的衍生物及其制备方法和应用(zl200610037302.1)”和“胡黄连素衍生物及其制备与应用(zl201010185981.3)”。这两个专利主要公开了胡黄连素单体衍生物以及这些化合物在制备防治免疫系统疾病、nadph氧化酶相关疾病、以及抗氧化与抗炎的药物及保健品方面的用途。本领域研究人员还公开了“胡黄连素硝酮在制备防治哮喘药物中的用途”(专利申请号:201510955782.9)。胡黄连素被用在许多涉及氧化应激损伤和炎症反应的疾病的治疗研究中,如帕金森病、老年痴呆症、急性肺损伤、缺血性脑中风等。胡黄连素可通过抑制nadph氧化酶诱导的ros产生、炎症反应和凋亡,对神经元细胞产生一定的保护作用((1)sharman,kapoorm,nehrub.apocynin,nadphoxidaseinhibitorpreventslipopolysaccharideinduced-synucleinaggregationandamelioratesmotorfunctiondeficitsinrats:possibleroleofbiochemicalandinflammatoryalterations[j].behavbrainres.2016,296:177-190.(2)stefanskaj,pawliczakr.apocynin:molecularaptitudes[j].mediatorsinflamm.2008,2008:106507.doi:10.1155/2008/106507.)。胡黄连素可以通过阻断nadph氧化酶的亚基,下调nadph氧化酶的p47-phox与gp91-phox亚基的表达,进而特异性抑制nadph氧化酶活性,从而起到清除氧自由基的作用(kanegaemp,condino-netoa,pedrozala,etal.diapocyninversusapocyninaspretranscriptionalinhibitorsofnadphoxidaseandcytokineproductionbyperipheralbloodmononuclearcells[j].biochembiophysrescommun.2010,393(3):551-554.)。ros在正常的生理状态之下,具有传导细胞信号以及杀死外部侵入细菌的作用。在病理状态时,过量的ros超过了细胞的应对能力,引起细胞内炎症反应的发生,导致线粒体受损,激活凋亡途径,产生caspase与bax系列凋亡蛋白,最后导致神经元细胞的凋亡(ramalingamm,kimsj.reactiveoxygen/nitrogenspeciesandtheirfunctionalcorrelationsinneurodegenerativediseases[j].jneuraltransm(vienna).2012,119(8):891-910.)。研究发现,胡黄连素发挥药理活性的关键是在体内转化成二聚体,本领域研究人员设计合成了胡黄连素二聚体类似物jja-d0,胡黄连素(apocynin)、胡黄连素二聚体(apocynindimer)以及胡黄连素二聚体类似物jja-d0的结构如下。技术实现要素:本发明的目的在于克服现有技术的缺点与不足,提供一种胡黄连素二聚体类似物衍生物或其药学上可接受的盐在制备治疗帕金森病的药物或保健品中的应用。本发明公开了这些衍生物在帕金森病细胞模型上的抗氧化、抗炎、抗凋亡活性及相关作用机制,公开了胡黄连素二聚体类似物对帕金森病模型小鼠的治疗作用,证明胡黄连素二聚体类似物jja-d0及其衍生物具有显著的防治帕金森病的作用,主要是通过抗氧化、抗炎与抗凋亡作用,达到对神经细胞的保护,可增加多巴胺能神经元数量与多巴胺水平,并改善帕金森病模型小鼠的行为学。本发明的目的通过下述技术方案实现:一种胡黄连素二聚体类似物衍生物或其药学上可接受的盐在制备防治帕金森病的药物或保健品中的应用,其中,所述的胡黄连素二聚体类似物衍生物的结构式如式i所示:其中,r1、r2、r3相同或不相同,分别选自:氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-8,更优选为1-4),取代或未取代的单环芳基、杂芳基,烷氧羰酰烷基,硫辛酸基,取代或未取代的半胱氨酰基、硝酸酯基、酰基、磺酸酯基。所述的胡黄连素二聚体类似物衍生物优选为jja-d0和jja-d1~jja-d40中的至少一种;其中,jja-d0和jja-d1~jja-d40的结构式如下所示:所述的胡黄连素二聚体类似物衍生物或其药学上可接受的盐在制备防治帕金森病的药物或保健品中的应用,所述的药物或保健品为激活神经元细胞中pi3k/akt与nrf2/ho-1信号通路,抑制神经元细胞中mapks与nf-κb信号通路,抑制神经元细胞中nadph氧化酶的激活,和/或抑制神经元细胞的凋亡的药物或保健品。所述的抑制神经元细胞中nadph氧化酶的激活可以通过下调nadph氧化酶gp91-phox与p47-phox亚基的蛋白表达来抑制神经元细胞中nadph氧化酶的激活。所述的抑制神经元细胞的凋亡可以通过下调凋亡蛋白cleavedcaspase-3的表达以及提高bcl-2/bax的比例来抑制细胞的凋亡。所述的胡黄连素二聚体类似物衍生物或其药学上可接受的盐在制备防治帕金森病的药物或保健品中的应用,所述的药物或保健品为降低神经元细胞内ros水平,降低神经元细胞内脂质过氧化产物丙二醛(mda)的水平,提高神经元细胞内超氧化物歧化酶sod的相对活力,逆转神经元细胞内线粒体膜电位的降低,减少神经元细胞内炎性因子tnf-α的表达,降低神经元细胞中α-synuclein蛋白的表达,增加黑质多巴胺能神经元数量,提高纹状体内多巴胺水平,和/或提高纹状体内3,4-二羟基苯乙酸(dopac)水平,改善帕金森病行为学的药物或保健品。所述的药物或保健品还可以含有一种或者是至少两种药学上可以接受的载体;以上述胡黄连素二聚体类似物衍生物或其药学上可接受的盐为活性成份,加上药学上可接受的载体制成药物或保健品。所述的载体优选为缓释剂、赋形剂、填充剂、粘合剂、润湿剂、崩解剂、吸收促进剂、吸附载体、吸收剂、表面活性剂或润滑剂等。所述的药物或保健品可以进一步制成注射剂、片剂、丸剂、颗粒剂或胶囊等多种形式,各种剂型的药物或保健品可以按照药学领域的常规方法制备。本发明的技术方案如下:1、采用1-甲基-4-苯基-吡啶离子(mpp+)诱导人神经母细胞瘤细胞株sh-sy5y细胞,建立体外帕金森病细胞模型;采用1-甲基-4-苯基-1,2,3,6-四氢吡啶(mptp)诱导雄性c57bl/6小鼠建立体内帕金森病模型。2、考察胡黄连素二聚体类似物jja-d0及其衍生物对mpp+处理的sh-sy5y细胞的存活率、细胞内ros水平和线粒体膜电位的影响,初步评价上述化合物对体外帕金森病细胞模型的药效学活性。活性筛选结果显示,相对于模型组,胡黄连素二聚体类似物jja-d0及其衍生物均能够提高给药组细胞的存活率,降低细胞内ros水平,逆转细胞内线粒体膜电位的降低,大多数衍生物的活性优于母体化合物胡黄连素。3、以化合物jja-d10为分子探针,从机制、靶点和信号通路等方面对这类胡黄连素二聚体类似物衍生物防治帕金森病的药理作用机理进行探讨,具体考察的指标与信号通路有:细胞内脂质过氧化物丙二醛mda、超氧化物歧化酶sod活性、炎性因子tnf-α、凋亡蛋白caspase-3以及bcl-2/bax水平;细胞内nadph氧化酶亚基gp91-phox与p47-phox蛋白水平;pi3k/akt信号通路、nrf2/ho-1信号通路、mapks信号通路及nf-κb信号通路。研究结果表明,jja-d10能降低细胞内脂质过氧化物mda的水平,提高细胞内超氧化物歧化酶sod的相对活力,下调nadph氧化酶gp91-phox与p47-phox亚基的蛋白表达,从而降低细胞内氧化应激水平;可下调凋亡蛋白cleavedcaspase-3的表达以及提高bcl-2/bax的比例来抑制细胞凋亡;还能减少炎性因子tnf-α的表达。jja-d10通过激活pi3k/akt与nrf2/ho-1信号通路,抑制mapks与nf-κb信号通路,以及抑制nadph氧化酶的激活来达到抗氧化、抗炎与抗凋亡的作用,从而保护神经元细胞,实现对帕金森病的防治。4、考察胡黄连素二聚体类似物jja-d0对帕金森病模型小鼠的治疗作用。结果显示,jja-d0可明显改善模型小鼠行为学,增加黑质致密部多巴胺能神经元数量,提高纹状体内多巴胺和3,4-二羟基苯乙酸(dopac)水平。本发明相对于现有技术具有如下的优点及效果:1、基于目前临床应用的帕金森病治疗药物主要通过调节多巴胺与乙酰胆碱的水平来实现对症状的缓解,无法针对病因治愈疾病的情况,本发明利用胡黄连素二聚体类似物衍生物在帕金森病细胞模型(采用mpp+处理sh-sy5y细胞造成体外帕金森病细胞模型)上的活性进行筛选,针对氧化应激与炎症产生的发病机制,从抗氧化、抗炎、抗凋亡角度筛选获得防治帕金森病更好的化合物。该胡黄连素二聚体类似物衍生物或其药学上可接受的盐能针对帕金森病高氧化应激水平与炎症反应的发病机制,通过其抗氧化、抗炎以及抗凋亡作用,保护多巴胺能神经元细胞免受氧化、炎症损伤,减少凋亡,从而实现对疾病的有效防治。2、本发明中胡黄连素二聚体类似物衍生物或其药学上可接受的盐在帕金森病体外细胞模型上,显示出比母体化合物胡黄连素更优的药效活性。其抗氧化与抗炎双重作用明显优于胡黄连素,且具有抗凋亡作用。3、本发明以胡黄连素二聚体类似物衍生物jja-d10为分子探针,发现这类化合物主要通过激活pi3k/akt与nrf2/ho-1信号通路、抑制mapks与nf-κb信号通路以及抑制nadph氧化酶的激活,以抗氧化和抗炎的双重作用机制保护神经元细胞,防治帕金森病。4、本发明采用mptp诱导c57bl/6小鼠建立体内帕金森病动物模型,并考察胡黄连素二聚体类似物对帕金森病模型小鼠的治疗作用。结果显示,胡黄连素二聚体类似物jja-d0在帕金森病模型小鼠上显示出明显的帕金森病治疗作用,可明显改善模型小鼠行为学,增加黑质致密部多巴胺能神经元数量,提高纹状体内多巴胺和3,4-二羟基苯乙酸(dopac)水平。附图说明图1是胡黄连素与jja-d0对sh-sy5y细胞的毒性作用结果图(n=3;**p<0.01,***p<0.001,加药组与空白对照组相比);其中,图a为胡黄连素对sh-sy5y细胞的毒性作用;图b为jja-d0对sh-sy5y细胞的毒性作用。图2是mpp+诱导sh-sy5y细胞建立pd模型时不同浓度的mpp+对sh-sy5y细胞的影响图(n=3;***p<0.001,加药组与空白对照组相比)。图3是不同浓度的胡黄连素对mpp+诱导的pd模型细胞的影响图(n=3;###p<0.001模型组与空白对照组相比;**p<0.01,加药组与模型组相比)。图4是胡黄连素及胡黄连素二聚体类似物衍生物对mpp+诱导的pd模型细胞的影响图(n=3;###p<0.001,模型组与空白对照组相比;*p<0.05,**p<0.01,***p<0.001,加药组与模型组相比);其中,图a为apocynin、jja-d0~jja-d10对mpp+诱导的pd模型细胞的保护作用;图b为jja-d11~jja-d22对mpp+诱导的pd模型细胞的保护作用;图c为jja-d23~jja-d34对mpp+诱导的pd模型细胞的保护作用。图5是胡黄连素及胡黄连素二聚体类似物衍生物对mpp+诱导的sh-sy5y细胞内ros的清除能力影响图(n=3;###p<0.001,模型组与空白对照组相比;*p<0.05,**p<0.01,***p<0.001,加药组与模型组相比);其中,图a为apocynin、jja-d0~jja-d10对mpp+诱导的sh-sy5y细胞内ros的清除作用;图b为jja-d11~jja-d22对mpp+诱导的sh-sy5y细胞内ros的清除作用;图c为jja-d23~jja-d34对mpp+诱导的sh-sy5y细胞内ros的清除作用。图6是胡黄连素及胡黄连素二聚体类似物衍生物对mpp+诱导的sh-sy5y细胞内线粒体膜电位的影响图(n=3;###p<0.001,模型组与空白对照组相比;*p<0.05,**p<0.01,***p<0.001,加药组与模型组相比);其中,图a为apocynin、jja-d0~jja-d10对mpp+诱导的sh-sy5y细胞内线粒体膜电位下降的逆转作用;图b为jja-d11~jja-d22对mpp+诱导的sh-sy5y细胞内线粒体膜电位下降的逆转作用;图c为jja-d23~jja-d34对mpp+诱导的sh-sy5y细胞内线粒体膜电位下降的逆转作用。图7是jja-d10对mpp+诱导的sh-sy5y细胞内的总sod活性以及mda水平的影响图(n=3;###p<0.001,模型组与空白对照组相比;*p<0.05,**p<0.01,***p<0.001,加药组与模型组相比);其中,图a为jja-d10对mpp+诱导的sh-sy5y细胞内的总sod活性的影响;图b为jja-d10对mpp+诱导的sh-sy5y细胞内的mda水平的影响。图8是jja-d10对mpp+诱导的sh-sy5y细胞内tnf-α,cleavedcaspase-3和bax、bcl-2蛋白表达水平的影响图(n=3;###p<0.001,模型组与空白对照组相比;*p<0.05,**p<0.01,***p<0.001,加药组与模型组相比);其中,图a和b为jja-d10对mpp+诱导的sh-sy5y细胞内tnf-α表达水平的影响;图c和d为jja-d10对mpp+诱导的sh-sy5y细胞内cleavedcaspase-3表达水平的影响;图e和f为jja-d10对mpp+诱导的sh-sy5y细胞内bax、bcl-2蛋白表达水平的影响。图9是jja-d10对mpp+诱导的sh-sy5y细胞内gp91-phox与p47-phox蛋白表达水平的影响图(n≥3;###p<0.001,模型组与空白对照组相比;*p<0.05,**p<0.01,***p<0.001,加药组与模型组相比);其中,图a和b为jja-d10对mpp+诱导的sh-sy5y细胞内gp91-phox蛋白表达水平的影响;图c和d为jja-d10对mpp+诱导的sh-sy5y细胞内p47-phox蛋白表达水平的影响。图10是jja-d10对mpp+诱导的sh-sy5y细胞内pi3k-akt信号通路p-pi3k和p-akt蛋白表达水平的影响图(n≥3;###p<0.001,模型组与空白对照组相比;***p<0.001,加药组与模型组相比);其中,图a和b为jja-d10对mpp+诱导的sh-sy5y细胞内pi3k-akt信号通路p-pi3k蛋白表达水平的影响;图c和d为jja-d10对mpp+诱导的sh-sy5y细胞内pi3k-akt信号通路p-akt蛋白表达水平的影响。图11是jja-d10对mpp+诱导的sh-sy5y细胞内nrf2/ho-1信号通路nrf2和ho-1蛋白表达水平的影响图(n≥3;##p<0.01,模型组与空白对照组相比;*p<0.05,***p<0.001,加药组与模型组相比);其中,图a和b为jja-d10对mpp+诱导的sh-sy5y细胞内nrf2/ho-1信号通路nrf2蛋白表达水平的影响;图c和d为jja-d10对mpp+诱导的sh-sy5y细胞内nrf2/ho-1信号通路ho-1蛋白表达水平的影响。图12是jja-d10对mpp+诱导的sh-sy5y细胞内mapks信号通路p-erk1/2、p-jnk和p-p38蛋白表达水平的影响图(n≥3;###p<0.001,模型组与空白对照组相比;*p<0.05,**p<0.01,加药组与模型组相比);其中,图a和b为jja-d10对mpp+诱导的sh-sy5y细胞内mapks信号通路p-erk1/2蛋白表达水平的影响;图c和d为jja-d10对mpp+诱导的sh-sy5y细胞内mapks信号通路p-jnk蛋白表达水平的影响;图e和f为jja-d10对mpp+诱导的sh-sy5y细胞内mapks信号通路和p-p38蛋白表达水平的影响。图13是jja-d10对mpp+诱导的sh-sy5y细胞内nf-κb信号通路p-ikk、p-iκb和p-p65蛋白表达水平的影响图(n=3;###p<0.001,模型组与空白对照组相比;*p<0.05,**p<0.01,***p<0.001,加药组与模型组相比);其中,图a和b为jja-d10对mpp+诱导的sh-sy5y细胞内nf-κb信号通路p-ikk蛋白表达水平的影响;图c和d为jja-d10对mpp+诱导的sh-sy5y细胞内nf-κb信号通路p-iκb蛋白表达水平的影响;图e和f为jja-d10对mpp+诱导的sh-sy5y细胞内nf-κb信号通路p-p65蛋白表达水平的影响。图14是jja-d10对转染野生型α-synuclein的sh-sy5y细胞(sh-sy5y(wtα-syn))中α-synuclein表达水平的影响图;其中,图a为荧光显微镜下观察到的高表达α-synuclein的sh-sy5y(wtα-syn)细胞(图i:10×;图ii:20×);图b和c为α-synuclein的相对表达量(n=3;###p<0.001,sh-sy5y(wtα-syn)细胞模型组与普通sh-sy5y细胞对照组相比;*p<0.05,**p<0.01,加药组与模型组相比)。图15是catwalk自动步态分析仪检测jja-d0对mptp诱导的帕金森病模型小鼠行为学的影响图(mean±sd,n=18;#p<0.05,##p<0.01,###p<0.001,与正常对照组相比;*p<0.05,**p<0.01,与模型组相比);其中,图a为jja-d0对mptp诱导的帕金森病模型小鼠前肢与后肢脚间距离的影响作用;图b为jja-d0对mptp诱导的帕金森病模型小鼠前肢与后肢步周长的影响作用;图c为jja-d0对mptp诱导的帕金森病模型小鼠前肢与后肢支撑时相的影响作用;图d为jja-d0对mptp诱导的帕金森病模型小鼠前肢与后肢摆动速度的影响作用;图e为jja-d0对mptp诱导的帕金森病模型小鼠前肢与后肢行走周期的影响作用。图16是openfield试验检测jja-d0对mptp诱导的帕金森病模型小鼠行为学的影响图(mean±sd,n=18;#p<0.05,##p<0.01,与正常对照组相比;*p<0.05,**p<0.01,与模型组相比);其中,图a为jja-d0对mptp诱导的帕金森病模型小鼠运动的总路程的影响作用;图b为jja-d0对mptp诱导的帕金森病模型小鼠的总活动时间的影响作用;图c为jja-d0对mptp诱导的帕金森病模型小鼠的中央区域停留时间的影响作用;图d为jja-d0对mptp诱导的帕金森病模型小鼠在openfield试验中的运动轨迹的影响作用代表图。图17是jja-d0对mptp诱导的帕金森病模型小鼠黑质th-染色阳性的多巴胺能神经元数量的影响图(means±sd,n=6;###p<0.001,与正常对照组相比;*p<0.05,**p<0.01,***p<0.001,与模型组相比);其中,图a为各实验组中th-染色阳性的多巴胺能神经元的计数图;图b为各实验组中th-染色阳性的多巴胺能神经元数量占对照组数量的百分比图;图c为各组脑组织切片th-染色后的显微图片的代表图(20×)。图18是本发明的胡黄连素二聚体类似物衍生物对帕金森病的治疗作用图。具体实施方式下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,下列实施例中采用的试剂、方法和设备为本
技术领域:
常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。以下实施例中sh-sy5y细胞(购自atcc,manassas,va,usa)采用dmem/f12培养基,加入终浓度为10%(v/v)fbs、100u/ml青霉素和100μg/ml链霉素进行培养;即实施例中涉及的新鲜培养基(液)是含有fbs、青霉素和链霉素的dmem/f12培养基,培养基为dmem/f12培养基。本发明实施例中的涉及的胡黄连素二聚体类似物衍生物为jja-d0和jja-d1~jja-d34,其可以通过中国专利申请(申请号为:201710347578.8,名称为“胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐、制法与用途”)中记载的方法制备得到。实施例1胡黄连素与jja-d0对sh-sy5y细胞的毒性将sh-sy5y细胞以5×104/ml接种于96孔培养板,100μl/孔,放入5%(v/v)co2细胞培养箱,于37℃培养24h。取出,除空白对照组(ctrl)置换成新鲜培养液外,其它各组分别将培养液置换成含不同浓度胡黄连素(apocynin)与jja-d0的培养基;其中,胡黄连素的终浓度分别为50、100、200、500、1000、1500μm,jja-d0的终浓度分别为12.5、25、50、100、200、400μm。每个组别设4个复孔,分别继续培养24h、36h、48h、72h后,取出96孔培养板,往每孔加入mtt溶液(15μl/孔),使终浓度为0.5mg/ml。再放入培养箱温育4h后,吸出每孔的溶液,再加入二甲基亚砜(dmso,150μl/孔),溶解结晶,振摇10min后,用酶标仪检测od值,检测波长为570nm。计算不同时间点各浓度组的细胞存活率,考察化合物对细胞的毒性,以便确定后续实验的药物剂量。结果显示,在所测定的浓度下,培养不同时间后,胡黄连素没有显示出细胞毒性;jja-d0则随着培养时间与药物浓度的增加,对细胞的毒性也逐渐升高,结果如图1所示。根据结果,选择胡黄连素二聚体类似物jja-d0及其衍生物的实验浓度不高于200μm。实施例2mpp+处理sh-sy5y细胞建立体外帕金森病细胞模型将sh-sy5y细胞以5×104/ml接种于96孔培养板,100μl/孔,放入5%(v/v)co2细胞培养箱,于37℃培养24h。取出,将培养液置换成含不同浓度1-甲基-4-苯基-吡啶离子(mpp+)的培养基;其中,mpp+的终浓度分别为0、50、125、250、500、1000、2000μm。继续培养24h后,取出96孔培养板,往每孔加入mtt溶液(15μl/孔),终浓度为0.5mg/ml。再放入培养箱温育4h后,吸出每孔的溶液,再加入dmso(150μl/孔),溶解结晶,振摇10min后,用酶标仪检测od值,检测波长为570nm。计算不同mpp+浓度下的细胞存活率,结果如图2所示。当mpp+浓度为1mm时,模型组相对于对照组的细胞存活率为48%。所以选用mpp+浓度为1mm,处理时间为24h,作为后续实验建立帕金森病(parkinson’sdisease,pd)细胞模型的条件。实施例3胡黄连素对pd模型细胞的保护作用将sh-sy5y细胞以5×104/ml接种于96孔培养板,100μl/孔,放入5%(v/v)co2细胞培养箱,于37℃培养24h。取出,将加药组的培养液置换成含不同浓度胡黄连素的培养基预保护4h,其中,胡黄连素的终浓度分别为500、1000、1500μm;空白对照组(ctrl)与模型组(model)只加入新鲜培养基。4h后模型组与加药组的培养基都分别加入mpp+使终浓度为1mm,每个组别设4个复孔。继续培养24h后,取出96孔培养板,往每孔加入mtt溶液(15μl/孔),终浓度为0.5mg/ml。再放入培养箱温育4h后,吸出每孔的溶液,再加入dmso(150μl/孔),溶解结晶,振摇10min后,用酶标仪检测od值,检测波长为570nm,计算不同浓度胡黄连素处理后的细胞存活率。与模型组相比,胡黄连素在1000μm时,对pd模型细胞有较好的保护作用,结果如图3所示。在后续实施例中胡黄连素作为母体化合物对照,其终浓度均使用1000μm。实施例4胡黄连素二聚体类似物衍生物对pd模型细胞的保护作用将sh-sy5y细胞以5×104/ml接种于96孔培养板,100μl/孔,放入5%(v/v)co2细胞培养箱,于37℃培养24h。取出,将加药组的培养液置换成含不同浓度胡黄连素二聚体类似物及其衍生物(jja-d0~jja-d34)的培养基预保护4h,其中,胡黄连素二聚体类似物jja-d0及其衍生物的终浓度分别为50、100、200μm;胡黄连素组的培养液置换成含终浓度为1000μm的胡黄连素的培养基预保护4h;空白对照组与模型组只加入新鲜培养基。4h后模型组与加药组、胡黄连素组的培养基都分别加入mpp+使终浓度为1mm,每个组别设4个复孔。继续培养24h后,取出96孔培养板,往每孔加入mtt溶液(15μl/孔),终浓度为0.5mg/ml。再放入培养箱温育4h后,吸出每孔的溶液,再加入dmso(150μl/孔),溶解结晶,振摇10min后,用酶标仪检测od值,检测波长为570nm,计算采用不同浓度的系列衍生物处理后的细胞存活率。与模型组相比,所测定的胡黄连素二聚体类似物衍生物对pd模型细胞均有较好的保护作用,其中jja-d10显示出相对更好的保护作用,且具有明显的浓度依赖性(图4)。实施例5胡黄连素二聚体类似物衍生物对pd模型细胞中ros水平的影响将sh-sy5y细胞以5×104/ml接种于黑色边底透明96孔培养板,100μl/孔,放入5%(v/v)co2细胞培养箱,于37℃培养24h。取出,将加药组的培养液置换成含不同浓度胡黄连素二聚体类似物及其衍生物(jja-d0~jja-d34)的培养基预保护4h,其中,胡黄连素二聚体类似物jja-d0及其衍生物的终浓度分别为50、100、200μm;胡黄连素组的培养液置换成含终浓度为1000μm的胡黄连素的培养基预保护4h;空白对照组与模型组只加入新鲜培养基。4h后模型组与加药组、胡黄连素组的培养基都分别加入mpp+使终浓度为1mm,每个组别设4个复孔。继续培养24h后,取出96孔培养板,吸走每孔中的旧培养基,加入含有dcfh-da荧光探针的新鲜培养基,其终浓度为10μm,避光放入细胞培养箱内孵育20min。吸走含有探针的培养基,用hanks液清洗细胞三遍,再用多功能酶标仪检测,检测的激发波长为ex488nm,发射波长为em525nm。待检测完成之后,往每孔加入mtt溶液15μl/孔,终浓度为0.5mg/ml。再放入培养箱温育4h后,吸出每孔的溶液,再加入dmso(150μl/孔),溶解结晶,振摇10min后,用酶标仪检测od值,检测波长为570nm,按下式计算各组细胞荧光强度百分率表示各组细胞中ros的水平,其中n为空白对照组的复孔数。相对于模型组,所测定的胡黄连素二聚体类似物衍生物都显示了明显的ros清除能力,其中jja-d10显示出相对更好的清除能力,在高浓度时,使细胞中ros水平下降最多,且具有明显的浓度依赖性(图5)。实施例6胡黄连素二聚体类似物衍生物对pd模型细胞中线粒体膜电位的影响将sh-sy5y细胞以5×104/ml接种于黑色边底透明96孔培养板,100μl/孔,放入5%(v/v)co2细胞培养箱,于37℃培养24h。取出,将加药组的培养液置换成含不同浓度胡黄连素二聚体类似物及其衍生物(jja-d0~jja-d34)的培养基预保护4h,其中,胡黄连素二聚体类似物jja-d0及其衍生物的终浓度分别为50、100、200μm;胡黄连素组的培养液置换成含终浓度为1000μm的胡黄连素的培养基预保护4h;空白对照组与模型组只加入新鲜培养基。4h后模型组与加药组、胡黄连素组的培养基都分别加入mpp+使终浓度为1mm,每个组别设4个复孔。继续培养24h后,取出96孔培养板,吸走每孔中的旧培养基,每孔加50μl新鲜培养基,再加入现配预冷的jc-1工作液(按线粒体膜电位检测试剂盒说明书配制)50μl,避光放入细胞培养箱内孵育30min。吸走含有探针的培养基,用预冷的jc-1染色缓冲液(1×)清洗细胞三遍,每孔再加入hanks液100μl,用多功能酶标仪分别检测jc-1聚集态(检测激发波长为ex535nm、发射波长em590nm)与单体(检测激发波长为ex488nm、发射波长em525nm)的荧光值,用两者的比值计算线粒体膜电位的变化。胡黄连素二聚体类似物衍生物对pd模型细胞中线粒体膜电位的影响如图6所示。与对照组比,pd模型细胞组线粒体膜电位显著下降。相对于模型组,胡黄连素二聚体类似物衍生物均能明显地逆转mpp+诱导的sh-sy5y细胞中线粒体膜电位的下降,其中jja-d10升高线粒体膜电位的能力更强,且具有明显的浓度依赖性。实施例7jja-d10对pd模型细胞中sod活性与mda水平的影响将sh-sy5y细胞以5×105/ml接种于6孔培养板,2ml/孔,放入5%(v/v)co2细胞培养箱,于37℃培养24h。取出,将加药组的培养液置换成含不同待测化合物(胡黄连素、jja-d0和jja-d10)的培养基预保护4h,其中,胡黄连素、jja-d0和jja-d10的终浓度分别为1000、100和200μm;空白对照组与模型组只加入新鲜培养基。4h后模型组与加药组的培养基都分别加入mpp+使终浓度为1mm,继续培养24h后,取出6孔培养板,弃去旧培养基,用pbs缓冲液清洗细胞三遍,用培养基收集细胞,离心1000转/min,5min,弃去上清。然后按照超氧化合物歧化酶(sod)活性检测试剂盒(wst-8法)以及丙二醛(mda)含量测定试剂盒说明书,分别测定细胞中sod的活性和脂质过氧化产物丙二醛mda的水平,同时通过bca蛋白定量法测定各样品中的总蛋白浓度,实验重复测定3次。实验结果如图7所示,三种待测化合物均能够显著增加sod活性与降低mda水平,具有抗氧化活性,且jja-d10作用最强。实施例8jja-d10对pd模型细胞的抗炎与抗凋亡作用将sh-sy5y细胞以5×105/ml接种于6孔培养板,2ml/孔,放入5%(v/v)co2细胞培养箱,于37℃培养24h。取出,将加药组的培养液置换成含不同待测化合物(胡黄连素、jja-d0和jja-d10)的培养基预保护4h,其中,胡黄连素、jja-d0和jja-d10的终浓度分别为1000、100和200μm;空白对照组与模型组只加入新鲜培养基。4h后模型组与加药组的培养基都分别加入mpp+使终浓度为1mm,继续培养24h后,取出6孔培养板,提取细胞内总蛋白,采用westernblot法检测细胞内bax,bcl-2,tnf-α,cleavedcaspase-3与caspase-3的蛋白表达情况,实验重复3次。实验结果如图8所示,三种待测化合物均能够降低炎症因子tnf-α与凋亡蛋白cleavedcaspase-3的表达,可增高bcl-2/bax的比例,说明它们均具有抗炎与抗凋亡的作用,且jja-d10作用最强。实施例9jja-d10在pd模型细胞中抗炎与抗氧化信号通路的研究将sh-sy5y细胞以5×105/ml接种于6孔培养板,2ml/孔,放入5%(v/v)co2细胞培养箱,于37℃培养24h。取出,将加药组的培养液置换成含不同待测化合物(胡黄连素、jja-d0和jja-d10)的培养基预保护4h,其中,胡黄连素、jja-d0和jja-d10的终浓度分别为1000、100和200μm;空白对照组与模型组只加入新鲜培养基。4h后模型组与加药组的培养基都分别加入mpp+使终浓度为1mm,继续培养24h后,提取细胞内总蛋白,采用westernblot法检测细胞内pi3k-akt、nf-κb、mapks、nrf2/ho-1等信号通路中的关键蛋白以及nadph氧化酶的gp91-phox与p47-phox亚基蛋白,考察待测化合物对这些蛋白表达的影响,结果如图9~13所示。由图9可知,jja-d10能够降低gp91-phox与p47-phox的蛋白表达,抑制nadph氧化酶的活性,阻止ros的进一步产生。蛋白激酶p-pi3k与p-akt具有诱导下游抗氧化因子的作用以及阻止下游凋亡蛋白激活的作用,jja-d10能够提高二者的蛋白表达量,从而通过抗氧化、抗凋亡达到保护细胞的目的(图10)。nrf2/ho-1信号通路是细胞自我保护抗氧化的一条作用通路,当细胞产生氧化应激时,自身的ho-1蛋白表达量上升,具有抗氧化作用。由图11可见,jja-d10也能够促进该通路的激活,提高nrf2、ho-1两种蛋白的表达,发挥抗氧化的功能。对于mapks信号通路,该通路的蛋白激酶上调,会导致下游的nadph氧化酶的p47-phox亚基的磷酸化,最后导致nadph氧化酶的激活而产生ros,对细胞造成损伤。而且,该激酶还会激活下游的nf-κb核转录因子,使得nf-κb的p65蛋白入核,促进转录,导致炎症因子tnf-α的产生,进一步危害细胞。jja-d10能够下调该信号通路中erk1/2,p38与jnk蛋白的磷酸化激活,阻止后续的ros与炎症因子的产生,从而保护细胞(图12)。在nf-κb信号通路中,最常见的nf-κb是由p65与p50亚基组成的二聚体,当处于静息态时,nf-κb被iκb束缚位于胞浆中,不能进入细胞核,促进下游因子的转录。而当细胞受到各种胞内外刺激后,ikk蛋白被磷酸化激活为p-ikk之后,p-ikk能够磷酸化iκb蛋白使其激活,然后iκb蛋白脱离nf-κb二聚体使其游离,使得p65与p50入核,促进下游的炎症因子转录与表达。jja-d10能够下调p-ikk的表达,降低p-ikk对下游靶蛋白iκb的磷酸化,从而阻止iκb与nf-κb的解聚,进而减少p-p65的产生与入核,减少后续炎症因子的转录与表达,达到抗炎的目的(图13)。实施例10jja-d10对野生型α-synuclein高表达的sh-sy5y细胞中α-synuclein蛋白表达的影响α-synuclein蛋白在正常生理条件下,具有保护神经细胞、维护突触功能、抗氧化应激以及促进异常聚集的蛋白降解的作用。当细胞处于病理状态下,如受到mpp+、鱼藤酮等一些外来刺激时,易使得α-synuclein蛋白过度聚集从而超出了细胞的正常承受能力,导致出现线粒体功能紊乱、氧化应激等状况,最后出现细胞毒性,导致凋亡。将转染野生型α-synuclein的sh-sy5y细胞[sh-sy5y(wtα-syn)细胞]以5×105/ml接种于6孔培养板,2ml/孔,放入5%(v/v)co2细胞培养箱,于37℃培养24h;同法培养正常的sh-sy5y细胞作为空白对照组。将加药组的培养液置换成含不同待测化合物(胡黄连素、jja-d0和jja-d10)的培养基,其中,胡黄连素、jja-d0和jja-d10的终浓度分别为1000、100和200μm;空白对照组与模型组只加入新鲜培养基。培养24h后,在荧光显微镜下观察,并提取细胞内总蛋白,采用westernblot法检测细胞内α-synuclein蛋白,结果如图14所示。在荧光显微镜下观察到,高表达α-synuclein的sh-sy5y(wtα-syn)细胞显绿色荧光(图14a),在模型组中,sh-sy5y(wtα-syn)细胞中α-synuclein蛋白过表达,jja-d10可显著降低sh-sy5y(wtα-syn)细胞中α-synuclein蛋白表达量,能够实现对神经细胞的保护,达到治疗pd的作用。实施例11jja-d0对帕金森病模型小鼠的治疗作用采用mptp诱导雄性c57bl/6小鼠(8~12周齡,20~25g,购于广东省医学实验动物中心)建立帕金森病动物模型,将动物分为模型组(mptp)、阳性药物司来吉兰组(sel,用量为10mg/kg)、药物jja-d0组(10、20、40、80mg/kg),并设置正常对照组(control,ctrl),共7个组,每组12只。模型组与正常对照组给予溶剂,阳性药物组与药物组分别给予相应剂量的药物,共给药20天后,进行自动步态分析仪(catwalk)与旷场(openfield)试验,测定相应的行为学指标。完成行为学试验后,每组取6只小鼠处死后进行免疫组化检测多巴胺能神经元数量,6只小鼠取纹状体采用hplc法测定其中多巴胺(da)、3,4-二羟基苯乙酸(dopac)和高香草酸(hva)的含量。结果显示,jja-d0可以明显改善模型小鼠的行为学指标。在catwalk试验中,mptp、阳性药物及jja-d0对前肢的脚间距离无明显影响,mptp使模型组后肢的脚间距离(baseofsupport)显著增加,阳性药物与jja-d0(40、80mg/kg)使后肢脚间距离较模型组明显减小;mptp使模型组小鼠前肢与后肢的步周长(stridelength)均明显减小,阳性药物与jja-d0(80mg/kg)可使其增大;mptp使模型组小鼠前肢与后肢的支撑时相大大延长(durationofstance),阳性药物可显著缩短前肢与后肢的支撑时相,jja-d0在20、40mg/kg时可显著缩短前肢支撑时相,在10、20和80mg/kg时可显著缩短后肢支撑时相;mptp使模型组小鼠前肢与后肢的摆动速度(swingspeed)均明显减小,阳性药物与jja-d0(20、40mg/kg)可使其明显增大至与正常对照组相当;mptp使模型组小鼠前肢与后肢的行走周期(stepcycle)均明显延长,阳性药物与jja-d0(40mg/kg)可使其明显缩短,接近正常对照组(图15)。在openfield试验中,mptp使模型组小鼠运动的总路程、总活动时间和中央区域停留时间显著下降;阳性药物可明显增加小鼠运动的路程和总活动时间,对动物中央区域停留时间无明显影响;jja-d0在20、40、80mg/kg可明显增加总路程,在40、80mg/kg可明显增加小鼠总活动时间,在40mg/kg能明显增加小鼠中央区域停留时间(图16)。免疫组化的结果见图17,可见jja-d0可增加黑质th-染色阳性的多巴胺能神经元的数量。jja-d0还可增加纹状体多巴胺及其代谢物dopac的水平,对hva的水平没有明显影响(表1)。表1.jja-d0对mptp诱导的pd模型小鼠纹状体中多巴胺及其代谢物水平的影响(mean±sd,n=6)组别与剂量da(ng/mg组织)dopac(ng/mg组织)hva(ng/mg组织)control5.982±0.3340.811±0.0560.876±0.076mptp3.533±0.152###0.363±0.148##0.752±0.075mptp+sel(10mg/kg)5.157±0.087***0.645±0.062*0.843±0.044mptp+jja-d0(10mg/kg)3.857±0.1350.443±0.0650.744±0.069mptp+jja-d0(20mg/kg)5.040±0.231***0.588±0.108*0.765±0.074mptp+jja-d0(40mg/kg)4.850±0.170***0.671±0.110*0.801±0.078mptp+jja-d0(80mg/kg)3.477±0.2280.505±0.0620.741±0.042注:#p<0.05,##p<0.01,###p<0.001,与正常对照组相比;*p<0.05,**p<0.01,***p<0.001,与模型组相比。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1