一种冻干制剂及其制备方法和应用与流程
本发明涉及制剂技术领域,特别是涉及一种冻干制剂及其制备方法和应用。
背景技术:
冻干制剂是将药用成分(原料)及辅助成分(辅料),用溶媒(例如水)溶解后,配制成一定浓度的前培育,再在无菌密闭环境中,低温下冻结,再通过降低环境气压,缓慢升高制品温度的方法使制品中的溶媒(例如水)升华,留下固体形态的疏松块状或粉末状药物而成的制剂。
三萜皂苷是一类天然药物化学成分,具有结构复杂、含量低、药理活性强的特点,这类成分中很多具有极易溶于水、热敏等特点,相对于甾体皂苷而言,三萜皂苷中的酸性皂苷由于其热不稳定性的特点,基本只存在于鲜材中,在制品的加工过程中会促使酸性皂苷转变为甾体皂苷,因此难以保存,很少应用到实际产品中。
在临床上,三萜皂苷又具有很多药理活性,如降糖、降脂等,目前大部分三萜皂苷通过鉴定,得到结构信息后,多通过人工合成来实现,人工合成的获取方式大大提高了其成本,同时合成路线中溶剂和中间产物的残留、杂质的控制,都会成为安全隐患。
三萜皂苷的常规应用为心血管病的治疗,在临床应用于注射剂和口服片剂、胶囊剂等多个剂型。但三萜皂苷中的酸性皂苷由于具有热不稳定性,在加工工艺方面和储存等方面受到诸多限制。作为含有皂苷的冻干制剂,由于其具有发泡性的特征,多具有载药量非常有限(一般在1-50mg/粒,规格为0.4-1ml/粒)的特征、崩解及溶解变差(高于10s,甚至长达1-3min)、溶出变慢(15-60min)等缺陷。
技术实现要素:
本发明的目的是针对现有技术中存在的冻干制剂的载药量小、崩解和溶解差、溶出慢等问题,而提供一种冻干制剂,该冻干制剂包括三萜皂苷和粘结剂,或者还包括辅料,所述冻干制剂作为口服制剂时,崩解时间小于3s,1min内溶出量大于90%;所述冻干制剂作为固体饮料时,崩解时间小于10s,溶解时间小于15s,1min内溶出量大于90%。
本发明的另一方面,是提供一种所述冻干制剂的制备方法,利用直接冻干或通过软冰冻干的方法制备,工艺简单,便于商业化推广应用。
本发明的另一方面,是提供所述冻干制剂的应用,其可应用于日用化学品、药品、保健品和食品领域。
本发明的另一方面,是提供一种三萜皂苷的提取方法,该方法不会破坏三萜皂苷的药理活性,并且具有提取量大的优点,每1g含皂苷药材可提取出0.24-0.54g酸性皂苷,同时该提取方法具备生产可行性,并且可以深加工出具有相应功能的冻干制剂。
为实现本发明的目的所采用的技术方案是:
一种冻干制剂,其中三萜皂苷在冻干制剂中质量百分数为0.004-95%,粘结剂在冻干制剂中的质量百分数为0.01-99%;
所述冻干制剂由内含三萜皂苷和粘结剂的前配液冻干而成:
当三萜皂苷在前配液中的质量百分数为0.001%-50%时,粘结剂在前配液中的质量百分数为0.01%-50%,且三萜皂苷的质量随着粘结剂质量的增加而增加;
当三萜皂苷在前配液中的质量百分数为50%-95%时,粘结剂在前配液中的质量百分数为0.01%-20%,且三萜皂苷的质量随着粘结剂的质量增加而减少。
一种冻干制剂,所述冻干制剂由内含三萜皂苷和粘结剂的前配液冻干而成,所述冻干制剂为口服制剂、固体饮料或非洗护用护肤品。
当所述冻干制剂为口服制剂时,其中三萜皂苷在所述前配液中质量百分数为0.004%-50%,粘结剂在所述前配液中的质量百分数为0.01%-50%;优选的,三萜皂苷在所述前配液中质量百分数为0.004%-30%,粘结剂在所述前配液中的质量百分数为0.01%-35%,更为优选的,三萜皂苷在所述前配液中质量百分数为0.004%-20%,粘结剂在所述前配液中的质量百分数为0.01%-30%。更为优选的,三萜皂苷在所述前配液中质量百分数为10%-20%,粘结剂在所述前配液中的质量百分数为1%-10%。
当所述冻干制剂为固体饮料(包括冲剂和速溶片剂等)时,其中三萜皂苷在所述前配液中质量百分数为50%-95%,粘结剂在所述前配液中的质量百分数为0.01%-20%。优选的,三萜皂苷在所述前配液中质量百分数为50%-85%,粘结剂在所述前配液中的质量百分数为0.01%-20%,更为优选的,三萜皂苷在所述前配液中质量百分数为50%-80%,粘结剂在所述前配液中的质量百分数为0.01%-20%。更为优选的,三萜皂苷在所述前配液中质量百分数为70%-80%,粘结剂在所述前配液中的质量百分数为0.01%-10%。
当所述冻干制剂为非洗护用护肤品(包括精华、膏霜乳或身体乳)时,其中三萜皂苷在所述前配液中质量百分数为0.004-30%,粘结剂在所述前配液中的质量百分数为0.01-50%。优选的,三萜皂苷在所述前配液中质量百分数为0.004-10%,粘结剂在所述前配液中的质量百分数为0.01-10%,更为优选的,萜皂苷在所述前配液中质量百分数为0.004-0.1%,粘结剂在所述前配液中的质量百分数为0.01-3%。
在上述技术方案中,所述口服制剂的崩解时间小于3s,1min内溶出量大于90%,所述固体饮料的崩解时间小于10s,溶解时间小于15s,1min内溶出量大于90%。
所述冻干制剂作为口服制剂时,可实现入口崩解(0.1-0.3ml唾液,3s内崩解)与快速溶出(1min内90%以上);作为固体饮料(包括冲剂、速溶片剂等)时,投入水中(水温为20℃~50℃都可)依然快速崩解(10s内崩散),并快速均匀溶解(15s内看不到颗粒物),同时快速溶出(1min内90%以上)。
在上述技术方案中,所述冻干制剂中还包括辅料,辅料在前配液中的质量百分数为0.01-50%,所述辅料为骨架支持剂,崩解剂,肤感改良剂,抗氧化剂,矫味剂,香精,跨黏膜、透皮吸收促进剂或ph调节剂中的一种或多种组合。
其中:骨架支持剂为糖(如麦芽糖、海藻糖、微晶纤维素)、糖醇(如甘露糖醇、山梨醇、木糖醇)、2-12碳原子的氨基酸(如甘氨酸、丙氨酸、谷氨酸等)以及无机盐(如磷酸钠、硅酸铝等),糊精(麦芽糊精),或它们的组合;崩解剂选自泡腾剂、无水乳糖、淀粉与淀粉酶、纤维素类与纤维素酶、树胶与半纤维素酶、明胶与蛋白酶、海藻酸盐类、角叉菜胶酶、蔗糖与转化酶中的一种或数种混合物;所述肤感改良剂,为聚甲基硅倍半氧烷、木薯淀粉、改性木薯淀粉、玉米淀粉、改性玉米淀粉、珍珠粉、硅石、钛白粉、云母、聚二甲基硅氧烷、二c12-13醇苹果酸酯、二肉豆蔻醇酒石酸酯、ppg-15硬脂醇醚、锦纶-12、欧洲越桔籽油等具有改善肤感的物质中的任一种或数种混合物;所述的抗氧化剂,为维生素c、维生素e、2,6-二叔丁基-4-甲基苯酚、特丁基对苯二酚、丁基羟基茴香醚、n-苯乙酰基-l-谷氨酰胺、三羟基苯丁酮、柠檬酸、磷酸衍生物、edta、黄芩甙、虾青素、亚硫酸钠、焦亚硫酸钠、没食子酸酯、植酸、茶多酚、花青素、白藜芦醇、谷胱甘肽、超氧化物歧化酶、酵母菌/大米发酵产物滤液、植物提取物、白僵菌提取物、白松露菌提取物、果蔬提取物、植物来源的多元酚类化合物等具有抗氧化功效物质中的任一种或数种的混合物;所述矫味剂和香精选自薄荷味、巧克力味、果蔬味、花草香味、植物香味、香草味、咖啡味、茶味、玉米味、柠檬味、牛奶味、果香味、红莓味、山楂味、枸杞味等香精或以上一种或几种香味的混合物;所述的跨黏膜或透皮吸收促进剂选自卵磷脂、吐温、司盘、中的任一种或数种的混合物;所述透皮吸收剂选自氮酮、卵磷脂、乙氧基二乙二醇中的任何一种或数种的混合物;所述的ph调节剂选自柠檬酸、山梨酸、酒石酸、乳酸、苹果酸、碳酸氢钠、碳酸钠,磷酸氢二钠、磷酸钙、磷酸钾、磷酸三镁等中的任何一种或数种的混合物。
在上述技术方案中,所述粘结剂由冻干粘结剂和/或低温粘结剂组成;所述冻干粘结剂选自人工或天然高分子聚合物、改性人工或天然高分子聚合物、无机物凝胶剂、多糖、多糖衍生物及其盐类、糖醇类、纤维素醚类、改性淀粉类、白蛋白或聚氨基酸中的一种或组合;所述低温粘结剂为c1-c16的醇、油脂、表面活性剂、人工或天然高分子聚合物或改性人工或天然高分子聚合物中的一种或组合。
其中自人工或天然高分子聚合物选自胶原、明胶、水解明胶、水解胶原、阿拉伯胶、黄原胶、大豆蛋白胶、小核菌胶、生物糖胶、卡拉胶、瓜儿豆胶、结冷胶、果胶、魔芋胶、角叉菜胶、刺槐豆胶、树胶、海藻酸、海藻酸钠、琼脂、聚乙烯醇丙烯酸甲酯接枝共聚物、卡波姆、卡波树脂、聚乙烯吡咯烷酮、聚乙烯醇及其衍生物、聚乙二醇及其衍生物、聚氧化乙烯、聚丙烯酰胺、聚丙烯酸钠、聚丙烯酸酯、聚丙烯酸及其衍生物,或它们的组合;改性人工或天然高分子聚合物可为改性阿拉伯胶、改性黄原胶、改性瓜儿豆胶、改性果胶、改性聚丙烯酸钠及其接枝淀粉、改性石蜡,或它们的组合。
在上述技术方案中,所述冻干制剂中还包括活性成分,活性成分在前配液中的质量百分数为0.01-50%,所述活性成分为甾体皂苷、黄芪提取物、人参提取物、西洋参提取物、绞股蓝提取物、黄酮、参多糖、海参多糖、氨基酸、三七素、鹿茸多肽、白藜芦醇、珍珠粉、水解珍珠、林蛙油提取物、sod或山楂提取物的一种或多种组合。
在上述技术方案中,所述三萜皂苷为酸性热敏性皂苷,优选为丙二酰基人参皂苷、绵毛黄芪苷、桔梗皂苷e、党参皂苷a-g、紫菀皂苷、hb轮叶党参皂苷i-iii或绞股蓝皂苷中的一种或组合。酸性热敏性皂苷是指结构中带有羧基且加热温度高于50℃时,损失率大于30%的三萜皂苷,对于敏感度高的酸性热敏性皂苷,加热1-10分钟后,损失率就可达到30%,对于敏感度稍低的酸性热敏性皂苷,加热1-48h后,损失率可达到30%。
在上述技术方案中,所述三萜皂苷利用二氧化碳超临界萃取工艺和大孔树脂交换吸附的过程,从含皂苷药材中纯化取得(三萜皂苷的提取率为80-90%),其包括以下步骤:
1)取含皂苷药材,洗净,切碎,加入1~10倍的纯水;
2)0℃~50℃低温环境下,对含皂苷药材碎块进行匀浆榨汁,得到汁a和渣b;
3)取渣b,采用二氧化碳超临界萃取工艺,在-30℃~40℃下萃取时间30-100min,夹带剂为乙醇,得到萃取物c,弃去剩余残渣;
4)取汁a,过大孔树脂柱,水洗去杂,30%~100%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,0℃~55℃下减压浓缩至无醇味,冷冻干燥,得到三萜皂苷1;
5)取萃取物c,过大孔树脂柱,水洗去杂,30%~100%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,0℃~55℃下减压浓缩至无醇味,冷冻干燥,得到三萜皂苷2;
6)分开使用或合并三萜皂苷1和2,得到最终三萜皂苷产物。
在上述技术方案中,所述含皂苷药材为西洋参、人参、三七、绞股蓝、柴胡、党参、桔梗、远志、甘草或商陆中的一种植物或多种植物组合,所述含皂苷药材为植物的根部、茎叶或花中的一种或组合。作为优选的,所述含皂苷药材为西洋参根部、三七根部、人参根部、人参花和三七花叶茎。
在述技术方案中,所述冻干制剂通过以下方法制备:
a)将溶剂(选用水)、三萜皂苷和粘结剂混合形成溶液、乳液或者悬浊液形式的前配液,或将溶剂、三萜皂苷、粘结剂和辅料混合形成溶液、乳液或者悬浊液形式的前配液后,定容、脱气;
b)使用定量灌装泵,将a)得到的前配液注入到定量成型模具中,进行脱气;
c)将b)得到侧产物冷冻干燥,除去溶剂,得到冻干制剂(冻干赋形制剂);
或通过以下步骤制备:
a)制备软冰混合物:
将三萜皂苷、粘结剂与溶剂(水)混合得到前配液,或将三萜皂苷、粘结剂、溶剂和辅料混合得到前配液,将前配液进行凝冻,得到软冰混合物1;
b)将活性成分、粘结剂和溶剂(水)混合得到前液,或活性成分、粘结剂、辅料和溶剂(水),与溶剂(水)混合得到前配液,进行低温冷冻粉碎或低温喷雾,得到冰粉2;
c)将活性成分、辅料,作为干粉3;
d)将活性成分,作为干粉4;
e)将软冰混合物1、冰粉2、干粉3或干粉4的一种或多种组合混合,得到的所有软冰混合物;
f)使用一定模具定型,得到定型后的混合物5,脱模;
g)对混合物5进行冷冻干燥,得到冻干制剂(冻干赋形制剂)。
或通过以下步骤制备:
a)将溶剂(选用水)、三萜皂苷和粘结剂混合形成溶液、乳液或者悬浊液形式的前配液,或将溶剂、三萜皂苷、粘结剂和辅料混合形成溶液、乳液或者悬浊液形式的前配液后,定容、脱气;
b)使用定量灌装泵,在内部温度处于溶液共晶点以下的舱体内进行滴注,使其滴液时迅速冻结;
c)将已冻结的溶液进行冷冻干燥,得到冻干赋形制剂。
在上述技术方案中,所述冻干制剂可为但不限于片剂形状、球形、椭球形或者各种人物、动物、植物、食物、图形标识或卡通形象。
本发明的另一方面,还包括所述冻干制剂在日用化学品、药品、保健品和食品中的应用。
本发明的另一方面,还包括内容物为所述冻干制剂的阻隔性包装。
在上述技术方案中,所述阻隔性包装为双铝、铝塑或高阻隔高分子材料的泡罩装,带有铝塑封口或膜封口的玻璃或金属容器,或者金属材质的密封容器。铝塑材料为pvdc、aclar、evoh与al的复合材料,或者铝与pp、pe、pet和pvc的复合材料),高阻隔高分子材料为pvdc、aclar、evoh,密封容器可为盒、罐、瓶,比如易拉罐、铝罐、不锈钢罐等。或也可以为胶囊咖啡装或小铝碗装等。
本发明的另一方面,还包括三萜皂苷在冻干制剂中的应用,所述述三萜皂苷为热敏性酸性皂苷,所述热敏性酸性皂苷是结构中带有羧基且加热温度高于50℃时,损失率大于30%的三萜皂苷。对于敏感度高的酸性热敏性皂苷,加热1-10分钟后,损失率就可达到30%,对于敏感度稍低的酸性热敏性皂苷,加热1-48h后,损失率可达到30%。
本发明的另一方面,还包括三萜皂苷在冻干制剂中的应用,所述三萜皂苷利用二氧化碳超临界萃取工艺和大孔树脂交换吸附的过程,从含皂苷药材中纯化取得,其包括以下步骤:
1)取含皂苷药材,洗净,切碎,加入1~10倍的纯水;
2)0℃~50℃低温环境下,对含皂苷药材碎块进行匀浆榨汁,得到汁a和渣b;
3)取渣b,采用二氧化碳超临界萃取工艺,在-30℃~40℃下萃取时间30-100min,夹带剂为乙醇,得到萃取物c,弃去剩余残渣;
4)取汁a,过大孔树脂柱,水洗去杂,30%~100%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,0℃~55℃下减压浓缩至无醇味,冷冻干燥,得到三萜皂苷1;
5)取萃取物c,过大孔树脂柱,水洗去杂,30%~100%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,0℃~55℃下减压浓缩至无醇味,冷冻干燥,得到三萜皂苷2;
6)分开使用或合并三萜皂苷1和2,得到最终三萜皂苷产物。
在上述技术方案中,所述含皂苷药材为西洋参、人参、三七、绞股蓝、柴胡、党参、桔梗、远志、甘草、黄芪或商陆的的一种植物或多种植物组合,所述含皂苷药材为植物的根部、茎叶或花中的一种或组合。
本发明的另一方面,一种提取三萜皂苷的方法,包括以下步骤:
1)取含皂苷药材,洗净,切碎,加入1~10倍的纯水;
2)0℃~50℃低温环境下,对含皂苷药材碎块进行匀浆榨汁,得到汁a和渣b;
3)取渣b,采用二氧化碳超临界萃取工艺,在-30℃~40℃下萃取时间30-100min,夹带剂为乙醇,得到萃取物c,弃去剩余残渣;
4)取汁a,过大孔树脂柱,水洗去杂,30%~100%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,0℃~55℃下减压浓缩至无醇味,冷冻干燥,得到三萜皂苷1;
5)取萃取物c,过大孔树脂柱,水洗去杂,30%~100%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,0℃~55℃下减压浓缩至无醇味,冷冻干燥,得到三萜皂苷2;
6)分开使用或合并三萜皂苷1和2,得到最终三萜皂苷产物。
三萜皂苷在含皂苷药材中的含量一般为30-60%,利用该方法提取时,含皂苷药材内三萜皂苷80-90%可被提取出来,提取率高。
在上述技术方案中,所述含皂苷药材为西洋参、人参、三七、绞股蓝、柴胡、党参、桔梗、远志、甘草、黄芪或商陆的的一种植物或多种植物组合,所述含皂苷药材为植物的根部、茎叶或花中的一种或组合。
本发明的另一方面,还包括一种冻干制剂的制备方法,包括以下步骤:
a)将溶剂、三萜皂苷和粘结剂混合形成溶液、乳液或者悬浊液形式的前配液,或将溶剂、三萜皂苷、粘结剂和辅料混合形成溶液、乳液或者悬浊液形式的前配液后,定容、脱气;
b)使用定量灌装泵,将a)得到的前配液注入到定量成型模具中,进行脱气;
c)将b)得到侧产物冷冻干燥,除去溶剂,得到冻干制剂;
或通过以下步骤制备:
a)制备软冰混合物:将三萜皂苷、粘结剂与溶剂混合得到前配液,或和将三萜皂苷、粘结剂、溶剂和辅料混合得到前配液,将前配液进行凝冻,得到软冰混合物1;
b)将活性成分、粘结剂和溶剂混合得到前液,或活性成分、粘结剂、辅料和溶剂,与溶剂混合得到前配液,进行低温冷冻粉碎或低温喷雾,得到冰粉2;
c)将活性成分、辅料,作为干粉3;
d)将活性成分,作为干粉4;
e)将软冰混合物1、冰粉2、干粉3或干粉4的一种或多种组合混合,得到的所有软冰混合物;
f)使用一定模具定型,得到定型后的混合物5,脱模;
g)对混合物5进行冷冻干燥,得到冻干制剂;
或通过以下步骤制备:
a)将溶剂、三萜皂苷和粘结剂混合形成溶液、乳液或者悬浊液形式的前配液,或将溶剂、三萜皂苷、粘结剂和辅料混合形成溶液、乳液或者悬浊液形式的前配液后,定容、脱气;
b)使用定量灌装泵,在内部温度处于溶液共晶点以下的舱体内进行滴注,使其滴液时迅速冻结;
c)将已冻结的溶液进行冷冻干燥,得到冻干制剂。
与现有技术相比,本发明的有益效果是:
1.由于特设比例的三萜皂苷的加入,使得本发明的冻干制剂作为口服剂具有崩解速度快的优点,崩解时间小于3s。作为固体饮料具有崩解速度快,溶解时间短和溶出速度快的优点,崩解时间小于3s,溶解时间小于10s,1min内溶出量大于90%。
2.利用本发明的提取三萜皂苷的方法,从含皂苷药材中提出的皂苷可保持良好的药理特性,将其添加到冻干剂内后,仍可保留良好的药理特性,如降糖、降脂等,解决了三萜皂苷依靠人工合成的问题。
3.实现了在冻干制剂形态下对于皂苷成分的大载药量,最高可达到950mg/粒(1ml/粒规格)。
附图说明
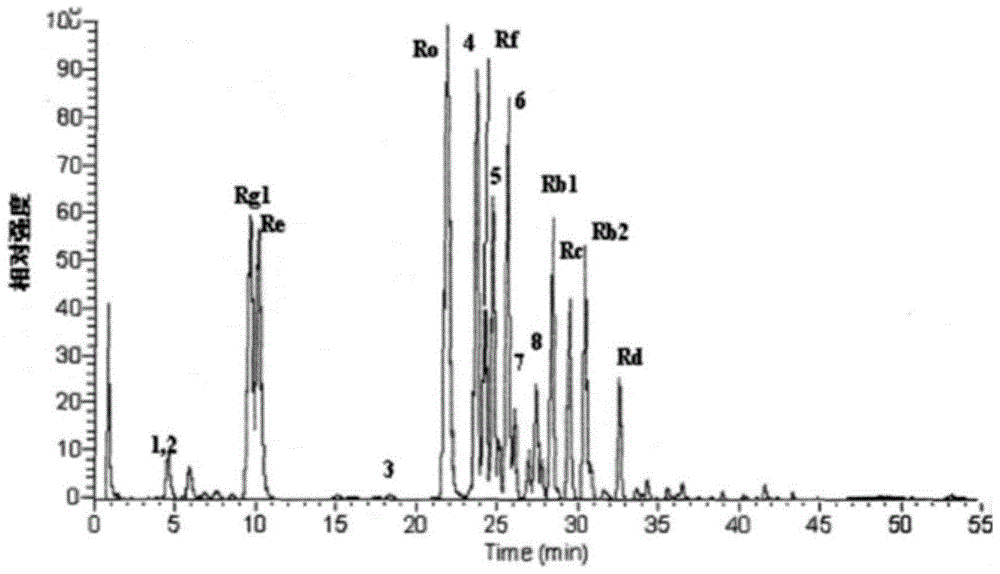
图1所示为提取物的丙二酰基人参皂苷hplc-ms总离子流色谱图。
图中:1-丙二酰基人参皂苷rg1,2-丙二酰基人参皂苷re,3-丙二酰基人参皂苷rf,4-丙二酰基人参皂苷rb1,5-丙二酰基人参皂苷rc,6-丙二酰基人参皂苷rb2,7-丙二酰基人参皂苷rb3,8-丙二酰基人参皂苷rd。
具体实施方式
以下结合具体实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例组
a组实验:
一种提取三萜皂苷的方法,包括以下步骤:
1)取人参或西洋参的根部,或者人参或西洋参的“芦头”位置(地下茎部分),洗净,切碎,加入10倍的纯水;
2)0℃低温环境下,对含皂苷药材碎块进行匀浆榨汁,得到汁a和渣b;
3)取渣b,采用二氧化碳超临界萃取工艺,在-30℃下萃取时间30min,夹带剂为乙醇,得到萃取物c,弃去剩余残渣;
4)取汁a,过大孔树脂柱,水洗去杂,30%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,0℃下减压浓缩至无醇味,冷冻干燥,得到丙二酰基人参皂苷rg1、re、rf、rb1、rc、rb2、rb3和rd;
5)取萃取物c,过大孔树脂柱,水洗去杂,30%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,0℃下减压浓缩至无醇味,冷冻干燥,得到丙二酰基人参皂苷rg1、re、rf、rb1、rc、rb2、rb3和rd。
将步骤4)和步骤5)所得到的丙二酰基人参皂苷进行混合,得到如图1所示的丙二酰基人参皂苷hplc-ms总离子流色谱图。
利用相同的工艺提取三七的根部或茎叶或花或任意混合物,也可得到丙二酰基人参皂苷rg1、re、rf、rb1、rc、rb2、rb3和rd。a组实验中人参或西洋参的根部,或者人参或西洋参的“芦头”位置中丙二酰基人参皂苷(包括rg1、re、rf、rb1、rc、rb2、rb3和rd)的提取率为80-83%。
b组实验:
一种提取三萜皂苷的方法,包括以下步骤:
1)取绞股蓝根部或茎叶或花或任意混合物,洗净,切碎,加入5倍的纯水;
2)50℃低温环境下,对含皂苷药材碎块进行匀浆榨汁,得到汁a和渣b;
3)取渣b,采用二氧化碳超临界萃取工艺,在40℃下萃取时间100min,夹带剂为乙醇,得到萃取物c,弃去剩余残渣;
4)取汁a,过大孔树脂柱,水洗去杂,100%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,55℃下减压浓缩至无醇味,冷冻干燥,得到绞股蓝皂苷;
5)取萃取物c,过大孔树脂柱,水洗去杂,100%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,55℃下减压浓缩至无醇味,冷冻干燥,得到绞股蓝皂苷。
b组实验中绞股蓝根部或茎叶或花或任意混合物中绞股蓝皂苷的提取率为81-85%。
利用hplc-ms对b组实验得到的绞股蓝皂苷进行验证,得到的总离子流色谱图与相关文献报道的标准图谱一致。
c组实验:
一种提取三萜皂苷的方法,包括以下步骤:
1)取黄芪根部或茎叶或花或任意混合物,洗净,切碎,加入5倍的纯水;
2)50℃低温环境下,对含皂苷药材碎块进行匀浆榨汁,得到汁a和渣b;
3)取渣b,采用二氧化碳超临界萃取工艺,在20℃下萃取时间60min,夹带剂为乙醇,得到萃取物c,弃去剩余残渣;
4)取汁a,过大孔树脂柱,水洗去杂,60%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,25℃下减压浓缩至无醇味,冷冻干燥,得到绵毛黄芪苷(x、xiv、xv、xvi);
5)取萃取物c,过大孔树脂柱,水洗去杂,60%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,25℃下减压浓缩至无醇味,冷冻干燥,得到绵毛黄芪苷(x、xiv、xv、xvi)。
c组实验中黄芪根部或茎叶或花或任意混合物中绵毛黄芪苷(x、xiv、xv、xvi)的提取率为85-90%。
利用hplc-ms对c组实验得到的绵毛黄芪苷(x、xiv、xv、xvi)进行验证,得到的总离子流色谱图与相关文献报道的标准图谱一致。
d组实验:
一种提取三萜皂苷的方法,包括以下步骤:
1)取党参根部或茎叶或花或任意混合物,洗净,切碎,加入1倍的纯水;
2)20℃低温环境下,对含皂苷药材碎块进行匀浆榨汁,得到汁a和渣b;
3)取渣b,采用二氧化碳超临界萃取工艺,在30℃下萃取时间50min,夹带剂为乙醇,得到萃取物c,弃去剩余残渣;
4)取汁a,过大孔树脂柱,水洗去杂,40%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,40℃下减压浓缩至无醇味,冷冻干燥,得到党参皂苷a-g、紫菀皂苷hb轮叶党参皂苷i-iii;
5)取萃取物c,过大孔树脂柱,水洗去杂,40%乙醇洗脱三萜皂苷,取样薄层色谱确定目标物,收集目标段,40℃下减压浓缩至无醇味,冷冻干燥,党参皂苷a-g、紫菀皂苷hb轮叶党参皂苷i-iii。
d组实验中,党参根部或茎叶或花或任意混合物中党参皂苷a-g、紫菀皂苷hb和轮叶党参皂苷i-iii的提取率为82-86%。
利用hplc-ms对c组实验得到的党参皂苷a-g、紫菀皂苷hb和轮叶党参皂苷i-iii进行验证,得到的总离子流色谱图与相关文献报道的标准图谱一致。
实施例1
一种冻干制剂,该冻干制剂作为口服制剂使用,该冻干制剂中三萜皂苷为丙二酰基人参皂苷re,其百分含量为10%,粘结剂为出芽短梗酶多糖,其百分含量为3%。
所述冻干制剂通过以下步骤制备:
a)将水、丙二酰基人参皂苷re和出芽短梗酶多糖混合形成前配液后,定容、脱气;
b)使用定量灌装泵,将a)得到的前配液注入到1ml片型成型模具中,进行脱气;
c)将b)得到侧产物冷冻干燥,除去溶剂,得到口服冻干制剂。
该口服制剂具有降血糖功能,其崩解时间为3s以内,溶出速度为30s以内溶出95%。在本实施例中,将丙二酰基人参皂苷re更换为其他种类的丙二酰基人参皂苷,得到的口服制剂有相同性质,崩解时间均在3s以内,溶出速度为30s以内溶出具可达到95%。
在该实施例中修改丙二酰基人参皂苷re的含量为0.004%,出芽短梗酶多糖的含量为0.01%,或者丙二酰基人参皂苷re的含量为50%,出芽短梗酶多糖的含量为50%均得到相同效果的口服制剂。
实施例2
一种冻干制剂,该冻干制剂作为口服制剂使用,该冻干制剂中三萜皂苷为10%丙二酰基人参皂苷rg1和20%丙二酰基人参皂苷rb1,合计为30%,粘结剂为瓜儿豆胶(百分含量为0.5%)以及丁二醇(百分含量为15%);辅料为骨架支持剂(改性木薯淀粉),其百分含量为5%。该口服制剂的崩解时间为3s以内,溶出速度为30s以内溶出95%。
所述冻干制剂通过以下步骤制备:
a)制备软冰混合物:按设定比例将丙二酰基人参皂苷rg1和丙二酰基人参皂苷rb1、瓜儿豆胶与丁二醇,加水混合得到前配液,将前配液进行凝冻,得到软冰混合物1;
b)使用0.6ml规格球形模具定型,得到定型后的混合物2,脱模;
c)对混合物2进行冷冻干燥,得到冻干制剂;
该口服制剂具有降压降脂功能,其崩解时间为3s以内,溶出速度为30s以内溶出95%。
在本实施例中,修改三萜皂苷为0.002%丙二酰基人参皂苷rg1和0.002%丙二酰基人参皂苷rb1,瓜儿豆胶(百分含量为0.005%)以及丁二醇(百分含量为0.005%),或者修改三萜皂苷为20%丙二酰基人参皂苷rg1和10%丙二酰基人参皂苷rb1,瓜儿豆胶(百分含量为20%)以及丁二醇(百分含量为15%),均得到相同性质的口服制剂。
实施例3
一种冻干制剂,该冻干制剂作为口服制剂使用,该冻干制剂中三萜皂苷为桔梗皂苷e30%,粘结剂为改性淀粉(百分含量为30%);辅料为抗氧化剂(维生素c,其百分含量为7%),活性成分为参多糖(百分含量为5%)。该口服制剂的崩解时间为3s以内,溶出速度为50s以内溶出90%。
所述冻干制剂通过以下步骤制备:
a)制备软冰混合物:按设定比例将桔梗皂苷e、改性淀粉、维生素c与水混合得到前配液将前配液进行凝冻,得到软冰混合物;
b)将参多糖,作为干粉;
e)将软冰混合物、冰粉混合,得到的所有软冰混合物;
f)使用椭球形模具定型,得到定型后的混合物,脱模;
g)对混合物进行冷冻干燥,得到口服制剂。
该口服制剂具有心血管护理功能,其崩解时间为3s以内,溶出速度为30s以内溶出93%。
在本实施例中修改三萜皂苷为桔梗皂苷e10%,改性淀粉(百分含量为1%);辅料为抗氧化剂(维生素c,其百分含量为0.01%),活性成分为参多糖(百分含量为50%),或者修改为三萜皂苷为桔梗皂苷e20%,改性淀粉(百分含量为10%);辅料为抗氧化剂(维生素c,其百分含量为50%),活性成分为参多糖(百分含量为0.01%),均可得到相同性质的口服制剂。
在实施例1-3的基础上,在本发明的范围内,改变三萜皂苷、粘结剂、辅料或者活性成分进行种类和含量,均可实现口服制剂的崩解时间小于3s以内,1min溶出量大于90%。
实施例4
一种冻干制剂,该冻干制剂作为固体饮料(冲剂或速溶片剂均可)使用,具有降脂功能,该冻干制剂中三萜皂苷为党参皂苷a(百分含量为70%),粘结剂为透明质酸钠(百分含量为10%)。该固体饮料的崩解时间为8s,溶解时间小于12s,30s内溶出量大于90%。
所述冻干制剂通过以下步骤制备:
a)按设定比例将水、党参皂苷a或聚氨基酸混合形成前配液后,定容、脱气;
b)使用定量灌装泵,将a)得到的前配液注入到1ml片型成型模具中,进行脱气;
c)将b)得到侧产物冷冻干燥,除去溶剂,得到固体饮料。
在本实施例的基础上,修改三萜皂苷为党参皂苷a(百分含量为50%),粘结剂为透明质酸钠(百分含量为20%),或者修改三萜皂苷为党参皂苷a(百分含量为95%),粘结剂为透明质酸钠(百分含量为0.01%),均可得到相同性质的固体饮料。
实施例5
一种冻干制剂,该冻干制剂作为固体饮料(冲剂或速溶片剂均可)使用,具有降压功能;该冻干制剂中三萜皂苷为绞股蓝皂苷(百分含量为95%),粘结剂为聚氨基酸(百分含量为1%),辅料为ph调节剂(柠檬酸、百分含量为1%)以及香精(咖啡味、百分含量为1%)。该固体饮料的崩解时间为6s,溶解时间小于10s,30s内溶出量大于95%。
所述冻干制剂通过以下步骤制备:
a)制备软冰混合物:按设定比例将绞股蓝皂苷、聚氨基酸、ph调节剂以及香精,加水混合得到前配液,将前配液进行凝冻,得到软冰混合物1;
b)使用1ml规格具有卡通形象的模具定型,得到定型后的混合物2,脱模;
c)对混合物2进行冷冻干燥,得到冻干制剂;
在本实施例的基础上,修改绞股蓝皂苷(百分含量为85%),粘结剂为聚氨基酸(百分含量为0.01%),或者修改绞股蓝皂苷(百分含量为50%),粘结剂为聚氨基酸(百分含量为20%),均可得到相同性质的固体饮料。
实施例6
一种冻干制剂,该冻干制剂作为固体饮料(冲剂或速溶片剂均可)使用,具有抗疲劳功能;该冻干制剂中三萜皂苷为紫菀皂苷hb(百分含量为80%),粘结剂为无机物凝胶剂(百分含量为10%),辅料为羧甲基淀粉钠(百分含量为2%),活性成分为精氨酸(百分含量为1%)和鹿茸多肽(百分含量为1%)。该固体饮料的崩解时间为5s,溶解时间小于12s,50s内溶出量大于95%。
所述冻干制剂通过以下步骤制备:
a)制备软冰混合物:按设定比例将紫菀皂苷hb、羧甲基淀粉钠与水混合得到前配液将前配液进行凝冻,得到软冰混合物;
b)将精氨酸、鹿茸多肽和泡腾剂,作为干粉;
e)将软冰混合物、冰粉混合,得到的所有软冰混合物;
f)使用片剂形模具定型,得到定型后的混合物,脱模;
g)对混合物进行冷冻干燥,得到固体饮料。
在本实施例的基础上,修改紫菀皂苷hb(百分含量为70%),粘结剂为无机物凝胶剂(百分含量为10%),或者修改紫菀皂苷hb(百分含量为80%),粘结剂为无机物凝胶剂(百分含量为0.01%),均可得到相同性质的固体饮料。
在实施例4-6的基础上,在本发明的范围内,改变三萜皂苷、粘结剂、辅料或者活性成分进行种类和含量,均可实现固体饮料的崩解时间小于10s,溶解时间小于15s,1min内溶出量大于90%。
实施例7
一种冻干制剂,该冻干制剂作为非洗护用护肤品(具体为美白抗老精华)使用,具有美白抗老的功能;该冻干制剂中三萜皂苷为轮叶党参皂苷i(百分含量为0.1%),粘结剂为纤维素醚类(百分含量为2%),辅料为透皮吸收促进剂(百分含量为0.2%)和肤感改良剂(百分含量为5%),活性成分为甾体皂苷(百分含量为0.1%)和水解珍珠(百分含量为1%)。该非洗护用护肤品的崩解时间为5s,溶解时间小于12s,50s内溶出量大于95%。
所述冻干制剂通过以下步骤制备:
a)制备软冰混合物:按设定比例将轮叶党参皂苷i、纤维素醚类与水混合得到前配液将前配液进行凝冻,得到软冰混合物;
b)将透皮吸收促进剂、肤感改良剂、甾体皂苷和水解珍珠,作为干粉;
e)将软冰混合物、冰粉混合,得到的所有软冰混合物;
f)使用片剂形模具定型,得到定型后的混合物,脱模;
g)对混合物进行冷冻干燥,得到非洗护用护肤品。
使用该非洗护用护肤品时,利用1-3ml水、化妆水或精华将其溶解,得到精华、膏霜乳或身体乳,涂抹于身体相应位置的表皮上,具有美白抗衰老的功效。
在本实施例的基础上,修改三萜皂苷为轮叶党参皂苷i(百分含量为0.004%),粘结剂为纤维素醚类(百分含量为0.01%),或者修改三萜皂苷为轮叶党参皂苷i(百分含量为30%),粘结剂为纤维素醚类(百分含量为50%),或者修改修改三萜皂苷为轮叶党参皂苷i(百分含量为10%),粘结剂为纤维素醚类(百分含量为10%),或者修改三萜皂苷为轮叶党参皂苷i(百分含量为0.1%),粘结剂为纤维素醚类(百分含量为3%)均可得到相同性质的非洗护用护肤品。
在实施例7的基础上,在本发明的范围内,改变三萜皂苷、粘结剂、辅料或者活性成分进行种类和含量,均可实现冻干制剂的崩解时间为5s,溶解时间小于12s,50s内溶出量大于95%。
以上实施例1-3的包装可为双铝、铝塑或高阻隔高分子泡罩装,实施例4-6的包装可为铝塑封口或膜封口的玻璃或金属容器。实施例7的包装可为金属材质的易拉罐。
以上所述仅是本发明的优选实施方式,应当指出的是,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!