用于治疗胆管癌的喹啉衍生物的制作方法
本发明属于医药
技术领域:
,具体涉及喹啉衍生物在制备用于治疗胆管癌的药物或药物组合物中的用途。
背景技术:
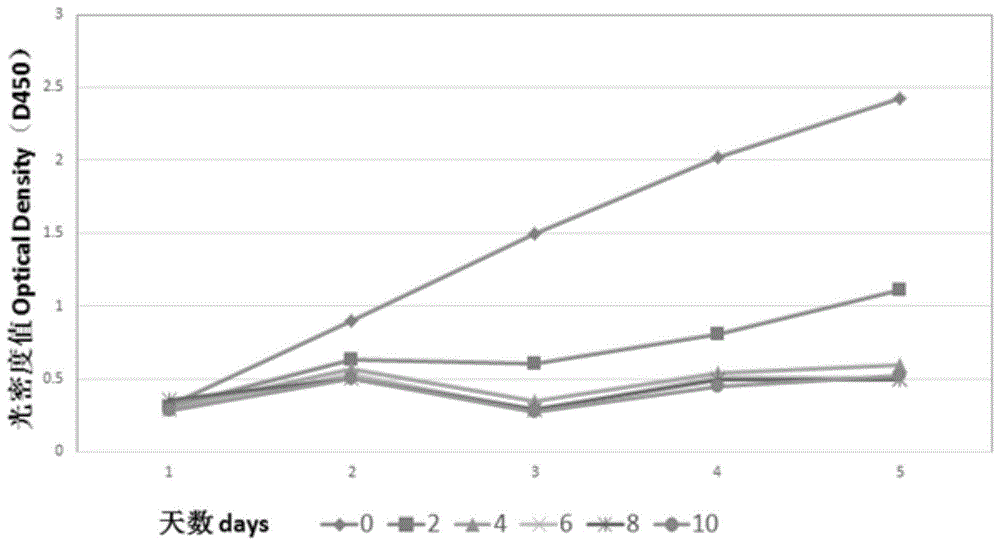
:胆管癌是一类起源于上皮细胞的恶性肿瘤,医学上,胆管癌根据解剖位置的不同分为:肝门部胆管癌(perihilarcholangiocarcinoma,pha)、远端胆管癌(distalcholangioearcinoma,dcca)和肝内胆管癌(intrahepaticcholangiocarcinoma,icca),其中肝门部胆管癌最为常见。nataliya等人在lancet.jun21,2014;383(9935):2168–2179中指出,所有亚型的胆管癌首选手术治疗,但如果注意到的话,还要考虑肿瘤是否侵犯了血管和淋巴结,胆管癌高度促结蹄组织增生能力、丰富的肿瘤微环境和深远的遗传异质性,都有助于其对治疗的抵抗。虽然手术和根治性肝移植是肝门部胆管癌患者的首选,但5年生存率仍然非常低。吉西他滨和顺铂的化疗方案通常用于不可手术的疾病。局部治疗用于肝内胆管癌,但缺乏有效性的确凿证据。现实中,由于早期诊断困难,胆管癌确诊时多为晚期,因此只有不到10%的患者能够耐受手术治疗。技术实现要素:一方面,本发明提供了一种治疗胆管癌的方法,所述方法包括给予需要治疗的患者治疗有效量的式(i)化合物或其药学上可接受的盐。式(i)化合物的化学名为1-[[[4-(4-氟-2-甲基-1h-吲哚-5-基)氧基-6-甲氧基喹啉-7-基]氧基]甲基]环丙胺,其具有如下的结构式:另一方面,本发明提供了化合物(i)或其药学上可接受的盐在制备用于治疗胆管癌的药物或药物组合物中的用途。在本发明的一些具体实施方案中,提供了化合物(i)或其药学上可接受的盐在制备用于治疗肝门部胆管癌的药物或药物组合物中的用途,所述用途包括给予需要治疗的患者治疗有效量的式(i)化合物或其药学上可接受的盐。在本发明的一些具体实施方案中,提供了化合物(i)或其药学上可接受的盐在制备用于治疗远端胆管癌的药物或药物组合物中的用途,所述用途包括给予需要治疗的患者治疗有效量的式(i)化合物或其药学上可接受的盐。在本发明的一些具体实施方案中,提供了化合物(i)或其药学上可接受的盐在制备用于治疗肝内胆管癌的药物或药物组合物中的用途,所述用途包括给予需要治疗的患者治疗有效量的式(i)化合物或其药学上可接受的盐。在本发明的一些具体实施方案中,提供了化合物(i)或其药学上可接受的盐在制备用于预防和/或治疗中和/或低分化型胆管癌的药物或药物组合物中的用途,所述用途包括给予需要治疗的患者治疗有效量的式(i)化合物或其药学上可接受的盐。在本发明的一些具体实施方案中,提供了化合物(i)或其药学上可接受的盐在制备用于预防和/或治疗腺癌型胆管癌的药物或药物组合物中的用途,所述用途包括给予需要治疗的患者治疗有效量的式(i)化合物或其药学上可接受的盐。在本发明的一些具体实施方案中,提供了化合物(i)或其药学上可接受的盐在制备用于治疗晚期和/或转移性胆管癌的药物或药物组合物中的用途,所述用途包括给予需要治疗的患者治疗有效量的式(i)化合物或其药学上可接受的盐。在本发明的一些具体实施方案中,提供了化合物(i)或其药学上可接受的盐在制备用于预防和/或治疗胆管癌复发的药物或药物组合物中的用途,所述用途包括给予需要治疗的患者治疗有效量的式(i)化合物或其药学上可接受的盐。在本发明的一些具体实施方案中,所述胆管癌的患者既往已接受过化疗、小分子靶向治疗和/或放疗;在本发明的一些优选实施方案中,所述胆管癌的患者既往接受过化疗、小分子靶向治疗和/或放疗后疾病发生进展;在本发明的一些更优选实施方案中,所述胆管癌的患者既往已接受过的化疗剂包括吉西他滨、奥沙利铂、顺铂、5-氟脲嘧啶、紫杉醇和/或替吉奥;所述胆管癌的患者既往已接受过的小分子靶向治疗剂为舒尼替尼。化合物(i)可以以它的游离碱形式给药,也可以以其盐、水合物和前药的形式给药,该前药在体内转换成化合物(i)的游离碱形式。例如,化合物(i)的药学上可接受的盐在本发明的范围内,可按照本领域公知的方法由不同的有机酸和无机酸产生所述盐。在本发明的一些具体实施方案中,以化合物(i)的盐酸盐的形式给药。在一些具体的实施方案中,以化合物(i)的一盐酸盐或二盐酸盐的形式给药。在一些具体的实施方案中,以化合物(i)的盐酸盐的晶体形式给药。在一些具体的实施方案中,以化合物(i)的二盐酸盐的晶体形式给药。式(i)化合物或其药学上可接受的盐可通过多种途径给药,该途径包括但不限于:口服、肠胃外、腹膜内、静脉内、动脉内、透皮、舌下、肌内、直肠、透颊、鼻内、经吸入、阴道、眼内、经局部、皮下、脂肪内、关节内和鞘内。在一些具体的实施方案中,通过口服给药,具体剂型包括但不限于片剂、胶囊剂、粉剂、颗粒剂、滴丸、糊剂、散剂等,优选片剂和胶囊剂。其中片剂可以是普通片剂、分散片、泡腾片、缓释片、控释片或肠溶片,胶囊剂可以是普通胶囊、缓释胶囊、控释胶囊或肠溶胶囊。所述的口服制剂可使用本领域公知的药学上可接受的载体通过常规方法制得。药学上可接受的载体包括但不限于填充剂、吸收剂、润湿剂、粘合剂、崩解剂、润滑剂等。填充剂包括淀粉、乳糖、甘露醇、微晶纤维素等;吸收剂包括但不限于硫酸钙、磷酸氢钙、碳酸钙等;润湿剂包括水、乙醇等;粘合剂包括但不限于羟丙甲纤维素、聚维酮、微晶纤维素等;崩解剂包括但不限于交联羧甲基纤维素钠、交联聚维酮、表面活性剂、低取代羟丙基纤维素等;润滑剂包括但不限于硬脂酸镁、滑石粉、聚乙二醇、十二烷基硫酸钠、微粉硅胶、滑石粉等。药用辅料还包括着色剂、甜味剂等。在本发明的一些具体实施方案中,给予患者的日剂量可为2毫克至20毫克;在一些具体的实施方案中,给予患者的日剂量为5毫克至20毫克;在一些具体的实施方案中,给予患者的日剂量为10毫克至16毫克;在本发明的一些具体实施方案中,给予患者的日剂量为10毫克至14毫克;在一些具体的实施方案中,给予患者的日剂量为8毫克、10毫克、12毫克、14毫克或16毫克。在上述治疗方法中,可以单剂量或多剂量每日一次或多次给予式(i)化合物或其药学上可接受的盐。在本发明的一些具体实施方案中,每天一次给予式(i)化合物或其药学上可接受的盐。给予式(i)化合物或其药学上可接受的盐的量可根据疾病的严重程度、疾病的响应、任何治疗相关的毒性、患者的年龄和健康状态来确定。优选的,以间隔给药的方式给予式(i)化合物或其药学上可接受的盐,所述的间隔给药包括给药期和停药期,在给药期内可以每天一次或多次给予式(i)化合物或其药学上可接受的盐。例如,在给药期内每天给予式(i)化合物或其药学上可接受的盐。然后停药期内停止给药一段时间,接着给药期,然后停药期,如此可以反复进行多次。其中给药期和停药期的以天数计的比值为2:0.5-5,优选2:0.5-3,进一步优选2:0.5-2,更优选2:0.5-1。在一些具体的实施方案中,连续给药2周停药2周。在一些具体的实施方案中,每天给药1次,持续给药14天,然后停药14天;接着每天给药1次,持续给药14天,然后停药14天,如此以连续给药14天停药14天的间隔给药方式可以反复进行多次。在一些具体的实施方案中,连续给药2周停药1周。在一些具体的实施方案中,每天给药1次,持续给药14天,然后停药7天;接着每天给药1次,持续给药14天,然后停药7天,如此以连续给药14天停药7天的间隔给药方式可以反复进行多次。在一些具体的实施方案中,连续给药5天停药2天。在一些具体的实施方案中,每天给药1次,持续给药5天,然后停药2天;接着每天给药1次,持续给药5天,然后停药2天,如此以连续给药5天停药2天的间隔给药方式可以反复进行多次。在一些实施方案中,式(i)化合物或其药学上可接受的盐是作为唯一的活性成分单独给予胆管癌患者的。在一些实施方案中,式(i)化合物或其药学上可接受的盐与其他抗肿瘤药物同时或依照次序给予胆管癌患者。在一些实施方案中,其他抗肿瘤药物包括但不限于烷化剂、铂配合物、氟嘧啶衍生物、喜树碱及其衍生物、蒽醌类抗肿瘤抗生素、紫杉烷类化合物或单抗类抗癌药物。另一方面,本发明提供了式(i)化合物或其药学上可接受的盐在制备用于治疗胆管癌的药物组合物中的用途。再一方面,本发明提供了一种治疗胆管癌的药物组合物,其包含式(i)化合物或其药学上可接受的盐,以及至少一种药学上可接受的载体。再一方面,本发明提供了一种试剂盒,其包含(a)至少一个单位剂量的式(i)化合物或其药学上可接受的盐的药物组合物和(b)用于治疗胆管癌的说明书。本文中,除非另有说明,这里提供的剂量和范围都是基于化合物i的游离碱形式的分子量。本文中,所述的化合物i的盐酸盐的晶体形式包括但不限于中国专利申请cn102344438a公开的a、b和c型结晶,其中a和b型结晶为基本上不含结晶水和其它溶剂的结晶,c型结晶为含两个结晶水的结晶。在一些实施方案中,所述的化合物i的二盐酸盐的晶体形式为a型结晶。除非另有说明,为本申请的目的,本说明书和权利要求书中所用的下列术语应具有下述含义。“患者”是指哺乳动物,优选人。“药学上可接受的”是指其用于制备药物组合物,该药物组合物通常是安全、无毒的并且既不在生物学上或其它方面不合乎需要,并且包括其对于人类药物使用是可接受的。“药学上可接受的盐”包括,但不限于与无机酸如盐酸、氢溴酸、硫酸、硝酸、磷酸等等形成的酸加成盐;或者与有机酸如乙酸、三氟乙酸、丙酸、己酸、庚酸、环戊烷丙酸、乙醇酸、丙酮酸、乳酸、丙二酸、琥珀酸、苹果酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、1,2-乙二磺酸、2-羟基乙磺酸、苯磺酸、对氯苯磺酸、对甲苯磺酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、十二烷基硫酸、葡糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸等形成的酸加成盐。“治疗有效量”意指化合物被给予人用于治疗疾病时,足以实现对该疾病控制的使用量。“治疗”意指治疗上有效量的化合物的任何施用,并且包括:(1)抑制正经历或显示出所述疾病的病理学或症状学的人体中的该疾病(即,阻止所述病理学和/或症状学的进一步发展),或(2)改善正经历或显示出所述疾病的病理学或症状学的人体中的该疾病(即逆转所述病理学和/或症状学)。“cr”是指完全缓解,具体指肿瘤的靶病灶小时,无新病灶出现,且肿瘤标志物正常,至少维持4周。“pr”是指部分缓解,具体指肿瘤的靶病灶直径之和比基线水平减少30%以上,至少维持4周。“pd”是指疾病进展,具体指肿瘤的靶病灶直径之和比基线水平增加20%以上。“sd”是指疾病稳定,具体指肿瘤的靶病灶减少程度没达到pr水平,增加的程度也没达到pd水平,介于两者之间。“qd”是指每天服药一次。“bid”是指每天服药两次“晚期”包括“局部晚期”。附图简要说明图1显示的是实施例3中的cck-8法测得的细胞生长增殖曲线图2显示的是实施例4中所测的各组裸鼠的平均体重变化曲线图3显示的是实施例4中裸鼠处死后被剥离肿瘤的照片图4显示的是实施例4中裸鼠处死后的各组裸鼠被剥离肿瘤的平均瘤重柱状图具体实施方式实施例11-[[[4-(4-氟-2-甲基-1h-吲哚-5-基)氧基-6-甲氧基喹啉-7-基]氧基]甲基]环丙胺二盐酸盐参照wo2008112407中实施例24的方法制备得到1-[[[4-(4-氟-2-甲基-1h-吲哚-5-基)氧基-6-甲氧基喹啉-7-基]氧基]甲基]环丙胺,然后参照说明书中盐形式的实施例的制备方法,制备得到标题化合物。实施例21-[[[4-(4-氟-2-甲基-1h-吲哚-5-基)氧基-6-甲氧基喹啉-7-基]氧基]甲基]环丙胺二盐酸盐(实施例1化合物)的胶囊的制备将实施例1化合物粉碎,过80目筛;然后与甘露醇、羟丙纤维素混合均匀;接着加入处方量的微晶纤维素,混合均匀,过0.8mm筛网;最后加入处方量的硬脂酸镁混合均匀,并填充胶囊。对于化合物i的二盐酸盐为其它含量的胶囊,可参照上述相同的比例和处方制备得到。实施例3细胞实验以实施例1化合物为测试药,用ckk-8(cellcountingkit-8)法测本发明对人胆管细胞癌细胞系huh28增殖抑制试验:将胰蛋白酶消化过的细胞悬液以每孔100μl体积,3000个细胞每孔接种于96孔板,边缘用无菌pbs擦净,贴壁24h后,更换培养基(rmpi1640培养基),每孔添加100μl梯度浓度药物配比的培养液,设6个浓度,分别为:0、2、4、6、8、10μm。置于37℃、5%co2培养箱中培养。加药后每24h使用cck-8测量细胞活性,即加入1:10稀释的cck-8,37℃培养2h,最后用自动酶标仪在450nm波长处检测各孔的光密度值。根据测定的光密度,制作细胞生长增殖曲线(参见附图1)。通过本实施例可知,与0μm的不含药组相比,含药组均表现出对huh28明显的细胞增殖抑制作用,即实施例1化合物对胆管细胞癌细胞系huh28具有明显的抑制作用。实施例4动物实验在无菌条件下,取对数生长期的人胆管细胞癌细胞系huh28,接种于balb/c裸鼠皮下,接种数为1.5*106个细胞/只。接种后第三天将动物随机分组并开始灌胃给药实施例1化合物,分为溶媒对照组(control)、低剂量组(5mg/kg)、高剂量组(10mg/kg),每组6只。每周一到周五给药,并称鼠重(参见附图2)、测量肿瘤长短径,记录数据(具体操作见表1)。接种后第21天,处死小鼠,拍照(参见附图3),剥离肿瘤,称量肿瘤重量(参见附图4),可知。表1动物实验操作记录表天数操作1称重、量瘤2称重、量瘤3称重、量瘤、给药6称重、量瘤、给药7称重、量瘤、给药8称重、量瘤、给药9称重、量瘤、给药10称重、量瘤、给药13称重、量瘤、给药14称重、量瘤、给药15称重、量瘤、给药16称重、量瘤、给药17称重、量瘤、给药20称重、量瘤、给药21称重、量瘤、给药通过本实施例可知,与对照组(control)相比,低剂量组(5mg/kg)和高剂量组(10mg/kg)裸鼠的肿瘤生长得到了明显的抑制,表现出对huh28明显的细胞增殖抑制作用;且低剂量组(5mg/kg)和高剂量组(10mg/kg)的裸鼠体重在经历21天给药后仅轻微降低,提示裸鼠对该药物耐受性良好。即实施例1化合物对胆管细胞癌细胞系huh28具有明显的抑制作用,该化合物毒性低,具有良好的治疗胆管癌的临床应用前景。实施例5临床试验入组标准1)经病理和/或细胞学明确诊断的晚期恶性肿瘤患者;2)缺乏常规有效治疗方法或常规方法治疗后失败或复发;3)18~70岁;ecogps评分:0~1分;预计生存期超过3月;4)以往使用过其它化疗药物者,需停药30天以上。如化疗药物为亚硝基脲类和丝裂霉素c,需停药6周以上。接受过大手术者需手术4周以后;5)实验室检查符合下列标准:血常规检查:hb≥90g/l(14天内未输血);anc≥1.5×109/l;plt≥80×109/l生化检查:血清肌酐cr≤1.5正常值上限(uln)、胆红素bil≤1.5×uln、alt、ast≤2.5×uln,对于有肝转移者≤5×uln;甘油三酯≤3.0mmol/l,胆固醇≤7.75mmol/l;多普勒超声评估:左室射血分数(lvef)≥正常值低限(50%)。6)女性应为同意在研究期间和研究结束后6个月内必须采用避孕措施(如宫内节育器[iud],避孕药或避孕套);在研究入组前的7天内血清或尿妊娠试验阴性,且必须为非哺乳期患者;男性应同意在研究期间和研究期结束后6个月内必须采用避孕措施的患者。7)患者自愿加入本研究,签署知情同意书,依从性好。一名55岁男性患者,就诊行腹核磁检查发现肝门区占位,压迫胆管,考虑恶性病变。随即行“围肝门切除、扩大左半肝切除、门静脉重建胆肠吻合术”,术后病理为:肝门区胆管中-低分化腺癌,淋巴结转移4/5。1个多月后开始全身化疗吉西他滨+奥沙利铂/14天×6周期,疗后复查未见明确异常,随后口服舒尼替尼治疗2月,2个月后开始口服替吉奥胶囊60mgbidd1-14/21天×3周期,疗后复查未见明确异常。后出院休息,数月后复查提示右侧腹腔多发结节,大者1.3×1.2cm,余腹腔多发小斑片影,倾向腹膜转移。考虑腹腔多发转移。随后开始每日一次口服12mg(连续用两周停一周为一个治疗周期)剂量的实施例1化合物的胶囊进行治疗。在服用实施例1化合物的胶囊前的ct扫描中,靶病灶直径之和为15mm(网膜转移瘤),右肺、右锁骨上淋巴结多发转移(非靶病灶)。在其后的治疗过程进行的ct扫描中,开始治疗二周期后影像学检查示转移灶直径之和降至12mm(网膜转移瘤),非靶病灶稳定;四周期用药后直径之和为12mm(网膜转移瘤),非靶病灶稳定,疗效评价为sd;六周期用药后直径之和降至10mm(网膜转移瘤),非靶病灶稳定,疗效评价为pr;八周期用药后直径之和为11mm(网膜转移瘤),非靶病灶稳定,疗效评价为sd;十一周期用药后直径之和降至11mm(网膜转移瘤),非靶病灶稳定,疗效评价为sd;十四周期用药后疗效评价为sd,继续给予实施例1化合物的胶囊治疗,在第十五周期用药期间,患者无明显诱因突发晕厥,1分钟后意识恢复,诊断为:急性心肌梗死,给予抗栓治疗,停用安罗替尼;患者服用实施例1化合物的胶囊期间,总体耐受性良好,主要不良反应为ii°高血压、i°贫血、i°胆红素升高、i°白细胞计数降低。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1