一种弹性膜、其制备方法和应用与流程
本发明属于医疗器械领域,涉及一种弹性膜、制备方法和应用。
背景技术:
子宫是产生月经和孕育胎儿的器官,位于骨盆腔中央,是女性独有的脏器。子宫大小与年龄及生育有关,未产者约长7.5cm、宽5cm、厚3cm,子宫可分为底、体与颈三个部分。宫腔呈倒置三角形,深约6cm,上方两角为“子宫角”,通向输卵管。下端狭窄为“峡部”,长约1cm。
流产、放取环、手术等宫腔操作、以及感染等原因,会引起子宫区域发生各种病变,子宫疾病是女性最常见的疾患之一,严重影响到患者的正常生活和健康,进而影响孕育新生命的能力。这些病变包括,子宫内膜炎、子宫内膜异位症、子宫肥大、子宫息肉、子宫肌瘤、子宫囊肿、子宫脱垂、子宫内膜癌等。
药物治疗对上述病变治疗的效果有限,随着微创技术在手术领域的迅速发展,宫腔镜检查和手术在妇科诊疗领域得到了广泛的推广,创伤小、术中出血少等一系列的优势,使宫腔镜称为微创外科手术重要的组成部分。
然而,大部分手术都要对宫腔造成损伤,息肉、肌瘤、囊肿、粘连切除,刮宫等一系列操作都可能会导致子宫内膜基底层受损,导致内膜纤维化和宫腔粘连。
子宫主要组成部分是肌肉,宫体的前壁和后壁几乎相互接触,中间的子宫腔仅为一裂缝。宫体壁由三层组织所组成,即浆膜层、肌肉层和黏膜层;黏膜层即子宫内膜层,又可分为三层,致密层、海绵层和基底层。致密层和海绵层是由基底层再生的增殖带,合称为功能层,对性激素敏感,在卵巢激素的影响下发生周期性变化,若未受孕则功能层在每一周期最后脱落伴子宫出血,临床上表现为月经来潮。基底层紧贴肌肉层,对卵巢激素不敏感,无周期性变化。正常子宫内膜腺体可分泌稀薄的碱性液体,以保持宫腔潮湿,因此,正常子宫前壁和后壁虽然离得很近,但不会粘连和生长在一起。
宫内手术后,子宫内膜基底层受损,特别是相同位置的前壁和后壁同时受损,宫腔即发生粘连。目前一致认为,对妊娠子宫的创伤是宫腔粘连的主要原因。创伤经常发生在产后或流产后1-4周因过量出血需刮宫者。在此易感期,任何创伤都可引起子宫内膜基底层脱落,导致子宫壁相互粘着,形成永久粘连,致使子宫变形和对称性消失。其次,对非孕子宫内膜的创伤也可以引起宫腔粘连。文献报道,宫腔粘连可以发生在诊断性刮宫、开腹肌瘤剔除、宫颈活检、子宫内膜息肉取出术、宫内置避孕器或者应用放射线治疗后。此外宫腔粘连还可以发生在各种宫腔镜手术后,例如宫腔镜下子宫肌瘤切除术、子宫纵膈切除术后等。
由此可见,在微创手术后,由于宫腔受损,相对创面贴合后粘连在一起的几率很大,宫腔粘连后经血无法畅通排出,育龄女性没有办法正常受孕,通常的方法是再次采用宫腔镜粘连切开术将粘连部位分割开来。但是,尽管宫腔镜手术得到了广泛应用,宫腔粘连的治疗仍然十分困难,宫腔粘连治疗的预后仍不理想,宫角等部位粘连或严重宫腔粘连,即便经过了宫腔分离术,仍然很容易出现复发现象,很难根治。而宫腔粘连术后妊娠为具有高度流产危险和胎盘异常的高危妊娠,需密切监护,防治并发症出现。因此,宫腔粘连的治疗不仅包括宫腔镜手术恢复宫腔正常形态,还应采取措施促进子宫内膜修复,预防宫腔粘连复发,最终恢复患者正常生活和生育功能。
目前对宫腔粘连分离术后预防再次粘连有众多的方法和手段,主要有,药物治疗、宫内屏障介质、球囊扩张法、生物胶治疗、羊膜移植、纤维宫腔镜探查及钝性分离术。但至今仍缺乏能绝对有效完全避免再次粘连的方法,也缺乏一个统一的治疗标准。
口服雌二醇药物对预防粘连有效果,但由于口服药物的肝脏首过效应,再加上盆腔血液循环系统的相对独立性,导致口服性激素药物大部分被肝脏截留,全身血药浓度不高,而尤其到达子宫内部的浓度甚低,生物利用度很低。
临床有很多透皮给药的案例,有文献显示口服4mg(2mgbid)戊酸雌二醇,血清雌二醇(简称e2)测值上升211.89±57.40pg/ml。阴道外用0.5mg芬吗通雌二醇,血清雌二醇测值上升201.01±51.196pg/ml,阴道外用1mg芬吗通雌二醇,血清中雌二醇测值约589.65pg/ml,观察已知芬吗通雌二醇阴道用药吸收效果可达口服的约10~20倍。
戊酸雌二醇或雌二醇经阴道给药时,雌激素能快速有效地被阴道粘膜吸入血。戊酸雌二醇在阴道用药时,通过血液中的酯酶解链,这个过程十分迅速,但由于阴道粘膜的吸收效率,对吸收利用稍有影响。一般认为戊酸雌二醇的阴道用药约为口服效应的4~8倍左右。口服时,雌激素有95%被肝脏代谢失活,而阴道内雌激素吸收后,通过阴道静脉直接进入下腔静脉,不经过肝门静脉,从而避免了肝脏的首过效应。经阴道给药可以避免雌二醇在肠、肝脏大量被转变为雌酮(简称e1),使e2/e1更近生理比值。阴道用药时,e2直接作用于内膜相关受体,对内膜局部产生影响。
这些事例表明,子宫内靶向用药可以达到小剂量,高效率的效果。
上述众多治疗方法大部分只是暂时性的将粘连几率降低,等到器械或药物作用消失后,再次粘连的概率很大,特别是对于中重度粘连患者。而增长子宫内膜,特别是增长已破坏到基底层的内膜是个难题,大剂量的口服药物对破坏了基底层的内膜作用甚微,而且对患者有很大副作用。子宫内膜厚度不足,是不孕症的主要因素之一。因此,如何激活基底层细胞,使其再次活化分化出功能层,使内膜厚度达到合理受孕的厚度,是防止粘连和恢复生育能力的关键。
因此,开发一种缓释效果好,且能够治疗子宫损伤的弹性模非常有必要。
技术实现要素:
本发明的目的在于提供一种弹性膜、其制备方法和应用,所述的弹性膜具有较久的试药周期,能实现药物的稳态释放且控释更均匀,此外能通过小剂量的用药量从而达到高效的治疗效果;通过调节控制控释膜和药芯弹性膜中硅橡胶的弹性模量,从而使弹性膜具有较好的弹性,并能达到较低药物释放量,适合微量药物的释放;弹性膜的制备方法简单,原料易得,易于实现,在治疗子宫损伤具有较好的效果,便于工业大规膜生产应用;弹性膜制备的子宫内植入物通过将弹性膜植入子宫内部,达到较好的治疗效果,且能有效避免基质型弹性膜自身的粘连,从而达到和子宫较好的贴合,从而达到更好的治疗效果。
为达到此发明目的,本发明采用以下技术方案:
本发明的目的之一在于提供一种弹性膜,所述弹性膜包括硅橡胶和药物,所述药物以储药区的方式被包覆在硅橡胶内部,所述药物包括雌激素。
在本发明中,所述硅橡胶的厚度为0.02-1mm,例如0.02mm、0.05mm、0.08mm、0.1mm、0.3mm、0.5mm、0.8mm、1mm等,优选0.02-0.3mm。
在本发明中,所述硅橡胶的弹性模量为0.5-1.2mpa,例如0.5mpa、0.6mpa、0.7mpa、0.8mpa、0.9mpa、1.0mpa、1.1mpa、1.2mpa等,优选0.5-0.8mpa。
在本发明中,所述硅橡胶的交联密度1000-5000g/mol,例如1000g/mol、1500g/mol、2000g/mol、2500g/mol、3000g/mol、3500g/mol、4000g/mol、4500g/mol、5000g/mol等,优选1000-3000g/mol。
在本发明中,所述硅橡胶包括热硫化硅橡胶、室温硫化硅橡胶、低温硫化硅橡胶、美国道康宁silastic-382医用级硅橡胶、美国道康宁q7医用级硅橡胶系列或植入级mdx系列中的任意一种或至少两种的组合。
在本发明中,所述硅橡胶包括自改性htv硅橡胶、rtv固体硅橡胶、ltv固体硅橡胶、rtv液态硅橡胶或ltv液态硅橡胶中的任意一种或至少两种的组合。
在本发明中,所述储药区的厚度为0.2-1mm,例如0.2mm、0.3mm、0.4mm、0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1.0mm等。
在本发明中,所述储药区边缘至硅橡胶边缘的最短距离为0.5-5mm,例如0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、2mm、3mm、4mm、5mm等。
在本发明中,所述储药区包括反应型储药区和混合型储药区。
在本发明中,所述储药区为反应型储药区,所述储药区包括基质和药物
在本发明中,所述储药区为反应型储药区,所述基质和药物的质量比为(50-99%):(50%-1%),例如50%:50%、55%:45%、60%:40%、65%:35%、70%:30%、75%:25%、80%:20%、85%:15%、90%:10%、95%:5%、99%:1%等。
在本发明中,所述基质为药芯用硅橡胶。
在本发明中,所述药芯用硅橡胶的弹性模量为0.9-1.5mpa,例如0.9mpa、1.0mpa、1.1mpa、1.2mpa、1.3mpa、1.4mpa、1.5mpa等。
本发明中弹性膜通过药物微量释放,从而达到高效率的治疗效果,且药物释放更稳定,具有较久的释药周期和较好的缓释能力,用于子宫宫腔损伤的治疗。
本发明中,通过控制硅橡胶,从而控制药物的微量释放从而达到治疗效果;当储药区为反应型时,药物通过基质(如药芯用硅橡胶)进行第一阶段缓释,后经过所述硅橡胶进行第二阶段缓释,从而更好地控制药物的微粒释放,且释放更稳定,达到较久的试药周期;其中药芯用硅橡胶的弹性模量大于硅橡胶的弹性模量,药芯能够对硅橡胶起到支撑的作用,硅橡胶的弹性模量影响交联度,若弹性模量过大则会影响对药物的释放。
在本发明中,所述混合型储药区包括固态药芯和/或液态药芯。
在本发明中,所述混合型储药区包括药物。
在本发明中,所述混合型储药区还包括辅料和表面活性剂。
在本发明中,所述混合型储药区为固态药芯,所述混合型储药区包括质量百分比为1-80%的药物、10-89%的辅料和0.05-10%的表面活性剂。
在本发明中,所述混合型储药区为固态药芯,所述混合型储药区包括质量百分比为50-80%的药物、19-45%的辅料和1-5%的表面活性剂。
在本发明中,所述混合型储药区为固态药芯,所述辅料包括可可脂、聚乙二醇400-2000、凡士林、羟丙基甲基纤维素、甲基纤维素、乙基纤维素、羟丙基纤维素、滑石粉、微晶纤维粉、淀粉、二氧化硅、糊精、β型环糊精、γ型环糊精、硅橡胶、硬脂酸、硫酸钡、硅酸镁铝、单硬脂酸甘油酯或聚维酮中的任意一种或至少两种的组合。
在本发明中,所述混合型储药区为液态药芯,所述辅料为甘油、石蜡油、二甲基硅油或液态硅橡胶中的任意一种或至少两种的组合。
在本发明中,所述表面活性剂包括司盘20-80、苄泽类52-76、烷基酚聚氧乙烯醚乳化剂、聚乙二醇400-2000、聚维酮、普朗尼克-124、普朗尼克-188、十二烷基硫酸钠、十四烷基磺酸钠、十二烷基磺酸钠、乳糖、硅藻土或三乙醇胺中的任意一种或至少两种的组合。
在本发明中,所述雌激素包括17β雌二醇、雌酮、雌三醇或雌二醇衍生物中的任意一种或至少两种的组合。
在本发明中,所述雌激素包括苯甲酸雌二醇、戊酸雌二醇、炔雌醇、炔雌醚、妊马雌酮、乙烯雌酚、尼尔雌醇或普罗雌烯中的任意一种或至少两种的组合。
在本发明中,所述雌激素的目数为1000-10000目,例如1000目、2000目、3000目、4000目、5000目、6000目、7000目、8000目、9000目、10000目等,优选3000-8000目。
在本发明中,所述药物还包括改善子宫内膜血流药物和/或集落刺激因子。
在本发明中,所述改善子宫内膜血流药物包括阿司匹林、枸橼酸西地那非、己酮可可碱、维生素e、l-精氨酸或低分子肝素中的任意一种或至少两种的组合。
在本发明中,所述集落刺激因子包括粒细胞集落刺激因子和/或粒细胞-巨噬细胞集落刺激因子。
在本发明中,所述雌激素和改善子宫内膜血流药物的质量比为1:(0.1-1),例如1:0.1、1:0.2、1:0.3、1:0.4、1:0.5、1:0.6、1:0.7、1:0.8、1:0.9、1:1等,优选1:(0.3-0.6)。
在本发明中,所述集落刺激因子和雌激素的质量比为(0.05-0.5):1,例如0.05:1、0.1:1、0.15:1、0.2:1、0.25:1、0.3:1、0.35:1、0.4:1、0.45:1、0.5:1等。
在本发明中,所述弹性膜的厚度为0.1-4mm,例如0.1mm、0.5mm、0.8mm、1mm、1.2mm、1.5mm、1.8mm、2mm、2.2mm、2.5mm、2.8mm、3mm、3.2mm、3.5mm、3.8mm、4mm等,优选0.2-1mm。
在本发明中,所述弹性膜的缓释周期为3-90天,例如3天、10天、20天、30天、40天、50天、60天、70天、80天、90天等。
在本发明中,所述弹性膜的形状为倒梯形。
本发明中弹性膜的形状为上端大下端小,植入体内后上端对应子宫宫底部位,下端对应子宫颈子宫内开口部位,便于弹性膜和子宫的有效贴合。
在本发明中,所述倒梯形的高度为25-35mm,例如25mm、26mm、27mm、28mm、29mm、30mm、31mm、32mm、33mm、34mm、35mm等,上底长度为20-40mm,例如20mm、22mm、25mm、27mm、30mm、32mm、35mm、37mm、40mm等,下底长度为5-15mm,例如5mm、6mm、7mm、8mm、9mm、10mm、11mm、12mm、13mm、14mm、15mm等。
本发明的目的之二在于提供一种如目的之一所述弹性膜的制备方法,所述弹性模的制备方法包括:将储药区包覆在硅橡胶内,得到弹性膜。
本发明的制备方法简单、原料易得、价格低廉,适用于工业大规模生产应用。
在本发明中,所述储药区为反应型储药区,所述储药区的制备方法包括:将药芯用硅橡胶和药物混合、交联、固化,得到储药区。
在本发明中,所述交联为硫化交联。
在本发明中,所述交联过程中还包括加入表面活性剂。
在本发明中,所述储药区为反应型储药区,所述弹性模的制备方法还包括:将硅橡胶热压,将反应型储药区置于热压后的硅橡胶上,留出0.5-5mm的封边位置,得到薄膜,取两片得到的薄膜热压或将单片的薄膜翻折热压,得到弹性模。优选地,将反应型储药区置于热压后的硅橡胶上,留出3-5mm的封边位置。
在本发明中,所述储药区为混合型储药区,所述储药区的制备方法包括:将药物、任选的辅料和表面活性剂物理混合,得到混合型储药区。
在本发明中,所述混合型储药区为固态药芯,所述混合时还包括加入水混合。
在本发明中,所述混合型储药区为固态药芯,所述弹性模的制备方法还包括:将硅橡胶热压,将混合型储药区置于热压后的硅橡胶上,留出0.5-5mm的封边位置,得到薄膜,取两片得到的薄膜热压或将单片的薄膜翻折热压,得到弹性模。优选地,将混合型储药区置于热压后的硅橡胶上,留出3-5mm的封边位置
在本发明中,所述混合型储药区为液态药芯,所述弹性模的制备方法包括:将硅橡胶热压成薄膜,取两片薄膜热压或单片薄膜翻折热压,得到预制的硅橡胶囊,而后将液态药芯注入到预制的硅橡胶囊中,得到弹性模。
本发明的目的之三在于提供一种如目的之一所述的弹性模在药物缓释系统中的应用。
相对于现有技术,本发明具有以下有益效果:
本发明中弹性膜通过药物的微量释放,达到高效的治疗效果,且药物释放更稳定,具有较久的试药周期和较好的缓释能力,用于子宫宫腔损伤的治疗;通过控制硅橡胶和药芯用硅橡胶的弹性膜量,一方面便于药芯用硅橡胶对外层硅橡胶的支撑作用,另一方面通过控制外层硅橡胶的弹性模量能够控制药物的微量释放,且释放更稳定,达到较久的试药周期,从而达到更好的治疗效果;弹性膜的制备方法简单,原料易得,价格低廉,便于工业大规膜的生产应用。
附图说明
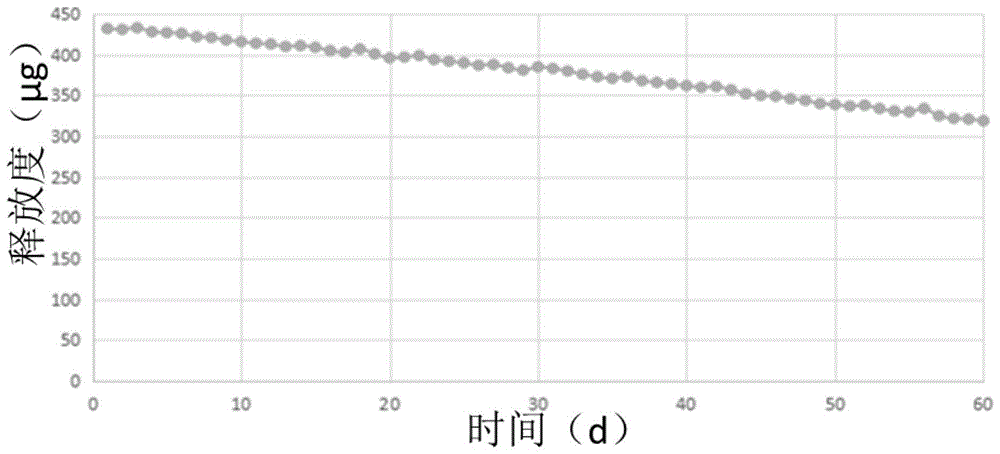
图1是实施例1中弹性膜的药物释放曲线图;
图2是对比例1中弹性膜的药物释放曲线图;
图3是实施例2中弹性膜的药物释放曲线图;
图4是实施例3中弹性膜药物释放曲线图;
图5为实施例4中弹性膜药物释放曲线图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1
本实施例提供一种弹性膜,弹性膜包括储药区以及包覆在储药区表面的硅橡胶,所述储药区包括药芯用硅橡胶和药物,其中硅橡胶的厚度为0.02mm,弹性模量为0.7mpa,交联密度为2000g/mol;储药区的厚度为0.2mm,弹性模量为1.3mpa;储药区边缘至硅橡胶边缘的最短距离为3mm;药物为雌二醇,粒径为2000目;其中一个弹性膜中雌二醇的含量为100mg。
本实施例还提供一种弹性膜的制备方法,所述制备方法如下:
(1)将5g17β雌二醇(平均粒径2000目)、30ghtv医用硅橡胶(分子量20-100万)、10g二氧化硅、5g羟基硅油、6g医用级硫酸钡、0.5g氧化铁红、2g的过氧化苯甲酰在炼胶机上混炼至均匀,在平板硫化机上热压制成厚度0.2mm薄片,然后进行剪裁成需要的形状体积即得到储药区。
(2)将30ghtv医用硅橡胶(分子量20-100万)、10g二氧化硅、5g羟基硅油、6g医用级硫酸钡、0.5g氧化铁红、2g过氧化苯甲酰在炼胶机上混炼至均匀,在平板硫化机上热压制成厚度0.02mm薄片,然后进行剪裁成需要的形状体积即得到外层硅橡胶膜。
(3)将(2)制得的硅橡胶膜包裹在(1)制备的储药区外,在平板硫化机上加热硫化成型,得到弹性膜。
使用药物溶出试验仪对样品在37℃的pbs溶液中进行药物溶出,用hplc测试溶出药物量。
对比例1
与实施例1的区别仅在于所述储药区表面不包裹硅橡胶膜,其余组成与制备方法均与实施例1相同。
图1为实施例1中弹性膜的药物释放曲线,图2为对比例1中弹性模的药物释放曲线图,从图1、图2对比可知,实施例1相较对比例1多在储药区表面多加了一层控释硅橡胶膜,因此,释出量更小,但是每天药物释放会很平缓,没有基质型弹性膜前期爆释的现象,对小剂量长期释放药物治疗有利。
实施例2
本实施例提供一种弹性膜,弹性膜包括储药区以及包覆在储药区表面的硅橡胶,所述储药区包括药芯用硅橡胶和药物,其中硅橡胶的厚度为0.02mm,弹性模量为0.7mpa,交联密度为2000g/mol;储药区的厚度为0.2mm,弹性模量为1.3mpa;储药区边缘至硅橡胶边缘的最短距离为5mm;药物为雌二醇,粒径为2000目;其中一个弹性膜中雌二醇的含量为100mg。本实施例还提供一种弹性膜的制备方法,所述制备方法如下:
(1)将5g17β雌二醇(平均粒径2000目)、3g司盘20、30ghtv医用硅橡胶(分子量20-100万)、10g二氧化硅、5g羟基硅油、6g医用级硫酸钡、0.5g氧化铁红、2g的过氧化苯甲酰在炼胶机上混炼至均匀,在平板硫化机上热压制成厚度0.2mm薄片,然后进行剪裁成需要的形状体积即得到储药区。
(2)将30ghtv医用硅橡胶(分子量20-100万)、10g二氧化硅、5g羟基硅油、6g医用级硫酸钡、0.5g氧化铁红、2g过氧化苯甲酰在炼胶机上混炼至均匀,在平板硫化机上热压制成厚度0.02mm薄片,然后进行剪裁成需要的形状体积即得到外层硅橡胶膜。
(3)将(2)制得的硅橡胶膜包裹在(1)制备的储药区外,使用医用胶粘结,得到弹性膜。
使用药物溶出试验仪对样品在37℃的pbs溶液中进行药物溶出,用hplc测试溶出药物量。
图3为实施例2的弹性膜的药物释放曲线图,从图3可知,通过加入表面活性剂,药物的溶出量会增加,每天药物释放量依然保持平缓。
实施例3
本实施例提供一种弹性膜,弹性膜包括储药区以及包覆在储药区表面的硅橡胶,所述储药区包括药芯用硅橡胶和药物,其中硅橡胶的厚度为0.5mm,弹性模量为0.5mpa,交联密度为5000g/mol;药物为雌二醇和阿司匹林,雌二醇的粒径为5000目;其中一个弹性膜中雌二醇的含量为50mg,阿司匹林的含量为10mg。
本实施例还提供一种弹性膜的制备方法,所述制备方法如下:
(1)将5g17β雌二醇(平均粒径5000目)、1g阿司匹林、3g二氧化硅、0.5g二甲基硅油、0.3g聚维酮和4g蒸馏水混合均匀,取适量体积放在模具中模压成药芯,制成含雌二醇50mg、阿司匹林10mg的储药区。
(2)将30ghtv医用硅橡胶(分子量20-100万)、10g二氧化硅、5g羟基硅油、6g医用级硫酸钡、0.5g氧化铁红、2g过氧化苯甲酰在炼胶机上混炼至均匀,在平板硫化机上热压制成厚度0.5mm薄片,然后进行剪裁成需要的形状体积即得到外层硅橡胶膜。
(3)将步骤(1)得到的储药区放在步骤(2)得到的外层硅橡胶膜中间,放入模具中硫化得产品,手压药芯成均匀粉末状。
使用药物溶出试验仪对样品在37℃的pbs溶液中进行药物溶出,用hplc测试溶出药物量。
图4为本实施例中弹性膜药物释放曲线图,从图4可知,雌二醇和阿司匹林的每天释放量均比较缓。
实施例4
本实施例提供一种弹性膜,储库型弹性膜包括液体药芯以及位于药芯表面的硅橡胶膜,其中硅橡胶的厚度为0.3mm,弹性模量为0.7mpa,交联密度为2000g/mol;药物为雌二醇,粒径为5000目,其中一个弹性膜中雌二醇的含量为75mg。
本实施例还提供一种弹性膜的制备方法,所述制备方法包括如下步骤:
(1)将30ghtv医用硅橡胶(分子量20-100万)、10g二氧化硅、5g羟基硅油、6g医用级硫酸钡、0.5g氧化铁红、2g过氧化苯甲酰在炼胶机上混炼至均匀,在平板硫化机上热压制成厚度0.3mm薄片,然后进行剪裁成需要的形状体积,硫化密封后留一注射口,即得到外层硅橡胶囊。
(2)将2g17β雌二醇(平均粒径5000目)、5g液体硅橡胶、0.5g二甲基硅油和2g甘油混合均匀。用注射器将适量混合液通过注射口注入到第(1)步制得的硅橡胶囊中,排净气泡,用胶密封注射口,得到弹性膜。
使用药物溶出试验仪对样品在37℃的pbs溶液中进行药物溶出,用hplc测试溶出药物量。
图5为本实施例的弹性膜的药物释放曲线图,从图5可知,通过该实施例制备的弹性膜的每天药物释放量相对平缓。
对比例2
与实施例1的区别仅在于所述雌二醇的目数为800目,其余组成以及制备方法均与实施例1相同。
使用药物溶出试验仪对样品在37℃的pbs溶液中进行药物溶出,用hplc测试溶出药物量,可见在30天内,前3天药物溶出最大量雌二醇为175μg/d,后面逐渐平稳趋缓,30天内平均释放度为雌二醇65μg/d。
通过实施例1和对比例2的对比可知,雌二醇目数越大,原料药颗粒越大,比表面积越大,被释放出来的可能性就越小;反之,被释放出来的可能性就越大。原料药的目数分布在500目以上,越大释放量会越大,但是从微粉加工技术考虑,目前10000目以上加工成本高且稳定性难控制,因此常规使用目数不超过10000目以上。
对比例3
与实施例1的区别仅在于所述药芯用硅橡胶的弹性模量为0.5mpa,所述外层硅橡胶的弹性模量量为0.3mpa,交联密度为6000g/mol,其余组成以及制备方法均与实施例1相同。
使用药物溶出试验仪对样品在37℃的pbs溶液中进行药物溶出,用hplc测试溶出药物量,可见在30天内,前3天药物溶出最大量雌二醇为257μg/d,后面逐渐平稳趋缓,30天内平均释放度为雌二醇93μg/d。
取新西兰试验兔试验,在植入子宫前,通过手术方式将子宫刮宫获得创伤模型6只,在植入子宫过程中,弹性膜在子宫内呈现卷曲状态,使用辅助器械铺平。30日后探查子宫,对照组发生不同程度的粘连。
对比例4
与实施例3的区别仅在于所述固态药芯中不添加表面活性剂聚维酮,其余组成以及制备方法均与实施例3相同。
使用药物溶出试验仪对样品在37℃的pbs溶液中进行药物溶出,用hplc测试溶出药物量,可见在30天内,前3天药物溶出最大量雌二醇为169μg/d,阿司匹林为93μg/d,后面逐渐平稳趋缓,30天内平均释放度为雌二醇133μg/d,阿司匹林为58μg/d。
通过实施例3和对比例4可知,通过加入表面活性剂,药物的溶出量会增加,每天药物释放量依然保持平缓。
申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!