稳定的迈华替尼药物组合物及其制备方法与流程
本发明涉及一种稳定的迈华替尼药物组合物及其制备方法。
背景技术:
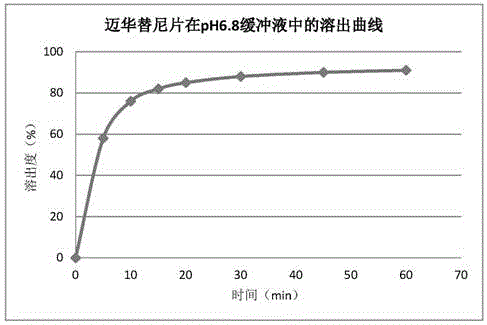
:肿瘤是威胁人类健康的重大疾病,每年在中国有120万新增患者。其中,肺癌已经成为我国恶性肿瘤死亡的首位原因,每年有60万人死于肺癌。表皮生长因子受体(epidermalgrowthfactorreceptor,EGFR,HER1/erbB1)家族是跨膜的受体型酪氨酸激酶中最具有代表性的受体之一,具有广泛的生物学功能。表皮生长因子和转化生长因子-α等多种配体可与EGFR细胞外部分结合,将有丝分裂信号向细胞内传递,从而调控细胞周期,调节细胞正常分化,促进损伤修复。EGFR还可活化其下游的血管表皮生长因子受体(vascularepidermalgrowthfactorreceptor,VEGFR),促进实体瘤微血管网形成。因此EGFR在肿瘤细胞的发生、发展、分化、修复及转移中发挥着重要的作用。研究表明,在乳腺癌、大肠癌、肺癌、头颈部鳞癌和胰腺癌等多种上皮细胞来源的肿瘤中都存在着EGFR基因的异常活化、扩增以及过度表达。人类表皮生长因子受体-2(humanepidermalgrowthfactorreceptor,HER2/neu,erbB-2)是一个跨膜受体,在许多表皮肿瘤如乳腺癌、卵巢癌、前列腺癌、非小细胞肺癌、鼻咽癌等中过度表达,约25%~30%的原发性乳腺癌存在HER2/neu基因的过度表达。迈华替尼(Mefatinib),其化学名称为:2-丁烯醛氨基-N-[4-[(3-氯-4-氟苯基)氨基]-7-二氟甲基氧基]-6-喹唑啉基]-4-(二甲基氨基);分子式:C21H19ClF3N5O2;结构式如下:是一种第二代不可逆EGFR/HER2高效双重抑制剂,具有高活性,高水溶性特点,对第一代EGFR激酶为靶点的药物产生的耐药性有很好的治疗效果(ZL201200785900)。技术实现要素:申请号为201810750822.X的专利申请中提供了一种迈华替尼药物组合物,其说明书中公开了迈华替尼含量为5mg,生产规模为5000片的片剂处方及工艺。发明人经过进一步研究发现,当使迈华替尼的含量达到45mg或更大(比如80mg、120mg)时,若将此专利申请处方中的各组分直接按比例放大,可能导致片剂体积过大的问题。但若直接增加该专利申请处方中迈华替尼的百分含量,因迈华替尼本身具有粘性,则在制剂制备过程中可能会出现粘冲现象,比如含量为45mg片剂,压不到10片就会粘冲,含量为80mg或120mg的粘冲现象更甚。该专利申请提供的迈华替尼制剂处方不适合进行大规格片剂的规模化生产。另外,发明人还发现,上述专利申请的药物组合物的配方制备得到的片剂,在室温(25℃±2℃,RH65%±5%)条件下储存24个月后,其稳定性下降,具体表现为溶出度下降。为解决以上技术问题,发明人经过进一步深入的研究发现,采用硬脂酸镁作为润滑剂,采用乳糖和/或微晶纤维素作为填充剂,能够有效解决迈华替尼药物组合物在大规格片剂的规模化生产中的粘冲问题,同时还保证了很好的质量稳定性。鉴于此,本发明提供一种迈华替尼药物组合物,包括迈华替尼和药用辅料,所述的药用辅料包括润滑剂和填充剂;其特征在于,所述润滑剂包括硬脂酸镁,所述填充剂包括乳糖和/或微晶纤维素。可选地,所述填充剂还包括甘露醇;可选地,所述药用辅料还包括崩解剂,可选地,所述崩解剂包括羧甲淀粉钠或交联羧甲纤维素钠。可选地,所述药物组合物中各组分的重量含量为:迈华替尼8-99%,可选为15-80%,可选为24-60%;可选地,润滑剂0.1-10%,可选为0.5-5%,可选为1-2%;可选地,填充剂0-91.5%,可选为5-65%,可选为30-65%;可选地,崩解剂0-15%,可选为1-10%,可选为1-5%。可选地,所述药物组合物中各组分的重量含量为:硬脂酸镁为0.1-10%,可选为0.5-5%,可选为1-2%;可选地,微晶纤维素为0-91.5%,可选为5-65%,可选为30-65%;可选地,乳糖为0-91.5%,可选为5-65%,可选为30-65%;可选地,所述药物组合物中各组分的重量含量为:硬脂酸镁为1-2%;微晶纤维素为30-65%;乳糖为30-65%。可选地,所述药物组合物为片剂或胶囊剂;可选地,所述片剂为薄膜衣片或糖衣片。可选地,所述药物组合物的单位剂型中迈华替尼的含量为30-120mg,可选为45-80mg,更优选60mg。另一方面,本发明还提供上述药物组合物的制备方法,所述药物组合物为片剂,采用的制备工艺为直接压片法或干法制粒后压片法;所述药物组合物为胶囊剂,采用的制备方法为粉末直接灌装胶囊或干法制粒后灌装胶囊。可选地,所述直接压片法或直接灌装胶囊法包括如下步骤:(1)混合:取处方量的迈华替尼和辅料,加入料斗混合机中混合。(2)压片或灌装胶囊。可选地,所述干法制粒后压片法或干法制粒后灌装胶囊法包括如下步骤:(1)混合:取处方量的迈华替尼和辅料,加入料斗混合机中混合;(2)干法制粒:取混合粉末,在干法制粒机上制粒;(3)压片或灌装胶囊。可选地,所述片剂含有包衣层,包衣层的重量为片剂重量的3%。包衣层采用常规包衣材料,比如欧巴代。另外,在申请号为201810750822.X的专利申请的原辅料相容性试验(DSC扫描法)中,公开了迈华替尼与硬脂酸镁混合物的熔融峰与迈华替尼和硬脂酸镁的熔融峰不对应,二者可能存在相容性问题;微晶纤维素与迈华替尼混合后,产生一个新的吸热峰,二者也可能存在相容性问题。因此,该专利申请中不推荐使用硬脂酸镁作为润滑剂,不推荐使用微晶纤维素作为填充剂。本发明人进一步研究,取迈华替尼与硬脂酸镁(质量比为5:1)、迈华替尼与微晶纤维素(质量比为1:5)物理混合物,于避光、强光(总照度不低于1.2×106Lux.hr,近紫外能量不低于200W.hr/m2)、高温(60℃)、高湿(RH90%±5%)条件下放置10天,分别于第0天、5天和第10天取样检测,考察外观、有关物质的变化情况。结果显示高温高湿和避光下无明显变化,长期放置杂质无明显变化。在迈华替尼药物组合物进行大规格、规模化生产的工艺中,生产的环境温度控制不超过30℃,瞬间温度也不高,因此可以避免迈华替尼与硬脂酸镁以及微晶纤维素的相容性问题。迈华替尼为抗肿瘤药,毒理研究表明,其有一定的副作用,主要表现粘膜毒性。因此上述简单的制片或制胶囊工艺,一方面可以简化生产工艺,提高生产设备的通用性,适应于大生产;另一方面可以进一步的保护工人免受污染,从而降低职业风险的发生。本发明迈华替尼药物组合物中,选择硬脂酸镁作为润滑剂,乳糖和/或微晶纤维素作为填充剂,很好地解决了迈华替尼药物组合物在大规格、规模化生产中的粘冲问题,同时还保证了很好的质量稳定性。附图说明图1是实施例3所得的迈华替尼片的溶出曲线图。具体实施方式以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于示例性地对本发明进行说明,并不用于限制本发明。以下实施例中迈华替尼的规格均以C21H19ClF3N5O2计,处方投量均以迈华替尼二马来酸盐C21H19ClF3N5O2·(C4H4O4)2计。对比例1:参照申请号201810750822.X的申请中实施例1的处方,将迈华替尼的含量由12%提高到27%,同时将乳糖的含量由85%降低到70%,制备45mg迈华替尼片时,出现粘冲情况。处方:制备方法同申请号201810750822.X实施例1,具体为:(1)过筛:取迈华替尼和硬脂酸,分别过100目筛。(2)称量:称取处方量迈华替尼、乳糖和硬脂酸备用。(3)预混:取处方量的迈华替尼、乳糖,加入料斗混合机中,设置速度24rpm,混合20min。(4)干法制粒:取预混粉末,在干法制粒机上制粒,参数设置为:启动压力7MPa,终止压力8MPa,送料速度3~10rpm,压片速度5~10rpm,整粒速度100~150rpm,筛网目数24目。(5)总混:取制得的颗粒和处方量的硬脂酸,加入料斗混合机中混合,设定转速24rpm,混合20分钟,取样检测混合均匀度。(6)融合处理:取总混后的颗粒置恒温鼓风烘箱中进行融合,融合温度为70℃,时间1小时。(7)整粒:取融合后的颗粒,用24目筛进行整粒。(8)压片:选用Ф9.0mm浅凹冲,按理论片重进行压片。结果:当压制到约10片时,开始粘冲,片子表面开始出现芝麻粒状少量缺失现象,并越来越严重。无法完成压片。实施例1:处方:制备方法:(1)混合:按处方量称取迈华替尼和辅料到聚乙烯袋中备用;将称取的迈华替尼和辅料倒入料斗混合机内,设置转速25rpm,混合20分钟;(2)压片:使用合适的冲模,调节填充和片厚,压片。结果:制备过程中未出现压片粘冲的现象,顺利制备出合格的片剂。实施例2:处方:制备方法:(1)混合:按处方量称取迈华替尼和辅料到聚乙烯袋中备用;将称取的迈华替尼和辅料倒入料斗混合机内,设置转速25rpm,混合20分钟;(2)压片:使用合适的冲模,调节填充和片厚,压片;(3)包衣:取0.75Kg欧巴代包衣粉,加入到纯化水中,边加边搅拌,配制成固含量13%的包衣液;将压好的素片放入包衣机内,设置进风温度为70度,雾化压力0.2MPa,包衣增重约3%。结果:制备过程中未出现压片粘冲的现象,顺利制备出合格的片剂。实施例3:处方:制备方法:(1)混合:按处方量称取迈华替尼和辅料到聚乙烯袋中备用;将称取的迈华替尼和辅料倒入料斗混合机内,设置转速25rpm,混合20分钟;(2)压片:使用合适的冲模,调节填充和片厚,压片;(3)包衣:取0.45Kg欧巴代包衣粉,加入到纯化水中,边加边搅拌,配制成固含量13%的包衣液;将压好的素片放入包衣机内,设置进风温度为70度,雾化压力0.2MPa,包衣增重约3%。结果:制备过程中未出现压片粘冲的现象,顺利制备出合格的片剂。实施例4:处方:制备方法:(1)混合:按处方量称取迈华替尼和辅料到聚乙烯袋中备用;将称取的迈华替尼和辅料倒入料斗混合机内,设置转速25rpm,混合20分钟;(2)干法制粒:取上述混合物,用干法制粒机制粒,24目筛整粒;(3)压片:使用合适的冲模,调节填充和片厚,压片;(4)包衣:取0.012Kg欧巴代包衣粉,加入到纯化水中,边加边搅拌,配制成固含量13%的包衣液;将压好的素片放入包衣机内,设置进风温度为70度,雾化压力0.2MPa,包衣增重约3%。结果:制备过程中未出现压片粘冲的现象,顺利制备出合格的片剂。实施例5:处方制备方法:与实施例1相同。结果:制备过程中未出现压片粘冲的现象,顺利制备出合格的片剂。实施例6:处方:制备方法:与实施例1相同。结果:制备过程中未出现压片粘冲的现象,顺利制备出合格的片剂。实施例7:处方制备方法:与实施例1相同。结果:制备过程中未出现压片粘冲的现象,顺利制备出合格的片剂。实施例8:处方:制备方法:(1)混合:按处方量称取迈华替尼和辅料到聚乙烯袋中备用;将称取的迈华替尼和辅料倒入料斗混合机内,设置转速25rpm,混合20分钟;(2)灌装胶囊:采用合适的胶囊壳,灌装胶囊。实施例9:处方:制备方法:与实施例1相同。结果:制备过程中未出现压片粘冲的现象,顺利制备出合格的片剂。试验例1:溶出曲线试验实验方法:取实施例3所得的迈华替尼片,照溶出度测定法(中国药典2015年版第四部通则0931第二法),以900mlpH6.8缓冲液作为溶出介质,转速为每分钟50转,分别在5、10、15、20、30、45、60分钟时,取溶液10ml,同时补充10ml溶出介质,将取出的样品用0.45μm滤膜滤过,弃去2ml,取续滤液稀释成一定浓度作为供试品溶液。照紫外-可见分光光度法(中国药典2015年版四部通则0401)测定,检测波长335nm。另取迈华替尼对照品适量,精密称定,加溶出介质溶解并制成每ml含迈华替尼22.2μg(以C21H19ClF3N5O2计)的溶液作为对照品溶液,同法测定。按外标法以吸光度计算每片的溶出量。以时间-溶出度绘制溶出曲线,结果见图1。从图1可以看出:本发明的迈华替尼片为速释制剂,可以快速溶出。试验例2:稳定性对比实验样品1:按专利申请迈华替尼药物组合物及其制备方法(申请号201810750822.X,申请日为2018年7月10日)中的实施例1的处方制备得到的迈华替尼片,具体制备方法和处方如下:处方:(规格:5mg,以C21H19ClF3N5O2计)[注1]:以C21H19ClF3N5O2·(C4H4O4)2计。制备方法:(1)过筛:取迈华替尼和硬脂酸,分别过100目筛。(2)称量:称取处方量迈华替尼、乳糖和硬脂酸备用。(3)预混:取处方量的迈华替尼、乳糖,加入料斗混合机中,设置速度24rpm,混合20min。(4)干法制粒:取预混粉末,在干法制粒机上制粒,参数设置为:启动压力7MPa,终止压力8MPa,送料速度3~10rpm,压片速度5~10rpm,整粒速度100~150rpm,筛网目数24目。(5)总混:取制得的颗粒和处方量的硬脂酸,加入料斗混合机中混合,设定转速24rpm,混合20分钟,取样检测混合均匀度。(6)融合处理:取总混后的颗粒置恒温鼓风烘箱中进行融合,融合温度为70℃,时间1小时。(7)整粒:取融合后的颗粒,用24目筛进行整粒。(8)压片:选用Ф5.0mm浅凹冲,按理论片重进行压片。样品2:由实施例3制备得到实验方法:取样品1和样品2,置于25℃±2℃/RH60%±5%的稳定性留样箱中,于24个月取样测定溶出度,与0月进行比较。溶出度测定方法同试验例1,取样时间为30分钟,溶出度测定结果见下表。实验结果:30min的溶出度结果0月24月样品184%67%样品287%87%实验结论:采用实施例3处方制备的样品2:迈华替尼片,在贮存24个月后,溶出度没有下降,而采用申请号201810750822.X中的处方制备所得的样品1,溶出度下降,表明本申请的迈华替尼药物组合物质量稳定性更好。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1