一种青蒿琥酯肝靶向纳米微球、制备方法及其应用与流程
本发明涉及医药技术领域,尤其涉及一种青蒿琥酯肝靶向纳米微球新剂型及其在治疗肝脏疾病方面的应用。
背景技术:
青蒿琥酯(artesunate,art)是从天然植物青蒿中提取的一种含内过氧化基团的倍半萜内酯化合物,是目前常用的抗疟特效药之一。20世纪90年代以来,科学家发现除具有良好抗疟性之外,青蒿琥酯还具有抗肿瘤、抗病毒、抗炎、抗血管生成、抗纤维化等多种生物功能,对白血病、肝癌、肺腺癌及乳腺癌等都具有很好的抑制效果,而对正常组织细胞的毒性较低,同时与传统化学治疗药物有协同增效作用且无交叉耐药性。
青蒿琥酯为无色结晶或白色结晶粉末,无臭,几乎无味,微溶于水,易溶于乙醇、丙酮、氯仿。目前国内上市的青蒿琥酯制剂有片剂和粉针型注射剂。但是青蒿琥酯片剂不能克服肝脏的首过效应;粉针剂使用过程复杂、需要现用现配、放置不稳定、必须缓慢静注且体感疼痛。此外,由于青蒿琥酯在水中溶解性和稳定性差,生物利用度低,体内代谢快,导致难以有效地被输送至病变部位及细胞内,使得病人用药次数频繁,耐受性差,药效低,从而大大限制了它的临床应用。
微球是近年来发展较快的一种新剂型,是以天然或人工合成的高分子材料将药物包裹其中的一种微粒分散体系。微球粒径范围一般为1~500μm,小的可以是几纳米,大的可达800μm,其中粒径小于500nm的,通常又称为纳米球或纳米粒,属于胶体范畴。
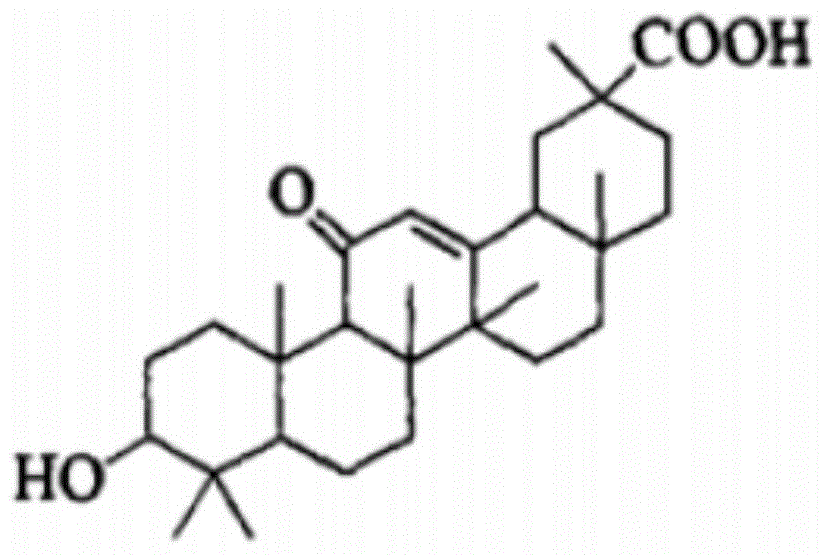
肝靶向纳米微球能直接靶向肝脏、肝细胞或细胞内结构输送药物,具有控制释放、保护药物、提高疗效、降低毒副作用等特点,对治疗各种肝脏疾病具有特殊意义。当纳米粒足够小(50~100nm)且表面覆以特殊包被后,便可逃过kupffer细胞的吞噬,靠其连接的特异性抗体等物质定位于肝实质细胞发挥作用,从而具有主动靶向作用。肝实质细胞表面存在大量甘草次酸(ga,结构见图1)结合位点,这些位点具有高度特异性。plga(聚乳酸-羟基乙酸共聚物)和聚乙二醇(peg)具有良好的生物相容性,无免疫原性,由两者形成的嵌段共聚物目前已被广泛用作药物载体材料,并且plga和peg均已商品化,来源广泛.与基于聚谷氨酸苄酯的合成高分子材料相比,plga和peg更有利于实现载体材料的临床应用。将肝靶向分子ga偶联至peg-plga嵌段共聚物上,以此为材料包埋青蒿琥酯,制成肝靶向载药纳米微球新剂型,可以突破临床应用中的限制,且尚未见报道。
技术实现要素:
本发明提供了一种高效肝靶向、稳定性好、生物利用度高的青蒿琥酯肝靶向纳米微球的制备方法。
本发明同时提供了一种由上述方法制备得到的青蒿琥酯肝靶向纳米微球,其靶向性和稳定性更好、生物利用度更高,进而治疗效果也较好,同时使用方便。
本发明还公开一种青蒿琥酯肝靶向纳米微球新剂型在抗肝脏疾病方面的应用。
一种青蒿琥酯肝靶向纳米微球,包括青蒿琥酯以及将青蒿琥酯包裹形成纳米微球的包材,所述包材采用甘草次酸修饰的聚乙二醇-聚(乳酸-羟基乙酸)嵌段共聚物。
作为优选,所述纳米微球中载药量为2~8%;即所述纳米微球中青蒿琥酯的质量百分比含量。进一步优选的平均载药量为3~6%。本发明中,所述载药量是指,纳米微球中负载的药物的总重量占纳米微球总重量的百分比。
作为优选,所述纳米微球的平均粒径为50~120nm。进一步优选的平均粒径为50~100nm;更进一步优选为60~90nm。本发明的纳米微球具有良好的靶向性和缓释性。且pdi为0.1~0.3,zeta电位-40~50mv。
作为优选,所述纳米微球的包封率为70~100%,进一步优选为80~90%。本发明中,所述包封率是指,负载于载体(本发明中的载体为甘草次酸修饰的聚乙二醇-聚(乳酸-羟基乙酸)嵌段共聚物)上的药物重量占投加的所有药物的总重量的百分比。
作为优选,所述青蒿琥酯肝靶向纳米微球由如下制备方法制备得到:将青蒿琥酯和甘草次酸修饰的聚乙二醇-聚(乳酸-羟基乙酸)嵌段共聚物溶解于有机溶剂iii中,搅拌条件下,将得到的溶液加入到乳化剂水溶液中,除去有机溶剂,除去游离药物,得到负载后的青蒿琥酯肝靶向纳米微球
一种上述任一技术方案所述的青蒿琥酯肝靶向纳米微球制备方法,将青蒿琥酯和甘草次酸修饰的聚乙二醇-聚(乳酸-羟基乙酸)嵌段共聚物溶解于有机溶剂iii中,搅拌条件下,将得到的溶液加入到乳化剂水溶液中,除去有机溶剂,除去游离药物,得到负载后的青蒿琥酯肝靶向纳米微球。
作为优选,有机溶剂iii中,甘草次酸修饰的聚乙二醇-聚(乳酸-羟基乙酸)嵌段共聚物质量浓度为5~20g·ml-1,进一步优选为8~12g·ml-1;水溶液中,乳化剂的浓度为0.1~1%,进一步优选为0.1~0.4%,青蒿琥酯与甘草次酸修饰的聚乙二醇-聚(乳酸-羟基乙酸)嵌段共聚物的质量比为1:1~1:4。
作为优选,所述乳化剂选自聚乙烯醇(pva)、泊洛沙姆188(p188)和聚乙二醇维生素e(tpgs)中的一种或几种。
作为优选,搅拌条件下,将得到的溶液加入到乳化剂水溶液中,搅拌速度为500~2000r·min-1。进一步优选为750~1250r·min-1。
作为优选,所述甘草次酸修饰的聚乙二醇-聚(乳酸-羟基乙酸)嵌段共聚物由下述方法制备得到:
(1)在有机溶剂i中,活化剂存在下,甘草次酸与聚乙二醇二胺的氨基进行缩合反应,得到含有甘草次酸单边修饰的聚乙二醇胺(ga-peg-nh2)的中间产物;
(2)在有机溶剂ii中,含(ga-peg-nh2)的中间产物与聚(乳酸-羟基乙酸)在活化剂存在下进一步反应,后处理得到所述甘草次酸修饰的聚乙二醇-聚(乳酸-羟基乙酸)嵌段共聚物。
作为优选,所述活化剂为n,n-二环己基碳二亚胺(ddc)、n-羟基琥珀酰哑胺(nhs)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)中的一种或多种。作为进一步优选,所述活化剂为n,n-二环己基碳二亚胺(ddc)与n-羟基琥珀酰哑胺(nhs)的组合,或者所述活化剂为1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)与n-羟基琥珀酰哑胺(nhs)的组合。
作为优选,甘草次酸与聚乙二醇二胺的摩尔比为(1~3):1。活化剂与聚乙二醇二胺的摩尔比为(1~10):1。当活化剂选择n,n-二环己基碳二亚胺(ddc)与n-羟基琥珀酰哑胺(nhs)的组合,或者为1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)与n-羟基琥珀酰哑胺(nhs)的组合时,聚乙二醇二胺(peg-(nh2)2)与n,n-二环己基碳二亚胺(ddc)和n-羟基琥珀酰哑胺(nhs)或者聚乙二醇二胺(peg-(nh2)2)与1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)和n-羟基琥珀酰哑胺(nhs)的摩尔比为1:(2~4):(2~4)。
步骤(1)可以在惰性气体保护下进行,比如可以在氮气保护下进行。反应温度可以选择室温。反应时间可以为10~36小时。反应结束后,低温真空浓缩,过滤,真空干燥,即得含有ga-peg-nh2的混合物。
步骤(2)中,含(ga-peg-nh2)的中间产物与聚(乳酸-羟基乙酸)(plga)的质量比1:(2~4)。含(ga-peg-nh2)的混合物与活化剂的比例为1:(0.05~0.3)。当活化剂选择n,n-二环己基碳二亚胺(ddc)与n-羟基琥珀酰哑胺(nhs)的组合,或者为1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)与n-羟基琥珀酰哑胺(nhs)的组合时,含(ga-peg-nh2)的中间产物与n,n-二环己基碳二亚胺(ddc)和n-羟基琥珀酰哑胺(nhs)或者含(ga-peg-nh2)的混合物与1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)和n-羟基琥珀酰哑胺(nhs)的摩尔比为1:(0.01~0.08):(0.01~0.08)。
步骤(2)反应结束后,过滤,浓缩,无水乙醚(当然也可以采用其它适合的溶剂进行沉淀析晶)沉淀,得ga修饰的聚乙二醇-聚(乳酸-羟基乙酸)(peg-plga)嵌段共聚物ga-peg-plga。
具体讲,作为进一步优选,所述青蒿琥酯肝靶向纳米微球由下述方法制备得到:
(1)在ga的有机溶剂i(以二氯甲烷(ch2cl2)为例)溶液中加入聚乙二醇二胺(peg-(nh2)2)、活化剂,在n2气保护下室温搅拌20~30h,低温真空浓缩,过滤,真空干燥,即得含有ga-peg-nh2的中间产物;取含有ga-peg-nh2的中间产物和聚(乳酸-羟基乙酸)(plga)溶解于有机溶剂ii(以二氯甲烷(ch2cl2)为例)中,加入活化剂,在n2气保护下室温反应1~3天。过滤,浓缩,无水乙醚沉淀,得ga修饰的聚乙二醇-聚(乳酸-羟基乙酸)(peg-plga)嵌段共聚物ga-peg-plga;
(2)精密称取适量青蒿琥酯和ga-peg-plga溶解于有机溶剂iii中,超声30~60s,一定速度搅拌下将溶液以固定速度滴入一定浓度乳化剂的水溶液中,旋蒸除去有机溶剂,10000~20000r/min低温高速离心10~20min,分离游离药物与载药纳米微球,收集纳米微球,用水分散。当然,根据不同需求,可以多次离心。
有机溶剂i、有机溶剂ii和有机溶剂iii可分别独立的选自ch2cl2、丙酮和乙酸乙酯中的一种或几种,可以不同也可以相同。
本发明得到的所述的青蒿琥酯肝靶向纳米微球新剂型,外观圆整,表面光滑,分散良好。
上面所述的青蒿琥酯肝靶向纳米微球新剂型,在体外72h内缓慢释药,释放符合一级动力学方程。
上面所述的青蒿琥酯肝靶向纳米微球新剂型,在小鼠体内具有较好的肝靶向性,肝脏中相对摄取率(re)为4.86,靶向效率(te)为6.32。
一种上述任一项技术方案所述的青蒿琥酯肝靶向纳米微球在制备治疗肝脏病变药物中的应用。
上面所述的青蒿琥酯肝靶向纳米微球新剂型,用于治疗肝脏疾病,包括肝纤维化、非酒精性脂肪性肝病(nash)、酒精性脂肪性肝病、各种病原体感染引起的肝病、慢性肝炎、肝硬化或肝脏肿瘤等。
上面所述的青蒿琥酯肝靶向纳米微球新剂型,用于各种原因引起的肝纤维化,如慢性乙型肝炎、慢性丙型肝炎、酒精性或非酒精性脂肪性肝病、自身免疫性肝病、药物性肝病、慢性血吸虫病以及一些代谢性或先天性慢性肝病等。
上面所述的青蒿琥酯肝靶向纳米微球新剂型,用于各种病原体感染引起的肝病,包括病毒、细菌、寄生虫等感染,如病毒性肝炎,细菌感染引起的肝脓肿、肝结核,寄生虫感染引起的肝吸虫病、阿米巴肝脓肿等。
上面所述的青蒿琥酯肝靶向纳米微球新剂型,用于各种原因引起的肝硬化,如慢性乙型肝炎、慢性丙型肝炎、酒精性或非酒精性脂肪性肝病、自身免疫性肝病、药物性肝病、慢性血吸虫病以及一些代谢性或先天性慢性肝病等。
本发明所述的青蒿琥酯肝靶向纳米微球新剂型的制备方法,通过先合成甘草次酸(ga)修饰的聚乙二醇-聚(乳酸-羟基乙酸)(peg-plga)嵌段共聚物,然后以其为包材,采用溶剂挥发法制备,用正交设计法全面优化纳米微球的制备工艺及参数。工艺稳定,操作方便,重复性好;制得的纳米微球外观圆整,表面光滑,分散良好;有较高的载药量和包封率;体外释放缓慢;体内有较好的肝靶向性。其可明显降低四氯化碳致肝纤维化大鼠的肝纤维化状况、肝功能异常,可有效阻止肝纤维化的发展并促进肝纤维化的逆转,且在同等剂量下,与青蒿琥酯相比具有显著差异。本发明的新剂型具有一定的缓释性能、对肝脏的主动靶向性,以及更高的生物利用度,能够提高对肝脏疾病的作用效果,在治疗肝脏疾病方面有广阔的应用前景。具体讲,本发明的有益效果:
(1)本发明制备了青蒿琥酯肝靶向纳米微球新剂型,利用甘草次酸(ga)修饰的聚乙二醇-聚(乳酸-羟基乙酸)(peg-plga)嵌段共聚物为包材,将青蒿琥酯包裹在微球内,提高了稳定性,避免了首过效应;同时通过制剂学方法改善青蒿琥酯的代谢动力学性质,提高其与肝细胞的亲和力,通过主动靶向提高青蒿琥酯在肝脏的浓度,从而提高生物利用度。
(2)本发明制备得到的纳米微球新剂型靶向性好,药物利用率高,且具有缓释作用,提高了生物利用度,降低了毒性,可减少给药量及给药次数,提高患者依从性。
(3)本发明制备得到的纳米微球新剂型,其给药途径多样化,可注射,也可以口服。
(4)本发明制备得到的纳米微球新剂型肝靶向性良好,可用于多种肝脏疾病的治疗,具有较好的临床应用前景。
附图说明
图1:甘草次酸(ga)的化学结构;
图2:ga-peg-plga合成路线;
图3:ga-peg-plga@art纳米微球的制备示意图;
图4:ga-peg-plga@art纳米微球的电镜照片;
图5:ga-peg-plga@art纳米微球的粒径分布图;
图6:ga-peg-plga@art纳米微球在不同浓度na2s04溶液中的稳定性;
图7:ga-peg-plga@art纳米微球体外释放曲线图;
图8a和图8b为对ccl4致肝纤维化大鼠的影响(he染色,10×200)的结果图;
图9a和图9b为对ccl4致肝纤维化大鼠的影响(masson染色,10×200)的结果图;
图10为实施例得到的ga修饰的聚乙二醇-聚(乳酸-羟基乙酸)(peg-plga)嵌段共聚物ga-peg-plga的核磁共振(nmr)图;
图11为实施例得到的ga修饰的聚乙二醇-聚(乳酸-羟基乙酸)(peg-plga)嵌段共聚物ga-peg-plga的红外(ir)谱图;
图12为对实施例得到的ga修饰的聚乙二醇-聚(乳酸-羟基乙酸)(peg-plga)嵌段共聚物ga-peg-plga进行表征得到的凝胶渗透色谱(gpc)。
具体实施方式
通过以下具体实施例对本发明进行说明,但本发明不受这些具体实施例限定。
本发明提供一种青蒿琥酯肝靶向纳米微球新剂型的制备方法,参见图2和图3,主要步骤如下:
(1)在5.0mmolga的二氯甲烷(ch2cl2)溶液中加入聚乙二醇二胺(peg-(nh2)2)2.0mmol、n,n-二环己基碳二亚胺(dcc)6.0mmol和n-羟基琥珀酰哑胺(nhs)6.0mmol,在n2气保护下室温搅拌24h,低温真空浓缩,过滤,真空干燥,即得ga-peg-nh2;取0.46gga-peg-nh2和1.5g聚(乳酸-羟基乙酸)(plga)溶解于20mlch2cl2中,加入0.02gdcc和0.03gnhs,在n2气保护下室温反应2天。过滤,浓缩,无水乙醚沉淀,得ga修饰的聚乙二醇-聚(乳酸-羟基乙酸)(peg-plga)嵌段共聚物ga-peg-plga,并通过nmr(a)、ir(b)和gpc(c)对ga-peg-plga进行了表征,见图10~图12;
(2)精密称取适量青蒿琥酯和ga-peg-plga溶解于有机相中,超声30s,一定速度搅拌下将溶液以固定速度滴入一定浓度乳化剂和稳定剂的水溶液中,旋蒸除去有机溶剂,16000r/min低温高速离心10min,分离游离药物与载药纳米微球,收集纳米微球,用水分散。
上面所述的青蒿琥酯肝靶向纳米微球新剂型的制备方法中,ga-peg-plga质量浓度为8~12mg·ml-1,乳化剂质量百分比浓度为0.1~0.4%,药载比例(青蒿琥酯与ga-peg-plga嵌段共聚物的质量比为1:1~1:4,搅拌速度为750~1250r·min-1,通过正交设计优选最佳工艺和参数。
上面所述的青蒿琥酯肝靶向纳米微球新剂型的制备方法中,有机相选自ch2cl2、丙酮和乙酸乙酯中的一种或几种。
上面所述的青蒿琥酯肝靶向纳米微球新剂型的制备方法中,乳化剂选自聚乙烯醇(pva)、p188和聚乙二醇维生素e(tpgs)中的一种。
实施例1溶剂挥发法制备青蒿琥酯肝靶向纳米微球
精密称取适量青蒿琥酯0.02g和ga-peg-plga0.02g溶解于2mlch2cl2中,超声30s,750r/min搅拌下将溶液以固定速度滴入20ml0.1%pva水溶液中,旋蒸除去有机溶剂,16000r/min低温高速离心10min,分离游离药物(微溶于水,可采用纯净水进行多次洗涤和离心分离,本实施例中,体系液离心分离后,再利用纯净水洗涤三次,其中离心条件选择16000r/min低温高速离心10min)与载药纳米微球,收集纳米微球,用水分散。
实施例2溶剂挥发法制备青蒿琥酯肝靶向纳米微球
精密称取适量青蒿琥酯0.01g和ga-peg-plga0.02g溶解于2ml丙酮中,超声30s,1000r/min搅拌下将溶液以固定速度滴入20ml0.2%tpgs水溶液中,旋蒸除去有机溶剂,16000r/min低温高速离心10min,分离游离药物与载药纳米微球,收集纳米微球,用水分散。
实施例3溶剂挥发法制备青蒿琥酯肝靶向纳米微球
精密称取适量青蒿琥酯0.04g和ga-peg-plga0.02g溶解于2ml乙酸乙酯中,超声30s,1250r/min搅拌下将溶液以固定速度滴入20ml0.4%pva水溶液中,旋蒸除去有机溶剂,16000r/min低温高速离心10min,分离游离药物与载药纳米微球,收集纳米微球,用水分散。
实施例4溶剂挥发法制备青蒿琥酯肝靶向纳米微球
精密称取适量青蒿琥酯0.012g和ga-peg-plga0.024g溶解于2mlch2cl2中,超声30s,1250r/min搅拌下将溶液以固定速度滴入20ml0.1%p188水溶液中,旋蒸除去有机溶剂,16000r/min低温高速离心10min,分离游离药物与载药纳米微球,收集纳米微球,用水分散。
实施例5溶剂挥发法制备青蒿琥酯肝靶向纳米微球
精密称取适量青蒿琥酯0.008g和ga-peg-plga0.024g溶解于2ml丙酮中,超声30s,750r/min搅拌下将溶液以固定速度滴入20ml0.2%tpgs水溶液中,旋蒸除去有机溶剂,16000r/min低温高速离心10min,分离游离药物与载药纳米微球,收集纳米微球,用水分散。
实施例6溶剂挥发法制备青蒿琥酯肝靶向纳米微球
精密称取适量青蒿琥酯0.024g和ga-peg-plga0.024g溶解于2ml乙酸乙酯中,超声30s,1000r/min搅拌下将溶液以固定速度滴入20ml0.4%p188水溶液中,旋蒸除去有机溶剂,16000r/min低温高速离心10min,分离游离药物与载药纳米微球,收集纳米微球,用水分散。
实施例7溶剂挥发法制备青蒿琥酯肝靶向纳米微球
精密称取适量青蒿琥酯0.005g和ga-peg-plga0.016g溶解于2mlch2cl2中,超声30s,1000r/min搅拌下将溶液以固定速度滴入20ml0.1%p188水溶液中,旋蒸除去有机溶剂,16000r/min低温高速离心30min,分离游离药物与载药纳米微球,收集纳米微球,用水分散。
实施例8溶剂挥发法制备青蒿琥酯肝靶向纳米微球
精密称取适量青蒿琥酯0.016g和ga-peg-plga0.016g溶解于2ml丙酮中,超声30s,1250r/min搅拌下将溶液以固定速度滴入20ml0.2%tpgs水溶液中,旋蒸除去有机溶剂,16000r/min低温高速离心30min,分离游离药物与载药纳米微球,收集纳米微球,用水分散。
实施例9溶剂挥发法制备青蒿琥酯肝靶向纳米微球
精密称取适量青蒿琥酯0.008g和ga-peg-plga0.016g溶解于2ml乙酸乙酯中,超声30s,750r/min搅拌下将溶液以固定速度滴入20ml0.4%pva水溶液中,旋蒸除去有机溶剂,16000r/min低温高速离心30min,分离游离药物与载药纳米微球,收集纳米微球,用水分散。
实施例10表观形态观察
用透射电子显微镜对实施例1制备得到的纳米微球进行拍摄,结果见图4。从图4中可知:制备的纳米微球外观圆整,表面光滑,分散良好。
实施例11粒径和zeta电位的测定
用粒度测定仪对实施例1制备得到的纳米微球的粒径、pdi值及zeta电位进行测定,结果见图5。从图5中可知:纳米微球的粒径为0.089μm,小于0.1μm,能进入肝实质细胞中;pdi为0.15;zeta为-45.6mv。电位与纳米粒体系的稳定性密切相关,一般认为zeta电位绝对值高于25mv时,电荷间的排斥作用强,粒子间凝聚减少,体系比较稳定。本试验所得纳米微球zeta电位高于25mv,符合要求。
按照相同方法对其余实施例制备得到的纳米微球的粒径进行检测,其均在0.1μm以内,符合要求。
实施例12载药量和包封率的测定
根据载药量公式dl(%)=(wtotal-wfree)/wnp×100%,和包封率公式er(%)=(wtotal-wfree)/wtotal×100%,其中wnp为纳米微球总重量,wtotal为投加的药物的总重量,wfree为分离出的游离药物的总重量,计算出实施例1制备得到的纳米微球样品中青蒿琥酯载药量和包封率分别为4.65%、85.3%。
按照相同方法对其余实施例制备得到的纳米微球的载药量和包封率进行测定,分别为4.33±1.24%,84.8±2.53%。
实施例13稳定性试验
将实施例1制备得到的样品按1ml分装,于4℃密封保存在安瓿瓶中,在0天、10天、20天和30天时检测其粒径及包封率,每次取3瓶样品测量,结果见表1。
表1稳定性试验结果(
从表1的试验结果可知:样品在一个月内稳定性较好,粒径变化很小,包封率较稳定,没有发生药物的泄漏。按照同样办法,对实施例2~9制备的样品进行稳定性试验,结果显示所有样品在一个月内稳定性较好,粒径变化很小,包封率较稳定。
实施例14稳定性试验
将0.5ml实施例1制备得到的纳米微球水溶液(10mg/ml)加至2.5ml不同浓度(0~1.0mol/l)的na2s04溶液中,以青蒿琥酯原药为对照样品,于37℃静置10min,紫外检测样品在289nm处的吸光度,用于稳定性评价。人体环境复杂,体液中含有大量电解质,因此考察纳米微球在电解质中的稳定性显得尤为重要。目前临界絮凝浓度是衡量纳米微球稳定性的一个重要参数,临界絮凝浓度是指纳米微球的浊度突然增加时所需的电解质浓度。图6为ga-peg-plga@art纳米微球和原料药与不同浓度的na2s04溶液作用后的吸光度变化曲线。当na2s04浓度低于0.4mol/l时,ga-peg-plga@art纳米微球体系吸光度几乎不变,继续增加电解质浓度,吸光度急剧增大,其临界絮凝浓度为0.4mol/l,远高于人体血液中电解质浓度(主要成分为0.14mol/lna+和0.10mol/lc1-),而原料药在na2s04浓度为0.2mol/l时吸光度就明显增大,说明纳米微球具有高度稳定性。这是因为在纳米微球形成过程中,亲水的peg和tpgs吸附大量水分子,在粒子表面形成疏松的水分子保护层,起到稳定纳米微球的作用。向体系中加入电解质后,peg和tpgs的溶剂化程度均有所降低,导致部分水分子被挤出粒子表面,从而在聚合物链段间产生吸引而引起凝聚,随着电解质浓度的进一步增加,纳米微球最终沉淀析出,使体系吸光度发生突变。
实施例2~9制备得到的微球,进行相同的实验,结果显示,相对于青蒿琥酯原药对照品,得到的纳米微球均具有高度稳定性。
实施例15体外释放实验
精确称量实施例1制备得到的纳米微球100mg,以及相同含量的原药作为对比样品,加入5mlpbs缓冲液(含乙醇28%)中,超声分散形成均匀纳米粒子悬液。将纳米粒子悬液放入超滤管中,在恒温振荡培养箱中保持37℃、100r/min振荡,每天定时取样(共10天),并补充等量新鲜缓冲液于超滤管中,保持体积不变。更换出的滤液,用紫外分光光度计测定289nm处吸光度,计算释放量,绘制累积释放曲线,见图7。从图7中可知:在体外pbs缓冲液条件下,art原料药4h内药物已基本释放完全,而ga-peg-plga@art纳米微球递送体系的释放呈现缓慢、持续过程。在初期阶段(3h之前),art释放较快,是突释阶段,之后进入持续缓释阶段。在释放动力学研究测定12小时范围之内,art的累积释放比例达到98%。与原料药art相比,我们成功制备的ga-peg-plga@art纳米微球具备了持续、缓慢释放的特性。
实施例2~9制备得到的纳米微球,进行相同的实验,结果显示得到的纳米微球均呈现缓慢、持续过程;并且在初期阶段(3~4h之前),art释放较快,是突释阶段,之后进入持续缓释阶段。在释放动力学研究测定12小时范围之内,art的累积释放比例达到97%或以上。
实施例16体内分布研究
1.分组及给药方法
昆明种小鼠72只,随机分为22组,每组3只。前11组给予art混悬液(溶剂为水),后11组给予实施例1制备得到的art肝靶向微球混悬液(溶剂为水),采用灌胃给药,给药剂量均为70mg·kg-1(按青蒿琥酯计)。
2.取样方法及取样点的设计
分别于0min及给药后15min、30min、1h、2h、4h、6h、8h、12h、24h、48h对小鼠进行眼眶取血,随后脱颈处死小鼠取出小鼠心、肝、脾、肺、肾,用生理盐水漂洗各组织后,用滤纸吸干,精密称重,并记录组织重量,标记后置于-70℃冰箱中保存,高效液相色谱法测定血浆和各组织中art浓度。
3.用3p97药动学软件对各组药物浓度-时间数据进行处理,计算药-时曲线面积(auc),对血药浓度数据进行曲线拟合,以aic法判断其体内过程。
结果见表2。
表2药动学参数和靶向性评价结果(
从表2的试验结果可知:药物制剂的靶向性可由以下两个参数来评价:相对摄取率(re)和靶向效率(te):相对摄取率(re)大于1表示药物制剂在该器官或组织有靶向性,re愈大靶向效果愈好,等于或小于1表示无靶向性;靶向效率(te)表示药物制剂或药物溶液对靶器官的选择性,te值大于1表示药物制剂对靶器官比某非靶器官有选择性,te值愈大,选择性愈强。ga-peg-plga@art纳米微球的re和te分别为4.86和6.32,表明该纳米微球的靶向性良好。针对实施例2~9制备得到的纳米微球,进行上述靶向性评价实验,实验结果分别如下:
由上述结果可知,本发明提供的纳米微球具有非常好的肝靶向性。能够有效提高药物的生物利用度,降低了毒性,减少了给药次数,病人依从性提高。
实施例17抗肝纤维化作用
1.动物造模及给药
90只sd大鼠经适应性饲养1周后,随机分为6组,每组15只。正常组以2ml·kg-1橄榄油皮下注射;模型组以25%ccl4橄榄油为造模剂,按2ml·kg-1剂量皮下注射;治疗组3组,在皮下注射造模剂的同时灌胃治疗药物,每日1次,青蒿琥酯纳米微(实施例1)球低、中、高剂量组分别灌胃药物5、15、45mg·kg-1(按青蒿琥酯计);阳性对照组为水飞蓟宾,剂量100mg·kg-1。造模每周2次,连续8周,每周称重1次,根据体质量调节给药剂量。
2.标本采集
于末次给药24h后,3%戊巴比妥钠(0.2ml/100g)腹腔注射麻醉后,腹腔静脉取血,离心留取血清。分离肝组织,一部分-80℃冻存备用,剩余部分用10%福尔马林固定,作病理检查。
3.指标检测
3.1血清肝功能指标检测
血清采用全自动生化分析仪,按试剂盒说明书对alt、ast、alp、ldh等指标进行测定。
3.2血清肝纤维化指标检测
部分血清标本送至艾迪康医学检验中心检测ha、ln、ⅲ-c和ⅳ-c。
3.3组织氧化和抗氧化指标检测
准确称取组织重量,按重量(g):体积(ml)=1:9的比例加入9倍的生理盐水,冰水浴条件下制成10%的组织匀浆,2500r·min-1,离心10min,取上清液测定肝组织匀浆中mda、hyp含量和sod、gsh-px活性。
3.4肝组织病理学检查
常规he染色,在光镜下观察肝组织切片的病理形态学变化,结果见图8a、图8b。masson染色,用imagepro-plus6.0软件分析masson胶原纤维面积百分比方法:每组内每张切片随机挑选3个200倍视野进行拍照,拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用image-proplus6.0软件对每张照片进行分析得出每张照片蓝色胶原纤维占整个组织面积的比率即胶原纤维的面积百分比。结果见图9a和图9b。
4.统计学处理
所有数据均以均数±标准差
5.结果与结论
5.1青蒿琥酯纳米微球对肝功能的影响
与正常组比较,模型组大鼠血清中alt、ast、alp活性显著升高(p<0.01),表明大鼠有很显著的肝脏损伤。与模型组比较,青蒿琥酯纳米微球低、中、高剂量组alt、alp水平均有极显著差异(p<0.01),低剂量组ast活性有显著差异(p<0.05);青蒿琥酯溶液组只有高剂量组对alt、ast、alp活性有极显著差异(p<0.01),低、中剂量组差异无显著性(p>0.05)。结果见表3。
表3对ccl4致肝纤维化大鼠血清肝功能指标的影响(
注:与正常组比较,**代表有极显著差异(p<0.01),*表示有显著差异(0.01<p<0.05);与模型组比较△△代表有极显著差异(p<0.01),△表示有显著差异(0.01<p<0.05)。
5.2青蒿琥酯纳米微球对肝纤维化损伤的影响
与正常组比较,模型组大鼠各指标明显升高,差异具有统计学意义;青蒿琥酯纳米微球低、中、高剂量组及青蒿琥酯溶液高剂量ln、pc-ⅲ、pc-ⅳ均有极显著差异(p<0.01)。结果见表4。
表4对ccl4致肝纤维化大鼠肝纤维化指标的影响(
注:与正常组比较,**代表有极显著差异(p<0.01),*表示有显著差异(0.01<p<0.05);与模型组比较△△代表有极显著差异(p<0.01),△表示有显著差异(0.01<p<0.05)。
5.3青蒿琥酯纳米微球对肝脏组织相关指标的影响
与正常组比较,模型组大鼠各指标明显升高,差异具有统计学意义;青蒿琥酯纳米微球低、中、高剂量组及青蒿琥酯溶液高剂量组sod、hyp水平均有显著差异(p<0.01,p<0.05);青蒿琥酯纳米微球中、高剂量组及青蒿琥酯溶液高剂量组mda、gsh-px水平均有显著差异(p<0.01,p<0.05)。结果见表5。
表5对cl4致肝纤维化大鼠肝脏组织相关指标的影响(
注:与正常组比较,**代表有极显著差异(p<0.01),*表示有显著差异(0.01<p<0.05);与模型组比较△△代表有极显著差异(p<0.01),△表示有显著差异(0.01<p<0.05)。
5.4青蒿琥酯纳米微球对肝脏病理损伤的影响
5.4.1he染色结果
正常组肝小叶结构正常,肝细胞无明显水肿、纤维化,组织基本正常。
模型组肝细胞广泛脂肪变性,肝组织可见许多大小不等的圆形空泡(黑色箭头所示),部分肝细胞水肿(红色箭头所示),汇管区重度纤维化伴炎症细胞灶性浸润(黄色箭头所示)。
阳性药对照组,青蒿琥酯纳米微球中、高剂量组,青蒿琥酯溶液高剂量组均见肝细胞广泛脂肪变性,肝组织可见许多大小不等的圆形空泡(黑色箭头所示),均见部分肝细胞水肿(红色箭头所示),均无明显纤维化;青蒿琥酯纳米微球低剂量组和青蒿琥酯溶液中剂量组,汇管区周围可见组织轻度纤维化(黄色箭头所示);青蒿琥酯溶液低剂量组,汇管区可见组织中度纤维化(黄色箭头所示)。结果见图8a和8b。
5.4.2masson染色结果
与正常组比较,模型组大鼠蓝色纤维化面积百分比显著升高(p<0.01);与模型组比较,青蒿琥酯纳米微球低、中、高各剂量组和青蒿琥酯溶液中、高剂量组蓝色纤维化面积百分比均有不同程度的降低,其中青蒿琥酯纳米微球中、高剂量组和青蒿琥酯溶液高剂量组水平显著降低(p<0.01,p<0.05),其它给药组虽有下降趋势,但差异无显著性(p>0.05)。结果见图9a和图9b,表6。
表6对ccl4致肝纤维化大鼠的影响(masson染色,10,son)。
注:与正常组比较**代表有极显著差异(p<0.01),*表示有显著差异(0.01<p<0.05);与模型组比较△△代表有极显著差异(p<0.01),△表示有显著差异(0.01<p<0.05)。
结果表明,ga-peg-plga@art纳米微球可明显降低ccl4致肝纤维化大鼠的肝纤维化状况、肝功能异常,降低血清alt、ast、alp;减少肝组织丙二醛mda和hyp;提高sod和gsh-px活性;降低血清纤维化标志物ln、pc-iii、pc-ⅳ水平,可有效阻止肝纤维化的发展并促进肝纤维化的逆转,且在同等剂量下,与青蒿琥酯相比具有显著差异。
实施例18对h22小鼠肝癌的体内抑瘤作用
1.药物配制
注射用art,用5%nahco3溶解,再用生理盐水配制成1.5、4.5、7.5mg/ml低、中、高三个浓度,按0.2ml/10g给药,给药剂量分别为30、90、150mg/kg,ga-peg-plga@art纳米微球按art计,低、中、高剂量组与art组剂量对应一致;取注射用环磷酰胺(ctx),用生理盐水配制成2mg/ml,按0.1ml/10g给药,给药剂量为20mg/kg。所配溶液均于冰箱保存备用。
2.取瘤种
无菌操作,将h22小鼠肝癌细胞株腹腔接种小鼠,于第10天选择腹水饱满小鼠,用碘酒、75%乙醇局部消毒,无菌条件下抽取出腹水,用生理盐水按体积比1∶3稀释成瘤细胞悬液。
3.接种瘤液
给每只小鼠右前肢腋皮下准确接种瘤液0.2ml(细胞数约2×107)。
4.分组给药
接种24小时后,将小鼠随机分为青蒿琥酯低、中、高剂量组,ctx组和模型对照组,每组8只。青蒿琥酯按0.2ml/10g体重腹腔注射给药,ctx按0.1ml/10g体重腹腔注射给药,模型对照组腹腔注射生理盐水,1天1次。各组均连续注射8天。
5.称瘤重
末次给药后24小时,颈椎脱臼处死小鼠,称体重,剥取瘤块和脾脏,称重,计算抑瘤率(%)。
抑瘤率(%)=(模型对照组平均瘤重-给药组平均瘤重)/模型对照组平均瘤重×100%。
6.统计学方法
实验数据均以
7.实验结果
ctx组的抑瘤率为57.8%,对h22小鼠肝癌具有非常明显的体内抑制作用(p<0.01)。art低剂量组的抑瘤率为40.5%,ga-peg-plga@art纳米微球低、中、高剂量组抑瘤率分别为56.2%、79.1%和48.7%,差异有统计学意义(p<0.01,p<0.05)。在相同剂量下,ga-peg-plga@art纳米微球体内抗肿瘤效果较为明显。结果见表7。
表7对h22荷瘤小鼠体质量、脾脏及瘤体量的影响(
注:与模型组比较△△代表有极显著差异(p<0.01),△表示有显著差异(0.01<p<0.05)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!