一种骨修复材料及其制备方法与流程
本发明涉及材料技术领域,尤其涉及一种骨修复材料及其制备方法。
背景技术:
骨缺损是指由于创伤、感染、骨髓炎手术清创、肿瘤切除或其它先天性疾病等导致的骨质缺如,破坏了骨骼的连续性和完整性而形成较大的间隙。随着建筑、交通事故以及人口老龄化的增加,存在骨缺损的患者日趋增多,对患者的生活质量及社会的卫生事业投入有重要的影响,尤其是承重部位的骨缺损及大段骨缺损的治疗一直是骨科学亟待解决的难题。大段骨缺损的定义是当骨缺损长度等于或大于长骨直径1.5倍时称为临界骨缺损或大段骨缺损,大段骨缺损无法自行愈合,需要有天然或人造的生物材料支架计入,通过提供结构支撑以及骨诱导作用方可使骨缺损得以修复。自体骨移植是治疗大段骨缺损的金标准,自体骨组织相容性好,不存在排异反应,同时成骨能力强,成骨迅速。但是自体骨移植因为存在:1)“剜肉补疮”,无法大量取骨;2)供区易发生局部疼痛、伤口感染等并发症;3)移植骨与骨缺损的形态、大小等方面难以很好的匹配等问题从而难以在临床推广。而同种异体骨或异种异体骨面临着免疫排异反应、潜在的疾病传播风险、新骨替代缓慢、生物力学性状差、骨来源受限等问题。冻干、煮沸、脱钙、辐照等处理虽可减少免疫排异反应的繁盛及潜在的疾病的传播风险,但也同时大大降低异体骨材料的骨强度和生物活性,从而影响植入后的骨愈合。因此,如何选择或者制备兼具优良的生物学性能及力学性能的可推广的天然或者人造骨修复材料是促进骨修复和提高骨愈合质量的前提,也是生物医学工程和临床工作者研究的热点和难点。
生物医学材料现在已经成为了当代材料学科的重要分支,尤其是随着生物技术的蓬勃发展和重大突破,生物医学材料已经成为了国际上研发的热点。同样,随着我国整体医疗水平的提升,临床工作中对生物医学材料的应用也愈来愈多,预计在未来20年内,生物医用材料所占份额将赶超药物市场,成为排名第一的医疗支柱产业。近年来,随着国家的重视与持续增加的研发投入,我国骨科生物材料研究领域发展迅猛,但由于研发和生产技术等限制,我国在医用生物材料研究领域仍落后于西方发达国家。在此环境下,越来越多的新型医用物材料如雨后春笋般出现在临床工作中。在骨科生物材料的应用中,最关键的因素为:生物相容性、骨传导性及骨整合性。在现今骨组织替代及修复研究领域中,目前主要应用的生物材料分为金属与非金属两大类。金属材料的高弹性模量、缺乏物活性、释放出的金属离子有引起人体金属过敏及炎性假瘤形成等缺陷现今得到了越来越多的报道与关注。另外,非金属类生物材料诸如聚氨基酸、聚乳酸等近年来在骨科中应用的一些可降解型生物材料,也因为其降解速率不可控、降解产物可能产细胞毒性或改变局部ph值影响成骨细胞活性等自身缺陷,而限制了其进一步的临床应用。与此同时,另一类由具有生物活性的无机化合物及高分化合物组成的非降解型生物材料被证明兼具生物活性及较好的力学性能,故该类生物材料也得到了科研作者们的重视,非降解型物材料在植入宿主体内后不会降解,是与宿主骨之间通过骨整合成为一体,骨整合是最为理想的内植物-骨界面。此时,内植物材料与骨之间除了简单的机械反应外,还存在生物化学反应,最终内植物与骨之间实现真正的无缝连接。
现今骨组织替代及修复研究领域中,由具有生物活性的无机化合物及高分子化合物组成的生物材料被证明兼具优良的生物活性及较好的力学性能。有鉴于此,设计及制备兼具优良的生物相容性、生物活性及力学性能的该类复合型生物活性材料,其最重要的因素即为如何选择其组成物(无机物/有机物)。鉴于上诉国内外现状,研发制备一种新型的由具有生物活性的无机化合物及高分子化合物组成的生物医用材料显得尤为重要。而该类生物材料也将为生物医用材料这个大家族带来一名新的成员,并为未来骨科生物医用材料提供更多的选择,同时也可为患者带来福音。
纳米羟基磷灰石/聚酰胺(nano-hydroxyapatite/polyamide66,nha/pa66,以下简称:nha/pa66)作为一种优良的仿生生物活性纳米材料,在近年来得到了较多研究与关注,它的仿生特性就体现在与人体骨的组成成分相似:人体骨的组成结构也是由无机物/有机物构成,其中最主要的组成成分即为羟基磷灰石与i型胶原,聚酰胺66(pa66)就在其中扮演了型胶原的角色。但在既往研究中,我们发现nha/pa66虽然具有较优良的生物相容性及生物活性,但其力学性能及生物学性能尚存在提空间,而这一缺陷也限制了其在临床中的进一步应用。故如何在提其生物学性能的同时,兼顾提升其力学性能,成为目前需要解决的问题。
技术实现要素:
本发明的目的在于解决上述现有技术存在的缺陷,提供一种既具生物力学性能、又具有生物活性的骨修复材料及其制备方法。
一种骨修复材料的制备方法,包括以下步骤:
(1)将纳米羟基磷灰石与氧化锆粉末按照一定比例混合进行研磨;
(2)将步骤(1)所得研磨混合物压坯后进行高温烧结,升温步骤及时间参数为:室温~600℃,300分钟;600℃~850℃,100分钟;850℃~1500℃;1500℃条件下维持4小时;
(3)烧结程序完成后,采取自然降温,降温至100℃后将烧结好的混合物进行粉碎,然后再与聚酰胺66进行预混;
(4)将预混后的混合物注塑成型。
进一步地,如上所述的骨修复材料的制备方法,所述纳米羟基磷灰石的粒径为80-100nm;所述氧化锆的粒径为70-100nm;所述聚酰胺的分子量为30000,相对粘度3.2。
进一步地,如上所述的骨修复材料的制备方法,所述烧结好的混合物与聚酰胺66的质量比为3:7。
进一步地,如上所述的骨修复材料的制备方法,步骤(4)中注塑按iso527-2-2012标准制备力学样条,相关参数为:第一阶段注塑温度240℃,第二阶段注塑温度260℃,第三阶段注塑温度265℃,第四阶段注塑温度272℃,第五阶段注塑温度290℃,注射压力为60~90mpa,注射速度为79~90g/s。
进一步地,如上所述的骨修复材料的制备方法,步骤(1)中研磨所用研磨球直径10mm,研磨球数量100粒,转速350转/分钟,研磨时间8小时。
进一步地,如上所述的骨修复材料的制备方法,所述纳米羟基磷灰石与氧化锆粉末的质量比为3:2。
如上所述方法制备得到的骨修复材料。
nha/pa66作为一种优良的仿生生物活性纳米材料,在近年来得到了较多研究与关注,它的仿生特性就体现在与人体骨的组成成分相似:人体骨的组成结构也是由无机物/有机物构成,其中最主要的组成成分即为羟基磷灰石与i型胶原,聚酰胺66就在其中扮演了型胶原的角色。但在既往研究中,我们发现nha/pa66虽然具有较优良的生物相容性及生物活性,但其力学性能及生物学性能尚存在提空间,而这一缺陷也限制了其在临床中的进一步应用。故如何在提其生物学性能的同时,兼顾提升其力学性能,成为本次研究的重点。在生物工程材料的医学应用中,“不含金属的修复材料”这一理念也得到了更多研究者的认同和关注。
氧化锆陶瓷材料,尤其是由氧化钇作为稳定剂的四方相氧化锆(yttria-stabilizedtetragonalzirconia,以下简称:ytz)陶瓷材料相比于其它类型的陶瓷材料,具有更优的高断裂韧度及抗弯折强度,同时还其具有耐磨损、耐腐蚀、耐高温、抗氧化、具有亲水性等优越的性能,能够解决常规陶瓷材料强度和韧性不足等问题。同时氧化锆属于生物陶瓷类材料,既具有良好的生物相容性、骨传导性及骨结合性,也不会像其它金属材料,可能引起人体的过敏反应,故目前已应用于人工髋关节假体、齿冠及其它一些口腔科植入材料。由于氧化锆的各种优良特性被研究发现,氧化锆陶瓷已成为传统金属修复材料的重要替代品。本发明利用氧化锆的马氏体相变作用及其优良的生物学性能进行三元复合材料增韧改良;目前骨科的生物材料主要表现为骨传导作用,而本发明实现了新生骨-生物材料-自体骨的充分骨整合,即复合材料可促进骨组织的生成,并达到新生骨与植入材料间的“无缝结合”;
本发明方法制备的三元复合材料为兼具优良力学性能及生物学性能的非降解型生物医用材料,较金属材料而言,生物活性更佳,弹性模量接近人体骨,更有利于促进骨愈合;相较于降解型材料,无降解速率不可控、降解产物可能产生细胞毒性或改变局部ph值而影响成骨细胞活性等缺陷,同时具备更优良的生物力学性能
有益效果:
(1)可实现骨修复中的最佳状态,即骨整合,实现真正的新生骨与植入材料之间的“无缝链接”,而nha/pa66及目前现有的骨修复材料,往往只具备骨传导作用;
(2)通过氧化锆的加入,使新的三元复合材料nha/pa66/ytz具有优良力学性能及生物学性能,较金属材料而言,生物活性更佳,弹性模量接近人体骨,不会引起应力遮挡及其它金属材料相关的副作用,更有利于促进骨愈合;
(3)相较于可降解型材料,避免了降解速率不可控、降解产物可能产生细胞毒性或改变局部ph值而影响成骨细胞活性等缺陷,同时具备更优良的生物力学性能。
附图说明
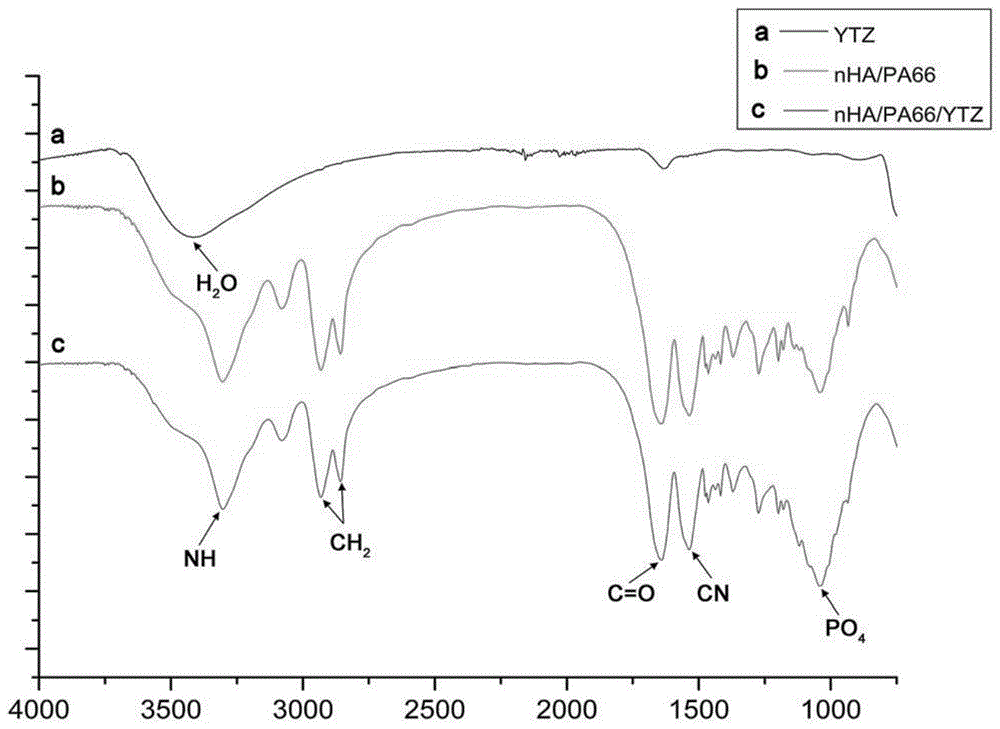
图1为实施例1制备得到的骨修复材料红外光谱分析图;
图2为sem观察细胞在不同材料表面的黏附情况:其中,(a)对照组:细胞培养皿;(b)对照组:nha/pa66;(c,d)实验组:nha/pa66/ytz;
图3为细胞与复合材料共培养状态下进行成骨诱导,茜素红染色评价成骨能力,其中,(a)对照组:细胞培养皿;(b)对照组:nha/pa66;(c,d)实验组:nha/pa66/ytz;
图4为硬组织切片,he染色观察多孔骨填充材料植入30、90天后植入物周围情况对比图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面本发明中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:
(1)选用的纳米羟基磷灰石(nano-hydroxyapatite,nha)与氧化锆(yttria-stabilizedtetragonalzirconia,ytz)均为纳米级,nha粒径为80-100nm,ytz粒径为70-100nm;聚酰胺66(polyamide66,pa66),pa66的分子量为30000,相对粘度3.2。
(2)首先将nha与ytz粉末分别以3:2质量比置于行星球磨仪中进行研磨混合8小时。将混合物装入氧化铝坩埚中,压坯,置于数控电炉中行高温烧结,升温步骤及时间参数为:室温-600℃,300分钟;600℃-850℃,100分钟;850℃-1500℃;1500℃条件下维持4小时,烧结程序完成后,采取自然降温,降温至100℃后开炉。
(3)将烧结好的混合物进行粉碎,将nha/ytz复合材料粉末再与pa66进行预混,nha/ytz复合材料与pa66的质量比为3:7。然后将混合物装入注塑成型机中进行注塑成型,按iso527-2-2012标准制备力学样条,相关参数为:注塑温度为240℃-290℃,注射压力为60-90mpa,注射速度为79-90g/s,最终制备得到本发明所述骨修复材料。
下面分别通过通过扫描电镜(scanningelectronmicroscopy,sem)、x线衍射(x-raydiffraction,xrd)、傅里叶转换红外光谱分析仪(fouriertransforminfraredspectroscopy,ftir)等分析复合材料组成及材料表征,原子粒显微镜(atomicforcemcroscope,afm)检测复合材料表面粗糙度,接触角测试仪测试nha/pa66/ytz复合材料的亲水性,力学测试仪测试nha/pa66/ytz实施例1制备得到的骨修复材料的力学性能。
实验例1:
力学性能测试:
力学性能测试按照iso527-2-2012标准,测试骨修复材料力学性能。步骤如下:抗压强度测试,样品尺寸:10×10×4mm,加压速度:5mm/min,压缩高度比:50%;抗弯强度测试,样品尺寸:10×4×80mm,弯曲跨度:60mm,加压速度:5mm/min,弯曲度:15mm;抗张强度、断裂伸长率及弹性模量测试,样品尺寸:10×4×100mm,标距长度:60mm,拉伸速度:5mm/min,具体见表1。
表1.力学强度检测
通过表1可以看出,本发明实施例1制备得到的骨修复材料相比现有的nha/pa66,其在抗压强度、抗张强度、抗弯强度、断裂伸长率方面均能达到要求。
实验例2:
傅里叶红外光谱析骨修复材料,图1为实施例1制备得到的骨修复材料红外光谱分析图;通过图1可以看出,该检测为材料官能团组成检测,说明本发明方法制备得到的骨修复材料nha/pa66/ytz化学结构稳定,未发生官能团变化。
实验例3:
图2为sem观察细胞在不同材料表面的黏附情况:其中,(a)对照组:细胞培养皿;(b)对照组:nha/pa66;(c,d)实验组:nha/pa66/ytz。可见本发明方法制备得到的骨修复材料nha/pa66/ytz表面有更好的细胞黏附与增殖。
实验例4:
图3为细胞与复合材料共培养状态下进行成骨诱导,茜素红染色评价成骨能力,其中,(a)对照组:细胞培养皿;(b)对照组:nha/pa66;(c,d)实验组:nha/pa66/ytz。可见本发明方法制备得到的骨修复材料nha/pa66/ytz有更佳的成骨能力。
实验例5:
图4为硬组织切片,he染色观察骨填充材料植入30、90天后植入物周围情况对比图;(he染色)。可见本发明方法制备得到的骨修复材料nha/pa66/ytz相比nha/pa66有更好的新生骨长入。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!