荷载小干扰RNA的脂质体纳米粒药物递送系统及其制备方法和应用与流程
阳离子脂质体属于化妆品、药品原料制备领域,涉及荷载小干扰RNA的脂质体纳米粒药物递送系统及其制备方法和应用。
背景技术:
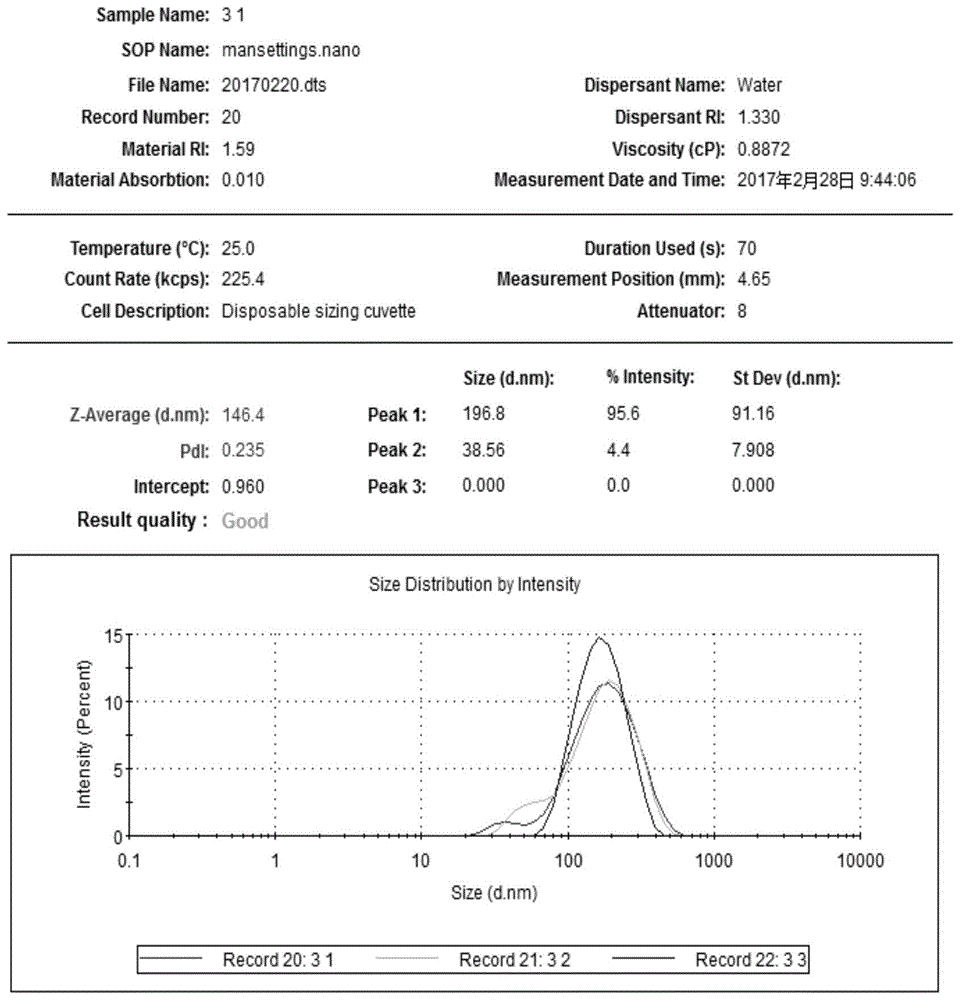
:阳离子脂质体是一个两性离子型表面活性剂,具有亲水性和疏水性,作为药物载体,其包裹范围非常广,可包裹水溶性物质、脂溶性物质及两性物质;同时,脂质为脂质体的主要成分,同生物膜成分相似,可以很容易被生物体内存在的大量分解酶降解排出体外;阳离子脂质体在体内无毒,无免疫原性,安全可靠;药物由阳离子脂质体携带以后,能改进其在皮肤的透皮效应,降低毒副作用,提高和延长药物疗效。壳聚糖(chitosan,CH)又称脱乙酰甲壳素,是自然界生物所含的一种天然聚阳离子碱性氨基多糖,可生物降解,安全无毒,具有良好的细胞亲和性、组织相容性和生物可降解性,化学性质比较稳定。壳聚糖本身可以作为一种药物载体,它对生物膜具有很强的特异粘附作用,可以通过延长在作用部位的滞溜时间而提高药物生物利用度。同时,壳聚糖还是一种安全有效的促渗剂,带正电的壳聚糖通过与带负电的细胞膜表面糖蛋白分子相互作用而增加亲水性大分子细胞旁路的通透性,促进亲水性大分子药物的吸收,因此壳聚糖能够作为透皮促进剂用于透皮给药系统中。但单纯的壳聚糖作为药物载体在生理条件下溶解性差、对pH的依赖性太强,机械性能不好。RNA干扰技术是基因调节的重要方法。利用一段与目的基因同源的双链RNA分子,通过RNA沉默通路抑制目的基因的表达,目前应用较广泛的RNA干扰技术是siRNA/asiRNA。siRNA/asiRNA是一段合成的双链RNA分子,其反义链与目的基因mRNA互补,因此理论上其是抑制致病基因表达的理想药物。许多疾病,例如心脑血管疾病、神经系统疾病、病毒性疾病以及肿瘤等都有着特殊的致病基因,研制相应的siRNA/asiRNA药物可以高效、特异地使致病基因沉默,从而达到治疗的目的,在医疗领域有较好的发展前景。但裸siRNA/asiRNA自身带负电,分子量大,极性强,很难穿过细胞膜、血管内皮,容易在脾脏滞留,在生物体内容易被核酸酶降解,半衰期短,转染效率低,甚至会产生强烈的炎症反应,有潜在毒性等,这些都限制了它在体内的应用。因此,利用合适的载体以保持它在体内的稳定性对其疗效的发挥至关重要。递送siRNA/asiRNA的载体可以大致分为病毒载体和非病毒载体。病毒载体是最早用于体内递送siRNA/asiRNA的载体,其优点在于单次给药后可以获得干扰RNA的长期表达,但是由于病毒载体在基因治疗实验中出现一些毒副作用和潜在的免疫原性、致瘤性等问题,目前病毒载体已非首选递送方式。非病毒载体又包含了聚合物载体、阳离子多糖和肽、阳离子脂质体。专利号为CN101437544的专利提供了一种阳离子聚合物——聚乙烯亚胺(PEI)作为递送siRNA的载体,但是PEI分子表面较高的正电荷密度将会导致严重的细胞毒性,该专利用了一系列的化学剂对其进行交联和改性,最终得到低毒性的阳离子聚合物载体,但是聚合物的修饰过程过于复杂,在研发和应用中的成本较高。专利号为CN105039412A的专利提供了一种含有阳离子肽的多糖聚合物的核酸传递载体,该阳离子肽含有高密度的基本氨基酸(精氨酸或赖氨酸),能与质膜表面的负电荷相互作用提高肽段的内化。多糖核酸复合体具有约1:1至约100:1的N/P比,而过量的阳离子肽可能与细胞中负电分子发生非特异性的相互作用或者将胞外的负电分子带入胞内而引起副作用。脂质体介导的siRNA递送是目前最为成熟和接近于临床应用的RNA干扰技术治疗方法。脂质体与siRNA/asiRNA通过静电吸附作用形成无定形复合物,结构进行重排,导致siRNA/asiRNA的压缩,结构发生变化,产生空间位阻,由此保护siRNA/asiRNA免受体内RNA酶降解,通过内吞作用促进细胞内吸收,增加siRNA/asiRNA从内涵体/溶酶体的释放,从而促进siRNA/asiRNA在细胞的积累。专利号为CN105521497A的专利提供了一种蔗糖脂肪酸酯嵌入式阳离子脂质体基因载体,能有效压缩质粒DNA和siRNA,具有高转染效率和低毒性。技术实现要素:本发明提出一种阳离子脂质体(包括壳聚糖修饰脂质体)作为具有良好透皮效应的核酸类药物载体的组合物以及应用,作为一种新型的透皮给药制剂,目的在于解决核酸类药物透皮效果不佳的问题。本发明的另一目的是提供该药物递送系统的制备方法。本发明的又一目的是提供该药物递送系统的应用。本发明的目的可通过以下技术方案实现:一种荷载小干扰RNA的脂质体纳米粒药物递送系统,包括阳离子脂质体或壳聚糖修饰阳离子脂质体,及其荷载的小干扰RNA。所述的阳离子脂质体主要由卵磷脂、胆固醇、十八烷基胺组成,膜材中卵磷脂:胆固醇:十八烷基胺的摩尔比为1.5~3:0.5~1.5:1~3。所述的药物递送系统优选为壳聚糖修饰阳离子脂质体在水溶液中与化学合成的小干扰RNA自组装形成的带正电荷的纳米粒。所述的纳米粒粒径分布在130-150nm,纳米粒表面Zeta电位分布在40-60mv;载药纳米粒具有良好的透皮效应和安全性。所述的小干扰RNA选自化学修饰或不修饰的两条链对称的小核酸干扰分子,或者化学修饰或不修饰的两条链配对不对称的小核酸干扰分子。所述的化学修饰优选胆固醇修饰。本发明所述的一种荷载小干扰RNA的阳离子脂质体纳米粒药物递送系统,包括壳聚糖修饰脂质体及其荷载的小干扰RNA。所述的制备方法优选包括如下步骤:(1)阳离子脂质体纳米粒药物递送系统:阳离子脂质体制备:膜材中卵磷脂:胆固醇:十八烷基胺的摩尔比为1.5~3:0.5~1.5:1~3比例溶于适量体积的氯仿中,经减压蒸发去除氯仿,形成脂膜,经水化和冰浴超声后,用孔径为0.45μm和0.22μm的滤膜依次过滤,得到直径约100-200nm的脂质体。将脂质体与靶向基因的siRNA/asiRNA溶液(20uM)按5~20:1的质量比混合,充分混匀,室温静置30分钟。通过自组装得到阳离子脂质体-siRNA/asiRNA复合物。(2)壳聚糖修饰脂质体纳米粒药物递送系统制备:以粘均分子量4400~21000道尔顿的壳聚糖用pH4.4(0.2M)的醋酸钠缓冲液稀释成0.1%的浓度。按一定的质量比,先将0.1%壳聚糖溶液缓慢地滴加至阳离子脂质体溶液,边滴边摇匀,充分混匀形成壳聚糖修饰脂质体,简称为壳-脂。然后将壳-脂与靶向基因的siRNA/asiRNA溶液(20uM)按一定质量比混合,充分混匀,室温静置30分钟。通过自组装得到壳-脂-siRNA/asiRNA复合物。本发明所述的一种荷载小干扰RNA的脂质体纳米粒药物递送系统,包括壳聚糖修饰脂质体及其荷载的小干扰RNA,优选在皮肤肿瘤靶向治疗药物中的应用。有益效果:本发明阳离子脂质体(包括壳聚糖修饰脂质体),通过自组装方式与小干扰RNA形成荷载小干扰RNA的脂质体纳米粒药物递送系统。与现有技术相比具有以下特点:制得的阳离子脂质体始终带正电荷,安全、稳定,并且具有较好的透皮效应。用该阳离子脂质体运送目标药物,解决了药物透皮效果不佳,以及药物在体内不稳定、半衰期短、毒副作用大等问题,在化妆品及医药领域有较好的应用前景。附图说明图1、阳离子脂质体粒径分布。图2、阳离子脂质体的Zeta电位图。图3、按不同质量比配制的asiRNA-脂质体复合物的琼脂糖凝胶阻滞实验照片。泳道从左至右:1:asiRNA;2:asiRNA:脂质体=2:1;3:asiRNA:脂质体=1:1;4:asiRNA:脂质体=1:2;5:asiRNA:脂质体=1:5。图4携带CY5荧光片段的干扰RNA活体透皮照片。1号:脂质体+RNAfreewater,2号:PBS+RNA-cy5,3号:脂质体+RNA-cy5图5阳离子脂质体冻干粉图6脂质体冻干粉复溶后光镜照片(400X)图7冻干粉复溶后的脂质体-asiRNA复合物的琼脂糖凝胶阻滞实验图8按不同质量比配制的siRNA-0.1%壳聚糖-脂质体复合物的琼脂糖凝胶阻滞实验照片。泳道从左至右:1:未加样;2:siRNA;3:siRNA:0.1%壳聚糖:脂质体=1:2:5;4:siRNA:0.1%壳聚糖:脂质体=1:5:5;5:siRNA:0.1%壳聚糖:脂质体=1:10:5;6:siRNA:0.1%壳聚糖:脂质体=1:15:5;7:siRNA:0.1%壳聚糖:脂质体=1:20:5;8:siRNA。图9壳-脂-siRNA复合物细胞毒性试验72小时细胞抑制率。图10Lipofectamine2000组细胞转染实验显微镜下观测照片(左图为光镜,右图为同视野下荧光显微镜)。图11壳聚糖修饰的脂质体/siRNA复合物的细胞转染实验显微镜下观测照片。(左图为光镜,右图为同视野下荧光显微镜)图12空白对照组的细胞转染实验显微镜下观测照片。(左图为光镜,右图为同视野下荧光显微镜)图13壳聚糖-脂质体-siRNA体外透皮实验siRNA透皮速率随时间变化关系图,对照组是pH7.4的磷酸盐缓冲溶液,实验组是壳-脂-siRNA混悬液。具体实施方式在本发明中所使用的术语,除非有另外说明,一般具有本领域普通技术人员通常理解的含义。下面结合具体的制备实施例和应用实施例,并参照数据进一步详细地描述本发明。应理解,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。在以下的实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。实施例1阳离子脂质体-asiRNA递送系统(1)阳离子脂质体的制备:蛋黄卵磷脂、胆固醇、十八烷基胺,以21:9:18的摩尔比例溶于适量体积的氯仿中,经减压蒸发去除氯仿,在圆底烧瓶中形成脂膜,经水化和冰浴超声后,用孔径为0.45μm和0.22μm的滤膜依次过滤,得到阳离子脂质体。采用ZS90(英国Malvern)电位仪测定所制备的阳离子脂质体的粒径及Zeta电位。其平均粒径146.4nm(图1),电位49.3mv(图2)。(2)脂质体-asiRNA复合物的琼脂糖凝胶阻滞实验实验所用的化学合成的asiRNA是靶向人VEGFA(GenBankNM001171630.1)1146-1164的不对称的asiRNA17+2/19+2(asiRNA19/21)正义链:5’AUCACGAAGUGGUGAAGdTdT3’反义链:5’CUUCACCACUUCGUGAUGAdTdT3’实验前将电泳仪器及器皿均用0.1%DEPC水预处理。先配置不同质量比的脂质体-asiRNA复合物(asiRNA:脂质体质量比分别为2:1、1:1、1:2、1:5),其中每份样品asiRNA的质量均为4ug,按以上比例配置成复合物后,用DEPC水将各样品调至相同体积100ul。裸asiRNA作为对照。将样品分别与5×RNA上样缓冲液混匀,上样于0.8%的琼脂糖凝胶加样孔中,电压100V,电泳30分钟,于凝胶成像系统中紫外光下检测并拍照(见图3)。由以上琼脂糖电泳结果可知,在1~4泳道的加样孔中均未见荧光,只有在第五泳道即asiRNA:脂质体=1:5时,部分asiRNA被脂质体包裹,所以荧光信号在加样孔和泳道前沿均可见到。(3)脂质体-asiRNA复合物包封率的测定将脂质体-asiRNA复合物在4℃条件下,12000rpm高速离心30分钟,用分光光度计检测上清液中260nm处的吸光值,以不含siRNA的脂质体溶液为空白对照。由此可计算出游离asiRNA的质量(W游),从而计算出包封率,计算公式为:包封率=(W总-W游)/W总×100%。平均包封率为80.37%。(4)脂质体-asiRNA复合物在体透皮实验选择裸鼠,以cys标记的asiRNA与制备的阳离子脂质体混合制备成脂质体-cys-asiRNA复合物涂抹于裸鼠一侧腹部皮肤作为实验组,以未荧光标记的asiRNA与阳离子脂质体形成的脂质体-asiRNA复合物为空白对照组,以等质量的cys标记的asiRNA的PBS溶液为阴性对照组,三组分别经同样操作后分别于15分钟及20分钟后于活体动物成像仪拍照,结果见附图4,由结果可见,制备的阳离子脂质体可携带asiRNA透皮,随时间增加,asiRNA透皮量增加。(5)阳离子脂质体冻干粉制备分别以5%葡萄糖、10%蔗糖作为冻干保护剂,待冻干保护剂完全溶解后,先放4℃预冷0.5-1h,后放-20℃预冻过夜(10-12h),-80℃冷冻6-8h,再用冻干机常温抽真空冻干48h。以10%蔗糖(或5%葡萄糖)作为保护剂所得的脂质体冻干粉质地较为细腻,为白色疏松块状物,体积基本维持不变,无萎缩、分层、喷瓶等现象,总体外观较好。(见附图5)采用ZS90(英国Malvern)电位仪测定冻干前和等体积水复溶后脂质体粒径和电位,结果如下表所示:表1阳离子脂质体冻干前后粒径和电位变化电位/mV粒径/nmPDI冻干前阳离子脂质体49.3146.40.23510%蔗糖复溶后脂质体34.0150.70.2085%葡萄糖复溶后脂质体44.3126.10.207注:PDI说明脂质体的多分散性、均一性,值越小均一度越好脂质体冻干粉复溶后光镜下观察脂质体为圆形和类圆形,未聚集,分散度好(见附图6);通过脂质体-asiRNA复合物的琼脂糖凝胶阻滞实验显示脂质体冻干粉复溶后结合asiRNA能力不变(见附图7,对照组为裸asiRNA),这为脂质体的保存和运输提供便利,利于将来的工业化应用。实施例2壳聚糖修饰的脂质体/siRNA复合物的制备1.阳离子脂质体的制备同实施例12.壳聚糖修饰的脂质体/siRNA复合物的制备(简称壳-脂-siRNA复合物)所述的siRNA为根据目的DNA序列设计的,所述的目的DNA序列是根据美国国家卫生研究院的NCBI标准数据库中选择络氨酸酶基因tyr片段序列为靶序列。其序列为:正义链:5’GUACAACAGCCAUCAGUCUUU3’(SEQIDNO.1)反义链:5’CUCAUGUUGUCGGUAGUCAGA3’(SEQIDNO.2)先将0.1%壳聚糖溶液以2:5的质量比缓慢地滴加至脂质体水溶液(2.7ug/ul),室温下边滴边摇匀,充分混匀形成壳聚糖修饰脂质体,简称为壳-脂。30分钟后将壳-脂与靶向基因的siRNA(以下简称siRNA)溶液(20uM)按siRNA:0.1%壳聚糖:脂质体质量比为1:2:5混合,充分混匀,室温静置30分钟。各成分混合后通过自组装得到壳-脂-siRNA复合物。壳-脂-siRNA复合物的粒径及Zeta电位检测:采用ZS90(英国Malvern)电位仪测定所制备的壳-脂-siRNA复合物的粒径及Zeta电位。结果见表2和表3,其电位平均57.2mv,平均粒径137.8nm。表2壳-脂-siRNA复合物的Zeta电位TypeT(℃)ZP(mV)Mob(Hmcm/Vs)Cond(mS/cm)1Zeta25.053.64.2033.162Zeta25.058.54.5833.693Zeta25.059.64.6733.92表3壳-脂-siRNA复合物的粒径TypeT(℃)Z-Ave(dm)PDI1Size25.1137.00.3002Size25.0139.00.2683Size25.0137.60.2793.壳-脂-siRNA复合物的琼脂糖凝胶阻滞实验实验前将电泳槽和加样枪头均用0.1%DEPC水预处理。按前述方法配制不同质量比的壳-脂-siRNA复合物(siRNA:0.1%壳聚糖:脂质体质量比分别为1:2:5,1:5:5,1:10:5,1:15:5及1:20:5),其中每份样品siRNA的质量均为4ug,按以上比例配置成复合物后,用DEPC水将各样品调至相同体积。裸siRNA作为对照。将样品分别与5×RNA上样缓冲液混匀,上样于0.8%的琼脂糖凝胶孔中,电压100V,电泳30分钟,于凝胶成像系统中紫外光下检测并拍照(见图8)。由图8可知,当siRNA:0.1%壳聚糖:脂质体质量比为1:2:5时,壳聚糖修饰的脂质体就可完全包裹siRNA,相比同体积的未修饰的脂质体,经壳聚糖修饰后其包裹同样量的siRNA的效率大大提高。4壳-脂-siRNA复合物包封率的测定将壳-脂-siRNA复合物在4℃条件下,12000rpm高速离心30分钟,用分光光度计检测上清液中260nm处的吸光值,以不含siRNA的壳-脂溶液为空白对照。由此可计算出游离siRNA的质量(W游),从而计算出包封率,计算公式为:包封率=(W总-W游)/W总×100%。包封率平均为83.24%。实施例3壳聚糖修饰脂质体纳米粒药物递送系统对正常细胞毒性的研究将HUVEC细胞以5×103/孔的密度接种到96孔板,接种体积均为100uL,将接种细胞置于5%CO2的细胞培养箱中,37℃过夜培养。用PBS清洗细胞后,将质量比为2:5的壳聚糖-脂质体的复合脂质溶液各取0.625uL,1.25uL,2.5uL,5uL,10uL加入96孔板的相应孔中(用全培养基将每孔体积补至100uL),每组设6个复孔;脂质体组为相同浓度的阳离子脂质体分别取0.3uL,0.6uL,1.2uL,2.4uL,4.8uL的脂质体加入96孔板的相应孔中(用全培养基将每孔体积补至100uL),每组设6个复孔,不加任何处理的细胞作为调零孔。细胞分别继续培养72小时后,从培养箱中取出,每孔加5mg/mL的MTT溶液20μL,放入细胞培养箱继续培养。4h后,吸弃孔内培养液,每孔加150μL二甲基亚砜,置于震荡机上100r/min轻度震10min,使细胞内生成的紫色甲臜结晶重复溶解。于490nm波长测定每孔吸光度(见图9)。计算增殖抑制率=(空白对照组OD值-实验组OD值)/空白对照组OD值×100%由图9可见,在低剂量时,经壳聚糖修饰后的脂质体对正常细胞的增殖抑制作用要低于纯脂质体组,即脂质体对正常细胞的毒性在经过壳聚糖修饰后可大大减轻。实施例4壳聚糖修饰脂质体纳米粒药物递送系统的细胞转染实验本实验以Cy5标记siRNA进行细胞转染,观察荧光显微镜下壳聚糖修饰的脂质体对黑色素瘤细胞A375的转染情况。1).取对数生长期的肿瘤细胞,0.25%胰蛋白酶消化制成单细胞悬液。以24孔板每孔细胞浓度2×104个/孔接种细胞,每孔体积1mL,待24h细胞贴壁后开始转染。2).按以下步骤准备对照组siRNA-Lipo2000:a.稀释(μL)质粒RNA/孔:用48.75μL的Opti-MEM稀释1.25μL的siRNA质粒(20μM)轻轻混合,室温孵育5min;b.稀释Lipo2000/孔:用47μL的Opti-MEM稀释3μL的Lipo2000轻轻混合,室温孵育5min;c.将a与b轻轻混匀后室温孵育20min;吸出24孔板中的培养液,以每1mL/孔的PBS洗细胞两次,每孔加ab复合物100μL。3).实验组按前述方法配置siRNA:0.1%壳聚糖:脂质体=1:2:5的壳聚糖修饰的脂质体/siRNA复合物,其中,每100μL转染液中siRNA含量为1.25μL,每孔加转染液100μL。其余操作同前,并设只有正常培养的细胞空白对照组。4).各组在37℃、5%CO2条件下继续培养4h后补加0.9mL完全培养基。继续培养20h后,显微镜下观察拍摄(见图10,11,12)。由荧光照片可见,壳-脂-siRNA复合物组可将带Cy5荧光标记的siRNA转染入活细胞内,壳聚糖修饰的脂质体具有递送核酸物质进入细胞的作用。实施例5壳聚糖修饰脂质体纳米粒药物递送系统的体外透皮实验本实验以纯种ICR小鼠离体皮肤为皮肤模型,用TP—6透皮扩散仪进行体外透皮试验,考察了壳聚糖修饰的脂质体运载siRNA的透皮效果。Franz扩散池由上下两个杯状磨口玻璃容器组件对合而成,释药面积为1.13cm2,接受池体积为15mL。以pH7.4磷酸盐缓冲溶液为接收介质,在(32±1)℃条件下,磁力搅拌器350rpm搅拌,每间隔一小时取样0.5mL然后用PBS溶液0.5mL补足体积,在25小时后终止实验。对照组加样液中用等体积PBS代替实验组中siRNA,其余操作相同。本实验中,siRNA为Cy5荧光标记,如前所述,配制壳-脂-siRNA溶液,并以PBS做系列稀释,得到在激发波长620nm、发射波长680nm时有浓度-荧光强度的比例关系,绘制标准曲线,回归方程:y=812.87X+0.8908(X为壳-脂-siRNA溶液中siRNA含量,y为荧光强度,回归系数0.9972)通过测定取样液的荧光强度通过回归方程计算取样液中壳-脂-siRNA含量,计算透过率(见图13)。透过率=(接收池中siRNA含量/加样液中siRNA含量)×100%由图13可知,壳聚糖修饰脂质体可携载siRNA透过皮肤,大约在20小时左右透过率最高。实施例6壳聚糖修饰脂质体纳米粒药物递送系统的动物皮肤敏感实验以PBS缓冲液作为对照,进行了壳聚糖修饰脂质体对豚鼠皮肤毒性和致敏性实验。选取健康成年雄性豚鼠4只,体重为250-300g,待豚鼠适应环境后,于实验前24h,将脊柱两侧对称使用脱毛剂脱毛,脱毛区域面积至少3cm×3cm,脱毛后动物适应饲养一天,在实验前检查去毛区域皮肤有无破损。在室温18~29℃、相对湿度为40%~70%的条件下进行实验。脱毛后24h,在左侧脱毛区涂抹PBS缓冲液0.5mL,在右侧脱毛区涂抹0.5mL壳聚糖修饰脂质体;给药后1h,观察是否有皮肤急性毒性反应,每隔24h在同一部位重复给药1次,肉眼观察并记录涂药部位有无红斑和水肿情况。皮肤过敏反应评分:根据2010版《中国药典》中的皮肤过敏反应程度和刺激强度评分标准评分,计算平均分值,同时注意观察豚鼠是否有哮喘、呼吸困难及站立不稳等全身性过敏反应。皮肤急性毒性实验结果:动物给药后1h,壳聚糖修饰脂质体在豚鼠皮肤涂药部位均未见红斑和水肿,与对照组比较无差别,动物未出现震颤、抽搐、流涎、腹泻、嗜睡和昏迷等症状,动物表现基本正常,无死亡现象,由此可初步证明壳聚糖修饰脂质体无皮肤急性毒性。多次给药皮肤刺激性实验结果:涂药后每隔24h观察动物皮肤,壳聚糖修饰脂质体对豚鼠皮肤刺激性实验结果见表3,涂药部位均未见红斑、水肿、色素沉着、出血点、皮肤粗糙或皮肤变薄等现象,3-4d后除毛部位有正常新毛长出,故壳聚糖修饰脂质体对豚鼠皮肤的刺激性估分均为0,皮肤过敏反应强度为无刺激性。表4壳聚糖修饰脂质体皮肤刺激性实验结果(n=4)序列表<110>广东和康众联健康产业管理有限公司<120>荷载小干扰RNA的脂质体纳米粒药物递送系统及其制备方法和应用<160>2<170>SIPOSequenceListing1.0<210>1<211>21<212>RNA<213>人工序列(ArtificialSequence)<400>1guacaacagccaucagucuuu21<210>2<211>21<212>RNA<213>人工序列(ArtificialSequence)<400>2cucauguugucgguagucaga21当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1