一种金线莲配方颗粒的制备方法与流程
本发明属于中成药制备技术领域,具体涉及一种金线莲配方颗粒的制备方法。
背景技术:
金线莲(anoectochilusroxburghi)又名金线兰、金丝草等,是兰科(orchidaceae)开唇兰属(anoectochilus)的多年生草本植物。金线莲是我国民间珍稀药材,主要含有多酚类、黄酮类、多糖类、皂苷类、甾体类、生物碱、挥发油、氨基酸和矿质元素等多种化学物质。金线莲具有清热凉血、祛风利湿、强心利尿、滋阴润肺、保肝护肝、防癌抗癌、降血压、降血糖、降血压等功效,有较强的抗氧化作用,主治糖尿病、肿瘤、肺炎、高血压和急慢性肝炎等症,素有“药王”、“金草”等美称,几百年来为民间常用草药使用,在福建和台湾民间使用尤广。
中药配方颗粒是传统中药饮片经现代工艺手段制备的颗粒状产品,具中药配方颗粒是在中医药理论指导下,采用现代科技手段将传统中药饮片按一定的生产工艺制成的提取物与适当辅料或药材细粉制成的粉状或颗粒状产品,有携带方便,即冲即服的特点,更加能适应现代快节奏的生活方式。在实际生产中,中药配方颗粒多以流浸膏或干膏为原料,粘度大,吸湿性强,在生产和储存过程中容易造成药物混合不均匀、易潮解等现象,从而影响颗粒的临床疗效。
技术实现要素:
本发明的目的在于克服现有技术缺陷,提供一种金线莲配方颗粒的制备方法。
本发明的原理如下:
本发明改变提取物与辅料的固-固混合方式,将金线莲提取物冻干品与辅料共同溶解于含有粘合剂的水相中,制成液体均一相,并通过冷冻干燥制备成中间体冻干粉,再进行湿法制粒,从而使提取物与辅料实现分子层面的混合,降低金线莲配方颗粒的吸湿性并改善金线莲有效成分含量均匀度。
本发明的技术方案如下:
一种金线莲配方颗粒的制备方法,包括如下步骤:
(1)取金线莲药材,加浓度为60-80%的乙醇水溶液回流提取3次,
其中,第一次加金线莲药材的质量的8~14倍量的乙醇水溶液,加热回流提取1~2h,获得第一提取液,趁热用100~200目的筛网过滤,获得第一滤液;
第二次加金线莲药材的质量的5~8倍量的乙醇水溶液,加热回流提取0.5~1h,获得第二提取液,趁热用100~200目的筛网过滤,获得第二滤液;
第三次加金线莲药材的质量的4~6倍量的乙醇水溶液,加热回流提取0.5~1h,获得第三提取液,趁热用100~200目的筛网过滤,获得第三滤液;
(2)合并第一至第三滤液,混匀,在60~70℃下加压浓缩至相对密度为1.2~1.3的浸膏;
(3)将上述浸膏进行真空冷冻干燥,得金线莲提取物冻干粉;
(4)将上述金线莲提取物冻干粉与辅料混合于浓度为2-4wt%的淀粉浆溶液中,进行真空冷冻干燥,得金线莲颗粒中间体冷冻干燥粉末;
(5)将上述金线莲颗粒中间体冷冻干燥粉末与适量浓度为2-4wt%的淀粉浆溶液混合制成软材,过9-11目筛,再经烘干和整粒,即得每克相当于6-9g生药的所述金线莲配方颗粒。
在本发明的一个优选实施方案中,所述步骤(1)中,第一次加金线莲药材的质量的10倍量的乙醇水溶液,加热回流提取1h,获得第一提取液,趁热用100~200目的筛网过滤,获得第一滤液。
在本发明的一个优选实施方案中,所述步骤(1)中,第二次加金线莲药材的质量的8倍量的乙醇水溶液,加热回流提取1h,获得第二提取液,趁热用100~200目的筛网过滤,获得第二滤液。
在本发明的一个优选实施方案中,所述步骤(1)中,第三次加金线莲药材的质量的5倍量的乙醇水溶液,加热回流提取0.5h,获得第三提取液,趁热用100~200目的筛网过滤,获得第三滤液。
在本发明的一个优选实施方案中,所述步骤(3)中的真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为46~72h,最佳解析干燥温度为40℃,时间为2~4h。
在本发明的一个优选实施方案中,所述步骤(4)中的真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为46~72h,最佳解析干燥温度为40℃,时间为2~4h。
在本发明的一个优选实施方案中,所述辅料为糊精、微晶纤维素、可溶性淀粉、乳糖和甘露醇中的一种或两种,且所述金线莲提取物冻干粉与辅料的质量比为2-4∶1。
在本发明的一个优选实施方案中,所述步骤(5)中的烘干的温度为50-60℃。
本发明的有益效果是:
1、本发明的制备方法制备的产品吸湿性低,药物含量均匀度高,每克相当于生药量6-9g,吸湿平衡时间较传统工艺延长范围在13-24%,平衡吸湿量降低范围在15-25%。
2、本发明的制备方法简单高效。
附图说明
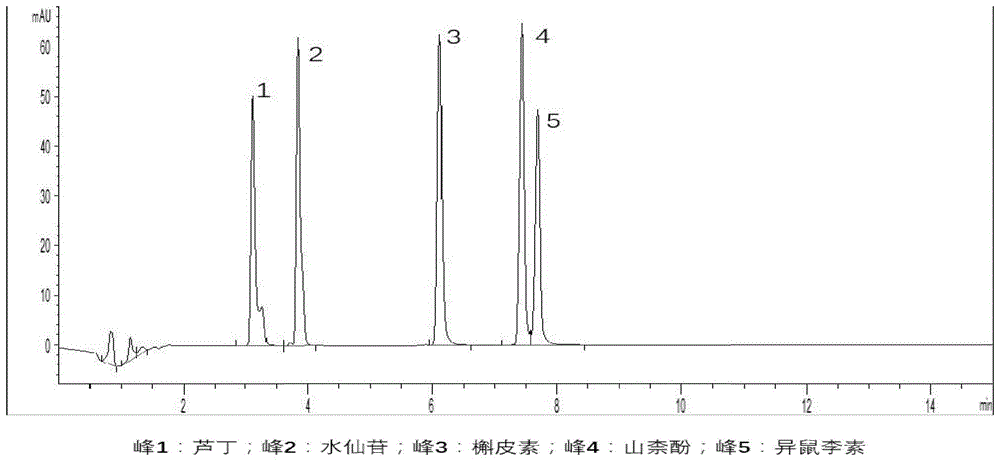
图1为对照品参照物溶液的uplc特征谱图。
图2为本发明制得的金线莲配方颗粒供试品的uplc特征谱图。
具体实施方式
以下通过具体实施方式结合附图对本发明的技术方案进行进一步的说明和描述。
对比例1
本对比例为现有技术中制备金线莲配方颗粒,具体如下:
(1)取金线莲药材,加浓度为60%的乙醇水溶液回流提取3次,
其中,第一次加金线莲药材的质量的14倍量的乙醇水溶液,加热回流提取2h,获得第一提取液,趁热用100目的筛网过滤,获得第一滤液;
第二次加金线莲药材的质量的8倍量的乙醇水溶液,加热回流提取1h,获得第二提取液,趁热用100目的筛网过滤,获得第二滤液;
第三次加金线莲药材的质量的4倍量的乙醇水溶液,加热回流提取1h,获得第三提取液,趁热用100目的筛网过滤,获得第三滤液;
(2)合并第一至第三滤液,混匀,在70℃下加压浓缩至相对密度为1.3的浸膏;
(3)将上述浸膏进行真空冷冻干燥,得金线莲提取物冻干粉;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(4)将上述金线莲提取物冻干粉与糊精以2∶1的质量比混合,适量4wt%的淀粉浆溶液混合制成软材,过10目筛,再经60℃烘干5h和整粒,即得金线莲配方颗粒
经检测,本对比例制得的金线莲配方颗粒的平衡吸湿量25.68%,平衡时间78.35h。建立金线莲配方颗粒特征图谱,测定金线莲配方颗粒指标成分,每克的金线莲配方颗粒含芦丁14ug,水仙苷247ug,槲皮素180ug,山奈酚8.5ug,异鼠李糖86.7ug及相对药材的转移率80.5%。
实施例1
(1)取金线莲药材,加浓度为60%的乙醇水溶液回流提取3次,
其中,第一次加金线莲药材的质量的14倍量的乙醇水溶液,加热回流提取2h,获得第一提取液,趁热用100目的筛网过滤,获得第一滤液;
第二次加金线莲药材的质量的8倍量的乙醇水溶液,加热回流提取1h,获得第二提取液,趁热用100目的筛网过滤,获得第二滤液;
第三次加金线莲药材的质量的4倍量的乙醇水溶液,加热回流提取1h,获得第三提取液,趁热用100目的筛网过滤,获得第三滤液;
(2)合并第一至第三滤液,混匀,在70℃下加压浓缩至相对密度为1.3的浸膏;
(3)将上述浸膏进行真空冷冻干燥,得金线莲提取物冻干粉;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(4)将上述金线莲提取物冻干粉与糊精以2∶1的质量比混合于浓度为2wt%的淀粉浆溶液中,进行真空冷冻干燥,得金线莲颗粒中间体冷冻干燥粉末;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(5)将上述金线莲颗粒中间体冷冻干燥粉末与适量4wt%的淀粉浆溶液混合制成软材,过10目筛,再经60℃烘干5h和整粒,即得所述金线莲配方颗粒。
经检测,本实施例制得的金线莲配方颗粒的平衡吸湿量较对比例1制备的金线莲配方颗粒降低了18%,平衡时间延长了13%。建立了金线莲配方颗粒特征图谱,测定金线莲配方颗粒指标成分,每克的金线莲配方颗粒含芦丁12ug,水仙苷236ug,槲皮素178ug,山奈酚8.6ug,异鼠李糖87.5ug及相对药材的转移率81%。
实施例2
(1)取金线莲药材,加浓度为60%的乙醇水溶液回流提取3次,
其中,第一次加金线莲药材的质量的10倍量的乙醇水溶液,加热回流提取2h,获得第一提取液,趁热用200目的筛网过滤,获得第一滤液;
第二次加金线莲药材的质量的8倍量的乙醇水溶液,加热回流提取1h,获得第二提取液,趁热用200目的筛网过滤,获得第二滤液;
第三次加金线莲药材的质量的6倍量的乙醇水溶液,加热回流提取1h,获得第三提取液,趁热用200目的筛网过滤,获得第三滤液;
(2)合并第一至第三滤液,混匀,在70℃下加压浓缩至相对密度为1.2的浸膏;
(3)将上述浸膏进行真空冷冻干燥,得金线莲提取物冻干粉;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(4)将上述金线莲提取物冻干粉与可溶性淀粉以2∶1的质量比混合于浓度为2wt%的淀粉浆溶液中,进行真空冷冻干燥,得金线莲颗粒中间体冷冻干燥粉末;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(5)将上述金线莲颗粒中间体冷冻干燥粉末与适量2wt%的淀粉浆溶液混合制成软材,过10目筛,再经60℃烘干5h和整粒,即得所述金线莲配方颗粒。
经检测,本实施例制得的金线莲配方颗粒的平衡吸湿量较对比例1制备的金线莲配方颗粒降低了19%,平衡时间延长了15%。建立了金线莲配方颗粒特征图谱,测定金线莲配方颗粒指标成分,每克的金线莲配方颗粒含芦丁11.5ug,水仙苷221ug,槲皮素164ug,山奈酚8.8ug,异鼠李糖76.4ug及相对药材的转移率75%。
实施例3
(1)取金线莲药材,加浓度为60%的乙醇水溶液回流提取3次,
其中,第一次加金线莲药材的质量的14倍量的乙醇水溶液,加热回流提取2h,获得第一提取液,趁热用100目的筛网过滤,获得第一滤液;
第二次加金线莲药材的质量的8倍量的乙醇水溶液,加热回流提取1h,获得第二提取液,趁热用100目的筛网过滤,获得第二滤液;
第三次加金线莲药材的质量的4倍量的乙醇水溶液,加热回流提取1h,获得第三提取液,趁热用100目的筛网过滤,获得第三滤液;
(2)合并第一至第三滤液,混匀,在70℃下加压浓缩至相对密度为1.3的浸膏;
(3)将上述浸膏进行真空冷冻干燥,得金线莲提取物冻干粉;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(4)将上述金线莲提取物冻干粉与微晶纤维素以2∶1的质量比混合于浓度为4wt%的淀粉浆溶液中,进行真空冷冻干燥,得金线莲颗粒中间体冷冻干燥粉末;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(5)将上述金线莲颗粒中间体冷冻干燥粉末与适量4wt%的淀粉浆溶液混合制成软材,过10目筛,再经60℃烘干5h和整粒,即得所述金线莲配方颗粒。
经检测,本实施例制得的金线莲配方颗粒的平衡吸湿量较对比例1制备的金线莲配方颗粒降低了20%,平衡时间延长了18%。建立了金线莲配方颗粒特征图谱,测定金线莲配方颗粒指标成分,每克的金线莲配方颗粒含芦丁11.5ug,水仙苷215ug,槲皮素189ug,山奈酚8.9ug,异鼠李糖79.8ug及相对药材的转移率83%。
实施例4
(1)取金线莲药材,加浓度为60%的乙醇水溶液回流提取3次,
其中,第一次加金线莲药材的质量的14倍量的乙醇水溶液,加热回流提取2h,获得第一提取液,趁热用100目的筛网过滤,获得第一滤液;
第二次加金线莲药材的质量的8倍量的乙醇水溶液,加热回流提取2h,获得第二提取液,趁热用100目的筛网过滤,获得第二滤液;
第三次加金线莲药材的质量的4倍量的乙醇水溶液,加热回流提取1h,获得第三提取液,趁热用100目的筛网过滤,获得第三滤液;
(2)合并第一至第三滤液,混匀,在70℃下加压浓缩至相对密度为1.3的浸膏;
(3)将上述浸膏进行真空冷冻干燥,得金线莲提取物冻干粉;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(4)将上述金线莲提取物冻干粉与乳糖以2∶1的质量比混合于浓度为4wt%的淀粉浆溶液中,进行真空冷冻干燥,得金线莲颗粒中间体冷冻干燥粉末;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(5)将上述金线莲颗粒中间体冷冻干燥粉末与适量4wt%的淀粉浆溶液混合制成软材,过10目筛,再经60℃烘干5h和整粒,即得所述金线莲配方颗粒。
经检测,本实施例制得的金线莲配方颗粒的平衡吸湿量较对比例1制备的金线莲配方颗粒降低了14%,平衡时间延长了12%。建立了金线莲配方颗粒特征图谱,测定金线莲配方颗粒指标成分,每克的金线莲配方颗粒含芦丁14ug,水仙苷245ug,槲皮素186ug,山奈酚8.0ug,异鼠李糖83.8ug及相对药材的转移率83%。
实施例5
(1)取金线莲药材,加浓度为60%的乙醇水溶液回流提取3次,
其中,第一次加金线莲药材的质量的14倍量的乙醇水溶液,加热回流提取2h,获得第一提取液,趁热用100目的筛网过滤,获得第一滤液;
第二次加金线莲药材的质量的8倍量的乙醇水溶液,加热回流提取1h,获得第二提取液,趁热用100目的筛网过滤,获得第二滤液;
第三次加金线莲药材的质量的4倍量的乙醇水溶液,加热回流提取1h,获得第三提取液,趁热用100目的筛网过滤,获得第三滤液;
(2)合并第一至第三滤液,混匀,在70℃下加压浓缩至相对密度为1.2的浸膏;
(3)将上述浸膏进行真空冷冻干燥,得金线莲提取物冻干粉;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(4)将上述金线莲提取物冻干粉与辅料(由糊精和乳糖以1∶1的质量比组成)以2∶1的质量比混合于浓度为4wt%的淀粉浆溶液中,进行真空冷冻干燥,得金线莲颗粒中间体冷冻干燥粉末;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(5)将上述金线莲颗粒中间体冷冻干燥粉末与适量4wt%的淀粉浆溶液混合制成软材,过10目筛,再经60℃烘干5h和整粒,即得所述金线莲配方颗粒。
经检测,本实施例制得的金线莲配方颗粒的平衡吸湿量较对比例1制备的金线莲配方颗粒降低了21%,平衡时间延长了18%。建立了金线莲配方颗粒特征图谱,测定金线莲配方颗粒指标成分,每克的金线莲配方颗粒含芦丁12.5ug,水仙苷245ug,槲皮素165ug,山奈酚9.0ug,异鼠李糖80.2ug及相对药材的转移率80.8%。
实施例6
(1)取金线莲药材,加浓度为60%的乙醇水溶液回流提取3次,
其中,第一次加金线莲药材的质量的14倍量的乙醇水溶液,加热回流提取2h,获得第一提取液,趁热用100目的筛网过滤,获得第一滤液;
第二次加金线莲药材的质量的8倍量的乙醇水溶液,加热回流提取1h,获得第二提取液,趁热用100目的筛网过滤,获得第二滤液;
第三次加金线莲药材的质量的4倍量的乙醇水溶液,加热回流提取1h,获得第三提取液,趁热用100目的筛网过滤,获得第三滤液;
(2)合并第一至第三滤液,混匀,在70℃下加压浓缩至相对密度为1.2的浸膏;
(3)将上述浸膏进行真空冷冻干燥,得金线莲提取物冻干粉;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(4)将上述金线莲提取物冻干粉与辅料(由糊精和淀粉以1∶1的质量比组成)以2∶1的质量比混合于浓度为2wt%的淀粉浆溶液中,进行真空冷冻干燥,得金线莲颗粒中间体冷冻干燥粉末;该真空冷冻干燥具体为:预冻结温度-20℃,保持24h,冷阱温度-50℃,绝对压力3pa,升华干燥温度为5℃,时间为72h,最佳解析干燥温度为40℃,时间为2~4h;
(5)将上述金线莲颗粒中间体冷冻干燥粉末与适量4wt%的淀粉浆溶液混合制成软材,过10目筛,再经60℃烘干5h和整粒,即得所述金线莲配方颗粒。
经检测,本实施例制得的金线莲配方颗粒的平衡吸湿量较对比例1制备的金线莲配方颗粒降低了22%,平衡时间延长了19%。建立了金线莲配方颗粒特征图谱,测定金线莲配方颗粒指标成分,每克的金线莲配方颗粒含芦丁10.3ug,水仙苷206ug,槲皮素158ug,山奈酚8.4ug,异鼠李糖79.8ug及相对药材的转移率78%。
上述各实施例和对比例中金线莲配方颗粒特征图谱的建立方法如下:
(1)对照品参照物溶液的配制:
取芦丁,水仙苷,槲皮素,异鼠李糖,山奈酚对照品,精密称定,加甲醇制成每1ml分别含芦丁60ug,水仙苷50ug,槲皮素45ug,异鼠李素40ug,山柰酚40ug的混合溶液,作为对照品参照物溶液。
(2)供试品溶液的制备:
取金线莲配方颗粒,粉碎,过六号筛,粉末0.2-0.3g,加入甲醇提取,提取液离心后过滤,去续滤液即得;
(3)高效液相色谱测定:
分别吸取对照品参照物溶液和供试品溶液各20ul,注入高效液相色谱仪,测定条件:acquityuplchsst3(2.1×100mm,1.8μm);流动相洗脱条件:0-1min,水∶乙腈(85∶15);1-13min,水∶乙腈(30∶70);13-15min,水∶乙腈(85∶15);。流速:0.3min.ml-1;检测波长:368nm,柱温:38℃,进样量5μl。
各实施例制得的金线莲配方颗粒的uplc特征图谱应呈现7-10个共有特征峰,如图2所示,其中包括芦丁(峰1)、水仙苷(峰2)、槲皮素(峰3)、山奈酚(峰4)、异鼠李糖(峰5),且与相应的对照品参照物溶液的特征峰有相同的保留时间(如图1所示)。
此外,按最终成品与投料量之比测定金线莲配方颗粒的出膏率,范围为13.9%-25.6%。
以上所述,仅为本发明的较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
- 还没有人留言评论。精彩留言会获得点赞!