小分子抑制剂在制备抑制鸟氨酸脱羧酶与鸟氨酸脱羧酶抗酶1的相互作用的制药用途的制作方法
本发明涉及一种小分子抑制剂及其制药用途,具体为-[n'-(4-二甲基氨基苯甲基)-肼基-[1,3,5]三氮唑-2,4-二胺、或1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺、或1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮及其同类化合物的制药用途。
背景技术:
蛋白质是生物体的主要组成成分之一,是完成各种生命活动的主要物质。在各种蛋白质中,蛋白酶对生命活动至关重要,几乎所有生物体内的生化反应过程都由蛋白酶进行催化。生物体内各种蛋白酶的活性具有严格的调控机制,一旦其调控机制出现问题,造成蛋白酶的活性过高、过低或者是完全失活,都会造成相应的各类疾病。因此,通过药物来调控蛋白酶的活性,使其恢复和保持在正常水平,具有非常重要的理论意义和现实意义。以结构为基础的药物设计,是设计以蛋白质为靶标的药物的一个非常重要的手段。
多胺(polyamines)是一类从氨基酸代谢产生的带正电的阳离子小分子,在所有生物体中都存在,对细胞生长、分化、存活及正常生物学功能等都不可缺少。多胺带多正电荷的特性,使它们能通过与带负电荷的生物大分子(dna、rna、蛋白质、细胞膜等)形成静电作用,从而调控非常广泛的生物学过程,包括染色体结构形成、dna合成与稳定、dna复制、转录和翻译、蛋白质磷酸化、核糖体生成、离子通道和膜表面受体的调控、自由基清除等。天然的多胺有很多种。在哺乳动物中,天然存在的有三种,即putrescine(腐胺),spermidine(精脒),spermine.(精胺),它们对哺乳动物正常生长和发育必不可少。由于多胺具有重要的生物学功能,其细胞内水平受到严格的调控。在快速繁殖的细胞(如肿瘤细胞)中,多胺水平及odc表达水平也会上升和失调。多胺水平升高,伴随着细胞增殖加快、凋亡减少、以及肿瘤浸润和转移相关基因的表达水平升高等。因此,多胺的调控,成为肿瘤治疗和药物研发中的一个重要手段。
多胺代谢的起始底物是鸟氨酸(ornithine),它是精氨酸在尿素循环(ureacycle)中被精氨酸酶(arginase)催化的反应产物。odc是多胺合成途径的第一个酶,催化从鸟氨酸(ornithine)到腐胺的反应,该步催化反应也是多胺合成途径的一个限速步骤。因此,合成odc抑制剂,抑制腐胺的生成,是目前很受关注的一个肿瘤治疗途径。同时,由于病原微生物也需要正常的多胺水平,因此odc抑制剂也成为针对病原微生物(如导致非洲锥虫病的布氏锥虫)的重要靶标。
当前,odc的抑制剂dfmo(α-二氟甲基鸟氨酸)已经被用于临床,辅助癌症的化疗。但其与odc的结合能力较弱,作用浓度很高,且由于是与odc形成共价键的自杀性抑制剂,毒副作用非常大。因此,非常有必要开发出具有更好效果的odc新型抑制剂。
技术实现要素:
本发明的目的是利用计算机辅助筛选,得到能同时具有抑制鸟氨酸脱羧酶(odc)酶活性、稳定鸟氨酸脱羧酶(odc)非活性二聚体、抑制鸟氨酸脱羧酶与鸟氨酸脱羧酶抗酶1(odc-oaz1)的相互作用的多功能小分子化合物。
本发明的技术方案是,通过分析odc的晶体结构,利用蛋白质药物口袋分析软件,找出并确定可以用于药物设计的结合口袋,并对该口袋进行小分子药物的筛选和验证。
按照以上方案,首先利用pocket蛋白质药物口袋分析软件,以人源odc的晶体结构为基础,对其底物及plp配体结合口袋进行了分析。通过pocket软件的辅助,确定了以odc同源二聚体界面上的底物和plp配体所在区域为一个药物设计口袋。为验证该口袋作为药物口袋的可行性,进行了药物筛选和实验验证。
实验对象是人源odc,但由于不同来源的odc之间具有同源性,因此抑制剂可能同样能够作用于其它非人源的odc,以及与odc的底物及plp结合口袋高度同源的蛋白质。
基于上述工作,本发明的技术方案筛选并合成了小分子抑制剂化合物,具体为6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺的合成方法,包括如下步骤:
反应容器中,依次加入d24-1-1、水合肼和水,氮气保护,升温至70℃-90℃,反应5-8h后降至室温,过滤,真空干燥,得白色d24-1-2固体;
反应容器中,依次加入d24-1-2、d24-1-3和甲醇,氮气保护,25-40℃下反应15-20h,冷却至室温,过滤,所得固体用dmso打浆,氮气保护,过滤,真空干燥得白色d24-1-4固体化合物,即得到产物6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺,合成路线如下:
所述的水合肼的质量浓度为75-90%。
所述的d24-1-1、质量浓度为75-90%的水合肼、水的质量比为1:1.5-2.5:8-15。
所述的d24-1-2、d24-1-3、甲醇的质量比为1:0.9-1.1:8-18。
本发明的将所述制备得到的小分子化合物6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺作为抑制剂在制备抑制鸟氨酸脱羧酶与鸟氨酸脱羧酶抗酶1的相互作用的药物上的应用。
或将所述制备得到的6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺在制备稳定鸟氨酸脱羧酶非活性二聚体的药物上的应用。
更进一步的,本发明还提供1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺在制备抑制鸟氨酸脱羧酶与鸟氨酸脱羧酶抗酶1的相互作用上的应用。
更进一步的,本发明还提供1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮在制备抑制鸟氨酸脱羧酶与鸟氨酸脱羧酶抗酶1的相互作用上的应用。
更进一步的,本发明还提供1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺在制备稳定鸟氨酸脱羧酶非活性二聚体的药物上的应用。
更进一步的,本发明还提供1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮在制备稳定鸟氨酸脱羧酶非活性二聚体的药物上的应用。
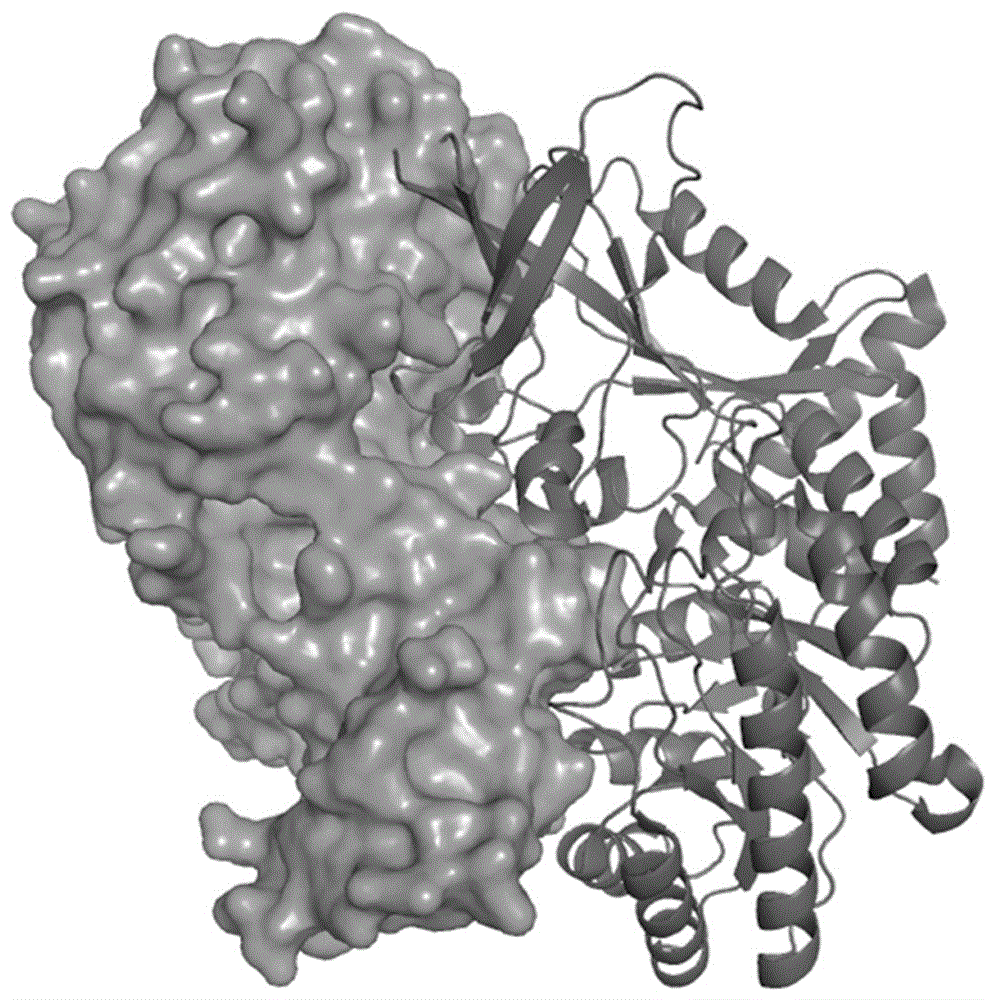
本发明的技术方案中,为了筛选得到同时具有3种功能的小分子,采用如下过程和策略:首先,基于对odc同源二聚体(参见图1,所述的图1为人odc同源二聚体结构示意图,一条链显示为表面,另一条显示为卡通。)的结构分析,确定利用其辅因子plp和底物结合位点共同组成的口袋(参见图2,所述的图2为odc的底物和plp结合位点示意图,一条链显示为表面,另一条显示为卡通,底物(腐氨)和plp显示为棍状。)作为筛选靶点,进行小分子筛选。为了得到能够抑制odc活性的分子,利用了以下3个步骤。
第一步,首先移除对该口袋贡献残基数较少(参见图3)的残基,然后进行分子对接,并要求小分子的结合打分低于plp的结合打分。
第二步,为了得到能够抑制odc酶活性并稳定odc非活性同源二聚体的小分子,将第一步得到的小分子进一步对接到图3的二聚体共同口袋中,并要求小分子具有与第一步类似的结合构象,且结合打分低于第一步中的打分。所述的图3为二聚体界面口袋示意图,口袋显示为半透明表面,周围棍状为odc同源二聚体上的氨基酸残基侧链,组成该口袋的残基有其中一个蛋白单体的phe65,ala67,lys69,cys70,asp88,ala90,ala111,asn112,pro113,thr132,arg154,cys164,arg165,leu166,phe170,phe196,his197,gly199,ser200,gly201,gly235,gly236,gly237,phe238,pro239,glu274,pro275,gly276,arg277,tyr278,asn327,cys328,tyr331,asp332,his333,ala388,tyr389,以及另一个蛋白单体上的tyr323,thr359,cys360,asp361,gly362,leu363,phe397,asn398;口袋中的细棍状分别为plp、腐氨及odc的已知抑制剂dfmo。
第三步,为了进一步从第二步得到的分子中筛选能抑制odc-oaz1相互作用的分子,将小分子对接到odc-oaz1复合物结合界面有这两个蛋白共同形成的结合口袋部位(图4,所述的图4:用于对接筛选的odc-oaz1复合物口袋。图中黑色为odc,浅灰色为oaz1,球形显示的为plp。plp结合位点及周围空间为小分子对接区域)。进一步要求,小分子不能以与第一步和第二步相似的构象,结合到该口袋。
能够同时满足上述规则的小分子,被认为是可以同时具有抑制odc活性、稳定odc非活性二聚体和抑制odc-oaz1相互作用的小分子。
能够结合到odc的图3口袋的小分子,虽然通常能抑制odc的酶活性,但并不能天然具有后面两种功能。例如odc的特异性抑制剂dfmo,就没有报到和实验证据表明具有后面两种功能;相反,dfmo能够在一定程度上促进odc和oaz1的相互作用,而这一点也是dfmo的临床功能受限的主要因素之一。因此,经过本发明技术方案的创新性筛选途径,得到的小分子是十分具有创新价值的。
附图说明
图1为人odc同源二聚体结构示意图,一条链显示为表面,另一条显示为卡通。
图2为odc的底物和plp结合位点示意图,一条链显示为表面,另一条显示为卡通,底物(腐氨)和plp显示为棍状。
图3为二聚体界面口袋示意图,口袋中的细棍状分别为plp、腐氨及odc的已知抑制剂dfmo。
图4:用于对接筛选的odc-oaz1复合物口袋。图中黑色为odc,浅灰色为oaz1,球形显示的为plp。
图5:基于荧光共振能量转移(fret)检测实施例1的小分子抑制剂6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺对odc-oaz1相互作用的抑制。
图6是odc在不同盐浓度下的寡聚状态。
图7是在50mmnacl条件下,实施例1的小分子抑制剂6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺、dfmo及不添加任何小分子的溶液对照组对odc寡聚状态的影响。
图8是在150mmnacl条件下,实施例1的小分子抑制剂6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺、dfmo及不添加任何小分子的溶液对照组对odc寡聚状态的影响。
图9为实施例1的小分子抑制剂6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺对移植瘤的体积增长的影响。
图10为实施例1的小分子抑制剂6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺对移植瘤的重量增长的影响。
图11为实施例1的小分子抑制剂6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺对裸鼠体重的影响。
图12为不同浓度的实施例1的小分子抑制剂6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺对肿瘤组织形态的影响。
图13为实施例1的小分子抑制剂6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺高效液相色谱图。
图14为实施例1的小分子抑制剂6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺质谱图。
图15为实施例1的小分子抑制剂6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺核磁氢谱图。
图16为抑制剂1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮对odc酶活的半数抑制浓度。
图17是基于荧光共振能量转移(fret)检测实施例2的小分子抑制剂1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮对odc-oaz1相互作用的抑制。
图18是odc在不同盐浓度下的寡聚状态。
图19是在50mmnacl条件下,实施例2的小分子抑制剂1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮、dfmo及不添加任何小分子的溶液对照组对odc寡聚状态的影响。
图20是在150mmnacl条件下,实施例2的小分子抑制剂1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮、dfmo及不添加任何小分子的溶液对照组对odc寡聚状态的影响。
图21为抑制剂1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺对odc酶活的半数抑制浓度。
图22是基于荧光共振能量转移(fret)检测实施例3的小分子抑制剂1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺对odc-oaz1相互作用的抑制。
图23是odc在不同盐浓度下的寡聚状态。
图24是在50mmnacl条件下,实施例3的小分子抑制剂1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺、dfmo及不添加任何小分子的溶液对照组对odc寡聚状态的影响。
图25是在150mmnacl条件下,实施例3的小分子抑制剂1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺、dfmo及不添加任何小分子的溶液对照组对odc寡聚状态的影响。
具体实施方式
实施例1
小分子抑制剂:6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺的化学合成途径。
于100ml单口瓶中,依次加入d24-1-1(购自上海阿拉丁生化科技股份有限公司)5g、水合肼(购自上海阿拉丁生化科技股份有限公司)(80%wt)11g和水50ml,氮气保护,升温至85℃,反应7h,降温至室温,过滤,真空干燥(45℃,24h),得白色d24-1-2固体3.85g,收率79.4%。
于100ml单口瓶中,依次加入d24-1-23.5g、d24-1-3(购自上海阿拉丁生化科技股份有限公司)3.8g和甲醇40ml,氮气保护,30℃下反应18h,冷却至室温,过滤,所得固体用dmso20ml打浆,氮气保护,过滤,45℃真空干燥12h,得白色d24-1-4固体化合物2.1g(产率31.1%)。
d24-1-4的纯度用hplc进行检测,达到98%以上,如图13所示。
d24-1-4的分子量用质谱进行检测,与理论分子量吻合,如图14所示。
d24-1-4的核磁结果也与理论值符合,如图15所示。
图19:d24-1-4的核磁氢谱分析结果。1hnmr(400mhz,dmso)δ10.23(s,1h),7.94(s,1h),7.42(d,j=8.9hz,2h),6.73(d,j=8.9hz,2h),6.27(br,4h),2.95(d,j=4.1hz,6h).
综上,该合成途径能够有效合成高纯度的d-24-1-4化合物。
对6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺小分子,为了验证其对odc-oaz1相互作用的抑制,使用了基于荧光共振能量转移(fret)的方法。通过表达纯化带有ypet荧光蛋白标记的odc蛋白(ypet-odc)和带有cypet荧光标记的oaz1(cypet-oaz1),然后将其共同孵育。在正常情况下,由于odc与oaz1相互结合,可以使ypet和cypet靠近,从而发生fret现象。若小分子能够抑制odc和oaz1的相互作用,就可以从一定程度上降低fret信号。如图5所述的基于荧光共振能量转移(fret)检测小分子对odc-oaz1相互作用的抑制,6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺小分子能够明显抑制fret信号。这意味着6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺小分子能够抑制odc和oaz1的相互作用。
在前面专利中验证了6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺对odc酶活性的抑制,为了进一步验证6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺分子是否能够稳定odc同源二聚体,利用分析型体积排阻凝胶柱对odc的寡聚状态进行了分析。如图6(图6为odc在不同盐浓度下的寡聚状态不一样。流出时间越早,代表在该条件下odc同源二聚体形成越容易),odc在不同盐(nacl)浓度下,其寡聚状态不一样,从凝胶柱中流出的时间不一样(时间越早,分子量越大):在50mmnacl条件下,odc主要以二聚体形式存在(计算分子量为105.1kda),在300mmnacl条件下,odc主要以单体形式存在(计算分子量为53.0kda),而在150mmnacl条件下,odc中单体和二聚体处于共存和快速交换状态,对应流出峰位于两者之间。
如图7所示(图7为在50mmnacl条件下,检测6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺分子和dfmo对odc寡聚状态的影响,不添加任何小分子的溶液作为对照。三条流出曲线几乎完全重合,意味着6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺分子和dfmo在该条件下都不破坏odc同源二聚体。),在50mmnacl条件下,6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺分子、dfmo和无小分子对照的流出峰高度重合,意味着a分子和dfmo都不破坏odc同源二聚体的稳定性。如图8所示(图8为在150mmnacl条件下,检测6-[n’-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺分子和dfmo对odc寡聚状态的影响,不添加任何小分子的溶液作为对照。添加6-[n’-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺分子的曲线流出峰前移,而dfmo和空白对照的流出峰重叠。这意味着6-[n’-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺分子能够稳定odc同源二聚体,而dfmo不能。),在150mmnacl条件下,6-[n’-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺分子能够显著使流出峰前移,意味着odc同源二聚体含量增加。而dfmo与空白对照一致,表明dfmo不能促进odc同源二聚体的形成。
综合以上结果可以得出结论,本实施例所述的6-[n’-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺小分子是新型的、能够抑制odc酶活性、稳定odc同源二聚体、抑制odc-oaz1相互作用的新型小分子化合物。
对所述的6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺小分子,为了进一步研究其用作活体药物的潜力,评价了其肝微粒体(microsome)稳定性。所述的肝微粒体稳定性是指评价化合物是否被肝脏药物代谢酶所代谢,从而影响其生物利用度、并为代谢产物及其途径的鉴定的设计提供参数。在检测时间内,比对照药物的剩余百分比高,可以认为是比较稳定的。
通过将a549细胞接种于裸鼠体内,构建了移植瘤模型。然后通过腹腔连续给药10天,评价了6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺化合物对移植瘤的抑制作用。如图9和图10所示,6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺化合物在3.6mg/kg和0.36mg/kg的给药剂量下,均能明显抑制肿瘤体积和重量的增长。如图11所示,在上述浓度下,裸鼠的体重并没有受到明显影响。如图12所示,给药裸鼠身上剥离的肿瘤组织具有明显差异。
综上,6-[n'-(4-二甲基氨基苯亚甲基)-肼基-[1,3,5]三氮唑-2,4-二胺化合物是一种安全的、有效的抑制肿瘤生长的化合物。
实施例2
小分子抑制剂1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮,购买自specs(http://www.specs.net)。
为了验证1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮小分子是否能够抑制odc的酶活性,通过高效液相色谱(hplc)检测酶催化产物腐胺,得到c小分子对odc酶活的半数抑制浓度约31.8μm(图16)。图16为利用高效液相色谱检测odc催化产物腐胺,通过与不添加小分子比较,计算小分子对odc酶活性的抑制效率。
对1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮小分子,为了验证其对odc-oaz1相互作用的抑制,使用了基于荧光共振能量转移(fret)的方法。通过表达纯化带有ypet荧光蛋白标记的odc蛋白(ypet-odc)和带有cypet荧光标记的oaz1(cypet-oaz1),然后将其共同孵育。在正常情况下,由于odc与oaz1相互结合,可以使ypet和cypet靠近,从而发生fret现象。若小分子能够抑制odc和oaz1的相互作用,就可以从一定程度上降低fret信号。如图17所述的基于荧光共振能量转移(fret)检测小分子对odc-oaz1相互作用的抑制,1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮小分子能够明显抑制fret信号。这意味着1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮小分子能够抑制odc和oaz1的相互作用。
上述验证了1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮对odc酶活性的抑制,为了进一步验证1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮分子是否能够稳定odc同源二聚体,利用分析型体积排阻凝胶柱对odc的寡聚状态进行了分析。如图18(图18为odc在不同盐浓度下的寡聚状态。流出时间越早,代表在该条件下odc同源二聚体形成越容易),odc在不同盐(nacl)浓度下,其寡聚状态不一样,从凝胶柱中流出的时间不一样(时间越早,分子量越大):在50mmnacl条件下,odc主要以二聚体形式存在(计算分子量为105.1kda),在300mmnacl条件下,odc主要以单体形式存在(计算分子量为53.0kda),而在150mmnacl条件下,odc中单体和二聚体处于共存和快速交换状态,对应流出峰位于两者之间。
如图19所示(图19为在50mmnacl条件下,检测1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮分子和dfmo对odc寡聚状态的影响,不添加任何小分子的溶液作为对照。三条流出曲线几乎完全重合,意味着1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮分子和dfmo在该条件下都不破坏odc同源二聚体),在50mmnacl条件下,1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮分子、dfmo和无小分子对照的流出峰高度重合,意味着1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮分子和dfmo都不破坏odc同源二聚体的稳定性。
如图20所示(图20为在150mmnacl条件下,检测1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮和dfmo对odc寡聚状态的影响,不添加任何小分子的溶液作为对照。添加1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮分子的曲线流出峰前移,而dfmo和空白对照的流出峰重叠。这意味着1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮分子能够稳定odc同源二聚体,而dfmo不能。),在150mmnacl条件下,1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮分子能够显著使流出峰前移,意味着odc同源二聚体含量增加。而dfmo与空白对照一致,表明dfmo不能促进odc同源二聚体的形成。
综合以上结果可以得出结论,本实施例所述的1,3-二甲基-8-(2-噻吩基)-3,7-二氢-1h-嘌呤-2,6-二酮小分子是新型的、能够抑制odc酶活性、稳定odc同源二聚体、抑制odc-oaz1相互作用的新型小分子化合物。
实施例3
小分子抑制剂:1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺,购买自specs(http://www.specs.net)。
为了验证1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺小分子是否能够抑制odc的酶活性,通过高效液相色谱(hplc)检测酶催化产物腐胺,得到c小分子对odc酶活的半数抑制浓度约31.8μm(图21)。图21为利用高效液相色谱检测odc催化产物腐胺,通过与不添加小分子比较,计算小分子对odc酶活性的抑制效率。
为了验证1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺分子对odc-oaz1相互作用的抑制,使用了基于荧光共振能量转移(fret)的方法。通过表达纯化带有ypet荧光蛋白标记的odc蛋白(ypet-odc)和带有cypet荧光标记的oaz1(cypet-oaz1),然后将其共同孵育。在正常情况下,由于odc与oaz1相互结合,可以使ypet和cypet靠近,从而发生fret现象。若小分子能够抑制odc和oaz1的相互作用,就可以从一定程度上降低fret信号。如图22所示(图22为基于荧光共振能量转移(fret)检测小分子对odc-oaz1相互作用的抑制。),1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺小分子能够明显抑制fret信号。这意味着1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺小分子能够抑制odc和oaz1的相互作用。
为了进一步验证1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺分子是否能够稳定odc同源二聚体,利用分析型体积排阻凝胶柱对odc的寡聚状态进行了分析。如图23(图23为odc在不同盐浓度下的寡聚状态不一样。流出时间越早,代表在该条件下odc同源二聚体形成越容易。)odc在不同盐(nacl)浓度下,其寡聚状态不一样,从凝胶柱中流出的时间不一样(时间越早,分子量越大):在50mmnacl条件下,odc主要以二聚体形式存在(计算分子量为105.1kda),在300mmnacl条件下,odc主要以单体形式存在(计算分子量为53.0kda),而在150mmnacl条件下,odc中单体和二聚体处于共存和快速交换状态,对应流出峰位于两者之间。
如图24所示(图24为在50mmnacl条件下,检测1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺分子和dfmo对odc寡聚状态的影响,不添加任何小分子的溶液作为对照。三条流出曲线几乎完全重合,意味着1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺分子和dfmo在该条件下都不破坏odc同源二聚体。),在50mmnacl条件下,1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺分子、dfmo和无小分子对照的流出峰高度重合,意味着1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺分子和dfmo都不破坏odc同源二聚体的稳定性。
如图25所示(图25为在150mmnacl条件下,检测1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺分子和dfmo对odc寡聚状态的影响,不添加任何小分子的溶液作为对照。添加1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺分子的曲线流出峰前移,而dfmo和空白对照的流出峰重叠。这意味着1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺分子能够稳定odc同源二聚体,而dfmo不能。),在150mmnacl条件下,1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺分子能够显著使流出峰前移,意味着odc同源二聚体含量增加。而dfmo与空白对照一致,表明dfmo不能促进odc同源二聚体的形成。
综合以上结果,可以得出结论,1-丁基-n-(4-氯苯基)-1h-苯并[d]咪唑-2-胺小分子是新型的、能够抑制odc酶活性、稳定odc同源二聚体、抑制odc-oaz1相互作用的新型小分子化合物。
- 还没有人留言评论。精彩留言会获得点赞!