一种治疗或预防动脉粥样硬化药物及应用的制作方法
本发明属于医药技术领域,尤其涉及一种治疗或预防动脉粥样硬化药物及应用。
背景技术:
目前,最接近的现有技术:
随着经济的发展、人口老龄化及各种危险因素的流行,心脑血管病患者的人数不断增加。动脉粥样硬化(atherosclerosis,as)是动脉阻塞性心脑血管病如急性冠脉综合征、脑卒中等的重要致病因素。动脉粥样硬化主要指动脉及其分支的脉管壁内膜和内膜下的脂质沉着,同时伴有中层平滑肌细胞的内膜移行,从而使血管内膜增厚并形成粥样病灶及纤维脂质斑块病灶的一种疾病。高血脂、肥胖、高血压、高血糖、吸烟及遗传等多种因素均可以导致动脉粥样硬化发生,其中高血脂是最重要的原因之一。
目前,业内常用的现有技术是这样的:
药物治疗是控制动脉粥样硬化斑块形成最有效的措施。目前临床上治疗as主要还是以降血脂、抗血小板聚集等药物为主。但由于上述药物存在各自特定的禁忌症或患者不能耐受治疗的情况严重限制了它们的应用。因此,急需发掘治疗动脉粥样硬化的其他机制并寻找新的治疗药物来改善动脉粥样硬化患者的预后。动脉粥样硬化的发病过程较为复杂,主要涉及脂质沉淀、内皮细胞损伤、单核-巨噬细胞浸润、平滑肌细胞迁移增殖等机制。目前的学术观点认为,血管组织氧化应激是动脉粥样硬化斑块形成过程中的重要病理因素,氧化应激理论对动脉粥样硬化的发生发展过程解释得较为全面。从高血脂(主要是血液循环中氧化低密度脂蛋白(oxldl)浓度升高)刺激血管内皮细胞和单核细胞开始,氧化应激和活性氧(ros)水平增高就贯穿于动脉粥样硬化发生发展的整个过程,并随着疾病的发展逐渐级联和正反馈性地放大。降低血管组织中的氧化应激水平可以有效防治动脉粥样硬化斑块形成。由此可见,发掘动脉粥样硬化发展过程中的氧化应激机制,寻找治疗动脉粥样硬化的新药物和新靶点具有重要的研究意义。
kelch样环氧氯丙烷相关蛋白1(keap1)是keap1-nrf2-抗氧化反应元件(are)信号通路的主调节器,其可根据细胞内的氧化还原状态打开或者关闭keap1-nrf2-are通路。在生理条件下,keap1以泛素化底物结合蛋白的形式与nrf2结合于胞浆,因此keap1主导nrf2泛素化降解,使之维持在正常水平,从而抑制下游基因的表达。当细胞感受到刺激后,keap1的构象发生变化,nrf2与keap1发生解离并转移进入细胞核内,识别are上的结合位点并与之结合,启动下游抗氧化基因的转录,提高细胞抵抗外源性刺激的能力。可见,keap1-nrf2-are信号轴是细胞内调控氧化应激反应的重要途径。
丁苯酞(n-butylphthalide,nbp),又称芹菜甲素,属于简单苯酞类,是我国第三个拥有自主知识产权的化学药物,也是世界上专门用于治疗脑血管病的化学新药。2004年,丁苯酞在中国被批准用于治疗脑缺血。丁苯酞具有出色的、安全的单一体结构,同时具有多种药理作用,如:提高能量代谢,抗氧化,促进微循环,减少神经细胞凋亡以及抑制炎症等作用。丁苯酞能够全面治疗缺血性脑卒中、明显减少梗塞后神经功能缺失及改善患者生活能力状态,且在临床前和临床研究中的副作用轻微。在心血管保护方面,有报道称丁苯酞抑制氧化应激并缓解大鼠急性心肌梗死。wang,y.g.等发现丁苯酞可保护缺血/再灌注诱导的大鼠心肌细胞凋亡。综上,丁苯酞作为临床上治疗缺血性脑卒中的药物,同时也具备对缺血性心脏病的保护作用。动脉粥样硬化是缺血性脑卒中及急性缺血性心脏病的共同病理学基础,但由于目前尚无利用动脉粥样硬化动物及细胞模型对丁苯酞进行的相关实验研究,因此,丁苯酞在防治动脉粥样硬化中的作用尚不清楚。
丁苯酞具有较好的抗氧化活性。wang,s.等发现丁苯酞通过激活pi3k/akt及mash1通路来保护h2o2诱导的神经干细胞损伤。在阿尔兹海默样病变中,丁苯酞可通过上调nrf2来抑制神经元细胞中的氧化应激水平。此外,丁苯酞还可通过减低组织中ros含量来缓解阿霉素及脂多糖诱导的抑郁样表现。
但是,目前的研究仅检测了丁苯酞对抗氧化信号通路的调控作用,没有进一步筛选丁苯酞发挥抗氧化作用的靶向蛋白,因此,丁苯酞的抗氧化靶点尚不清楚。
综上所述,现有技术存在的问题是:
目前常用的治疗动脉粥样硬化药物因其存在的禁忌症或患者不能耐受治疗等情况严重限制了它们的应用。
丁苯酞在动脉粥样硬化中的作用及机制尚不明确,解决该问题可以前期预防急性脑梗死及急性冠脉综合征,具有较好的临床价值。丁苯酞的直接抗氧化靶点尚不清楚,解决该问题将为丁苯酞应用于临床治疗心脑血管疾病提供理论依据。
解决上述技术问题的难度:
目前,缺乏丁苯酞在动脉粥样硬化动物及细胞模型中作用及机制的研究;此外,丁苯酞的抗氧化靶点及分子机制研究尚不清楚。
解决上述技术问题的意义:
本发明一方面,为治疗动脉粥样硬化疾病提供了新的药物及新的作用机制及靶点;另一方面,揭示丁苯酞的抗氧化靶点,为丁苯酞应用于临床治疗心脑血管疾病提供理论依据。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种治疗或预防动脉粥样硬化药物及应用。涉及丁苯酞在制备治疗动脉粥样硬化药物中的用途,还涉及丁苯酞在制备具有抗氧化活性的keap1抑制剂中的用途。
本发明是这样实现的,一种治疗或预防动脉粥样硬化药物,所述治疗或预防动脉粥样硬化药物为丁苯酞。丁苯酞用于注射用的针剂和口服的胶囊。
本发明的另一目的在于提供一种利用所述治疗或预防动脉粥样硬化药物制成的针剂(10-20mg/kg/天)。
本发明的另一目的在于提供一种利用所述治疗或预防动脉粥样硬化药物制成的口服胶囊(10-20mg/kg/天)。
本发明的另一目的在于提供一种利用所述治疗或预防动脉粥样硬化药物制成的具有抗氧化活性keap1抑制剂(10-20mg/kg/天),所述具有抗氧化活性keap1抑制剂由丁苯酞和药学上可接受的辅料配制而成(“辅料”指药学领域常规的药物载体,例如:稀释剂、赋形剂如水等,填充剂如淀粉、蔗糖等;粘合剂如纤维素衍生物、藻酸盐、明胶和聚乙烯吡咯烷酮;湿润剂如甘油;崩解剂如琼脂、碳酸钙和碳酸氢钠;吸收促进剂如季铵化合物;表面活性剂如十六烷醇;吸附载体如高岭土和皂粘土;润滑剂如滑石粉、硬脂酸钙/镁、聚乙二醇等。配制比例以0.9%氯化钠为例为丁苯酞:0.9%氯化钠=1:20)。
进一步,可接受的辅料为可接受的载体或填充剂或粘合剂或湿润剂或崩解剂或吸收促进剂或表面活性剂或吸附载体或润滑剂或0.9%氯化钠;
按质量比,丁苯酞和药学上可接受的辅料比例为1:20。
本发明的另一目的在于提供一种利用所述具有抗氧化活性keap1抑制剂制成的片剂。
本发明的另一目的在于提供一种利用所述具有抗氧化活性keap1抑制剂制成的丸剂。
本发明的另一目的在于提供一种利用利用所述具有抗氧化活性keap1抑制剂制成的混悬剂。
本发明的另一目的在于提供一种利用利用所述具有抗氧化活性keap1抑制剂制成的颗粒剂。
本发明的另一目的在于提供一种利用所述具有抗氧化活性keap1抑制剂制成的乳液剂。
综上所述,本发明的优点及积极效果为:
本发明发现丁苯酞通过靶向抑制keap1产生降低氧化应激的作用机制,达到治疗动脉粥样硬化的效果;本发明解决了丁苯酞在治疗或预防动脉粥样硬化方面的新用途和/或提供其通过靶向抑制keap1蛋白降低氧化应激的新用途。
在本发明中,首先发现了丁苯酞对动脉粥样硬化斑块形成的治疗效果。利用高脂饮食(hfd)喂养apoe敲除(apoe-/-)小鼠12周造成动脉粥样硬化模型,并给予小鼠腹腔注射丁苯酞(20mg/kg/2天12周)。结果提示丁苯酞显著缓解hfd诱导的apoe-/-小鼠主动脉弓、主动脉内膜及主动脉瓣内粥样硬化斑块堆积增加(实施例1)。同时,本发明检测了各组小鼠的血脂水平,结果提示丁苯酞并不影响hfd诱导的apoe-/-小鼠血脂改变(实施例1)。
丁苯酞是通过抑制或降低血管组织中氧化应激水平而发挥治疗或者预防动脉粥样硬化的作用。在本发明中,发现丁苯酞有效地抑制了hfd诱导的apoe-/-小鼠动脉组织氧化应激水平升高及(实施例2)。此外,本发明还发现丁苯酞可以减弱氧化低密度脂蛋白(oxldl50ug/ml)诱导的血管内皮细胞(huvec)中氧化应激产物水平的改变(实施例2)。
丁苯酞是通过抑制keap1而产生降低氧化应激的作用机制和治疗动脉粥样硬化的效果的。当细胞处于正常状态,nrf2锚定在细胞浆中,并且与keap1紧密结合并相互作用。keap1通过使nrf2发生泛素化降解来将其维持在一个较低的水平。本发明利用免疫荧光技术发现丁苯酞可以抑制hfd诱导apoe-/-小鼠动脉组织中keap1表达量增高,丁苯酞还可增加动脉中nrf2的含量(实施例3)。此外,本发明利用免疫共沉淀试验发现丁苯酞可以抑制huvec中keap1与nrf2蛋白的复合,进一步地,利用质粒在huvec中高表达keap1则会减弱丁苯酞对nrf2的激活作用(实施例3)。
丁苯酞与keap1蛋白可存在直接结合,为具有抗氧化活性keap1抑制剂。本发明利用分子对接技术及分子动力学(md)模拟预测发现丁苯酞与keap1蛋白可存在直接结合且动力学稳定,其中通过疏水作用连接两者的关键氨基酸位点依次是val-465,gly-417,val-418等(实施例4)。
具体应用时,所述的药物为丁苯酞和药学上可接受的辅料而配制成的各种制剂。其中优选于用于注射用的针剂和口服的胶囊。本发明的制剂可以为单位剂量形式,如针剂、胶囊(包括持续释放或延迟释释放形式)、片剂、丸剂、混悬剂、颗粒剂、酊剂、糖浆剂、乳液剂、悬浮液等剂型以及各种缓释剂型,从而适合各种给药方式,例如口服、非肠道注射、粘膜、肌肉、静脉内、皮下、眼内、皮内或经过皮肤等的给药形式(其中优选于用于注射用的针剂和口服的胶囊)。
附图说明
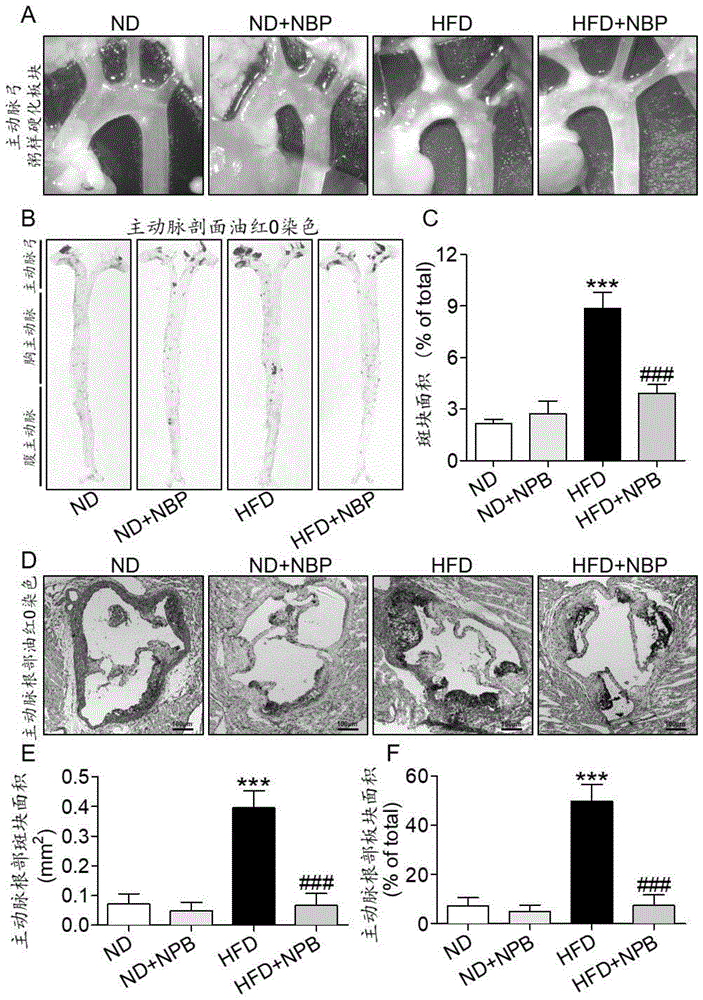
图1是本发明实施例提供的丁苯酞对hfd诱导的apoe-/-小鼠动脉粥样硬化斑块堆积增加的影响图。
图2是本发明实施例提供的丁苯酞对hfd诱导的apoe-/-小鼠血脂水平改变的影响图。
图3是本发明实施例提供的丁苯酞对hfd诱导的apoe-/-小鼠动脉组织氧化应激水平升高及丁苯酞对oxldl诱导的huvec中氧化应激产物水平的改变的影响图。
图4是本发明实施例提供的丁苯酞对小鼠血管及huvec中keap1/nrf2信号的调控图。
图5是本发明实施例提供的丁苯酞与keap1结合的结构及动力学分析图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
目前常用的治疗动脉粥样硬化药物因其存在的禁忌症或患者不能耐受治疗等情况严重限制了它们的应用。丁苯酞在动脉粥样硬化中的作用及机制尚不明确。丁苯酞的直接抗氧化靶点尚不清楚。
为解决上述问题,下面结合附图对本发明作详细描述。
本发明实施例提供一种治疗或预防动脉粥样硬化药物,所述治疗或预防动脉粥样硬化药物为丁苯酞(10-20mg/kg/天)。丁苯酞用于注射用的针剂和口服的胶囊。
在本发明中,动脉粥样硬化包括高血脂、肥胖、高血压、高血糖、吸烟及遗传等各种因素所致的动脉粥样硬化中的一种或者多种。动脉粥样硬化为高血脂所致的动脉粥样硬化。
在本发明中,丁苯酞用于减少高血脂诱导的动脉粥样硬化斑块形成。
丁苯酞是通过抑制或降低高血脂在动脉中诱导的氧化应激而发挥治疗或者预防动脉粥样硬化的作用。
丁苯酞是通过靶向抑制氧化应激调控蛋白kelch样环氧氯丙烷相关蛋白1(keap1)发挥降低高血脂在动脉中诱导的氧化应激的作用。
本发明实施例提供一种丁苯酞和药学上可接受的辅料(其中,术语“药学上可接受的辅料”是本领域技术人员所熟知的,包括药学上可接受的载体、赋形剂、稀释剂等,它们与活性成分相容。具体配制比例视各辅料成分而定)配制而成的具有抗氧化活性keap1抑制剂(10-20mg/kg/天)。
所述具有抗氧化活性keap1抑制剂由丁苯酞和药学上可接受的辅料配制而成(“辅料”指药学领域常规的药物载体,例如:稀释剂、赋形剂如水等,填充剂如淀粉、蔗糖等;粘合剂如纤维素衍生物、藻酸盐、明胶和聚乙烯吡咯烷酮;湿润剂如甘油;崩解剂如琼脂、碳酸钙和碳酸氢钠;吸收促进剂如季铵化合物;表面活性剂如十六烷醇;吸附载体如高岭土和皂粘土;润滑剂如滑石粉、硬脂酸钙/镁、聚乙二醇等。配制比例以0.9%氯化钠为例为丁苯酞:0.9%氯化钠=1:20)。
下面结合具体实施例对本发明作进一步描述。
实施例1
丁苯酞对hfd诱导的apoe-/-小鼠动脉粥样硬化斑块堆积增加的影响:
雄性c57bl/6背景的apoe-/-小鼠购买自北京华阜康生物科技股份有限公司,饲养于嘉兴学院动物实验中心。小鼠用标准啮齿类动物食物和水饲养在恒温昼夜12-12h节律的动物房内。动物在实验开始前至少花一周时间进行环境适应性生长。涉及到动物使用的协议都获得嘉兴市第二医院动物政策与福利委员会的批准(批准文件:2018jxsa27)。在实验中所用的丁苯酞为制成的可溶于9%氯化钠的剂型。溶液的ph值为7.36并经0.22的微孔滤膜过滤。8-10周龄雄性apoe-/-小鼠随机分为4组:正常喂养组(nd)、正常喂养+丁苯酞组(nd+丁苯酞)、高脂喂养组(hfd)、高脂喂养+丁苯酞组(hfd+丁苯酞),每组8只。正常饮食内含10kcal.%脂肪,20kcal.%蛋白质及70kcal.%碳水化合物,高脂饮食内含40kcal.%脂肪,20kcal.%蛋白质及20kcal.%碳水化合物;丁苯酞为皮下注射给药(10mg/kg/2天12周)。结果提示丁苯酞显著缓解hfd诱导的apoe-/-小鼠主动脉弓处粥样硬化斑块堆积增加(图1a)。油红o染色的结果提示丁苯酞显著缓解hfd诱导的apoe-/-小鼠主动脉内膜(图1b-c)及主动脉瓣(图1d-f)粥样硬化斑块堆积增加。同时,本发明检测了各组小鼠的血脂水平,结果提示丁苯酞并不影响hfd诱导的apoe-/-小鼠血脂改变,如胆固醇(tch)增高(图2a)、甘油三酯(tg)增高(图2b)、低密度脂蛋白(ldl)增高(图2c)及高密度脂蛋白(hdl)降低(图2d)。以上结果提示丁苯酞对动脉粥样硬化斑块形成的具有治疗作用,且这种作用并非通过调控血脂实现。
其中,图1a表示的是光镜下丁苯酞缓解hfd诱导apoe-/-小鼠主动脉弓粥样硬化斑块形成;图1b表示油红o染色染主动脉整体标本显示丁苯酞缓解hfd诱导apoe-/-小鼠主动脉内膜粥样硬化斑块形成;图1c表示图1b中各组相对斑块面积统计图;图1d表示油红o染色染主动脉根部标本显示丁苯酞缓解hfd诱导apoe-/-小鼠主动脉瓣膜粥样硬化斑块形成;图1e及f表示主动脉根部斑块面积统计。以上结果说明丁苯酞缓解高脂喂养诱导的apoe-/-小鼠主动脉粥样硬化斑块堆积增加。
其中,图2a表示的是丁苯酞不影响hfd诱导apoe-/-小鼠血清胆固醇(tch)含量升高;图2b表示的是丁苯酞不影响hfd诱导apoe-/-小鼠血清甘油三酯(tg)含量升高;图2c表示的是丁苯酞不影响hfd诱导apoe-/-小鼠血清低密度脂蛋白(ldl)含量升高;图2d表示的是丁苯酞不影响hfd诱导apoe-/-小鼠血清高密度脂蛋白(hdl)含量降低。
实施例2
丁苯酞对动脉粥样硬化血管组织中氧化应激水平升高的作用:
氧化应激伴随动脉粥样硬化的发生发展。前期本发明检测了各组小鼠动脉中的ros含量及氧化应激标志物3-nt水平,结果发现丁苯酞腹腔注射有效地抑制了hfd诱导的apoe-/-小鼠动脉组织ros含量升高(图3a)及3-nt表达量增加(图3b)。
采用丁苯酞对oxldl刺激huvec氧化应激(丙二醛(mda)升高及超氧化物歧化酶(sod)降低)影响的方法测试了丁苯酞的体外抗氧化活性,具体方法如下:1.2×10^6个huvec细胞用dmem培养液培养于37℃,24小时后更新培养液,并加入受测丁苯酞(终浓度为10μm)预处理1小时,再用oxldl(50μg/ml)继续处理12小时,收集细胞检测mda和sod含量,收集细胞检测总蛋白浓度,mda和sod结果用相应的总蛋白浓度相除较准,每个化合物重复测试3次,计算平均值和误差值。结果显示丁苯酞减轻oxldl诱导的内皮细胞mda水平升高(图3d)及sod水平降低(图3e)。本发明显示丁苯酞可以有效缓解动脉粥样硬化血管组织中氧化应激水平升高。
其中,图3a表示的是dhe染色提示丁苯酞抑制hfd诱导的apoe-/-小鼠动脉ros含量升高;图3b表示的是免疫组化染色提示丁苯酞抑制hfd诱导的apoe-/-小鼠动脉3-nt水平增高;图3c表示的是丁苯酞对huvec细胞活性的影响;图3d表示的是丁苯酞减轻oxldl诱导的huvec中mda水平升高;图3e表示丁苯酞减轻减轻oxldl诱导的huvec中sod水平的降低。
实施例3
丁苯酞对小鼠血管及huvec中keap1/nrf2信号的调控:
keap1-nrf2-are信号轴是机体重要抗氧化信号机制。其中keap1是nrf2的主调节器,它可根据细胞内的氧化还原状态打开或者关闭该通路。本发明在前期实验中考察了nbp对keap1/nrf2信号的影响,结果提示nbp可以抑制动脉粥样硬化诱导的keap1表达量增高(图4a),nbp还可增加动脉中nrf2的含量(图4b)。
同时,本发明利用免疫共沉淀试验发现丁苯酞可以抑制huvec中keap1与nrf2蛋白的复合。本发明利用免疫共沉淀实验检测了丁苯酞对这keap1与nrf2复合体的体外抑制活性。实验数据见图4c。实验表明丁苯酞显著抑制huvec中keap1对nrf2的锚定,促进nrf2的释放。进一步地,利用keap1质粒(sinobiologicallnc.,d236hmutations,beijing,china)及lipofectamine2000(invitrogen,carlsbad,california)转染huvec,高表达keap1蛋白(图4d)。再用oxldl(50μg/ml)继续处理6小时,收集培养液用rt-qpcr法检测nrf2mrna表达的情况,结果显示高表达keap1会减弱丁苯酞引起的nrf2mrna表达增加(图4e)。本发明显示丁苯酞可以抑制keap1来激活nrf2。
实施例4
丁苯酞与keap1蛋白有直接的结合作用且动力学稳定:
利用分子对接试验和分子动力(md)模拟技术分析丁苯酞与keap1蛋白的结合关系:分子动力学模拟采用amber11软件的pmemd模块完成。在分子动力学模拟之前,所有体系在本研究中通过六个步骤的优化。为了防止体系局部能量过高,首先对体系进行能量优化。之后第七步进行50ns的分子动力学模拟系宗模拟。非键的截断距离设为9a,用particlemeshewald(pme)方法计算长程的静电作用,氢原子键长采用shake方法进行限制,温度控制采用langevin算法,其中碰撞频率γ设为2ps-1。体系压强为1atm,积分步长为2fs,共25000000步,每隔10ps(500步)保存轨迹用于后续分析。均方根偏差(rmsd)的结果显示,keap1蛋白和nbp已达到动态平衡(图5a),可用于后续结合自由能和结构分析。dcc分析显示keap1/nbp复合物在刺激过程中已达到相对稳定(图5b)。随后,利用mm/gbsa氨基酸残基分解法,本发明预测keap1蛋白和nbp在相互识别过程中的关键氨基酸残基依次是val-465,gly-417,val-418,gly-464,ile-559,val-512,ala-366,val-606,cys-513,ala-556(图5c)。结合关键氨基酸残基能量分解和复合物结构分析,keap1蛋白与nbp结合的主要相互作用为疏水作用(图5d)。
下面结合药物的制备方法对本发明作进一步描述。
本发明实施例提供的治疗或预防动脉粥样硬化药物制备方法包括:本发明药物组合物的各种剂型可以按照药学领域的常规生产方法制备。例如使活性成分丁苯酞与一种或多种载体辅料混合,然后将其制成所需的剂型,如针剂、胶囊及片剂等。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!