KD025在制备防治慢性肾纤维化的药物中的用途的制作方法
本发明属于医药领域,具体涉及kd025在制备防治慢性肾纤维化的药物中的用途,kd025通过抑制肾小管上皮细胞纤维化及抗炎的双重作用机制防治慢性肾纤维化。
背景技术:
慢性肾脏病(chronickidneydisease,ckd)是世界性的公共健康问题,根据不同地区的流行病学调查结果,发病率在8%-16%之间。在我国,约有1.2亿人患有ckd。几十年来,虽然人们对ckd发病机制及干预策略进行了广泛的探索,但到目前为止,对慢性肾脏病的防治仍缺乏有效手段,相当一部分ckd患者最终进展为终末期肾脏病,需要昂贵的肾脏替代治疗,给家庭和社会带来极大负担。慢性肾脏病虽然病因复杂,但是最终的共同病理发展方向是肾小管间质纤维化,纤维化程度也是影响ckd预后的重要指标。寻找阻断肾小管间质纤维化发生和进展的有效药物是目前肾脏病领域亟待解决的问题。
肾小管上皮细胞(renaltubularepithelialcell,rtec)具有旺盛的代谢活性和潜在的增殖能力。在疾病状态下,作为能耗较高的组织细胞,rtec极易发生功能和结构损伤。目前认为,非致死性受损的rtec可经历适应不良的修复过程(maladaptiverepair),在修复过程中活化增殖,异常合成细胞外基质蛋白,并分泌多种趋化因子和生长因子。因此异常活化的肾小管上皮细胞是介导肾间质纤维化的关键环节,也是肾功能受损的主要原因。
rho/rock信号通路在细胞内具有广泛的作用,可被组织生长因子(tissuegrowthfactor-β,tgf-β)、血管紧张素ii(angiotensinii)、内皮素i(endothelin-i)等促纤维化生长因子激活,对组织纤维化具有重要调节作用。rock的两种亚型rock1和rock2对肾纤维化具有不同程度的调节作用。已有文献发现敲除rock1并不能减轻肾间质纤维化,提示特异性抑制rock1不是开发抑制肾间质纤维化药物的最佳靶点。目前全球约有16个正在进行临床前到iv期临床试验的rock2选择性抑制剂,它们的活性、作用方式、选择性和化学结构不相同,使得其组织分布等药代动力学参数也不一样,因此,并非所有rock2抑制剂能够在未被体内代谢酶修饰之前富集在肾脏,达到有效治疗浓度。这些已有的rock2选择性抑制剂中大部分并未见报道对肾间质纤维化有治疗效果。在基因水平上直接敲低rock2,使其蛋白水平降低一半,也不能对肾间质纤维化产生明显的治疗效果。kd025是kadmon公司开发的rock2特异性抑制剂,属于新型rho相关蛋白激酶-2(rhoassoacitedproteinkinase-2,rock2)活性抑制剂。目前kd025正在作为治疗特发性肺纤维化、慢性移植物抗宿主病和银屑病的药物进行ii期临床试验,但是kd025抗肾间质纤维化的活性却从未得到证实。
肾间质纤维化和特发性肺纤维化从发病机制、病理特征及已有治疗方法上均不相同。肾间质纤维化一般由长期炎症引起,炎症一方面可使肾小管上皮细胞受损,出现上皮细胞间质化的转分化作用,同时也可激活成纤维细胞,使其产生大量细胞外基质。目前对肾间质纤维化并无特效疗法,在炎症的初期可采用糖皮质激素冲击疗法,通过减轻炎性反应,可缓解部分患者的症状,但是这种疗法不能有效保护肾小管上皮细胞,因此无法逆转受损的肾功能。而对激素疗法无反应的肾间质纤维化患者有极大风险进展到终末期肾病,此时只能采用透析等替代治疗。与肾间质纤维化不同,特发性肺纤维化病因不明,目前认为环境污染物、基因突变、食管返流等为特发性肺纤维化的潜在病因。其病理特征为蜂窝肺,主要表现为肺成纤维细胞的活化,而并不一定具有明显炎症。在临床治疗方面,2015年特发性肺纤维化国际指南中提出治疗药物包括吡非尼酮、尼达尼布、抗酸药物、n-乙酰半胱氨酸等。由于特发性肺纤维化的治疗药物和肾间质纤维化在临床上已获批的治疗方法完全不同,用于治疗特发性肺纤维化的药物如抗酸药物对肾间质纤维化无疗效,n-乙酰半胱氨酸对肾间质纤维化具有疗效,但是其机制与已有报道的大部分肾间质纤维化相同,是通过抑制成纤维细胞活化,而对肾小管上皮细胞无保护作用。因此并不能从kd025用于治疗特发性肺纤维化推导出其对肾间质纤维化的治疗效果和治疗机制。
本发明从体内和体外实验证明,kd025可通过减轻肾小管上皮细胞纤维化和炎症防治慢性肾纤维化,具有显著的效果。
技术实现要素:
针对现有技术中存在的技术问题,本发明提供了kd025在制备防治慢性肾纤维化药物中的用途,特别是提供了kd025在制备抗炎和肾小管上皮细胞保护的药物中的用途。所述的这种用途解决了现有技术中没有合适的药物用于逆转肾小管上皮细胞纤维化、治疗慢性肾纤维化的技术问题。
kd025在制备针对慢性肾纤维化患者的肾小管保护作用的药物中的应用,为慢性肾纤维化治疗提供一种新的候选化合物。
上述所说的应用,具体的可以是kd025显著降低慢性肾纤维化患者的肾纤维化病理、保护肾小管、逆转肾小管上皮细胞纤维化、减轻炎症。
而且,可以是将kd025制成防治慢性肾纤维化药物的组合物。
我们在uuo模型诱导的慢性肾纤维化小鼠模型上使用rock2活性抑制剂kd025,来探讨通过抑制rock2活性对慢性肾纤维化的保护作用及其机制。结果发现,对uuo模型中出现的慢性肾纤维化使用rock2活性抑制剂kd025进行干预治疗,可显著减轻小鼠肾间质纤维化和炎性反应。kd025通过抑制rock2,减少肾小管上皮细胞在tgf-β刺激下的emt过程,并减轻巨噬细胞激活、降低促炎细胞因子的释放,从而起到减少肾间质纤维化,改善肾脏病理损伤的作用。
kd025通过抑制肾小管上皮细胞纤维化及抗炎的双重作用机制在制备防治慢性肾纤维化药物中的用途。因此,kd025应用于肾小管上皮细胞保护,特别是慢性肾纤维化患者的肾小管上皮细胞保护具有显著效果。
附图说明
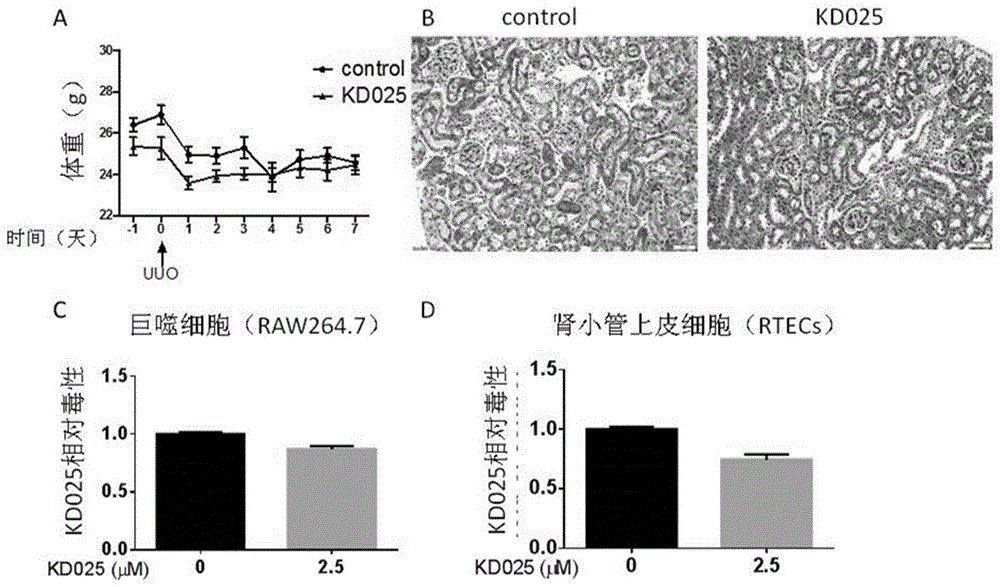
图1显示了治疗剂量的kd025对小鼠和raw264.7巨噬细胞系和肾小管上皮细胞rtecs并无毒副作用。
图1a显示kd025对小鼠体重没有影响;
图1b显示kd025对小鼠正常肾脏没有毒性;
图1c显示kd025不影响小鼠巨噬细胞系raw264.7的增殖;
图1d显示kd025不显著影响肾小管上皮细胞rtecs的增殖。
图2显示了kd025可改善小鼠uuo模型中的肾纤维化病理。
图3显示了在小鼠uuo模型中,kd025降低了肾脏组织中纤维化指标的表达水平。
图3a显示了kd025显著降低了uuo模型中上升的纤维化指标fibronectin的mrna表达水平。
图3b显示了kd025显著降低了uuo模型中上升的纤维化指标α-sma的mrna表达水平。
图3c显示了kd025显著降低了uuo模型中上升的纤维化指标collegeni的mrna表达水平。
图4显示了在小鼠uuo模型中,kd025降低了肾脏组织中炎性因子的表达。
图4a显示了kd025显著降低了uuo模型中上升的炎性因子il-6的mrna表达水平。
图4b显示了kd025显著降低了uuo模型中上升的炎性因子il-1β的mrna表达水平。
图4c显示了kd025显著降低了uuo模型中上升的炎性因子tnf-α的mrna表达水平。
图5显示了在体外培养raw264.7巨噬细胞系中,kd025降低了巨噬细胞的激活和炎性因子的表达与释放。
图5a显示2.5μm的kd025可显著抑制lps诱导的小鼠巨噬细胞raw264.7的增殖;
图5b显示2.5μm的kd025可显著降低lps诱导的小鼠巨噬细胞raw264.7释放促炎细胞因子il-1β。
图6显示了在体外培养小鼠肾小管上皮细胞rtecs中,kd025降低了tgf-β诱导的纤维化指标fibronectin的表达。
图7显示了在体外培养的肾间质成纤维细胞系nrk-49f中,kd025未能降低tgf-β诱导的纤维化指标fibronectin的表达。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。本发明实施例中所使用的生物材料和试剂,如无特别说明均可从市售渠道获得。
实施例1治疗剂量的kd025对小鼠和细胞无毒副作用
1实验材料与方法
1)小鼠的给药、饲养与取材
本发明使用的c57bl/6种属雄性小鼠(购买时7周龄,体重20-24g)购自南京医科大学实验动物中心,饲养于南京医科大学实验动物中心spf级屏障环境中,动物自由进食,维持12小时光照和12小时黑暗的昼夜节律。实验室温度:20-25℃,湿度50±5%。小鼠在适应性饲养1周后随机分为对照组(n=10)和kd025组(n=10)。
本发明使用kd025(纯度≥99%)购自selleck公司。给药前采用溶媒(5%dmso,35%peg-300,65%无菌生理盐水)稀释至6mg/ml。给药组小鼠剂量为60mg/kg,通过腹腔注射进行给药,给药体积为每10g体重给0.1ml;对照组小鼠腹腔注射给予同样体积的上述溶媒,每天给药一次,共给药7天。末次给药24h后将小鼠安乐死后取双侧肾脏,去除肾包膜后取肾皮质保存于-80℃以供提取rna和蛋白,或将组织采用多聚甲醛固定后进行病理检验。
病理检测:
肾脏组织经多聚甲醛固定、石蜡包理,组织切片后进行组织学检验。采用h&e法染色,观察是否有组织变性。
2)细胞的给药与增殖检测
点板:将小鼠巨噬细胞系raw264.7采用含10%胎牛血清的dmem培养基培养于96孔板,培养条件为37℃,5%二氧化碳和95%空气。给药:为研究kd025对细胞增殖的影响,我们在点板18h后将培养基换成含2.5μmkd025的培养基,将细胞在上述培养条件下继续培养24h后进行cck8细胞增殖检测。增殖检测:细胞增殖检测采用cck8细胞增殖试剂盒(购自凯基生物)进行检测,即向每孔加入10μlcck8检测试剂后继续培养1h,在450nm波长下检测吸光度,od值越高表示细胞越多。
3)实验结果
在动物实验中,kd025在60mg/kg剂量下对小鼠体重无显著影响(图1a),对小鼠肾脏进行h&e染色检验可知kd025对小鼠肾脏也无明显毒性作用(图1b)。在细胞实验中,kd025在2.5μm剂量下对raw264.7细胞和rtecs细胞增殖均无显著影响(图1c&d)。这些结果说明kd025在这些剂量下对小鼠和细胞安全无毒。
实施例2kd025改善uuo模型中的肾纤维化
1实验材料
本发明使用的c57bl/6种属小鼠和kd025(纯度≥99%)与实施例1中的来源相同。
2实验方法
2.1动物给药、造模与取材
雄性c57bl/6小鼠20只(购买时7周龄,体重20-24g)饲养于南京医科大学实验动物中心spf级屏障环境中,动物自由进食,维持12小时光照和12小时黑暗的昼夜节律。实验室温度:20-25℃,湿度50±5%。小鼠在适应性饲养1周后随机分为对照组(n=10)和kd025组(n=10)。分组后,对照组小鼠和kd025组小鼠分别每天进行一次腹腔注射溶媒或kd025,共进行8次注射。第一次给药后24h进行单侧输尿管结扎手术(unilateralureteralobstruction,uuo),术后7天对小鼠进行安乐死后取双侧肾脏,去除肾包膜后取肾皮质保存于-80℃以供提取rna和蛋白,或将组织采用多聚甲醛固定后进行病理检验。
1)肾皮质病理检验
肾脏组织经多聚甲醛固定、石蜡包理,组织切片后进行组织学检验。采用masson三色法染色,观察肾间质纤维化程度。其中蓝色面积指示纤维化区域。
2)蛋白质免疫印迹
肾脏组织提取蛋白,按照文献方法操作。蛋白质免疫印迹(westernblot)结果用imagej软件进行灰度分析。
3)rt-pcr
采用takara公司rnaiso试剂按照说明书提取样本中的rna后,利用vazyme公司逆转录试剂盒将rna逆转录为cdna,并采用sybrgreenpcrmix结合相应引物进行rt-pcr检测。
4)统计分析
使用均值士sem表示数据。多组间比较用方差分析(anova),两组间数据比较用t检验。以p<0.05为具有统计学意义。
3实验结果
为了评估检测kd025对肾纤维化的作用,我们采用masson三色法染色检测了小鼠肾皮质病理。uuo造模7天后,肾皮质出现明显的间质纤维化和肾小管扩张坏死等肾脏病理损伤,而kd025治疗后,其相应肾脏病理损伤都显者下降(图2)。因此,kd025可以显著减轻肾脏纤维化病理损伤。这些结果表明kd025可以减轻肾小管间质纤维化。
实施例3kd025降低了肾脏组织中纤维化指标的表达水平
1.实验材料与方法
小鼠和kd025的来源和使用同实施例2中所述。小鼠uuo模型的建立方法、组织取材同实施例2。
1)rt-pcr
采用takara公司rnaiso试剂按照说明书提取样本中的rna后,利用vazyme公司逆转录试剂盒将rna逆转录为cdna,并采用sybrgreenpcrmix结合相应引物进行rt-pcr检测。
2)统计分析
柱状图使用均值士sem表示数据。多组间比较用方差分析(anova),两组间数据比较用t检验。以p<0.05为具有统计学意义。
2.实验结果
为了进一步确证kd025对uuo模型中肾纤维化具有治疗作用,我们检测了肾皮质中肾纤维化特异性分子指标fibronectin、α-sma、collegeni等的表达情况。如图2的rt-pcr检测显示,这些肾纤维化指标在空白对照组小鼠uuo模型肾皮质中高表达,在kd025治疗后,其表达水平显著下降(图3a-c),这进一步说明kd025可减轻肾纤维化。
实施例4在uuo模型中,kd025降低了肾脏组织中炎性因子的表达
1.实验材料与方法
小鼠和kd025的来源和使用同实施例2中所述。小鼠uuo模型的建立方法、组织取材、rt-pcr法及统计学检验同实施例3。
2.实验结果
由于过度的炎性反应是肾纤维化的诱因之一,我们检测了kd025治疗之后肾皮质组织促炎细胞因子或炎性介质的mrna水平,包括il-6、il-1β和tnf-α。rt-pcr结果显示,在正常小鼠肾脏中,促炎细胞因子或炎性介质表达很低或者不表达,uuo模型可显著升高促炎细胞因子及炎性介质的表达,而使用kd025治疗可显著降低促炎细胞因子的表达水平。这些结果提示,在uuo模型中,kd025能够抑制肾皮质中的炎性反应。
实施例5kd025显著抑制lps诱导的巨噬细胞活化和炎性因子的分泌。
1.实验材料与方法
小鼠巨噬细胞系raw264.7采用含10%胎牛血清的dmem培养基培养,培养条件为37℃,5%二氧化碳和95%空气。为研究kd025对巨噬细胞激活导致的炎性反应的影响,我们将raw264.7细胞培养于96孔板中,在点板18h后加入kd025,使终浓度为2.5μm,预处理2h后加入终浓度为100ng/ml的lps进行刺激。加入lps24h后收集细胞上清培养基进行elisa检测,并采用cck8法检测细胞增殖情况(方法及材料同实施例1所述)。
1)elisa
il-1β的释放采用il-1βelisa检测试剂盒(购自达科为公司)。收集细胞培养基后,在1000×g,5min的条件下离心,将上清采用elisa试剂盒按照说明书进行检测。il-1β的含量根据内参进行计算获得。
2.实验结果
过度激活的巨噬细胞介导的炎症反应是肾间质纤维化的重要发生机制之一。在细菌内毒素lps的刺激下,静息状态的巨噬细胞可被激活,出现增殖及释放促炎细胞因子的现象。我们首先通过cck8法检测不同剂量的kd025对lps诱导的巨噬细胞增殖的影响,发现2.5μm剂量下,kd025可显著降低lps诱导的巨噬细胞增殖现象,且在无lps的情况下,kd025并不会影响巨噬细胞的增殖,说明2.5μm的kd025抑制lps诱导的巨噬细胞激活与细胞毒性无关(图5a)。进一步,我们通过elisa法检测培养基上清中的促炎细胞因子il-1β的含量,分析kd025对lps诱导的促炎细胞因子释放的影响。我们发现lps可显著诱导巨噬细胞释放il-1β,2.5μm的kd025可显著抑制il-1β的释放(图5b)。这些结果说明,kd025具有强效抗炎作用。
实施例6kd025显著抑制tgf-β1诱导的的小鼠肾小管上皮细胞纤维化
1.实验材料与方法
小鼠肾小管上皮细胞(rtecs)采用含10%胎牛血清的dmem/f12培养基培养,培养条件为37℃,5%二氧化碳和95%空气。为研究kd025对肾小管上皮细胞纤维化的影响,我们采用tgf-β1处理来在体外诱导rtecs纤维化,我们将rtecs在无血清培养基中加入2.5μm的kd025预处理2h,之后加入终浓度为5ng/ml的tgf-β1模拟慢性肾纤维化过程中的肾小管上皮细胞纤维化,24h后收集细胞总蛋白进行westernblot检测。纤维化指标分子fibronectin抗体购于abcam公司。内参蛋白gapdh及二抗购于南京巴傲得公司。数据的统计与分析同实施例3所述。
2.实验结果
tgf-β1刺激rtecs可在体外模拟慢性肾脏病中肾小管上皮细胞纤维化。为了研究kd025对于肾纤维化的作用,我们采用kd025预处理了rtecs2h后加入5ng/ml的tgf-β1,24小时后收集细胞,采用westernblot法检测纤维化指标fibronectin的表达。如图6所示,tgf-β1能够显著上调fibronectin的蛋白水平,而kd025明显降低了tgf-β1上调的fibronectin蛋白水平,说明kd025能够直接抑制肾小管上皮细胞纤维化(图6)。
实施例7kd025不影响tgf-β1诱导的成纤维细胞活化
1.实验材料与方法
大鼠肾间质成纤维细胞(nrk-49f)采用含10%胎牛血清的dmem/f12培养基培养,培养条件为37℃,5%二氧化碳和95%空气。为研究kd025对肾间质成纤维细胞活化的影响,我们采用tgf-β1处理来在体外诱导nrk-49f活化,我们将nrk-49f在低血清(2%胎牛血清)培养基中加入2.5μm的kd025预处理2h,之后加入终浓度为5ng/ml的tgf-β1模拟慢性肾纤维化过程中的成纤维细胞活化,24h后收集细胞总蛋白进行westernblot检测。纤维化指标分子fibronectin抗体购于abcam公司。内参蛋白gapdh及二抗购于南京巴傲得公司。数据的统计与分析同实施例3所述。
2.实验结果
tgf-β1刺激nrk-49f细胞可在体外模拟慢性肾脏病中肾间质成纤维细胞的活化。为了研究kd025对于肾纤维化的作用,我们采用kd025预处理了nrk-49f2h后加入5ng/ml的tgf-β1,24小时后收集细胞,采用westernblot法检测纤维化指标fibronectin的表达。如图7所示,tgf-β1能够显著上调fibronectin的蛋白水平,而kd025对tgf-β1上调的fibronectin蛋白水平无影响,说明kd025对成纤维细胞活化无影响(图7)。
综上所述,本发明提供了一种rock2活性抑制剂在制备防治慢性肾纤维化药物中的用途,该抑制剂通过注射途径给药,通过抑制巨噬细胞的过度炎症和直接抑制肾小管上皮细胞纤维化的双重作用机制,有效抑制了肾纤维化,从而发挥防治慢性肾纤维化的目的。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!