重组人神经突起生长因子Neuritin蛋白的应用及一种用于治疗听神经病的药物的制作方法
本发明涉及生物医药技术领域,特别是涉及一种重组人神经突起生长因子neuritin蛋白的应用及一种用于治疗听神经病的药物。
背景技术:
耳聋是临床上最常见的致残性疾病之一,据2018年世界卫生组织的数据显示,全世界范围内约有4.66亿人遭受听力损失的困扰,其中包括3400万儿童,预计到2050年将达到9亿,已成为各国一个主要的健康和社会经济问题。听力损失不仅会急剧降低信息的传达效率,且会严重导致儿童的言语和认知功能发育障碍,给人类的情感和社会经济带来严重的负担。
耳聋可根据损伤的部位不同大致分为三种类型:传导性耳聋、感音神经性耳聋和混合性耳聋,其中,感音神经性耳聋约占90%。感音神经性耳聋可细分为感音性耳聋、神经性耳聋和中枢性耳聋。感音性耳聋由耳蜗毛细胞受损所致,神经性耳聋是由听神经受损所致,中枢性耳聋则是由听觉传导通路及各级神经元损伤所致,从而使得声音感受与神经冲动传递障碍。普遍的致聋因素主要包括耳毒性药物使用、噪声暴露、年龄、感染及遗传因素等。耳蜗的感觉神经组织具有非常有限的自我修复和再生能力,成熟的耳蜗受体细胞,包括耳蜗螺旋神经元以及内、外毛细胞均不能自发分化和再生。因此,寻找能够减少听神经细胞丢失或促进其再生的方法,对感音神经性耳聋的治疗至关重要。
目前研究发现,部分感音神经性耳聋患者可以通过药物缓解,但临床上目前仍然没有十分有效的药物可以用于治疗,绝大部分患者只能依靠配戴助听器或人工耳蜗植入部分缓解听力损失。然而人工耳蜗的植入要求有一定数量的螺旋神经节细胞(spiralganglioncells,sgns)存在,sgns作为第一级传入神经,可携带来自耳蜗的声音信息传到中枢神经,产生听觉,在声音传递通路中十分关键。人工耳蜗植入后效果很大程度上取决于残存sgns的数量及功能,因此能够有效的维持其数量和功能,在保护或治疗感音神经性耳聋方面具有重要的实用价值。最新研究发现,神经营养因子(neurotrophicfactors,ntfs)可调控耳蜗螺旋神经节细胞转导通路,进而对sgns发挥保护作用,因此探究神经营养因子对受损sgns数量和结构的保护,促进听功能恢复,可为治疗神经性耳聋的生物蛋白药物的研发提供理论基础。
本课题研究对象重组人神经突起生长因子neuritin是一种神经营养因子,具有神经突起可塑性,也是神经生长因子(ngf)、脑源性神经营养因子(bdnf)等ntfs发挥作用的下游效应因子。上述ntfs在促进受损听功能恢复方面显示出了重要作用,但是关于neuritin在听觉系统中的研究鲜少见文献报导。neuritin作为ntfs的作用已较明确:本课题组长期从事重组人neuritin的功能和机制研究,利用基因工程技术获得了大量有活性的重组人neuritin蛋白,相应表达菌种保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为cmccno.9912。本课题组前期研究发现重组人neuritin蛋白对治疗感音神经性耳聋有效,该感音神经性耳聋为噪音损伤、药物损伤、衰老等导致的耳蜗毛细胞损伤而支持细胞未明显受损的疾病(公开号为cn109078169a的中国专利申请)。
技术实现要素:
本发明提供了一种重组人神经突起生长因子neuritin蛋白的新应用。
重组人神经突起生长因子neuritin蛋白在制备治疗听神经病的药物中的应用,所述听神经病为耳蜗螺旋神经节细胞损伤而毛细胞未受损的疾病。
所述重组人神经突起生长因子neuritin蛋白通过保护螺旋神经节细胞,维持神经纤维的数量和排列,保障毛细胞、神经纤维以及螺旋神经节细胞之间的有效连接起作用。
所述重组人神经突起生长因子neuritin蛋白使用时滴加到耳蜗圆窗。所述重组人神经突起生长因子neuritin蛋白的滴加量为每耳16~32μg。
本发明又公开了一种用于治疗听神经病的药物,有效成分为重组人神经突起生长因子neuritin蛋白。给药方式为滴加到耳蜗圆窗。给药量为:以有效成分重组人神经突起生长因子neuritin蛋白的量计算为每耳16~32μg。
本发明经研究发现,重组人神经突起生长因子neuritin蛋白能够对噪音损伤、药物损伤、衰老等导致的耳蜗螺旋神经节细胞损伤而毛细胞未明显损伤的神经性耳聋具有疗效,具体起效果的机理为:重组人神经突起生长因子neuritin蛋白能够有效的保护螺旋神经节细胞,同时有效维持神经纤维的数量和排列,保障毛细胞、神经纤维以及螺旋神经节有效的连接,从而促进其功能的发挥。所以重组人神经突起生长因子neuritin蛋白可用于制备治疗该诱因引起的神经性耳聋。
附图说明
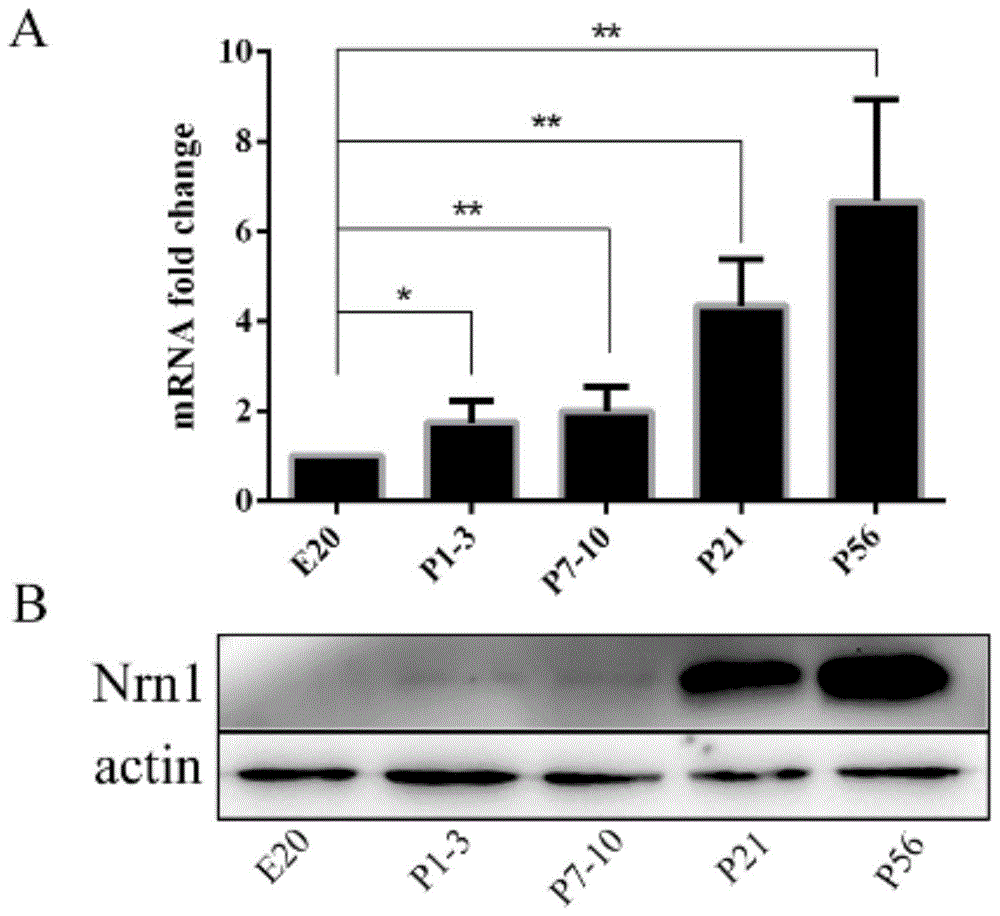
图1为neuritin蛋白在长爪沙鼠耳蜗不同发育阶段中的表达结果图,其中,图a为不同发育阶段neuritinmrna的表达变化;图b为不同发育阶段neuritin蛋白的表达变化。
图2为neuritin蛋白在成年长爪沙鼠耳蜗中免疫荧光染色定位结果图,其中,图a、d、g分别为耳蜗顶、中、底回neuritin的表达情况;图b、e、h分别为对应的耳蜗顶、中、底回tuj1标记的螺旋神经节;图c、f、i分别为对应的耳蜗顶、中、底回dapi标记的细胞核。
图3为ouabain损伤后长爪沙鼠耳蜗中neuritin蛋白的表达变化结果图,其中,图a为损伤后不同时间点neuritinmrna的表达变化;图b为损伤后不同时间点neuritin蛋白的表达变化。
图4为ouabain损伤后长爪沙鼠耳蜗组织中neuritin的表达变化结果图,其中,图a、b、c为对照组,a为正常情况下neuritin的表达情况,b为tuj1标记的螺旋神经节,c为dapi标记的细胞核;图d、e、f为损伤组,d为损伤后neuritin的表达情况,e为tuj1标记的螺旋神经节,f为dapi标记的细胞核,bar=100μm。
图5为重组人neuritin对受损长爪沙鼠耳蜗螺旋神经节的保护作用(体外)检测结果图,其中,图a.对照组;b.ouabain(200μm)损伤组;c.neuritin(16μg/ml)处理组;d.neuritin(32μg/ml)处理组,bar=50μm;e.对应个处理组螺旋神经节数量统计;f.对应各处理组神经纤维数量统计;“**”:p<0.01vs对照组。
图6为各处理组对应毛细胞的变化(体外)检测结果图,其中,图a、b、c、d分别为对照组、ouabain(200μm)损伤组、neuritin(16μg/ml)处理组、neuritin(32μg/ml)处理组,bar=200μm;图e、f、g、h分别为各族对应的局部放大结果,bar=50μm;图i、j为各组对应的内毛细胞和外毛细胞数量的统计结果。
图7为abr功能检测结果图,其中,图a.abr阈值统计结果;图b.neuritin(16μg)组32khz频率处abr波形图。
图8为重组人neuritin对受损长爪沙鼠耳蜗螺旋神经节的保护作用(体内)检测结果图,其中,图a、b、c为ouabain(1mm)损伤组对应的耳蜗顶、中、底回;图d、e、f为neuritin(16μg)处理组对应的耳蜗顶、中、底回;图g、h、i为neuritin(32μg)处理组对应的耳蜗顶、中、底回,图中黄色箭头标注为螺旋神经节所在的位置,bar=50μm;j为各组对应的螺旋神经节细胞数量统计结果。
图9为各处理组对应毛细胞的变化(体内)检测结果图,其中,图a、b、c为ouabain(1mm)损伤组对应的耳蜗顶、中、底回;图d、e、f为neuritin(16μg)处理组对应的耳蜗顶、中、底回;图g、h、i为neuritin(32μg)处理组对应的耳蜗顶、中、底回,bar=50μm;图j、k为各组对应的内毛细胞和外毛细胞数量统计结果。
具体实施方式
实施例1
1.引物的设计
从ncbi中下载蒙古长爪沙鼠的neuritin序列,经分析比对,使用primerpremier5.0软件设计荧光定量pcr引物,引物由上海捷瑞生物工程有限公司合成。
2.耳蜗样本的制备
a将胚胎20天、出生后1-3天、7天、21天、56天的沙鼠各10只,分别脱颈椎处死,钝性分离皮肤及肌肉组织,快速暴露听泡,取出耳蜗,迅速投入到液氮环境中,以防止蛋白质和rna降解,后续置于-80℃条件下保存以备后续蛋白质和rna检测试验。
b取出生后56天的沙鼠,按上述操作快速取出耳蜗后,在解剖显微镜下,剥离残留的肌肉及血液组织,再用1ml注射器于蜗尖钻一个小孔,自蜗尖慢慢注入4%多聚甲醛(ph7.4)1-2ml,并置于4℃条件下固定过夜,再用0.5m乙二胺四乙酸二钠(edta-na2)(ph7.0)常温脱钙3-4天,将脱钙完全的耳蜗冲洗干净后,依次经15%、30%的蔗糖中梯度脱水,而后使用otc胶包埋,置于-80℃保存,待切片检测。另取部分耳蜗组织,脱钙后,在解剖显微镜下取出基底膜,进行铺片,用于免疫荧光检测。
c乳鼠耳蜗基底膜铺片,取刚出生0-3天的沙鼠乳鼠,充分消毒处理后,断头处死,在d-hanks操作液中,使用眼科剪分离皮肤和肌肉组织,暴露听泡,然后再用显微剪游离出基底膜,进行铺片。
3.蛋白质免疫印迹(westernbolt)
3.1耳蜗蛋白的提取
a从-80℃冰箱中取出样本放入液氮中,分别用研钵充分研磨(在液氮环境中),研磨充分后加入裂解液(ripa+pmsf=100∶1)500-600μl,继续研磨至完全融化后,将溶液转移至1.5ml中。
b于4℃,12000rpm离心20min。
c取上清液(小心吸取,切勿吸入沉淀和悬浮物)至新管中,待检测蛋白浓度。
d蛋白浓度检测,使用bca蛋白浓度测定试剂盒(bacproteinassaykit碧云天p0012),按照说明书步骤操作。
e蛋白变性,根据样本的浓度,配平后100℃,5min条件下变性处理。变性完成后放入-20℃保存。
3.2聚丙烯酰胺凝胶电泳。
a凝胶配制:首先配制浓度为15%的分离胶,由于目的蛋白nrn1的分子量较小,为10.9kd,故使用较大浓度的分离胶进行电泳,再配制5%的浓缩胶。
b清洗玻璃板,取正反两块板使用ddh2o清洗,洗净好切勿用手触碰中间区域。加入板架固定后,然后加水静置10min,检测是否漏水。
c加入分离胶至标记处(黑线)即可,在上方均匀加入h2o(注:此处加水是用力均匀,尽量防止胶面不平)。常温下静置25-30min。
d在分离胶上层加入浓缩胶,防止产生气泡。静置30min后,凝固后备用。
e上样,将聚丙烯酰胺凝胶固定于电泳槽内,使用1x电泳液浸没,按序上样。
f电泳,浓缩胶:80v,30min;分离胶:120v,1h,具体时间参照maker条带位置确定。
3.3转模(半干转)
a准备1×电转液
b取出胶块取出两侧多余的胶块,并在胶块上剪去一角,以确定正反面,放入电转液中。pvdf膜使用前在甲醇中激活3min,另准备滤纸用电转液浸润备用。
c打开电转仪,加入少量电转液润湿,依次放置滤纸、pvdf膜、胶块、滤纸,刮除部分电转液至半干状态,除尽气泡即可。
d开始电转,23v,43min。
3.4封闭孵育抗体
a电转完成后,将pvdf膜取出,放置与5%脱脂奶粉(1g脱脂奶粉+20mltbst)中封闭40-60rpm,2h。
b加一抗,抗体β-actin按1:2000,nrn1按1:1000,使用5%脱脂奶粉稀释,均为兔源性。4℃摇床,过夜。
c清洗一抗,tbst清洗4次,5minx1次+15minx3次rt120-130rpm
d加二抗,抗体使用回收的5%脱脂奶粉稀释,比例为1:2000,rt40-60rpm2h。
e清洗二抗,tbst清洗4次,5minx1次+10minx3次rt120-130rpm
3.5化学发光及成像分析
使用ecl发光试剂,充分覆盖到pvdf膜上。放入曝光仪中曝光拍照。
4.荧光定量pcr检测
a耳蜗rna的提取:将收集的耳蜗样本,按照tiangendp422核酸提取试剂盒说明书,手动提取病毒rna,并进行核酸浓度测定,常规方法反转录成cdna,-20℃保存备用。
b用荧光定量pcr试剂盒对提取的rna进行检测,反应体系如下:2×superrealmastermix5μl,上下游引物(10μmol/l)各0.3μl,模板cdna1.0μl,补水至10μl。反应体系为10μl,为减少误差,做3个复孔,将上述混匀后的样品,进行上样,完成后短暂离心,使所用溶液沉积至底部。上机,将样本置于荧光定量pcr仪中,设置扩增程序为:95℃15min,94℃15s,60℃30s,72℃30s,循环次数为40次。数据处理。
5.耳蜗冰冻切片的制备
从-80℃取出包埋好的耳蜗组织样本,将其用otc胶固定于底座30分钟后,用冰冻切片机切片,片厚12μm,使用带正电荷的载玻片取片,使其自然伸展,室温晾干,置于-80℃冰箱保存,待检测。
6.neuritin在不同发育阶段沙鼠耳蜗中表达免疫组织化学染色检测
a.取出样本,清洗3次(1×pbs),每次间隔15min。
b.封闭,10%马血清+0.03%皂苷(用0.1%tritonx100的1×pbs配制),室温封闭1h。
c.上一抗,nrn1(兔来源多克隆抗体,1:1000)和tuj1(鼠来源单克隆抗体,1:1000),采用3%马血清+0.03%皂苷+3%bsa(用0.1%tritonx100的1×pbs配制)配制。4℃冰箱放置过夜。
d.第二天,吸除一抗,0.1%pbst(0.1%tritonx100的1×pbs),清洗4次,每次间隔2h。
e.上二抗,山羊抗兔alexfluro488(1:500)、山羊抗鼠alexfluro568(1:500),3%马血清+0.03%皂苷+3%bsa(0.1%tritonx100的1×pbs配制)配制,常温2h。
f.吸除二抗,清洗3次(1×pbs),每次间隔15min。
g.将组织转移到载玻片上,加入20μl封片剂,固定封片,共聚焦拍摄。
7.听性脑干反应(abr)检测
为保证建模后各指标的真实性,每只动物需在给药之前进行abr阈值检测,确定其听力健康,以明确造模后产生的各指标变化是源于损伤的因素而非先天性耳聋所造成的病变,造模后也通过此方法对其听力功能进行检测和鉴定。
abr阈值通过美国tdt公司听觉诱发电位仪进行检测,在标准隔音室内完成。操作方法如下:待测动物使用腹腔注射5%水合氯醛溶液(0.1ml/10g)进行麻醉,麻醉后,将动物置于37℃恒温加热垫上维持体温,以保证电生理检测的稳定性。将听觉电生理工作站tdtrz6的记录电极经皮下固定于动物两耳连线的中间点(即颅顶处),测量电极固定于待测耳部乳突皮下,接地电极固定于对侧耳部乳突处皮下,外置耳声发射器置于待测耳一侧,与外耳道齐平放置,距离外耳道约10cm的位置。检测电阻抗,3kω以下即可检测。开启软件操作,首先进行系统自检,完成后打开siggenrp系统软件,使用toneburst刺激,采用20次/秒的频率,扫描时间为10ms,滤波范围为100~3000hz,叠加次数为1024次,测量的频率依次为2khz、4khz、8khz、16khz和32khz,刺激声强为90~10dbspl,从90dbspl开始,每5dbspl递减,直到特征性的脑电波消失,将该波对应的声音强度记录为该动物的听力阈值(沙鼠为ⅱ波),各实验动物左右耳均进行听力阈值检测。
8.感音神经性耳聋的建立
本研究采用耳毒性药物哇巴因,建立急性感音神经性耳聋模型。哇巴因为经圆窗局部给药,另设局部给药对照组,每组8只。模型组建立操作如下:
哇巴因经圆窗局部给药:首先用按动物体重腹腔注射一定量的5%水合氯醛麻醉,然后使用眼科手术剪剔除耳背部毛发,酒精擦拭手术区域,从耳背部开口,钝性分离肌肉和脂肪组织,充分暴露听泡,使用解剖针或者注射器在听泡上打一个小孔,顺着开孔方向找到圆窗位置,固定好手术术野,使用微量进样器将药物缓慢滴注于圆窗膜上,20μl每耳,分4次给药,每次间隔15分钟,且置于37℃加热台上孵育;给药完成后,使用明胶海绵和动物脂肪组织填塞创口,并用缝合针将肌肉和皮肤缝合,置于37℃加热台,待动物苏醒后放回笼内饲养。
9.给予外源性neuritin干预处理方法
acorti组织体外培养(体外)
取刚出生0-3天的沙鼠断头处死,在充分消毒处理后,取出耳蜗组织,使用显微镊分离出基底膜组织,铺片,将取好的组织进行随机分组,适应性培养24小时后,加入ouabain损伤的同时,加入不同浓度的neuritin处理,48小时后,通过免疫荧光试验检测。
bneuritin圆窗给药(体内)
实验共分5组,正常组、阴性对照组、neuritin(16μg)组、neuritin(32μg)组和阳性对照组(bdnf),每组各8只动物,雌雄各半。给药保护组先按照实验二筛选出的建模方法,依次向圆窗滴注哇巴因进行损伤,给药完成后孵育15分钟后,吸除残留的液体,再滴注对应的蛋白药物,分2次给药,每次孵育30分钟,给药完成后使用明胶海绵填塞创口进行缓释,完成后使用手术缝合线将切口缝合,置于37℃恒温孵育至动物苏醒。阴性对照组圆窗滴注等量的生理盐水。
10.统计学分析
数据运用spssstatistics22软件处理,首先分析其正态性,满足正态分布后,采用配对样本t检测,分析各组数据之间的差异,p<0.05认为有显著性差异,p<0.01认为有极显著性差异。
结果与分析:
1.重组人神经突起神经生长因子在不同发育阶段沙鼠耳蜗中的表达
1.1neuritin在沙鼠耳蜗不同发育阶段中的表达
为明确neuritin与感音神经性耳聋的相关性,本实验首先检测neuritin在沙鼠耳蜗不同发育阶段中的表达变化。取沙鼠不同发育阶段的耳蜗组织,按照上述的蛋白和rna检测方法操作,mrna水平检测结果显示,neuritin在沙鼠耳蜗发育的各阶段均有不同程度的表达,且出生后耳蜗中表达量显著高于胚胎期(图1a)。蛋白水平检测结果与mrna水平检测结果基本一致,结果显示,neuritin在胚胎期20左右表达量较低,出生后,随着年龄的增长,从p1至p56neuritin在耳蜗中的表达量持续升高,至出生21天后较刚出生时表达量出现极显著差异,表明neuritin可能在沙鼠幼年到成年阶段耳蜗发育过程中起关键作用(图1b)。
1.2neuritin在成年沙鼠耳蜗中免疫荧光染色定位
根据neuritin在沙鼠耳蜗不同发育阶段中mrna和蛋白水平的表达结果(图1),在沙鼠发育过程中neuritin的表达持续增高,尤其在幼年到成年的阶段。显示neuritin可能在沙鼠幼年至成年期阶段,对耳蜗的发育发挥重要作用。所以本实验取p56天沙鼠耳蜗,经固定、脱钙、脱水、包埋、冰冻切片,经免疫荧光实验,检测neuritin在耳蜗中的表达定位情况。形态学观察显示,neuritin主要在sgns和corti器区域表达(绿色荧光为neuritin阳性标记),即图2中黄色虚线标记的位置,对应的耳蜗的顶、中、底回结果一致(图2a、d、g)。红色荧光为tuj1抗体特异性标记的耳蜗对应各回sgns(图2b、e、h),蓝色荧光为dapi标记的耳蜗各回对应的细胞核(图2c、f、i)。
2.哇巴因损伤后沙鼠耳蜗neurtin的表达变化
根据前期感音神经性耳蜗模型的建立及鉴定发现,在1mm哇巴因(20μl/耳)圆窗给药造模条件下,可以建立沙鼠耳蜗sgns特异性损伤的模型,且损伤模型很稳定。为进一步明确neuritin在沙鼠听功能中发挥的作用,本实验旨在探究哇巴因损伤后沙鼠耳蜗中neuritin的表达变化。取对照组以及给药损伤后6小时、3天、7天及56天的沙鼠耳蜗组织,按照按照上述的蛋白和rna检测方法操作,结果显示,哇巴因损伤6小时后neuritin的表达就出现下调,而后随时间延长存在持续下调的趋势(图3)。
取对照组和损伤后2周的沙鼠耳蜗组织,经固定、脱钙、脱水、包埋、冰冻切片,经免疫荧光检测neuritin在耳蜗中的表达定位情况。形态学观察显示,损伤组sgns区域neuritin的表达量较对照组显著降低,corti器区域则未见明显差异(图4a、d),与分子水平检测结果一致;红色荧光为tuj1特异性标记耳蜗对应螺旋神经节细胞(图4b、e),蓝色荧光为dapi标记的对应的细胞核(图4c、f)。
3.重组人neuritin对沙鼠耳蜗螺旋神经节细胞损伤保护作用的研究
3.1重组人neuritin对受损耳蜗螺旋神经节细胞的保护作用(体外)
根据实验2研究,结果显示低浓度哇巴因(1mm)可以造成沙鼠耳蜗螺旋神经节细胞特异性的丢失,并且发现neuritin与该耳聋模型呈负相关关系,提示neuritin在沙鼠耳蜗听功能的维持上可能发挥重要作用。本研究首先体外培养沙鼠乳鼠的柯蒂氏器组织,用哇巴因损伤建立体外损伤模型,同时加入不同浓度的外源性neuritin蛋白,以探究neuritin对受损沙鼠耳蜗细胞的保护作用。结果显示,正常情况下螺旋神经节(25.7±0.6/100μm2)以及神经纤维(13.4±1.1/100μm)均有序排列(图5a),哇巴因损伤后,螺旋神经节细胞(7.3±2.2/100μm2)以及神经纤维(4.6±1.1/100μm)的数量显著减少(图5b),neuritin(16μg/ml)处理后,螺旋神经节细胞(13.2±1.2/100μm2)和神经纤维(8.2±1.1/100μm)的数量均较损伤组多,且神经纤维的排列较整齐(图5c);如图5d所示,neuritin(32μg/ml)处理组效果更明显,螺旋神经节细胞和神经纤维的数量分别为16±2.6/100μm2,11.6±1.5/100μm。图5e和f分别为各组螺旋神经节细胞以及神经纤维的数量统计结果。
同时,实验检测各组毛细胞的形态学变化(图6),a、b、c、d分别为正常组、损伤组、neuritin(16μg/ml)保护组以及neuritin(32μg/ml)保护组对应的全耳蜗图,e、f、g、h为对应的局部放大图。i、j为各组内、外毛细胞数量统计结果,结果显示,各组毛细胞并未见明显丢失,且与对照没有显著差异。
综上可知,外源性的给与neuritin干预后对螺旋神经节细胞和神经纤维的数量都有明显的保护,且维持二者之间的结构连接,保持听神经通路的完整。
3.2重组人neuritin对受损耳蜗螺旋神经节细胞的保护作用(体内)
根据体外实验结果,发现外源性的给与neuritin对沙鼠耳蜗螺旋神经节细胞具有显著的保护作用。随后本实验利用建立的沙鼠耳蜗螺旋神经节细胞特异性损伤的动物模型,通过圆窗给药的方式,在体内进行实验。实验结果显示,与正常组相比哇巴因损伤后2周,沙鼠耳蜗各频率的听力阈值均有显著的上升;neuritin(16μg)处理组高频区16khz和32khz处听力阈值为32.5±8.9db,61.3±3.5db,显著低于损伤组的48.3±16.0db,85±5.5db;neuritin(32μg)处理组高频区8khz、16khz和32khz处听力阈值为25±10.7db,31.3±9.9db,55±5.3db,也均显著低于损伤组。随着neuritin浓度的增高,对听功能的保护趋向中低频区,neuritin(32μg)组在32khz处较损伤组恢复30db左右,而16μg组仅20db(图7a),表明neuritin剂量依赖的促进沙鼠听功能的恢复。正常组各动物听力阈值均处于正常范围,阳性对照组相比损伤组在高频区32khz听力阈值明显降低,表明本实验的整个实验体系可靠。
图7b为neuritin(16μg)处理组给药2周后,abr检测32khz处的波形图,从波形亦可看出,哇巴因损伤后听力阈值明显上升,给neuritin处理后听力阈值显著降低,听功能得到了较好的保护。
abr听功能检测完成后,进行组织水平观察,取各组沙鼠耳蜗组织,经固定、脱钙、脱水、包埋、冰冻切片,而后进行免疫荧光检测。结果显示,损伤后耳蜗各回螺旋神经节数量大量丢失,只残留少量,如图8a、b、c所示,为对应耳蜗顶、中、底回残留螺旋神经节(黄色箭头标记)。给neuritin处理后,残留的耳蜗各回螺旋神经节数量明显较损伤组多,且neuritin(32μg)处理组较neuritin(16μg)处理组更为显著,根据图8j统计结果显示,neuritin(16μg)处理组在顶回(图8d)和底回(图8f)螺旋神经节的数量显著多于损伤组,neuritin(32μg)处理组则在顶、中、底回(图8g、h、i)螺旋神经节细胞的数量均较损伤组显著增加。组织形态学结果与abr功能检测结果一致。
同时,取各组沙鼠耳蜗基底膜,通过免疫荧光实验检测毛细胞(myo7a特异性标记)的变化情况。发现各组毛细胞几乎均未出现丢失,且与正常组未见显著差异,图9a、b、c为损伤组对应的耳蜗基底膜顶、中、底回,d、e、f为neuritin(16μg)处理组,g、h、i为neuritin(32μg)处理组,图j、k为各处理组对应的顶、中、底回内外细胞数量化结果(图9)。
序列表
<110>杭州师范大学
<120>重组人神经突起生长因子neuritin蛋白的应用及一种用于治疗听神经病的药物
<160>6
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
cgcggtgcaaatagcttacc20
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
tgttcgtcttgtcgtccagg20
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
cacaagagtgtgggctttgc20
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
cagtggacctgaaagacgct20
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
ctggctcctagcaccatgaa20
<210>6
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>6
cgcagctcagtaacagtccg20
- 还没有人留言评论。精彩留言会获得点赞!
- UCP1在人重组FGF21蛋白活性检测中的应用的制造方法与工艺
- UCP3在人重组FGF21蛋白活性检测中的应用的制造方法与工艺
- 原核表达载体及rbFGF‑2表达方法与工程菌和应用与流程
- 一种利用鱼卵母细胞提取物诱导成纤维细胞重编程为成骨细胞样细胞的试剂盒及方法与流程
- 控制影响角化细胞和/或成纤维细胞和真皮的皮肤失调和皮肤老化的组合产品和美容组合物的制造方法与工艺
- 在CHO细胞中rhIL‑12表达系统的构建方法与制造工艺
- 人皮肤成纤维细胞诱导为神经细胞的方法与应用与制造工艺
- 一种制备人皮肤成纤维细胞膜片的细胞培养基和使用方法与制造工艺
- 检测人FGFR3基因突变的引物组及其试剂盒的制造方法与工艺
- 一种氧调控性碱性成纤维细胞生长因子修饰细胞的方法与制造工艺