本发明属于肿瘤调控技术领域。更具体地,涉及端粒结合蛋白hp1bp3在制备alt机制肿瘤细胞调控剂中的应用。
背景技术:
大约85%的人类肿瘤细胞利用端粒酶机制延长端粒,10%-15%的肿瘤细胞以同源重组为基础的端粒延长替代(alternativelengtheningoftelomeres,alt)机制。相比于端粒酶阳性肿瘤细胞,alt机制肿瘤细胞恶性程度更高,临床上治疗难度更大。治疗alt肿瘤是当今的医学难题。alt机制肿瘤细胞通常具有端粒长度不均一、端粒区域姐妹染色单体高频率的交换(sce)、高含量的染色体外端粒dna(c-circles)和端粒共定位的早幼粒细胞白血病核小体(apbs)等分子标记。它们很大程度地反映出alt细胞的活性,alt细胞活性的高低会影响alt肿瘤细胞的生长和繁殖。相比端粒酶阳性肿瘤细胞,alt肿瘤细胞端粒存在更多的dna损伤。dna损伤是alt细胞维持的必要条件。alt细胞通过端粒dna损伤诱导的复制机制(break-inducedreplication)对端粒进行延伸。但过多的端粒dna损伤能导致细胞衰老和死亡。alt肿瘤细胞是如何维持其端粒稳定性,其机制还不是很清楚。所以,研究alt肿瘤细胞的端粒稳定的维持机制既能回答端粒研究领域中的基本科学问题,也能为alt肿瘤防控提供重要的参考价值。
端粒结合蛋白hp1bp3全称为heterochromatinprotein1bindingprotein3,其氨基酸序列全长554个氨基酸,在ncbi上的geneid:15441。hp1bp3与组蛋白h1类似,hp1bp3蛋白含有三个可识别核小体连接dna(linker-dna)的h15结构域,能够结合核小体连接dna,因此hp1bp3被认为是与组蛋白h1类似的表观遗传调控蛋白。在表皮癌a431细胞的g1-s期,hp1bp3可调控异染色质的形成,敲除hp1bp3会使细胞周期阻滞在s期,表明hp1bp3对细胞正常增殖和异染色质结构的形成具有重要作用。在低氧环境下肿瘤形成过程中,hp1bp3对肿瘤的形成、增殖及肿瘤细胞对环境的抗性均有促进作用。表明了hp1bp3可能通过表观遗传作用机制调控肿瘤细胞。
技术实现要素:
本发明要解决的技术问题是克服现有肿瘤细胞调控存在的问题和技术不足,提供了端粒结合蛋白hp1bp3在制备alt机制肿瘤细胞调控剂上的应用。所述端粒结合蛋白hp1bp3在alt机制的肿瘤细胞中都有重要的端粒调控功能。
本发明的目的是提供端粒结合蛋白hp1bp3在制备alt机制肿瘤细胞调控剂方面的应用。
本发明另一目的是提供一种抗alt机制肿瘤细胞药物制剂。
本发明上述目的通过以下技术方案实现:
与端粒酶阳性癌细胞相比,端粒酶阴性肿瘤细胞不依赖端粒酶延长端粒,被称为alt机制。本发明解析了hp1bp3定位到alt机制肿瘤细胞的端粒上,调控alt机制肿瘤细胞分子标记和端粒长度。hp1bp3能够定位到alt机制肿瘤细胞的端粒上,通过hp1bp3与端粒核心蛋白trf1与trf2相互作用。在alt机制肿瘤细胞中,利用rna干扰技术降低hp1bp3蛋白表达,增加alt机制肿瘤细胞的分子标记水平和端粒长度。因此hp1bp3在alt机制的肿瘤细胞中具有重要的端粒调控功能,可以针对其调控机制制备有效的alt机制肿瘤细胞调控剂。
本发明解析了hp1bp3调控alt机制肿瘤细胞的端粒稳定性和细胞增殖。在alt机制肿瘤细胞中利用rna干扰技术降低hp1bp3蛋白表达,导致端粒损伤增加。敲低hp1bp3严重影响u2os细胞(alt机制的肿瘤细胞)增殖。
因此,以下应用应在本发明的保护范围之内:
端粒结合蛋白hp1bp3在制备alt机制肿瘤细胞调控剂方面的应用。
具体地,所述应用是端粒结合蛋白hp1bp3在alt机制肿瘤细胞中通过表观遗传机制调控alt肿瘤细胞生长。
端粒结合蛋白hp1bp3的抑制剂在制备抗alt机制肿瘤细胞药物中的应用。
端粒结合蛋白hp1bp3的表达抑制剂在制备抗alt机制肿瘤细胞药物中的应用。
另外,包括有效量的端粒结合蛋白hp1bp3抑制剂和/或其表达抑制剂的抗alt机制肿瘤药物,也在本发明的保护范围之内。
具体地,所述药物还包括药学上可接受的辅料,制备成注射制剂活口服制剂。
优选地,所述注射制剂为冻干粉针剂,口服制剂为散片剂、胶囊剂或颗粒剂。
本发明具有以下有益效果:
本发明提供了端粒结合蛋白hp1bp3在制备alt机制肿瘤细胞调控剂上的应用。本发明发现在alt机制肿瘤细胞中hp1bp3能够定位到端粒上去,在alt机制肿瘤细胞中hp1bp3功能丧失可以促进alt机制的活性,延伸端粒以维持端粒长度,端粒不稳定和细胞增殖受阻。因此,根据hp1bp3的这种功能,开发应用抗alt机制肿瘤细胞药物,对癌症的攻克具有举足轻重的意义,具有很好的应用前景。
附图说明
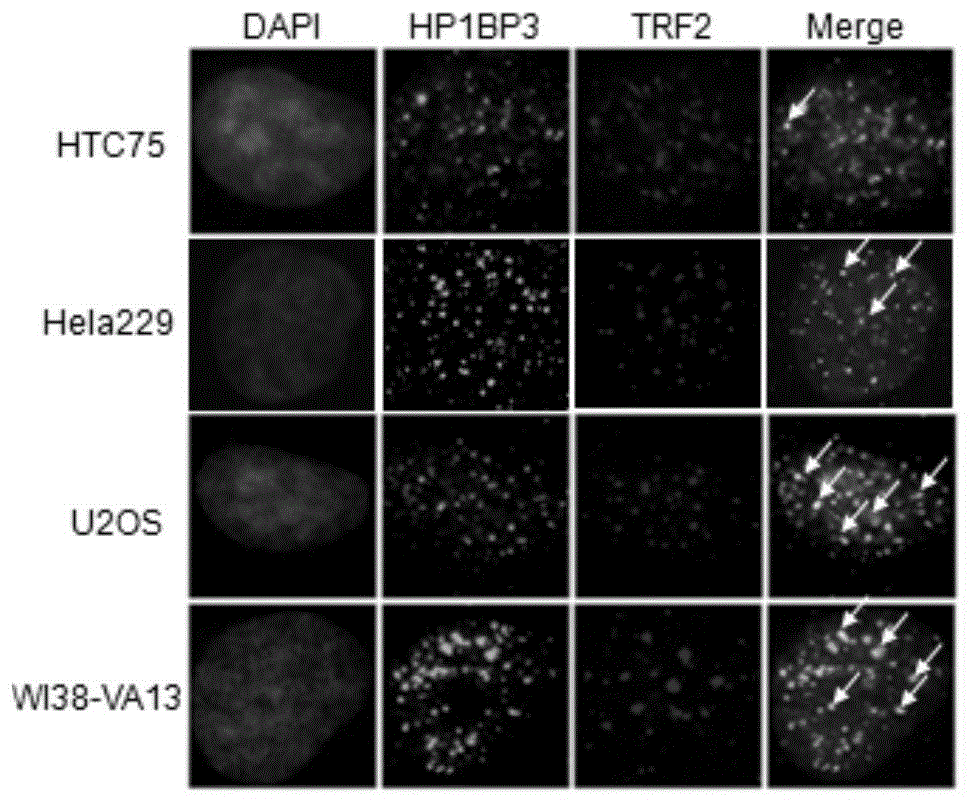
图1为内源hp1bp3蛋白在不同细胞中与端粒核心蛋白trf2的共定位情况。
图2hp1bp3结合端粒dna的染色质免疫共沉淀实验结果。
图3hp1bp3与端粒核心蛋白trf1和trf2的体内免疫共沉淀实验结果。
图4在对照组和敲低hp1bp3的alt机制的细胞u2os中,alt机制肿瘤细胞的分子标记c-circles的数量变化情况。左图为c-circles实验检测图,右图为灰度分析图。
图5在对照组和敲低hp1bp3的alt机制的细胞u2os中,alt机制肿瘤细胞的分子标记pml小体的数量变化情况。左图为检测pml小体的免疫荧光图,右图为pml小体与端粒dna共定位的统计图。
图6hp1bp3敲低的u2os细胞系中端粒长度的变化图。a图为敲低hp1bp3蛋白的免疫印迹检测图,b图为敲低hp1bp3蛋白后细胞端粒长度检测图,c图为端粒长度统计图。
图7hp1bp3敲低的u2os细胞系中γh2a与端粒dna共定位情况。左图为检测γh2a与端粒dna的免疫荧光图,右图为γh2a与端粒dna共定位的统计图。
图8hp1bp3敲低的u2os、hela和hek293t细胞系中细胞增殖情况。左中右图分别表示u2os、hela和hek293t细胞系。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1
1、本发明为了研究端粒结合蛋白hp1bp3对alt机制肿瘤细胞的调控功能,具体实验设计如下:
s1.免疫荧光实验,检测內源hp1bp3蛋白在端粒上的定位情况;
s2.染色质免疫共沉淀,检测hp1bp3在端粒dna上的结合情况;
s3.免疫共沉淀,检测hp1bp3与端粒核心蛋白trf1和trf2相互作用;
s4.敲低u20s细胞中hp1bp3表达水平,研究daxx与alt机制的活性的关系;
s5.端粒长度检测实验,检测hp1bp3敲低的细胞中端粒长度的变化;
s6.端粒功能障碍诱导的损伤灶实验,检测hp1bp3敲低的细胞中端粒损伤情况;
s7.细胞增殖实验,研究hp1bp3敲低后三种细胞系的增殖情况。
2、实验材料如下:
试剂:本实验所用兔多抗hp1bp3内源抗体是自制的,纯化后使用时用3%牛血清蛋白(bsa)按1:1000稀释;pml抗体(购于santacruz公司,产品货号sc-966),使用时用3%bsa按1:100稀释;flag抗体(购于sigma公司,产品货号f7425),使用时用3%牛血清蛋白(bsa)按1:5000稀释;gst抗体(购于abmart公司,产品货号m20007),使用时用3%牛血清蛋白(bsa)按1:5000稀释;二抗(羊抗鼠,fitc标记,购于invitrogen公司,产品货号a11017,羊抗兔,txred标记,购于联科生物公司,产品货号lk-gar5492),使用时用3%bsa按1:2000稀释;pna端粒探针(购于panagene公司,产品货号f1009-5),工作浓度为10nm。hp1bp3sirnas,吉玛生物公司合成,工作浓度80nm。
肿瘤细胞(hela)、肿瘤细胞(u2os),hek293t细胞均购买于上海中国科学院细胞库。按照常规肿瘤细胞培养方法进行培养,将培养的肿瘤细胞放入24孔板(用前在24孔板中放入盖玻片),让细胞在盖玻片上贴壁生长,待细胞生长至细胞汇合度为85%~95%时,吸走培养基,用磷酸缓冲盐溶液(pbs)洗两次;所述培养基的组成为:dmem培养基、10%fbs。
3、实验方法
(1)免疫荧光:将无菌的玻片铺到24孔板中,加入0.1%明胶处理30min,然后将消化细胞并接种到板中;一天后收集细胞,吸走细胞培养基后用pbs洗3次,用4%的多聚甲醛冰上固定15min;pbs洗3次,每次5min;加入透化液反应10min,同样地用pbs洗3次;用5%羊血清室温封闭1h;配好的一抗溶液加入孔中,4℃孵育过夜;封闭液洗3次,每次5min;二抗溶液室温孵育1h;同样地用封闭液洗3次;封片处理以便荧光显微镜镜检。
(2)免疫共沉淀:收集细胞,用预冷的ripa缓冲液裂解细胞,冰上静置30min,高速离心后取上清液。加入蛋白a/g琼脂糖颗粒和抗体4℃孵育4h或过夜,低速离心后ripa缓冲液洗涤颗粒2次,然后用pbs洗涤3次,40μl样品缓冲液悬浮颗粒,100℃煮沸5min,高速短时离心15s,吸取上清用于sds-page电泳。
(3)蛋白印迹分析:各细胞蛋白样品进行sds-page凝胶分离,再将蛋白电转至hybond-p膜上。印迹膜经过5%脱脂奶粉室温封闭1h后,于4℃孵育一抗过夜。洗涤印迹膜上的一抗,然后用带有远红外光标记的二抗进行孵育,洗涤印迹膜上的二抗,检测荧光发光信号。
(4)染色质免疫共沉淀技术(chromatinimmunoprecitation,chip):用1%甲醛室温固定细胞(约1×107)10min,然后用终浓度为0.125m的甘氨酸终止交联。低速离心收集细胞,pbs洗涤2次。细胞用包含50mm的trisph8.0,10mmedta,1%sds的缓冲液中裂解。超声破碎处理,将染色质dna打断成片段大小为200-800bp范围。高速离心取其裂解液上清,将抗体、预处理过的磁珠以及20μg染色质于4℃过夜孵育。分别用低盐缓冲液、高盐缓冲液、氯化锂缓冲液和te缓冲液中各洗涤1次。然后染色质和dna复合物解交联,对富集的dna进行柱回收纯化,并用来做定量pcr或构建chip-seq文库。如对端粒dna检测,将富集的dna上样到膜上,紫外交联处理,使用同位素p32标记的端粒(ccctaa)3探针杂交。
(5)荧光定量原位杂交(quantitativefluorescentinsituhybridization,q-fish):收集细胞前nocodazole处理细胞2~4h,用37℃预热的0.075mkcl重悬细胞静置30min,然后1200rpm离心5min;用冰冷的固定液(甲醇:冰乙酸=3:1)室温固定细胞30min,1200rpm离心5min,重复固定、离心步骤3次;用0.5ml冰冷的固定液重悬细胞沉淀,高空悬滴到冰冷的载玻片上,得到分散的染色体核型。用4%的甲醛固定2min,pbs洗2次,每次5min,然后用70%-90%-100%乙醇梯度脱水,每次5min。晾干玻片后,加入含探针的杂交液,85℃变性处理5min,37℃杂交处理2h,tbst洗3次,每次5min。再次用70%-90%-100%乙醇梯度脱水,每次5min,晾干玻片后,封片处理,避光以备荧光显微镜镜检。
(6)端粒功能障碍诱导的损伤灶(telomeredysfunctioninducedfocus,tif):首先在12孔板中铺玻璃片,用1%明胶处理玻璃片30min,接种一定密度的细胞于12孔中。一天后收集细胞,吸走细胞培养基后用pbs洗3次,用4%的多聚甲醛冰上固定15min;pbs洗3次,每次5min;加入透化液反应10min,同样地用pbs洗3次;用5%羊血清室温封闭1h。用抗trf2的一抗和抗γh2a的一抗,4℃孵育过夜;封闭液洗3次,每次5min;二抗溶液室温孵育1h;同样地用封闭液洗3次;封片处理以便荧光显微镜镜检。
4、实验结果分别如图1-8所示:
图1为内源hp1bp3蛋白在不同细胞中与端粒核心蛋白trf2的共定位情况。红色显示trf2蛋白信号,绿色显示hp1bp3蛋白信号。结果表明hp1bp3在alt机制肿瘤细胞中与trf2蛋白共定位明显。
图2hp1bp3结合端粒dna的染色质免疫共沉淀实验结果。结果表明hp1bp3结合在端粒dna上。
图3hp1bp3与端粒核心蛋白trf1和trf2的体内免疫共沉淀实验结果。结果表明hp1bp3与trf1和trf2相互作用。
图4在对照组和敲低hp1bp3的alt机制的细胞u2os中,alt机制肿瘤细胞的分子标记c-circles的数量变化情况。结果表明,敲低hp1bp3蛋白增加alt机制肿瘤细胞中c-circles的数量。
图5在对照组和敲低hp1bp3的alt机制的细胞u2os中,alt机制肿瘤细胞的分子标记pml小体的数量变化情况。结果表明,敲低hp1bp3蛋白增加alt机制肿瘤细胞中pml小体的数量。
图6hp1bp3敲低的u2os细胞系中端粒长度的变化图。结果表明,敲低hp1bp3蛋白增加alt机制肿瘤细胞中端粒长度。
图7hp1bp3敲低的u2os细胞系中γh2a与端粒dna共定位情况。结果表明,敲低hp1bp3蛋白增加alt机制肿瘤细胞中γh2a与端粒dna共定位。
图8hp1bp3敲低的u2os、hela和hek293t细胞系中细胞增殖情况。结果表明,敲低hp1bp3蛋白严重降低u2os细胞生长。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。