短肽MPM在制备用于治疗肌肉细胞分化相关疾病的药物中的应用的制作方法
本发明涉及生物医药技术领域,更具体的,涉及短肽mpm在制备用于治疗肌肉细胞分化相关疾病的药物中的应用。
背景技术:
肌肉是人体占比最大的器官,肌肉分化对于肌肉的发育、再生非常重要。肌肉分化的过程是一个多基因调控的过程,任何一个环节发生突变都会导致肌肉分化障碍,导致肌肉细胞分化相关疾病,例如肌少症、肌肉萎缩、横纹肌肉瘤。
肌少症,又叫骨骼肌减少症,常见于老年人,主要表现为骨骼肌质量减少、肌肉力量减弱。随着年龄的增加,肌少症最终会影响老年人各种脏器的功能,包括心脏、肾脏等功能的减退。杜氏肌萎缩是常见的肌肉疾病,主要发生于男孩。据统计,全球平均每3500个新生男婴中就有一人罹患此病。患者一般在3~5岁开始发病,12岁失去行走能力,20岁~30岁因呼吸衰竭而死亡。胫骨肌萎缩症是一种常染色体显性迟发性远端肌病。胫骨肌萎缩症患者的虚弱和萎缩通常局限于小腿的前腔室,尤其是胫前肌,临床症状通常发生在35~45岁或更晚。到目前为止,对于任何肌肉细胞分化相关疾病都还没有特定的治疗方法,主要是改造病人的卫星细胞或者移植正常卫星细胞,但是疗效一般。横纹肌肉瘤是起源于横纹肌细胞或向横纹肌细胞分化的间叶细胞的一种恶性肿瘤,主要由细胞成肌分化受阻、细胞无限增殖导致,是一种最常见的儿童软组织肉瘤,也发生于成人。与其他类型肿瘤治疗类似,目前对于横纹肌肉瘤的治疗以手术治疗、化疗、放疗及磁感应治疗为主要手段,尚未有特异性针对横纹肌肉瘤的较好的方法。
短肽mpm是由长链非编码rnalinc00116编码的一个高度保守的56氨基酸的短肽,又称mitoregulin(mtln)、smim37或moxi;研究表明,mpm定位于线粒体内膜,与心磷脂结合并影响蛋白质复合物的组装,mpm的过度表达增加线粒体膜电位、呼吸速率和ca2+保留能力,同时降低线粒体的活性氧和基质游离ca2+浓度,mpm敲除小鼠在线粒体呼吸复合物形成和活性、脂肪酸氧化、三羧酸循环酶和ca2+保留能力方面会受到干扰。但是,关于短肽mpm在肌肉发育和功能调控方面的作用,及其在肌肉细胞分化相关疾病诊治中的应用还未见报道。
技术实现要素:
本发明为了克服现有技术的上述不足,提供一种短肽mpm在制备用于治疗肌肉细胞分化相关疾病的药物中的应用。
本发明的另一目的在于提供编码短肽mpm的linc00116在制备肌肉细胞分化相关疾病治疗药物中的应用。
本发明的另一目的在于提供一种用于治疗肌肉细胞分化相关疾病的药物。
本发明的上述目的是通过以下技术方案给予实现的:
短肽mpm在制备肌肉细胞分化相关疾病治疗药物中的应用,所述短肽mpm的氨基酸序列如seqidno.1或seqidno.2所示,或含有seqidno.1或seqidno.2所示氨基酸序列中任一片段的序列,或与上述任一氨基酸序列具有至少73%同源性的序列。
seqidno.1:n端-madvsertlqlsvlvafasgvllgwqanrlrrryldwrkrrlqdklaatqkkldla-c端,所述序列为人源短肽mpm。
seqidno.2:n端-madvsertlqvsvlvafasgvvlgwqanrlrrryldwrkrrlqdklattqkkldla-c端,所述序列为鼠源短肽mpm。
本发明研究发现,短肽mpm在细胞成肌分化,骨骼肌的发育、再生,肌纤维的发育、再生过程中起着关键性作用;mpm高表达会促进细胞的成肌分化,而低表达则会抑制细胞的成肌分化,同时mpm的表达水平直接影响到小鼠的最大抓力和小鼠运动耐力;与正常人相比,在胫骨肌肉萎缩症(dmd)、杜氏肌肉萎缩症(tmd)、不同病理类型的横纹肌肉瘤患者的患病肌肉及老年人肌肉中,mpm表达水平均降低;表明短肽mpm与肌肉细胞分化相关;因此,可通过利用短肽mpm来提高肌肉细胞的分化能力,从而制备与肌肉细胞分化相关疾病治疗药物。
另一方面,可利用分子生物学手段提高短肽mpm在肌肉细胞内的表达量,或通过基因工程制备短肽mpm,再用于制备与肌肉细胞分化相关疾病治疗药物。因此,本发明还请求保护编码短肽mpm的linc00116在制备肌肉细胞分化相关疾病治疗药物中的应用,所述linc00116的核苷酸序列如seqidno.3或seqidno.4所示,或含有seqidno.3或seqidno.4所示核苷酸序列中的任一片段的序列。
seqidno.3:5’-atggcggatgtgtcagagaggacactgcagttgtccgtgctagtagccttcgcttctggagtactcctgggctggcaggcgaaccgactgcggaggcgctacttggactggaggaaaaggaggctgcaggacaagctggcggcgacgcagaagaagctggacctggcctga-3’,所述序列为人源短肽mpm的核苷酸序列。
seqidno.4:5’-atggcggacgtgtctgagaggacgctgcaggtgtccgtgctagtggctttcgcctctggagtggtcctgggctggcaagcgaatcggctgcggaggcgttacctagactggaggaagcggaggctgcaggacaagctggcaacgactcagaaaaagctggacctggcctga-3’,所述序列为鼠源短肽mpm的核苷酸序列。
本法发明还请求保护短肽mpm或其表达促进剂在制备提高肌肉细胞分化能力的药物中的应用,短肽mpm或其表达促进剂在制备提高骨骼肌发育、再生能力的药物中的应用,短肽mpm或其表达促进剂在制备提高肌纤维的发育、再生能力的药物中的应用,所述短肽mpm的氨基酸序列如seqidno.1或seqidno.2所示,或含有seqidno.1或seqidno.2所示氨基酸序列中任一片段的序列。
具体地,所述肌肉细胞分化相关疾病为肌少症、肌肉萎缩症、横纹肌肉瘤,例如衰老过程中的肌肉减少、胫骨肌肉萎缩症或杜氏肌肉萎缩症。
本发明还提供一种用于治疗肌肉细胞分化相关疾病的药物,包含短肽mpm或能表达短肽mpm的试剂,所述的短肽mpm的氨基酸序列如seqidno.1或seqidno.2所示,或含有seqidno.1或seqidno.2所示氨基酸序列中任一片段的序列;所述短肽可以是人工合成的多肽,也可以是利用基因工程手段在体外表达获得的短肽。
优选地,所述能表达短肽mpm的试剂为含有编码短肽mpm的linc00116dna序列的质粒或病毒载体,所述linc00116的核苷酸序列如seqidno.3或seqidno.4所示,或含有seqidno.3或seqidno.4所示核苷酸序列中的任一片段的序列;即可以通过将含有编码短肽mpm的linc00116dna序列的质粒或病毒载体导入细胞内,让生物体自身表达产生短肽mpm用于治疗。
本发明还研究发现,短肽mpm定位于线粒体,mpm低表达损伤线粒体呼吸能力,高表达促进线粒体呼吸能力;猜想短肽mpm可能通过调控线粒体呼吸能力来影响肌肉细胞分化相关功能。
因此,本发明还请求保护短肽mpm在制备促进细胞线粒体呼吸能力的药物中的应用,所述短肽mpm的氨基酸序列如seqidno.1或seqidno.2所示,或含有seqidno.1或seqidno.2所示氨基酸序列中任一片段的序列。
以及编码短肽mpm的linc00116在制备促进细胞线粒体呼吸能力的药物中的应用,所述linc00116的核苷酸序列如seqidno.3或seqidno.4所示,或含有seqidno.3或seqidno.4所示核苷酸序列中的任一片段的序列。
与现有技术相比,本发明具有以下有益效果:
本发明提供了短肽mpm在制备用于治疗肌肉细胞分化相关疾病的药物中的应用,本发明研究发现:短肽mpm在细胞肌性分化,骨骼肌的发育、再生,肌纤维的发育、再生过程中起着关键性作用;mpm高表达会促进细胞的成肌分化,而低表达则会抑制细胞的成肌分化,同时mpm的表达水平直接影响到最大抓力和小鼠运动耐力;与正常人相比,在胫骨肌肉萎缩症(dmd)、杜氏肌肉萎缩症(tmd)、不同病理类型的横纹肌肉瘤患者的患病肌肉及老年人肌肉中,mpm表达水平均降低。上述研究表明短肽mpm与肌肉细胞分化相关,可通过促进mpm的表达来提高肌肉细胞的分化能力,从而制备与肌肉细胞分化相关疾病治疗药物,具有较大的应用前景。
附图说明
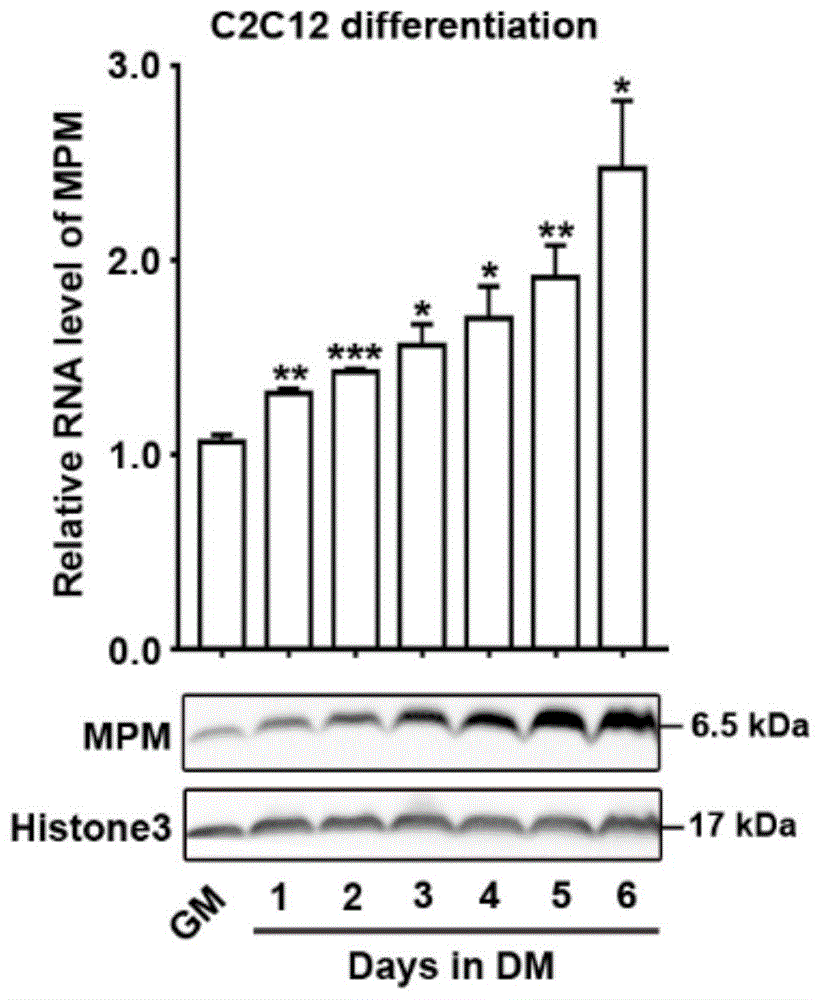
图1为小鼠成肌细胞系c2c12在成肌分化过程中mpm的rna及蛋白表达的实验结果图。
图2为小鼠肌肉发育过程中mpm的rna及蛋白表达的实验结果图。
图3为小鼠肌肉损伤再生过程中mpm的rna及蛋白表达的实验结果图。
图4为mpm低表达抑制小鼠成肌细胞系c2c12成肌分化的结果图。
图5为mpm高表达促进小鼠成肌细胞系c2c12成肌分化的结果图。
图6为mpm敲除鼠肌纤维大小与野生型小鼠的比较图。
图7为mpm敲除鼠肌肉损伤修复能力减弱的结果图。其中,图7a为肌肉修复过程中关键基因的表达情况图;图7b为再生肌纤维统计图。
图8为mpm敲除鼠的运动功能检测的实验结果图。其中,图8a为转棒实验检测野生型和mpm敲除鼠运动耐力的统计图;图8b为负重游泳实验检测野生型和mpm敲除鼠运动耐力的统计图;图8c为最大抓力实验检测野生型和mpm敲除鼠最大抓力的统计图。
图9为短肽的亚细胞定位的实验结果图。其中,图9a为免疫荧光实验,检测c2c12的亚细胞定位荧光图;图9b为免疫荧光实验,检测人源宫颈癌细胞株hela的亚细胞定位荧光图。
图10为mpm低表达抑制小鼠成肌细胞系c2c12线粒体呼吸的实验结果图。
图11为mpm高表达促进小鼠成肌细胞系c2c12线粒体呼吸的实验结果图。
图12为mpm低表达抑制人源横纹肌肉瘤细胞株rd线粒体呼吸的实验结果图。
图13为多种肌肉萎缩症、横纹肌肉瘤病人及老年人肌肉中mpm的表达图。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
本发明中采用的mpm小干扰rna(sirna)由上海吉玛公司合成,序列从dharmacon网站获得,其双链rna序列从5’端到3’端分别为:
si-mpm-1(mouse)正义链:5’-ggacaagcuggcaacgacudtdt-3’;
si-mpm-1(mouse)反义链:5’-agucguugccagcuuguccdtdg-3’;
si-mpm-2(mouse)正义链:5’-cuuucagcuugucgaagaudtdt-3’;
si-mpm-2(mouse)反义链:5’-aucuucgacaagcugaaagdtda-3’;
si-hmpm-1(human)正义链:5’-agccuucgcuucuggaguadtdt-3’;
si-hmpm-1(human)反义链:5’-uacuccagaagcgaaggcudadc-3’;
si-hmpm-2(human)正义链:5’-gcauauagacuaccggaaadtdt-3’;
si-hmpm-2(human)反义链:5’-uuuccgguagucuauaugcdadt-3’。
阴性对照组的阴性对照rna序列(也称nc)为上海吉玛公司合成的用于sirna实验的标准阴性对照序列,其rna序列从5’端到3’端分别为:
正义链:5’-uucuccgaacgugucacgudtdt-3’;
反义链:5’-acgugacacguucggagaadtdt-3’。
本发明所采用的慢病毒载体为pcdh-cmv-mcs-ef1-puro(简称pcdh),购自systembiosciences。
短肽mpm的序列信息如下所示:
人源短肽mpm:n端-madvsertlqlsvlvafasgvllgwqanrlrrryldwrkrrlqdklaatqkkldla-c端;
鼠源短肽mpm:n端-madvsertlqvsvlvafasgvvlgwqanrlrrryldwrkrrlqdklattqkkldla-c端。
实施例1mpm在小鼠成肌细胞系c2c12细胞成肌分化过程中的表达变化
1、细胞诱导成肌分化
(1)接种小鼠成肌细胞系c2c12:于6孔板中,接种适当密度的c2c12细胞,使用含10%胎牛血清的高糖dmem进行培养。
(2)诱导成肌分化:当细胞长至90%密度时,更换细胞培养基为含有2%马血清的高糖dmem,进行成肌分化诱导。使用rna抽提试剂trizol及蛋白提取液1×sds细胞裂解液收集分化0天(gm)、1天(dm1)、2天(dm2)、3天(dm3)、4天(dm4)、5天(dm5)、6天(dm6)的rna及蛋白。
2、蛋白质免疫印迹
(1)电泳前:制备tricine-sds-page(tricine-sds-聚丙烯酰胺凝胶);
(2)电泳:蛋白在浓缩胶中按恒压30v进行电泳,在分离胶中按恒压120v进行电泳;
(3)转膜:电泳结束后取出凝胶,根据目的蛋白分子量的大小,割取相应大小的凝胶。按照海绵垫—滤纸—聚偏二氟乙烯膜(pvdf膜,0.2μm孔径)—凝胶—滤纸—海绵垫的顺序制备“夹心饼”,在电泳槽中置入冰盒,恒压100v转膜2小时;
(4)封闭及孵育抗体:转膜结束后取出pvdf膜,1×tbs洗10分钟后加入含有5%脱脂奶粉的tbs/t封闭半小时以上;弃封闭液,1×tbs/t溶液洗膜,5min/次,重复3次。加入适当比例稀释的mpm(购自金丝瑞公司)或histone3(内源对照,购自碧云天公司)一抗溶液(稀释液为含1%bsa的tbs/t),4℃孵育过夜。回收一抗,1×tbs/t溶液室温洗膜,5min/次,重复3次。加入相应种属的二抗,室温孵育1h。
(5)显影:将膜浸泡于显影试剂ecl中2min,然后用tanon5200显影仪进行成像以及分析(图1)。
3、实时定量pcr(qpcr)检测
(1)rna提取:提取步骤1的rna;
(2)逆转录和荧光定量聚合酶链式反应(qpcr):纯化的rna采用6mer的随机引物进行逆转录,按照promegam-mlv试剂盒的步骤进行。利用biomaker的2×sybrgreenmix进行qpcr反应,每个样品设置2个复孔;以u6的表达水平为内参进行定量分析。用u6的表达水平进行标准化,得到目标rna的表达值为2-δct(δct=ct靶基因-ct参照基因)。
mpmqpcr引物序列从5’端到3’端分别为:
正向引物:5’-gtgtccgtgctagtggcttt-3’;
反向引物:5’-ccaggtccagctttttctga-3’。
u6qpcr引物序列从5’端到3’端分别为:
正向引物:5’-ctcgcttcggcagcaca-3’;
反向引物:5’-aacgcttcacgaatttgcgt-3’。
4、结果分析
如图1所示,检测小鼠成肌细胞系c2c12分化0至6天mpm的rna及蛋白水平,发现随着分化的进行,mpm的rna及蛋白水平逐渐升高,提示mpm在c2c12细胞肌性分化过程中起着关键性作用。
实施例2mpm在小鼠骨骼肌发育过程中的表达变化
1、rna及蛋白提取
切取不同发育时期的小鼠骨骼肌组织(1日龄、7日龄、2周龄、3周龄),用trizol及1×sds细胞裂解液裂解组织,提取rna及蛋白;
2、蛋白质免疫印迹,方法同实施例1步骤2;
3、实时定量pcr(qpcr)检测,方法同实施例1步骤3;
4、结果分析
如图2所示,共检测1日龄、7日龄、2周龄、3周龄的小鼠骨骼肌组织中mpm的rna及蛋白水平,发现随着小鼠骨骼肌的发育,mpm的表达逐渐升高,提示mpm在小鼠骨骼肌的发育中起着关键性作用。
实施例3mpm在小鼠骨骼肌再生过程中的表达变化
1、注射心肌毒素诱导小鼠骨骼肌再生
取5周龄c57bl/6j小鼠,左侧腓肠肌注射20μm心肌毒素50μl,右侧注射等量生理盐水作为对照,收取注射后1天,3天,5天,7天的腓肠肌,用trizol及1×sds细胞裂解液裂解组织,提取rna及蛋白;
2、蛋白质免疫印迹,方法同实施例1步骤2;
3、实时定量pcr(qpcr)检测,同实施例1步骤3;
4、结果分析
如图3所示,检测注射心肌毒素后1天,3天,5天,7天的腓肠肌的小鼠骨骼肌组织中mpm的rna及蛋白水平,发现随着小鼠骨骼肌损伤后再生过程,mpm的表达逐渐升高,提示mpm在小鼠骨骼肌的再生中起着关键性作用。
实施例4mpm低表达抑制c2c12细胞的成肌分化
1、细胞转染
采用lipofectaminernaimax转染试剂(购自lifetechnology)反转的方式转染rna寡核苷酸,具体步骤如下(以24孔板为例):
(1)将加0.6ul20μmsirna至100μlopti-mem(无血清培养基)中并混匀,加入1μllipofectaminernaimax并轻柔混匀,室温静置15min;
(2)将上述静置的混合液加入24孔板,随后加入500μl含有c2c12细胞的悬液,米字形混匀后置于5%co2、37℃培养箱中培养。
(3)24小时后,将0.6ul20μmsirna加至25μlopti-mem中并混匀,另准备25μlopti-mem加入1μllipofectamine3000并轻柔混匀;这两管opti-mem合并并轻柔混匀,温静置15min;
(4)将上述静置的混合液加入24孔板,随后加入500μl细胞悬液,米字形混匀后置于5%co2、37℃培养箱中培养。
sirna抑制剂购自上海吉玛,为双链rna,其rna序列从5’端到3’端分别为:
si-mpm-1正义链:5’-ggacaagcuggcaacgacudtdt-3’;
si-mpm-1反义链:5’-agucguugccagcuuguccdtdg-3’;
si-mpm-2正义链:5’-cuuucagcuugucgaagaudtdt-3’;
si-mpm-2反义链:5’-aucuucgacaagcugaaagdtda-3’;
对照sirna正义链:5’-uucuccgaacgugucacgudtdt-3’;
对照sirna反义链:5’-acgugacacguucggagaadtdt-3’。
2、诱导成肌分化
当细胞长至90%密度时,更换细胞培养基为含有2%马血清的高糖dmem,进行成肌分化诱导3天。4%多聚甲醛固定细胞或trizol收集rna。
3、免疫荧光
(1)取步骤2中固定的细胞,1×pbs洗1次;
(2)加入300ulpbst(含有0.25%tritonx-100的1×pbs),室温破膜15min后,弃去pbst,1×pbs洗1次;
(3)加入300ul封闭液(含有1%bsa的pbs),室温封闭30min后,弃去封闭液;
(4)加入200ulmhc(mf20;53-6503-82,thermofisherscientific)一抗稀释液(封闭液1:1000配置),室温2小时;
(5)回收一抗稀释液,pbst(含有0.1%tween20的1×pbs)室温洗涤,5min/次,重复3次;
(6)加入dapi染细胞核5min后室温洗涤,5min/次,重复3次;抗淬灭封片剂封片。
(7)尼康荧光显微镜成像。
4、实时定量pcr(qpcr)检测,同实施例1步骤3;
5、结果分析
如图4所示,mpm低表达,c2c12细胞成肌分化的标志分子mhc的rna水平降低,mhc阳性细胞减少,表明mpm低表达抑制c2c12细胞的成肌分化。
实施例5mpm高表达促进c2c12细胞的成肌分化
1、细胞转染
(1)构建表达mpm的过表达载体:mpm的表达片段以正常小鼠肌肉组织的rna逆转录所得的cdna为模板进行扩增。扩增获得的pcr产物插入pcdh-cmv-mcs-ef1-copgfp(pcdh,systembiosciences,ca)骨架中ecori和bamhi的位点。
(2)采用superelectroporatornepa21电转仪(nepageneco.ltd.,chiba,japan)电转质粒。具体步骤如下(以一种质粒为例):
细胞加至100μlopti-mem及10μg质粒中并混匀,100μl电转杯中,电转条件:poringpulse,150vfor7.5ms;transferpulse,20vfor50ms。将上述混合液加入2ml培养基的6孔板,米字形混匀后置于5%co2、37℃培养箱中培养。24小时后,将细胞重新消化贴孔至24孔板。
过表达质粒pcdh-mpm的插入dna片段为atggcggacgtgtctgagaggacgctgcaggtgtccgtgctagtggctttcgcctctggagtggtcctgggctggcaagcgaatcggctgcggaggcgttacctagactggaggaagcggaggctgcaggacaagctggcaacgactcagaaaaagctggacctggcctga。
对照质粒为第二个密码子缺失一个碱基的移码突变序列pcdh-mpm-fs,插入dna片段为gcgccaatccgtagctcactctactttgtgctgagtggttgcaatggcggacgtgtctgagaggacgctgcaggtgtccgtgctagtggctttcgcctctggagtggtcctgggctggcaagcgaatcggctgcggaggcgttacctagactggaggaagcggaggctgcaggacaagctggcaacgactcagaaaaagctggacctggcctgagcacgcgctgcagcccgagtccgccgggttctcactccctaagcccaacgcagcccggatcgtgggagccgcgcgacccaggagtcgtccttgcacggcttgcaagaacatggcttgcttcagaaagaaaatagttttgtcttctctaacaacttactttcagcttgtcgaagatgaaaataaaaagcactggagagaaataatttcttgcactttatgaatctatttttaaaataaaaaattaaacatc
2、诱导成肌分化
当细胞长至90%密度时,更换细胞培养基为含有2%马血清的高糖dmem,进行成肌分化诱导3天。4%多聚甲醛固定细胞或trizol收集分化3天的rna。
3、免疫荧光,同实施例4步骤3;
4、实时定量pcr(qpcr)检测,同实施例1步骤3;
5、结果分析
如图5所示,mpm高表达,c2c12细胞成肌分化的标志分子mhc的rna水平升高,mhc阳性细胞增加,表明mpm高表达促进c2c12细胞的成肌分化。
实施例6mpm影响小鼠肌纤维粗细
1、crispr-cas9技术制备mpm敲除鼠。
2、收取腓肠肌组织
8周龄野生型(mpm+/+)及mpm敲除鼠(mpm-/-),取腓肠肌进行福尔马林固定。脱水包埋后,制作石蜡切片用于苏木精-伊红染色。
3、苏木精-伊红染色
小鼠的腓肠肌组织取自步骤6.2,制成4μm石蜡切片4℃保存。后续检测步骤为:
(1)脱蜡:55℃烤片30min以上,放于二甲苯中脱蜡两次,10min/次;依次用100%、95%、90%、80%、70%和双蒸水洗3min;然后用0.3%的双氧水处理10min;
(2)染色:苏木精染色5min,水洗3min,伊红复染30s,水洗1min。
(3)计数:在低倍视野(100×)下拍摄统计。每只小鼠统计450个肌纤维的直径。
4、结果分析
如图6所示,mpm敲除鼠的肌纤维直径比野生型小,表明mpm对于肌纤维的发育具有关键作用。
实施例7mpm影响小鼠肌肉再生
1、诱导小鼠肌肉损伤修复
取5周龄野生型及mpm敲除鼠左侧腓肠肌注射20μm心肌毒素50μl,右侧注射等量生理盐水作为对照,收取注射后0天、1天,3天,5天,7天的腓肠肌,用trizol裂解组织,提取rna;收取注射后7天的腓肠肌,进行福尔马林固定。脱水包埋后,制作石蜡切片用于苏木精-伊红染色。
2、实时定量pcr(qpcr)检测,同实施例1步骤3。
3、苏木精-伊红染色,同实施例6步骤3。
4、结果分析
如图7a所示,敲除mpm的小鼠,肌肉再生相关基因在第三天表达显著降低;如图7b所示,敲除mpm的小鼠,损伤后七天,再生的肌纤维显著变细。表明mpm对于肌纤维的再生具有关键作用。
实施例8mpm影响小鼠运动耐力及最大抓力
取8~10周龄野生型及mpm敲除鼠进行运动能力检测。
1、小鼠转棒实验
将小鼠放置于转棒疲劳仪(yls-4c)上,该仪器设有一根悬空的横杆,横杆直径3.2cm。小鼠攀附其上,转棒速度为每分钟32转。在横杆转动过程中,小鼠由于恐惧坠落的天性,会一直在转棒仪上爬行,直至力竭落棒。统计小鼠掉棒的潜伏期作为抗疲劳的指标。同时该实验的结果也可以反应小鼠的运动协调耐力。在正式检测前须进行两天的训练,使小鼠熟悉转棒疲劳仪,排除意外落棒的误差。
2、小鼠负重游泳实验
在小鼠的尾巴根部绑缚一个相当于小鼠体重10%重量的铅皮,将小鼠置于注满水的水箱当中。出于保持呼吸的本能,小鼠会奋力游泳,直到力竭。统计小鼠力竭的潜伏期作为运动疲劳的指标。以小鼠口鼻没入水下至少5秒钟视为力竭,负重游泳时间视为力竭潜伏期。实验后将小鼠从水中捞出,擦干后放回鼠笼。
3、小鼠最大抓力实验
将小鼠放置于大小鼠抓力测定仪(yls-13a),手持小鼠尾部末端做水平牵引,方向平行于抓力检测仪的移动轴方向。此时小鼠因为本能会抓住检测仪的横梁,随着牵引距离的增加,所需的牵引力不断增加,直至小鼠力竭松开检测仪。此时仪器的读值即为小鼠四肢的最大抓力。该实验每只小鼠检测5次,取最大值指征小鼠四肢的最大抓力。
4、结果分析
如图8a所示,在抓力实验中,mpm敲除鼠最大抓力比野生型小。如图8b所示,在转棒实验中,mpm敲除鼠落棒时间较短。如图8c所示,在负重游泳实验中,mpm敲除鼠力竭时间较短。以上三个实验提示,mpm的表达水平直接影响到最大抓力和小鼠运动耐力。
实施例9mpm定位于线粒体
1、载体构建
构建表达mpm-flag融合蛋白的载体(flag为标签蛋白):鼠源mpm-flag的表达片段以正常小鼠肌肉组织的rna逆转录所得的cdna为模板进行扩增。扩增获得的pcr产物插入pcdh-cmv-mcs-ef1(pcdh,systembiosciences,ca)骨架ecori和bamhi的位点。人源hmpm-flag的表达片段以hela细胞的rna逆转录所得的cdna为模板进行扩增。扩增获得的pcr产物插入pcdh-cmv-mcs-ef1(pcdh,systembiosciences,ca)骨架ecori和bamhi的位点。
构建表达线粒体定位的红色荧光蛋白mito-dsred质粒:线粒体定位的红色荧光蛋白mito-dsred序列以质粒pdsred-mito(购买于clontech,takara,632421)为模板克隆到pmxs载体中。
2、细胞转染,同实施例4步骤1;
3、免疫荧光
(1)取9.2转染48小时的细胞,加入300ul4%多聚甲醛,室温放置15min后,弃去多聚甲醛,1×pbs洗1次;
(2)加入300ulpbst(含有0.25%tritonx-100的1*pbs),室温破膜15min后,弃去pbst,1×pbs洗1次;
(3)加入300ul封闭液(含有1%bsa的pbs),室温封闭30min后,弃去封闭液;
(4)加入200ulflag一抗稀释液(封闭液1:1000配置),4℃孵育过夜;
(5)回收一抗稀释液,pbst(含有0.1%tween20的1×pbs)室温洗涤,5min/次,重复3次;
(6)加入相应种属的二抗,室温孵育1h后,室温洗涤,5min/次,重复3次;
(7)加入dapi染细胞核5min后室温洗涤,5min/次,重复3次;抗淬灭封片剂封片。
(8)莱卡双光子共聚焦显微镜成像。
4、结果分析
如图9a所示,鼠源mpm-flag与mito-dsred共定位。如图9b所示,人源hmpm-flag与mito-dsred共定位,表明mpm定位于线粒体。
实施例10mpm低表达抑制c2c12细胞线粒体呼吸能力
1、构建shmpm的载体
序列同sirna序列。
2、细胞电转,同实施例5步骤1(2);
3、线粒体应激检测实验
(1)将电转24小时后的细胞,按照每个孔7×104的密度贴于seahorsexf24仪器配套的细胞培养板,使其恰好在底部铺成单层细胞,加入正常细胞培养基。
(2)水化液探针板,置于无二氧化碳培养箱水化过夜。
(3)贴细胞12h后,移除细胞培养板中的正常培养基,分析培养基洗涤2次后,加入分析培养基(含葡萄糖、谷氨酰胺和丙酮酸),置于无二氧化碳培养箱1h。此时在探针板的药物孔中依次加入oligomycin(寡霉素),fccp,以及rotenone&antimycina(鱼藤酮和抗霉素),使其终浓度为2umoligomycin,1umfccp,0.5umrotenone&antimycina。
(4)将探针板嵌入细胞培养板中,放入seahorsexf24仪器中,实验在仪器中进行。仪器会依次将药品孔内的药品注入分析培养基中,并通过探针监测单层细胞表面的氧气消耗速率。同时绘制氧耗速率曲线。
(5)借由氧耗速率曲线,分析细胞的呼吸能力。
4、结果分析
如图10所示,mpm低表达,细胞线粒体基础呼吸能力、最大呼吸能力、atp产量都降低。提示,mpm低表达损伤线粒体呼吸能力。
实施例11mpm高表达促进c2c12细胞线粒体呼吸能力
1、细胞电转,同实施例5步骤1;
2、线粒体应激检测实验,同实施例10步骤3;
3、结果分析
如图11所示,mpm高表达,细胞线粒体基础呼吸能力、最大呼吸能力、atp产量都增加。提示,mpm高表达促进线粒体呼吸能力。
实施例12mpm低表达损伤人源rd细胞的线粒体呼吸功能
1、细胞转染同实施4步骤1;
sirna抑制剂购自上海吉玛,为双链rna,其rna序列从5’端到3’端分别为:
si-hmpm-1正义链:5’-agccuucgcuucuggaguadtdt-3’;
si-hmpm-1反义链:5’-uacuccagaagcgaaggcudadc-3’;
si-hmpm-2正义链:5’-gcauauagacuaccggaaadtdt-3’;
si-hmpm-2反义链:5’-uuuccgguagucuauaugcdadt-3’;
对照sirna正义链:5’-uucuccgaacgugucacgudtdt-3’;
对照sirna反义链:5’-acgugacacguucggagaadtdt-3’。
2、线粒体应激检测实验,同实施例10步骤3;
3、结果分析
如图12所示,mpm低表达,细胞线粒体基础呼吸能力、最大呼吸能力、atp产量都降低。提示,mpm低表达损伤线粒体呼吸能力。
实施例13在肌肉分化障碍患者中mpm表达水平降低
1、分析两种肌肉萎缩患者、横纹肌肉瘤患者及老年人肌肉组织的表达谱
(1)胫骨肌肉萎缩症(tmd)患者的患病肌肉活检组织与健康肌肉组织的rna的microarray数据,来自gpl570平台的人类基因组u133第二版芯片。
(2)杜氏肌肉萎缩症(dmd)患者的患病肌肉活检组织与健康肌肉组织的rna的microarray数据,来自gpl95平台的人类基因组u95e芯片。
(3)横纹肌肉瘤患者的患病组织与健康肌肉的rnaseq数据,来自平台gpl11154illuminahiseq2000(homosapiens)和gpl16791illuminahiseq2500(homosapiens)。
(4)67~75岁男性与21~27岁男性肌肉活检组织的rna的microarray数据,来自gpl97平台的人类基因组u133b芯片。
(5)65~71岁女性与20~29岁女性肌肉活检组织的rna的microarray数据,来自gpl97平台的人类基因组u133b芯片。
2、结果分析
如图13所示,与正常人相比,在胫骨肌肉萎缩症(dmd)、杜氏肌肉萎缩症(tmd)、不同病理类型的横纹肌肉瘤患者的患病肌肉及老年人肌肉中,mpm表达水平均降低,表明mpm可能与肌肉萎缩症、横纹肌肉瘤及老年人肌少症的发病相关。
序列表
<110>中山大学
<120>短肽mpm在制备用于治疗肌肉细胞分化相关疾病的药物中的应用
<141>2019-05-27
<160>4
<170>siposequencelisting1.0
<210>1
<211>56
<212>prt
<213>人(homosapiens)
<400>1
metalaaspvalsergluargthrleuglnleuservalleuvalala
151015
phealaserglyvalleuleuglytrpglnalaasnargleuargarg
202530
argtyrleuasptrparglysargargleuglnasplysleualaala
354045
thrglnlyslysleuaspleuala
5055
<210>2
<211>56
<212>prt
<213>鼠(mouse)
<400>2
metalaaspvalsergluargthrleuglnvalservalleuvalala
151015
phealaserglyvalvalleuglytrpglnalaasnargleuargarg
202530
argtyrleuasptrparglysargargleuglnasplysleualathr
354045
thrglnlyslysleuaspleuala
5055
<210>3
<211>171
<212>dna
<213>人(homosapiens)
<400>3
atggcggatgtgtcagagaggacactgcagttgtccgtgctagtagccttcgcttctgga60
gtactcctgggctggcaggcgaaccgactgcggaggcgctacttggactggaggaaaagg120
aggctgcaggacaagctggcggcgacgcagaagaagctggacctggcctga171
<210>4
<211>171
<212>dna
<213>鼠(mouse)
<400>4
atggcggacgtgtctgagaggacgctgcaggtgtccgtgctagtggctttcgcctctgga60
gtggtcctgggctggcaagcgaatcggctgcggaggcgttacctagactggaggaagcgg120
aggctgcaggacaagctggcaacgactcagaaaaagctggacctggcctga171
- 还没有人留言评论。精彩留言会获得点赞!