原发性肝癌根治切除术的预后情况分组方法、装置和系统与流程
本发明涉及互联网技术领域,具体涉及一种原发性肝癌根治切除术的预后情况分组方法、装置和系统。
背景技术:
原发性肝癌(theprimarycarcinomaoftheliver,pcl)是目前我国第四位的常见恶性肿瘤及第三位的肿瘤致死病因,严重威胁我国人民的生命和健康。对pcl的组织病理学分类和分级是明确诊断、确定治疗方案以及判断患者预后的基础。目前经典的pcl的组织病理学分类是根据世界卫生组织(worldhealthorganization,who)制定的标准进行的,该分类标准以肿瘤的组织形态为基础,即:肝细胞癌(hepatocellularcarcinoma,hcc)、肝内胆管细胞癌(intrahepaticcholangiocarcinoma,icc)和hcc-icc混合型三种不同病理类型,其中hcc占85-90%。
对肿瘤的综合评价有助于治疗方式的选择和患者术后预后的评估。目前,手术切除是治疗肝功能良好的孤立性肿瘤的一线疗法,肝功能较差者可行肝移植治疗。然而,高复发率和高转移率严重影响根治性切除术后的疗效,即便是按照极具限制性的米兰标准(milancriteria)选择患者,在移植术后依然有10%-20%的患者复发,而根治性切除术后两年内复发率高达50%。因此,如何更准确地识别具有高复发风险的个体是一个巨大挑战。
近年来,随着一些肝癌生物学标志物的发现,使得人类对肝癌发生、发展的认识有了长足的进步。现有技术中,可以根据原发性肝癌中ck19或gpc3的表达与患者术后肿瘤转移、复发的关系,识别具有高复发风险的个体。
但是,现有技术中,对原发性肝癌中ck19或gpc3的表达研究并不全面,且原发性肝癌中ck19或gpc3的表达仅为识别具有复发风险的个体的一个因素,导致识别结果的误差较大。
技术实现要素:
有鉴于此,本发明的目的在于提供一种原发性肝癌根治切除术的预后情况分组方法、装置和系统,以解决现有技术识别复发风险的个体的识别结果的误差较大的问题。
为实现以上目的,本发明提供一种原发性肝癌根治切除术的预后情况分组方法,包括:
检测患者的原发性肝癌组织样品中细胞的ck19和gpc3表达情况,并基于表达情况给患者赋值,得到第一赋值结果:如为ck19和gpc3均不表达的ck19-/gpc3-,赋值0分;如为表达gpc3但不表达ck19的ck19-/gpc3+,赋值1分;如为共表达ck19和gpc3的ck19+/gpc3+,或者,表达ck19但不表达gpc3的ck19+/gpc3-,赋值2分;
检测所述患者的原发性肝癌组织样品的脉管瘤栓情况,并基于所述脉管瘤栓情况给患者赋值,得到第二赋值结果:如为无脉管瘤栓情况,赋值0分;如为有脉管瘤栓情况,赋值1分;
检测所述患者的肝脏内肿瘤的结节个数,并基于所述结节个数给患者赋值,得到第三赋值结果:如为1个肿瘤结节的单发,赋值0分;如为至少2个肿瘤结节的多发,赋值1分;
将所述第一赋值结果、所述第二赋值结果和所述第三赋值结果进行加和,得到所述患者的总赋值,由此将总赋值为0分的患者人群定义为根治性切除术后低级别复发风险组,将总赋值为1分或2分的患者人群定义为根治性切除术后中级别复发风险组,将总赋值为3分或4分的患者人群定义为根治性切除术后高级别复发风险组;
其中,所述患者符合米兰标准,所述原发性肝癌组织样品获取自所述患者的术前肝穿活检或原发性肝癌根治切除术中得到的切除标本,并且所述方法不用于诊断疾病。
进一步地,上述所述的方法中,所述检测所述患者的原发性肝癌组织样品中细胞的ck19和gpc3表达情况,包括:
获取对所述原发性肝癌组织样品进行免疫组织化学染色后的第一原发性肝癌组织信息;
对所述第一原发性肝癌组织信息进行识别,确定ck19和gpc3表达情况。
进一步地,上述所述的方法中,所述免疫组织化学染色包括利用生物素标记的分别针对ck19和gpc3的单克隆抗体进行。
进一步地,上述所述的方法中,所述免疫组织化学染色包括利用不同颜色荧光素标记的分别针对ck19和gpc3的单克隆抗体进行。
进一步地,上述所述的方法中,所述检测所述患者的原发性肝癌组织样品的脉管瘤栓情况,包括:
获取对所述原发性肝癌组织样品进行苏木素-伊红染色后的第二原发性肝癌组织信息;
对所述第二原发性肝癌组织信息进行识别,确定所述脉管瘤栓情况。
进一步地,上述所述的方法中,所述检测所述患者的肝脏内肿瘤的结节个数,包括:
通过原发性肝癌根治切除术前的影像学检查结果或者原发性肝癌根治切除术中得到的切除标本的检查结果来确定患者肝脏内肿瘤结节个数。
进一步地,上述所述的方法中,所述影像学检查结果获取自增强ct或增强核磁扫描成像。
进一步地,上述所述的方法,还包括:
判断所述患者术前的每个赋值结果与所述患者术后的每个赋值结果是否一致;
若不一致,选择权重值较大的赋值结果对当前赋值结果进行替换,以便重新计算所述总赋值。
本发明还提供一种原发性肝癌根治切除术的预后情况分组装置,包括:
ck19和gpc3表达分析模块,用于检测患者的原发性肝癌组织样品中细胞的ck19和gpc3表达情况,并基于表达情况给患者赋值,得到第一赋值结果:如为ck19和gpc3均不表达的ck19-/gpc3-,赋值0分;表达gpc3但不表达ck19的ck19-/gpc3+,赋值1分;如为共表达ck19和gpc3的ck19+/gpc3+,或者,表达ck19但不表达gpc3的ck19+/gpc3-,赋值2分;
组织病理学分化分析模块,用于检测所述患者的原发性肝癌组织样品的脉管瘤栓情况,并基于所述脉管瘤栓情况给患者赋值,得到第二赋值结果:如为无脉管瘤栓情况,赋值0分;如为有脉管瘤栓情况,赋值1分;
肿瘤结节个数分析模块,用于检测所述患者的肝脏内肿瘤的结节个数,并基于所述结节个数给患者赋值,得到第三赋值结果:如为1个肿瘤结节的单发,赋值0分;如为至少2个肿瘤结节的多发,赋值1分;
分组模块,用于将所述第一赋值结果、所述第二赋值结果和所述第三赋值结果进行加和,得到所述患者的总赋值,由此将总赋值为0分的患者人群定义为根治性切除术后低级别复发风险组,将总赋值为1分或2分的患者人群定义为根治性切除术后中级别复发风险组,将总赋值为3分或4分的患者人群定义为根治性切除术后高级别复发风险组;
其中,所述患者符合米兰标准,所述原发性肝癌组织样品获取自所述患者的术前肝穿活检或术后原发性肝癌根治切除标本,并且所述装置不用于诊断疾病。
本发明还提供一种原发性肝癌根治切除术的预后情况分组系统,包括存储器和处理器;
所述处理器与存储器通过通信总线相连接:
其中,所述处理器,用于调用并执行所述存储器中存储的程序;
所述存储器,用于存储所述程序,所述程序至少用于执行上述所述的原发性肝癌根治切除术的预后情况分组方法。
本发明的原发性肝癌根治切除术的预后情况分组方法、装置和系统,通过检测所述患者的原发性肝癌组织样品中细胞的ck19和gpc3表达情况,并基于表达情况给患者赋值,得到第一赋值结果:通过检测所述患者的原发性肝癌组织样品的脉管瘤栓情况,并基于所述脉管瘤栓情况给患者赋值,得到第二赋值结果:通过检测所述患者的肝脏内肿瘤的结节个数,并基于所述结节个数给患者赋值,得到第三赋值结果:并将所述第一赋值结果、所述第二赋值结果和所述第三赋值结果进行加和,得到所述患者的总赋值,由此将总赋值为0分的患者人群定义为根治性切除术后低级别复发风险组,将总赋值为1分或2分的患者人群定义为根治性切除术后中级别复发风险组,将总赋值为3分或4分的患者人群定义为根治性切除术后高级别复发风险组,实现了结合ck19或gpc3联合检测、有无脉管瘤栓以及肿瘤的结节个数可以对原发性肝癌患者的术后复发进行有效分层和预测。采用本发明的技术方,能够全面、准确地对原发性肝癌根治切除术患者的复发风险的级别评估,进而提高识别具有高复发风险的个体的识别准确率。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明的原发性肝癌根治切除术的预后情况分组方法实施例的流程图;
图2为基于术前肝穿活检的肿瘤组织ck19和gpc3免疫分型、脉管瘤栓和肿瘤数目的原发性肝癌患者肿瘤根治性切除术后复发风险评估流程图;
图3为基于图2的方法得到的显示不同转移复发风险组中的患者的生存曲线;
图4为基于图2的方法得到的各组中患者的复发风险的roc曲线;
图5为基于切除标本的肿瘤组织ck19和gpc3免疫分型、脉管瘤栓和肿瘤数目的原发性肝癌患者肿瘤根治性切除术后复发风险评估流程图;
图6为基于图5的方法得到的显示不同转移复发风险组中的患者的生存曲线;
图7为基于图5的方法得到的各组中患者的复发风险的roc曲线。
图8为本发明的原发性肝癌根治切除术的预后情况分组装置实施例的结构示意图;
图9为本发明的原发性肝癌根治切除术的预后情况分组系统实施例的结构示意图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
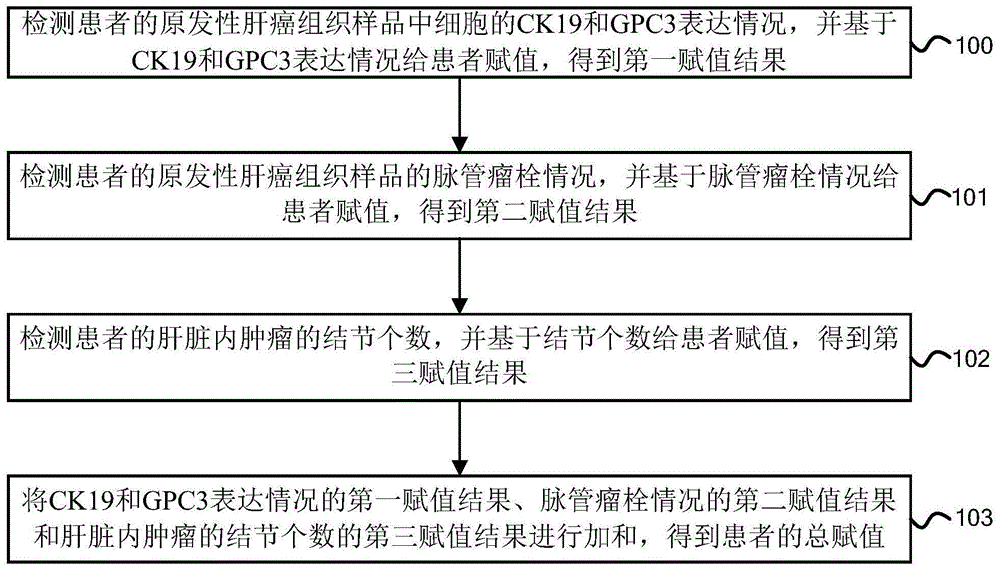
图1为本发明的原发性肝癌根治切除术的预后情况分组方法实施例的流程图,如图1所示,本实施例的原发性肝癌根治切除术的预后情况分组方法具体可以包括如下步骤:
100、检测患者的原发性肝癌组织样品中细胞的ck19和gpc3表达情况,并基于ck19和gpc3表达情况给患者赋值,得到第一赋值结果;
本实施例中,原发性肝癌组织样品获取自患者的术前肝穿活检或原发性肝癌根治切除术中得到的切除标本,并且方法不用于诊断疾病。
例如,可以收集某一段时间内指定医院内原发性肝癌手术切除的多个病历,并根据每个病历对应的影像学资料判断原发性肝癌患者中符合米兰标准的个体作为患者,患者病历作为原发性肝癌组织样品,并从原发性肝癌组织样品中检测ck19和gpc3表达情况,在得到ck19和gpc3表达情况后,可以基于ck19和gpc3表达情况给患者赋值,得到第一赋值结果。
具体地,可以对原发性肝癌组织样品进行免疫组织化学染色,得到相应的第一原发性肝癌组织信息,从而可以对第一原发性肝癌组织信息进行识别,确定ck19和gpc3表达情况。其中,第一原发性肝癌组织信息可以为实际染色后的信息,也可以为染色后的图像信息。本实施中,对原发性肝癌组织样品进行免疫组织化学染色后,可以将患者分为ck19+/gpc3+、ck19-/gpc3+、ck19-/gpc3-和ck19+/gpc3-四种分子亚型,从而更加全面的对中ck19或gpc3的表达进行研究,使得识别具有高复发风险的个体更加细致,得到更加准确的数据。其中,如ck19和gpc3表达情况为ck19和gpc3均不表达的ck19-/gpc3-,赋值0分;表达gpc3但不表达ck19的ck19-/gpc3+,赋值1分;如为共表达ck19和gpc3的ck19+/gpc3+,或者,表达ck19但不表达gpc3的ck19+/gpc3-,赋值2分。
例如,可以利用生物素标记的分别针对ck19和gpc3的单克隆抗体进行,也可以不同颜色荧光素标记的分别针对ck19和gpc3的单克隆抗体进行。本实施例中,优选为基于人工智能技术,对第一原发性肝癌组织信息进行观察,从而提高检测效率,同时,降低人为观察时,由于疲惫、医生经验不足等因素,造成观察出现错误的概率。
具体地,可以根据已知的病历中ck19细胞和gpc3细胞的特性,并利用神经网络算法对已知的病历进行训练、学习,从而得到相应的ck19和gpc3的表达模型,在得到第一原发性肝癌组织信息后,可以利用图像识别算法等将第一原发性肝癌组织信息转化为ck19和gpc3的表达模型能够识别的数据,并将转化的数据输入训练的ck19和gpc3的表达模型,从而输出相应的检测结果作为ck19和gpc3表达情况的观察结果。如果观察到肿瘤细胞为ck19细胞比率≥5%,gpc3细胞比率≥5%,则说明肿瘤细胞共表达ck19和gpc3,即记录为ck19+/gpc3+;如果肿瘤细胞只显示gpc3阳性,则记录为ck19-/gpc3+(即ck19细胞比率<5%,gpc3细胞比率≥5%);如果肿瘤细胞ck19和gpc3染色均无阳性表达,则记录为ck19-/gpc3-(即ck19细胞比率<5%,gpc3细胞比率<5%);如肿瘤细胞显示ck19阳性而gpc3染色阴性,则记录为ck19+/gpc3-(ck19细胞比率≥5%,gpc3细胞比率<5%)。
101、检测患者的原发性肝癌组织样品的脉管瘤栓情况,并基于脉管瘤栓情况给患者赋值,得到第二赋值结果;
在一个具体实现过程中,可以对原发性肝癌组织样品进行苏木素-伊红染色后,从而可以获取到对原发性肝癌组织样品进行苏木素-伊红染色后的第二原发性肝癌组织信息;并对第二原发性肝癌组织信息进行识别,确定脉管瘤栓情况。本实施例中,也可以基于人工智能技术,实现对脉管瘤栓情况的识别,其实现过程可以参考对ck19和gpc3的表达情况进行识别的记载,在此不再赘述。其中,如检测结果为无脉管瘤栓情况,赋值0分;如检测结果为有脉管瘤栓情况,赋值1分。
102、检测患者的肝脏内肿瘤的结节个数,并基于结节个数给患者赋值,得到第三赋值结果;
例如,本实施了可以通过原发性肝癌根治切除术前的影像学检查结果或者原发性肝癌根治切除术中得到的切除标本的检查结果来确定患者肝脏内肿瘤结节个数。如检测结果为1个肿瘤结节的单发,赋值0分;如检测结果为至少2个肿瘤结节的多发,赋值1分。其中,影像学检查结果获取自增强ct或增强核磁扫描成像。本实施例也可以基于人工智能技术,实现对肿瘤结节的单发、多发进行识别,其实现过程可以参考对ck19和gpc3的表达情况进行识别的记载,在此不再赘述。
103、将ck19和gpc3表达情况的第一赋值结果、脉管瘤栓情况的第二赋值结果和肝脏内肿瘤的结节个数的第三赋值结果进行加和,得到患者的总赋值。
在得到ck19和gpc3表达情况的第一赋值结果、脉管瘤栓情况的第二赋值结果和肝脏内肿瘤的结节个数的第三赋值结果后,可以基于如下公式(1),将ck19和gpc3表达情况的第一赋值结果、脉管瘤栓情况的第二赋值结果和肝脏内肿瘤的结节个数的第三赋值结果进行加和,得到患者的总赋值。
s=a+b+c(1)
其中,s代表总得分,a代表ck19和gpc3表达情况的第一赋值结果,b代表脉管瘤栓情况的第二赋值结果,c代表肝脏内肿瘤的结节个数的第三赋值结果。
在得到患者的总赋值后,将患者的总赋值为0分的患者人群定义为根治性切除术后低级别复发风险组,将总赋值为1分或2分的患者人群定义为根治性切除术后中级别复发风险组,将总赋值为3分或4分的患者人群定义为根治性切除术后高级别复发风险组。
本实施例中,在得到原发性肝癌根治切除术的预后情况分组后,可以进使得临床医生对具有高转移、复发风险的病例实施密切监测和早期处理,以提高总生存率。
本实施例的原发性肝癌根治切除术的预后情况分组方法,通过检测患者的原发性肝癌组织样品中细胞的ck19和gpc3表达情况,并基于表达情况给患者赋值,得到第一赋值结果:通过检测患者的原发性肝癌组织样品的脉管瘤栓情况,并基于脉管瘤栓情况给患者赋值,得到第二赋值结果:通过检测患者的肝脏内肿瘤的结节个数,并基于结节个数给患者赋值,得到第三赋值结果:并将第一赋值结果、第二赋值结果和第三赋值结果进行加和,得到患者的总赋值,由此将总赋值为0分的患者人群定义为根治性切除术后低级别复发风险组,将总赋值为1分或2分的患者人群定义为根治性切除术后中级别复发风险组,将总赋值为3分或4分的患者人群定义为根治性切除术后高级别复发风险组,实现了结合ck19或gpc3联合检测、有无脉管瘤栓以及肿瘤的结节个数可以对原发性肝癌患者的术后复发进行有效分层和预测。采用本发明的技术方,能够全面、准确地对原发性肝癌根治切除术患者的复发风险的级别评估,进而提高识别具有高复发风险的个体的识别准确率。
下面以具体示例对本发明的技术方案进行描述:
图2为基于术前肝穿活检的肿瘤组织ck19和gpc3免疫分型、脉管瘤栓和肿瘤数目的原发性肝癌患者肿瘤根治性切除术后复发风险评估流程图;图3为基于图2的方法得到的显示不同转移复发风险组中的患者的生存曲线。图4为基于图2的方法得到的各组中患者的复发风险的受试者工作特征曲线(receiveroperatingcharacteristiccurve,简称roc曲线)。
如图2所示,可以从北京某三级甲等医院收集术前曾进行肝脏穿刺活检的候选患者,并根据影像学资料进行“米兰标准”评估,若候选患者符合“米兰标准”,则确定为受测患者,否则,若候选患者符合“米兰标准”,则排出,从而确定出最终的受测患者。
在确定最终的受测患者后,确定肿瘤数目分类,1个肿瘤为0分,大于1个肿瘤为1分。针对最终的受测患者进行肝脏穿刺活检获得肿瘤标本,对肿瘤标本的ck19和gpc3进行免疫组化染色,如ck19和gpc3表达情况为ck19和gpc3均不表达的ck19-/gpc3-,赋值0分;表达gpc3但不表达ck19的ck19-/gpc3+,赋值1分;如为共表达ck19和gpc3的ck19+/gpc3+,或者,表达ck19但不表达gpc3的ck19+/gpc3-,赋值2分。对肿瘤标本进行苏木素-伊红染色,如无脉管瘤栓情况,赋值0分;如有脉管瘤栓情况,赋值1分。
将上述三个项目各自的得分相加得到个体的累计积分,即总赋值。将患者的总赋值为0分的患者人群定义为根治性切除术后低级别复发风险组,将总赋值为1分或2分的患者人群定义为根治性切除术后中级别复发风险组,将总赋值为3分或4分的患者人群定义为根治性切除术后高级别复发风险组。
如图3-图4所示,本实施例中,从北京某三级甲等医院收集术前曾进行肝脏穿刺活检的符合米兰标准的原发性肝癌的肿瘤手术切除病例85例。患者肿瘤脉管瘤栓度和ck19,gpc3免疫组化染色结果从病理科数据库获得。患者影像学信息从医学影像科获得。患者术后生存信息由该院医生电话随访获得。基于技术方案一方法,根据每一入组病例的免疫表型、脉管瘤栓和单/多发的分类及得分,计算每一患者手术切除术后转移和复发风险累计得分,并根据结果绘制该队列中患者的生存曲线(图3)和roc曲线(图4)。结果显示,该队列中总的切除术后复发率为50.6%(42/85),切除术后低危风险组中的实际复发率为15.4%(2/13),在中危复发风险组中的实际复发率为49.2%(31/63),在高危复发风险组中的实际复发率为100%(9/9)。本实施案例显示,基于技术方案一可以更有效地在切除术前对患者术后的转移和复发风险进行分层。
图5为基于切除标本的肿瘤组织ck19和gpc3免疫分型、脉管瘤栓和肿瘤数目的原发性肝癌患者肿瘤根治性切除术后复发风险评估流程图;图6为基于图5的方法得到的显示不同转移复发风险组中的患者的生存曲线。图7为基于图5的方法得到的各组中患者的复发风险的roc曲线。
如图5所示,可以从北京某三级甲等医院收集术前曾进行肝脏穿刺活检的候选患者,并根据手术大体标本进行“米兰标准”评估,若候选患者符合“米兰标准”,则确定为受测患者,否则,若候选患者符合“米兰标准”,则排出,从而确定出最终的受测患者。
在确定最终的受测患者后,确定肿瘤数目分类,1个肿瘤为0分,大于1个肿瘤为1分。针对最终的受测患者进行肝脏穿刺活检获得肿瘤标本,对肿瘤标本的ck19和gpc3进行免疫组化染色,如ck19和gpc3表达情况为ck19和gpc3均不表达的ck19-/gpc3-,赋值0分;表达gpc3但不表达ck19的ck19-/gpc3+,赋值1分;如为共表达ck19和gpc3的ck19+/gpc3+,或者,表达ck19但不表达gpc3的ck19+/gpc3-,赋值2分。对肿瘤标本进行苏木素-伊红染色,如无脉管瘤栓情况,赋值0分;如有脉管瘤栓情况,赋值1分。
将上述三个项目各自的得分相加得到个体的累计积分,即总赋值。将患者的总赋值为0分的患者人群定义为根治性切除术后低级别复发风险组,将总赋值为1分或2分的患者人群定义为根治性切除术后中级别复发风险组,将总赋值为3分或4分的患者人群定义为根治性切除术后高级别复发风险组。
如图6-图7所示,本实施例中,从北京某三级甲等医院收集符合米兰标准的原发性肝癌的肿瘤手术切除病例63例。患者脉管瘤栓和ck19、gpc3免疫组化染色结果从病理科数据库获得。患者影像学信息从医学影像科获得并结合手术大体标本检查最终确定。患者术后生存信息由该院医生电话随访获得。根据技术方案一方法,根据每一入组病例的免疫表型、脉管瘤栓和单/多发的分类及得分,计算每一患者手术切除术后转移和复发风险累计得分,并根据结果绘制该队列中患者的生存曲线(图5)和roc曲线(图6)。结果显示,该队列中总的切除术后复发率为45.6%(123/226),切除术后低危风险组中的实际复发率为15.0%(3/20),在中危复发风险组中的实际复发率为51.9%(80/154),在高危复发风险组中的实际复发率为76.9%(40/52)。本实施案例显示,基于技术方案二可以有效地对肿瘤根治性切除术后对患者的肿瘤复发或转移进行预测。
本实施例中,具有低级别复发风险的原发性肝癌患者,其肿瘤根治性切除术后两年内无复发率约为85%,中位无复发生存时间为29个月,具有对单纯肿瘤根治性切除术较好的疗效,但术后应进行密切的肿瘤监测以及早发现肿瘤转移或复发,及时采取进一步的治疗措施以提高总生存率;具有中级别复发风险的原发性肝癌患者,其肿瘤根治性切除术后两年内无复发率为48.1%,中位无复发生存时间为23个月;具有高级别复发风险的原发性肝癌患者,其肿瘤根治性切除术后两年内无复发率为23.1%,中位无复发生存时间仅为12个月。具有高和中级别级复发风险的患者,如果选择单纯肿瘤切除手术,术后应该进行更密切的肿瘤检测以及早发现肿瘤转移或复发,及时采取进一步的治疗措施以提高总生存率。
在一个具体实现过程中,在利用人工智能技术对ck19和gpc3表达情况、脉管瘤栓情况、肝脏内肿瘤的结节个数等进行检测时,为了保证检测结果准确,可以针对每个检测结果预先设定相应的匹配度,若检测结果表示的检测的匹配度大于或等于预设的匹配度才可以进行最后的加和计算,否则,若检测结果表示的检测的匹配度小于预设的匹配度,则需要发送相应的通知信息,以便由专业人员进行人工复核,并将复核结果进行反馈后,再根据反馈结果和检测结果进行加和得到患者的总赋值。
在实际应用中,针对同一患者,可以在对该患者拟进行原发性肝癌根治切除术时,可以利用本发明的技术方案,得到该患者所在的分组。同理,也可以对该患者已进行原发性肝癌根治切除术时,可以利用本发明的技术方案,得到该患者所在的分组。这两种情况下得到的分组可能相同,也可能不相同,因此,可能造成对同一患者的复发风险造成无误评估,因此,为了减少同一患者在术前和术后出现不同分组的情况,提高对患者复发风险的准确评估,本实施例还提供了以下技术方案。
本实施例中,可以针对ck19和gpc3表达情况、脉管瘤栓情况和肝脏内肿瘤的结节个数分别设置术前权重值和术后权重值。这样,在进行原发性肝癌根治切除术之前,分别针对患者进行检测,得到ck19和gpc3表达情况的第一赋值结果、脉管瘤栓情况的第二赋值结果和肝脏内肿瘤的结节个数的第三赋值结果,并在进行原发性肝癌根治切除术后,再次对该患者进行检测,得到ck19和gpc3表达情况的第一赋值结果、脉管瘤栓情况的第二赋值结果和肝脏内肿瘤的结节个数的第三赋值结果。在得到患者术前的每个赋值结果和患者术后的每个赋值结果后,可以判断患者术前的每个赋值结果与患者术后的每个赋值结果是否一致;若不一致,选择权重值较大的赋值结果对当前赋值结果进行替换,以便重新计算总赋值。
例如,ck19和gpc3表达情况的术前权重值为1,ck19和gpc3表达情况的术后权重值为2。在对患者进行根治切除术过程中,术前检测到ck19和gpc3均不表达的ck19-/gpc3-,术后检测到表达gpc3但不表达ck19的ck19-/gpc3+,此时在进行加和计算时,需要以赋值1分进行计算,得到最终的患者的总赋值。
脉管瘤栓情况和肝脏内肿瘤的结节个数的赋分制的确定情况与ck19和gpc3表达情况的赋分制的确定情况类似,详细请参考上述相关计算,再次不再赘述。
图8为本发明的原发性肝癌根治切除术的预后情况分组装置实施例的结构示意图,如图8所示,本实施例的原发性肝癌根治切除术的预后情况分组装置包括ck19和gpc3表达分析模块10、组织病理学分化分析模块11、肿瘤结节个数分析模块12和分组模块13。
ck19和gpc3表达分析模块10,用于检测患者的原发性肝癌组织样品中细胞的ck19和gpc3表达情况,并基于表达情况给患者赋值,得到第一赋值结果:如为ck19和gpc3均不表达的ck19-/gpc3-,赋值0分;表达gpc3但不表达ck19的ck19-/gpc3+,赋值1分;如为共表达ck19和gpc3的ck19+/gpc3+,或者,表达ck19但不表达gpc3的ck19+/gpc3-,赋值2分;
组织病理学分化分析模块11,用于检测患者的原发性肝癌组织样品的脉管瘤栓情况,并基于脉管瘤栓情况给患者赋值,得到第二赋值结果:如为无脉管瘤栓情况,赋值0分;如为有脉管瘤栓情况,赋值1分;
肿瘤结节个数分析模块12,用于检测患者的肝脏内肿瘤的结节个数,并基于结节个数给患者赋值,得到第三赋值结果:如为1个肿瘤结节的单发,赋值0分;如为至少2个肿瘤结节的多发,赋值1分;
分组模块13,用于将第一赋值结果、第二赋值结果和第三赋值结果进行加和,得到患者的总赋值,由此将总赋值为0分的患者人群定义为根治性切除术后低级别复发风险组,将总赋值为1分或2分的患者人群定义为根治性切除术后中级别复发风险组,将总赋值为3分或4分的患者人群定义为根治性切除术后高级别复发风险组;
其中,患者符合米兰标准,原发性肝癌组织样品获取自患者的术前肝穿活检或术后原发性肝癌根治切除标本,并且该装置不用于诊断疾病。
本实施例的原发性肝癌根治切除术的预后情况分组装置,通过检测患者的原发性肝癌组织样品中细胞的ck19和gpc3表达情况,并基于表达情况给患者赋值,得到第一赋值结果:通过检测患者的原发性肝癌组织样品的脉管瘤栓情况,并基于脉管瘤栓情况给患者赋值,得到第二赋值结果:通过检测患者的肝脏内肿瘤的结节个数,并基于结节个数给患者赋值,得到第三赋值结果:并将第一赋值结果、第二赋值结果和第三赋值结果进行加和,得到患者的总赋值,由此将总赋值为0分的患者人群定义为根治性切除术后低级别复发风险组,将总赋值为1分或2分的患者人群定义为根治性切除术后中级别复发风险组,将总赋值为3分或4分的患者人群定义为根治性切除术后高级别复发风险组,实现了结合ck19或gpc3联合检测、有无脉管瘤栓以及肿瘤的结节个数可以对原发性肝癌患者的术后复发进行有效分层和预测。采用本发明的技术方,能够全面、准确地对原发性肝癌根治切除术患者的复发风险的级别评估,进而提高识别具有高复发风险的个体的识别准确率。
进一步地,上述实施例的原发性肝癌根治切除术的预后情况分组装置中,ck19和gpc3表达分析模块10具体用于获取对原发性肝癌组织样品进行免疫组织化学染色后的第一原发性肝癌组织信息;对第一原发性肝癌组织信息进行识别,确定ck19和gpc3表达情况。其中,免疫组织化学染色包括利用生物素标记的分别针对ck19和gpc3的单克隆抗体进行,或者,利用不同颜色荧光素标记的分别针对ck19和gpc3的单克隆抗体进行。
进一步地,上述实施例的原发性肝癌根治切除术的预后情况分组装置中,组织病理学分化分析模块11具体用于获取对原发性肝癌组织样品进行苏木素-伊红染色后的第二原发性肝癌组织信息;对第二原发性肝癌组织信息进行识别,确定脉管瘤栓情况。
进一步地,上述实施例的原发性肝癌根治切除术的预后情况分组装置中,肿瘤结节个数分析模块12,具体用于通过原发性肝癌根治切除术前的影像学检查结果或者原发性肝癌根治切除术中得到的切除标本的检查结果来确定患者肝脏内肿瘤结节个数。其中,影像学检查结果获取自增强ct或增强核磁扫描成像。
在一个具体实现过程中,分组模块13,还用于判断患者术前的每个赋值结果与患者术后的每个赋值结果是否一致;
若不一致,选择权重值较大的赋值结果对当前赋值结果进行替换,以便重新计算总赋值。
关于上述实施例中的装置,其中各个模块执行操作的具体方式已经在有关该方法的实施例中进行了详细描述,此处将不做详细阐述说明。
图9为本发明的原发性肝癌根治切除术的预后情况分组系统实施例的结构示意图,如图9所示,本实施例的,原发性肝癌根治切除术的预后情况分组系统包括存储器21和处理器20;
处理器20与存储器21通过通信总线相连接:
其中,处理器20,用于调用并执行存储器21中存储的程序;
存储器21,用于存储程序,程序至少用于执行上述实施例的原发性肝癌根治切除术的预后情况分组方法。
本发明还提供一种存储介质,其上存储有计算机程序,计算机程序被处理器执行时,实现如上实施例的原发性肝癌根治切除术的预后情况分组方法。
本发明还提供一种本发明的方法或系统组合使用的试剂盒,试剂盒包括:
(a)用于检测肝细胞癌组织样品中细胞的ck19和gpc3表达情况的试剂;和
(b)用于检测肝细胞癌组织样品的分化情况的试剂。
在本发明提供的试剂盒中,优选地,(a)中的试剂包括用于对肝细胞癌组织样品进行免疫组织化学染色的试剂;例如,试剂包括ck19和gpc3的单克隆抗体;更优选地,试剂包括不同颜色荧光素标记的分别针对ck19和gpc3的单克隆抗体。
在本发明提供的试剂盒中,优选地,(b)中的试剂包括用于对肝细胞癌组织样品进行苏木素-伊红染色的试剂。
可以理解的是,上述各实施例中相同或相似部分可以相互参考,在一些实施例中未详细说明的内容可以参见其他实施例中相同或相似的内容。
需要说明的是,在本发明的描述中,术语“第一”、“第二”等仅用于描述目的,而不能理解为指示或暗示相对重要性。此外,在本发明的描述中,除非另有说明,“多个”的含义是指至少两个。
流程图中或在此以其他方式描述的任何过程或方法描述可以被理解为,表示包括一个或更多个用于实现特定逻辑功能或过程的步骤的可执行指令的代码的模块、片段或部分,并且本发明的优选实施方式的范围包括另外的实现,其中可以不按所示出或讨论的顺序,包括根据所涉及的功能按基本同时的方式或按相反的顺序,来执行功能,这应被本发明的实施例所属技术领域的技术人员所理解。
应当理解,本发明的各部分可以用硬件、软件、固件或它们的组合来实现。在上述实施方式中,多个步骤或方法可以用存储在存储器中且由合适的指令执行系统执行的软件或固件来实现。例如,如果用硬件来实现,和在另一实施方式中一样,可用本领域公知的下列技术中的任一项或他们的组合来实现:具有用于对数据信号实现逻辑功能的逻辑门电路的离散逻辑电路,具有合适的组合逻辑门电路的专用集成电路,可编程门阵列(pga),现场可编程门阵列(fpga)等。
本技术领域的普通技术人员可以理解实现上述实施例方法携带的全部或部分步骤是可以通过程序来指令相关的硬件完成,的程序可以存储于一种计算机可读存储介质中,该程序在执行时,包括方法实施例的步骤之一或其组合。
此外,在本发明各个实施例中的各功能单元可以集成在一个处理模块中,也可以是各个单元单独物理存在,也可以两个或两个以上单元集成在一个模块中。上述集成的模块既可以采用硬件的形式实现,也可以采用软件功能模块的形式实现。集成的模块如果以软件功能模块的形式实现并作为独立的产品销售或使用时,也可以存储在一个计算机可读取存储介质中。
上述提到的存储介质可以是只读存储器,磁盘或光盘等。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!