二硫化钼量子点自发还原高锰酸钾制备双模态成像纳米复合物的方法与流程
本发明涉及一种荧光/磁共振双模态成像纳米复合物的制备法,具体涉及二硫化钼量子点自发还原高锰酸钾一步制备二氧化锰/二硫化钼量子点荧光/磁共振双模态成像纳米复合物。
背景技术:
mno2纳米片(mno2nss)作为一种具有良好生物相容性的2d典型过渡金属氧化物(tmo)(j.meyer,s.hamwi,m.kroger,w.kowalsky,t.riedlanda.kahn,advancedmaterials,2012,24,5408-5427),由于其独特的结构,已引起多学科的广泛关注。它们由mno6八面体组成,锰离子占据八面体的中心,并与六个临近的氧离子配位,而每个氧离子与三个临近的锰离子配位(h.wang,j.zhang,x.hang,x.zhang,j.xie,b.panandy.xie,angewandtechemie,2015,54,1195-1199)。mno2nss在300-600nm间有较宽的吸收,并在360nm处有典型的强吸收峰,八面体晶格的配位场中mn离子的d-d跃迁,使它们成为有效的广谱猝灭剂(e.lhuillier,s.pedetti,s.ithurria,b.nadal,h.heuclinandb.dubertret,accountsofchemicalresearch,2015,48,22-30)。mno2nss作为荧光猝灭剂的应用主要得益于两个方面:(1)在300-600nm间有较宽的吸收带;(2)随着mno2还原为mn2+,纳米片结构的分解。不仅作为荧光猝灭剂,mno2纳米片也可用作肿瘤微环境激活的mri造影剂。此外,较大的比表面积也使mno2纳米片成为药物纳米载体的候选。wang和shi团队在2014年报道了一个引人注目的工作,即基于高度分散的2dmno2ns构建智能化的诊疗平台,实现超灵敏的ph响应mri和药物输送/释放(w.shi,b.song,x.qin,z.liu,m.tan,l.wang,f.songandj.yuan,acsappliedmaterials&interfaces,2018,10,27681-27691)。
mno2nss的合成对于其广泛的生物医学应用具有重要意义。目前用于制备mno2ns的方法主要分为两类:自上而下(top-down)和自下而上(bottom-up)。2003年,omomo等人首次描述了通过剥离四丁基铵氢氧化物溶液(tba·oh)中的层状氧化锰(h0.13mno2·h2o)制备mno2的单层二维微晶(y.omomo,t.sasaki,l.wangandm.watanabe,journaloftheamericanchemicalsociety,2003,125,3568-3575)。这种传统的“自上而下”方法是成本要求高、耗时的多步合成工艺;此外,必须克服获得纳米片厚度分布较宽的障碍。2008年,kazuyakai等人报道了一步“自下而上”直接获取mno2nss的方法(k.kai,y.yoshida,h.kageyama,g.saito,t.ishigaki,y.furukawaandj.kawamata,journaloftheamericanchemicalsociety,2008,130,15938-15943)。到目前为止,“自下而上”法作为一种新颖且简便的策略,已经引起了众多研究人员的关注,因为它具有易于制备和易于控制的独特优势。用于制备mno2nss的“自下而上”方法主要包括mn2+的氧化和kmno4的还原,通常在氧化剂或还原剂存在下引入自牺牲模板(例如氧化石墨烯纳米片,gons)或螯合剂(例如乙二胺四乙酸,edta)。2007年,oaki等人提出了“自下而上”的方法,通过溶解氧来氧化锰离子获得mno2nss(y.oakiandh.imai,angewandtechemie,2007,46,4951-4955),并使用乙二胺四乙酸(edta)作为mn2+的螯合剂,以阻止mn(oh)2的快速沉淀。尽管如此,它们的沉淀物由多层组成,并且耗时的缺点是不可避免的。还原型“自下而上”方法近年来发展迅速,以kmno4作为mn源,引入不同的还原剂制备。例如,liu组首先通过在ph=6的2-(n-吗啉代)乙磺酸(mes)缓冲液中加入kmno4来制备mno2nss(r.deng,x.xie,m.vendrell,y.-t.changandx.liu,journaloftheamericanchemicalsociety,2011,133,20168-20171)。2015年,yin和同事采用十二烷基硫酸钠(sds)作为还原剂制备mno2nss(z.liu,k.xu,h.sunands.yin,small,2015,11,2182-2191)。然而,目前文献报道的此类还原法得到的mno2nss仅具备可激活的mri信号。
技术实现要素:
针对上述现有技术存在的问题,本发明提供一种二硫化钼量子点自发还原高锰酸钾制备双模态成像纳米复合物的方法,制备过程简单、条件宽松,且制备的产物具有肿瘤微环境响应的荧光/磁共振成像信号特性,可用于荧光/磁共振双模态成像。
为实现上述目的,本发明提供如下技术方案:一种二硫化钼量子点自发还原高锰酸钾制备双模态成像纳米复合物的方法,包括以下步骤:
a.在二硫化钼量子点中加入高锰酸钾溶液,混匀后在4℃环境中反应24h;
b.步骤a中反应后的溶液超滤除去未反应的原料得mno2/mos2纳米复合物。
进一步的,所述步骤a中二硫化钼量子点的加入量为112.3μl,高锰酸钾的加入量为20-175μl2mm。
进一步的,所述步骤b中超滤管的截留分子量为1kda。
与现有技术相比,本发明以mos2qds为还原剂,利用二硫化钼量子点的还原性自发还原高锰酸钾一步制备mno2/mos2纳米复合物,与现有的氧化法制备mno2相比,本发明制备方法简单、环保、经济、易操作、无需引入自牺牲模板或螯合剂,对制备条件要求相对宽松;与现有的还原制备法相比,本发明制备的mno2/mos2纳米复合物不仅具有肿瘤微环境响应的mri信号,而且具备肿瘤微环境响应的荧光成像信号,简化多模态纳米复合物的制备过程,对制备条件要求相对宽松,所得纳米复合物分散性好、稳定性高、生物相容性佳,具有良好的生物相容性和肿瘤微环境响应的荧光/磁共振成像信号。
附图说明
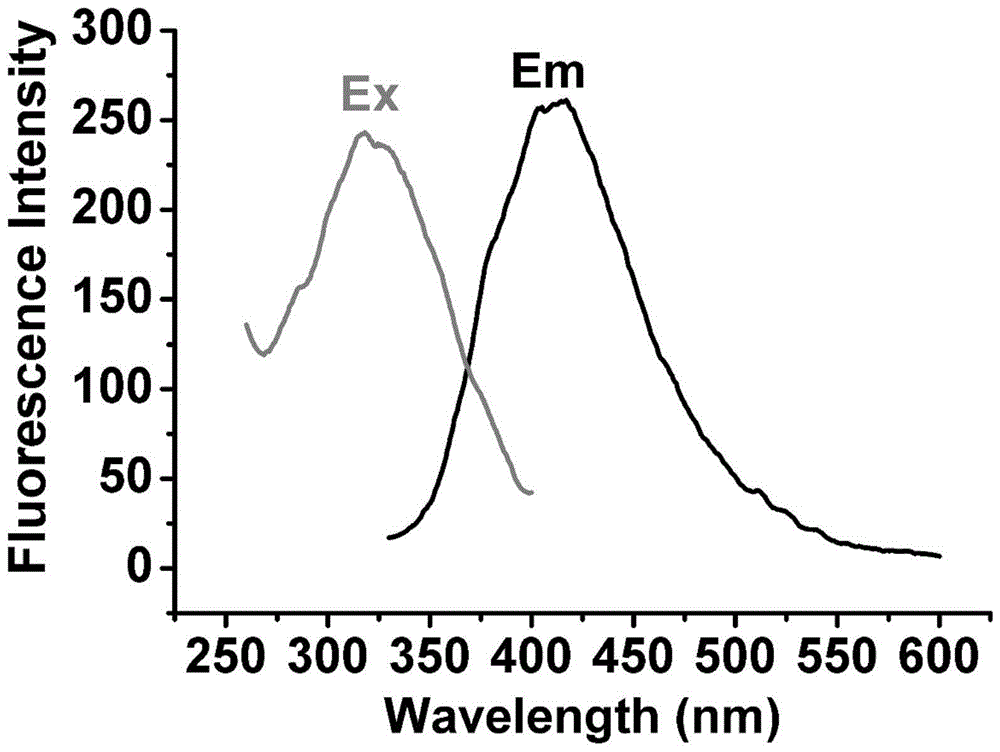
图1为本发明所制备二硫化钼量子点的荧光光谱图;
图2a为高锰酸钾溶液及本发明所制备mno2/mos2纳米复合物水溶液在日光灯照射下的对比图;
图2b为本发明所制备mno2/mos2纳米复合物在谷胱甘肽存在与否时在日光灯照射下的对比图;
图3为本发明在所制备mno2/mos2纳米复合物的不同反应原料比荧光优化图;
图4为本发明在所制备mno2/mos2纳米复合物的不同反应原料比磁共振优化图;
图5a为本发明所制备mos2qds的透射电镜图;
图5b为本发明所制备mno2/mos2纳米复合物的透射电镜图;
图5c为本发明所制备mno2/mos2纳米复合物在谷胱甘肽存在时的透射电镜图;
图6a为本发明所制备mos2qds的原子力显微镜图;
图6b为本发明所制备mno2/mos2纳米复合物的原子力显微镜图;
图6c为本发明所制备mno2/mos2纳米复合物在谷胱甘肽存在时的原子力显微镜图;
图7为本发明所制备mno2/mos2纳米复合物的eds元素分布图;
图8为本发明所制备mno2/mos2纳米复合物在谷胱甘肽存在与否时的mri弛豫率测定曲线图;
图9为本发明所制备mno2/mos2纳米复合物的肾癌细胞和血管内皮细胞生物相容性评估图;
图10为本发明所制备mno2/mos2纳米复合物对小鼠主要脏器的病理切片分析图;
图11为本发明所制备mno2/mos2纳米复合物对小鼠血液中红细胞比容(hct),血红蛋白(hgb),平均红细胞血红蛋白(mch),平均血红蛋白浓度(mchc),平均红细胞体积(mcv),血小板(plt),红细胞(rbc)和白细胞(wbc)水平的影响图;
图12为本发明所制备mno2/mos2纳米复合物对小鼠血液中白蛋白(alb),天冬氨酸转氨酶(alt),谷丙转氨酶(ast),肌酸酐(crea),总蛋白(tp)和尿素(urea)水平的影响图。
具体实施方式
下面结合附图对本发明作进一步说明。
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:
取112.3μl二硫化钼量子点溶液,加入150μl2mmkmno4和37.7μlh2o,混匀后在4℃环境中反应24h,超滤除去未反应的原料得mno2/mos2纳米复合物。
实施例2:
取112.3μl二硫化钼量子点溶液,加入20μl2mmkmno4和37.7μlh2o,混匀后在4℃环境中反应24h,超滤除去未反应的原料得mno2/mos2纳米复合物。
实施例3:
取112.3μl二硫化钼量子点溶液,加入175μl2mmkmno4和37.7μlh2o,混匀后在4℃环境中反应24h,超滤除去未反应的原料得mno2/mos2纳米复合物。
如图1所示,二硫化钼量子点的最佳激发波长为320nm,荧光发射波长为415nm。
如图2a、2b所示,加入二硫化钼量子点后,高锰酸钾溶液颜色由玫红色变成棕色,说明mno2纳米片的生成。加入谷胱甘肽后,溶液颜色进一步变为无色,说明生成的mno2纳米片被谷胱甘肽还原为锰离子。
如图3所示,当kmno4与mos2量子点反应摩尔比为24.6:1时,本发明所制备mno2/mos2纳米复合物对谷胱甘肽表现出最佳的荧光信号响应。
如图4所示,当kmno4与mos2量子点反应摩尔比为28.8:1时,本发明所制备mno2/mos2纳米复合物对谷胱甘肽表现出最佳的磁共振成像信号响应。
如图5a、5b、5c、6a、6b、6c所示,制备的mos2量子点粒径约1.37nm,与高锰酸钾反应后,形成纳米片结构,mos2量子点分布在mno2纳米片的边缘和基面上,加入谷胱甘肽后,mno2纳米片结构消失。
如图7所示,eds元素分布图谱显示制备的mno2/mos2纳米复合物由mn,mo,s,o等元素组成。
如图8所示,本发明所制备的mno2/mos2纳米复合物的弛豫率在有无谷胱甘肽存在下时分别为5.05和0.082mms-1。
如图9所示,将不同浓度的mno2/mos2纳米复合物溶液与肾癌786-0细胞株共培养24小时后,与未加入纳米材料的对照组细胞相比较,发现mno2/mos2纳米复合物对肿瘤细胞具有一定的生长抑制作用。
如图10所示,将不同浓度的mno2/mos2纳米复合物溶液与人脐静脉细胞ea.hy926细胞株共培养24小时后,与未加入纳米材料的对照组细胞相比较,发现mno2/mos2纳米复合物具有良好的生物相容性。
如图11所示,本发明所制备mno2/mos2纳米复合物对小鼠血液中红细胞比容(hct),血红蛋白(hgb),平均红细胞血红蛋白(mch),平均血红蛋白浓度(mchc),平均红细胞体积(mcv),血小板(plt),红细胞(rbc)和白细胞(wbc)水平无显著性影响。
如图12所示,本发明所制备mno2/mos2纳米复合物对小鼠血液中白蛋白(alb),天冬氨酸转氨酶(alt),谷丙转氨酶(ast),总蛋白(tp)和尿素(urea)水平无显著性影响,可下调肌酸酐(crea)的水平,说明所制备的mno2/mos2纳米复合物具有良好的在体生物相容性。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其它的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
以上所述,仅为本发明的较佳实施例,并不用以限制本发明,凡是依据本发明的技术实质对以上实施例所作的任何细微修改、等同替换和改进,均应包含在本发明技术方案的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!