酪氨酸激酶抑制剂联合单克隆抗体以及紫杉醇类药物治疗肿瘤疾病的用途的制作方法
本发明属于医药领域,涉及酪氨酸激酶抑制剂联合单克隆抗体以及紫杉醇类药物在制备预防或治疗肿瘤疾病的药物中的用途。
背景技术:
恶性肿瘤是危害人们生命健康的重大疾病。近年来,随着肿瘤生物学及相关学科的飞速发展,针对肿瘤细胞内异常信号系统靶点的特异性抗肿瘤药物是新药研发的焦点。同时,多种抗肿瘤药物联合用于治疗肿瘤疾病也是科学研究的热点。
乳腺癌是女性最常见的恶性肿瘤之一,其发生率逐年上升。在中国,乳腺癌居女性癌症发病率第一位,发病率约为37.86/10万,呈逐年上升趋势,是危害女性健康的常见恶性肿瘤。her2分子是乳腺癌预后较差的独立因子,中国乳腺癌患者中约20%~30%存在her2基因的扩增/过表达。大量临床试验已证实,靶向治疗在her2阳性乳腺癌的辅助治疗和晚期治疗中疗效显著,也推动了其在新辅助治疗中的发展。
新辅助治疗是局部晚期乳腺癌的标准治疗,长期以来被用于缩小肿瘤以使不可手术转变为可手术,并能提高保乳率,还可以降低腋窝分期从而避免腋窝清扫而仅需前哨淋巴结活检。新辅助治疗的病理完全缓解(pcr)与早期乳腺癌的无病生存(dfs)和总生存(os)相关。早期乳腺癌患者的病理反应和远期生存之间的相关性在三阴性乳腺癌患者中最强,her2阳性患者次之,激素受体阳性患者的相关性最小。新辅助治疗通过在全身治疗之前和期间提供肿瘤标本和血液样本来测试新型治疗和预测性生物标志物,新辅助研究允许快速评估药物疗效,加快了早期乳腺癌治疗策略的发展和批准。her2过表达的患者对内分泌治疗和标准化疗治疗的效果均不佳,抗her2单克隆抗体曲妥珠单抗在术后辅助和晚期乳腺癌中的应用改善了这部分患者的转归。
目前,新辅助治疗临床实践中,曲妥珠单抗联合化疗能够显著提高患者的pcr率并改善患者的转归,确立了目前her2阳性乳腺癌新辅助治疗的标准模式,同时大量研究也在努力挖掘其他分子靶向药物联合化疗在新辅助阶段治疗的疗效潜力。
受体酪氨酸激酶是一类参与信号转导的跨膜蛋白,在多种细胞中表达,调节细胞的生长、分化和新生血管生成。研究表明,超过50%的原癌基因和癌基因产物都具有酪氨酸激酶活性,它们的异常表达将导致肿瘤发生,另外还与肿瘤的侵袭和转移、肿瘤新生血管的生成、肿瘤的化疗抗性密切相关。wo2011029265公开了一种有效的酪氨酸激酶抑制剂及其制备方法,其结构如式i所示,
该化合物具有明显的药效优势。cn102933574a中描述了该化合物的二马来酸盐形式,其具有改善的理化性质、药代动力学性质以及生物利用度。
本发明提供了一种新的酪氨酸激酶抑制剂与单克隆抗体以及紫杉醇类药物联合在制备预防或治疗肿瘤疾病的药物中的用途,并显示了良好的抑瘤效果。
技术实现要素:
本发明提供了酪氨酸激酶抑制剂与单克隆抗体以及紫杉醇类药物联合在制备预防或治疗肿瘤疾病的药物中的用途,其中,所述酪氨酸激酶抑制剂选自式(i)所示化合物(化合物i)或其复合物或其可药用盐或其立体异构体,
在某些实施方式中,所述肿瘤疾病选自her2阳性或her2突变肿瘤,特别是her2阳性或her2突变的乳腺肿瘤。
在某些实施方式中,所述肿瘤疾病选自复发或转移性her2阳性乳腺癌。
在某些实施方式中,所述肿瘤疾病选自早期或局部晚期her2阳性乳腺癌。
在某些实施方式中,所述的乳腺肿瘤选自乳头肿瘤、男性乳腺肿瘤、乳腺恶性淋巴瘤、纤维上皮性肿瘤、上皮-肌上皮性肿瘤、导管内癌、小叶原位癌、乳头湿疹样乳腺癌、早期浸润性导管癌、早期浸润性小叶癌、乳头状癌、髓样癌、小管癌、腺样囊性癌、粘液腺癌、大汗腺样癌、鳞状细胞癌、浸润性小叶癌、浸润性导管癌、硬癌。
在某些实施方式中,所述疾病选自复发或转移性her2阳性浸润性乳腺癌。
在某些实施方式中,所述疾病不包括转移性乳腺癌和炎性乳腺癌。
在某些实施方式中,所述式(i)所示化合物或其复合物或其可药用盐或其立体异构体的剂量范围选自100-1000mg。
在某些实施方案中,所述式(i)所示化合物或其复合物或其可药用盐或其立体异构体的剂量选自100mg、125mg、150mg、175mg、200mg、250mg、300mg、350mg、400mg、450mg、500mg,600mg、700mg、750mg、800mg、900mg、1000mg。
本发明所述药物的可药用盐可以是盐酸盐、磷酸盐、磷酸氢盐、硫酸盐、硫酸氢盐、亚硫酸盐、乙酸盐、草酸盐、丙二酸盐、戊酸盐、谷氨酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、硼酸盐、对甲苯磺酸盐、甲磺酸盐、羟乙基磺酸盐、马来酸盐。苹果酸盐、酒石酸盐、苯甲酸盐、双羟萘酸盐、水杨酸盐、香草酸盐、扁桃酸盐、琥珀酸盐、葡萄糖酸盐、乳糖酸盐或月桂基磺酸盐等。
在某些实施方式中,所述式(i)所示化合物的可药用盐为马来酸盐,优选二马来酸盐。
在某些实施方式中,所述单克隆抗体选自曲妥珠单抗、帕妥珠单抗或t-dm1。
在某些实施方式中,所述单克隆抗体的剂量范围选自4mg/kg至20mg/kg。
在某些实施方式中,所述的紫杉醇类药物选自紫杉醇、多西他赛或白蛋白结合型紫杉醇。
在某些实施方式中,所述的紫杉醇类药物的剂量范围选自50-200mg/m2,优选50-180mg/m2,更优选50mg/m2、60mg/m2、75mg/m2、100mg/m2、125mg/m2、150mg/m2。
在某些实施方式中,所述疾病患者未接受过恶性肿瘤的抗肿瘤治疗或放射疗法,其中所述恶性肿瘤不包括已治愈的宫颈原位癌、基底细胞癌或鳞癌。
本发明所述联合的给药方式选自同时给药、独立地配制并共给药或独立地配制并相继给药。
本发明所述联合的给药途径选自经口给药、胃肠外给药、经皮给药,所述胃肠外给药包括但不限于静脉注射、皮下注射、肌肉注射。
本发明进一步涉及式(i)所示化合物或其复合物或其可药用盐或其立体异构体与单克隆抗体以及紫杉醇类药物联合在制备预防或治疗肿瘤疾病的药物中的用途,其中式(i)所示化合物或其复合物或其可药用盐或其立体异构体的给药频次可以是一日一次、一日二次、一日三次。
在某些实施方式中,其中式(i)所示化合物或其复合物或其可药用盐或其立体异构体的给药频次为一日一次,单克隆抗体的给药频次为每3周一次,紫杉醇类药物的给药频次为每3周一次。
在某些实施方式中,其中式(i)所示化合物或其复合物或其可药用盐或其立体异构体的给药频次为一日一次,剂量为300mg、350mg、400mg或450mg;单克隆抗体的给药频次为每3周一次,剂量为4mg/kg、6mg/kg、8mg/kg或10mg/kg;紫杉醇类药物的给药频次为每3周一次,剂量为50mg/m2、60mg/m2、75mg/m2、100mg/m2、125mg/m2、150mg/m2。
在某些实施方式中,每21天为一个给药周期,第一个给药周期中单克隆抗体的剂量为8mg/kg,后续给药周期中单克隆抗体的剂量为6mg/kg。
本发明所述的方案中,所述的联合任选的还包含其他组分,所述其他组分包括但不限于其他抗肿瘤药等。
本发明还提供了一种治疗肿瘤疾病的方法,包括向患者施用本发明所述的式(i)所示化合物或其复合物或其可药用盐或其立体异构体、单克隆抗体以及紫杉醇类药物。
在某些实施方式中,所述肿瘤疾病选自her2阳性或her2突变肿瘤,特别是her2阳性或her2突变的乳腺肿瘤。
在某些实施方式中,所述肿瘤疾病选自复发或转移性her2阳性乳腺癌。
在某些实施方式中,所述疾病选自复发或转移性her2阳性浸润性乳腺癌。
本发明还提供了一种治疗肿瘤疾病的方法,包括向患者施用本发明所述的式(i)所示化合物或其复合物或其可药用盐或其立体异构体、单克隆抗体以及紫杉醇类药物,然后进行手术治疗。
在某些实施方式中,所述肿瘤疾病选自her2阳性或her2突变肿瘤,特别是her2阳性或her2突变的乳腺肿瘤。
在某些实施方式中,所述肿瘤疾病选自早期或局部晚期her2阳性乳腺癌。
在某些实施方式中,所述疾病不包括转移性乳腺癌和炎性乳腺癌。
在某些实施方式中,所述患者未接受过恶性肿瘤的抗肿瘤治疗或放射疗法,其中所述恶性肿瘤不包括已治愈的宫颈原位癌、基底细胞癌或鳞癌。
本发明还涉及一种包含式(i)所示化合物或其复合物或其可药用盐或其立体异构体、单克隆抗体和紫杉醇类药物,以及一种或多种药用载体、赋形剂、稀释剂的药物组合物。所述药物组合物可以制成药学上可接受的任一剂型。例如,可以配制为片剂、胶囊剂、丸剂、颗粒剂、溶液剂、混悬剂、糖浆剂、注射剂(包括注射液、注射用无菌粉末与注射用浓溶液)、栓剂、吸入剂或喷雾剂。
本发明所述的含式(i)所示化合物或其复合物或其可药用盐或其立体异构体、单克隆抗体和紫杉醇类药物的药物组合物,可以单独给药,或者与一种或多种治疗剂联合使用。
待组合的各成分(例如,式(i)所示化合物或其复合物或其可药用盐或其立体异构体、单克隆抗体和紫杉醇类药物,与其他任意组分药物)可同时给药或依次顺序地分开用药。此外,待组合的各成分还可以以同一制剂形式或以分开的不同制剂的形式联合给药。
本发明还提供了一种药物包装盒,其中包装有本发明所述的酪氨酸激酶抑制剂、单克隆抗体和紫杉醇类药物的药物组合物,其中酪氨酸激酶抑制剂选自式(i)所示化合物或其复合物或其可药用盐或其立体异构体。
本发明所述的“联合”是一种给药方式,是指一定时间期限内给予至少一种剂量的酪氨酸激酶抑制剂、至少一种剂量的单克隆抗体以及至少一种剂量的紫杉醇类药物,其中给予的药物都显示药理学作用。所述的时间期限可以是一个给药周期内,优选4周内,3周内,2周内,1周内,或24小时以内,更优选12小时以内。可以同时或依次给予酪氨酸激酶抑制剂、单克隆抗体以及紫杉醇类药物。这种期限包括这样的治疗,其中通过相同给药途径或不同给药途径给予酪氨酸激酶抑制剂、单克隆抗体以及紫杉醇类药物。本发明所述联合的给药方式选自同时给药、独立地配制并共给药或独立地配制并相继给药。
本发明将式(i)所示化合物或其复合物或其可药用盐或其立体异构体与、单克隆抗体和紫杉醇类药物联合给药,从而增强了抗肿瘤活性,以及改善了肿瘤疾病的治疗效果。
附图说明
图1为式(i)所示化合物、
图2为式(i)所示化合物、
具体实施方式
实施例1:式(i)所示化合物的马来酸盐联合曲妥珠单抗加多西他赛对比安慰剂联合曲妥珠单抗加多西他赛术前治疗早期或局部晚期her2阳性乳腺癌
1、试验药物
式(i)所示化合物的马来酸盐片剂,规格为80mg和160mg。
注射用曲妥珠单抗,由罗氏制药生产,规格为440mg。
多西他赛注射液(多西他赛),即
2、入组受试者
(1)年龄≥18岁,且≤75岁的女性初治患者;
(2)ecog评分0~1级;乳腺癌符合下列标准:
--组织学确证的浸润性乳腺癌,研究中心经标准评估方法测定的原发性肿瘤直径>2cm;
--肿瘤分期:早期(t2-3、n0-1、m0)或局部晚期(t2-3、n2或n3、m0);
--病理检测证实的her2表达阳性乳腺癌。
3、给药方法
经筛选合格的受试者按1:1比例随机分配至式(i)所示化合物联合曲妥珠单抗加多西他赛治疗组(试验组)或安慰剂联合曲妥珠单抗加多西他赛治疗组(对照组)。式(i)所示化合物或安慰剂剂量为400mg/天;曲妥珠单抗剂量为第1疗程为8mg/kg负荷剂量,第2-4疗程为6mg/kg;多西他赛剂量为100mg/m2。曲妥珠单抗及多西他赛将在每个疗程的第1天静脉注射给药,每21天为一个疗程,共4个疗程(第1-4疗程)。疗程时间按照曲妥珠单抗及多西他赛给药周期的起止时间计算。式(i)所示化合物从第1个疗程第1天至第4个疗程第21天,每天400mg连续口服给药。完成四个疗程并适合手术的受试者接受手术治疗,并评估其病理缓解情况。
实施例2:式(i)所示化合物的马来酸盐联合曲妥珠单抗加多西他赛对比安慰剂联合曲妥珠单抗加多西他赛治疗her2阳性复发/转移性乳腺癌
1、试验药物
式(i)所示化合物的马来酸盐片剂,规格为80mg和160mg。
注射用曲妥珠单抗,由罗氏制药生产,规格为440mg。
多西他赛注射液(多西他赛),即
2、入组受试者
(1)年龄≥18岁,且≤75岁的女性初治患者;
(2)ecog评分0~1级;乳腺癌符合下列标准:
--病理检测证实的her2阳性浸润性乳腺癌;
--her2阳性定义为>10%免疫反应细胞的免疫组织化学(ihc)分数为3+或原位杂交(ish)结果为her2基因扩增;
--肿瘤分期:复发或转移性乳腺癌;局部复发者需经研究者确认无法进行根治性手术切除。
3、给药方法
经筛选合格的受试者按1:1比例随机分配至式(i)所示化合物联合曲妥珠单抗加多西他赛治疗组(试验组)或安慰剂联合曲妥珠单抗加多西他赛治疗组(对照组)。式(i)所示化合物或安慰剂剂量为400mg/天;曲妥珠单抗剂量为第1疗程为8mg/kg负荷剂量,后续疗程为6mg/kg;多西他赛剂量为75mg/m2。曲妥珠单抗及多西他赛将在每个疗程的第1天静脉注射给药,每21天为一个疗程。疗程时间按照曲妥珠单抗及多西他赛给药周期的起止时间计算。式(i)所示化合物从第1个疗程第1天起,每天400mg连续口服给药。所有药物按照给药周期持续给药至研究者评估为疾病进展、出现不耐受的毒性、撤回知情同意书或研究者认为必须终止给药时。
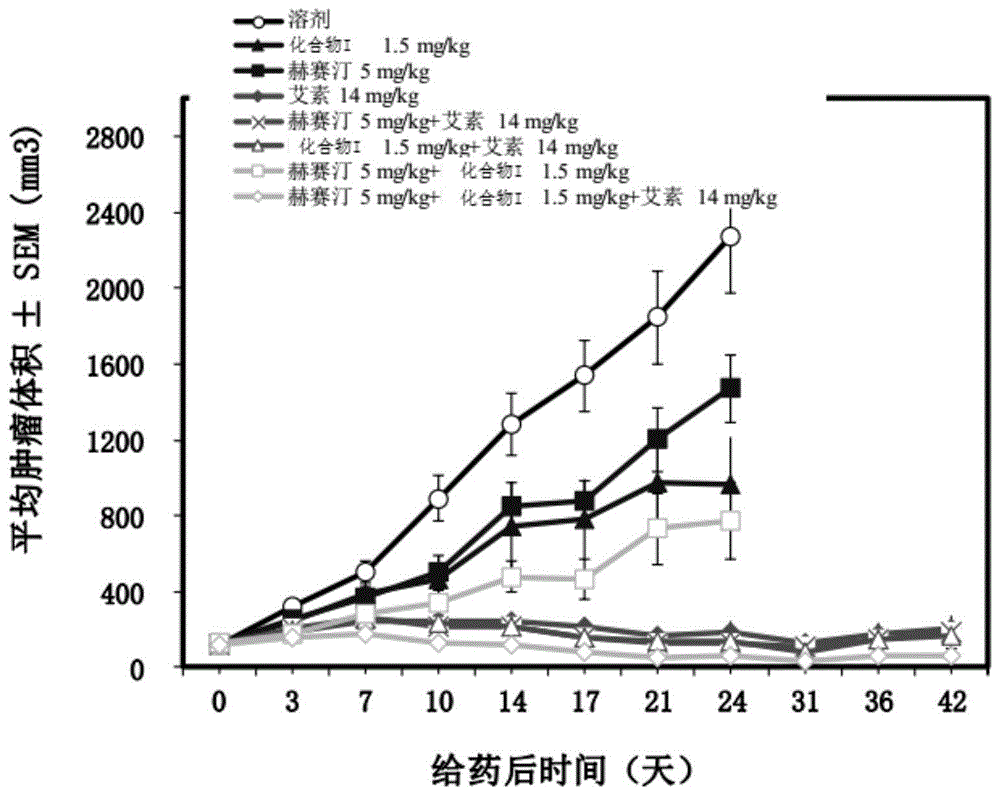
实施例3:式(i)所示化合物的马来酸盐联合曲妥珠单抗加多西他赛单用或合用对her2阳性人乳腺癌bt-474裸小鼠皮下移植瘤的疗效。
1.受试药物
药物名称:式(i)所示化合物的二马来酸盐;
配制方法:化合物i的二马来酸盐用0.1%tween-80配制;曲妥珠单抗先用原研厂家提供的溶剂复溶,然后用生理盐水稀释;
2.实验动物
balb/c裸小鼠,4-8周龄,雌性,购自江苏集萃药康生物科技有限公司。实验动物使用许可证号:scxk(苏)2018-0008;动物合格证号:201806325;饲养环境:spf级。
3.细胞
人乳腺癌bt-474细胞购自中国科学院细胞库。bt-474细胞用10-cm培养皿贴壁培养,培养条件为dmem培养基中加10%胎牛血清以及青、链霉素,于37℃、含5%co2空气的培养箱中培养。一周2-3次传代,当细胞呈指数生长期时,胰酶消化、收集细胞,计数,接种。
4.实验步骤
裸小鼠皮下接种人乳腺癌bt-474细胞,待肿瘤生长至100-150mm3后,根据肿瘤体积将动物分组(d0)。小鼠静脉注射(iv),或灌胃(i.g.)给药,每天1次(qd)、每7天(q7d)、或每周2次(biw);给药体积10ml/kg;溶剂组给予相同体积的“溶剂”;具体给药剂量和给药方案见表1。化合物i以盐计算。每周测2次肿瘤体积,称小鼠体重,记录数据。
表1.实验方案
注:
加黑、划线部分为药物给药频率,其他部分为溶剂给药频率。
biw溶剂:生理盐水;qd溶剂:0.1%tween80;q7d溶剂:3%tween80+1.5%乙醇
实验指标:
肿瘤体积(v)计算公式为:
v=1/2×a×b2,其中a、b分别表示长、宽。
t/c(%)=(t-t0)/(c-c0)×100%,其中t、c为实验结束时的肿瘤体积;t0、c0为实验开始时的肿瘤体积。
当肿瘤出现消退时,抑瘤率(tgi)(%)=100-(t-t0)/t0×100如果肿瘤比起始体积缩小,即t<t0或c<c0时,即定义为肿瘤部分消退(pr);如果肿瘤完全消失,即定义为肿瘤完全消退(cr)。实验结束、达到实验终点、或肿瘤体积达到1500mm3,co2麻醉处死动物,随后解剖取瘤并拍照。
5.实验结果
化合物i(1.5mg/kg,i.g.,qd×21)抑制her2阳性人乳腺癌bt-474裸小鼠皮下移植瘤的生长,抑瘤率为61%;
- 还没有人留言评论。精彩留言会获得点赞!