一种miRNA在制备抗抑郁药物中的应用的制作方法
本发明属于核酸类药物领域,具体涉及一种mirna在制备抗抑郁药物中的应用。
背景技术:
抑郁症是一种精神情感障碍性疾病,主要表现为持续性的情绪低落、快感缺乏、兴趣丧失、自我评估底下、认知功能障碍及回避社交活动等。重度抑郁甚至可以出现自杀行为。随着社会生活节奏的加快及慢性压力的增加,抑郁症的发病率呈现上升趋势。据世界卫生组织统计,抑郁症已成为世界第四大疾病,至2030年将可能成为世界第一疾病负担。目前针对抑郁的药物治疗主要包括单胺氧化酶抑制剂、三环类抗抑郁药、5-羟色胺再摄取抑制剂及去甲肾上腺素再摄取抑制剂等。然而,这些药物大多个体差异性大、药效持续时间有限、延迟反应时间长,因此寻找新的治疗抑郁症的新靶点意义重大。
除了环境因素的影响,免疫炎症、遗传因素均导致抑郁的发生,这些因素决定了个体对情感障碍的相对易感性。研究显示抑郁症的易感性35-40%受基因影响,组蛋白及dna的修饰均与应激相关的抑郁症状相关。微小rna(micrornas,mirnas)是一类非编码单链rna。它们能够通过绑定至靶基因的3’非翻译区,抑制其靶基因的翻译或诱导对应的mrna降解,进而调控着基因的表达。越来越多研究表明mirna能够影响脑神经活性相关基因的表达,进而在抑郁症的发生发展中起重要作用。例如抑郁模型大鼠脑内mirna-134表达量升高,进而使区域蛋白激酶家族1、树突棘素、cofilin蛋白表达减少;抑制抑郁大鼠模型脑内mirna-134的表达,可使区域蛋白激酶家族1、树突棘素、cofilin蛋白表达量增加,进而增加了树突棘及突触的数目,改善抑郁样行为;抑制大鼠杏仁核mir-30c-5p及mir-3963可以通过结合mrna并抑制其翻译,进而抑制谷氨酸信号通路、环鸟苷酸-蛋白激酶k信号通路发挥抗抑郁效应。目前已有大量研究发现mirna与抑郁症相关,这些mirna有望成为治疗抑郁症的靶点。
技术实现要素:
针对现有技术中对mirna与抑郁症之间的研究,本发明提供一种mirna在制备抗抑郁药物中的应用。具体技术方案如下:
本发明提供了mirna-98-5p在制备抗抑郁药物中的应用。
mirna-98-5p的序列为:人源:5’-ugagguaguaaguuguauuguu-3’(seqidno:1);鼠源:5’-ugagguaguaaguuguauuguu-3’(seqidno:2)。
本发明提供了一种促进mirna-98-5p表达或增强mirna-98-5p功能的试剂在制备抗抑郁药物中的应用。促进mirna-98-5p表达或增强mirna-98-5p功能的试剂包括蛋白、寡核苷酸、小分子化合物。
上述试剂包括:mirna-98-5p的模拟物、mirna-98-5p的前体、mirna-98-5p的激动剂、携带mirna-98-5p的载体。
根据mirna-98-5p序列设计出它的模拟物或激动剂,mirna-98-5p的模拟物是化学合成的小rna,mirna-98-5p的激动剂是经过特殊标记和化学修饰的双链小rna,将mirna-98-5p模拟物或者激动剂转移到人体内后,它们能够明显上调mirna-98-5p的表达。
本发明的治疗抗抑郁的药物还包含药物学上可以接受的载体,所述载体包括但不限于:稀释剂、缓冲剂、混悬剂、乳剂、颗粒剂、包囊剂、赋形剂、填充剂、粘合剂、喷雾剂、透皮吸收剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、着色剂、矫味剂或吸附载体。
所述药物可以制成包括但不限于显微注射剂、适于转染的剂型、注射液、片剂、粉剂、粒剂、胶囊剂。上述各种剂型的药物均可以按照药学领域的常规方法制备。
所述药物可以单独施用或者与其他能够抗抑郁的药物进行组合施用。
所述药物可以离体施用:将mirna-98-5p的模拟物、mirna-98-5p的激动剂、mirna-98-5p的前体或者mirna-98-5p的表达载体在体外导入或转染人体自身或异体细胞(或异种细胞),经体外细胞扩增后,输回人体。
所述药物可以体内施用:将mirna-98-5p的模拟物、mirna-98-5p的激动剂、mirna-98-5p的前体或者mirna-98-5p的表达载体直接导入体内。这种载体可以是病毒型或非病毒性,甚至是裸dna或rna。
本发明的核酸分子可以是rna、dna、pna、lna的形式。
本发明提供了上面所述的试剂在制备治疗抗抑郁药物中的应用。
应当知道,本发明的mirna-98-5p包括组成型核酸分子的功能等同物,即变体,其显示完整mirna-98-5p核酸分子相同的功能,它们可能通过核苷酸残基的缺失、置换或者插入而突变。
本领域人员熟知,为了保证mirna的稳定性,可以在mirna的一端或者两端增加保护性碱基,如tt,也可对mirna碱基进行修饰,但是不影响mirna的功能。因此,本领域技术人员熟知,在不影响mirna-98-5p功能的条件下,对mirna-98-5p进行碱基修饰或者在两端增加碱基获得的序列同样包含在本发明的保护范围之内。
本发明的mirna-98-5p可以是天然的或是人工合成的,或者使用可以表达mirna-98-5p的dna片段的载体转染细胞获得。所述载体包括病毒载体、真核表达载体。
病毒载体可以是任何适当的载体,包括但不限于逆转录病毒载体、腺病毒载体、腺病毒相关病毒载体、疱疹病毒(例如单纯疱疹病毒、痘苗病毒及eb病毒)载体、甲病毒载体。
本发明通过affymetrixmirna表达谱基因芯片分析在前期建立的慢性社会挫败应激(chronicsocialdefeatstress,csds)模型的抑郁易感组小鼠与抑郁非易感组小鼠中筛选出差异表达的mirnas,其中mirna-98-5p在抑郁易感组中的表达相比于非易感组明显降低。提示其可能与抑郁的发生发展有关,有望成为抗抑郁治疗的靶标之一。
为了证实mirna-98-5p在抑郁中的确切作用,申请人在建立的csds抑郁易感组小鼠中通过qrt-pcr的方法进一步证明了抑郁易感组小鼠的海马及前额皮质中mirna-98-5p的表达较对照组显著降低,且经氯胺酮治疗改善抑郁症状的易感组小鼠的海马及前额皮质中mirna-98-5p的表达较未治疗的易感组小鼠明显增高。
在此基础上,申请人通过给易感组小鼠尾静脉注射mirna-98-5p激动剂(agomir)方法,特异的上调小鼠海马及前额皮质mirna-98-5p的表达,小鼠社会行为学实验指标显示上调海马及前额皮质mirna-98-5p的表达可以改善抑郁易感组小鼠的抑郁症状。
进一步,本发明人采用化学合成的mirna-98-5p抑制物(inhibitor)转染易感组小鼠,特异的抑制mirna-98-5p的表达。通过社会行为学实验发现,抑制mirna-98-5p后,氯胺酮无法改善抑郁易感组小鼠的抑郁症状。
本发明中,申请人运用spss及r语言对结果进行统计分析。计量资料采用t检验及方差分析进行统计分析;p<0.05视为有统计学意义。柱状图由graphpad作图软件完成,热图由r语言软件完成。
有益效果:本发明提供的mirna-98-5p能够制备抗抑郁药物,通过促进mirna-98-5p的表达和活性,在一定程度上可以减轻抑郁症状。上述研究结果为抑郁症的发生提供了新的病理生理学机制,并为抗抑郁药物靶向治疗提供了新的靶点。
附图说明
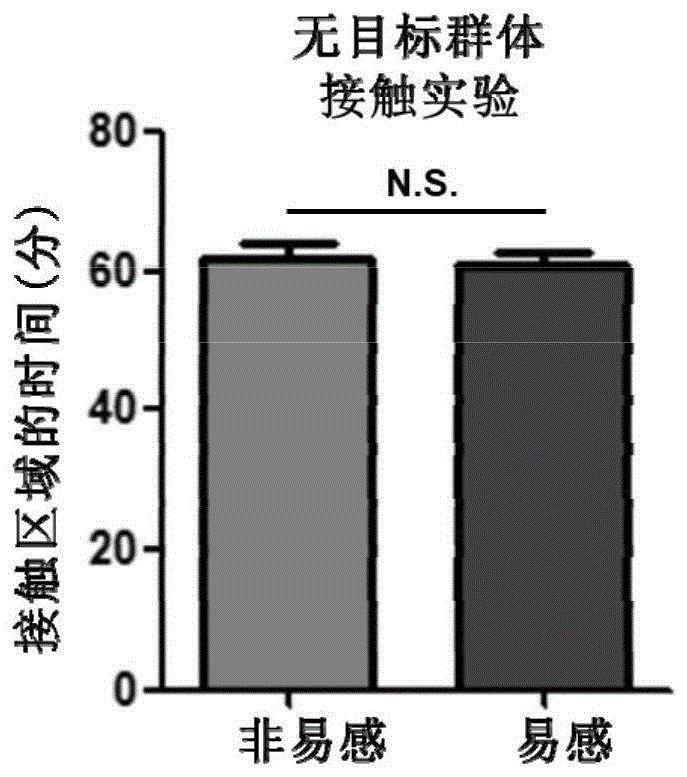
图1为易感组小鼠与非易感组小鼠无目标群体接触实验的柱状图;
图2为易感组小鼠与非易感组小鼠有目标群体接触实验的柱状图;*p<0.05,与非易感组比较有统计学意义;
图3为易感组小鼠与非易感组小鼠强迫游泳实验的移动距离的柱状图;
图4为易感组小鼠与非易感组小鼠强迫游泳实验的不懂时间的柱状图;*p<0.05,与非易感组比较有统计学意义;
图5为易感组小鼠与非易感组小鼠糖水偏好实验的柱状图;*p<0.05,与非易感组比较有统计学意义;
图6为易感组小鼠与非易感组小鼠前额皮质的micrna表达量的柱状图;*p<0.05,与非易感组比较有统计学意义;
图7为易感组小鼠与非易感组小鼠相对micrna含量的柱状图;
图8为上调抑郁易感组小鼠mirna-98-5p后,小鼠海马及前额皮质的相关mirna表达量与对照易感组的差异;显示易感组鼠注射mirna-98-5p腺相关病毒转染后,鼠海马及前额皮质mirna-98-5p的表达量增多;*p<0.05,与对照组比较有统计学意义;
图9为易感组鼠的强迫游泳实验的移动距离的柱状图;
图10为易感组鼠的强迫游泳实验的不动时间的柱状图;*p<0.05,与对照组比较有统计学意义;
图11为易感组鼠的糖水偏好实验的柱状图;*p<0.05,与对照组比较有统计学意义;
图12为氯胺酮干预、生理盐水干预的抑郁易感组鼠与非易感组鼠的强迫游泳实验的移动距离的柱状图;
图13为氯胺酮干预、生理盐水干预的抑郁易感组鼠与非易感组鼠的强迫游泳实验的不动时间的柱状图;*p<0.05,与对照组比较有统计学意义;
图14为氯胺酮干预、生理盐水干预的抑郁易感组鼠与非易感组鼠的糖水偏好实验的柱状图;*p<0.05,与对照组比较有统计学意义;
图15为氯胺酮干预、生理盐水干预的抑郁易感组鼠与非易感组鼠之间的海马及额皮质相关mirna的差异;显示氯胺酮干预的抑郁易感组鼠的海马及前额皮质mirna-98-5p表达量增多。*p<0.05,与生理盐水干预组比较有统计学意义;
图16为易感组小鼠经抑制或非抑制mirna-98-5p后经氯胺酮或经生理盐水干预的强迫游泳实验的移动距离的柱状图;
图17为易感组小鼠经抑制或非抑制mirna-98-5p后经氯胺酮或经生理盐水干预的强迫游泳实验的不动时间的柱状图;***p<0.05,与对照组比较有统计学意义;
图18为感组小鼠经抑制或非抑制mirna-98-5p后经氯胺酮或经生理盐水干预的强迫游泳实验的糖水偏好实验的柱状图;***p<0.05与对照组比较有统计学意义。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
实施例1:
慢性社会挫败应激模型抑郁易感组小鼠及非易感组小鼠社会行为学实验的差异
1.1实验动物
选取雄性c57bl/6j小鼠(c57小鼠,19-23g,6-9周龄)和雄性cd1小鼠(6-8月龄)。建模前选取有合适攻击力的雄性cd1小鼠,饲养3-5天后开始正式的造模实验。实验前将实验前将c57小鼠随机分成两组:对照组(control)和应激组(stress)。
1.2抑郁易感组非易感组小鼠造模流程
将应激组的c57小鼠编号、称重,放入cd1小鼠笼中,cd1小鼠便开始对c57小鼠进行攻击,攻击时间5-10min不等,当c57小鼠表现出明显的恐惧行为出现身体僵直不再躲避cd1攻击的时候,将小鼠取出,放入同一个笼子的隔板另一侧,使c57小鼠和cd1小鼠之间无法进行直接的接触,但c57小鼠仍可以看到cd1小鼠并嗅到cd1小鼠散发出来的气味,接受cd1小鼠间断的恐吓行为,此为训练的第一天。第二天将c57小鼠与另一只陌生cd1小鼠接触,同上当c57小鼠表现出明显的恐惧行为时取出,并同样放置处理。以此种造模方式不间断地反复应激10天,并保持在造模期间c57小鼠和cd1小鼠有充足的水和食物供应。在造模第10天攻击结束之后,将应激的c57小鼠分笼,进行社会接触和糖水偏好的行为学测试,根据行为学结果对应激组c57小鼠的抑郁样行为进行评估,依据其行为学的结果,接受应激的小鼠被划分为易感组(susceptible)和非易感组(resilient)。
1.3社会行为学实验
1.3.1群居接触实验
群居接触实验主要用于检测动物对陌生目标探索和逃避的行为正常c57小鼠碰见陌生小鼠后,会主动与陌生小鼠接触,表现出探索行为,而经历过慢性社会挫败应激的c57小鼠,则会表现出社交恐惧与逃避的行为,因此经历过社会挫败应激的c57小鼠在一段时间范围内,其与陌生cd1小鼠的社会接触时间会显著低于正常组的社会接触时间根据这一项差异,能判断出小鼠是否出现了抑郁样行为。
具体步骤:在白色敞口箱中一面的中央区内放入一个带铁丝网的小框,将cd1小鼠放入小框中间,接受测试的c57小鼠能够隔着小方框的铁丝网与cd1小鼠接触在中央小方框区域附近的矩形区域面积认为是实验小鼠的社会接触区在实验过程中any-maze软件与红外摄像头自动跟踪并记录小鼠的运动轨迹与在各区所停留的时间,当实验结束后,软件自动分析小鼠在接触区停留的时间。以2.5min为一个测试阶段,在第一个2.5min时间内,小框内不放入cd1小鼠,即无目标(no-target)的测试。之后将c57小鼠放入测试箱子的角落,开始计时,在测试时间内软件自动识别no-target阶段c57小鼠在接触区所停留的时间,记为no-target阶段的社会接触时间。测试结束后,用30%的乙醇擦拭笼子和框部分,以消除上一次测试残留的小鼠气味,待乙醇挥发散去开始第二次的测试。第二个测试阶段也为2.5min,过程同上,记为有目标(target)阶段社会接触区时间。
根据两个不同阶段接触区所停留的时间,求出社会接触的比值,具体计算公式如下所示。社会接触比值=target阶段社会接触区时间/no-target阶段社会接触区时间通过社会接触比值对csds造模完成后的c57小鼠抑郁程度进行划分,应激后c57小鼠该比值大于或者等于1,划分为非易感组(resilient),而应激后c57小鼠该比值小于1,划分为易感组(susceptible)。
与建模后的第11天按上述步骤对小鼠进行群居接触实验。结果显示,在无目标测试中,如图1所示,易感组与非易感组无差异;在有目标测试中,如图2所示,抑郁易感组群居接触时间明显少于非易感组。
1.3.2强迫游泳实验
强迫游泳实验主要用于评估小鼠的自我评估情况。实验的装置是一只圆柱形的玻璃缸(直径10cm,高25cm),缸内水深19cm,水温25±1℃。在实验的第12天,实验开始前先将小鼠放入实验环境中适应几分钟,并打开实验环境中的红灯照明。实验开始时,将小鼠轻轻放入玻璃缸中,用摄像头记录下小鼠在水中的活动情况(摄像头与玻璃缸内的水平面在一条直线上)记录6min小鼠的游泳距离,之后记录后5min小鼠不动时间,随后统计数据分析。结果显示,如图3所示,易感组与非易感组的强迫游泳距离无差异,如图4所示,而易感组的强迫游泳不动时间明显长于非易感组。
1.3.3糖水偏好实验
喝甜味溶液可以让小鼠感到兴奋,相当于小鼠的一种快感体验,所以糖水偏嗜度实验被用于评价小鼠的快感缺失。实验的第13天,给予小鼠两瓶普通饮用水,24h后同样给予每笼1%的蔗糖水,同样适应24h,之后断水断粮3h,将准备好的一瓶普通水,一瓶1%的蔗糖水称重放入每笼中间位置,4h后称其重量,计算糖水偏嗜度值,即spt=[糖水引用量/(糖水引用量+普通水引用量)]×100%。结果显示,如图5所示,易感组糖水偏好比重明显低于非易感组。
结合上述实验结果,根据图1至图5,易感组小鼠与非易感组小鼠行为学实验指标上的差异;显示易感组小鼠有目标群居接触时间少、糖水偏好比重低、强迫游泳不动时间多,无目标接触群居接触时间、强迫游泳距离无差异。我们可知抑郁小鼠表现为强迫游泳不动时间较长,糖水偏好实验比重较小。
实施例2:
抑郁易感组小鼠及非易感组小鼠海马及前额皮质mirna表达量的差异
确定模型建立成功后,选取非易感组和第13天易感组各5只小鼠的海马及前庭皮质提取总rna进行qrt-pcr检测。为了避免偏倚以及减小误差,各组小鼠的样本均采用随机方法选取。结果发现,与非易感组相比,易感组海马mirna-98-5p表达明显减少。结合实验结果,我们可知抑郁小鼠海马中的mirna-98-5p表达量较低。
2.1试验方法
2.1.1提取rna
取c57小鼠,放入呈有75%酒精的烧杯中消毒,断头取出脑组织,放入盛有d-hanks缓冲液的培养皿中,剥除脑膜及血管,分离出前额皮质放入另一培养皿中(以上冰上操作),并用剪刀剪成约1mm3小块。将小鼠海马及前庭皮质置于干冰上研磨致均浆状。
按微量rna提取试剂盒rneasyminikit(qiagen)说明书,提取小鼠海马及前额皮质的总rna。将提取的rna溶于30μl的depc水,用nanodropnd-1000测定rna浓度,并采用琼脂糖凝胶电泳检测rna完整性,存于-80℃冰箱备用。
2.2表达谱基因芯片分析
抽提的rna通过质检后,使用mircurytmarraypowerlabelingkitcat#208032-a,exiqon)对mirna进行标记。1μg的rna加水至2μl加1μl的cipbufferandcip酶。混匀合后置于37℃反应下30min。将样品置于95℃下5min终止反应。加入3μl的labelingbuffer,1.5μl的fluorescentlabelhv3tm,2μl的labelingenzyme。在160℃下反应1h。将样品置于65℃下15min终止反应。标记完成后,按照exiqon试剂盒说明书,将样品与mircurytmlnaarrayv.l9.0芯片杂交,根据exiqon的实验方法进行。25μl的样品与25μl的杂交缓冲液混合,95℃下变性2min,然后置于冰上2min。与芯片在56℃下杂交16-20h,杂交系统为nimblegensystemsinc,madisonwi,usa。杂交完成后,使用washbufferkit清洗芯片。使用axongenepix4000b芯片扫描仪扫描芯片。
对于两个样品,利用foldchange进行差异mirnas挑选,默认foldchange≥1.5。对于两组样品,利用foldchange和p-value进行差异mirnas挑选,默认foldchange≥1.5,p-value≤0.05。
2.3实时定量pcr检测mirna水平
mirna逆转录反应:逆转录体系包括5×mirnareactionbuffermix(forrealtime)2μlmirnaprimescriptrtenzymemix0.5μlhas-mir-98-5prtprimer(5μm)0.2μl、u6rtprimer(5μm)0.2μl、totalrna(l0pg/μl—lμg/μl)lμl及6.lμldepc水。反应条件为42℃15分钟;85℃5秒。反应结束后加入20ldepc水,立即使用或置于-20℃保存。使用仪器为bio-radtloothermalcycle。逆转录引物由广州锐博生物科技公司设计和合成。
qrt-pcr扩增反应:反应体系总体积为5μl,包括sybrpremixextaq(tlirnasehplus)(2×)2.5μl、roxreferencedye(50×)0.1μl、mir-98-5ppcrforwardprimer(5μm)0.2μl、mir-98-5ppcrreverseprimer(5μm)0.2μl、u6pcrforwardprimer(5μm)0.2μl、u6pcrreverseprimer(5μm)0.2μl、dna模版1μl、depc水1μl。使用abiprism7900荧光定量pcr仪,反应条件为:95℃,30秒—95℃,5秒;60℃,34秒(40个循环)—95℃,15秒;60℃,1分钟;95℃,15秒。扩增反应正向引物和反向引物均由广州锐博生物科技公司设计和合成。
从图6-图7所示,易感组小鼠与非易感组小鼠海马及前额皮质的micrna表达量的差异;显示易感组小鼠海马mirna-98-5p表达量低。
实施例3:
上调抑郁易感组鼠海马及前额皮质mirna-98-5p的表达
如实施例1所述,实验的前10天对小鼠进行抑郁造模。于实验的第11天,随机抽取5只易感组小鼠,经尾静脉注射2天mirna-98-5pagomir,对小鼠进行mirna-98-5p转染。在实验的第13天对小鼠进行强迫游泳实验(步骤如实施例1)。于实验的第14天对小鼠性糖水偏好实验(步骤如实施例1),并处死小鼠,取出小鼠的海马及前额皮质检测mirna-98-5p的表达(步骤如实施例2)。
结果显示,经mirna-98-5pagomir转染后,易感组小鼠海马及前庭皮质的mirna-98-5p表达明显高于未转染组(图8)。
行为学实验显示,上调mirna-98-5p后,易感组鼠的强迫游泳不动时间减少、糖水偏好比重多,即说明抑郁症状好转。图9-图11为抑制或上调抑郁易感组小鼠相关mirna后,小鼠社会行为学实验指标与对照易感组鼠的差异;显示上调mirna-98-5p的表达后,易感组鼠的强迫游泳不动时间减少、糖水偏好比重多,即说明抑郁症状好转。结合实验结果,我们可知上调小鼠颅内mirna-98-5p的表达可以改善抑郁症状。
实施例4:
氯胺酮干预抑郁易感组小鼠
如实例1所述,实验的前10天对小鼠进行抑郁造模。于实验的第12日,随机抽取10只抑郁易感组小鼠,随机予其中5只尾静脉按1-2mg/kg注射盐酸氯胺酮注射液,另外5只尾静脉按1-2mg/kg注射生理盐水。分别于实验第12日及第13日进行强迫游泳实验及糖水偏好实验(步骤如实例1)。并与第13日处死小鼠,取出小鼠的海马及前额皮质检测mirna-98-5p的表达(步骤如实施例2)。
如图12-14所示,结果显示,与生理盐水干预的易感组鼠相比,氯胺酮干预的抑郁易感组小鼠强迫游泳不动时间减少、糖水偏好比重增加,强迫游泳距离无差异,即氯胺酮干预的抑郁易感组鼠抑郁症状改善。且氯胺酮干预的抑郁易感组小鼠海马及前额皮质mirna-98-5p表达量明显多于生理盐水组,如图15所示。结合研究结果,我们可知氯胺酮可以改善抑郁小鼠的抑郁症状,并伴随着颅内mirna-98-5p表达的升高。
实施例5下调氯胺酮干预的易感组鼠mirna-98-5p
如实例1所述,实验的前10天对小鼠进行抑郁造模。与实验的第11日,随机抽取20只抑郁易感组小鼠,随机予其中10只连续2天行尾静脉注射mirna-98-5p抑制物(inhibitor),下调小鼠脑组织mirna-98-5p的表达。于实验的第13天,分别在转染了mirna-98-5pinhibitor的易感组鼠及未转染的易感组鼠中随机各挑选5只,尾静脉按1-2mg/kg注射盐酸氯胺酮注射液,余下的10只尾静脉按1-2mg/kg注射生理盐水。并在实验的第13及14天分别行强迫游泳实验及糖水偏好实验。
结果显示,如图16-18所示,未抑制mirna-98-5p,抑郁易感组小鼠经氯胺酮治疗强迫游泳不动时间明显减少、糖水偏好比重明显增加,即氯胺酮可以改善抑郁针状。然而在抑制mirna-98-5p后,抑郁易感组小鼠经氯胺酮治疗强迫游泳不动时间、糖水偏好比重与生理盐水干预组无差异,即抑制mirna-98-5p后,氯胺酮无法改善抑郁易感组小鼠抑郁症状。结合研究结果,我们可知氯胺酮经mirna-98-5p的某种某未知信号发挥抗抑郁效应,而此类信号通路对于理解抑郁的发病机制意义重大,并有极大的可能性成为抗抑郁药物的新型靶点。
序列表
<110>常州市第一人民医院
<120>一种mirna在制备抗抑郁药物中的应用
<130>2019.5.28
<141>2019-06-11
<160>2
<170>siposequencelisting1.0
<210>1
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>1
ugagguaguaaguuguauuguu22
<210>2
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>2
ugagguaguaaguuguauuguu22
- 还没有人留言评论。精彩留言会获得点赞!