一种具有pH/氧化还原双重响应的灵芝多糖基结合物载药纳米粒子及其制备方法与流程
本发明涉及一种具有ph/氧化还原双重响应的灵芝多糖基结合物载药纳米粒子及其制备方法,属于生物医药和纳米医药技术领域。
背景技术:
纳米递药系统作为癌症化疗药物递送的一种重要方式得到研究者的广泛关注,但药物的非特异性释放会给正常组织带来严重的毒副作用。刺激响应性释药是纳米系统常见的一种药物递送策略,可以在患病的组织或细胞定点释放,以及在特定的病变及特定生理环境下进行相应的智能控制释放,从而改善药物在体内分布,增强治疗作用,并降低毒副反应的效果,具有广阔的应用前景。
灵芝多糖glp是一种天然高分子多糖,是灵芝最有效的成分之一,由三股单糖链构成的、具有螺旋状立体构形(三级结构)的葡聚糖,是一种大分子化合物,其分子量从数千到数十万。近年来,国内外大量的研究工作致力于灵芝多糖的提取、分离、纯化和结构验证,并且研究了灵芝多糖的抗肿瘤和增强免疫力的药理作用,但将灵芝多糖作为纳米药物载体材料的研究目前几乎没有报道。与多数天然高分子多糖相似,灵芝多糖具有良好的安全性和生物相容性,其分子结构中的大量羟基使其具有较强的亲水能力,并且可以方便的对其进行修饰,因此,灵芝多糖可作为纳米药物递送系统的亲水性载体。
研究表明,肿瘤细胞具有独特的生理微环境,具有低ph值、高温、高浓度的还原型谷胱甘肽(gsh)等特点。硼酸在弱碱性环境下会自发地与含邻二醇结构的化合物结合,形成在酸性环境下可断裂的硼酸酯键,具有ph响应性。二硫键能在还原环境(如高谷胱甘肽浓度)的刺激下还原成自由的巯基,从而导致交联胶束结构受到破坏,使胶束具有还原响应性,因此可以利用二硫键来设计制备还原响应性的纳米胶束载体。
在此基础上,本研究应用苯硼酸(pba)的ph响应和二硫键的氧化还原响应性能,设计并制备了基于灵芝多糖的双重响应纳米药物载体,并同时负载芦丁(rutin)、双氢青蒿素(dha)和10-羟基喜树碱(hcpt)三种抗癌药物增加药物的抗癌作用。迄今为止,还没有以灵芝多糖为材料的刺激-响应型纳米药物载体研究的报道。
技术实现要素:
本发明的目的是建立一种具有ph/氧化还原双重响应的灵芝多糖基结合物载药纳米粒子及其制备方法,本发明方法制备的具灵芝多糖基结合物载药纳米粒子具有良好的ph和氧化还原双重响应性能,以及良好的生物相容性。本发明制备的以灵芝多糖为材料的载药纳米粒子制备方法操作简单,没有使用表面活性剂,具有靶向性和低毒性。
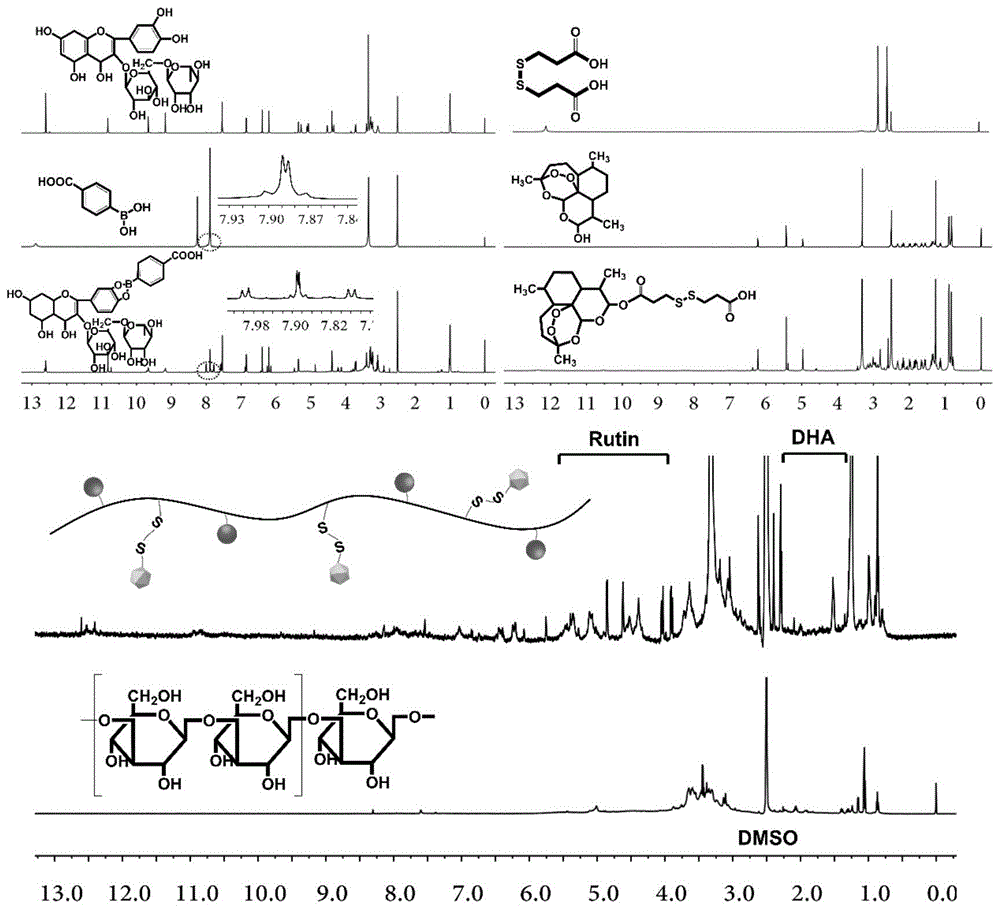
本发明提出的一种具有ph/氧化还原双重响应的灵芝多糖基结合物载药纳米粒子及其制备方法,其特征在于,所述的灵芝多糖基结合物由芦丁、苯硼酸、灵芝多糖、二硫代二丙酸和双氢青蒿素化学连接形成芦丁(rutin)-苯硼酸(pba)-灵芝多糖(glp)-二硫代二丙酸(dpa)-双氢青蒿素(dha)结合物,灵芝多糖作为亲水段,芦丁、双氢青蒿素为疏水段,芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物在水溶液中自组装包载10-羟基喜树碱以形成载药纳米粒子(rcgdd/hcpt)。
所述的芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物为式ⅰ所示的结构:
本发明的技术方案:
一种具有ph/氧化还原双重响应灵芝多糖基结合物的合成:
本发明所述的灵芝多糖基结合物纳米粒子的制备方法,包括以下步骤:
(1)将芦丁与苯硼酸化学连接形成芦丁-苯硼酸结合物,将芦丁溶于n,n-二甲基甲酰胺中,四羧基苯硼酸,于室温n2保护下反应24h;然后将反应液滴入氯仿中,析出沉淀,并用氯仿洗涤沉淀三次,真空干燥,得到芦丁-苯硼酸结合物;
(2)将二硫代二丙酸与双氢青蒿素化学连接形成二硫代二丙酸-双氢青蒿素结合物,将二硫代二丙酸溶于二甲基亚砜中,加入碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs)有机碱活化羧基3h,加入双氢青蒿素和4-二甲氨基吡啶(dmap),于室温n2保护下反应24h,反应结束后,将反应液滴入去离子水中,析出沉淀,并用去离子水反复洗涤,随后用二甲基亚砜将固体复溶,用去离子水透析48h,冷冻干燥得到二硫代二丙酸-双氢青蒿素结合物;
(3)将步骤(1)和(2)得到的芦丁-苯硼酸结合物和二硫代二丙酸-双氢青蒿素结合物与灵芝多糖反应,将苯硼酸-芦丁结合物和二硫代二丙酸-双氢青蒿素结合物分别溶解于二甲基亚砜中,加入碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs)有机碱活化羧基3h,之后将溶液混合,并加入灵芝多糖和4-二甲氨基吡啶(dmap),于室温n2保护下下反应24h,反应结束后,用去离子水透析48h,冷冻干燥得到芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物;
(4)芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物载药纳米粒子的制备,将芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物与10-羟基喜树碱(hcpt)溶于二甲基亚砜(dmso)中,然后将得到的溶液逐滴加入到高速搅拌的水溶液中自组装一段时间,再用磷酸盐缓冲液(pbs)透析3h,滤膜过滤后,冷冻干燥得到芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素/10-羟基喜树碱载药纳米粒子(rutin-pba-glp-dpa-dha/hcpt)。
本发明所述的一种具有ph/氧化还原双重响应的灵芝多糖基结合物载药纳米粒子的制备方法,其特征在于,按质量比,芦丁:苯硼酸=2:1~5:1,优选3.5:1。
本发明所述的一种具有ph/氧化还原双重响应的灵芝多糖基结合物载药纳米粒子的制备方法,其特征在于,按质量比,双氢青蒿素:二硫代二丙酸=0.5:1~2:1,优选1.4:1。
本发明所述的一种具有ph/氧化还原双重响应的灵芝多糖基结合物载药纳米粒子的制备方法,其特征在于,按质量比,芦丁-苯硼酸:二硫代二丙酸-双氢青蒿素:灵芝多糖=0.5:0.5:1~2:2:1,优选2:1.5:0.7:1。
本发明所述的一种具有ph/氧化还原双重响应的灵芝多糖基结合物载药纳米粒子的制备方法,其特征在于,按质量比,edc:nhs:dmap=2:2:1~5:5:1,优选3:2:1。
本发明制备了一种具有ph/氧化还原双重响应的灵芝多糖基结合物载药纳米粒子,基于具有良好生物相容性、抗癌作用的天然高分子灵芝多糖为药物载体,提高了抗癌药物在体内的循环时间,同时通过接入苯硼酸和二硫键,使其具有ph、氧化还原双重响应性能,可靶向作用于癌细胞,减少了药物对正常细胞的破坏。
附图说明(所取样品来源于实施事例1)
图1为芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物核磁示意图;
图2为芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素/10-羟基喜树碱纳米粒子tem示意图;
图3为芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素/10-羟基喜树碱纳米粒子在不同ph及不同浓度谷胱甘肽磷酸盐缓冲液中药物缓释示意图;
图4为纯药及芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素/10-羟基喜树碱纳米粒子对mcf-7细胞的毒性示意图;
图5为纯药及芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素/10-羟基喜树碱纳米粒子对患乳腺癌小鼠的相对肿瘤抑制率示意图;
具体实施方式
实施例1:
1.称取350mg芦丁置于10ml干燥的三口瓶中,加入5mln,n-二甲基甲酰胺dmf中,向三口瓶中持续通入n2,加入100mgapba,于室温下反应24h;待反应结束后,将反应液滴入氯仿中,析出沉淀,用氯仿洗涤沉淀三次,过滤得到固体,将固体真空干燥12h,得到芦丁-苯硼酸结合物;
2.称取100mg二硫代二丙酸溶于5mldmso中,分别加入140mg碳二亚胺(edc)和90mgn-羟基琥珀酰亚胺(nhs),于室温下活化羧基3h;加入140mg双氢青蒿素和45mg4-二甲氨基吡啶(dmap),于室温n2保护下反应24h,反应结束后,将反应液滴入去离子水中,析出沉淀,并用去离子水反复洗涤,将固体复溶于2mldmso中,用去离子水透析48h,冷冻干燥得到二硫代二丙酸-双氢青蒿素结合物;
3.称取180mg芦丁-苯硼酸结合物,溶于3mldmso中,加入72mgedc和40mgnhs,室温条件下活化羧基3h,得到溶液a;称取130mg二硫代二丙酸-双氢青蒿素结合物,溶于3mldmso中,加入78mgedc和40mgnhs,室温条件下活化羧基3h,得到溶液b;将溶液a和溶液b混合,加入90mg纯化后的灵芝多糖和50mgdmap,在n2的保护下,室温搅拌24h,反应结束后,用去离子水透析48h,冷冻干燥得到纯度95%以上的芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物;
4.称取16mg芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物与8mg10-羟基喜树碱溶于0.5mldmso中,充分溶解后,逐滴加入到3.5ml高速搅拌的ph为7.4的pbs溶液中,转速为650r/min搅拌15min;将反应液转移至3500d的透析袋中透析24h,之后冷冻干燥48h,得到载药纳米粒子。
实施例2:
1.称取300mg芦丁置于10ml干燥的三口瓶中,加入5mln,n-二甲基甲酰胺dmf中,向三口瓶中持续通入n2,加入150mgapba,于室温下反应24h;待反应结束后,将反应液滴入氯仿中,析出沉淀,用氯仿洗涤沉淀三次,过滤得到固体,将固体真空干燥12h,得到芦丁-苯硼酸结合物;
2.称取150mg二硫代二丙酸溶于5mldmso中,分别加入210mg碳二亚胺(edc)和150mgn-羟基琥珀酰亚胺(nhs),于室温下活化羧基3h;加入300mg双氢青蒿素和80mg4-二甲氨基吡啶(dmap),于室温n2保护下反应24h,反应结束后,将反应液滴入去离子水中,析出沉淀,并用去离子水反复洗涤,将固体复溶于2mldmso中,用去离子水透析48h,冷冻干燥得到二硫代二丙酸-双氢青蒿素结合物;
3.称取50mg芦丁-苯硼酸结合物,溶于3mldmso中,加入20mgedc和20mgnhs,室温条件下活化羧基3h,得到溶液a;称取45mg二硫代二丙酸-双氢青蒿素结合物,溶于3mldmso中,加入25mgedc和20mgnhs,室温条件下活化羧基3h,得到溶液b;将溶液a和溶液b混合,加入90mg纯化后的灵芝多糖和10mgdmap,在n2的保护下,室温搅拌24h,反应结束后,用去离子水透析48h,冷冻干燥得到纯度95%以上的芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物;
4.称取20mg芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物与8mg10-羟基喜树碱溶于0.5mldmso中,充分溶解后,逐滴加入到4.0ml高速搅拌的ph为7.4的pbs溶液中,转速为550r/min搅拌15min;将反应液转移至3500d的透析袋中透析24h,之后冷冻干燥48h,得到载药纳米粒子。
实施例3:
1.称取450mg芦丁置于10ml干燥的三口瓶中,加入3mln,n-二甲基甲酰胺dmf中,向三口瓶中持续通入n2,加入150mgapba,于室温下反应24h;待反应结束后,将反应液滴入氯仿中,析出沉淀,用氯仿洗涤沉淀三次,过滤得到固体,将固体真空干燥12h,得到芦丁-苯硼酸结合物;
2.称取120mg二硫代二丙酸溶于5mldmso中,分别加入170mg碳二亚胺(edc)和150mgn-羟基琥珀酰亚胺(nhs),于室温下活化羧基3h;加入120mg双氢青蒿素和90mg4-二甲氨基吡啶(dmap),于室温n2保护下反应24h,反应结束后,将反应液滴入去离子水中,析出沉淀,并用去离子水反复洗涤,将固体复溶于2mldmso中,用去离子水透析48h,冷冻干燥得到二硫代二丙酸-双氢青蒿素结合物;
3.称取100mg芦丁-苯硼酸结合物,溶于3mldmso中,加入55mgedc和40mgnhs,室温条件下活化羧基3h,得到溶液a;称取100mg二硫代二丙酸-双氢青蒿素结合物,溶于3mldmso中,加入40mgedc和35mgnhs,室温条件下活化羧基3h,得到溶液b;将溶液a和溶液b混合,加入80mg纯化后的灵芝多糖和50mgdmap,在n2的保护下,室温搅拌24h,反应结束后,用去离子水透析48h,冷冻干燥得到纯度95%以上的芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物;
4.称取15mg芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物与8mg10-羟基喜树碱溶于0.5mldmso中,充分溶解后,逐滴加入到4.0ml高速搅拌的ph为7.4的pbs溶液中,转速为550r/min搅拌15min;将反应液转移至1000d的透析袋中透析24h,之后冷冻干燥48h,得到载药纳米粒子。
实施例4:
1.称取250mg芦丁置于10ml干燥的三口瓶中,加入3mln,n-二甲基甲酰胺dmf中,向三口瓶中持续通入n2,加入150mgapba,于室温下反应24h;待反应结束后,将反应液滴入氯仿中,析出沉淀,用氯仿洗涤沉淀三次,过滤得到固体,将固体真空干燥12h,得到芦丁-苯硼酸结合物;
2.称取80mg二硫代二丙酸溶于5mldmso中,分别加入110mg碳二亚胺(edc)和100mgn-羟基琥珀酰亚胺(nhs),于室温下活化羧基3h;加入120mg双氢青蒿素和30mg4-二甲氨基吡啶(dmap),于室温n2保护下反应24h,反应结束后,将反应液滴入去离子水中,析出沉淀,并用去离子水反复洗涤,将固体复溶于2mldmso中,用去离子水透析48h,冷冻干燥得到二硫代二丙酸-双氢青蒿素结合物;
3.称取120mg芦丁-苯硼酸结合物,溶于3mldmso中,加入60mgedc和40mgnhs,室温条件下活化羧基3h,得到溶液a;称取100mg二硫代二丙酸-双氢青蒿素结合物,溶于3mldmso中,加入40mgedc和35mgnhs,室温条件下活化羧基3h,得到溶液b;将溶液a和溶液b混合,加入80mg纯化后的灵芝多糖和40mgdmap,在n2的保护下,室温搅拌24h,反应结束后,用去离子水透析48h,冷冻干燥得到纯度95%以上的芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物;
4.称取15mg芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物与6mg10-羟基喜树碱溶于0.5mldmso中,充分溶解后,逐滴加入到4.0ml高速搅拌的ph为7.4的pbs溶液中,转速为550r/min搅拌10min;将反应液转移至3500d的透析袋中透析24h,之后冷冻干燥48h,得到载药纳米粒子。
实施例5:
1.称取200mg芦丁置于10ml干燥的三口瓶中,加入3mln,n-二甲基甲酰胺dmf中,向三口瓶中持续通入n2,加入50mgapba,于室温下反应24h;待反应结束后,将反应液滴入氯仿中,析出沉淀,用氯仿洗涤沉淀三次,过滤得到固体,将固体真空干燥12h,得到芦丁-苯硼酸结合物;
2.称取150mg二硫代二丙酸溶于5mldmso中,分别加入210mg碳二亚胺(edc)和150mgn-羟基琥珀酰亚胺(nhs),于室温下活化羧基3h;加入200mg双氢青蒿素和40mg4-二甲氨基吡啶(dmap),于室温n2保护下反应24h,反应结束后,将反应液滴入去离子水中,析出沉淀,并用去离子水反复洗涤,将固体复溶于2mldmso中,用去离子水透析48h,冷冻干燥得到二硫代二丙酸-双氢青蒿素结合物;
3.称取150mg芦丁-苯硼酸结合物,溶于3mldmso中,加入80mgedc和80mgnhs,室温条件下活化羧基3h,得到溶液a;称取150mg二硫代二丙酸-双氢青蒿素结合物,溶于3mldmso中,加入60mgedc和60mgnhs,室温条件下活化羧基3h,得到溶液b;将溶液a和溶液b混合,加入80mg纯化后的灵芝多糖和50mgdmap,在n2的保护下,室温搅拌24h,反应结束后,用去离子水透析48h,冷冻干燥得到纯度95%以上的芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物;
4.称取15mg芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物与8mg10-羟基喜树碱溶于0.5mldmso中,充分溶解后,逐滴加入到4.0ml高速搅拌的ph为7.4的pbs溶液中,转速为500r/min搅拌15min;将反应液转移至3500d的透析袋中透析24h,之后冷冻干燥48h,得到载药纳米粒子。
实施例6:
1.称取350mg芦丁置于10ml干燥的三口瓶中,加入5mln,n-二甲基甲酰胺dmf中,向三口瓶中持续通入n2,加入200mgapba,于室温下反应24h;待反应结束后,将反应液滴入氯仿中,析出沉淀,用氯仿洗涤沉淀三次,过滤得到固体,将固体真空干燥12h,得到芦丁-苯硼酸结合物;
2.称取300mg二硫代二丙酸溶于5mldmso中,分别加入420mg碳二亚胺(edc)和400mgn-羟基琥珀酰亚胺(nhs),于室温下活化羧基3h;加入200mg双氢青蒿素和150mg4-二甲氨基吡啶(dmap),于室温n2保护下反应24h,反应结束后,将反应液滴入去离子水中,析出沉淀,并用去离子水反复洗涤,将固体复溶于3mldmso中,用去离子水透析48h,冷冻干燥得到二硫代二丙酸-双氢青蒿素结合物;
3.称取100mg芦丁-苯硼酸结合物,溶于3mldmso中,加入55mgedc和40mgnhs,室温条件下活化羧基3h,得到溶液a;称取100mg二硫代二丙酸-双氢青蒿素结合物,溶于3mldmso中,加入40mgedc和35mgnhs,室温条件下活化羧基3h,得到溶液b;将溶液a和溶液b混合,加入80mg纯化后的灵芝多糖和50mgdmap,在n2的保护下,室温搅拌24h,反应结束后,用去离子水透析48h,冷冻干燥得到纯度95%以上的芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物;
4.称取50mg芦丁-苯硼酸-灵芝多糖-二硫代二丙酸-双氢青蒿素结合物与20mg10-羟基喜树碱溶于1mldmso中,充分溶解后,逐滴加入到9ml高速搅拌的ph为7.4的pbs溶液中,转速为650r/min搅拌10min;将反应液转移至3500d的透析袋中透析24h,之后冷冻干燥48h,得到载药纳米粒子。
- 还没有人留言评论。精彩留言会获得点赞!