一种山荷叶提取物及其制备方法和应用与流程
本发明涉及医药领域,具体涉及一种山荷叶提取物及其制备方法和应用。
背景技术:
山荷叶(astilboidestabularis(hemsl.)engler)是虎耳草科大叶子属多年生草本植物,又名大叶子、佛伞子、大脖梗子。主要分布于我国东北地区(朝鲜半岛也有分布),生于山坡、沟谷林下,产于吉林省吉林,抚松、长白、浑江等市县。性涩、平、微苦,具有收涩、固肠、止泻等功效,常用于治疗腹泻。但是,迄今为止,从未报道过山荷叶的抗癌作用相关研究。
恶性肿瘤是危害人类生命与健康的重要疾病,已成为仅次于心脑血管疾病的全球第二大死亡原因,国际癌症研究中心(iarc)的数据显示,2012年全球恶性肿瘤新发病1410万例,并导致820万例死亡。近年来,随着人口老龄化加剧、城市化及工业化进程的加快以及居民生活环境等因素的不断变化,我国恶性肿瘤谱不断变化,对居民健康造成了严重的危害,防控形势不容乐观,国家癌症中心全国范围的研究结果显示,2015年我国新发恶性肿瘤病例429万,居民因恶性肿瘤死亡281万。在肿瘤治疗中,传统的放,化疗在杀伤肿瘤细胞的同时,也造成机体骨髓抑制和免疫功能低下,毒副作用大。天然药物无论在减轻临床症状,提高生存质量,防止复发转移,延长生存期,还是在与放化疗配合增效减毒方面都有很好的效果。
本发明人在寻找中草药抗癌活性成分的过程中,发现山荷叶提取物具有良好的抗肿瘤活性。这为后期这种植物提取物的抗癌或辅助治疗作用研究奠定了一定的基础。
技术实现要素:
本发明的目的是提供一种山荷叶提取物及其制备方法和应用。该山荷叶提取物抗癌活性好,制备工艺简单,为山荷叶在抗癌药物研究中的应用奠定了基础。
为了实现上述目的,本发明采用的技术方案如下:
一种山荷叶提取物的制备方法,包括以下步骤:取山荷叶,加甲醇溶液提取,滤过,合并滤液,回收甲醇至滤液无醇味,即得。
进一步地,包括以下步骤:取山荷叶,加甲醇溶液提取2-3次,每次加甲醇溶液的量为山荷叶原料质量的3~10倍,滤过,合并滤液,回收甲醇至滤液无醇味,即得,整个制备过程温度不超50℃。
优选地,包括以下步骤:取山荷叶,加甲醇溶液,在超声波辅助下提取3次,每次0.5~1.5小时,每次加甲醇溶液的量为山荷叶原料质量的5倍,滤过,合并滤液,回收甲醇至滤液无醇味,即得,整个制备过程温度不超50℃。
本发明中,所述甲醇溶液为质量百分比浓度为55%~95%的甲醇溶液。
本发明中,所述回收甲醇在43℃~48℃、真空度0.04~0.06mpa条件下进行。
本发明中,所述山荷叶为虎耳草科大叶子属多年生草本植物山荷叶astilboidestabularis(hemsl.)engler的干燥叶。
本发明提供了上述制备方法制备得到的山荷叶提取物。
本发明还提供了上述山荷叶提取物在制备治疗癌症药物中的应用。
本发明还提供了一种抗癌药物制剂,由有效量的上述山荷叶提取物和药学上可接受的载体组成。本领域技术人员可将所述山荷叶提取物直接或间接加入制备不同剂型时所需的药学上可接受的各种常用载体,如崩解剂、润滑剂、乳化剂、粘合剂等,以常规药物制剂方法,制成常用剂型如口服液、胶囊剂、涂剂、巴布剂、喷雾剂、注射剂、注射用冻干制剂、颗粒剂、片剂、丸剂、散剂或滴丸剂。所述制剂可以通过以下方式中的适合方式给药:口服、喷雾吸入、直肠给药、鼻腔给药、阴道给药、局部给药、非肠道给药如皮下、静脉、肌肉、腹膜内、鞘内、心室内、胸骨内或颅内注射或输入,或借助一种外植的储器用药,其中优选口服、肌注、腹膜内或静脉内用药方式。
综上所述,由于采用了上述技术方案,本发明的有益效果是:
本发明山荷叶提取物的制备工艺简单实用,制得的提取物抗癌活性好;实验结果显示:山荷叶提取物对colon205细胞抑制作用明显,为后期这种植物提取物的抗癌或辅助治疗作用研究奠定了一定的基础。
【附图说明】
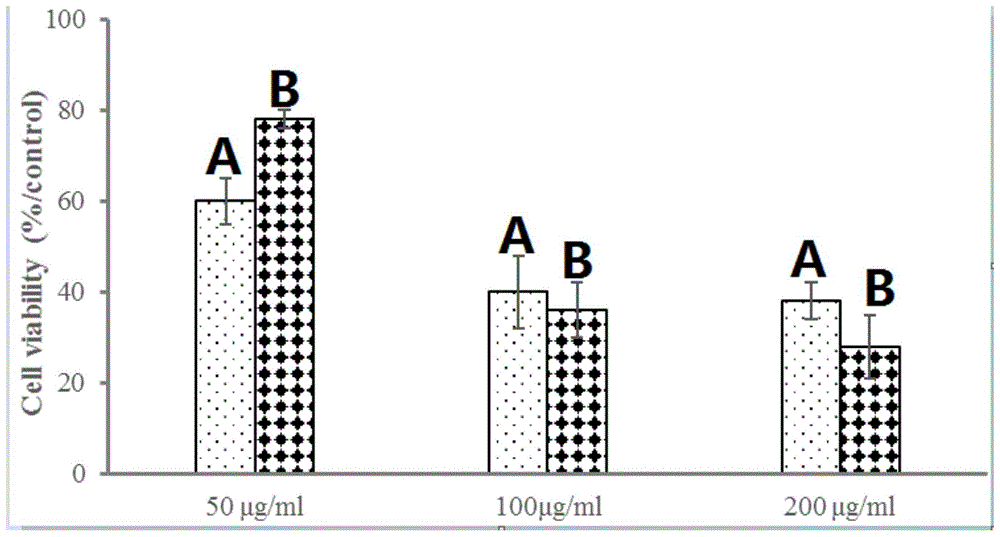
图1:实施例1制备得到的山荷叶提取物对colo205细胞生长的抑制作用。
图2:实施例2制备得到的山荷叶提取物对colo205细胞生长的抑制作用。
图3:实施例3制备得到的山荷叶提取物对colo205细胞生长的抑制作用。
a为5-fu,b为山荷叶提取物。
【具体实施方式】
实施例1山荷叶提取物的制备
(1)将干燥后山荷叶40g浸入200g质量百分比浓度为95%的甲醇溶液中40-50℃超声提取(功率550w,频率25khz)1h,滤过,滤渣中再添加200g质量百分比浓度为95%的甲醇溶液超声提取(功率550w,频率25khz)1h,滤过,滤渣中再添加200g质量百分比浓度为95%的甲醇溶液超声提取(功率550w,频率25khz)1h,滤过,合并三次滤液得到提取液;
(2)步骤(1)的提取液在43℃-48℃、真空度0.04~0.06mpa条件下减压回收甲醇至滤液无醇味,即得。
实施例2山荷叶提取物的制备
(1)将干燥后山荷叶40g浸入400g质量百分比浓度为75%的甲醇溶液中40-50℃超声提取(功率550w,频率25khz)1.5h,滤过,滤渣中再添加320g质量百分比浓度为75%的甲醇溶液超声提取(功率550w,频率25khz)1.5h,滤过,合并两次滤液得到提取液;
(2)步骤(1)的提取液在43℃-48℃、真空度0.04~0.06mpa条件下减压回收甲醇至滤液无醇味,即得。
实施例3山荷叶提取物的制备
(1)将干燥后山荷叶40g浸入320g质量百分比浓度为55%的甲醇溶液中40-50℃超声提取(功率550w,频率25khz)1h,滤过,滤渣中再添加200g质量百分比浓度为55%的甲醇溶液超声提取(功率550w,频率25khz)1h,滤过,滤渣中再添加120g质量百分比浓度为95%的甲醇溶液超声提取(功率550w,频率25khz)1h,滤过,合并三次滤液得到提取液;
(2)步骤(1)的提取液在43℃-48℃、真空度0.04~0.06mpa条件下减压回收甲醇至滤液无醇味,即得。
实施例4山荷叶提取物的体外抗癌实验
1.细胞株,试剂以及仪器
人恶性结肠癌细胞系colon205,rpmi1640培养基(美国gibico公司),胎牛血清(天津市灏阳生物制品科技有限公司),胰蛋白酶(美国sigma公司),dmso(分析纯,amresco),青霉素(sigma),链霉素(sigma),mtt(amresco),96孔板,co2培养箱(日本sanyo公司),96孔板酶标仪bio-rad680(美国bio-rad公司),生物操作台(吴江市绿岛净化设备厂)。
2.肿瘤细胞培养方法
基础培养基1640+10%fbs(胎牛血清)+1%双抗青链霉素,培养条件为37℃,5%co2浓度及饱和湿度;当细胞生长至对数期时,用胰蛋白酶消化细胞,洗涤吹散细胞,以每孔1×104个细胞100μl接种于96孔板,以备mtt实验。
3.细胞增殖实验(mtt法)
3.1将处于对数生长期的人恶性结肠癌细胞系colon205细胞,铺板于96孔板,每组设3个平行孔。实验组加入实施例1制得的不同浓度的山荷叶提取物样品。对照组加入培养液,另设空白组,分别处理24h后,采用mtt法检测癌细胞增殖抑制率,增殖抑制率(%)=(1-实验组od值/对照组od值)×100%;从图1中可以看出:低浓度山荷叶提取物(50μg/ml)对细胞抑制增殖作用不明显,较高浓度(100μg/ml、200μg/ml)山荷叶提取物对colo205细胞有明显的抑制增殖作用,且呈量效关系,特别对colo205细胞抑制率高于阳性药物氟尿嘧啶(5-fu)。
3.2将处于对数生长期的人恶性结肠癌细胞系colon205细胞,铺板于96孔板,每组设3个平行孔。实验组加入实施例2制得的不同浓度的山荷叶提取物样品。对照组加入培养液,另设空白组,分别处理24h后,采用mtt法检测癌细胞增殖抑制率,增殖抑制率(%)=(1-实验组od值/对照组od值)×100%;从图2中可以看出:低浓度山荷叶提取物(50μg/ml)对细胞抑制增殖作用不明显,较高浓度(100μg/ml、200μg/ml)山荷叶提取物对colo205细胞有明显的抑制增殖作用,且呈量效关系,特别对colo205细胞抑制率高于阳性药物氟尿嘧啶(5-fu)。
3.3将处于对数生长期的人恶性结肠癌细胞系colon205细胞,铺板于96孔板,每组设3个平行孔。实验组加入实施例3制得的不同浓度的山荷叶提取物样品。对照组加入培养液,另设空白组,分别处理24h后,采用mtt法检测癌细胞增殖抑制率,增殖抑制率(%)=(1-实验组od值/对照组od值)×100%;从图3中可以看出:低浓度山荷叶提取物(50μg/ml)对细胞抑制增殖作用不明显,较高浓度(100μg/ml、200μg/ml)山荷叶提取物对colo205细胞有明显的抑制增殖作用,且呈量效关系,特别对colo205细胞抑制率高于阳性药物氟尿嘧啶(5-fu)。
以上结果表明本发明的山荷叶提取物具有较好的抗癌生物活性,可以用于制备抗癌制剂。
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
- 还没有人留言评论。精彩留言会获得点赞!