一种pH响应型水凝胶的制备方法及其应用与流程
本发明属于生物材料
技术领域:
,具体涉及一种ph响应型水凝胶的制备方法及其应用。
背景技术:
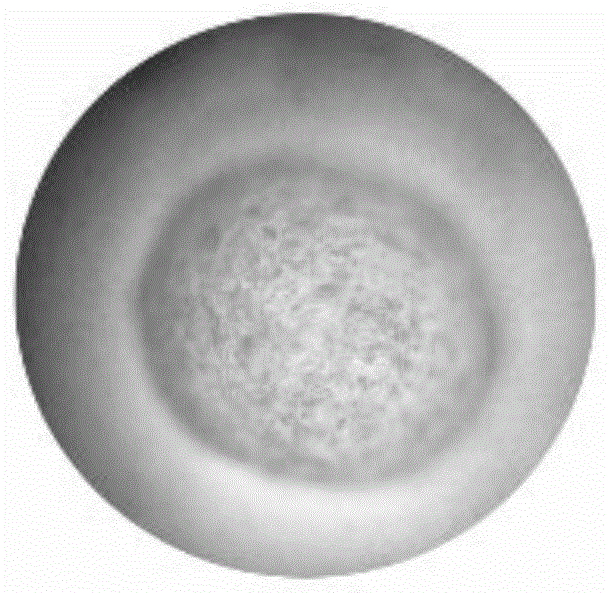
:一些生物活性药剂如蛋白质、核酸、酶等,因口服导致物质过早降解,从而影响了利用率。主要原因是口服这些生物药剂或生物制品在经过胃的极酸环境时,大部分生物活性会被破坏,到达主要吸收位置小肠的活性成分大幅降低,同时高浓度的药物或生物制品直接释放对胃肠粘膜都会造成损害。因此设计环境响应型药物释放体系,构建能智能性载体,实现药物靶向释放,成为药剂学,高分子材料科学和纳米科学的研究热点。近年来,智能水凝胶在药物的控制释放、基因传送、组织工程等领域的应用前景诱人。ph响应载体,基于胃、肠ph的显著差异,通过调节载体基质的带电性,实现ph响应。它既能保护药物稳定通过胃的强酸环境,又可降低药物对胃的副作用,靶向运输至结肠部分,通过缓释,提升其药效和作用时间,在药物递送领域具有明显的优势。技术实现要素:本发明提供了一种ph响应型水凝胶的制备方法及其应用,制备得到的水凝胶具有良好的ph响应性,所用基材具有良好的生物相容性、无毒副作用、无刺激性。该制备工艺简单易行,不使用有毒副作用的有机溶剂、催化剂或引发剂,也不需要乳化剂,故安全性高,绿色无污染,适应于工业化生产。本发明采取的技术方案为:一种ph响应型水凝胶的制备方法,所述制备方法包括以下步骤:(1)将γ-聚谷氨酸溶解在碱液中,然后加入壳聚糖混合均匀,得到混合溶液a;(2)向混合溶液中加入与其等体积的海藻酸钠溶液,搅拌均匀,得到混合溶液b;(3)向混合溶液b中滴加冰醋酸溶液,搅拌反应得到反应液c;(4)将反应液c中滴加到氯化钙溶液中,固化反应后,清洗,即可得到所述ph响应型水凝胶。步骤(1)中,所述碱液的ph为8.5~9.5,优选为9.0。所述γ-聚谷氨酸与碱液的质量体积比为1g:0.3~0.4l。步骤(1)中,所述碱液为氢氧化钠溶液。步骤(1)中,所述γ-聚谷氨酸与壳聚糖的质量比为1:6-9,优选为1:9。步骤(2)中,所述海藻酸钠溶液的质量分数为1.0~6.0%,优选为3%。步骤(3)中,所述冰醋酸溶液与混合溶液b的体积比为1:10-20,优选为1:15;所述冰醋酸溶液的体积浓度为2-8%,优选为4%。步骤(3)中,所述冰醋酸溶液的滴加速度为50μl/min;所述搅拌反应的时间为1h。步骤(4)中,所述反应液c与氯化钙溶液的体积之比为1:1.5~2.0。步骤(4)中,所述氯化钙溶液的质量浓度为1.5-2.5%,优选为2.0%,滴加速度为3ml/min,所述固化反应的时间为0.5-2h。本发明提供的制备方法所使用的原料中,γ-聚谷氨酸(γ-polyglutamicacid,γ-pga)和海藻酸钠(sodiumalginate,sa)含有大量的羧基,为天然的聚阴离子化合物;壳聚糖(chitosan,cs)含有大量的伯氨酸,为天然的聚阳离子化合物,它们通过静电吸引形成聚电解质膜从而构成γ-pga-sa/cs水凝胶,其具有较好的ph响应性,可稳定存在于体外模拟胃液6h,在体外模拟肠液中较为敏感,易溶解破裂,具有显著的ph响应性能,非常适用于靶向运输生物活性制品的载体。其包埋纳豆激酶(nattokinase,nk)的靶向运输效率达到87%,大幅降低了nk在胃液强酸环境下的损失,有效提升了nk的实际利用率。本发明公开的ph响应型水凝胶,随着固化使用的氯化钙浓度增加,其孔径更为致密。可以通过调控氯化钙浓度,实现包埋物质的缓慢释放,有效缓解高浓度物质对肠道的损伤。故本发明所制备的ph响应型水凝胶可用于包埋益生菌,调节肠道菌群平衡。本发明通过应用cs和γ-pga通过冰醋酸的作用,线型分子链之间相互交联形成三维立体结构的交联网络状大分子结构。其中,cs还有大量的氨基,γ-pga还有大量的羧基,两者通过静电作用相互结合,具有灵敏的ph响应性;在此基础上,应用sa含有大量的羟基和羧基,它不仅可以与cs静电作用,还可以与氯化钙结合形成海藻酸钙,同时具备ph响应和缓释调控的作用。因此,本发明可通过调控sa平衡水凝胶的ph响应性与缓释的平衡,进而实现包埋物质的靶向输送与缓慢释放的双功能。本发明提供的ph响应型水凝胶可作为药物的靶向运输载体,定向地将药物运输至肠液的环境中进行作用,避免了药物在胃液强酸环境下的损失,有效提升了药物的实际利用率。本发明所用的cs、sa和γ-pga都是高生物相容性和可降解性,对人体无毒副作用,所制备的水凝胶不仅具有ph响应性和缓释可控的优势,而且绿色无副作用。本方法反应温和、能耗小、设备简单、制备过程简便易行,是一种高效便捷的生产方式。因具有成本低,设备要求不高,且绿色无污染,具有巨大的发展潜力。因此,本发明具有重要的社会意义和应用推广价值。附图说明图1为实施例1制备的cs/sa/γ-pgaph响应型水凝胶的表面光学显微镜图;图2为实施例1制备的cs/sa/γ-pgaph响应型水凝胶的表面剖面光学显微镜图;图3为实施例1制备的cs/sa/γ-pgaph响应型水凝胶(a)、经胃液3h(b)、肠液2h(c)、先胃液3h再肠液1h(d)处理后的表面扫描电镜图;e-f分别为a-d的剖面扫描电镜图;图4为比较例1(a)、实施例1(b)及比较例2中当氯化钙溶液的浓度为10%时(c)制备得到的凝胶微球的剖面扫描电镜图;图5为不同浓度氯化钙对微球在胃(上)、肠(下)液中ph响应性的影响,a、b分别指ph3.0的胃液、ph7.2的肠液中放置6h,1、2、3、4、5分别代表在浓度为2%、4%、6%、8%、10%的氯化钙溶液中制备的微球;图6为比较例3、比较例4、比较例5制备的凝胶微球的光学显微镜图。具体实施方式下面结合实施例对本发明进行详细说明。实施例1一种cs/sa/γ-pgaph响应型水凝胶的制备方法,包括以下步骤:(1)将0.04gγ-聚谷氨酸溶解在15mlph为9.0的氢氧化钠溶液中,然后加入0.36g壳聚糖混合,在45℃,800rpm下搅拌均匀,得到混合溶液a;(2)向混合溶液a中加入与其等体积的3%质量浓度的海藻酸钠溶液,搅拌均匀,得到混合溶液b;(3)向混合溶液b中以50μl/min的速度滴加2ml4%体积浓度的冰醋酸溶液,搅拌反应1h得到反应液c;(4)将反应液c中以3ml/min的速度滴加到50ml2%质量浓度的氯化钙溶液中,固化反应0.5h后,用蒸馏水清洗,即可得到cs/sa/γ-pgaph响应型水凝胶。其光学显微镜图如图1、2所示,从图中可以看出本实施例制备得到的cs/sa/γ-pgaph响应型水凝胶为致密均匀的微球。本实施例得到cs/sa/γ-pgaph响应型水凝胶微球的表面及剖面的扫描电镜图分别如图3a、3e所示,从图3a、3e中可以看出该水凝胶表面较为光滑致密,内部为多孔结构。将本实施例得到的cs/sa/γ-pgaph响应型水凝胶分为三组,分别放置于ph3.0的体外模拟胃液中3h、ph7.2的体外模拟肠液中2h、先胃液中3h再肠液中1h,再将每组中未溶解的水凝胶微球以蒸馏水冲洗干净,干燥后分别测试微球表面和剖面的扫描电镜图,结果分别如图3中的b-d、f-h所示。从图3中可以看出胃液对水凝胶的结构影响不大;肠液能显著腐蚀水凝胶的表面,使其变得粗糙,内部结构孔隙增多呈网状结构;胃肠液处理呈现叠加效应。实施例2一种ph响应型水凝胶的制备方法,其他同实施例1,只是步骤(3)中,冰醋酸溶液的体积为1ml,所得水凝胶微球经测试后同实施例1一样具有良好的ph响应性。实施例3一种ph响应型水凝胶的制备方法,其他同实施例1,只是步骤(2)中,海藻酸钠溶液的质量浓度为5%,所得水凝胶微球经测试后同实施例1一样具有良好的ph响应性。比较例1其他同实施例1,只是步骤(2)中,海藻酸钠溶液的质量浓度为1%,所得微球的剖面扫描电镜图如图4a所示。比较例2其他同实施例1,只是步骤(4)中,氯化钙溶液的质量浓度分别为4%、6%、8%、10%,在氯化钙溶液的质量浓度为10%时所得微球的剖面扫描电镜图如图4c所示。从图4中可以看出,海藻酸钠浓度和钙离子浓度对水凝胶内部孔径结构影响显著,随着海藻酸钠和钙离子浓度的增加,水凝胶内部结构越致密。将实施例1和比较例2所得的各凝胶微球分别放置于ph3.0的体外模拟胃液、ph7.2的体外模拟肠液中6h,观察各凝胶微球的溶解情况,结果如图5所示。从图5可以出,实施例1和比较例2制备得到的各凝胶微球在胃液中放置6h之后均未溶解;而在ph7.2的体外模拟肠液中,实施例1制备得到的凝胶微球已基本完全溶解而且实际上其在肠液中放置3小时后已基本完全溶解,而随着凝胶微球制备过程中固化时所使用的氯化钙溶液的质量浓度的增大,凝胶微球在肠液中的溶解程度越小,说明本发明公开的技术方案制备得到的cs/sa/γ-pgaph响应型水凝胶可在肠液中定向溶解。比较例3一种明胶/海藻酸钠(gn/sa)水凝胶,其制备方法包括以下步骤:(1)用15ml的去离子水溶解0.3ggn,55℃,1500rpm搅拌30min;(2)向(1)中按体积比为1:1加入3%sa溶液,均匀混合;(3)将(2)中的反应液以3ml/min的速度滴入50ml2%的氯化钙溶液中,固化半小时后,用蒸馏水洗净,所得微球的光学显微图如图6a所示。比较例4一种壳聚糖/海藻酸钠(cs/sa)水凝胶,其制备方法包括以下步骤:(1)15mlph9.0naoh溶液溶解0.3gcs,45℃,900rpm搅拌30min;(2)以50μl/min的速度向(1)中滴加15ml4%的冰醋酸溶液,搅拌1h;(3)向(2)中按体积比为1:1加入3%sa溶液,均匀混合。(4)将(3)中的反应液以3ml/min的速度滴入50ml2%的氯化钙溶液中,固化半小时后,用蒸馏水洗净,所得微球的光学显微图如图6b所示。比较例5一种羧甲基纤维素/海藻酸钠(cmc/sa)水凝胶,其制备方法包括以下步骤:(1)用15ml的去离子水溶解0.75gcmc,65℃,1500rpm搅拌30min;(2)向(1)中按体积比为1:1加入3%sa溶液,均匀混合。(3)将(2)中的反应液以3ml/min的速度滴入50ml2%的氯化钙溶液中,固化半小时后,用蒸馏水洗净,所得微球的光学显微图如图6c所示。从图6可以看出cs/sa组成的水凝胶较gn/sa和cmc/sa组成的水凝胶结构致密。为了维持水凝胶在强酸性胃液中的结构稳定性,防止内部包含物外泄,本发明在选择cs/sa为主要组成的基础上,添加适量的γ-pga,与sa竞争的cs,通过sa与cs和钙离子反应维持ph响应与缓释之间平衡关系。结果制备的cs/sa/γ-pga水凝胶如图1、2所示,组成结构相对致密、坚实,内部结构呈中空多孔状。实施例4一种cs/sa/γ-pgaph响应型水凝胶作为药物靶向运输载体的应用cs/sa/γ-pgaph响应型水凝胶对nk的包埋,方法如下:(1)将0.04gγ-聚谷氨酸溶解在15mlph为9.0的氢氧化钠溶液中,然后加入0.36g壳聚糖混合,在45℃,800rpm下搅拌均匀,得到混合溶液a;(2)将15ml的3%质量浓度的海藻酸钠溶液与2ml52.94mg/ml的nk溶液混合,得到混合溶液b;(3)将溶液a与溶液b混匀后,向其中以50μl/min的速度滴加2ml6.6%体积浓度的冰醋酸溶液,搅拌反应1h得到反应液c;(4)将反应液c中以3ml/min的速度滴加到50ml2%质量浓度的氯化钙溶液中,固化反应0.5h后,用蒸馏水清洗,得到了包埋nk的水凝胶微球。将包埋纳豆激酶nk的水凝胶微球依次置于ph3.0的体外模拟胃液6h后和ph7.2的体外模拟肠液中6h,分别检测模拟胃、肠液中蛋白的变化,结果如表1所示。根据公式1计算nk的靶向运输效率r:r=100%*n2*(d4-d3)*v2/[n1*(d2-d1)*v1+n2*(d4-d3)*v2](1)上述公式中,r表示靶向运输效率;d1、d2、d3和d4分别表示原始胃液、浸泡包埋纳豆激酶nk的水凝胶微球6h后的胃液、原始肠液、包埋纳豆激酶nk的水凝胶微球在胃液中浸泡6h后再转移至肠液中浸泡6h后的肠液的od280nm;v1和v2分别指胃液和肠液的体积,单位为ml;n1和n2、n3分别为胃液和肠液的稀释倍数。结果显示微球包埋的nk的靶向运输效率达到了87%,大幅降低了nk在胃液强酸环境下的损失,有效提升了nk的实际利用率,表明了本发明所制备的微球载体具有很好的ph响应性,并在靶向运输生物活性制品方面具有重要的应用价值。表1浸泡前后胃、肠液a280nm的变化样本od280nm体积/ml稀释倍数原始胃液(d1)0.9182010浸泡后胃液(d2)0.9992010原始肠液(d3)0.3262010浸泡后肠液(d4)0.8692010上述参照实施例对一种ph响应型水凝胶的制备方法及其应用进行的详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1