用卤代烷基胺减少神经元细胞死亡的方法与流程
相关申请的交叉引用
本申请要求2013年9月6日提交的美国临时专利申请号61/874,865的权益,并通过对它的引用并入该临时申请的本公开内容。
技术领域
本申请涉及包含卤代烷基胺(例如,酚苄明)的药物组合物,以治疗具有创伤性脑损伤(TBI)和/或中枢神经系统中的短暂缺氧/缺血状况(condition)的受试者。这样的状况可能导致神经元细胞中的氧化性损伤、细胞凋亡或坏死。公开的药物组合物和方法减少由这些状况引起的神经元细胞损伤或死亡的发生。
背景技术:
中风在临床上被定义为血管起源的一种快速发展的综合征,其将自身表现为大脑功能的局部丧失。在更严重的情形下,大脑功能的丧失是总体性的。中风可以归类为两大类:“缺血性中风”(约87%)和“出血性中风”(约10%)。当向脑的血液供给突然中断时,发生缺血性中风。当血管位于脑破裂(其导致血液的渗漏和直接在脑组织中积累)中或周围时,发生出血性中风。另外,患者可能经历短暂缺血发作,这指示将来发展更严重发作的高危。中风也包括蛛网膜下腔出血(约3%)。中风的征状经常包括麻木或虚弱,特别是在身体的一侧上;突然的意识错乱或难以发表或理解演讲;突然的单眼或双眼的难以观看;突然的难以行走;头晕;或平衡或协调的丧失。尽管最近在理解中风机制方面有进展,中风管理仍然不是最佳的。
中风是世界上第三大死亡原因,仅在心脏病和癌症之后。仅在美国,每年大约780,000人经历中风。在美国中风的花费超过430亿美元,包括直接和间接花费。直接花费占总量的约60%,且包括住院期、医师的费用和康复。这些花费通常在前3个月达到15,000美元/患者;但是,在大约10%的病例中,花费超过35,000美元。间接花费占剩余部分,且包括中风受害者的生产力损失和家族成员护理人员的生产力损失(National Institute of Neurological Disorders and Stroke,National Institutes of Health,Bethesda,Md.)。
中风的风险随着年龄增加。55岁以后,患中风的风险每十年倍增,大约40%的个体在他们的八十几岁患上中风。并且,患第二次中风的风险随时间增加。在第一次中风以后5年,患第二次中风的风险是25-40%。随着生育高峰一代的年龄,中风事件的总数反映为大幅增加。并且由于群体中超过65岁的部分随着生育高峰达到他们的黄金年龄而增加,中风相关的治疗的市场大小将大幅增加。并且,对有效治疗的需求将急剧增加。
创伤性脑损伤(TBI)经常由运动或娱乐相关的损伤造成,它在美国是一个国家健康担忧。基于CDC和美国医院急诊科统计,据估计每年有110万人寻求TBI的住院治疗(CDC:MMWR Weekly.Nonfatal Traumatic Brain Injuries from Sports and Recreation Activities,2007年7月27日;56(29);733-737)。运动和娱乐相关的TBI损伤的最高比例与10-14岁之间的男性和女性有关。TBI也常见于军事情形中,此时脑损伤可能源自例如直接撞击、穿透物体(诸如子弹和榴霰弹)和由爆炸造成的冲击波。
急性脑炎症最经常涉及TBI,并且大多数TBI被归类为轻度的。但是,即使轻度的TBI也可以影响人的返回学校或工作的能力,且可以导致长期认知问题或其它问题。另外,重复的和/或严重TBI可以导致身体问题、认知问题、行为问题或情绪问题,并导致各种长期的、消极的健康效应,诸如记忆丧失、行为变化和增加的抑郁症风险。所以,预防措施对于TBI而言是合乎需要的。特别关心的是用于减少由TBI诱导的神经病理学的第一期或第二期的有效治疗的缺乏。
由于TBI代表异源损伤,已经证实新颖神经保护剂的开发是困难的。尽管显然在中风和TBI之间存在显著差异,导致神经病理学的机制存在相似性。两种损伤都会诱导炎症、活性氧(ROS)、活性氮(RNS)、兴奋性中毒、钙调节异常和细胞凋亡的发展。TBI还会导致受剪切力的血管,从而导致受损的血流量和缺血。
对这样的治疗存在迫切需要:其在发生短暂缺氧和/或缺血状况之后在神经元损伤发生之前阻止神经元损伤,并和实际上提供神经元保护。本文中公开了预防性的方法和药物组合物,其在发生之前抑制或减少神经元细胞中的损伤和死亡,而不是在此后治疗损伤来促进恢复。
技术实现要素:
本发明涉及用卤代烷基胺治疗中枢神经系统中的短暂缺氧和/或缺血状况。在一个实施方案中,本发明提供了一种治疗中枢神经系统中的短暂缺氧和/或缺血状况的方法,所述方法包括给有此需要的受试者施用治疗有效量的卤代烷基胺,例如,酚苄明或二苄明(dibenamine)。在一个方面,卤代烷基胺的施用减少由短暂缺氧和/或缺血状况或由TBI事件造成的例如在受试者的纹状体、海马或皮质中的神经元脑细胞死亡的发生。在另一个实施方案中,本发明提供了一种减少中枢神经系统中的神经元细胞死亡的发生的方法。所述方法通常由给有此需要的受试者施用药物组合物组成,所述药物组合物包含治疗有效量的卤代烷基胺作为活性成分中的至少一种。
短暂缺氧和/或缺血状况经常由低血压、失血、心脏病发作、创伤性脑损伤(TBI)、脊髓损伤(SCI)、勒颈窒息(strangulation)、外科手术、中风、脊髓梗塞、缺血性视神经病、气道阻塞或新生儿缺氧或缺血造成。但是,所述状况可以由许多病症造成,所述病症可以更一般地分组为造成中枢神经系统中的神经元细胞损伤或死亡(由于在短暂时间段内到达神经元细胞的氧和/或葡萄糖的缺乏)的病症。
在另一个实施方案中,本发明涉及一种治疗由TBI事件造成的中枢神经系统中的短暂缺氧和/或缺血状况的方法,所述方法包括给有此需要的受试者施用治疗有效量的卤代烷基胺。TBI事件包括,例如,急性颈部扭伤、爆炸波冲击和钝力创伤,其中所述事件具有足以造成神经元细胞损伤或死亡的力。
在一个实施方案中,所述卤代烷基胺作为活性成分与药学上可接受的载体一起施用。所述卤代烷基胺可以与一种或多种额外的活性成分一起施用。所述卤代烷基胺还可以是在延长释放制剂中。
在本发明的方法的一个方面,所述卤代烷基胺是呈约0.5mg/kg体重至约5、10或20mg/kg体重的单元剂量。在另一个方面,在短暂缺氧和/或缺血状况发作或所述状况的原因发作(例如,低血压、失血、心脏病发作、TBI事件、SCI事件、勒颈窒息、外科手术、中风、脊髓梗塞、缺血性视神经病、气道阻塞或新生儿缺氧或缺血发作)以后24、18、16、14、12、10、8、6、4或2小时内施用所述卤代烷基胺。所述卤代烷基胺可以经由静脉内注射来施用。
在某些实施方案中,本发明涉及一种用于治疗中枢神经系统中的短暂缺氧和/或缺血状况的药物组合物,其中所述组合物包含卤代烷基胺作为活性成分。在一个方面,所述药物组合物是用于治疗由TBI事件造成的中枢神经系统中的短暂缺氧和/或缺血状况。在另一个方面,所述药物组合物减少受试者中神经元细胞死亡的发生。例如,所述药物组合物减少受试者的纹状体、海马或皮质的神经元细胞中的神经元细胞死亡的发生。在另一个实施方案中,本发明涉及一种用于减少中枢神经系统中的神经元细胞死亡的发生的药物组合物。在一个方面,神经元细胞死亡由短暂缺氧和/或缺血状况造成。在另一个方面,神经元细胞死亡由TBI事件造成。
在一个特定实施方案中,所述卤代烷基胺是酚苄明、二苄明或它们的组合。所述药物组合物可以包含约0.5mg/kg体重至约5、10、15或20mg/kg体重的单元剂量的卤代烷基胺,例如,酚苄明。所述药物组合物可以进一步包含药学上可接受的载体。它还可以呈延长释放制剂的形式。
在优选的实施方案中,在短暂缺氧和/或缺血状况发作或所述状况的原因发作(例如,低血压、失血、心脏病发作、TBI事件、SCI事件、勒颈窒息、外科手术、中风、脊髓梗塞、缺血性视神经病、气道阻塞或新生儿缺氧或缺血发作)以后24、18、16、14、12、10、8、6、4或2小时内施用所述药物组合物。所述药物组合物优选地经由胃肠外途径或口服途径施用,但是预见到其它途径且可以根据状况来使用。
附图说明
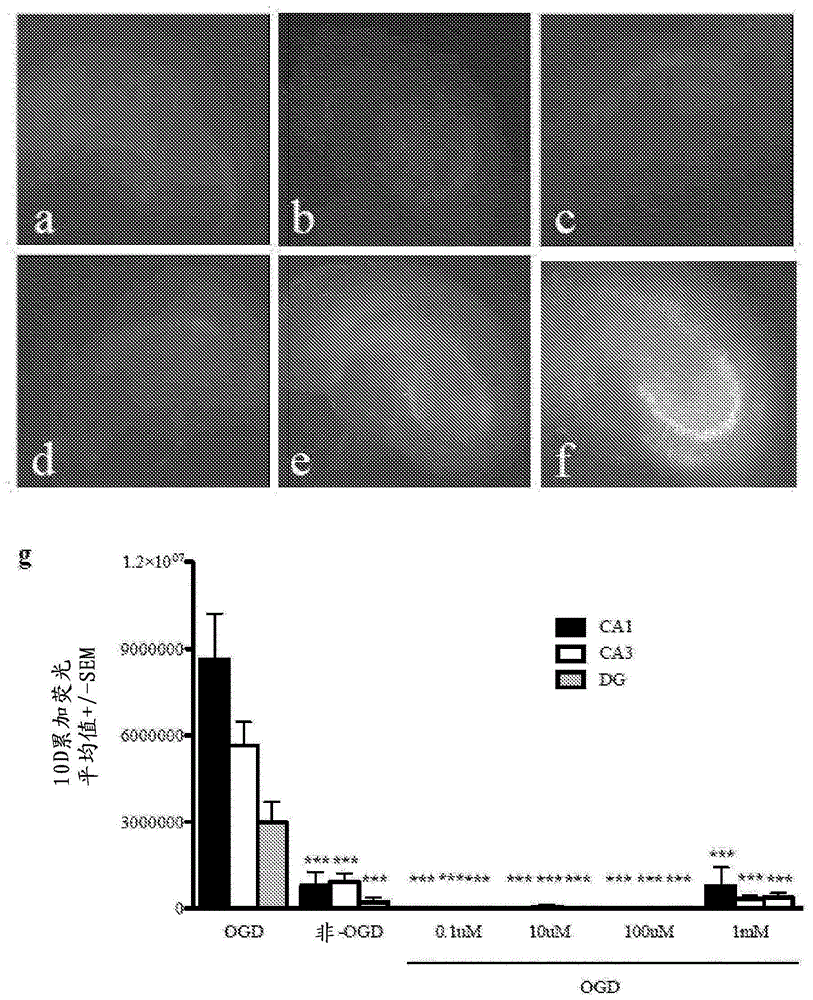
图1表明酚苄明在大鼠海马切片培养物中提供免于氧葡萄糖剥夺(oxygen glucose deprivation)的显著神经保护。显示了没有暴露于OGD的对照切片培养物(图1A)或暴露于OGD然后用0.1μM(图1B)、10μM(图1C)、100μM(图1D)、1mM(图1E)剂量的酚苄明处理或未处理(图1F)的培养物的代表性荧光图像。图1G显示了神经元损失,其呈现为CA1(黑色条)、CA3(白色条)和齿状回(DG-灰色条)内的碘化丙啶的相对荧光强度。OGD=氧葡萄糖剥夺暴露的培养物;非-OGD=没有暴露于OGD的对照培养物;***代表相对于OGD-暴露的培养物,p<0.001。
图2表明当递送直到OGD以后16小时时,酚苄明提供显著的神经保护。显示了没有暴露于OGD的对照切片培养物(图2A)或暴露于OGD然后在OGD以后2小时(图2B)、4小时(图2C)、8小时(图2D)或16小时(图2E)用酚苄明处理的培养物或没有接受药物处理的培养物(图2F)的代表性荧光图像。图2G显示了神经元损失,其呈现为CA1(黑色条)、CA3(白色条)和齿状回(DG-灰色条)内的碘化丙啶的相对荧光强度。OGD=氧葡萄糖剥夺暴露的培养物;非-OGD=没有暴露于OGD的对照培养物;***代表相对于OGD-暴露的培养物,p<0.001。
图3表明酚苄明显著地改善了行为功能。图3A描绘了神经学严重程度评分(NSS),图3B描绘了在TBI以后30天内的足误评估(foot fault assessment)。虚线代表未受伤害的动物,带菱形的线代表盐水治疗的对照,带圆圈的线代表用1mg/kg体重的酚苄明治疗的动物。*代表p<0.05,**代表p<0.01,和***代表p<0.001,都相对于盐水对照。
图4表明酚苄明显著地改善了严重TBI以后的学习和记忆。图4A显示了大鼠在莫里斯水迷宫中的潜伏时间,图4B显示了在目标象限中度过的平均时间,其用于搜索除去的逃跑平台。受损伤的盐水治疗的大鼠由带正方形的虚线表示。受损伤的酚苄明治疗的大鼠由带圆圈的虚线表示。并且假处理对照由带菱形的实线表示。*代表p<0.05,**代表p<0.01,和***代表p<0.001,都相对于盐水对照。
具体实施方式
如本文中使用的,在本说明书中和在权利要求书中使用的动词“包含”及其变体以它的非限制性含义使用,意指包括在该词语后面的项目,但是不排除没有特别提及的项目。另外,用不定冠词“a”或“an”对要素的提及不排除存在超过一个/种要素的可能性,除非上下文明显地要求有且仅有一个/种要素。不定冠词“a”或“an”因而经常是指“至少一个/种”。
本文中使用的术语“受试者”或“患者”表示任何脊椎动物,包括、但不限于,人类和其它灵长类动物(例如,黑猩猩和其它猿类和猴物种)、家畜(例如,牛、绵羊、猪、山羊和马)、家养哺乳动物(例如,狗和猫)、实验动物(例如,啮齿类动物诸如小鼠、大鼠和豚鼠)和禽类(例如,家禽、野禽和猎禽诸如鸡、火鸡和其它鹑鸡、鸭、鹅等)。在某些实现中,所述受试者可以是哺乳动物。在其它实现中,所述受试者可以是人。
术语“卤代烷基胺”在本文中用于表示卤代烷基胺α肾上腺素能阻滞剂,其包括,例如,酚苄明、二苄明和有关的卤代烷基胺及其盐。
本文中使用的“有关的卤代烷基胺”包括、但不限于与酚苄明具有结构相似性且也共享酚苄明的一些肾上腺素能相关作用的化合物。这样的化合物是本领域的技术人员已知的,例如,Iversen等人研究了共计21种卤代烷基胺衍生物(包括酚苄明)的肾上腺素能相关作用(Iversen L.L.等人,Inhibition of catecholamine uptake in the isolated heart by haloalkylamines related to phenoxybenzamine,Br.J.Pharmac,(1972)46:647-657;参见,例如,第650-651页的表1和2)。当将酚苄明或其它卤代烷基胺放在溶液中时自发地形成的化学环化产物也在本发明范围内(参见,例如,Adams和Kostenbauder,Phenoxybenzamine stability in aqueous ethanolic solutions.II.Solvent effects on kinetics,International J of Pharmaceutics,(1985)25:313-327)。在以上两篇出版物中的化合物的公开内容和它们的结构式通过引用并入本文。
本文中使用的“神经元细胞死亡”包括导致神经元细胞(例如,中枢神经系统中的神经元(nureonal)脑细胞或其它神经元细胞)的死亡的任何途径或机制。神经元细胞死亡途径或机制的非限制性例子是细胞凋亡、坏死、坏死状凋亡和兴奋性中毒。在某些方面,所述卤代烷基胺发挥神经保护作用,例如,通过预防神经元细胞损伤或死亡的发生,包括减少中枢神经系统中的神经元细胞(例如,神经元脑细胞)的氧化性损伤、细胞凋亡和/或坏死的发生。
“盐”表示从本领域众所周知的多种有机和无机抗衡离子衍生出的盐,且包括,仅作为示例,钠、钾、钙、镁、铵和四烷基铵。当所述分子含有碱性官能团时,它的盐通过添加有机酸或无机酸(诸如盐酸、氢溴酸、硫酸、硝酸、磷酸等)的酸盐而形成;或由有机酸形成,所述有机酸例如乙酸、丙酸、己酸、环戊烷丙酸、羟乙酸、丙酮酸、乳酸、丙二酸、琥珀酸、苹果酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、3-(4-羟基苯甲酰基)苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、1,2-乙烷-二磺酸、2-羟基乙磺酸、苯磺酸、4-氯苯磺酸、2-萘磺酸、草酸、4-甲苯磺酸、樟脑磺酸、甲磺酸、4-甲基二环[2.2.2]-辛-2-烯-1-甲酸、葡萄庚糖酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、月桂基硫酸、葡糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸、粘康酸等。当存在于母体化合物中的酸性质子发生以下情况时,也可以形成盐:被金属离子(例如,碱金属离子、碱土金属离子或铝离子)替换;或与有机碱(诸如乙醇胺、二乙醇胺、三乙醇胺、三甲胺、N-甲基葡萄糖胺等)配位(coordinate)。盐适合用于在受试者中施用,且具有合乎需要的药理学性能。合适的盐进一步包括在P.Heinrich Stahl,Camille G.Wermuth(编),Handbook of Pharmaceutical Salts Properties,Selection,and Use;2002中描述的那些。
本文中使用的术语“非甾体类抗炎药”和“NSAID”包括、但不限于:抑制环加氧酶的那些药剂,负责前列腺素的生物合成的酶,和某些自泌物抑制剂,包括环加氧酶的各种同工酶(包括、但不限于,环加氧酶-1和-2 aka COX-1和COX-2)的抑制剂,诸如商购可得的NSAID醋氯芬酸、阿西美辛、对乙酰氨基酚、醋氨沙洛、乙酰基-水杨酸(阿司匹林)、乙酰基-水杨-2-氨基-4-甲基吡啶-酸、5-氨基乙酰基水杨酸、阿氯芬酸、氨洛芬、氨芬酸、氨基安替比林、安吡昔康、阿尼利定、苄达酸、苯洛芬、柏莫洛芬、α-没药醇、溴芬酸、5-溴水杨酸乙酸酯、溴水杨醇、布氯酸、布替布芬、卡洛芬、塞来考昔、色甘酸盐(chromoglycate)、桂美辛、clindanac、氯吡酸、双氯芬酸钠、二氟尼柳、地他唑、屈昔康、恩芬那酸、依托度酸、依托芬那酯、联苯乙酸、芬布芬、芬克洛酸、芬度柳、非诺洛芬、芬替酸、非普地醇、flufenac、氟芬那酸、氟尼辛、氟诺洛芬、氟比洛芬、glutametacin、水杨酸乙二醇酯、异丁芬酸、布洛芬、异丁普生、吲哚美辛、吲哚洛芬、三苯唑酸、伊索克酸、伊索昔康、酮洛芬、酮咯酸、氯诺昔康(lomoxicam)、洛索洛芬、甲氯芬那酸、甲芬那酸、美洛昔康、美沙拉秦、甲嗪酸、莫苯唑酸、孟鲁司特、麦考酚酸、萘丁美酮、萘普生、尼氟酸、尼美舒利、奥沙拉秦、奥沙西罗、奥沙普秦、羟布宗、对乙酰氨基酚、帕沙米特、哌立索唑、苯基-乙酰基-水杨酸酯(phenyl-acethyl-salicylate)、保泰松、苯基水杨酸酯、吡拉唑酸(pyrazolac)、吡罗昔康、吡洛芬、普拉洛芬、丙替嗪酸、白藜芦醇、醋水杨胺、水杨酰胺、水杨酰胺-O-乙酸(salicylamide-O-acetyl acid)、水杨基硫酸、水杨苷、水杨酰胺、双水杨酯、舒林酸、舒洛芬、琥布宗(suxibutazone)、他莫昔芬、替诺昔康、茶碱、噻洛芬酸、噻拉米特、噻氯匹定(ticlopridine)、替诺立定、托芬那酸、托美丁、tropesin、联苯丁酸、希莫洛芬、扎托洛芬、佐美酸、托莫普罗(tomoxiprol)、扎鲁司特、罗非昔布和环孢菌素。另外,The Merck Manual,第16版,Merck Research Laboratories(1990)第1308-1309页以及The Pharmacological Basis of Therapeutics,第9版,Macmillan Publishing Co.,1996,第617-655页提供了NSAID的众所周知的例子。
本发明涉及以下发现:卤代烷基胺诸如酚苄明可以用于治疗中枢神经系统中的短暂缺氧/缺血状况。该治疗减少由短暂缺氧/缺血状况引起的神经元细胞损伤或死亡的发生。所述卤代烷基胺是独特的α肾上腺素能受体阻滞剂;它们与α肾上腺素能受体形成共价(不可逆)键,由此造成向被治疗的组织或器官的脉管系统的肾上腺素能传递的长期阻滞。在脉管系统中存在受体的重新合成(这似乎需要数天、数周或更久)之前,传递被阻滞。其它目前可得到的α肾上腺素能受体拮抗剂都不具有该性能。它们通过可逆的相互作用与受体作用。所以,它们的作用随着药物从体循环中清除(24小时的半衰期)而减小。卤代烷基胺的非限制性例子是酚苄明和二苄明。
在药理学上,酚苄明(Dibenzyline;Wellspring Pharmaceutical)是阻断α-1和α-2肾上腺素能受体、但是对α-1受体具有更高亲和力的卤代烷基胺。在静脉内施用以后,受体拮抗作用在大约1小时达到峰效应。酚苄明在脑中发挥长期效应,具有大约24小时的半衰期。以前的研究已经表明,逆转酚苄明的作用依赖于新受体的合成,且不依赖于药物的半衰期。Hamilton等人证实,仅50%的α-1受体已经在单次施用酚苄明以后8天恢复(J Cardiovasc Pharmacol(1983)5(5):868-873)。有利地,酚苄明的副作用是最小的:鼻塞、轻度嗜睡、视力模糊和胃部不适。
在一个实施方案中,本发明涉及通过给有此需要的受试者施用治疗有效量的卤代烷基胺来治疗中枢神经系统中的短暂缺氧和/或缺血状况的方法。所述卤代烷基胺可以是酚苄明、二苄明或有关的卤代烷基胺。由于化合物酚苄明是被称作卤代烷基胺α肾上腺素能阻滞剂的一类化合物中的一种,其它卤代烷基胺α肾上腺素能阻滞剂用于治疗中枢神经系统(CNS)中的短暂缺氧和/或缺血状况的用途也在本发明范围内。
在某些实施方案中,本发明涉及通过给需要这样的治疗的受试者施用治疗有效量的本文中公开的活性剂之一来减少由短暂缺氧和/或缺血状况造成的神经元细胞损伤或死亡的发生的方法。在其它实施方案中,本发明涉及通过给需要这样的治疗的受试者施用治疗有效量的本文中公开的活性剂之一来减少由短暂葡萄糖剥夺造成的神经元细胞损伤或死亡的发生的方法。这样的葡萄糖剥夺可以发生在遭受低血糖(例如由于糖尿病、内分泌缺乏、伴有胰岛素过度产生的病症,或某些药物治疗的消耗)的受试者中。这样的葡萄糖剥夺也可以局部地发生,例如在缺血的器官和/或细胞中。
由于神经元细胞和认知之间的关联,本发明在另一个实施方案中涉及通过给需要这样的治疗的受试者施用治疗有效量的本文中公开的活性剂之一来改善认知功能的方法。本文中使用的“认知功能”表示脑功能的任何精神组分。例如,认知功能包括、但不限于:注意力、专心、学习、记忆和集中。认知功能还可以包括运动协调。
用本发明治疗的缺氧和/或缺血状况可以由低血压、失血、心脏病发作、创伤性脑损伤(TBI)、脊髓损伤(SCI)、勒颈窒息、外科手术、中风、脊髓梗塞、缺血性视神经病、气道阻塞或新生儿缺氧或缺血中的任意一种或多种造成。在一个实施方案中,本发明提供了一种治疗由TBI事件造成的中枢神经系统中的短暂缺氧和/或缺血状况的方法。这样的治疗可以减少遭受TBI的受试者中的神经元细胞损伤或死亡的发生。在另一个实施方案中,本发明提供了一种治疗由SCI事件造成的、中枢神经系统中的短暂缺氧和/或缺血状况的方法。这样的治疗可以减少在遭受SCI的受试者中的神经元细胞损伤或死亡的发生。
如本文中定义的TBI源自任何事故、TBI事件,其中将显著量的物理力或扭转施加于个体的上躯干、颈或头,其中所述力足以造成脑中的短暂缺氧和/或缺血状况,具有造成神经元细胞损伤或死亡(诸如脑细胞死亡)的可能性。TBI事件的非限制性例子包括:集中的、封闭的头物理接触;震荡性的爆炸波能量(由直接或间接暴露于爆炸引起的脑创伤);急性颈部扭伤事件(撞击事件,其中头部具有突然地、激烈地变化的方向和速度);和开放性创伤脑损伤,其中头盖骨和硬脑膜被异物穿透。TBI事件可以进一步定义为其中个体的正常活动水平(基本功能)被撞击事件中断的任何事件。通过显示不同撞击事件(例如,爆炸、30英里/小时的汽车碰撞等)的撞击力的图表或装置,可以鉴别TBI。用于测量撞击力的装置的一个例子是由士兵(例如,可连接至头盔)或车辆的一部分负载的装置,其可以测量由爆炸波或钝力撞击造成的压力差,参见例如美国专利申请系列号12/154,166,标题为“Soft tissue impact assessment device and system”,其通过引用并入本文。
根据本发明,为了找到已经遭受TBI的受试者,不要求意识丧失。在TBI领域中的大量研究清楚地证实,TBI可以造成神经元细胞损伤或死亡,即使当所述受试者接受TBI时他或她没有丧失意识。可能发现受试者已经遭受TBI,而没有表现出神经学征状的物理呈现,这取决于物理力或扭转的来源。例如,优选地立即鉴别在战场上遭受震荡性爆炸波能量的士兵,并给其施用低剂量的卤代烷基胺。优选地给已经暴露于大量向上躯干、颈部或头部区域施加的物理力或扭转的任何个体以足以减少神经元细胞损伤或死亡的发生的量施用卤代烷基胺。
本文中使用的“脊髓损伤”或“SCI”是指其中脊髓的轴突或神经纤维被中断的损伤。中断可以由创伤力造成,其中所述创伤力压碎、压迫一个或多个椎骨、或者使一个或多个椎骨骨折、脱位。椎骨的骨折可以由损伤的震荡作用损伤脊髓(由于移位的骨片段或损伤的血管或伸出的神经根的挫伤)。脱位经常是椎间盘破裂的结果,并且它可以导致脊髓的部分的或完全的切断。当贯通伤造成脊髓的切断或部分切断时,贯通伤也可以造成脊髓损伤。创伤力也可以间接地损伤脊髓,例如,由对头部的打击或落在脚上诱发的损伤。除了来自外部物理力的中断以外,在来自创伤力的损伤以后在脊髓中和在脊髓周围的出血、肿胀、炎症可以继续中断脊髓的轴突或神经纤维。例如,硬膜外出血和脊髓硬膜下血肿可以由于对脊髓的压迫导致进行性轻截瘫。
脊髓损伤也可能在没有创伤力的情况下造成。例如,关节炎、癌症、炎症、感染或脊髓的椎间盘变性会导致脊髓的轴突和神经纤维的中断。骨髓内损伤可以是对脊髓的直接压迫或压力波在脊髓中的穿过、骨对脊髓的撕裂、或压力波在脊髓中穿过过程中血管破裂(向脊髓中出血)的结果。骨髓内出血和血肿形成还可以由减弱的血管的破裂造成。缺血性损伤可以发生在脊髓前动脉的压迫、对吻合动脉(anastornotic arteries)的压迫或对主要血管的损伤之后(Gilroy,in Basic Neurology,McGraw-Hill,Inc.New York,N.Y.(1990)。因此,SCI事件的非限制性例子是创伤力、关节炎、癌症、炎症、感染、脊髓的椎间盘变性、骨髓内损伤、骨髓内出血或血肿形成。
脊髓损伤可以分成两类:完全损伤和不完全损伤。损伤的分类可能在恢复过程中变化。完全脊髓损伤经常特征在于感觉和运动能力的丧失,且通常与由碰伤造成的脊髓损伤、流向脊髓的血液的损失或对脊髓的压迫有关。切开的和切断的脊髓是罕见的。通常,完全脊髓损伤会导致在损伤部位以下的感觉和运动的完全丧失。
不完全脊髓损伤通常不会导致在损伤部位以下的运动和感觉的完全丧失。存在多种将这样的损伤分类的模式,例如前索综合征、中心核综合征、布朗-塞卡尔综合征、对个别神经细胞的损伤和脊柱挫伤。前索综合征源自对脊髓的前区域中的运动和感觉途径的损伤。效应包括运动和总感觉的丧失,尽管可以感觉到借助于仍然完整的途径传递的有些感觉。中心核综合征源自对脊髓的颈区域的中心的损伤。所述损伤会影响皮质脊髓束,其负责运输脑和脊髓之间的信号以控制运动。遭受中心核综合征的患者会经历臂的虚弱或麻痹,并且它们也会经历感觉接受的一些丧失。在腿中的强度和感觉的丧失远远少于在臂中。许多具有中心核综合征的患者自发地恢复运动功能,并且其它患者在损伤以后的前六周经历相当大的恢复。布朗-塞卡尔综合征源自对脊髓的右侧或左侧的损伤。在身体的发生损伤的那侧上,在损伤水平线以下的运动和感觉丧失。在损伤的对侧,温度和痛觉由于脊髓中的这些途径的横断而丧失。对个别神经细胞的损伤导致受损伤的神经根对应的身体区域中的感觉和运动功能的丧失。因而,这些损伤的征状随受影响的特定神经根的位置和功能而变化。脊髓挫伤是最常见的脊髓损伤类型。在脊髓挫伤中,脊髓受伤,没有被切断,所以主要后果是损伤附近的血管的炎症和出血。脊髓挫伤可能导致暂时的(经常1-2天)不完全或完全脊髓虚弱,或不完全或完全脊髓虚弱可以是更长期,包括永久的不完全或完全脊髓虚弱。
在某些实施方案中,公开的方法另外包括鉴别需要治疗的受试者,其作为已经遭受低血压、失血、心脏病发作、TBI、SCI、勒颈窒息、外科手术、中风、脊髓梗塞、缺血性视神经病、气道阻塞或新生儿缺氧或缺血的结果。所述方法可以包括以下步骤:鉴别受试者具有短暂的缺氧/缺血状况或TBI事件,和,在所述状况发作的24小时、16小时、12小时、8小时、6小时、4小时或2小时内,给所述受试者施用足以治疗短暂缺氧和/或缺血状况或TBI的量的卤代烷基胺。在某些实施方案中,所述方法可以包括以下步骤:鉴别受试者具有短暂的缺氧/缺血状况,和,在低血压、失血、心脏病发作、TBI事件、SCI事件、勒颈窒息、外科手术、中风、脊髓梗塞、缺血性视神经病或气道阻塞发作的24小时、22小时、20小时、18小时、16小时、14小时、12小时、10小时、9小时、8小时、7小时、6小时、5小时、4小时、3小时、2小时或1小时内,给所述受试者施用足以治疗短暂缺氧和/或缺血状况的量的卤代烷基胺。
有利地,可以在TBI事件或SCI事件之后,甚至在神经元细胞损伤或死亡的神经学征状的身体表现之前,施用卤代烷基胺。甚至已经证实轻度至中度TBI事件会诱导神经学损伤,所述神经学损伤可能需要几个月才能表现为身体征状。因此,在一个实施方案中,在TBI事件或SCI事件之后尽可能快速地将卤代烷基胺施用给受试者。例如,所述方法可以包括以下步骤:鉴别受试者遭受TBI或SCI,和,在已经受到损伤的24小时、22小时、20小时、18小时、16小时、14小时、12小时、10小时、9小时、8小时、7小时、6小时、5小时、4小时、3小时、2小时或1小时内,给所述受试者施用足以治疗短暂缺氧和/或缺血状况(例如,以减少由TBI或SCI造成的神经元细胞损伤或死亡的发生)的量的卤代烷基胺。
本文中公开的剂量方案优选地也用在该具体TBI和SCI实施方案中。例如,优选的是,给具有TBI事件或SCI事件的受试者施用卤代烷基胺的步骤包括卤代烷基胺的一次或多次静脉内注射。还优选的是,施用在所述状况或事件之后尽可能快地开始。
本发明的方法通常有利地减少脑的海马、纹状体或皮质中的神经元细胞损伤的发生。在某些方面,卤代烷基胺通过减少炎症、拮抗α-1和α-2肾上腺素能受体和阻断去甲肾上腺素信号传递和/或抑制钙调蛋白(CaM)/CaMKII活性而对神经元细胞发挥神经保护作用。参见实施例4。在某些方面,本发明的方法显著地减轻神经学和认知功能障碍。
在某些实施方案中,所述卤代烷基胺与一种或多种另外的α-阻滞剂一起施用。本文中使用的“α-阻滞剂”是充当α-肾上腺素能受体的受体拮抗剂的试剂。α1-阻滞剂对α1-肾上腺素能受体起作用,且α2-阻滞剂对α2-肾上腺素能受体起作用。在某些方面,所述卤代烷基胺与非选择性的α-阻滞剂(例如,酚妥拉明、妥拉唑林、曲唑酮)、α1-阻滞剂(例如,阿夫唑嗪、哌唑嗪、多沙唑嗪、坦洛新、特拉唑嗪、西洛多新)和/或α2-阻滞剂(阿替美唑、咪唑克生、育亨宾)一起施用。
在某些实施方案中,所述卤代烷基胺与一种或多种抗炎剂诸如非甾体类抗炎药(NSAID)一起施用。当施用给遭受CNS中的短暂缺氧和/或缺血状况的受试者时,这样的组合可能产生协同神经保护作用。在一个实施方案中,所述卤代烷基胺与COX-2抑制剂一起施用。所述COX-2抑制剂可以是罗非昔布、塞来考昔、西米考昔、伐地考昔、依托考昔、帕瑞考昔、芦米考昔或双氯芬酸。
本发明也涉及用于治疗中枢神经系统中的短暂缺氧和/或缺血状况的药物组合物,其包含卤代烷基胺作为活性成分。所述短暂缺氧和/或缺血状况可以由低血压、失血、心脏病发作、TBI、SCI、勒颈窒息、外科手术、中风、脊髓梗塞、缺血性视神经病、气道阻塞或新生儿缺氧或缺血中的一种或多种造成。在某些实施方案中,所述药物组合物包含卤代烷基胺、NSAID和药学上可接受的载体。所述NSAID可以是COX-2抑制剂,例如,罗非昔布、塞来考昔、西米考昔、伐地考昔、依托考昔、帕瑞考昔、芦米考昔和双氯芬酸。
本发明的其它药物组合物包含卤代烷基胺作为用于减轻中枢神经系统中的神经元细胞死亡的发生的活性成分。神经元细胞死亡的发生可以由短暂缺氧和/或缺血状况造成。神经元细胞死亡的发生也可以由低血压、失血、心脏病发作、TBI事件、SCI事件、勒颈窒息、外科手术、中风、脊髓梗塞、缺血性视神经病、气道阻塞或新生儿缺氧或缺血中的一种或多种造成。在某些实施方案中,所述药物组合物包含卤代烷基胺、NSAID和药学上可接受的载体。所述NSAID可以是COX-2抑制剂,例如,罗非昔布、塞来考昔、西米考昔、伐地考昔、依托考昔、帕瑞考昔、芦米考昔和双氯芬酸。
酚苄明和/或有关的卤代烷基胺的药学上可接受的衍生物及其盐以及它们用于本文所述的方法中的用途也在本发明范围内。使用制药领域中的知识,可以制备这样的盐。药物组合物可以制备成各种剂型。因此,本发明的药物组合物和剂型包含本文中公开的活性成分。词语“药剂”或“神经保护剂”表示本文描述的发明的化合物或其盐。本发明的药物组合物和剂型可以进一步包含药学上可接受的载体。
在一个实施方案中,术语“药学上可接受的”是指,被联邦或州政府的管理机构批准,或在美国药典中列出,或在用于动物且更特别是人类的其它普遍公认的药典中列出。术语“载体”表示与活性成分一起施用的稀释剂、佐剂、赋形剂或媒介物。这样的药用载体可以是液体,例如水和油,包括石油、动物、植物或合成来源的那些油,诸如花生油、大豆油、矿物油、芝麻油等。所述药用载体可以是盐水、金合欢树胶、明胶、淀粉糊、滑石、角蛋白、胶态二氧化硅、脲等。另外,可以使用其它赋形剂。
本发明的单个单元剂型适合用于口服、粘膜(例如,鼻、舌下、阴道、含服或直肠)、胃肠外(例如,皮下、静脉内、快速推注、肌肉内或动脉内)或透皮施用给患者。剂型的例子包括、但不限于:片剂;囊片;胶囊剂,诸如软弹性明胶胶囊剂;扁囊剂;糖锭;锭剂;分散体;栓剂;软膏剂;泥敷剂(敷剂);糊剂;粉剂;敷料;乳膏剂;硬膏剂;溶液剂;贴剂;气雾剂(例如,鼻腔喷雾剂或吸入器);凝胶剂;适合于口腔或粘膜施用给患者的液体剂型,包括悬浮液(例如,水性或非水性液体悬浮液、水包油乳剂或油包水液体乳剂)、溶液和酏剂;适合于胃肠外施用给患者的液体剂型;和可以重构以提供适合于胃肠外施用给患者的液体剂型的无菌固体(例如,结晶固体或无定形固体)。本发明优选地经由胃肠外或口服途径施用,但是如在本文中详细讨论的预见到其它途径,并且在很大程度上取决于受试者的状况。
在某些方面,所述活性成分可以以约0.1mg/kg体重至约20mg/kg体重的单元剂量施用;例如,在约0.1mg/kg体重至约5、10、15或20mg/kg体重内的任意范围,诸如0.2mg/kg体重至约5、10或15mg/kg体重、约0.5mg/kg体重至约7.5或10mg/kg体重、约0.5mg/kg体重至约5mg/kg体重、约1mg/kg体重至约5mg/kg体重、约2.5mg/kg体重至约5mg/kg体重等。在一个实施方案中,所述活性成分以约0.5mg/kg体重至约5mg/kg体重的单元剂量施用。
在其它方面,所述活性成分可以以小于约20、15或10mg/kg体重、小于约9mg/kg体重、小于约8mg/kg体重、小于约7mg/kg体重、小于约6mg/kg体重、小于约5mg/kg体重、小于约4mg/kg体重、小于约3mg/kg体重、小于约2mg/kg体重或小于约1mg/kg体重的单元剂量施用。在一种实现中,所述活性成分以小于约5mg/kg体重的单元剂量施用。在其它方面,所述活性成分可以以约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约60mg、约70mg、约80mg、约90mg或约100mg的单元剂量施用。这些单元剂量可以每天施用一次、两次或三次。
在某些实施方案中,在中枢神经系统中的短暂缺氧和/或缺血状况发作的24小时、22小时、20小时、18小时、16小时、14小时、12小时、10小时、9小时、8小时、7小时、6小时、5小时、4小时、3小时、2小时或1小时内施用所述活性成分。在某些实施方案中,在低血压、失血、心脏病发作、TBI事件、SCI事件、勒颈窒息、外科手术、中风、脊髓梗塞、缺血性视神经病或气道阻塞发作的24小时、22小时、20小时、18小时、16小时、14小时、12小时、10小时、9小时、8小时、7小时、6小时、5小时、4小时、3小时、2小时或1小时内施用所述活性成分。在某些方面,连续地(例如通过连续静脉内输注)施用所述活性成分。
在一个实施方案中,在包含药学上可接受的载体的药物组合物中施用所述活性成分(例如,卤代烷基胺)。所述药物组合物可以是立即释放或延长释放制剂,取决于所述状况和复发的可能性。例如,用于治疗短暂缺氧状况的药物组合物可以不同于用于治疗短暂缺血状况的药物组合物。此外,用于治疗短暂缺氧和/或缺血状况的药物组合物也可以基于所述状况的原因而变化,例如如果所述状况由勒颈窒息造成(相对于如果所述状况由中风造成)。
本发明的剂型的组成、形状和类型通常随它们的施用途径和被治疗的受试者而变化。例如,与用于治疗相同疾病的口服剂型相比,胃肠外剂型可以含有更小量的它所包含的一种或多种活性成分。本领域技术人员会容易地明白这些和其它途径,其中本发明包括的具体剂型将随途径不同而变化。参见,例如,Remington's Pharmaceutical Sciences,第18版,Mack Publishing,Easton Pa.(1990)。
典型的药物组合物和剂型包含一种或多种赋形剂。合适的赋形剂是药学领域的技术人员众所周知的,且在本文中提供了合适的赋形剂的非限制性例子。特定赋形剂是否适合用于掺入药物组合物或剂型中取决于本领域众所周知的多种因素,包括、但不限于,将所述剂型施用给患者的途径。例如,口服剂型诸如片剂可以含有不适合用在胃肠外剂型中的赋形剂。特定赋形剂的适合性也可以取决于剂型中的具体活性成分。例如,有些活性成分的分解可以被有些赋形剂诸如乳糖加速,或当暴露于水时加速。
本发明进一步包括这样的药物组合物和剂型:其包含一种或多种降低活性成分的分解速度的化合物。这样的化合物(其在本文中被称作“稳定剂”)包括、但不限于:抗氧化剂诸如抗坏血酸、pH缓冲剂或盐缓冲剂。
对于特定的病症或治疗方法,使用已知方法根据经验来确定剂量,且取决于事实诸如采用的特定化合物的生物活性、施用方式、宿主的年龄、健康和体重;征状的性质和程度;治疗频率;其它治疗的施用和期望的效果。在下文中描述了多种可能的剂量和施用方法,应当理解以下内容意图仅仅是示例性的。本领域技术人员可以确定实际的剂量和施用或递送的方法。给药的频率也可以随使用的化合物和是否使用延长释放制剂而变化。但是,对于大多数障碍的治疗而言,单次剂量是优选的。
适合用于口服施用的本发明的药物组合物可以呈现为分离的剂型,例如,但不限于:片剂(例如,咀嚼片)、囊片、胶囊剂和液体(例如,矫味的糖浆)。这样的剂型含有预定量的活性成分,且可以通过本领域技术人员众所周知的药学方法来制备。通常参见Remington's Pharmaceutical Sciences,第18版,Mack Publishing,Easton Pa.(1990)。
通过根据常规药物配混技术将直接混合物中的活性成分与至少一种赋形剂组合,制备本发明的典型口服剂型。根据施用所期望的制品的形式,赋形剂可以呈多种形式。例如,适合于用在口服液或气雾剂剂型中的赋形剂包括、但不限于:水、二醇、油、醇、矫味剂、防腐剂和着色剂。适合于用在固体口服剂型(例如,粉剂、片剂、胶囊剂和囊片)中的赋形剂的例子包括、但不限于:淀粉、糖、微晶纤维素、稀释剂、造粒剂、润滑剂、粘合剂和崩解剂。
因为它们易于施用,片剂和胶囊剂代表了最有利的口服剂量单位形式,在该情况下,采用固体赋形剂。如果需要的话,可以通过标准的水性或非水性技术将片剂包衣。这样的剂型可以通过任何药学方法来制备。一般而言,如下制备药物组合物和剂型:将活性成分与液体载体、精细粉碎的固体载体或两者均匀地和亲密地混合,然后如果必要的话,将所述产品塑形成期望的外观。
例如,可以通过压制或模塑来制备片剂。可以如下制备压制的片剂:在合适的机器中压制自由流动形式(诸如粉末或颗粒)的活性成分,任选地与赋形剂混合。可以如下制备模塑的片剂:在合适的机器中模塑用惰性液体稀释剂润湿的粉末状化合物的混合物。
可以用在本发明的口服剂型中的赋形剂的例子包括、但不限于粘合剂、填充剂、崩解剂和润滑剂。适合用在药物组合物和剂型中的粘合剂包括、但不限于:玉米淀粉、马铃薯淀粉或其它淀粉、明胶、天然的和合成的树胶诸如阿拉伯胶、海藻酸钠、海藻酸、其它海藻酸盐、黄蓍胶粉末、瓜尔胶、纤维素及其衍生物(例如,乙基纤维素、醋酸纤维素、羧甲基纤维素钙、羧甲基纤维素钠)、聚乙烯吡咯烷酮、甲基纤维素、预胶化淀粉、羟丙基甲基纤维素(例如,编号2208、2906、2910)、微晶纤维素、及其混合物。
微晶纤维素的适当形式包括、但不限于:作为AVICEL-PH-101、AVICEL-PH-103 AVICEL RC-581、AVICEL-PH-105(可得自FMCCorporation,American Viscose Division,Avicel Sales,MarcusHook,Pa.)销售的物质及其混合物。一种具体的粘合剂是作为AVICEL RC-581销售的微晶纤维素和羧甲基纤维素钠的混合物。合适的无水或低湿度赋形剂或添加剂包括AVICEL-PH-103和淀粉1500LM。
适合用在本文公开的药物组合物和剂型中的填充剂的例子包括、但不限于:滑石、碳酸钙(例如,颗粒或粉末)、微晶纤维素、粉末状纤维素、葡聚糖结合剂、高岭土、甘露醇、硅酸、山梨醇、淀粉、预胶化淀粉、及其混合物。本发明的药物组合物中的粘合剂或填充剂通常占该药物组合物或剂型的约50至约99重量%。
在本发明的组合物中使用崩解剂,以提供当暴露于水性环境时崩解的片剂。包含太多崩解剂的片剂可以在贮存时崩解,而包含太少崩解剂的片剂可能不会以期望的速率或在期望的条件下崩解。因而,既不太多也不太少不利地改变活性成分的释放的足够量的崩解剂应当用于形成本发明的固体口服剂型。使用的崩解剂的量基于制剂的类型而变化,并且是本领域普通技术人员容易辨别的。典型的药物组合物包含约0.5至约15重量%的崩解剂,优选约1至约5重量%的崩解剂。
可以用在本发明的药物组合物和剂型中的崩解剂包括、但不限于:琼脂、海藻酸、碳酸钙、微晶纤维素、交联羧甲纤维素钠、交聚维酮、波拉克林钾、淀粉羟乙酸钠、马铃薯或木薯淀粉、其它淀粉、预胶化淀粉、其它淀粉、粘土、其它藻胶、其它纤维素、树胶、及其混合物。
可以用在本发明的药物组合物和剂型中的润滑剂包括、但不限于:硬脂酸钙、硬脂酸镁、矿物油、轻矿物油、甘油、山梨醇、甘露醇、聚乙二醇、其它二醇类、硬脂酸、月桂基硫酸钠、滑石、氢化植物油(例如,花生油、棉籽油、葵花籽油、芝麻油、橄榄油、玉米油和大豆油)、硬脂酸锌、油酸乙酯、月桂酸乙酯、琼脂及其混合物。额外的润滑剂包括,例如,syloid硅胶(AEROSIL 200,由W.R.Grace Co.of Baltimore,Md.制造)、合成硅的凝固气溶胶(由Degussa Co.of Plano,Tex.销售)、CAB-O-SIL(由Cabot Co.of Boston,Mass.销售的热原性二氧化硅产品)及其混合物。如果使用,通常以润滑剂所掺入的药物组合物或剂型的约1重量%以下的量使用润滑剂。
本发明的优选固体口服剂型包含活性成分、无水乳糖、微晶纤维素、聚乙烯吡咯烷酮、硬脂酸、无水胶体硅和明胶。
可以通过多种途径将胃肠外剂型施用给患者,包括、但不限于,皮下、静脉内、快速推注、肌肉内和动脉内。优选地,胃肠外剂型适合用于静脉内递送。本发明的胃肠外剂型优选地是无菌的或能够在施用给患者之前灭菌。胃肠外剂型的例子包括、但不限于:注射用溶液、准备好溶解或悬浮在药学上可接受的注射用媒介物中的干燥产品、注射用悬浮液和乳剂。
可以用于提供本发明的胃肠外剂型的合适媒介物是本领域技术人员众所周知的。例子包括、但不限于:注射用水USP;水性媒介物,例如但不限于,氯化钠注射液、林格氏注射液、右旋糖注射液、右旋糖和氯化钠注射液和加入乳酸盐的林格氏注射液;水可混溶的媒介物,例如但不限于,乙醇、聚乙二醇和聚丙二醇;和非水性媒介物,例如但不限于,玉米油、棉籽油、花生油、芝麻油、油酸乙酯、肉豆蔻酸异丙酯和苯甲酸苄酯。
以下不应解释为限制性的实施例进一步例证了本发明。贯穿本申请引用的所有参考文献、专利和公开的专利申请的内容以及附图通过引用整体并入本文用于所有目的。
实施例
对于下面提供的所有实施例,使用Prizm软件分析所有数据。为了确定高斯(正态)分布,对所有数据集执行Kolmogorof-Smirnov检验。使用不成对的、单尾T-检验(CI=95%)对含有两个组的数据集执行适当的参数分析。使用具有Tukey氏事后检验的单因素方差分析对具有超过2组的数据集执行分析,以确定组之间的统计显著性。p<0.05或更小被视为显著的。
对于需要TBI的实验,使用大鼠模型。雄性Wistar大鼠(350-500g)得自Charles River Laboratories(Wilmington,MA),并用12-小时光照/黑暗周期和随意接近食品和水进行圈养。使用如前所述的侧液叩诊(LFP)规程(Rau等人,2012,J Trauma and Acute Care Surgery 73:S165),诱导严重的TBI。简而言之,在右半球上从人字点和前囟点等距离地做5mm环钻术。以1.9-2.3大气压的压力给动物的脑施用流体脉冲持续20毫秒。所有动物经历呼吸暂停,并手工地通气直到发生正常呼吸。动物具有24分钟的平均纠正时间,并观察到25%的死亡率。在TBI后8小时,将酚苄明(1mg/kg)注射进随机选择的大鼠的尾静脉中。盐水治疗的动物接受相同的尾静脉注射规程,仅接受预温热的盐水。假手术的动物接受环钻术,但是不接受TBI。
实施例1.酚苄明预防大鼠海马切片培养物中的神经元细胞死亡-氧葡萄糖剥夺实验
海马切片培养物:
根据国立卫生研究院(National Institutes of Health)关于实验动物的照料和应用的指南(NIH公开号8023),所有实验动物规程得到University of Montana Institutional Animal Care and Use Committee批准。如以前所述(Selkirk等人,2005,Eur J Neur 21:2291),从7天龄Sprague-Dawley大鼠幼崽的脑制备海马切片培养物。培养7天以后,将切片暴露于氧-葡萄糖剥夺(OGD)。将由120mM NaCl、5mM KCl、1.25mM NaH2PO4、2mM MgSO4、2mM CaCl2、25mM NaHCO3、20mM HEPES、25mM蔗糖组成的无葡萄糖的平衡盐溶液(BSS)(pH7.3)用5%CO2/95%N2在10 L/小时鼓泡1小时。将切片在除氧的SBSS中洗涤6次以除去残余的葡萄糖,转移进除氧的SBSS中,并放在具有氧反馈传感器的37℃腔室(Pro-Ox)中保持60min,所述氧反馈传感器将气体水平维持在0.1%O2、5%CO2、94.4%氮。OGD以后,在正常氧条件下将切片立即转移回预温热的Neurobasal培养基(含有B27,不含抗氧化剂)。在OGD以后立即将在剂量-响应研究中用酚苄明处理过的切片放在预温热的含有0.1μM至1mM酚苄明的Neurobasal培养基中。对于时程研究,在OGD以后2、4、8或16小时加入100μM酚苄明。通过将切片用碘化丙啶(PI;Molecular Probes,Eugene,OR)染色并使用ImagePro Plus软件(Media Cybernetics,Silver Springs,MD)定量相对荧光强度(激发540/发射630),确定神经元损伤。在OGD之前4小时,将碘化丙啶(PI)以2μM的浓度加入培养基中(Noraberg等人,1999,Brain Research Protocols 3:278)。在OGD之前获取海马切片的图像以建立基线荧光。OGD以后,将切片放在含有2μM PI的正常培养基中,并在OGD以后24小时使用荧光光学部件用Olympus IMT-2显微镜和Hamamatsu照相机再次获取图像。使用ImagePro Plus软件(Media Cybernetics,Silver Springs,MD)确定每个切片中的总荧光强度,并将所有值表达为相对于暴露于OGD的未处理的切片的变化百分比。
结果
我们在大鼠海马切片培养物(RHSC)-OGD模型中的初步研究将酚苄明鉴别为潜在的神经保护性的候选物化合物。我们通过进行剂量响应研究在RHSC-OGD模型中进一步试验了酚苄明。酚苄明在宽剂量范围(0.1uM-1mM最终的培养基浓度)内维持CA1、CA3和齿状回中的主要神经元并产生稳健的神经保护作用(图1)。神经保护性化合物当在临床上有关的时间点(其在中风或创伤性脑损伤的情况下可以是损伤后数小时)施用时必须是有效的。因此,我们在RHSC-OGD模型中检查了酚苄明的潜在治疗窗。选择中间剂量(100μM)并在OGD后2、4、8或16小时加入培养物中。我们发现,当在OGD后2、4和8小时递送时,酚苄明阻止海马的所有区域中的由OGD引起的神经元死亡。当在OGD后16小时递送时,酚苄明仅阻止海马的CA1区域中的神经元死亡(图2)。这些数据强烈地提示,酚苄明可能充当潜在的神经保护剂。
实施例2.酚苄明治疗的TBI大鼠中的神经学严重程度评分和足误评估显著优于在未治疗的对照组中
神经学严重程度评分:
如以前所述(Rau等人,2011,Neuropharmacology 61:677;Rau等人,2012 J Trauma and Acute Care Surgery 73:S165),执行神经学严重程度评分(NSS)。在第1、7、14、21和30天由不知情的观察者进行评估。将动物进行0-16评分,其中0指示无病损,且16指示最大病损。严重TBI的评分标准是16-10,中等TBI是9-5,且轻度TBI是4-1。将在第1天具有9或更小的评分和NSS的动物鉴别为具有中等/轻度损伤并排除。
足误评估:
如以前所述(Rau等人,2011,Neuropharmacology 61:677;Rau等人,2012 J Trauma and Acute Care Surgery 73:S165),进行足误评估。简而言之,将大鼠固定在升高的网格上。对于每个负重步骤,爪子可能脱离或滑出丝网格。每次左前肢(受对右半球的损伤影响)错过丝支架上的布置,将它记录为足误。将大鼠用于跨过网格的步(每个前肢的运动)的总数计数,并记录每个前肢的足误的总数。
结果
为了检验酚苄明的治疗潜力,我们选择大鼠侧液叩诊损伤(LFP)作为严重TBI的体内模型。我们基于当前FDA批准的水平选择酚苄明的试验剂量。经常施用至多40mg多达每天3次(共120mg)的酚苄明。假定典型的成年人体重70kg,这代表1.7mg/kg体重。因此,我们选择1mg/kg体重的稍微更低的、单次静脉内剂量。在严重TBI以后8小时的临床上有关的时间点施用该剂量。基于行为结果和认知结果来确定治疗有效性。
使用神经学严重程度评分(NSS)和足误评估来检验以下假设:酚苄明治疗可以改善行为结果。在损伤以后24小时评估动物,并在TBI后第7、14、21和30天再次评估。我们发现在TBI以后24小时或7天在盐水和酚苄明治疗的动物之间不存在NSS或足误评分的显著差异。这些数据指示,两个治疗组中的所有动物经历类似严重程度的损伤。但是,酚苄明治疗的动物在第14、21和30天表现出NSS和足误评分的显著改善(图3)。值得指出的是,酚苄明治疗的大鼠在试验的第21和30天具有与未受损伤的大鼠类似的足误值。
实施例3.酚苄明治疗的TBI大鼠中的认知功能显著优于未治疗的对照组
认知功能的评估:
使用莫里斯水迷宫(MWM)来评估酚苄明对TBI以后的认知功能(学习和记忆)的影响。如以前公开的(Rau等人,2011,Neuropharmacology 61:677;Rau等人,2012 J Trauma and Acute Care Surgery 73:S165),执行评估规程。预顺应在TBI后第24天开始。训练期在损伤后第25天开始,且探查试验在损伤后第30天进行。
结果
从损伤后25天开始,使用莫里斯水迷宫(MWM)来评估认知功能。在TBI以后8小时施用酚苄明,导致在训练期的第2、3、4和5天的学习的显著改善(图4A)。令人惊奇的是,在任何训练天,酚苄明治疗的动物没有显著不同于未受损伤的假对照动物。这些数据提示,酚苄明显著地改善严重TBI以后的学习。除了学习以外,进行探查试验来评估空间记忆功能。在探查试验过程中,与盐水治疗的对照动物相比,酚苄明治疗的动物表现出显著更大的空间记忆能力(图4B)。与盐水治疗的动物(其仅花费10%的时间在目标象限中)相比,酚苄明治疗的动物花费大约28%的时间搜寻移除的逃跑平台的目标象限。如在训练期中一样,酚苄明治疗的TBI受损伤的动物没有不同于未受损伤的假对照动物,后者也花费大约25%的时间搜寻目标象限(图4B)。
实施例4.基因测定分析表明酚苄明诱导促炎症性信号传递蛋白在皮质组织中的表达
为了阐明在酚苄明介导的神经保护中涉及的可能的神经保护机制,我们执行了在损伤后32小时(治疗延迟8小时+治疗后24小时)取自动物的皮质组织的基因测定分析。选择该时间点来努力检测将影响继发性损伤的发展的可能的基因变化。我们检测到严重TBI以后促炎症信号传递蛋白CCL2(11倍,p=0.004)、IL1β(4.6倍,p=0.005)和MyD88(3倍,p=0.0001)的表达的显著增加。相反,在严重TBI以后用酚苄明治疗的大鼠不具有这些蛋白的表达的显著增加。这些数据提示,酚苄明可以通过调节神经炎症应答来介导神经保护。
在当前的研究中已经证实,酚苄明的单次静脉内施用(在TBI以后8小时递送)显著地减轻了行为和认知损害。这代表一个新发现;以前的研究没有指示酚苄明发挥神经保护作用。目前,使用酚苄明来治疗高血压和与肾上腺肿瘤(嗜铬细胞瘤)有关的过度出汗。酚苄明充当有效的α-1肾上腺素能拮抗剂(具有第二α-2拮抗作用),并从而阻断肾上腺素和去甲肾上腺素的作用。有证据表明,阻断肾上腺素和去甲肾上腺素的作用可能对TBI患者具有显著的益处。严重TBI会增加交感神经系统的活性,从而导致肾上腺素和去甲肾上腺素的过度释放(Tran等人,2008)。以前的研究指示TBI的严重程度、血浆肾上腺素和去甲肾上腺素水平与治愈率之间的直接关联(Tran等人,2008)。保持持续昏迷的患者具有比对照患者高数倍的肾上腺素和去甲肾上腺素血浆水平。此外,这些儿茶酚胺水平在昏迷状态的持续期间中保持升高。相反,已经发现具有轻微升高的初始儿茶酚胺水平的TBI患者在TBI后1周一致地改善至大于11的Glasgow Comma Scale(GCS)值。在具有多系统创伤和TBI的患者中,在损伤后48小时的血浆去甲肾上腺素水平预示在一周时的GCS、患者存活、呼吸机天数和住院期的长度,但是在没有TBI时,这些关联不存在(Woolf 1987,Hamill 1987)(Woolf 1988)。
基于这些研究,酚苄明的神经保护作用可以是阻断脑中的去甲肾上腺素信号传递的继发效应的α-1和α-2拮抗作用的直接结果。α-1肾上腺素能受体与活化磷脂酶C(PLC)的异源三聚体G蛋白Gq偶联(Strosberg,1993)。PLC造成IP3和钙的增加,这又会活化蛋白激酶C(PKC)(Strosberg,1993)。以前在TBI中的研究已经证实,PKC由于损伤而快速升高(Yang 1993)。与酚苄明有关的神经保护的另一种潜在机制是钙调蛋白(CaM)/CaMKII活性的下降。酚苄明是CaM/CaMKII活性的有效抑制剂(Cimino和Weiss,1988)。在基本条件下,CaMKII是谷氨酸信号传递的重要介质,但是,在急性损伤条件下,CaM/CaMKII会与NMDA受体的NR2B亚基相互作用,从而导致兴奋性中毒死亡(Vest等人,2010)。有证据表明,CaM/CaMKII会增加AMPA受体向细胞表面的运输,从而导致在急性损伤过程中更大的兴奋性中毒死亡。Zhang等人发现TBI会增加CaMKIIδ的表达,这支持了CaMKII的神经破坏作用。在TBI之前用CaMKIIδ抑制剂预治疗大鼠会导致损害体积的显著下降和神经运动功能的显著增加。Zhang等人继续阐明了机制,其中CaMKIIδ通过增加促细胞凋亡蛋白BAX和随后的天冬氨酸特异性半胱氨酸蛋白酶3活化而积极促进神经元中的细胞凋亡(Zhang等人,2012)。
从基因测定研究中,我们发现酚苄明似乎会阻断TBI以后发生的关键基因变化。在炎症诸如CCl2、IL-1β和MyD88中涉及的基因都在TBI动物中显著升高,但是酚苄明治疗的动物没有不同于未受损伤的对照动物。这是一项重要发现,因为炎症会促进水肿的形成、神经元的丧失,并不利地影响患者恢复。脑炎症的一种关键组分是对神经元有毒的嗜中性粒细胞和单核细胞的募集(Semple等人,2010)。单核细胞向脑中的募集主要由单核细胞趋化蛋白1(MCP-1)(或者称作CCl2)控制,所述趋化蛋白1由星形胶质细胞、巨噬细胞和反应性小胶质细胞表达。TBI以后,CCl2积极地将单核细胞募集至脑损伤区域,从而导致炎症、水肿和神经元损伤(Ziebell和Morganti-Kossmann,2012)。Rhodes等人(2009)发现了严重TBI以后人脊髓液中的CCl2的快速增加。此外,CCl2水平保持显著升高直到损伤后10天。Rhodes等人,(2009)也报道称,在TBI以后死亡的患者的血清中检测到增加的CCl2水平。
上皮细胞响应于促炎性细胞因子白介素-1β(IL-1β)而积极地合成CCl2(Prodjosudjadi等人,1995)。从我们的基因测定分析,我们发现,盐水治疗的动物在TBI以后具有IL-1β的显著增加,而酚苄明治疗的动物不会具有显著增加。就TBI而言,IL-1β是小胶质细胞的主要活化剂,并且直接地负责诱导炎症。IL-1β会通过增强NMDA受体和肿瘤坏死因子α(TNF-α)的敏感性而进一步促进免疫兴奋毒性,从而导致增加的脑炎症和兴奋性中毒(Arand等人,2001;Block等人,2007;Brown和Neher,2010)。
酚苄明可能通过减少骨髓细胞样分化主要应答蛋白88(Myd88)的表达而进一步减轻创伤后炎症。Myd88是一种参与Toll-样受体和促炎细胞因子信号转导的关键衔接蛋白(Li等人,2011;Ling等人,2013)。在盐水治疗的TBI动物中,Myd88与未受损伤的对照动物相比显著地上调。但是,在酚苄明治疗的TBI以后的大鼠中,MyD88表达水平等同于未受损伤的对照大鼠。在机械学上,Myd88是Toll-样受体、细胞因子和核因子κB(NF-κB)的关键衔接蛋白(Li等人,2011;Janssens和Beyaert,2002)。以前的研究提示,Toll-样受体的活化会导致Myd88的募集和随后的NF-κB的活化,这又会诱导促炎症分子(包括肿瘤坏死因子a(TNF-α)、IL-1β、白介素-6(IL-6)和细胞内粘附分子-1(ICAM-1))的快速表达,从而导致促炎症应答(Janssens和Beyaert,2002;Kenny和O’Neill,2008)。
除非另外定义,否则所有技术和科学术语在本文中具有与本发明所属领域的普通技术人员通常理解相同的含义。尽管与本文描述的那些类似或等同的任意方法和材料可以用在本发明的实践或试验中,但是本文描述了优选的方法和材料。引用的所有出版物、专利和专利公开通过引用整体并入本文用于所有目的。
在本文中讨论的出版物仅针对它们在本申请的提交日之前的公开内容而提供。在本文中的任何内容都不应解释为承认:本发明由于在前发明而丧失早于这样的出版物的资格。
尽管已经结合其具体实施方案描述了本发明,应该理解,能够进一步修改,并且本申请意图涵盖这样的本发明的任何变化、应用或改进:其一般而言遵循本发明的原理并包括落入本发明所属领域内的已知或常规实践中和可以应用于在上文中阐述的基本特征和落入所附权利要求的范围内的本公开内容的偏离。
参考文献
Arand M,Melzner H,Kinzl L,Bruckner UB,Gebhard F.Early inflammatory mediator response following isolated traumatic brain injury and other major trauma in humans.Langenbecks Arch Surg.2001;386:241-248
Block ML,Zecca L,Hong JS.Microglia-mediated neurotoxicity:Uncovering the molecular mechanisms.Nat Rev Neurosci.2007;8:57-69
Brown GC,Neher JJ.Inflammatory neurodegeneration and mechanisms of microglial killing of neurons.Mol Neurobiol.2010;41:242-247
Cimino M,Weiss B.Characteristics of the binding of phenoxybenzamine to calmodulin.Biochem Pharmacol.1988;37:2739-2745
Hamill RW,Woolf PD,McDonald JV,Lee LA,Kelly M.Catecholamines predict outcome in traumatic brain injury.Ann Neurol.1987;21:438-443
Janssens S,Beyaert R.A universal role for myd88 in tlr/il-1r-mediated signaling.Trends Biochem Sci.2002;27:474-482
Kenny EF,O'Neill LA.Signalling adaptors used by toll-like receptors:An update.Cytokine.2008;43:342-349
Li GZ,Zhang Y,Zhao JB,Wu GJ,Su XF,Hang CH.Expression of myeloid differentiation primary response protein 88(myd88)in the cerebral cortex after experimental traumatic brain injury in rats.Brain Res.2011;1396:96-104
Ling HP,Li W,Zhou ML,Tang Y,Chen ZR,Hang CH.Expression of intestinal myeloid differentiation primary response protein 88(myd88)following experimental traumatic brain injury in a mouse model.J Surg Res.2013;179:e227-234
Prodjosudjadi W,Gerritsma JS,Klar-Mohamad N,Gerritsen AF,Bruijn JA,Daha MR,van Es LA.Production and cytokine-mediated regulation of monocyte chemoattractant protein-1 by human proximal tubular epithelial cells.Kidney Int.1995;48:1477-1486
Rhodes JK,Sharkey J,Andrews PJ.The temporal expression,cellular localization,and inhibition of the chemokines mip-2 and mcp-1 after traumatic brain injury in the rat.J Neurotrauma.2009;26:507-525
Semple BD,Bye N,Rancan M,Ziebell JM,Morganti-Kossmann MC.Role of ccl2(mcp-1)in traumatic brain injury(tbi):Evidence from severe tbi patients and ccl2-/-mice.J Cereb Blood Flow Metab.2010;30:769-782
Strosberg AD.Structure,function,and regulation of adrenergic receptors.Protein Sci.1993;2:1198-1209
Tran TY,Dunne IE,German JW.Beta blockers exposure and traumatic brain injury:A literature review.Neurosurg Focus.2008;25:E8
Vest RS,O'Leary H,Coultrap SJ,Kindy MS,Bayer KU.Effective post-insult neuroprotection by a novel ca(2+)/calmodulin-dependent protein kinase ii(camkii)inhibitor.J Biol Chem.2010;285:20675-20682
Woolf PD,Hamill RW,Lee LA,Cox C,McDonald JV.The predictive value of catecholamines in assessing outcome in traumatic brain injury.J Neurosurg.1987;66:875-882
Woolf PD,Hamill RW,Lee LA,McDonald JV.Free and total catecholamines in critical illness.Am J Physiol.1988;254:E287-291
Yang K,Taft WC,Dixon CE,Todaro CA,Yu RK,Hayes RL.Alterations of protein kinase c in rat hippocampus following traumatic brain injury.J Neurotrauma.1993;10:287-295
Zhang M,Shan H,Gu Z,Wang D,Wang T,Wang Z,Tao L.Increased expression of calcium/calmodulin-dependent protein kinase type ii subunit delta after rat traumatic brain injury.J Mol Neurosci.2012;46:631-643
Ziebell JM,Morganti-Kossmann MC.Involvement of pro-and anti-inflammatory cytokines and chemokines in the pathophysiology of traumatic brain injury.Neurotherapeutics.2012;7:22-30
- 还没有人留言评论。精彩留言会获得点赞!