一种富血小板血浆和提取富血小板血浆的方法与流程
本申请涉及医疗技术领域,具体的,涉及一种富血小板血浆和提取富血小板血浆的方法。
背景技术:
富血小板血浆(platelet-richinplasma,prp)是一种外周血来源的血小板浓集物,通过离心全血得到的含高浓度血小板血浆。prp最初是作为一种生物凝胶和屏障膜,在临床上用于增强止血的效果。研究发现prp中包含多种生长因子,如pdgf、tgf-β、egf、vegf、igf、fgf以及调节伤口的其它分子,可以促进伤口愈合和组织再生,由于这些特点使prp广泛应用于颌面外科、整形外科、骨科、运动医学及难治性皮肤溃疡等医学领域研究中。目前,prp已在大鼠骨缺损模型、山羊下颌骨缺损模型中,prp复合材料的植入与对照组相比新骨生成量明显增加,骨修复和愈合程度也明显加快等。同时在动物组织创伤也表现出了良好的应用效果,包括创面抗感染,促进伤口愈合。但是,prp的制备方法尚存在回收率较低、浓度等指标变异系数大、生物活性不高等缺陷。
技术实现要素:
本公开的目的是提供一种提取富血小板血浆的方法,该方法制得的血小板浓集物血小板得率明显提高,浓度保持稳定,且生物活性明显改善。
本公开提供一种提取富血小板血浆的方法,包括以下步骤:
s1、将抗凝处理后的全血进行第一离心,得到第一离心产物;所述第一离心产物包括由上到下分布的第一血浆层、第一白膜层以及第一红细胞层;
s2、将所述第一红细胞层上段的0-5mm与所述第一血浆层和所述第一白膜层取出,得到取出的第一浓集物和剩余的第二浓集物;将所述第一浓集物进行第二次离心,得到第二离心产物;所述第二离心产物包括由上到下分布的第二血浆层、第二白膜层以及第二红细胞层;弃掉所述第二血浆层的50-75%的上段,得到剩余的第三浓集物;
s3、将所述第二浓集物用生理盐水稀释后进行冻融处理,并将冻融处理后的物料用生理盐水洗涤并离心,将离心所得的沉淀作为第四浓集物;
s4、将所述第三浓集物与所述第四浓集物混合。
优选的,冻融处理的条件包括:冷冻温度为零下196℃至零下40℃;冷冻时间为20~60min;解冻温度为10-35℃;解冻的升温速度为0.1-10℃/分钟。
优选的,所述全血的来源为人或哺乳动物;所述抗凝处理使用的抗凝剂为肝素钠、枸橼酸钠、edta盐和草酸盐中的至少一种。
优选的,步骤s2中,将所述第一红细胞层上段的1-3mm与所述第一血浆层和所述第一白膜层取出;弃掉所述第二血浆层的60-75%的上段。
优选的,步骤s3中,将所述第二浓集物用生理盐水稀释时,生理盐水的添加量为所述全血体积的1~3倍。
优选的,第一次离心的离心力为200-400g,时间为18-22min;第二次离心的离心力为1500-1900g,时间为14-16min。
优选的,步骤s3中,进行洗涤并离心的步骤包括:
s31、将所述第二浓集物冻融处理后的物料进行第三次离心,得到第三离心产物;
s32、将所述第三离心产物的上清进行第四次离心,得到第四离心产物;
s33、弃掉所述第四离心产物上清的50-75%的上段,在剩余的所述第四离心产物中加入生理盐水洗涤2-4次。
优选的,其中,s33步骤中,弃掉所述第四离心产物上清的60-75%的上段;加入生理盐水洗涤时的离心力为1800-2200g,时间为9-11min。。
优选的,第三次离心的离心力为100-300g,时间为14-16min;第四次离心的离心力为1500-1800g,时间为9-11min。
本公开还提供了一种用上述方法制得的富血小板血浆,该富血小板血浆的血小板浓度高。
通过上述技术方案,本公开显著提升了血小板的回收率,浓度保持稳定,且生物活性明显改善。
附图说明
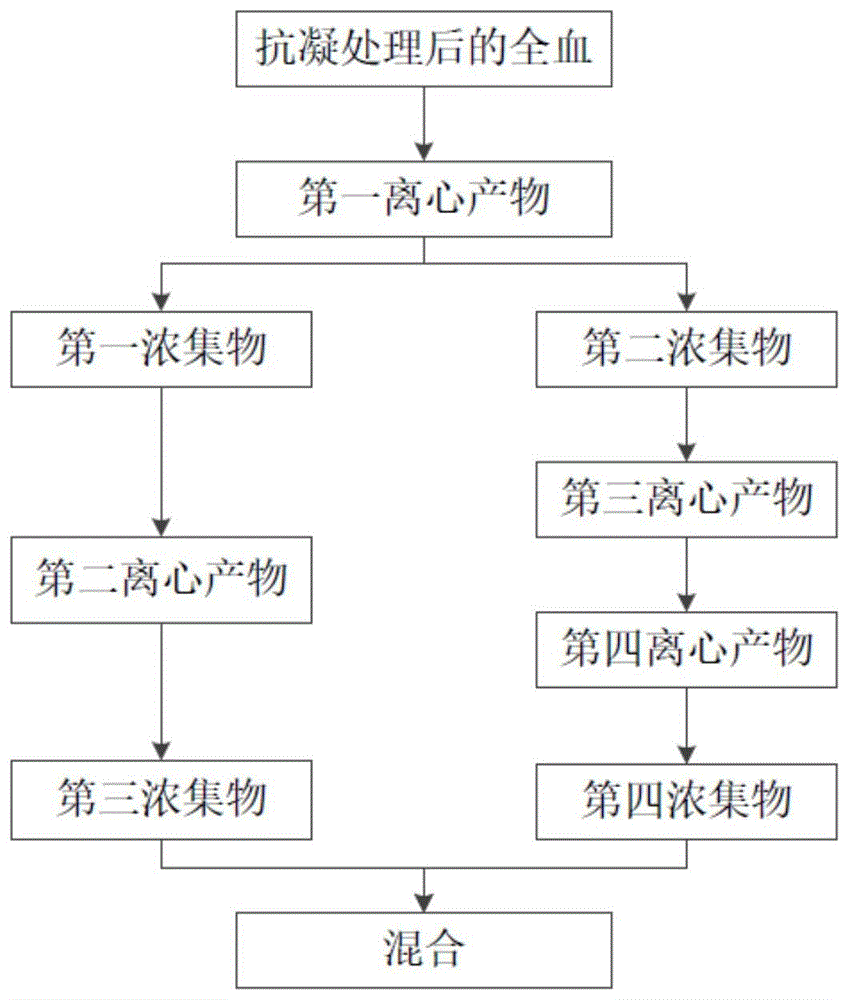
图1:富血小板血浆提取操作流程图。
具体实施方式
以下结合附图对本公开的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本公开,并不用于限制本公开。
本公开提供一种提取富血小板血浆的方法,包括以下步骤:
s1、将抗凝处理后的全血进行第一离心,得到第一离心产物;所述第一离心产物包括由上到下分布的第一血浆层、第一白膜层以及第一红细胞层;
s2、将所述第一红细胞层上段的0-5mm与所述第一血浆层和所述第一白膜层取出,得到取出的第一浓集物和剩余的第二浓集物;将所述第一浓集物进行第二次离心,得到第二离心产物;所述第二离心产物包括由上到下分布的第二血浆层、第二白膜层以及第二红细胞层;弃掉所述第二血浆层的50-75%的上段,得到剩余的第三浓集物;
s3、将所述第二浓集物用生理盐水稀释后进行冻融处理,并将冻融处理后的物料用生理盐水洗涤并离心,将离心所得的沉淀作为第四浓集物;
s4、将所述第三浓集物与所述第四浓集物混合。
本公开通过对离心后的红细胞部分进行冻融处理,进一步获取了红细胞部分中夹带的血小板,由此显著提升了血小板的回收率。并且,由于分离白膜层时对操作要求的降低,避免了人员主观判断不同导致的批次间差异。另外,可能由于血小板部分的组成更加丰富,生物活性具有明显的改善。
所述第一浓集物包括所述第一红细胞层上段的0-5mm与所述第一血浆层和所述第一白膜层。在将所述第一浓集物进行第二次离心前,可以将所述第一浓集物进行吹打混匀的操作,以利于血小板的分离。
优选的,冻融处理的条件包括:冷冻温度为零下196℃至零下40℃;冷冻时间为20~60min;解冻温度为10-35℃;更优选的,冷冻温度为零下80℃。所述冷冻可以通过将物料直接置入液氮、干冰或低温冰箱中来实现。所述解冻可以通过将冷冻的物料置于室温下自然解冻来实现,优选的,解冻温度为10-35℃;解冻的升温速度为0.1-10℃/分钟。
优选的,所述全血的来源为人或哺乳动物;所述抗凝处理使用的抗凝剂为肝素钠、枸橼酸钠、edta盐和草酸盐中的至少一种。所述全血通过常规的采血方式获得,例如通过静脉采血的方式获得。所述抗凝处理可以通过常规的抗凝采血管进行。
优选的,步骤s2中,将所述第一红细胞层上段的1-3mm与所述第一血浆层和所述第一白膜层取出;弃掉所述第二血浆层的60-75%的上段。在该优选情况下,可以进一步消除批次间差异。
优选的,步骤s3中,将所述第二浓集物用生理盐水稀释时,生理盐水的添加量为所述全血体积的1~3倍。
本公开中的离心转速和时间可以再较大的范围内变化,例如,第一次离心的离心力可以为200-400g,时间可以为18-22min;第二次离心的离心力可以为1500-1900g,时间可以为14-16min。
步骤s3中,进行洗涤并离心的作用包括但不限于去除红细胞碎片等杂志,进行洗涤并离心的操作可以在较大的范围内变化,优选的,步骤s3中,进行洗涤并离心的步骤包括:
s31、将所述第二浓集物冻融处理后的物料进行第三次离心,得到第三离心产物;
s32、将所述第三离心产物的上清进行第四次离心,得到第四离心产物;
s33、弃掉所述第四离心产物上清的50-75%的上段,在剩余的所述第四离心产物中加入生理盐水洗涤2-4次。
其中,s33步骤中,可以弃掉所述第四离心产物上清的60-75%的上段;加入生理盐水洗涤时的离心力可以为1800-2200g,时间可以为9-11min。。
优选的,第三次离心的离心力为100-300g,时间为14-16min;第四次离心的离心力为1500-1800g,时间为9-11min。
本公开还提供了一种用上述方法制得的富血小板血浆。该富血小板血浆浓度在批次间能够保持更加稳定,且生物活性明显改善。
以下,通过实施例进一步详细说明本公开。
实施例和对比例中的全血为符合中华人民共和国献血体检标准的健康者的静脉血,献血者献血前1天没有摄入含酒精类饮料,两周内没有服用阿司匹林或其他抗血小板及抗凝血的任何相关药物,没有可检测出的出血和凝血性疾病。每组实施例和对比例平行试验10次(男6例,女4例,年龄25-35岁)。
实施例中的实验仪器及试剂
仪器:水平离心机(品牌:thermo,型号:st8r)和超低温冰箱(品牌:thermo,型号:tse320v)均购自美国thermo;血细胞分析仪(品牌:迈瑞,型号:bc3000)购自迈瑞医疗股份有限公司。
试剂:生理盐水(品牌:安徽丰源药业股份有限公司,规格:500ml/瓶)购自安徽丰源药业股份有限公司;液氮和干冰均购自杭州电化集团气体有限公司;人血小板衍生因子(pdgf)elisa试剂盒(品牌:multisciences,货号:70-ek1213-96)和人转化生长因子β1elisa试剂盒(品牌:multisciences,货号:70-ek1812-96)均购自杭州联科生物有限公司。
实施例1
取全血5ml于采血管中加入枸橼酸钠进行抗凝处理,将抗凝处理后的全血放入水平离心机中进行第一次离心,离心力为300g,离心20min;离心完成后,取出上层血浆、中间白膜层以及下层红细胞上段3mm作为第一浓集物,剩余的下层红细胞作为第二浓集物,将第一浓集物至入一个新的15ml离心管,进行第二次离心,离心力为1700g,离心15min;离心完成后,弃掉上层75%的贫血小板血浆,保留25%重悬混匀即为第三浓集物。
将第二浓集物用生理盐水稀释3倍并混匀,将混匀后的悬液置于-80℃低温冰箱中冷冻40min,之后取出悬液室温解冻后,进行第三次离心,离心力为300g,离心15min;取上清进行第四次离心,离心力为1800g,离心时间10min;弃去75%的上清;然后加入生理盐水洗涤三次,每次离心的离心力为2000g,离心时间10min;最后一次离心完成后,去上清保留沉淀物为第四浓集物。
将第三浓集物与第四浓集物混匀,得到最终血小板浓集物。
实施例2
取全血5ml于采血管中加入枸橼酸钠进行抗凝处理,将抗凝处理后的全血放入水平离心机中进行第一次离心,离心力为300g,离心20min;离心完成后,取出上层血浆、中间白膜层以及下层红细胞上段3mm作为第一浓集物,剩余的下层红细胞作为第二浓集物,将第一浓集物至入一个新的15ml离心管,进行第二次离心,离心力为1700g,离心15min;离心完成后,弃掉上层75%的贫血小板血浆,保留25%重悬混匀即为第三浓集物。
将第二浓集物用生理盐水稀释3倍并混匀,将混匀后的悬液置于-70℃低温冰箱中冷冻45min,之后取出悬液室温解冻后,进行第三次离心,离心力为300g,离心15min;取上清进行第四次离心,离心力为1800g,离心时间10min;弃去75%的上清;然后加入生理盐水洗涤三次,每次离心的离心力为2000g,离心时间10min;最后一次离心完成后,去上清保留沉淀物为第四浓集物。
将第三浓集物与第四浓集物混匀,得到最终血小板浓集物。
实施例3
取全血5ml于采血管中加入枸橼酸钠进行抗凝处理,将抗凝处理后的全血放入水平离心机中进行第一次离心,离心力为300g,离心20min;离心完成后,取出上层血浆、中间白膜层以及下层红细胞上段3mm作为第一浓集物,剩余的下层红细胞作为第二浓集物,将第一浓集物至入一个新的15ml离心管,进行第二次离心,离心力为1700g,离心15min;离心完成后,弃掉上层75%的贫血小板血浆,保留25%重悬混匀即为第三浓集物。
将第二浓集物用生理盐水稀释3倍并混匀,将混匀后的悬液置于液氮中(约零下196℃)冷冻25min,之后取出悬液室温解冻后,进行第三次离心,离心力为300g,离心15min;取上清进行第四次离心,转速1800g,离心时间10min;弃去75%的上清;然后加入生理盐水洗涤三次,每次离心的离心力为2000g,离心时间10min;最后一次离心完成后,去上清保留沉淀物为第四浓集物。
将第三浓集物与第四浓集物混匀,得到最终血小板浓集物。
实施例4
取全血5ml于采血管中加入枸橼酸钠进行抗凝处理,将抗凝处理后的全血放入水平离心机中进行第一次离心,离心力为300g,离心20min;离心完成后,取出上层血浆、中间白膜层以及下层红细胞上段3mm作为第一浓集物,剩余的下层红细胞作为第二浓集物,将第一浓集物至入一个新的15ml离心管,进行第二次离心,离心力为1700g,离心15min;离心完成后,弃掉上层75%的贫血小板血浆,保留25%重悬混匀即为第三浓集物。
将第二浓集物用生理盐水稀释3倍并混匀,将混匀后的悬液置于干冰中(约零下40℃)冷冻50min,之后取出悬液室温解冻后,进行第三次离心,离心力为300g,离心15min;取上清进行第四次离心,离心力为1800g,离心时间10min;弃去75%的上清;然后加入生理盐水洗涤三次,每次离心的离心力为2000g,离心时间10min;最后一次离心完成后,去上清保留沉淀物为第四浓集物。
将第三浓集物与第四浓集物混匀,得到最终血小板浓集物。
实施例5
取全血5ml于采血管中加入枸橼酸钠进行抗凝处理,将抗凝处理后的全血放入水平离心机中进行第一次离心,离心力为300g,离心20min;离心完成后,取出上层血浆、中间白膜层以及下层红细胞上段1mm作为第一浓集物,剩余的下层红细胞作为第二浓集物,将第一浓集物至入一个新的15ml离心管,进行第二次离心,离心力为1700g,离心15min;离心完成后,弃掉上层75%的贫血小板血浆,保留25%重悬混匀即为第三浓集物。
将第二浓集物用生理盐水稀释3倍并混匀,将混匀后的悬液置于-80℃下冷冻40min,之后取出悬液室温解冻后,进行第三次离心,离心力为300g,离心15min;取上清进行第四次离心,离心力为1800g,离心时间10min;弃去75%的上清;然后加入生理盐水洗涤三次,每次离心的离心力为2000g,离心时间10min;最后一次离心完成后,去上清保留沉淀物为第四浓集物。
将第三浓集物与第四浓集物混匀,得到最终血小板浓集物。
对比例1
取全血5ml于采血管中加入枸橼酸钠进行抗凝处理,将抗凝处理后的全血放入水平离心机中进行第一次离心,离心力为300g,离心20min;离心完成后,取出上层血浆、中间白膜层以及下层红细胞上段3mm作为第一浓集物,剩余的下层红细胞作为第二浓集物,将第一浓集物至入一个新的15ml离心管,进行第二次离心,离心力为1700g,离心15min;离心完成后,弃掉上层75%的贫血小板血浆,保留25%重悬混匀即为第三浓集物,将第三浓集物作为最终的血小板浓集物。
对比例2
取全血5ml于采血管中加入枸橼酸钠进行抗凝处理,将抗凝处理后的全血放入水平离心机中进行第一次离心,离心力为300g,离心20min;离心完成后,取出上层血浆、中间白膜层以及下层红细胞上段3mm作为第一浓集物,剩余的下层红细胞作为第二浓集物,将第一浓集物至入一个新的15ml离心管,进行第二次离心,离心力为1700g,离心15min;离心完成后,弃掉上层75%的贫血小板血浆,保留25%重悬混匀即为第三浓集物。
将第二浓集物用生理盐水稀释3倍并混匀,将混匀后的悬液进行第三次离心,离心力为300g,离心15min;取上清进行第四次离心,离心力为1800g,离心时间10min;弃去75%的上清;然后加入生理盐水洗涤三次,每次离心的离心力为2000g,离心时间10min;最后一次离心完成后,去上清保留沉淀物为第四浓集物。
将第三浓集物与第四浓集物混匀,得到最终血小板浓集物。
对比例3
取全血5ml于采血管中加入枸橼酸钠进行抗凝处理,将抗凝处理后的全血放入水平离心机中进行第一次离心,离心力为300g,离心20min;离心完成后,取出上层血浆、中间白膜层以及下层红细胞上段3mm作为第一浓集物,剩余的下层红细胞作为第二浓集物,将第一浓集物至入一个新的15ml离心管,进行第二次离心,离心力为1700g,离心15min;离心完成后,弃掉上层75%的贫血小板血浆,保留25%重悬混匀即为第三浓集物。
将第二浓集物用生理盐水稀释3倍并混匀,将混匀后的悬液置于-18℃下冷冻40min,之后取出悬液室温解冻后,进行第三次离心,离心力为300g,离心15min;取上清进行第四次离心,离心力为1800g,离心时间10min;弃去75%的上清;然后加入生理盐水洗涤三次,每次离心的离心力为2000g,离心时间10min;最后一次离心完成后,去上清保留沉淀物为第四浓集物。
将第三浓集物与第四浓集物混匀,得到最终血小板浓集物。
测试例1
检测未处理的静脉血、实施例1-5和对比例1-5的血常规数值,检验方法为:血细胞计数仪检测法。检测数值见表1
通过表1数据可得利用本公开的方法制备的最终血小板浓集物中的血小板浓度明显高于静脉血和经传统二次离心法制得的血小板浓集物中的血小板浓度,并且利用本公开的方法制备的最终血小板浓集物中的红细胞含量显著下降,而当第二浓集物不做冻融处理或冷冻温度不够时,最终获取的血小板浓度显著下降。
根据表1数据计算血小板得率,计算方法为血小板得率(%)=浓集物血小板浓度×血小板浓集物体积/(全血血小板浓度×全血体积)×100,计算结果见表2
表2
通过表2数据可得利用本公开的方法制备的最终血小板浓集物中的血小板得率明显高于静脉血和经传统二次离心法制得的血小板浓集物中的血小板得率,而当第二浓集物不做冻融处理或冷冻温度不够时,最终获取的血小板得率显著下降。
测试例2
按照实施例1的方法条件提取不同批次的8管5ml静脉血的得到的血小板,测试批次间血小板得率的稳定性,评定标准为计算变异系数(cv),计算公式为:变异系数(cv%)=标准差/均值×100,具体的数据见表3:
表3
通过表3的数据可以计算得出cv%=1.84,表明本方法的血小板得率稳定性较好。
测试例3
本实验对以上实施例1-5和对比例1-3获取的血小板中的细胞因子pdgf和tgf-β作了检测,测试其生物活性的情况,检测方法参考elisa试剂盒说明,具体数据见表4
表4
通过表4的数据可以得出实施例获取的血小板中的细胞因子的含量均显著高于对比例中血小板中的细胞因子含量的,表明本方法得到浓集物血小板活性更高。
以上实施例仅是对本公开的优选方式进行描述,并非对本公开的范围进行限定,在不脱离本公开的设计精神的前提下,对本公开的技术方案作出的各种变型和改进,均应落入本公开的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!