基于高光谱和荧光成像引导的光动力精准治疗系统的制作方法
本发明涉及光学成像与生命医学领域,特别涉及一种基于高光谱和荧光成像引导的光动力精准治疗系统。
背景技术:
肿瘤光动力治疗是通过光、光敏剂和组织中氧分子的联合作用来治疗肿瘤的新疗法,是一种肿瘤的无创或微创疗法。光动力治疗的原理是将光敏剂聚集在病灶区域,通过特定波长(400~760nm)的光源照射,激发光敏剂分子,在一系列能量传递和电子转移作用下,将氧分子转化为单线态氧,杀死周围的病变细胞,完成肿瘤的治疗。肿瘤部位光敏剂的富集效率以及光照强度、时间是光动力治疗的效果的关键因素。目前肿瘤的光动力治疗过程中通过增强彩色图像或者荧光分子影像的内窥系统来粗略的区分正常组织和病变区域,通过无差别的光照实现光动力治疗,无法实现精准治疗。所以如何精准定位肿瘤位置以及准确判断光敏剂的分布,是光动力治疗的难点。
高光谱成像技术是成像技术和光谱技术的结合,能够同时获取目标的空间信息和光谱信息,部分研究表明高光谱成像技术在胃癌,结肠癌,宫颈癌,舌癌等检测中能够达到90%以上的识别精度。光动力治疗的光敏剂在特定波长激发下会产生荧光,可以用于光敏剂的示踪,以及剂量的计算。高光谱成像技术,荧光成像技术结合内窥成像系统,将有效的实现肿瘤的精准光动力治疗。
技术实现要素:
本发明所要解决的技术问题在于针对上述现有技术中的不足,提供一种基于高光谱和荧光成像引导的光动力精准治疗系统。
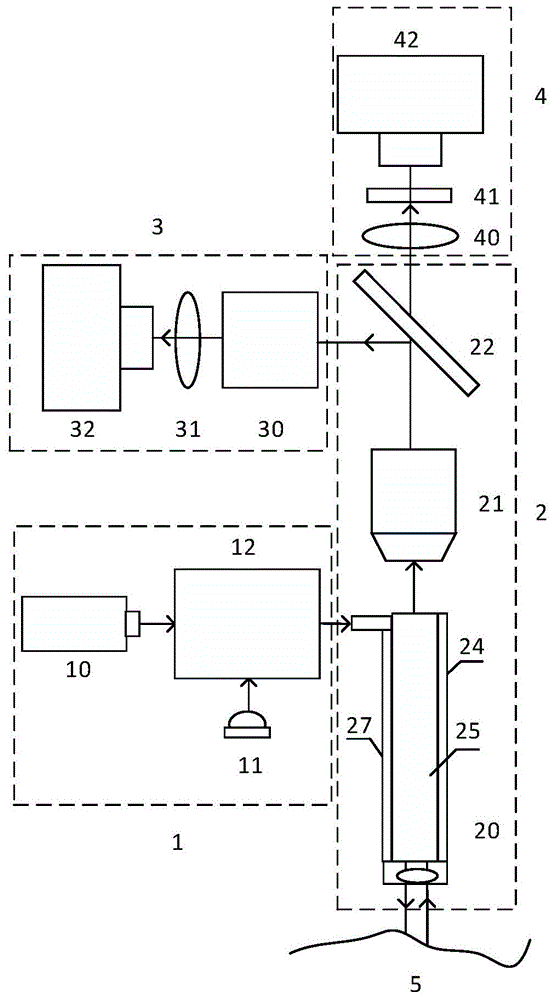
为解决上述技术问题,本发明采用的技术方案是:一种基于高光谱和荧光成像引导的光动力精准治疗系统,包括:光源系统、内窥成像系统、高光谱成像系统和荧光成像系统;
所述光源系统用于发出激光和白光;
所述内窥成像系统将所述激光和白光传导至活体组织处,并将活体组织反射的明场光和活体组织上的光敏剂被所述激光激发而产生的荧光分别传导至所述高光谱成像系统和荧光成像系统;
所述高光谱成像系统接受所述明场光,得到活体组织的高光谱图像,以对活体组织的肿瘤位置进行定位,从而引导所述光源系统发出激光光源照射至肿瘤位置,进行光动力治疗;
所述荧光成像系统接受所述荧光,得到活体组织的荧光图像,通过对所述荧光图像的强度和分布的分析推算光敏剂的浓度和分布数据,据此判断是否需要进行光敏剂再次注射以及在进行光动力治疗时对激光光源的强度进行控制。
优选的是,所述光源系统包括激光光源、白光光源和耦合装置。
优选的是,所述内窥成像系统包括内窥镜头、显微物镜和二向色镜。
优选的是,所述高光谱成像系统包括沿光路依次设置的分光装置、第一会聚镜和第一探测器;
所述荧光成像系统沿光路依次设置的第二会聚镜、滤光片和第二探测器。
优选的是,所述内窥镜头包括微型电机、操作孔、光纤成像束、设置于所述光纤成像束末端的微物镜、光源光纤及设置于所述光源光纤末端的微透镜;所述微型电机用于带动所述内窥镜头在二维方向进行运动。
优选的是,所述光源系统发出的激光和白光经过所述耦合装置后,传导至所述内窥镜头,再依次经过所述光源光纤和微透镜后照射到活体组织上,活体组织返回的明场光和活体组织上的光敏剂被所述激光激发而产生的荧光依次经过所述微物镜和光纤成像束后,到达所述显微物镜,然后传导至所述二向色镜上;其中的明场光被所述二向色镜反射,再依次经过所述分光装置、第一会聚镜后到达所述第一探测器,进行高光谱成像;其中的荧光透射所述二向色镜,再依次经过所述第二会聚镜、滤光片后到达所述第二探测器,进行荧光成像。
优选的是,所述分光装置包括色散器件和色散器件控制器,色散器件为棱镜光栅分光器或声光可调滤光器或者液晶可调滤光器。
优选的是,所述第一探测器和第二探测器均为emccd探测器或者scoms探测器。
优选的是,所述滤光片为荧光带通滤光片,带通波长为750nm-800nm。
优选的是,该系统的工作方法包括以下步骤:
1)开启白光光源,白光经过内窥成像系统后照射到活体组织上,活体组织返回的明场光经过内窥成像系统后到达高光谱成像系统,进行高光谱成像,然后根据获得的高光谱成像结合识别算法,判断出活体组织的肿瘤位置;
2)关闭白光光源,并打开激光光源,激光经过内窥成像系统后照射到活体组织上,活体组织上的光敏剂被激光激发产生的荧光经过内窥成像系统后到达荧光成像系统,进行荧光成像;
3)关闭激光光源,对所述步骤3)获得的荧光图像的强度和分布进行分析,得出活体组织上的光敏剂的浓度和分布数据,据此判断是否需要进行光敏剂再次注射,并将其作为后续光动力治疗时激光光源的强度的控制依据;
4)依据所述步骤2)得到的活体组织的肿瘤位置对激光光源的照射位置进行引导,打开激光光源,进行光动力治疗;依据所述步骤3)得到的活体组织上的光敏剂的浓度和分布数据,对激光光源的强度进行控制。
本发明的有益效果是:本发明的基于高光谱和荧光成像引导的光动力精准治疗系统,通过高光谱成像系统准确判断肿瘤的位置,通过荧光成像系统准确判断光敏剂的分布和剂量,据此准确控制光源的强度、照射范围,能实现肿瘤光动力精准治疗。本发明能够通过同时获取组织的高光谱图像数据和光敏剂分布的荧光图像数据,能够实现肿瘤定位和药物示踪,将极大提高肿瘤光动力治疗的准确度。
附图说明
图1为本发明的基于高光谱和荧光成像引导的光动力精准治疗系统的结构示意图;
图2为本发明的内窥镜头的结构示意图;
图3为本发明的内窥镜头的仰视方向的结构示意图;
图4为本发明的一种实施例中的系统的工作流程示意图。
附图标记说明:
1—光源系统;2—内窥成像系统;3—高光谱成像系统;4—荧光成像系统;5—活体组织;10—激光光源;11—白光光源;12—耦合装置;20—内窥镜头;21—显微物镜;22—二向色镜;23—微型电机;24—操作孔;25—光纤成像束;26—微物镜;27—光源光纤;28—微透镜;30—分光装置;31—第一会聚镜;32—第一探测器;40—第二会聚镜;41—滤光片;42—第二探测器。
具体实施方式
下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。
如图1-3所示,本实施例的一种基于高光谱和荧光成像引导的光动力精准治疗系统,包括:光源系统1、内窥成像系统2、高光谱成像系统3和荧光成像系统4;
光源系统1用于发出激光和白光;
内窥成像系统2将激光和白光传导至活体组织5处,并将活体组织5反射的明场光和活体组织5上的光敏剂被激光激发而产生的荧光分别传导至高光谱成像系统3和荧光成像系统;
高光谱成像系统3接受明场光,得到活体组织5的高光谱图像,以对活体组织5的肿瘤位置进行定位,从而引导光源系统1发出激光光源10照射至肿瘤位置,进行光动力治疗;
荧光成像系统4接受荧光,得到活体组织5的荧光图像,通过对荧光图像的强度和分布的分析推算光敏剂的浓度和分布数据,据此判断是否需要进行光敏剂再次注射以及在进行光动力治疗时对激光光源10的强度进行控制。
本发明的系统通过高光谱成像系统3准确判断肿瘤的位置,通过荧光成像系统4准确判断光敏剂的分布和剂量,据此准确控制光源的强度、照射范围,以实现肿瘤光动力精准治疗。
在一种实施例中,光源系统1包括激光光源10、白光光源11和耦合装置12。耦合装置12能将激光和白光进行耦合。激光光源10用于光动力治疗和激发光敏剂荧光,优选为波长705nm,白光光源11用于高光谱成像照明,优选为波长420nm-700nm的高亮度led光源。
参照图2和图3,内窥成像系统2包括内窥镜头20、显微物镜2621和二向色镜22。在进一步优选的实施例中,内窥镜头20包括微型电机23、操作孔24、光纤成像束25、设置于光纤成像束25末端的微物镜26、光源光纤27及设置于光源光纤27末端的微透镜28。微型电机23用于带动内窥镜头20在二维方向进行运动,从而能通过内窥镜头20遍历扫描整个活体组织5,获取活体组织5的完整高光谱图像和荧光图像。操作孔24用于进行光敏剂二次注射
高光谱成像系统3包括沿光路依次设置的分光装置30、第一会聚镜31和第一探测器32;在优选的实施例中,分光装置30包括色散器件和色散器件控制器,色散器件为棱镜光栅分光器或声光可调滤光器或者液晶可调滤光器。
荧光成像系统沿光路依次设置的第二会聚镜40、滤光片41和第二探测器42。滤光片41为荧光带通滤光片41,优选为带通波长为750nm-800nm。
在优选的实施例中,第一探测器32和第二探测器42均为emccd探测器或者scoms探测器。
在上述实施例中,进行高光谱成像和荧光成像时的光路流程为:
光源系统1发出的激光和白光经过耦合装置12后,传导至内窥镜头20,再依次经过光源光纤27和微透镜28后照射到活体组织5上,活体组织5返回的明场光和活体组织5上的光敏剂被激光激发而产生的荧光依次经过微物镜26和光纤成像束25后,到达显微物镜2621,然后传导至二向色镜22上;其中的明场光被二向色镜22反射,再依次经过分光装置30、第一会聚镜31后到达第一探测器32,进行高光谱成像;其中的荧光透射二向色镜22,再依次经过第二会聚镜40、滤光片41后到达第二探测器42,进行荧光成像。
在一种实施例中,参照图4,本发明的基于高光谱和荧光成像引导的光动力精准治疗系统的工作方法包括以下步骤:
1)开启白光光源11,白光经过内窥成像系统2后照射到活体组织5上,活体组织5返回的明场光经过内窥成像系统2后到达高光谱成像系统3,进行高光谱成像,然后根据获得的高光谱成像结合识别算法,判断出活体组织5的肿瘤位置;
2)关闭白光光源11,并打开激光光源10,激光经过内窥成像系统2后照射到活体组织5上,活体组织5上的光敏剂被激光激发产生的荧光经过内窥成像系统2后到达荧光成像系统,进行荧光成像;
3)关闭激光光源10,判断是否已经得到了活体组织5完整的高光谱图像和荧光图像,如果未得到,则调整内窥镜头20的角度、位置,再重复步骤1)和2),直至得到完整的高光谱图像和荧光图像;然后对步骤3)获得的荧光图像的强度和分布进行分析,得出活体组织5上的光敏剂的浓度和分布数据,据此判断是否需要进行光敏剂再次注射,并将其作为后续光动力治疗时激光光源10的强度的控制依据;当需要进行光敏剂二次注射时,通过内窥镜头20上的操作孔24进行光敏剂二次注射;
4)依据步骤2)得到的活体组织5的肿瘤位置对激光光源10的照射位置进行引导,调整好内窥镜头20的角度,打开激光光源10,使激光精准照射在肿瘤位置;依据步骤3)得到的活体组织5上的光敏剂的浓度和分布数据,对激光光源10的强度进行控制,以实现肿瘤光动力精准治疗。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节。
- 还没有人留言评论。精彩留言会获得点赞!