预激活间充质干细胞在治疗皮肤创伤的免疫生物学方面的应用的制作方法
[0001]
本发明涉及生物医药领域,具体地,涉及预激活间充质干细胞在治疗皮肤创伤的免疫生物学方面的应用。
背景技术:
[0002]
皮肤是包在身体肌肉层外表面的组织,直接与外界环境接触,除了具有感受外界刺激,保持体温和排泄的功能外,其作为机体最大的器官,也是机体抵抗外界侵扰的第一道防线[1,2]。正因为皮肤位于机体最外侧,所以极容易受到如机械外力,烧伤等外界因素造成的损伤,这些由外力等其他等物理、化学因素造成的皮肤组织破裂、离断或缺损就叫做皮肤创伤。轻度的皮肤创伤仅限表皮层破裂,机体可以通过再上皮化直接进行自我修复;中度的皮肤创伤会由于皮下组织断裂而出现伤口;重度的皮肤创伤可能会有肌肉或神经的断裂。但是,相比于皮肤创伤本身,其并发症如感染、持续炎症、瘢痕形成或组织功能缺失等对机体的危害更大,临床表现为肢体动静脉溃疡,糖尿病足溃烂,褥疮,增生性瘢痕或瘢痕瘤等疾病[3,4],严重影响患者生活质量,甚至危及生命。
[0003]
据数据统计,美国每年约650万人,欧洲约200万人发生皮肤创伤及其并发症,而其对应的治疗及护理也会消耗大量的医疗资源,在美国每年花费约250亿美元,占据住院病人护理支出的80%[5,6]。皮肤创伤主要来源于外科手术、烧伤和交通事故等因素,而且老年人及糖尿病人群比例的上升,更加剧了皮肤创伤的并发症,延长治疗进程,加重了医疗卫生系统的负担。我国作为人口大国,且严峻的老龄化时代日渐趋近,皮肤创伤必将成为医疗卫生系统的重大负担之一。据不完全统计,我国目前有约9200万糖尿病患者和1.45亿糖尿病潜在患者[7];在过去15年内,我国已建成69个医院创伤护理中心[8]。因此,深入研究并积极探索皮肤创伤及其并发症的治疗策略具有重要的临床意义和经济效益。
[0004]
间充质干细胞(mesenchymal stem cells,mscs)是一类具有自我更新和多向分化潜能的组织干细胞。此外,mscs还拥有强大的免疫调节能力,即mscs被炎症因子ifn-γ和tnf-α激活而分泌的多种免疫抑制分子如no、ido和生长因子vegf、fgf和egf等,能够影响免疫细胞的活化、增殖及功能。皮肤创伤愈合是免疫系统全面参与的组织再生过程,需要严格的免疫调节及适度的细胞增殖分化来实现组织修复。mscs因其来源广泛且易培养、低免疫原性、多向分化能力和强大的免疫调节能力,被广泛用于皮肤创伤治疗的研究。
[0005]
虽然已有大量动物模型研究表明mscs可以通过多种机制促进皮肤创伤愈合,但是只有5项小样本量的临床试验报道。输注自体骨髓来源的mscs可以改善慢性不愈合伤口的治疗,但是8年来,再没有基于mscs治疗皮肤创伤的临床试验的报道。面对动物模型治疗效果向临床应用的转化问题,研究者需要进一步发掘mscs治疗皮肤创伤的深入机制,探索治疗效果的优化方案。
技术实现要素:
[0006]
本发明的目的在于进一步发掘mscs治疗皮肤创伤的深入机制,探索治疗效果的优化方案。
[0007]
本发明第一方面提供了一种细胞制剂,包括:
[0008]
(i)第一药物组合物,所述第一药物组合物含有(a)第一活性成分,所述第一活性成分为巨噬细胞,以及药学上可接受的载体;
[0009]
(ii)第二药物组合物,所述第二药物组合物含有(b)第二活性成分,所述第二活性成分为预激活的间充质干细胞(msc);以及药学上可接受的载体;
[0010]
其中,所述的第一药物组合物和第二药物组合物为不同的药物组合物,或同一药物组合物。
[0011]
在另一优选例中,所述巨噬细胞选自下组:野生型的巨噬细胞、驯化的巨噬细胞、或其组合。
[0012]
在另一优选例中,所述驯化的巨噬细胞具有选自以下一种或多种特征:
[0013]
(a)1-99%的细胞高表达arginase1;
[0014]
(b)1-99%的细胞高表达hif1α;
[0015]
(c)1-99%的细胞高表达pd-l1;
[0016]
(d)1-99%的细胞高表达il-10;
[0017]
(e)1-99%的细胞高表达tgfβ。
[0018]
在另一优选例中,用如下方法制备所述预激活的msc:
[0019]
在炎症因子(如ifn-γ、il17a、和/或tnf-α)的存在下,激活msc,从而获得所述预激活的msc。
[0020]
在另一优选例中,所述巨噬细胞来源于骨髓、外周血单个核细胞、外周血单核细胞、腹腔或组织分化而来的巨噬细胞。
[0021]
在另一优选例中,所述msc来源于骨髓、脐带、牙龈、胎盘、脂肪、羊水或脐带血。
[0022]
在另一优选例中,所述细胞制剂包括液体制剂。
[0023]
在另一优选例中,所述的细胞制剂中的细胞基本上(≥90%、95%、96%、97%、98%、99%、99.5%、99.9%)或全部由(a)巨噬细胞和(b)激活的msc构成。
[0024]
在另一优选例中,所述组分(a)与组分(b)的细胞数量之比为1000:1-1:10,较佳地,100:1-1:1。
[0025]
在另一优选例中,所述组分(a)与组分(b)的细胞数量之比为1:1000-1:100,较佳地,1:100-1:10,更佳地,1:10-1:1。
[0026]
在另一优选例中,所述的组合物中,所述巨噬细胞的浓度0.001-50
×
106个/kg体重,较佳地,0.1-10
×
106个/kg体重,更佳地,1-5
×
106个/kg体重。
[0027]
在另一优选例中,所述的组合物中,所述预激活的msc的浓度为0.001-50
×
106个/kg体重,较佳地0.1-10
×
106个/kg体重,更佳地1-5
×
106个/kg体重。
[0028]
在另一优选例中,所述的载体选自下组:输液剂载体和/或注射剂载体,较佳地,所述的载体是选自下组的一种或多种载体:生理盐水、葡萄糖盐水、或其组合。
[0029]
在另有一优选例中,所述细胞制剂还包括gm-csf蛋白或其促进剂。
[0030]
在另一优选例中,所述gm-csf来源于msc、和/或t细胞。
[0031]
在另一优选例中,所述促进剂是指能够在体内或体外提高gm-csf蛋白的活性和/或含量的物质;所述物质可以为人工合成的或天然的化合物、蛋白、核苷酸等。
[0032]
在另一优选例中,所述gm-csf促进剂包括促进gm-csf表达的物质。
[0033]
在另一优选例中,所述促进gm-csf表达或活性指将gm-csf蛋白的表达或活性提高≥20%,较佳地,≥50%,更佳地,≥70%。
[0034]
在另一优选例中,所述gm-csf促进剂选自下组:小分子化合物、表达gm-csf的载体、或其组合。
[0035]
在另一优选例中,所述gm-csf促进剂选自下组:ifnγ、il-17、tnfα、或其组合。
[0036]
在另一优选例中,所述表达gm-csf的载体包括病毒载体。
[0037]
在另一优选例中,所述病毒载体选自下组:腺相关病毒载体、慢病毒载体、或其组合。
[0038]
在另一优选例中,所述的蛋白包括全长蛋白或蛋白片段。
[0039]
另一优选例中,所述的gm-csf蛋白来源于哺乳动物,更佳地来源于啮齿动物(如小鼠、大鼠)、灵长动物和人。
[0040]
在另一优选例中,所述gm-csf蛋白还包括gm-csf蛋白的衍生物。
[0041]
在另一优选例中,所述gm-csf蛋白的衍生物包括经修饰的gm-csf蛋白、氨基酸序列与天然gm-csf蛋白同源且具有天然gm-csf蛋白活性的蛋白分子、gm-csf蛋白的二聚体或多聚体、含有gm-csf蛋白氨基酸序列的融合蛋白。
[0042]
在另一优选例中,所述“氨基酸序列与天然gm-csf蛋白同源且具有天然gm-csf蛋白活性的蛋白分子”是指其氨基酸序列与gm-csf蛋白相比具有≥85%的同源性,较佳地≥90%的同源性,更佳地≥95%的同源性,最佳地≥98%同源性;并且具有天然gm-csf蛋白活性的蛋白分子。
[0043]
在另一优选例中,所述gm-csf蛋白选自下组:
[0044]
(a)氨基酸序列如seq id no.:1所示的多肽;
[0045]
(b)将seq id no.:1所示的氨基酸序列经过一个或几个(通常为1-60个,较佳地1-30个,更佳地1-20个,最佳地1-10个)氨基酸残基的取代、缺失或添加而形成的ecm1蛋白衍生物,或其活性片段;
[0046]
(c)序列与seq id no.:1所示的氨基酸序列相比,同源性≥90%,较佳地≥95%,更佳地≥98%,最佳地≥99%的gm-csf蛋白衍生物,或其活性片段。
[0047]
在另一优选例中,所述细胞制剂还包括其他促进伤口愈合的药物。
[0048]
在另一优选例中,所述其他促进伤口愈合的药物选自下组:蜂蜜、含有银离子的敷料、积雪苷片、云南白药、或其组合。
[0049]
本发明第二方面提供了一种药盒,包括:
[0050]
(i)第一容器,以及装于该第一容器中的活性成分(a)巨噬细胞,或含有活性成分(a)的药物;
[0051]
(ii)第二容器,以及装于该第二容器中的活性成分(b)预激活的msc,或含有活性成分(b)的药物;和
[0052]
(iii)说明书,所述说明书中记载了联合给予活性成分(a)和活性成分(b)从而促进创伤修复和伤口愈合、皮肤损伤、溃疡修复的说明。
[0053]
在另一优选例中,所述药盒还包括:
[0054]
(iv)第三容器,以及装于该第三容器中的活性成分(c)gm-csf蛋白或其促进剂,或含有活性成分(c)的药物。
[0055]
在另一优选例中,所述药盒还包括:
[0056]
(v)第四容器,以及装于该第四容器中的活性成分(d)其他促进伤口愈合的药物,或含其他促进伤口愈合的药物的药物。
[0057]
在另一优选例中,所述第一容器、第二容器、任选的第三容器、任选的第四容器可以相同,可以不同。
[0058]
在另一优选例中,所述的第一容器的药物是含巨噬细胞的单方制剂。
[0059]
在另一优选例中,所述的第二容器的药物是含预激活的msc的单方制剂。
[0060]
在另一优选例中,所述的第三容器是含gm-csf蛋白或其促进剂的单方制剂。
[0061]
在另一优选例中,所述第四容器是含其他促进伤口愈合的药物的单方制剂。
[0062]
在另一优选例中,所述药物的剂型为注射剂型。
[0063]
在另一优选例中,所述试剂盒还含有说明书,所述说明书中记载了联合给予活性成分(a)、活性成分(b)、任选的(c)和任选的(d)从而促进伤口愈合;创伤修复、皮肤损伤、溃疡修复的说明。
[0064]
在另一优选例中,所述含有(a)巨噬细胞的制剂中,所述巨噬细胞的浓度为0.01-50
×
106个/kg体重,较佳地1-30
×
106个/kg体重,更佳地2-20
×
106个/kg体重。
[0065]
在另一优选例中,所述含有(b)预激活的msc的制剂中,所述预激活的msc的浓度为0.01-100
×
106个/kg体重,较佳地1-80
×
106个/kg体重,更佳地5-50
×
106个/kg体重。
[0066]
在另一优选例中,所述含有(c)gm-csf蛋白或其促进剂的制剂中,所述gm-csf蛋白或其促进剂的浓度为0.1-100μg/kg体重,较佳地1-60μg/kg体重,更佳地2-30μg/kg体重。
[0067]
本发明第三方面提供了一种本发明第一方面所述的细胞制剂或本发明第二方面所述药盒的用途,用于制备组合物或药物,所述组合物或药物用于促进创口难愈性患者的伤口愈合。
[0068]
在另一优选例中,所述组合物或药物还用于选自下组的一种或多种用途:创伤修复、皮肤损伤、溃疡修复。
[0069]
本发明第四方面提供了一种药盒,包括:
[0070]
(a1)第一容器,以及位于所述第一容器中的治疗药物,所述治疗药物包括预激活的msc或含有msc和炎症因子的产品组合;和
[0071]
(b1)第二容器,以及位于所述第二容器中的巨噬细胞的检测试剂。
[0072]
在另一优选例中,所述药盒还含有gm-csf蛋白。
[0073]
在另一优选例中,所述炎症因子选自下组:ifnγ、il-17、tnfα、或其组合。
[0074]
在另一优选例中,所述的第一容器和第二容器是相同或不同的容器。
[0075]
在另一优选例中,所述的第一容器的药物是含治疗药物的单方制剂。
[0076]
在另一优选例中,所述检测试剂用于检测个体的创面中巨噬细胞的含量。
[0077]
在另一优选例中,所述药物的剂型为注射剂型、凝胶型或辅料型。
[0078]
在另一优选例中,所述药物的剂型为注射剂型。
[0079]
在另一优选例中,所述的试剂盒还含有说明书。
[0080]
在另一优选例中,所述个体包括创口难愈性的个体。
[0081]
在另一优选例中,所述说明书记载了选自下组的一个或多个说明:
[0082]
(a)当个体创面中的巨噬细胞的含量低于预定标准,则同时施用预激活的msc或含有msc和炎症因子的产品组合;和巨噬细胞;其中,预定标准指个体的创面中巨噬细胞的量n1/正常个体创面中巨噬细胞的量n2≤50%,较佳地,≤30%,更佳地,≤10%;
[0083]
(b)当个体创面中的巨噬细胞的含量高于预定标准,则施用预激活的msc;其中,预定标准指个体的创面中巨噬细胞的量n1/正常个体创面中巨噬细胞的量n2≤50%,较佳地,≤30%,更佳地,≤10%;
[0084]
(c)当个体创面中的msc的含量低于预定标准,则同时施用预激活的msc或含有msc和炎症因子的产品组合;和巨噬细胞;其中,预定标准指个体的创面中msc的量n1/正常个体创面中msc的量n2≤50%,较佳地,≤30%,更佳地,≤10%;
[0085]
(d)当个体创面中的msc的含量高于预定标准,则施用巨噬细胞;其中,预定标准指个体的创面中msc的量n1/正常个体创面中msc的量n2≤50%,较佳地,≤30%,更佳地,≤10%。
[0086]
本发明第五方面提供了一种确定治疗方案的方法,包括:
[0087]
a)提供来自受试者的测试样品;
[0088]
b)检测测试样品中巨噬细胞和/或msc的含量;和
[0089]
c)基于所述样品中的巨噬细胞和/或msc的含量来确定治疗方案。
[0090]
在另一优选例中,所述的受试者为人或非人哺乳动物。
[0091]
在另一优选例中,所述受试者包括创口难愈性的受试者。
[0092]
在另一优选例中,当所述样品中的巨噬细胞的含量低于预定标准,所述治疗方案包括同时施用预激活的msc或含有msc和炎症因子的产品组合;和巨噬细胞,其中,预定标准指个体的创面中巨噬细胞的量n1/正常个体创面中巨噬细胞的量n2≤50%,较佳地,≤30%,更佳地,≤10%。
[0093]
在另一优选例中,当所述样品中的巨噬细胞的含量高于预定标准,所述治疗方案包括施用预激活的msc,其中,预定标准指个体的创面中巨噬细胞的量n1/正常个体创面中巨噬细胞的量n2≤50%,较佳地,≤30%,更佳地,≤10%。
[0094]
在另一优选例中,当所述样品中的msc的含量低于预定标准,所述治疗方案包括同时施用预激活的msc或含有msc和炎症因子的产品组合;和巨噬细胞,其中,预定标准指个体的创面中msc的量n1/正常个体创面中msc的量n2≤50%,较佳地,≤30%,更佳地,≤10%。
[0095]
在另一优选例中,当所述样品中的msc的含量高于预定标准,所述治疗方案包括施用巨噬细胞,其中,预定标准指个体的创面中msc的量n1/正常个体创面中巨噬细胞的量n2≤50%,较佳地,≤30%,更佳地,≤10%。
[0096]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0097]
图1显示了基于mscs的皮肤创伤治疗效果与创伤组织细胞因子的浓度有关。
bioplex测定mscs治疗皮肤创伤的第3天组织间质液中细胞因子浓度,并分析其与伤口面积的关系。根据细胞因子类型分为(a)促炎因子ifn-γ、tnf-α、il17a、il1α、il1β和il6的局部浓度与伤口面积的相关性分析。(b)抑炎因子il-4和il10的局部浓度与伤口面积的相关性分析。(c)趋化因子ccl2、ccl3、ccl5和cxcl1的局部浓度与伤口面积的相关性分析。
[0098]
图2显示了ifn-γ、tnf-α和il17a预激活mscs能更好地促进皮肤创伤愈合。(a)实验进程表:ifn-γ、tnf-α和il17a三因子联合体外激活mscs,获得均一化高度激活的mscs,然后再进行伤口周边皮下组织注射,连续记录伤口愈合全程。(b)各治疗组伤口闭合进程。(c)image j定量分析伤口面积的统计值。(d)h&e染色分析创伤后第5天各治疗组的再上皮化情况(红色框中的区域;标尺,200μm)。(e)image j定量分析再上皮化距离的统计值。(f)anti-cd31免疫组织化学染色分析创伤后第5天各治疗组的血管新生情况(标尺,50μm)。图中primsc,即ifn-γ、tnf-α和il17a三因子联合体外激活mscs。
[0099]
图3显示了ifn-γ、tnf-α和il17a预激活mscs促进糖尿病小鼠皮肤创伤愈合。给予6周龄c57bl/6雄性小鼠进行高脂饲料喂养16周。(a)葡萄糖耐受试验确认糖尿病小鼠模型的建立情况。(b)在糖尿病小鼠皮肤创伤模型上,各治疗组伤口闭合进程。(c)image j定量分析糖尿病小鼠伤口面积的统计值。(d)image j定量分析糖尿病小鼠创伤组织中再上皮化距离的统计值。图中primsc,即ifn-γ、tnf-α和il17a三因子联合体外激活mscs。
[0100]
图4显示了预激活mscs治疗的皮肤创伤组织中有增多的巨噬细胞浸润。对皮肤创伤组织及接受msc或primsc治疗的皮肤创伤组织进行免疫细胞群流式分析。(a)创伤后第3天,组织中的免疫细胞主要为cd11b阳性的免疫细胞。(b)创伤后第5天,组织中巨噬细胞和中性粒细胞比例分析。(c-d)流式分析不同治疗组第5天巨噬细胞的浸润比例和统计分析结果。(e)anti-f4/80免疫组织化学染色分析创伤后第5天各治疗组的巨噬细胞浸润情况。图中primsc,即ifn-γ、tnf-α和il17a三因子联合体外激活mscs。
[0101]
图5显示了巨噬细胞介导预激活mscs的皮肤创伤治疗效果。建立巨噬细胞清除小鼠的皮肤创伤模型,进行mscs治疗或者巨噬细胞回补治疗。(a)尾静脉注射200μl氯膦酸盐脂质体,48小时后分析小鼠外周血和骨髓里巨噬细胞的比例和清除情况。(b)实验计划表:第一针氯膦酸盐脂质体后24小时,建立皮肤创伤模型,随后,ifn-γ、tnf-α和il17a三因子联合体外激活mscs,或者预激活mscs条件培养基培养的巨噬细胞,进行伤口周边皮下组织注射,连续记录伤口愈合全程。(c)各治疗组伤口愈合进程。(d)image j定量分析伤口面积的统计值。(e)h&e染色分析创伤后第5天各治疗组的再上皮化情况(红色框中的区域;标尺,200μm)。(f)image j定量分析再上皮化距离的统计值。(g)anti-cd31免疫组织化学染色分析创伤后第5天各治疗组的血管新生情况(标尺,50μm)。cl-:氯磷酸盐脂质体注射组;ctrl-:对照脂质体注射组。图中primsc,即ifn-γ、tnf-α和il17a三因子联合体外激活mscs。
[0102]
图6显示了gm-csf是介导预激活mscs对巨噬细胞驯化的潜在效应因子。为了探究预激活mscs驯化巨噬细胞的分子机制,借助bioplex在体外共培养实验系统中筛选潜在因子,并详细分析其对巨噬细胞调控的可能性。(a)浓缩预激活mscs条件培养基剂量依赖性地促进巨噬细胞arginase1和hif1α表达。(b)bioplex筛选预激活mscs条件培养基中潜在效应因子。(c)gm-csf浓度依赖性地促进巨噬细胞arginase1和hif1α的表达。(d)gm-csf在预激活mscs和mscs中的的mrna和蛋白水平表达量。(e)gm-csf受体在巨噬细胞和mscs中的表达
量。(f)gm-csf在共培养体系里的巨噬细胞和mscs中的表达量。
[0103]
图7显示了gm-csf介导预激活mscs对巨噬细胞的驯化作用。(a)采用gm-csf中和抗体拮抗mscs体外共培养体系中的gm-csf。(b)gm-csf中和抗体显著降低预激活mscs调控的巨噬细胞中arginase1、hif1a的mrna表达水平。(c)采用crispr/cas9技术构建csf2缺失的mscs(csf2-ko)。(d)csf2缺失的mscs(csf2-ko mscs)在ifn-γ、tnf-α和il17a的刺激下不再具备促进巨噬细胞高表达arginase1和hif1α的能力。(e)与预激活mscs共培养或利用gm-csf刺激均可以促进巨噬细胞的stat5磷酸化及arginase1的表达。图中primsc,即ifn-γ、tnf-α和il17a三因子联合体外激活mscs。
[0104]
图8显示了gm-csf是预激活mscs有效治疗皮肤损伤的关键分子。已证明预激活mscs分泌的gm-csf驯化了巨噬细胞。那么预激活mscs来源的gm-csf在体内创伤修复模型中是否具有相关性。我们检测了gm-csf在创伤修复中的变化及不同治疗组的组织中gm-csf浓度,并探究了csf2缺失的mscs对皮肤创伤的治疗效果。(a)正常皮肤创伤愈合进程中创伤组织gm-csf浓度的动态变化。(b)不同mscs治疗组的第5天创伤组织gm-csf浓度。(c)不同csf2缺失mscs治疗组伤口闭合进程,预激活mscs治疗组为阳性对照。(d)image j定量分析伤口面积的统计值。(e)h&e染色分析创伤后第5天各治疗组的再上皮化情况(红色框中的区域;标尺,200μm)。(f)image j定量分析再上皮化距离的统计值。(g)anti-cd31免疫组织化学染色分析创伤后第5天各治疗组的血管新生情况(标尺,50μm)。(h)anti-f4/80免疫组织化学染色分析创伤后第5天各治疗组的巨噬细胞浸润(标尺,50μm)。
[0105]
图9显示了过表达gm-csf(csf2)的mscs显著促进创伤愈合。(a)构建csf2质粒,给与mscs过表达csf2(csf2-oe msc)。(b)与pbs组和对照组mscs相比较,csf2-oe mscs治疗组伤口闭合进程。(c)image j定量分析伤口面积的统计值。
具体实施方式
[0106]
本发明人经过长期而深入的研究,意外地发现,ifn-γ,tnf-α和il17a体外预激活的msc可显著加速皮肤创伤(尤其是难治愈性的创伤)的愈合,并且,申请人还意外的发现,预激活的msc可驯化巨噬细胞,从而促进皮肤创伤修复,并且,预激活mscs来源的gm-csf介导了其对巨噬细胞的驯化,进而促进皮肤创伤愈合。在此基础上,本发明人完成了本发明。
[0107]
msc
[0108]
间充质干细胞(mesenchymal stem cells,mscs)是一类具有自我更新和多向分化潜能的组织干细胞。此外,mscs还拥有强大的免疫调节能力,即mscs被炎症因子ifn-γ和tnf-α激活而分泌的多种免疫抑制分子如no、ido和生长因子vegf、fgf和egf等,能够影响免疫细胞的活化、增殖及功能。皮肤创伤愈合是免疫系统全面参与的组织再生过程,需要严格的免疫调节及适度的细胞增殖分化来实现组织修复。mscs因其来源广泛且易培养、低免疫原性、多向分化能力和强大的免疫调节能力,被广泛用于皮肤创伤治疗的研究。
[0109]
预激活的msc
[0110]
在本发明中,所述预激活的msc指在炎症因子(如ifn-γ、il17a、和/或tnf-α)的存在下激活msc,所获得的msc为预激活的msc。
[0111]
mscs经10ng/ml的ifnγ、tnfα和il17a的处理16小时获得充分激活的mscs。
[0112]
巨噬细胞
[0113]
在本发明中,巨噬细胞包括野生型的巨噬细胞和驯化的巨噬细胞。
[0114]
在本发明中,所述驯化的巨噬细胞指用预激活的msc驯化巨噬细胞,从而获得呈现显著升高的arginase1,hif1α,mmp9,cd206和ddit4的促进组织修复基因表型和显著的促进血管新生的功能表型的驯化的巨噬细胞。
[0115]
gm-csf蛋白或其促进剂
[0116]
本发明涉及一种gm-csf蛋白及其变体,在本发明的一个优选例中,所述gm-csf蛋白的氨基酸序列如seq id no.:1或2所示。本发明的gm-csf蛋白或其促进剂可制备促进伤口(尤其是难治性伤口)愈合的组合物或制剂。
[0117]
本发明还包括与本发明的seq id no.:1或2所示序列具有50%或以上(优选60%以上,70%以上,80%以上,更优选90%以上,更优选95%以上,最优选98%以上,如99%)同源性的具有相同或相似功能的多肽或蛋白。
[0118]
其中,seq id no.:1为人源gm-csf蛋白,seq id no.:2为鼠源gm-csf蛋白。
[0119]
人源gm-csf序列:
[0120]
mwlqsllllgtvacsisaparspspstqpwehvnaiqearrllnlsrdtaaemnetvevisemfdlqeptclqtrlelykqglrgsltklkgpltmmashykqhcpptpetscatqiitfesfkenlkdfllvipfdcwepvqe(seq id no.:1)
[0121]
鼠源gm-csf序列:
[0122]
mwlqnllflgivvyslsaptrspitvtrpwkhveaikealnllddmpvtlneevevvsnefsfkkltcvqtrlkifeqglrgnftklkgalnmtasyyqtycpptpetdcetqvttyadfidslktfltdipfeckkpgqk(seq id no.:2)
[0123]
所述“相同或相似功能”主要是指:“促进伤口(尤其是难治性伤口)的愈合”。
[0124]
本发明的蛋白可以是重组蛋白、天然蛋白、合成蛋白。本发明的蛋白可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生。根据重组生产方案所用的宿主,本发明的蛋白可以是糖基化的,或可以是非糖基化的。本发明的蛋白还可包括或不包括起始的甲硫氨酸残基。
[0125]
本发明还包括具有gm-csf蛋白活性的gm-csf蛋白片段和类似物。如本文所用,术语“片段”和“类似物”是指基本上保持本发明的天然gm-csf蛋白相同的生物学功能或活性的蛋白。
[0126]
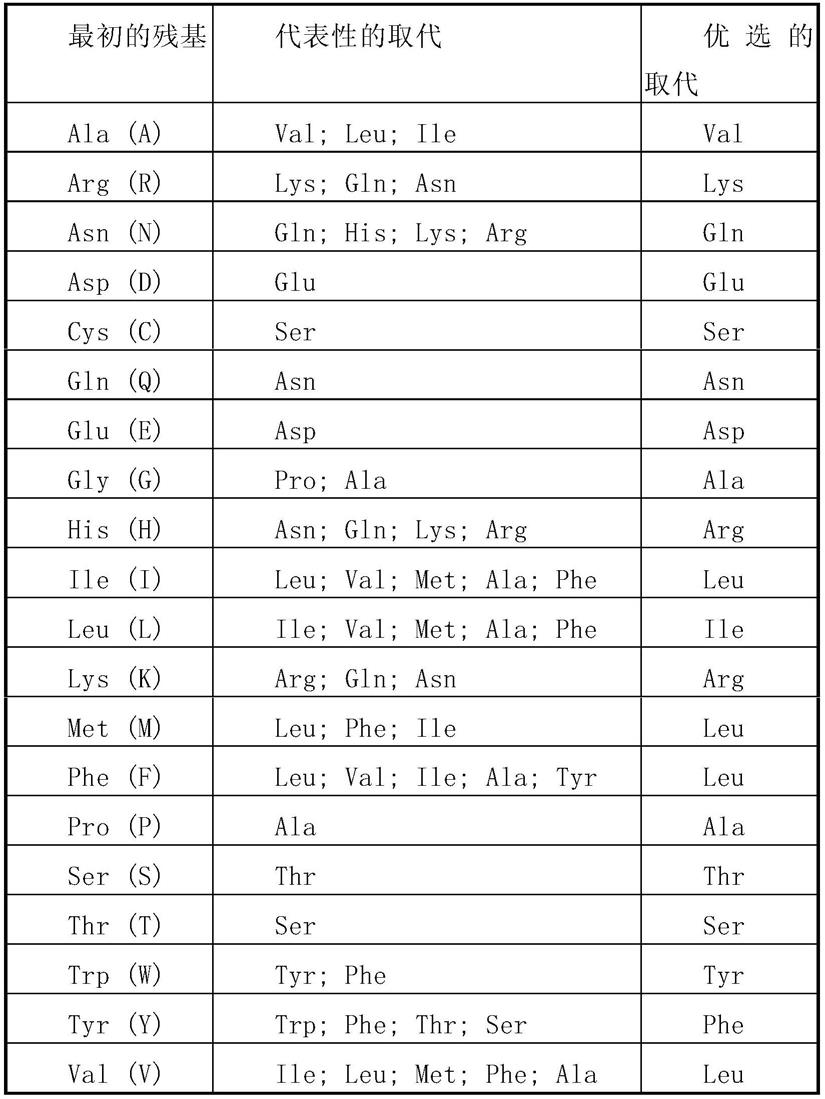
本发明的突变蛋白片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的突变蛋白,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的突变蛋白,或(iii)成熟突变蛋白与另一个化合物(比如延长突变蛋白半衰期的化合物,例如聚乙二醇)融合所形成的突变蛋白,或(iv)附加的氨基酸序列融合到此突变蛋白序列而形成的突变蛋白(如前导序列或分泌序列或用来纯化此突变蛋白的序列或蛋白原序列,或与抗原igg片段的形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。本发明中,保守性替换的氨基酸最好根据表i进行氨基酸替换而产生。
[0127]
表i
[0128][0129]
本发明还包括与本发明的天然gm-csf蛋白具有50%或以上(优选60%以上,70%以上,80%以上,更优选90%以上,更优选95%以上,最优选98%以上,如99%)同源性的具有相同或相似功能的多肽或蛋白。在蛋白质变体可以经过若干个(通常为1-60个,较佳地1-30个,更佳地1-20个,最佳地1-10个)取代、缺失或添加至少一个氨基酸所得的衍生序列,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在所述蛋白中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能,在c末端和/或\末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。本发明包括天然gm-csf蛋白类似物与天然gm-csf蛋白的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。这些蛋白的类似物包括天然或
诱导的遗传变异体。诱导变异体可以通过各种技术得到,如通过辐射或暴露于诱变剂而产生随机诱变,还可通过定点诱变法或其他已知分了生物学的技术。类似物还包括具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的蛋白并不限于上述例举的代表性蛋白。
[0130]
修饰(通常不改变一级结构)形式包括:体内或体外蛋白的化学衍生形式如乙酸化或羧基化。修饰还包括糖基化,如那些在蛋白质合成和加工中进行糖基化修饰。这种修饰可以通过将蛋白暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。此外,还可以对本发明突变蛋白进行修饰。修饰(通常不改变一级结构)形式包括:体内或体外的突变蛋白的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在突变蛋白的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的突变蛋白。这种修饰可以通过将突变蛋白暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的突变蛋白。
[0131]
本发明还提供了编码gm-csf蛋白的多核苷酸序列。本发明的多核苷酸可以是dna形式或rna形式。dna形式包括:dna、基因组dna或人工合成的dna,dna可以是单链的或是双链的。编码成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽的片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的多肽的功能。
[0132]
本发明的蛋白或多核苷酸优选以分离的形式提供,更佳地,被纯化至均质。
[0133]
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
[0134]
在本发明中,gm-csf促进剂包括能够在体内或体外提高gm-csf蛋白的活性和/或含量的物质。
[0135]
其中,可通过下述方法增加gm-csf的表达量:组织自身分泌大量gm-csf蛋白或人工过表达gm-csf蛋白、或者人工输送gm-csf蛋白(比如,用病毒载体,如腺相关病毒载体)或者gm-csf促进剂。
[0136]
在本发明中,所述gm-csf促进剂没有特别限制,只要能够促进gm-csf的表达或者增强gm-csf蛋白活性都在本发明的保护范围内。
[0137]
在一优选实施方式中,所述gm-csf促进剂包括小分子化合物。
[0138]
药物组合物(细胞制剂)
[0139]
本发明还提供了一种药物组合物,它含有有效量的巨噬细胞;预激活的msc,以及药学上可接受的载体。
[0140]
在本发明中,在个体损伤原位,施用的巨噬细胞与预激活的msc的细胞数量之比为1000:1-1:10,较佳地,100:1-1:1。
[0141]
在作为细胞制剂整体施用时,施用的巨噬细胞与预激活的msc的细胞数量之比为1:1000-1:100,较佳地,1:100-1:10,更佳地,1:10-1:1。
[0142]
在一优选实施方式中,所述药物组合物还包括gm-csf蛋白或其促进剂。
[0143]
在一优选实施方式中,所述药物组合物还包括其他促进伤口愈合的药物选自下组:蜂蜜、含有银离子的敷料、积雪苷片、云南白药、或其组合。
[0144]
通常,可将巨噬细胞和预激活的msc配制于无毒的、惰性的和药学上可接受的水性载体介质中,如生理盐水中,其中ph通常约为5-8,较佳地,ph约为7-8。
[0145]
如本文所用,术语“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。在本发明的优选实施例中,所述的有效量为:1.0
×
10
3-1.0
×
109个/ml,较佳地1.0
×
10
4-1.0
×
108个/ml,更佳地1.0
×
10
5-1.0
×
107个/ml。优选地,所述的有效量细胞一次性注射完毕。
[0146]
如本文所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括。在本发明中,可以使用的药学上可接受的载体并没有特别的限制,可以是一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的脂肪间充质祖细胞相互掺和,而不明显降低其治疗效果。本发明药学上可以接受的载体部分例子有生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,和用于重新溶解成无菌的可注射溶液或分散液的无菌粉末,适宜的含水和非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。除了上述的常规载体外,也可以根据脂肪间充质祖细胞的性质设计优化的载体。所述的载体优选为输液剂载体和/或注射剂载体。
[0147]
本发明的药物组合物含有安全有效量的巨噬细胞和预激活的msc,以及药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。活性成分的给药量是治疗有效量。本发明的药物制剂还可制成缓释制剂。
[0148]
本发明所述巨噬细胞和预激活的msc的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。
[0149]
本发明的药物组合物优选为静脉注射试剂。在另一优选例中,所述的静脉注射试剂中,巨噬细胞的浓度为1.0
×
10
3-1.0
×
109个/ml,较佳地1.0
×
10
4-1.0
×
108个/ml,更佳地1.0
×
10
5-1.0
×
107个/ml,所述预激活的msc的浓度为1.0
×
10
3-1.0
×
10
10
个/ml,较佳地1.0
×
10
4-1.0
×
109个/ml,更佳地1.0
×
10
5-1.0
×
108个/ml。所述的药物组合物的注射方式没有特别限制,可以是单次注射制剂,也可以是多次注射的制剂组合。在本发明的一种优选实施例中,所述的药物组合物为单次注射剂。在一优选实施方式中,所述的药物组合物为局
部给药剂型。
[0150]
在本发明中,所述的药物组合物优选为静脉注射制剂。
[0151]
本发明的主要优点包括:
[0152]
(1)本发明首次发现,将巨噬细胞(包括野生型的巨噬细胞和驯化的巨噬细胞)和预激活的msc联用,促进创伤组织血管新生,进而促进皮肤创伤(尤其是慢性不愈伤口)的愈合。
[0153]
(2)本发明首次发现,mscs来源的gm-csf是预激活mscs治疗皮肤创伤必需的效应因子。
[0154]
(3)本发明首次发现,预激活的msc可驯化巨噬细胞,使之呈现显著升高的arginase1,hif1α等促进组织修复的基因表型和显著的促进血管新生的功能表型。
[0155]
(4)本发明首次发现,预激活mscs来源的gm-csf介导了其对巨噬细胞的驯化,进而促进皮肤创伤愈合。
[0156]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0157]
实施例中用到的材料和试剂如无特殊说明,均为市售产品。
[0158]
1实验材料
[0159]
1.1试剂
[0160]
表2-1实验试剂
[0161]
[0162]
[0163]
[0164]
[0165]
[0166][0167]
1.2实验动物
[0168]
balb/c品系和c57bl/6品系小鼠,雄性8-10周,购自上海灵畅实验动物中心;所有小鼠饲养在中国科学院上海生命研究院健康所实验动物平台的spf级屏障环境。所有动物实验中,小鼠性别和周龄都是一致的。所有动物实验都经过了中国科学院上海生命科学研究院动物伦理委员会的审查并获得了许可。
[0169]
1.3主要耗材及仪器
[0170]
表2-2主要仪器与耗材
[0171]
[0172][0173]
2实验方法
[0174]
2.1细胞完全培养基及溶液配制
[0175]
(1)完全培养基:dmem或者dmem/f12培养基加入10%的fbs、100u/ml青霉素、100u/ml链霉素和2mm l-谷氨酰胺。
[0176]
(2)细胞冻存液:10%dmso+90%fbs
[0177]
(3)pbs缓冲液:磷酸二氢钾0.2g,氯化钾0.2g,磷酸氢二钠1.16g,氯化钠8.0g,先加入900ml双蒸水,溶解后,调节溶液ph值至7.4,最后定容到1000ml。
[0178]
(4)流式染色缓冲液:pbs中加入2%fbs(体积比)。
[0179]
(5)ripa细胞裂解液:原液加入proteinase inhibitor和1mm的pmsf(现配现用)。
[0180]
(6)10
×
蛋白电泳缓冲液:甘氨酸187.7g,tris 30.3g和sds 10g溶解于900ml双蒸水中,然后定容至1000ml。
[0181]
(7)10
×
蛋白电转移缓冲液:甘氨酸144.2g和tris 30.3g溶解于900ml双蒸水中,然后定容至1000ml。临用前将10
×
蛋白电转移缓冲液:甲醇:双蒸水以1:2:7混合配制1
×
工作缓冲液。
[0182]
(8)tbst缓冲液:tbs粉末按说明书溶于双蒸水,加入0.1%的tween-20(体积比)
[0183]
2.2小鼠骨髓来源msc的分离与培养
[0184]
将小鼠安乐死,经75%酒精浸泡1-2min消毒处理,然后用手术剪刀与医用眼科镊子小心剥离小鼠腿部的肌肉,分离出股骨与胫骨。使用剪刀剪掉股骨和胫骨的两端,留下空
腔,即可见骨内骨髓。随后用1ml注射器针头将骨内的骨髓冲出到pbs缓冲液中。最后用移液枪将骨髓团块吹散成单个细胞,300g离心5min,弃上清,细胞团块用dmem低糖完全培养基将细胞重悬,显微镜下计数,然后以5
×
106/cm2的细胞密度铺到10cm培养皿中,于细胞培养箱中37℃培养。24小时后,更换培养基以去除未贴壁细胞,pbs洗两遍,加入新鲜的完全低糖培养基,贴壁细胞继续培养,后续每隔一到两天更换一次培养基。待细胞长满后,0.25%胰蛋白酶消化贴壁细胞,用96孔板稀释法挑选单细胞克隆并进行扩增。通过流式分析细胞表面标志物cd34-cd11b-cd11c-cd45-mhc class ii-且cd44
+
sca-1
+
mhc class i
low
以及成脂、成骨和成软骨分化能力来鉴定获得的细胞克隆。本研究中使用的所有间充质干细胞均为20代以内。
[0185]
2.3小鼠皮肤创伤模型
[0186]
将8-10周的雄性balb/c小鼠用三溴乙醇麻醉后,借助电动剃毛刀剃除小鼠背部体毛,随后用医用碘伏擦拭消毒小鼠背部皮肤,用直径为6mm的生物取样器在小鼠正背部(远离腹部和皮下脂肪密集的区域)进行背部皮肤全皮层切除,搓动伤口周边确认没有伤到肌肉层和大出血。再次用医用碘伏擦拭消毒后将小鼠放于37℃热板上,待小鼠苏醒后转入小鼠饲养笼盒中。糖尿病小鼠皮肤创伤模型使用高脂饲料喂养16周的雄性c57bl/6小鼠,经葡萄糖耐受实验确认有糖尿病症状后,采用上述皮肤创伤制作方式进行模型建立。巨噬细胞删除小鼠皮肤创伤模型是在尾静脉注射200μl的氯膦酸盐脂质体后24小时,采用上述皮肤创伤制作方式进行模型建立。后续数据记录:创伤后的第一个24小时开始,每隔48小时将小鼠麻醉,在统一刻度标尺为长度内参的条件下对小鼠伤口进行拍照记录。直至最好治疗组的所有小鼠伤口结痂都自然脱落时,终止实验。
[0187]
2.4蛋白因子分析
[0188]
2.4.1bioplex高通量细胞因子蛋白定量系统
[0189]
(1)将收取的小鼠皮肤创伤组织经液氮冻存,然后根据组织重量,在加有钢珠和组织的管子中加入预冷的含有proteinase inhibitor和1mm pmsf的pbs缓冲液(每0.1g组织加入1ml缓冲液),然后使用研磨机打碎,12000rpm,于4℃离心15min,上清即为组织间质液,用于细胞因子检测。
[0190]
(2)取出bioplex专用96孔板,使用排枪将结合了抗体的磁珠加到孔板中,并将96孔板放于磁力架上,放置片刻,借助磁力架的力量保留磁珠,甩掉液体。
[0191]
(3)取下96孔板,在每孔中加入wash buffer,置于磁力架片刻,甩掉液体。
[0192]
(4)将试剂盒中的标准品依次稀释,配置8个浓度梯度用于制作标准曲线。
[0193]
(5)按顺序在铺好磁珠的96孔板中加入50μl标准品及样品。
[0194]
(6)用密封膜封住孔板,盖紧盖子,使用小型涡旋震荡仪800rpm震动数秒震起磁珠,使磁珠充分接触样品中的蛋白,300rpm慢摇孵育2小时。
[0195]
(7)96孔板放于磁力架上甩掉液体。
[0196]
(8)100μl wash buffer洗三次。
[0197]
(9)每孔中加入25μl连接着生物素的检测抗体,封好密封膜,盖紧盖子。使用小型涡旋震荡仪800rpm震动数秒震起磁珠,使检测抗体充分接触留下的结合了磁珠的蛋白,300rpm慢摇孵育60min。
[0198]
(10)使用assay buffer配检测用链亲和素-pe检测荧光染料,避光,混匀。
[0199]
(11)孵育结束的96孔板用100μl wash buffer洗三次,去除非特异性结合。
[0200]
(12)每孔快速加入50μl链亲和素-pe,使用小型涡旋震荡仪800rpm震动数秒震起磁珠,使链亲和素充分接触结合了样本的生物素,300rpm慢摇孵育30min。
[0201]
(13)96孔板放于磁力架上甩掉液体,100μl wash buffer洗三次。
[0202]
(14)每孔加入125μl assay buffer.
[0203]
(15)封好密封膜,盖紧盖子,高速震荡,800~900rpm震30sec。
[0204]
(16)去掉盖子以及密封膜,准备上机。
[0205]
(17)经bioplex特异性的机器及软件读取荧光信号,获取原始数据进行分析。
[0206]
2.4.2酶联免疫吸附试验(enzyme linked immunosorbent assay,elisa)
[0207]
根据试剂盒中说明书进行细胞因子浓度的检测:
[0208]
(1)包被孔板:提前一天将试剂盒中的capture antibody稀释到工作液浓度,立即将稀释好的抗体铺到96孔板中,100μl/孔,密封后室温孵育过夜。
[0209]
(2)撕掉密封膜,弃掉液体,wash buffer洗两遍,200μl/孔。
[0210]
(3)封闭:将reagent di luent加到孔板中进行封闭,200μl/孔,室温最少孵育60min。
[0211]
(4)弃掉液体,wash buffer洗两遍,200μl/孔。
[0212]
(5)标准品处理:将试剂盒中的标准品溶解,并梯度稀释产生多个浓度,用于制作检测用标准曲线。
[0213]
(6)用reagent diluent将样品稀释至合适的浓度,每孔中加入100μl待测浓度的样品以及标准品,密封后室温孵育2小时。
[0214]
(7)弃掉液体,wash buffer洗两遍,200μl/孔。
[0215]
(8)每孔加入100μl生物素连接的detection antibody,密封后室温孵育60min。
[0216]
(9)弃掉液体,wash buffer洗两遍,200μl/孔。
[0217]
(10)每孔加入100μl稀释好的streptavidin-hrp检测液,密封后室温孵育30min,避光放置。
[0218]
(11)弃掉液体,wash buffer洗两遍,200μl/孔。
[0219]
(12)每孔加入100μl底物substrate solution,室温孵育20min,避光放置。
[0220]
(13)增加50μl终止反应液stop solution,轻轻摇晃以混匀液体。
[0221]
(14)酶标仪在450nm波长下测定吸光度值。根据标准品浓度及其吸光度值产生标准曲线,再根据标准曲线计算样品中相应因子的浓度值。
[0222]
2.5免疫组织化学分析
[0223]
(1)将小鼠安乐死处理后,使用剃毛刀将小鼠伤口附近的毛发清理干净,用手术剪刀根据伤口位置剪下相应大小的小鼠皮肤创伤组织。
[0224]
(2)将皮肤创伤组织置于4%多聚甲醛溶液中固定24-48小时。
[0225]
(3)将组织转移至包埋框中,自来水冲洗4~6小时,以完全去除组织上残留的多聚甲醛。
[0226]
(4)脱水:自来水冲洗结束后转入70%乙醇,过夜放置;然后经过一系列脱水过程包括:80%乙醇放置120min;85%乙醇90min;90%乙醇40min;95%乙醇30min;无水乙醇1放置30min;无水乙醇2放置30min。
[0227]
(5)透明:二甲苯1放置30min;二甲苯2放置30min。
[0228]
(6)打开包埋机,提前融化机箱中的石蜡。
[0229]
(7)浸蜡:石蜡1中浸60min;石蜡2中浸60min。
[0230]
(8)包埋:沿伤口长轴将创伤组织横切开,然后以切口为底将组织立起来包埋于同一石蜡块内。自然凝蜡后,经-20℃冻存10min后,剥离包埋铁盒。
[0231]
(9)切片:石蜡块修平,切片设置5μm的厚度。
[0232]
(10)展片:42℃的水上漂片,使蜡片展开,保证组织未折叠。
[0233]
(11)捞片:将5μm的组织切片贴到载玻片上。
[0234]
(12)烤片:将贴好的组织切片放到60℃烘箱中1~2小时烘片,以使组织完全贴合到载玻片上。
[0235]
(13)脱蜡:切片置于二甲苯中40min以上,以去除组织周围及组织内部的石蜡,可根据室温调整时间长短。
[0236]
(14)复水:无水乙醇3min;90%乙醇2min;80%乙醇2min;70%乙醇2min;蒸馏水3min。
[0237]
此处获得脱蜡复水后的组织切片,后续操作根据不同的实验目的分别进行如下操作:
[0238]
2.5.1h&e染色
[0239]
(1)复水后将组织切片在苏木素染液中放置4min。
[0240]
(2)自来水冲洗,在1%盐酸酒精中轻蘸几下去掉浮色。
[0241]
(3)立即转入自来水中泡洗5min以上,尽可能洗去胞浆中的苏木素。
[0242]
(4)伊红染色2min,自来水冲洗几下。
[0243]
(5)脱水:95%乙醇20sec;无水乙醇20sec。
[0244]
(6)迅速转入二甲苯中透明。
[0245]
(7)中性树胶封片。
[0246]
2.5.2免疫组织化学染色
[0247]
(1)复水后,将组织切片置于配置好的ph为6.0的枸橼酸缓冲液中进行抗原修复,98℃水浴20min。
[0248]
(2)自然冷却至室温,3%过氧化氢浸泡20min,清除内源的过氧化物酶。
[0249]
(3)用pbs浸泡洗片子3遍,每次5min。然后用5%bsa封闭30min。
[0250]
(4)吸掉bsa后加入稀释后的一抗,4℃孵育过夜。
[0251]
(5)pbs浸泡洗3遍,加入稀释后的二抗(hrp连接),孵育30min。
[0252]
(6)pbs浸泡洗3遍,加入提前配好的aec底物显色液,20min左右,镜下观察确定时间。
[0253]
(7)pbs浸泡洗3遍,苏木素复染细胞核10sec。
[0254]
(8)自来水冲洗15min后,直接用aec水性封片剂封片。并于48小时内完成拍照分析。
[0255]
2.6皮肤创伤组织单细胞悬液制备及流式分析或磁珠分选
[0256]
将小鼠安乐死处理后,使用剃毛刀将小鼠伤口附近的毛发清理干净,用手术剪刀根据伤口位置剪下相应大小的小鼠皮肤创伤组织。用手术剪刀将组织剪碎后,转移入15ml
离心管,按每个伤口创伤组织3ml的量加入混合型胶原酶,37℃摇床内100rpm消化半小时。随后,消化混合液经70μm滤网过滤,600g离心5min,弃上清,用5ml pbs重悬细胞团沉淀后,400g离心5min,清洗一次之后。再用1ml pbs缓冲液重悬细胞团获得皮肤创伤组织单细胞悬液。后续根据实验目的进行不同的操作:
[0257]
2.6.1流式分析
[0258]
单细胞悬液细胞计数后,根据实验目的将单细胞悬液均匀分到各抗体组合染色组,细胞团400g离心5min后,每106细胞加入50μl未标记的anti-cd16/32抗体封闭巨噬细胞表面的非特异性受体。然后用不同的颜料标记的流式抗体组合配制于流式染色缓冲液中,在anti-cd16/32封闭10min后,加入抗体组合染色液,4℃条件下染色30min以上,pbs缓冲液清洗非特性结合的抗体两次后,进行流式上机分析。
[0259]
2.7巨噬细胞制备
[0260]
2.7.1骨髓来源的巨噬细胞
[0261]
将小鼠安乐死,经75%酒精浸泡1-2min消毒处理,然后用手术剪刀与医用眼科镊子小心剥离小鼠腿部的肌肉,分离出股骨与胫骨。使用剪刀剪掉股骨和胫骨的两端,留下空腔,即可见骨内骨髓。随后用1ml注射器针头将骨内的骨髓冲出到pbs中。最后用移液枪将骨髓团块吹散成单个细胞,300g离心5min,弃上清,细胞团块用骨髓巨噬细胞分化培养基将细胞重悬,将铺到无包被的10cm培养皿中,于细胞培养箱中37℃培养。骨髓巨噬细胞诱导分化培养基是由dmem/f12完全培养基与富含m-csf的l929细胞培养上清以4:1的比例配置,分化培养至第3天时每盘细胞补加5ml诱导分化培养基。到第七天时,贴壁的细胞即为分化成熟的巨噬细胞,pbs洗2遍后,轻轻吹下贴壁细胞,400g离心5min后,dmem/f12完全培养基重悬巨噬细胞用于后续实验。
[0262]
2.7.2腹腔来源的巨噬细胞
[0263]
给6~8周c57bl/6小鼠腹腔注射2ml灭菌处理的4%巯基乙酸盐(thioglycollate,ftg)。72小时后脱颈法将小鼠安乐死,经75%酒精浸泡1-2分钟消毒处理,用剪刀镊子小心打开小鼠腹部皮肤,用注射器向小鼠腹腔注射10ml pbs,轻轻摇晃小鼠腹部,再用注射器慢慢吸出腹腔灌洗液,400g离心5min,弃掉上清,用dmem/f12完全培养基重悬细胞团,细胞计数后铺到孔板中,2小时后细胞换液,pbs洗3遍,洗去不贴壁的细胞,剩下的贴壁细胞即为腹腔来源的巨噬细胞,加入dmem/f12完全培养基37℃静息培养24小时后,根据实验安排进行后续实验。
[0264]
2.8载体构建及慢病毒包装
[0265]
2.8.1基于crispr/cas9的csf2基因敲除慢病毒载体构建:
[0266]
(1)根据实验用慢病毒载体lenticrisprv2puro的特性,在张锋实验室网页(https://zlab.bio/guide-design-resources/)在线设计针对csf2的1号和3号外显子的小向导rna(sgrna)。e1-sg81:ccggccttggaagcatgtagagg;(seq id no.:3)
[0267]
e3-sg94:atattcgagcagggtctacgggg;(seq id no.:4)
[0268]
根据bsmⅰ酶切特性,在sgrna序列两端分别加上特定的碱基:
[0269]
sg81s:caccgccggccttggaagcatgtag(seq id no.:5)
[0270]
sg81a:aaacctacatgcttccaaggccggc(seq id no.:6)
[0271]
sg94s:caccgatattcgagcagggtctac(seq id no.:7)
[0272]
sg94a:aaacgtagaccctgctcgaatatc(seq id no.:8)
[0273]
送公司进行oligo的合成。
[0274]
(2)合成后的oligo粉末用双蒸水溶解为100μm,然后以上述体系及程序进行目的片段的退火融合合成。
[0275]
(3)慢病毒载体lenticrisprv2puro用bsmⅰ酶切,切胶回收线性化载体。
[0276]
(4)后续采用shrna慢病毒载体构建的流程:连接-转化-涂板-小体积单克隆菌落摇菌-测序鉴定-大体积摇菌-质粒大提,测定浓度,-20℃保存待用。
[0277]
2.8.2慢病毒包装
[0278]
(1)293t细胞培养于dmem高糖完全培养基中,待细胞融合度达到90%时,以1:6比例传代。
[0279]
(2)在10cm细胞培养皿内铺293t细胞,待细胞融合度达到80%时,根据lipofectamine2000转染试剂说明书,将慢病毒载体与其病毒包装辅助载体以:plvx:spax2:pmg2d=2:2:1的比例转染总载体量25μg每个10cm培养皿,转染293t细胞。8小时后,更换为完全培养基。
[0280]
(3)在后续的第24,48,72小时分别收细胞培养上清,混合。
[0281]
(4)使用0.45μm孔径的滤器过滤混合上清,以去除细胞碎片。
[0282]
(5)用100kd孔径的的浓缩管,4000rpm,4℃,离心60min;获得的上层浓缩液即为浓缩的慢病毒颗粒,-80℃保存待用。
[0283]
2.9rna抽提及实时定量分析
[0284]
2.9.1trizol法抽提总rna:
[0285]
(1)收获目的细胞于1.5ml ep离心管(rnase-free)中,离心后去除上清,加入1ml trizol,吹打混匀,室温放置5min,以保证充分裂解细胞。
[0286]
(2)1ml trizol对应加入0.2ml三氯甲烷(trizol:三氯甲烷=5:1),充分振荡混匀,室温静置15min至出现分层。
[0287]
(3)12000g,4℃离心15min。
[0288]
(4)小心缓慢的吸取上层rna溶解层(透明)0.2ml至新的rnase-free离心管中,避免接触下部细胞层。
[0289]
(5)0.2ml rna样品中对应加入0.2ml异丙醇(rna:异丙醇=1:1),缓慢摇匀,静置10min。
[0290]
(6)12000g,4℃离心10min。
[0291]
(7)轻轻倒掉上清,避免倒掉下部沉淀,加入1ml预冷的75%乙醇(rnase-free),震荡使沉淀悬浮。
[0292]
(8)7500g,4℃离心5min,弃上清。
[0293]
(9)倒置离心管数分钟以晾干乙醇。
[0294]
(10)晾干乙醇后向离心管中加入适量的rnase-free双蒸水溶解rna沉淀,获得总rna溶液。
[0295]
2.9.2rna反转录
[0296]
(1)测定rna浓度为a。
[0297]
(2)应用takara的primescripttm rt master mix试剂盒进行反转录,要求在10μl
的反应体系中最多加入500ng rna,体系如下:
[0298][0299]
(3)扩增反应条件:
[0300][0301]
2.9.3实时定量pcr
[0302]
(1)使用roche的faststart universal sybr green master试剂盒进行实时定量pcr分析,10μl反应体系如下:
[0303][0304]
(2)每个cdna在384孔板上都设2个复孔,减少系统误差。每个样都有内参基因和目的基因测定组。
[0305]
(3)abi荧光定量pcr仪检测,程序如下:
[0306]
stage 1:预变性;95℃,10min
[0307]
stage 2:pcr反应;95℃,10秒;60℃,60秒(40个循环)
[0308]
stage 3:dissociation stage
[0309]
(4)荧光定量pcr结果处理分析:根据经典的2
-△△
ct
法处理,以β-actin或rpl13a作为内参,结果的表达为relative toβ-actin,即相对于内参基因的基因表达量。
[0310]
所有基因的引物都由软件oligo7设计,引物上下游跨越1000bp以上的内含子区域,以排除基因组残余对mrna定量的影响。具体信息列于表2-3:
[0311]
表2-3实时荧光定量pcr引物
[0312][0313]
2.10蛋白提取及免疫印迹分析
[0314]
(1)蛋白样品提取:
[0315]
贴壁细胞弃去细胞培养基,迅速放于冰上,用预冷的pbs缓冲液清洗一次,然后再加预冷的pbs缓冲液,用细胞刮刮掉贴壁细胞,移入1.5ml ep管中,6000rpm,4℃离心1min,彻底去除上清,根据细胞团块大小加入适量的ripa蛋白裂解液,吹打均匀,冰上放置30min,期间每隔10min震荡混匀一次。然后13000rpm,4℃离心15min;将上清转入新的ep管中。待测定蛋白浓度后,根据体积加入4
×
蛋白上样缓冲液,充分震荡,98℃煮沸蛋白样品10min,期间震荡2-3次;-20℃保存待用。
[0316]
(2)蛋白浓度测定:
[0317]
借助thermo fisher scientific公司的蛋白定量试剂盒,采用bca测定法进行蛋白浓度测定。具体操作是:称取bsa粉末溶于pbs缓冲液,配制bsa浓度为2μg/μl蛋白标准品,然后用pbs稀释获得bsa浓度梯度标准品(2μg/μl,1.6μg/μl,1.2μg/μl,0.8μg/μl,0.4μg/μl,0.2μg/μl);将试剂盒中的试剂a与试剂b以50:1的比例混匀,然后以200μl每孔将混合液分装到平底96孔板中;在相应的标准品孔和样品测定孔中加入2.5μl的标准品或蛋白样品,每个样品在96孔板上做3个复孔;37℃孵育反应30min;用酶标仪在562nm处读取吸光度值。根据标准曲线,计算各样品的蛋白浓度。
[0318]
(3)配制sds-聚丙烯酰胺凝胶:
[0319]
采用10-12%分离胶和5%积层胶来制作凝胶板。将两块玻璃板清洗晾干后,组成
的模具,然后把分离胶液混合缓慢地加入两层玻璃板之间,并迅速在胶表面沿凝胶板内壁缓慢加入1ml异丙醇。室温放置1小时后分离胶聚合,倒去表面异丙醇,用双蒸水缓慢冲洗分离胶上层空间两次,并用滤纸吸干残余的液体。然后将配制好的积层胶液,缓慢加入到分离胶上层,至玻璃板上缘,再小心插入梳子;静置1小时待积层胶聚合后拔出梳子。
[0320]
(4)sds-聚丙烯酰胺凝胶电泳:
[0321]
将凝胶板用电极夹板夹好,放入电泳槽,加入电泳缓冲液,直至缓冲液浸没加样孔;根据测定的蛋白浓度,加入40μg蛋白量,并在凝胶板两侧的泳道加入蛋白彩色marker;插上电极,先用80v电泳约30min,直至样品已经从积层胶进入分离胶,将电压改为120v继续电泳约60min,直至样品前沿溴酚蓝指示剂运动至凝胶边缘。
[0322]
(5)蛋白转移:
[0323]
提前将硝酸纤维素膜(nc膜)放到蛋白转移缓冲液中平衡10分钟,将电泳结束的凝胶取下,切除积层胶,放于蛋白转移缓冲液;然后在黑色夹板面按海绵-滤纸-凝胶-nc膜-滤纸-海绵的顺序从下向上依次叠加,过程中刮压每一层排出气泡。将闭合的蛋白转膜夹置于转移装置中,然后接通电源,恒流250ma,电转1.5小时;蛋白转移结束后,关闭电源,取出膜,根据marker和目的蛋白分子量大小剪取相应位置的nc膜条带。
[0324]
(6)目的蛋白检测
[0325]
将nc膜在5%的脱脂奶粉溶液中室温封闭1小时,然后配制稀释的目的蛋白抗体孵育液,在摇床上4℃孵育nc膜过夜;次日,将nc膜取出,用tbst缓冲液清洗3次,每次5min;再加入稀释的hrp标记的二抗,在摇床上室温孵育1小时;然后将nc膜取出,用tbst缓冲液清洗3次,每次7min;将nc膜转移至暗盒片夹中,在暗室里加入ecl化学发光底物显色液,根据信号强弱适时终止反应,进行胶片的曝光、冲片。将胶片做好标记,用扫描仪灰度扫描成照片。根据照片上对应目的蛋白大小位置的条带的灰度强弱判断目的蛋白的表达量。
[0326]
2.11精氨酸酶活性测定实验
[0327]
借助购自sigma的arginase activity assay kit,根据试剂盒说明书进行精氨酸酶活性实验测定。具体操作如下:
[0328]
(1)配制组织细胞裂解液:10mm的tris-hcl,ph 7.4,加入proteinase inhibitor,1mm的pmsf和0.4%(重量/体积)的triton x-100。将试剂盒里的尿素标准品以24μl原液加入176μl双蒸水的方式配制成1mm的标准品工作液。
[0329]
(2)将液氮冻存的创伤组织转移至包含钢珠的2ml离心管中,根据组织总量(0.1g组织加0.5ml裂解液)加入相应的组织细胞裂解液。
[0330]
(3)利用组织研磨机将组织打碎,保持低温操作。冰上裂解10min;然后13000g,4℃离心10min。
[0331]
(4)取上清以40μl每孔直接分别加入96孔平底板中,每个样品设置测定组和对照组。同时设置50μl每孔的尿素标准品和双蒸水对照组。
[0332]
(5)将试剂盒里的arginine buffer预热至37℃,并和mn solution以4:1比例混合,配制5
×
底物反应液;然后在测定组每孔加入10μl 5
×
底物反应液。
[0333]
(6)37℃孵育反应2小时。期间将试剂盒里的试剂a和试剂b以1:1混合配制尿素试剂。
[0334]
(7)反应2小时后,所有实验组均加入200μl的尿素试剂。同时对样品对照组每孔加
入10μl 5
×
底物反应液。
[0335]
(8)室温孵育1小时。
[0336]
(9)用酶标仪在430nm处读取吸光度值a
430
。
[0337]
(10)吸光度值,按以下公式计算样品酶活性(units/l):
[0338]
酶活性=[a
430测定组-a
430对照组
]/[a
430标准品-a
430双蒸水
]
×
[1mm
×
50
×
103]/[v
样品体积
×
t
反应时间
]
[0339]
2.12统计学分析
[0340]
所有体外实验处理组都设置有三个及以上的生物学重复,体内动物实验处理组都设置有五只及以上的小鼠。实验结果均借助graphpad prism 7软件作图,且图中数据以平均数
±
标准差展示。数据的统计分析采用student’s t检验或双因素方差分析。显著性标准为α=0.05,其中*表p<0.05;**代表p<0.01;***代表p<0.001。
[0341]
实施例1创伤组织局部炎症因子浓度影响mscs治疗皮肤创伤的效果
[0342]
mscs因其多向分化能力和免疫调节能力被广泛用于皮肤创伤的治疗研究,大量的临床前动物模型研究也证明了mscs的显著疗效。然而,mscs的来源、动物模型研究中治疗策略的多样性以及不同研究组之间治疗效果的不稳定性,使得基于mscs的皮肤创伤治疗迟迟不能向临床研究转化。鉴于mscs免疫调节能力能够被免疫微环境的炎症因子种类及浓度影响,所以我们猜测mscs治疗效果的不稳定性也许与其所处的微环境相关,并且我们提出假设,mscs对皮肤创伤的治疗效果与局部创伤组织的免疫微环境有关系。
[0343]
为了验证该假设,我们用balb/c小鼠构建了背部全皮层切除的皮肤创伤模型,然后分别在创伤后24小时及48小时实施mscs治疗,即通过伤口周边皮下注射的方式给予细胞治疗,每个伤口对应注射1
×
10^6细胞数的mscs;然后在创伤后第3天,对伤口拍照并用image j软件定量伤口面积,同时取伤口组织样品,低温研磨组织获得组织间质液,采用bioplex高通量细胞因子蛋白定量系统分析伤口组织中炎症因子的种类及浓度;最后,统计分析细胞因子种类及浓度与其对应伤口面积的相关性。
[0344]
结果可见,在创伤后第三天,多数促炎因子在创伤组织微环境中仍处于较高水平,且伤口的面积和促炎因子(包括ifn-γ、tnf-α、il1、il6和il17a)的浓度呈负相关(图1a),尤其是il17a的浓度与伤口面积具有显著的负相关性。有文章报道il17a缺失的小鼠呈现延迟的伤口愈合表型[9],该结果也同样提示了il17a对创伤愈合的潜在促进作用。此时,尚处于创伤修复的炎症阶段,抑炎因子如il4和il10均处于较低水平,且与伤口面积没有显著相关性(图1b)。趋化因子方面,我们可以看到多数先天免疫细胞趋化因子ccl2、ccl3和ccl5与伤口面积呈负相关(图1c),尤其是趋化中性粒细胞的ccl3的浓度与伤口面积具有显著负相关性,此结果提示炎症阶段后期,本该消退的中性粒细胞如果继续大量浸润伤口组织,会抑制伤口愈合。类似于cxcl10不仅是趋化因子还能调节角质细胞增殖,促进再上皮化的功能[10],c-x-c型结构域的趋化因子cxcl1的浓度与伤口面积具有一定的负相关性。以上结果表明,基于mscs的皮肤创伤治疗效果有一定的波动性,且其治疗效果和创伤组织局部的细胞因子浓度有关系。
[0345]
实施例2 ifn-γ,tnf-α和il17a预激活mscs能提高其对皮肤创伤的治疗效果
[0346]
mscs的免疫抑制能力不是固有的,需要炎症因子ifn-γ和tnf-α或il1结合激活其免疫抑制能力[11],而且我们早期还发现il17a与ifn-γ、tnf-α三因子联用激活的mscs具
有显著增强的免疫抑制能力[12]。在图1中,我们也发现创伤组织的il17a浓度与mscs的创伤治疗效果显著正相关。因此,我们拟采用ifn-γ、tnf-α和il17a三因子联合体外激活mscs,获得均一化高度激活的mscs,然后再进行伤口周边皮下组织注射,连续记录伤口愈合全程(图2a),探究ifn-γ、tnf-α和il17a三因子体外预激活的mscs能否提高其对皮肤创伤的治疗效果。
[0347]
结果显示,像多数研究报道一样,mscs治疗组的伤口面积比同时期的pbs对照组小,提示mscs对皮肤创伤有治疗效果。更重要的是,ifn-γ、tnf-α和il17a体外预激活的mscs治疗组呈现显著提高的伤口愈合比例(图2b&c)。为了进一步确认预激活mscs具有更好的治疗效果,我们收集不同处理组创伤后第5天和第7天的创伤组织,经h&e染色和image j定量分析,我们发现预激活mscs治疗组有显著改善的再上皮化(图2d&e)。同时,使用anti-cd31抗体进行免疫组织化学分析的结果也表明预激活mscs治疗组在创伤后第5天有显著增加的血管新生(图2f)。以上结果表明,ifn-γ、tnf-α和il17a三因子体外预激活的mscs能显著加速正常的皮肤创伤愈合进程,取得较mscs更好的皮肤创伤治疗效果。
[0348]
糖尿病足溃烂患者的慢性不愈合伤口是皮肤创伤临床治疗的主要挑战之一。因此,ifn-γ、tnf-α和il17a预激活的mscs能否促进糖尿病患者的皮肤创伤修复是该治疗方案能否向临床转化的关键评价因素。因此,我们在高脂饮食诱导的糖尿病小鼠上建立背部全皮层切除皮肤创伤模型,然后实施mscs或ifn-γ、tnf-α和il17a预激活mscs治疗,探究不同mscs治疗组的皮肤创伤治疗效果。
[0349]
我们采用葡萄糖耐受实验gtt确认了高脂饮食诱导的糖尿病小鼠模型(图3a),此外,相比于正常小鼠9天的伤口愈合过程(图2b),糖尿病小鼠需要11天才能达到完全愈合伤口(图3b)。相似的,我们在糖尿病小鼠的皮肤创伤治疗中,也观察到ifn-γ,tnf-α和il17a体外预激活的mscs能够更好地促进伤口愈合;表现为相比于mscs治疗组更快的伤口愈合效率(图3b&c)和显著改善的再上皮化(图3d)。
[0350]
以上结果表明,ifn-γ,tnf-α和il17a三因子联用在体外预激活mscs可以显著提高mscs治疗皮肤创伤的效果。相比于其它来源mscs特性的不确定性和支架输注mscs的细胞富集效率改善,三炎症因子联用预处理mscs的优化方案从细胞功能的角度提高了基于mscs的皮肤创伤治疗效果,且简单易行。因此,该优化方案具有更高的临床转化意义。
[0351]
实施例3巨噬细胞介导预激活mscs的皮肤创伤治疗效果
[0352]
通过对创伤后第3天和第5天的创伤组织中的免疫细胞群进行流式分析。结果显示,混合型胶原酶消化获得的第3天创伤组织单细胞悬液中,有90%以上细胞是cd45+免疫细胞,且其中90%以上都是cd11b+的免疫细胞(图4a)。此时创伤愈合尚处在炎症阶段,该结果符合预期。我们用胶原酶消化法结合流式技术分析第5天的组织的情况(图4b),与前期相一致的是,创伤组织中仍然含有大量的cd11b+免疫细胞,其中的f4/80+的巨噬细胞占cd11b+阳性细胞群的50%以上。而且,接近90%的巨噬细胞高表达ly6c分子,提示创伤组织里的大多数巨噬细胞是从骨髓动员经外周血迁移到创伤组织的。鉴于巨噬细胞参与皮肤创伤修复的全程且具有功能多样性和可塑性的特性,我们对不同mscs治疗组的第5天创伤组织进行巨噬细胞定量分析(图4c&d),发现在预激活的mscs治疗组中,创伤组织具有显著增多的巨噬细胞浸润;该结果同样得到anti-f4/80抗体免疫组织化学染色的证实(图4e)。因此,在基于预激活mscs的皮肤创伤治疗中,巨噬细胞是预激活mscs潜在的免疫调控靶细胞。
[0353]
为了确认巨噬细胞在预激活mscs治疗皮肤创伤中的作用,我们拟采用尾静脉注射氯膦酸盐脂质体的方式清除机体巨噬细胞,结果发现注射后48小时,小鼠骨髓和外周血的巨噬细胞仍处于很低的水平,仅为原有水平的50%左右(图5a);据创伤组织中的巨噬细胞高表达ly6c(图4b)推断,尾静脉注射氯膦酸盐脂质体可以显著降低创伤组织中巨噬细胞的浸润。因此,我们在皮肤创伤模型构建前24小时和创伤建模后48小时,分别进行尾静脉注射氯膦酸盐脂质体以清除巨噬细胞,创伤建模后分别实施相应的处理治疗(图5b)。我们发现相比较于对照脂质体结合预激活mscs组的治疗效果,在巨噬细胞清除组预激活mscs不再有促进创伤愈合的效果。此外,当巨噬细胞清除后,mscs和预激活mscs的治疗相比较于pbs组的自然修复过程,都没有促进创伤修复的效果(图5c&d)。该结果提示巨噬细胞在基于mscs的皮肤创伤治疗中发挥不可或缺的作用。创伤后第5天和第7天的h&e染色及免疫组织化学分析,同样可以看到各治疗组之间在巨噬细胞清除后的再上皮化和血管新生过程均没有差异(图5e f&g),该结果同样证实了早期清除巨噬细胞会延迟再上皮化的研究报道。
[0354]
为了进一步确认巨噬细胞在mscs治疗皮肤创伤中的重要作用,我们同时实施了巨噬细胞回补实验。结果表明,回补由mscs的条件培养基培养的巨噬细胞,可以显著改善因巨噬细胞清除造成的再上皮化和血管生成的延迟。重要的是,回补经由激活mscs条件培养基培养的巨噬细胞,可以极显著地促进伤口愈合(图5c&d),增强再上皮化和血管生成(图5e f&g),接近对照脂质体组中预激活mscs的治疗效果。该结果充分证明,巨噬细胞是皮肤创伤治疗中预激活mscs的免疫调节靶细胞,而且预激活mscs驯化的巨噬细胞具有促进创伤修复的功能。
[0355]
实施例4 gm-csf介导预激活mscs对巨噬细胞的驯化作用
[0356]
上述结果已证明,预激活mscs可以调控巨噬细胞转化为高表达arginase1、hif1α等基因的特定表型,接下来我们将探究调控巨噬细胞的具体机制。前期实验证明预激活mscs的条件培养基可以驯化巨噬细胞,提示预激活mscs分泌了某种可溶性效应因子参与该过程调节。为了进一步证明该假设,我们将浓缩的预激活mscs条件培养基以不同剂量添加到巨噬细胞培养基中,可见巨噬细胞的arginase1和hif1α呈剂量依赖性的升高表达(图6a)。为了找到条件培养基中可溶性的效应因子,我们采用bioplex高通量细胞因子蛋白定量系统分析条件培养基中潜在的影响因子。结果显示,在mscs条件培养基和transwell共培养上清中均被高浓度富集到的因子只有gm-csf和il6(图6b)。gm-csf因能促进粒细胞和巨噬细胞分化成熟而得名,其基本生物学功能之一就是促进骨髓单核细胞分化成熟为巨噬细胞,il6是重要的炎症因子;而且巨噬细胞在lps刺激下均可大量产生gm-csf和il6。为了找出效应因子,我们使用不同浓度梯度的细胞因子刺激巨噬细胞,,结果显示只有gm-csf可以显著提高成熟巨噬细胞中arginase1和hif1α的表达,即使在100pg/ml的浓度时;而il6只有微弱的促进基因表达升高的趋势(图6c)。因此,我们以gm-csf作为候选效应因子,通过real-time pcr和elisa分别从mrna和蛋白水平确认预激活mscs中gm-csf的表达情况(图6d)。有文章报道mscs和巨噬细胞可以相互影响,为了确认其调控是由mscs到巨噬细胞的单向调控还是两者有相互作用的二次调控,我们检测了gm-csf受体(csf2rα和csf2rβ)在mscs和巨噬细胞表达情况,结果显示mscs不表达受体的csf2rβ亚基,而巨噬细胞中高表达两个亚基(图6e);并且在共培养体系中,巨噬细胞的gm-csf表达量显著低于mscs(图6f)。因此,在体外共培养体系中,预激活mscs产生的gm-csf是调控巨噬细胞表达arginase1和hif1α的
潜在效应因子,且该调控作用是单方向的。
[0357]
为了确认gm-csf作用的特异性,我们在共培养体系中加入gm-csf的中和抗体或igg2a对照,结果显示中和抗体体系里的gm-csf因子被完全中和(图7a),同时分析巨噬细胞中基因表达,同样可以看到arginase1和hif1α也呈现显著降低的趋势(图7b)。由于gm-csf蛋白产量较低且其对巨噬细胞的调控作用具有低浓度高效率的特点,我们采用crispr/cas9的方式,在mscs中敲除gm-csf基因座中的1号和3号外显子,称其为csf2-ko-mscs。为了证明其基因敲除的有效性,我们使用ifn-γ、tnf-α和il17a三因子刺激该细胞,发现其不再有gm-csf产生(图7c)。当巨噬细胞与预激活csf2-ko-mscs共培养时,亦不再有升高arginase1和hif1α表达的现象(图7d)。已有研究报道,在巨噬细胞中,stat5及其磷酸化介导gm-csf诱导的arginase1表达[13]。因此,我们检测mscs或预激活mscs条件培养基培养的巨噬细胞的stat5磷酸化活性及arginase1表达的情况,其中以gm-csf因子的刺激作为阳性对照。结果显示,相比于mscs培养基,预激活mscs条件培养基可以显著促进巨噬细胞中stat5的磷酸化及24小时arginase1的表达(图7e)。以上结果充分证明,在体外共培养体系中,gm-csf介导预激活mscs对巨噬细胞的驯化作用。
[0358]
实施例5 gm-csf是预激活mscs治疗皮肤创伤必需的效应因子
[0359]
我们已经证明,预激活mscs分泌的gm-csf能够诱导巨噬细胞升高表达arginase1和hif1α,赋予其促进组织修复的能力。与此同时,也有研究表明,在皮肤创伤中,皮肤角质细胞能够分泌gm-csf,促进角质细胞胶原合成和内皮细胞增殖,促进创伤修复[14]。那么,在预激活mscs加速的皮肤创伤愈合中,mscs来源的gm-csf对创伤愈合是否发挥额外的促进作用呢。首先,我们检测在正常的皮肤创伤进程中,血清及创伤组织局部的gm-csf含量的动态变化。结果显示,血清中检测不到gm-csf的含量,但在创伤组织中有很高gm-csf表达量,且在组织创伤后逐渐升高,第五天达到峰值,随后迅速降低至组织正常水平(图8a);然后,我们在gm-csf波动最高点的第5天,检测不同mscs治疗组的创伤组织中gm-csf含量,可见预激活mscs治疗组可显著提高创伤组织局部gm-csf浓度(图8b)。最后,我们利用csf2-ko-mscs及预激活csf2-ko-mscs实施皮肤创伤的治疗,基于预激活mscs的治疗为阳性对照。伤口面积的统计结果显示,预激活csf2-ko-mscs对皮肤创伤的治疗效果和csf2-ko-mscs没有差异,略好于pbs处理的正常创伤愈合,但是显著低于基于预激活mscs的皮肤创伤治疗效果(图8c&d)。同时,我们还利用h&e染色和免疫组织化学检测了创伤后第5天的创伤组织的再上皮化(图8e&f)和血管新生情况(图8g)相比于预激活mscs治疗组,预激活csf2-ko-mscs治疗组呈现显著减弱的再上皮化和减少的血管新生。此外,通过anti-f4/80免疫组织化学染色分析,我们发现预激活csf2-ko-mscs治疗的创伤组织中浸润的巨噬细胞也显著少于预激活mscs治疗组(图8h)。该结果提示gm-csf不仅能驯化巨噬细胞的促进创伤修复的表型,还可能影响创伤组织对巨噬细胞的招募及浸润单核细胞向巨噬细胞的分化。在此基础上,给予mscs过表达gm-csf可以显著促进皮肤损伤后的创伤愈合(图9a-c)。因此,以上结果表明,mscs来源的gm-csf作为机体本底gm-csf的增量补充,可以显著促进皮肤创伤愈合,是基于预激活mscs的皮肤创伤治疗的关键效应因子。
[0360]
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范
围。
[0361]
参考文献
[0362]
1.gantwerker,e.a.and d.b.hom,skin:histology and physiology of wound healing.facial plast surg clin north am,2011.19(3):p.441-53.
[0363]
2.proksch,e.,j.m.brandner,and j.m.jensen,the skin:an indispensable barrier.exp dermatol,2008.17(12):p.1063-72.
[0364]
3.ehrlichman,r.j.,et al.,common complications of wound healing.prevention and management.surg clin north am,1991.71(6):p.1323-51.
[0365]
4.eming,s.a.,p.martin,and m.tomic-canic,wound repair and regeneration:mechanisms,signaling,and translation.sci transl med,2014.6(265):p.265sr6.
[0366]
5.sen,c.k.,et al.,human skin wounds:a major and snowballing threat to public health and the economy.wound repair regen,2009.17(6):p.763-71.
[0367]
6.lindholm,c.and r.searle,wound management for the 21st century:combining effectiveness and efficiency.int wound j,2016.13suppl 2:p.5-15.
[0368]
7.yang,w.,et al.,prevalence of diabetes among men and women in china.n engl j med,2010.362(12):p.1090-101.
[0369]
8.jiang,y.,et al.,survey of wound-healing centers and wound care units in china.int j low extrem wounds,2016.15(3):p.274-9.
[0370]
9.macleod,a.s.,et al.,dendritic epidermal t cells regulate skin antimicrobial barrier function.j clin invest,2013.123(10):p.4364-74.
[0371]
10.satish,l.,d.yager,and a.wells,glu-leu-arg-negative cxc chemokine interferon gamma inducible protein-9 as a mediator of epidermal-dermal communication during wound repair.j invest dermatol,2003.120(6):p.1110-7.
[0372]
11.ren,g.,et al.,mesenchymal stem cell-mediated immunosuppression occurs via concerted action of chemokines and nitric oxide.cell stem cell,2008.2(2):p.141-50.
[0373]
12.han,x.,et al.,interleukin-17 enhances immunosuppression by mesenchymal stem cells.cell death differ,2014.21(11):p.1758-68.
[0374]
13.huen,s.c.,et al.,gm-csf promotes macrophage alternative activation after renal ischemia/reperfusion injury.j am soc nephrol,2015.26(6):p.1334-45.
[0375]
14.yonem,a.,et al.,effects of granulocyte-colony stimulating factor in the treatment of diabetic foot infection.diabetes obes metab,2001.3(5):p.332-7.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1