一种苓桂术甘药物组合物、制备方法及检测方法与流程
本发明涉及药学领域,具体涉及一种苓桂术甘药物组合物、制备方法及检测方法。
背景技术:
:苓桂术甘汤出自汉·张仲景《伤寒论》。古籍原文记载:茯苓四两、桂枝三两、白术三两、甘草二两,右四味,以水六升,煮取三升,去滓,分温三服。通过对剂量及煎煮方法考证,确定方中现代折合剂量为茯苓12g,桂枝9g,白术9g,甘草6g,即现代处方用量为汉代实际用量的1/5。度量衡专家对汉代量具进行实测和综合分析,得知汉代1升容积合今制约200毫升,同时重大新药创制专项“经典名方标准颗粒的研究”经典名方古今剂量折算原则专家共识也认为汉代1升相当于现代200毫升,则原方煎煮方法为“以上四味药加水1200ml(六升),煮至600ml(三升),过滤”。又因为该方剂量折合原方1/5,故加水量及服用量也应以相同比例折算,确定该方药味组成和用法用量为:茯苓12g,桂枝9g,白术9g,甘草6g,以上4味药,加水240ml,煎煮至120ml,去滓,每日分3服。每服温服40ml。苓桂术甘汤煎煮方法与《金匮要略》古籍原文记载基本一致。该方具有温阳化饮,健脾利湿功效。主治中阳不足之痰饮。胸胁支满,目眩心悸,短气而咳,舌苔白滑,脉弦滑或沉紧。方中君药为茯苓,臣药为桂枝,佐药为白术,使药为甘草,通过处方各药味的化学成分分析,基本了解处方质量概貌;确定处方中君药茯苓中多糖及三萜酸类成分,臣药桂枝中苯丙素类成分(肉桂酸),佐药白术中水溶性成分;甘草中黄酮(甘草苷)、三萜(甘草酸)及皂苷类成分;是其可能的主要药效物质基础,预测茯苓中多糖类、桂枝中苯丙素类、白术中水溶性苷类、甘草中黄酮类、三萜类、皂苷类成分可以在标准煎液中出现。《伤寒论》古籍原文记载处方及制备方法具有一定的疗效,但存在以下缺陷:①以中间体(提取液)体积为煎煮终点,但实际操作过程中实时量取药液体积操作不便;②由于苓桂术甘汤为煮散剂,原文去滓服用,因此存在药渣和泥沙的情况;③汤剂服用,服用不方便;④质量检测方法难以反映物质基准质量的优劣。申请号cn201810670486.8,发明名称:苓桂术甘汤复方颗粒剂及其制备方法,按以下重量份数比称取下述原料:茯苓4份、桂枝3份、白术3份、炙甘草2份;将桂枝和白术分别进行水蒸气蒸馏,得到桂枝挥发油成分和白术挥发油成分;将桂枝和白术残渣加入茯苓、炙甘草,加入8~12倍水进行提取,提取时间为1~2小时,提取1~3次;将提取物进行冷冻干燥制得苓桂术甘汤冻干粉;将制得的苓桂术甘汤冻干粉与辅料混合并过筛,加入乙醇制成软材,过筛制成颗粒状,真空干燥至恒重;喷入所述桂枝挥发油、白术挥发油,即得苓桂术甘汤复方颗粒剂。申请号cn201810670486.8对古籍原方及制备方法进行了一定的改进,但存在以下缺陷:①煎煮未明确煎煮火候,有效物质容易损失;②未明确冷冻干燥参数,不具有可操作性,从而有可能导致干膏粉发泡、融化、质地硬现象。申请号cn201811635810.9,发明名称:苓桂术甘汤指纹图谱的检测方法,存在以下缺陷:①未明确时间段的洗脱条件,峰分离度较差;②供试品溶液使用95%乙醇加热回流提取3h,提取时间较长,成本高。为了解决上述问题,本发明团队以臣药桂枝中肉桂酸及佐使药甘草中甘草苷及甘草酸为含量测定指标,考察处方工艺及质量的可控性。根据经典名方目录中记载的方法进行煎煮。采用砂锅煎煮,中间体(提取液)经冷冻干燥制备对应实物(干膏粉),以出膏率、肉桂酸、甘草苷、甘草酸提取总量、指纹图谱为指标,研究物质基准加热方式、煎煮时间、滤过及干燥工艺等进行研究相关参数,从而确定本发明物质基准工艺。技术实现要素:本发明的目的是克服
背景技术:
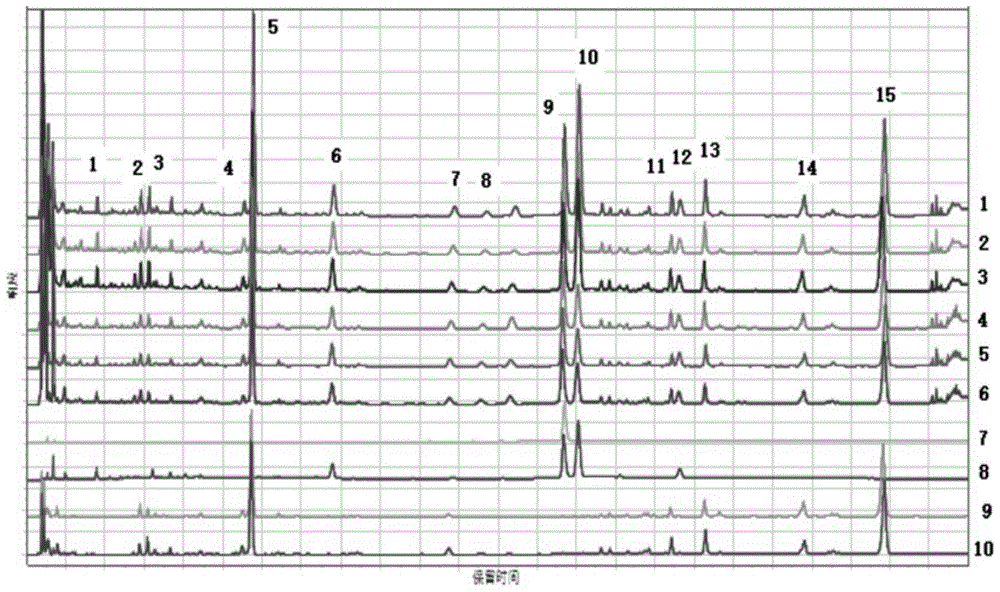
里所提的缺陷,提供一种苓桂术甘药物组合物;本发明另一目的是提供一种苓桂术甘药物组合物的制备方法;本发明另一目的是提供的一种苓桂术甘药物组合物在中阳不足之痰饮疾病方面的应用。本发明所述的苓桂术甘药物组合物由以下配方组成:茯苓8~15份、桂枝7~11份、白术7~11份、甘草4~8份。优选的,本发明所述的苓桂术甘药物组合物由以下配方组成:茯苓12份、桂枝9份、白术9份、甘草6份。本发明所述药物组合物还包括用药学上可接受的辅料制成药学上可接受的剂型。所述重量份数可以是μg、mg、g、kg等医药领域公知的重量单位。本发明所述药学上可接受的辅料是指药学领域常规的药物载体,选自填充剂、润滑剂、粘合剂、崩解剂、表面活性剂或矫味剂等中的一种或几种。其中所述填充剂选自糊精、淀粉、山梨醇、乳糖、甘露醇、木糖醇、微晶纤维素等;所述粘合剂选自纤维素衍生物、醋酸乙烯树脂、聚乙烯醇、明胶、藻酸盐等;所述崩解剂选自干淀粉、碳酸轻纳、低取代纤维素、微晶纤维素、羧甲基淀粉钠、聚乙烯吡咯烷酮、低取代羟丙基纤维素或交联羧甲基纤维素钠等;所述润滑剂选自硬脂酸、聚乙二醇、碳酸钙、碳酸氢钠、二氧化硅、滑石粉或硬脂酸镁等;所述表面活性剂选自十二烷基苯磺酸钠、硬脂酸、聚氧乙烯-聚氧丙烯共聚物、脂肪酸山梨坦或聚山梨酯(吐温)等;所述矫味剂选自甘油、山梨醇、甘露醇、阿斯巴甜、蔗糖素、柠檬、茴香、薄荷油等。本发明所述剂型为颗粒剂、胶囊剂、片剂、丸剂、散剂、注射剂、泡腾片、膏剂。本发明所述的药物组合物的制备方法包括以下步骤:(1)称取重量份的药物,备用;(2)煎煮:加水220~260ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮30~40分钟;(3)滤过:煎煮至120ml,200~300目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)加入药学上可接受的辅料制成药学上可接受的剂型。优选的,本发明所述的药物组合物的制备方法包括以下步骤:(1)称取重量份的药物,备用;(2)煎煮:加水240ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮35分钟;(3)滤过:煎煮至120ml,200目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)加入药学上可接受的辅料制成药学上可接受的剂型。本发明所述药物组合物的检测方法包括鉴别、指纹图谱、含量测定。本发明所述药物组合物检测方法具体包括以下步骤:鉴别(1)取本品0.5~1.5g,加水10ml使溶解,用乙醚振摇提取1~3次,每次20~30ml,合并乙醚液,挥干,残渣加乙醚2ml使溶解,作为供试品溶液,另取桂枝对照药材1g,加水45~55ml,煎煮25~35分钟,滤过,滤液同法制成对照药材溶液,再取肉桂酸对照品,用甲醇制成每1ml含0.4mg的溶液,作为对照品溶液,照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液及对照药材溶液各5μl,供试品溶液3μl,分别点于同一硅胶gf254薄层板上,以环己烷-乙醚-冰醋酸(5:5:0.3)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视;供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点;(2)取本品约1g,加水35~45ml,超声处理25~35分钟,滤过,滤液用乙醚振摇提取1~3次,每次7~13ml,弃去乙醚液,水液用水饱和正丁醇振摇提取2~4次,每次15~25ml,合并正丁醇液,用氨试液振摇提取1~3次,每次25~35ml,合并氨试液,用盐酸调ph值至3~4;再用乙酸乙酯振摇提取1~3次,每次25~35ml,合并乙酸乙酯液,蒸干,残渣加甲醇2ml使溶解,作为供试品溶液;另取甘草对照药材1g,加水45~55ml,煎煮25~35分钟,滤过,同法制成对照药材溶液;再取甘草苷对照品,加70%乙醇制成每1ml含0.5mg的溶液,作为对照品溶液;照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液5μl、对照药材溶液及供试品溶液各1μl,分别点于同一硅胶g薄层板上,以三氯甲烷-甲醇-水(13:7:2)5~10℃放置的下层液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置日光和紫外光灯(365nm)下检视,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点或荧光斑点;指纹图谱照高效液相色谱法(《中国药典》2015年版四部通则0512)测定;色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序进行梯度洗脱;检测波长为260nm;理论板数按肉桂酸峰计算应不低于5000;流动相洗梯度洗脱程序如下:参照物溶液的制备取肉桂酸对照品适量,精密称定,加甲醇制成每1ml含20μg的溶液,即得;供试品溶液的制备取本品约0.5~1.0g,精密称定,置具塞锥形瓶中,精密加入70%甲醇15~25ml,称定重量,用功率250w,频率40khz超声处理25~35分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得;测定法分别精密吸取参照物溶液和供试品溶液各10μl,注入液相色谱仪,测定,记录色谱图,即得;供试品指纹图谱中应呈现与参照物色谱峰保留时间相同的色谱峰,供试品色谱图应与对照指纹图谱基本一致,有相对应的15个共有峰,按中药色谱指纹图谱相似度评价系统,以共有峰计算相似度,供试品指纹图谱与对照指纹图谱的相似度不得低于0.90;对照指纹图见图25;含量测定桂枝照高效液相色谱法(《中国药典》2015年版四部通则0512)测定;色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.5%磷酸溶液(34:66)为流动相;检测波长为276nm;理论板数按肉桂酸峰计算应不低于7000;对照品溶液的制备取肉桂酸对照品适量,精密称定,加稀乙醇制成每1ml含10μg的溶液,即得;供试品溶液的制备取本品0.2~0.5g,精密称定,置具塞锥形瓶中,精密加入稀乙醇45~55ml,称定重量,超声处理(功率250w,频率40khz)25~35分钟,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,滤过,取续滤液,即得;测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得;本品按干燥品计算,每g含桂枝以肉桂酸c9h8o2计,应为0.50~2.0mg;甘草照高效液相色谱法(《中国药典》2015年版四部通则0512)测定;色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序进行梯度洗脱;检测波长237nm;理论塔板数按甘草苷峰计算应不低于5000;流动相梯度洗脱程序如下:对照品溶液的制备取甘草苷,甘草酸铵对照品适量,精密称定,加50%乙醇制成每1ml含甘草苷20μg和甘草酸铵0.1mg的溶液,即得(甘草酸重量=甘草酸铵重量/1.0207));供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入50%乙醇25ml,称定重量,以功率500w,频率40khz超声处理25~35分钟,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得;测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得;本品按干燥品计算,每g含甘草以甘草苷c21h22o9计,应为5.0~15.0mg,以甘草酸c42h62o16计,应为5.0~30.0mg。优选的,本发明所述药物组合物检测方法包括以下步骤:鉴别(1)取本品1g,加水10ml使溶解,用乙醚振摇提取2次,每次25ml,合并乙醚液,挥干,残渣加乙醚2ml使溶解,作为供试品溶液,另取桂枝对照药材1g,加水50ml,煎煮30分钟,滤过,滤液同法制成对照药材溶液,再取肉桂酸对照品,用甲醇制成每1ml含0.4mg的溶液,作为对照品溶液,照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液及对照药材溶液各5μl,供试品溶液3μl,分别点于同一硅胶gf254薄层板上,以环己烷-乙醚-冰醋酸(5:5:0.3)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视;供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点;(2)取本品约1g,加水40ml,超声处理30分钟,滤过,滤液用乙醚振摇提取2次,每次10ml,弃去乙醚液,水液用水饱和正丁醇振摇提取3次,每次20ml,合并正丁醇液,用氨试液振摇提取2次,每次30ml,合并氨试液,用盐酸调ph值至3~4;再用乙酸乙酯振摇提取2次,每次30ml,合并乙酸乙酯液,蒸干,残渣加甲醇2ml使溶解,作为供试品溶液;另取甘草对照药材1g,加水50ml,煎煮30分钟,滤过,同法制成对照药材溶液;再取甘草苷对照品,加70%乙醇制成每1ml含0.5mg的溶液,作为对照品溶液;照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液5μl、对照药材溶液及供试品溶液各1μl,分别点于同一硅胶g薄层板上,以三氯甲烷-甲醇-水(13:7:2)5~10℃放置的下层液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置日光和紫外光灯(365nm)下检视,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点或荧光斑点;指纹图谱照高效液相色谱法(《中国药典》2015年版四部通则0512)测定;色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序进行梯度洗脱;检测波长为260nm;理论板数按肉桂酸峰计算应不低于5000;流动相梯度洗脱程序如下:参照物溶液的制备取肉桂酸对照品适量,精密称定,加甲醇制成每1ml含20μg的溶液,即得;供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入70%甲醇20ml,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得;测定法分别精密吸取参照物溶液和供试品溶液各10μl,注入液相色谱仪,测定,记录色谱图,即得;供试品指纹图谱中应呈现与参照物色谱峰保留时间相同的色谱峰,供试品色谱图应与对照指纹图谱基本一致,有相对应的15个共有峰,按中药色谱指纹图谱相似度评价系统,以共有峰计算相似度,供试品指纹图谱与对照指纹图谱的相似度不得低于0.90;对照指纹图谱见图25。含量测定桂枝照高效液相色谱法(《中国药典》2015年版四部通则0512)测定;色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.5%磷酸溶液(34:66)为流动相;检测波长为276nm;理论板数按肉桂酸峰计算应不低于7000;对照品溶液的制备取肉桂酸对照品适量,精密称定,加稀乙醇制成每1ml含10μg的溶液,即得;供试品溶液的制备取本品约0.3g,精密称定,置具塞锥形瓶中,精密加入稀乙醇50ml,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,滤过,取续滤液,即得;测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得;本品按干燥品计算,每g含桂枝以肉桂酸c9h8o2计,应为0.50~2.0mg;甘草照高效液相色谱法(《中国药典》2015年版四部通则0512)测定;色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序进行梯度洗脱;检测波长237nm;理论塔板数按甘草苷峰计算应不低于5000;流动相梯度洗脱程序表如下:对照品溶液的制备取甘草苷,甘草酸铵对照品适量,精密称定,加50%乙醇制成每1ml含甘草苷20μg和甘草酸铵0.1mg的溶液,即得(甘草酸重量=甘草酸铵重量/1.0207);供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入50%乙醇25ml,称定重量,超声处理(功率500w,频率40khz)30分钟,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得;测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得;本品按干燥品计算,每g含甘草以甘草苷c21h22o9计,应为5.0~15.0mg,以甘草酸c42h62o16计,应为5.0~30.0mg。本发明所述药物组合物在中阳不足之痰饮疾病方面的应用。主要用于中阳不足之痰饮引起的胸胁支满,目眩心悸,短气而咳,舌苔白滑,脉弦滑或沉紧等症状。有益效果:1、本发明与现有技术相比,具有以下有益效果:(1)现有技术:《伤寒论》古籍原文记载处方及制备方法具有一定的疗效,但存在以下缺陷:①以中间体(提取液)体积为煎煮终点,但实际操作过程中实时量取药液体积操作不便;②由于苓桂术甘汤为煮散剂,原文去滓服用,因此存在药渣和泥沙的情况;③汤剂服用,服用不方便;④质量检测方法难以反映物质基准质量的优劣。本发明:本发明克服了上述技术问题,解决了以下问题:①本发明通过采用明火加热,加盖煎煮,武火煎煮至沸,优选文火煎煮35分钟,明确了煎煮方式,克服了现有技术以中间体(提取液)体积为煎煮终点,实际操作过程中实时量取药液体积操作不便的技术问题;(2)现有技术:申请号cn201810670486.8对古籍原方及制备方法进行了一定的改进,但存在以下缺陷:①煎煮未明确煎煮火候,有效物质容易损失;②未明确冷冻干燥参数,不具有可操作性,从而有可能导致干膏粉发泡、融化、质地硬现象。本发明:①本发明通过采用明火加热,加盖煎煮,武火煎煮至沸,文火煎煮35分钟,明确了煎煮方式,克服了现有技术未明确煎煮火候,有效物质容易损失的技术问题;②明确了冷冻干燥参数,预冻温度:-20~-50℃,冷冻干燥温度-45~-60℃,真空度<300pa,产量化生产可操作性强,不发泡不融化,干膏粉质地疏松,解决了现有技术导致干膏粉发泡、融化、质地硬现象。(3)现有技术:申请号cn201811635810.9,发明名称:苓桂术甘汤指纹图谱的检测方法,存在以下缺陷:①未明确时间段的洗脱条件,峰分离度较差;②供试品溶液使用95%乙醇加热回流提取3h,提取时间较长,成本高。本发明:①本发明明确时间段的洗脱条件,峰分离度较好,克服了现有技术峰分离度较差的技术问题;②本发明采取煎煮提取,时间短,成本低,克服了现有技术供试品溶液使用95%乙醇加热回流提取3h,提取时间较长,成本高的技术问题。2、对本发明建立的薄层色谱方法鉴别,通过对不同厂家的硅胶g薄层板以及不同展开温度、不同的相对湿度等影响因素的试验,结果耐用性好,主斑点清晰。3、本发明建立的液相鉴别方法通过对不同柱温、不同流速、不同色谱柱进行耐用性考察,结果表明,不同条件下色谱图中峰型尖锐、对称,分离度良好,同时阴性无干扰,表明本方法对不同流速、不同柱温、不同色谱柱耐用性良好。4、本发明建立了以指纹图谱为主的整体质量检测方法,克服了单纯的指标成分的定性鉴别和定量分析,难以反映物质基准质量的优劣的技术问题。5、本发明建立的指纹图谱经方法学考察显示,专属性、整体性、仪器精密度、重复性、耐用性良好;不同流速、不同色谱柱、不同仪器、不同柱温、不同酸比例、不同仪器条件下测定结果基本一致,色谱图中各共有峰峰型尖锐,对称,分离度良好,相似度>0.95。6、本发明建立的高效液相色谱法进行含量测定具有专属性,经过线性关系的考察表明肉桂酸在0.02μg~0.4995μg范围内线性良好;经过仪器精密度试验仪器精密度良好;重复性良好;供试品溶液在24小时内稳定性良好,准确度较好。附图说明图1苓桂术甘汤物质基准工艺验证指纹图谱对比图[1.lgzgt-b-180625-t04、2.lgzgt-b-180625-t05、3.lgzgt-b-180625-t06、4.lgzgt-b-180626-d07、5.lgzgt-b-180626-d08、6.lgzgt-b-180626-d09、7.肉桂酸对照品溶液、8.桂枝饮片溶液、9.甘草药材溶液、10.甘草饮片溶液]图2桂枝薄层色谱图[青岛海洋硅胶gf254薄层板(规格:10×10cm)、温度:22.8℃、湿度:74%;1.缺桂枝阴性样品溶液3μl(批号:lgzgt-gzy-180709-d01)、2.肉桂酸对照品溶液10μl(批号:110786-201604,中国食品药品检定研究院)、3.桂枝饮片溶液10μl(批号:gz-20171031-ygy-yp09)、4.供试品溶液2μl(批号:lgzgt-b-180707-d04)、5.供试品溶液3μl(批号:lgzgt-b-180707-d04)、6.供试品溶液5μl(批号:lgzgt-b-180707-d04)]图3桂枝薄层耐用性考察色谱图[青岛海洋/山东烟台/德国默克硅胶gf254薄层板(规格:10×10cm,);1.缺桂枝阴性样品溶液3μl(批号:lgzgt-gzy-180709-d01)、2.肉桂酸对照品溶液5μl(批号:110786-201604,中国食品药品检定研究院)、3.桂枝对照药材溶液10μl(批号:121191-201605,中国食品药品检定研究院)、4.供试品溶液3μl(批号:lgzgt-b-180707-d04)、5.供试品溶液3μl(批号:lgzgt-b-180707-d05)、6.供试品溶液3μl(批号:lgzgt-b-180707-d06)图4甘草薄层鉴别色谱图[青岛海洋硅胶g薄层板(规格:10×10cm);温度:24.8℃;湿度:77%;1.缺甘草阴性样品1μl(批号:lgzgt-gcy-180709-d01)、2.甘草苷对照品1μl(批号:111610-201607,中国食品药品检定研究院)、3.甘草对照药材溶液1μl(批号:120904-201519,中国食品药品检定研究院)、4.供试品溶液1μl(批号:lgzgt-b-180707-d04)、5.供试品溶液1μl(批号:lgzgt-b-180707-d05)、6.供试品溶液1μl(批号:lgzgt-b-180707-d06)图5指纹图谱色谱图图6指纹图谱全波长扫描图[注:图中波长从上到下依次为190、210、230、250、260、270、290、310、330、350、370、390、400nm]图7260nm信息最大化指纹图谱图8不同提取溶媒指纹图谱测定结果图9指纹图谱饮片归属色谱图图10一级质谱解析结果图11色谱峰指认结果图12整体性考察色谱图图13指纹图谱精密度测定色谱图图14指纹图谱稳定性测定色谱图图15指纹图谱重复性测定色谱图图16指纹图谱不同流速测定色谱图图17不同流速试验叠加图(r:对照指纹图谱、s2流速0.8ml/min、s3流速1.2ml/min、s4流速1.0ml/min)图18不同色谱柱指纹图谱测定色谱图图19不同色谱柱试验叠加图(r.对照指纹图谱、s2.菲罗门gemini-c18(4.6×250mm,5μm)s3.waterssymmetryc18(4.6×250mm,5μm)s4.agilentzorbaxsb-c18(4.6×250mm,5μm))图20不同仪器指纹图谱测定色谱图图21不同仪器试验叠加图(r:对照指纹图谱、s2岛津20a、s3安捷伦1260ⅱ)图22指纹图谱不同柱温测定色谱图图23不同柱温试验叠加图(r.对照指纹图谱、s2.35℃、s.3柱温30℃、s4.柱温25℃)图24不同批次物质基准指纹图谱共有模式图-1[r对照图谱、s2.lgzgt-b-180914-d01-1、s3.lgzgt-b-180914-d01-2、s4.lgzgt-b-180915-d02-1、s5.lgzgt-b-180915-d02-2、s6.lgzgt-b-180915-d03-1、s7.lgzgt-b-180915-d03-2、s8.lgzgt-b-180916-d04-1、s9.lgzgt-b-180919-d04-2、s10.lgzgt-b-180919-d05-1、s11.lgzgt-b-180919-d05-2、s12.lgzgt-b-180920-d06-1、s13.lgzgt-b-180920-d06-2、s14.lgzgt-b-180920-d07-1、s15.lgzgt-b-180920-d07-2、s16.lgzgt-b-180920-d08-1、s17.lgzgt-b-180921-d08-2、s18.lgzgt-b-180921-d09-1、s19.lgzgt-b-180921-d09-2、s20.lgzgt-b-180921-d10-1、s21.lgzgt-b-180922-d10-2、s22.lgzgt-b-180921-d11-1、s23.lgzgt-b-180922-d11-2、s24.lgzgt-b-180922-d12-1、s25.lgzgt-b-180922-d12-2、s26.lgzgt-b-180922-d13-1、s27.lgzgt-b-180922-d13-2、s28.lgzgt-b-180926-d14-1、s29.lgzgt-b-180926-d14-2、s30.lgzgt-b-180926-d15-1、s31.lgzgt-b-180926-d15-2]图25对照指纹图谱[15个共有峰中峰5:芹糖甘草苷、峰6:甘草苷、峰7:香豆素、峰8:甘草素、峰9:肉桂酸、峰10:桂皮醛、峰15:甘草酸]图26肉桂酸紫外扫描图图27对应实物(冻干粉)色谱图图28专属性考察色谱图图29肉桂酸对照品、供试品溶液峰纯度检查[图a肉桂酸对照品溶液(批号:110786-201604,中国食品药品检定研究院);图b供试品溶液(批号:lgzgt-b-180707-d04)]图30肉桂酸标准曲线图31甘草苷、甘草酸含量测定色谱图图32甘草专属性考察色谱图图33甘草苷标准曲线甘草酸回归方程:y=523.30x-29.535,相关系数:r=0.9998图34甘草酸铵标准曲线具体实施方式下面通过具体实施例,对本发明的技术方案作进一步地具体说明。实施例1处方:茯苓8g、桂枝7g、白术7g、甘草4g。制备方法:(1)称取重量份的药物,备用;(2)煎煮:加水220ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮30分钟;(3)滤过:煎煮至120ml,200目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)加入1/12的淀粉,按常规方法制粒,干燥,得颗粒剂。实施例2处方:茯苓15g、桂枝11g、白术11g、甘草8g。制备方法:(1)称取重量份的药物,备用;(2)煎煮:加水260ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮40分钟;(3)滤过:煎煮至120ml,300目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)加入1/8的糊精,混匀,粉碎,装入胶囊,得胶囊剂。实施例3处方:茯苓12g、桂枝9g、白术9g、甘草6g。制备方法:(1)称取重量份的药物,备用;(2)煎煮:加水240ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮35分钟;(3)滤过:煎煮至120ml,200目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)加入1/12的淀粉,按常规方法制粒,干燥,得颗粒剂。实施例4处方:茯苓12g、桂枝9g、白术9g、甘草6g。制备方法:(1)称取重量份的药物,备用;(2)煎煮:加水240ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮35分钟;(3)滤过:煎煮至120ml,200目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)加入1/8的淀粉,混匀,粉碎,装入胶囊,得胶囊剂。实施例5处方:茯苓12g、桂枝9g、白术9g、甘草6g。制备方法:(1)称取重量份的药物,备用;(2)煎煮:加水240ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮35分钟;(3)滤过:煎煮至120ml,200目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)加入1/9的淀粉,混合均匀,干燥,按常规方法制成丸剂。实施例6处方:茯苓12g、桂枝9g、白术9g、甘草6g。制备方法:(1)称取重量份的药物,备用;(2)煎煮:加水240ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮35分钟;(3)滤过:煎煮至120ml,200目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)加入1/8淀粉,按常规方法压片,干燥,得片剂。实施例7处方:茯苓12g、桂枝9g、白术9g、甘草6g。制备方法:(1)称取重量份的药物,备用;(2)煎煮:加水240ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮35分钟;(3)滤过:煎煮至120ml,200目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)加入1/15的碳酸氢钠,制粒,压片,制成泡腾片。实施例8处方:茯苓12g、桂枝9g、白术9g、甘草6g。制备方法:(1)称取重量份的药物,备用;(2)煎煮:加水240ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮35分钟;(3)滤过:煎煮至120ml,200目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)将干膏粉粉碎,用干膏粉0.2倍量的乙醇,调匀,得膏剂。实施例9处方:茯苓12g、桂枝9g、白术9g、甘草6g。制备方法:(1)称取重量份的药物,备用;(2)煎煮:加水240ml,以明火方式加热,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮35分钟;(3)滤过:煎煮至120ml,200目滤布趁热滤过;(4)滤液经冷冻干燥,干燥条件为:预冻温度:-20~-45℃,冷冻干燥温度-50~-70℃,真空度<300pa,收集干膏粉;(5)将干膏粉粉碎,加入5倍量注射用水,过滤,灭菌,得注射剂。实施例1-9按实施例10-12的检测方法检测实施例10检测方法【鉴别】(1)取本品0.5g,加水10ml使溶解,用乙醚振摇提取1次,每次20ml,合并乙醚液,挥干,残渣加乙醚2ml使溶解,作为供试品溶液,另取桂枝对照药材1g,加水45ml,煎煮25分钟,滤过,滤液同法制成对照药材溶液,再取肉桂酸对照品,用甲醇制成每1ml含0.4mg的溶液,作为对照品溶液,照薄层色谱法(《中国药典》2015年版四部通则0502试验,吸取对照品溶液及对照药材溶液各5μl,供试品溶液3μl,分别点于同一硅胶gf254薄层板上,以环己烷-乙醚-冰醋酸(5:5:0.3)为展开剂,展开,取出,晾干,置紫外光灯下(254nm)检视;供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。(2)取本品约1g,加水35ml,超声处理25分钟,滤过,滤液用乙醚振摇提取1次,每次7ml,弃去乙醚液,水液用水饱和正丁醇振摇提取2次,每次15ml,合并正丁醇液,用氨试液振摇提取1次,每次25ml,合并氨试液,用盐酸调ph值至3~4;再用乙酸乙酯振摇提取1次,每次25ml,合并乙酸乙酯液,蒸干,残渣加甲醇2ml使溶解,作为供试品溶液;另取甘草对照药材1g,加水45ml,煎煮25分钟,滤过,同法制成对照药材溶液;再取甘草苷对照品,加70%乙醇制成每1ml含0.5mg的溶液,作为对照品溶液;照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液5μl、对照药材溶液及供试品溶液各1μl,分别点于同一硅胶g薄层板上,以三氯甲烷-甲醇-水(13:7:2)5~10℃放置的下层液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置日光和紫外光灯(365nm)下检视,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点或荧光斑点。【指纹图谱】照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序进行梯度洗脱;检测波长为260nm;理论板数按肉桂酸峰计算应不低于5000。流动相梯度洗脱程序如下:参照物溶液的制备取肉桂酸对照品适量,精密称定,加甲醇制成每1ml含20μg的溶液,即得。供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入70%甲醇15ml,称定重量,用超声处理(功率250w,频率40khz)25分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取参照物溶液和供试品溶液各10μl,注入液相色谱仪,测定,记录色谱图,即得。供试品指纹图谱中应呈现与参照物色谱峰保留时间相同的色谱峰,供试品色谱图应与对照指纹图谱基本一致,有相对应的15个共有峰,按中药色谱指纹图谱相似度评价系统,以共有峰计算相似度,供试品指纹图谱与对照指纹图谱的相似度不得低于0.90。对照指纹图谱见图25;【含量测定】桂枝照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.5%磷酸溶液(34:66)为流动相;检测波长为276nm;理论板数按肉桂酸峰计算应不低于7000。对照品溶液的制备取肉桂酸对照品适量,精密称定,加稀乙醇制成每1ml含10μg的溶液,即得。供试品溶液的制备取本品0.2g,精密称定,置具塞锥形瓶中,精密加入稀乙醇45ml,称定重量,超声处理(功率250w,频率40khz)25~35分钟,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。本品按干燥品计算,每g含桂枝以肉桂酸(c9h8o2)计,应为0.50~2.0mg。甘草照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序进行梯度洗脱;检测波长237nm;理论塔板数按甘草苷峰计算应不低于5000。流动相梯度洗脱程序如下:对照品溶液的制备取甘草苷,甘草酸铵对照品适量,精密称定,加50%乙醇制成每1ml含甘草苷20μg和甘草酸铵0.1mg的溶液,即得(甘草酸重量=甘草酸铵重量/1.0207)。供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入50%乙醇25ml,称定重量,以超声处理(功率500w,频率40khz)25分钟,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。本品按干燥品计算,每g含甘草以甘草苷(c21h22o9)计,应为5.0~15.0mg,以甘草酸(c42h62o16)计,应为5.0~30.0mg。实施例11【鉴别】(1)取本品1.5g,加水10ml使溶解,用乙醚振摇提取3次,每次30ml,合并乙醚液,挥干,残渣加乙醚2ml使溶解,作为供试品溶液,另取桂枝对照药材1g,加水55ml,煎煮35分钟,滤过,滤液同法制成对照药材溶液,再取肉桂酸对照品,用甲醇制成每1ml含0.4mg的溶液,作为对照品溶液,照中国药典2015年版四部通则0502薄层色谱法试验,吸取对照品溶液及对照药材溶液各5μl,供试品溶液3μl,分别点于同一硅胶gf254薄层板上,以环己烷-乙醚-冰醋酸(5:5:0.3)为展开剂,展开,取出,晾干,置254nm紫外光灯下检视;供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。(2)取本品约1g,加水45ml,超声处理35分钟,滤过,滤液用乙醚振摇提取3次,每次13ml,弃去乙醚液,水液用水饱和正丁醇振摇提取4次,每次25ml,合并正丁醇液,用氨试液振摇提取3次,每次35ml,合并氨试液,用盐酸调ph值至3~4;再用乙酸乙酯振摇提取3次,每次35ml,合并乙酸乙酯液,蒸干,残渣加甲醇2ml使溶解,作为供试品溶液;另取甘草对照药材1g,加水55ml,煎煮35分钟,滤过,同法制成对照药材溶液;再取甘草苷对照品,加70%乙醇制成每1ml含0.5mg的溶液,作为对照品溶液;照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液5μl、对照药材溶液及供试品溶液各1μl,分别点于同一硅胶g薄层板上,以三氯甲烷-甲醇-水(13:7:2)5~10℃放置的下层液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置日光和紫外光灯(365nm)下检视,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点或荧光斑点。【指纹图谱】照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,0.05%磷酸溶液为流动相b,按按下表中的规定进行梯度洗脱;检测波长为260nm;理论板数按肉桂酸峰计算应不低于5000。参照物溶液的制备取肉桂酸对照品适量,精密称定,加甲醇制成每1ml含20μg的溶液,即得。供试品溶液的制备取本品约1.0g,精密称定,置具塞锥形瓶中,精密加入70%甲醇15ml,称定重量,用超声处理(功率250w,频率40khz)35分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取参照物溶液和供试品溶液各10μl,注入液相色谱仪,测定,记录色谱图,即得。供试品指纹图谱中应呈现与参照物色谱峰保留时间相同的色谱峰,供试品色谱图应与对照指纹图谱基本一致,有相对应的15个共有峰,按中药色谱指纹图谱相似度评价系统,以共有峰计算相似度,供试品指纹图谱与对照指纹图谱的相似度不得低于0.90。对照指纹图谱见图25。【含量测定】桂枝照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.5%磷酸溶液(34:66)为流动相;检测波长为276nm;理论板数按肉桂酸峰计算应不低于7000。对照品溶液的制备取肉桂酸对照品适量,精密称定,加稀乙醇制成每1ml含10μg的溶液,即得。供试品溶液的制备取本品0.5g,精密称定,置具塞锥形瓶中,精密加入稀乙醇45~55ml,称定重量,以超声处理(功率250w,频率40khz)25~35分钟,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。本品按干燥品计算,每g含桂枝以肉桂酸(c9h8o2)计,应为0.50~2.0mg。甘草照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以0.05%磷酸溶液为流动相b,按下表中的规定进行梯度洗脱;检测波长237nm;理论塔板数按甘草苷峰计算应不低于5000。对照品溶液的制备取甘草苷,甘草酸铵对照品适量,精密称定,加50%乙醇制成每1ml含甘草苷20μg和甘草酸铵0.1mg的溶液,即得(甘草酸重量=甘草酸铵重量/1.0207)。供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入50%乙醇25ml,称定重量,以超声处理(功率500w,频率40khz)35分钟,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。本品按干燥品计算,每g含甘草以甘草苷(c21h22o9)计,应为5.0~15.0mg,以甘草酸(c42h62o16)计,应为5.0~30.0mg。实施例12【鉴别】(1)取本品1g,加水10ml使溶解,用乙醚振摇提取2次,每次25ml,合并乙醚液,挥干,残渣加乙醚2ml使溶解,作为供试品溶液,另取桂枝对照药材1g,加水50ml,煎煮30分钟,滤过,滤液同法制成对照药材溶液,再取肉桂酸对照品,用甲醇制成每1ml含0.4mg的溶液,作为对照品溶液,照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液及对照药材溶液各5μl,供试品溶液3μl,分别点于同一硅胶gf254薄层板上,以环己烷-乙醚-冰醋酸(5:5:0.3)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视;供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。(2)取本品约1g,加水40ml,超声处理30分钟,滤过,滤液用乙醚振摇提取2次,每次10ml,弃去乙醚液,水液用水饱和正丁醇振摇提取3次,每次20ml,合并正丁醇液,用氨试液振摇提取2次,每次30ml,合并氨试液,用盐酸调ph值至3~4;再用乙酸乙酯振摇提取2次,每次30ml,合并乙酸乙酯液,蒸干,残渣加甲醇2ml使溶解,作为供试品溶液;另取甘草对照药材1g,加水50ml,煎煮30分钟,滤过,同法制成对照药材溶液;再取甘草苷对照品,加70%乙醇制成每1ml含0.5mg的溶液,作为对照品溶液;照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液5μl、对照药材溶液及供试品溶液各1μl,分别点于同一硅胶g薄层板上,以三氯甲烷-甲醇-水(13:7:2)5~10℃放置的下层液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置日光和紫外光灯(365nm)下检视,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点或荧光斑点;【指纹图谱】照高效液相色谱法(《中国药典》2015年版四部通则0512)测定;色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,0.05%磷酸溶液为流动相b,按以下表中的规定进行梯度洗脱;检测波长为260nm;理论板数按肉桂酸峰计算应不低于5000;参照物溶液的制备取肉桂酸对照品适量,精密称定,加甲醇制成每1ml含20μg的溶液,即得;供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入70%甲醇20ml,称定重量,用超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得;测定法分别精密吸取参照物溶液和供试品溶液各10μl,注入液相色谱仪,测定,记录色谱图,即得;供试品指纹图谱中应呈现与参照物色谱峰保留时间相同的色谱峰,供试品色谱图应与对照指纹图谱基本一致,有相对应的15个共有峰,按中药色谱指纹图谱相似度评价系统,以共有峰计算相似度,供试品指纹图谱与对照指纹图谱的相似度不得低于0.90;对照指纹图谱见图25。【含量测定】桂枝照高效液相色谱法(《中国药典》2015年版四部通则0512)测定;色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.5%磷酸溶液(34:66)为流动相;检测波长为276nm;理论板数按肉桂酸峰计算应不低于7000;对照品溶液的制备取肉桂酸对照品适量,精密称定,加稀乙醇制成每1ml含10μg的溶液,即得;供试品溶液的制备取本品约0.3g,精密称定,置具塞锥形瓶中,精密加入稀乙醇50ml,称定重量,以超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,滤过,取续滤液,即得;测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得;本品按干燥品计算,每g含桂枝以肉桂酸(c9h8o2)计,应为0.50~2.0mg;甘草照高效液相色谱法《中国药典》2015年版四部通则0512)测定;色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序表进行梯度洗脱;检测波长237nm;理论塔板数按甘草苷峰计算应不低于5000;对照品溶液的制备取甘草苷,甘草酸铵对照品适量,精密称定,加50%乙醇制成每1ml含甘草苷20μg和甘草酸铵0.1mg的溶液,即得(甘草酸重量=甘草酸铵重量/1.0207);供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入50%乙醇25ml,称定重量,以超声处理(功率500w,频率40khz)30分钟,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得;测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得;本品按干燥品计算,每g含甘草以甘草苷(c21h22o9)计,应为5.0~15.0mg,以甘草酸(c42h62o16)计,应为5.0~30.0mg。为了过一步验证本发明的可行性,发明人进行了一系列的实验,具体如下:实验例1工艺实验1、前处理根据古籍原文及考证结果,本处方所用饮片由药材按相应的炮制标准制得,茯苓饮片规格为8~12mm的方块,桂枝饮片规格为直径不超过1厘米,长度5~10mm的短段,白术饮片规格为2~4mm厚片,甘草饮片规格为2~4mm厚片,可直接投料,无需饮片前处理。(1)煎煮终点重量的确定由于处方原文中以中间体(提取液)体积为煎煮终点,但实验过程中实时量取药液体积操作不便,故以重量代替体积作为煎煮终点,我们将煎煮终点及加热方式同时进行考察,煎煮终点重量考察结果如下:处方药味均按四分法取样,称取6份日处方量饮片(茯苓12g,桂枝9g,白术9g,甘草6g),加水240ml,饮片+水+砂锅称重,记录重量为m1。分别采用明火及电陶炉(武火:2200w,文火:400w)加热,加盖煎煮,武火煮沸后改文火,文火煎煮一段时间后将提取液倒出,记录重量,量取药液体积,根据实际药液体积,决定是否继续煎煮,过程中实时监控重量及滤液体积,直至近煎煮终点,记录重量m2;根据煎煮过程中减失的重量m1-m2,确定煎煮时间。结果见表1。表1苓桂术甘汤物质基准煎煮重量考察结果由上表可知,若以煎煮终点体积接近120ml为准评价减失重量,应以明火2、3、4、电陶炉1、2数据计算平均减失重量,煎煮终点减失重量为80.69g,以此减失重量控制煎煮终点。(2)加热方式考察古代煎煮方式为明火煎煮,现拟用燃气灶作为明火加热方式,同时考虑到电陶炉加热方式通过功率控制加热效率,其控制火力作用更稳定,故拟采用出膏率、肉桂酸、甘草苷、甘草酸总量为指标,考察燃气灶明火与电陶炉加热方式,若两种加热方式结果无差异,则选择电陶炉作为加热方式。称取4份日处方量饮片(取茯苓12g,桂枝9g,白术9g,甘草6g),加水240ml,置于0.75l砂锅中,加盖煎煮,武火煎煮至沸,文火煎煮至120ml,提取液用200目筛滤过,记录提取液体积;明火和电陶炉(武火为2200w,文火为400w)煎煮均制备两份提取液,按照指标成分的测定方法,测定提取液中肉桂酸、甘草苷、甘草酸含量、出膏率,考察明火和电陶炉(武火为2200w,文火为400w)加热方式对指标性成分的影响。结果见表2。中间体(提取液)出膏率测定方法:精密量取提取液20ml,置已干燥至恒重的蒸发皿w1中,在水浴上蒸干后,于105℃干燥3小时,置干燥器中冷却30分钟,迅速精密称定重量w2。表2加热方式考察结果试验结果表明,明火及电陶炉两种加热方式,含量测定指标测定总量无显著性差异,但煎煮时间明火较电陶炉时间长,出膏率有差别,综合分析,两种加热方式存在差异,基于遵古原则,选择明火煎煮方式。(3)煎煮时间考察由于以重量代替体积作为煎煮终点在煎煮过程中操作仍不便,同时已固定加热方式,故现对煎煮时间代替重量作为煎煮终点,现进行煎煮终点时间考察如下:采用明火加热方式,称取日处方量饮片(茯苓12g,桂枝9g,白术9g,甘草6g),加水240ml,置于0.75l砂锅中,加盖煎煮,武火煎煮至沸,文火煎煮至120ml,平行制备4份,记录煎煮时间及提取液体积,以此确定煎煮时间。结果见表3。表3煎煮时间考察结果结论:通过平行4份经典名方物质基准煎煮时间考察,确定煎煮时间为35分钟。(4)煎煮工艺总结综上,暂定苓桂术甘汤物质基准煎煮优选工艺为:取茯苓12g,桂枝9g,白术9g,甘草6g加水240ml,置于0.75l砂锅中,采用明火加热,加盖煎煮,武火煎煮至沸,文火煎煮35分钟。3、滤过、浓缩与干燥(1)滤过工艺研究分别取煎煮时间考察项下提取液分别趁热过200目及300目滤布,观察二者滤液差异。结果表明:两种规格滤材均易过滤,通过观察过滤后药液状态,滤液澄明度差异不大,故选择200目滤布进行滤过。(2)浓缩工艺研究由物质基准制备结果可知,提取液为120ml左右,可以直接用于干燥,故不进行浓缩,直接进行冻干工序处理。(3)干燥工艺研究取滤过工艺考察提取液进行冷冻干燥,(预冻温度:-20~-50℃,冷冻干燥温度-45~-60℃,真空度<300pa),观察干燥情况。表4物质基准工艺研究考察结果综上所述:暂定本发明苓桂术甘汤物质基准优选制备工艺为:取茯苓12g、桂枝9g、白术9g、甘草6g,置于0.75l砂锅中,以明火方式加热,加水240ml,加盖煎煮,武火煮沸转为文火煎煮保持微沸,煎煮35分钟,200目滤布趁热滤过,经冷冻干燥,收集干膏粉,即得。4、关键工艺步骤和中间体(1)工艺验证样品制备称取3份日处方量饮片(茯苓12g(批号:fl-20170904-wyx-yp02),桂枝9g(批号:gz-20171031-ygy-yp09),白术9g(批号:bz-20170925-zpa-yp04),甘草6g(批号:gc-20171017-mhjq-yp02)),加水240ml,置于0.75l砂锅中,采用明火加热方式,加盖煎煮,武火煎煮至沸,文火煎煮时间35分钟,煎煮至约120ml,200目滤布趁热滤过,提取液留样25ml,其余滤液经冷冻干燥。(预冻温度:-20~-45℃,冷阱温度:-50~-70℃,真空度:<300pa),收集干膏粉,计算出膏率。取样,测定干膏粉中水分、浸出物、肉桂酸、甘草苷、甘草酸含量,并分别计算工艺过程中含量转移率。另按照上述工艺,进行单味饮片及药材提取液制备,进行指纹图谱测定。(2)工艺验证样品测定结果见表5~6,图1。表5苓桂术甘汤物质基准工艺验证数据汇总表6苓桂术甘汤物质基准工艺验证相对保留时间结果(3)工艺确定从煎煮体积角度分析,三批工艺验证中间体体积均值为114ml,与原文考证终点120ml接近,证明工艺煎煮时间确定合理。从肉桂酸、甘草苷、甘草酸总量上分析,三批验证提取液与干膏粉数据均基本平行,且工艺过程中物质传递损失较小;从浸出物、水分上分析,三批验证干膏粉无明显差异。从指纹图谱上分析,峰1、6、9、10、12为桂枝色谱峰,峰2、3、4、5、7、8、11、13、14、15为甘草色谱峰。暂以9号峰为参照峰计算相对保留时间,结果表明、药材、饮片、提取液、干膏粉色谱图中共有峰,其相对保留时间rsd小于2.0%,故所确定的物质基准制备工艺稳定可行。综上,确定物质基准最佳工艺为:取茯苓12g、桂枝9g、白术9g、甘草6g,置于0.75l砂锅中,以明火方式加热,加水240ml,加盖煎煮,武火煮沸转为小火煎煮保持微沸,煎煮35分钟,200目滤布趁热滤过,经冷冻干燥(预冻温度:-20~-50℃,冷冻干燥温度-50~-70℃,真空度<300pa),收集干膏粉,即得。6.3.2.1.1多批次物质基准的制备目前饮片以3个产地,不少于15个批次为原则进行收集;桂枝收集广西平南县、广东高要、广西容县三个产地,每个产地5批;甘草收集甘肃民勤、内蒙古阿拉善左旗、内蒙古阿拉善三个产地,每个产地5批;每个药味15批次饮片均按浸出物含量高低顺序排序,制备15批次物质基准。15批饮片排序组合结果见下表7。表7不同批次物质基准投料汇总注:编号1~15,即为15个组合方式。按照确定工艺,采用日处方量进行投料,每组实验设计两个平行样,每个平行样包括9份日处方量,提取液混合,再分瓶冷冻干燥。得到15批物质基准对应实物,15批次物质基准出膏率测定结果见下表8,测定范围为10.69%~14.16%,平均值为12.1%,确定物质基准出膏率范围为7.00%~25.00%。表8多批次物质基准批次信息实验例2质量检测方法研究1、分析方法的验证列入检测方法项目的分析方法学验证,按照现行版《中国药典》中有关的指导原则执行,方法学验证资料如下。(1)鉴别本品由四味中药制成,系用水煎煮工艺制成的复方制剂,选用了专属性强,快速、简便、重现性好的薄层鉴别方法,对方中茯苓、桂枝、白术、甘草的主要特征成分进行鉴别试验研究。结果概述如下:①桂枝桂枝中主要含有桂皮醛、肉桂酸、香豆素及其衍生物等苯丙素类化合物。挥发油是桂枝的主要活性成分(挥发油含量约为0.69%),主要含有桂皮醛、邻甲氧基桂皮醛、苯甲醛等醛类成分。根据以上化学成分对桂枝进行如下薄层摸索实验。a建立薄层色谱方法方法一:参考文献“五苓片中桂枝、茯苓的薄层色谱鉴别”进行摸索取本品及缺桂枝的阴性样品各1g,加水10ml使溶解,用乙醚振摇提取1次,每次25ml,合并乙醚液,挥干,残渣加乙醚2ml使溶解,作为供试品溶液及缺桂枝阴性样品溶液。另取桂枝饮片1g,加水50ml,煎煮30分钟,滤过,同法制成对照药材溶液。再取肉桂酸对照品,用50%甲醇制成每1ml含0.2mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取上述四种溶液各3μl,点于同一硅胶gf254薄层板上,以环己烷-乙醚-冰醋酸(5:5:0.3)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。结果分析:供试品色谱中,在与肉桂酸、桂枝药材色谱相应的位置上,有相同的斑点,且阴性无干扰。以肉桂酸为对照品,以桂枝饮片溶液作为对照,在紫外光(254nm)下检视,方法可行,但对照品及桂枝饮片溶液斑点较供试品溶液斑点浅,故下一步对对照品及桂枝饮片溶液点样量进行摸索。方法二:点样量摸索吸取“方法一”制备的三种样品溶液,将肉桂酸对照品溶液、桂枝饮片溶液的点样量增加至10μl,阴性样品的点样量为3μl,供试品点样量变为2μl,3μl和5μl,分别点于同一硅胶gf254薄层板上,以环己烷-乙醚-冰醋酸(5:5:0.3)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。见图2。结果表明,肉桂酸对照品溶液与桂枝饮片点样量均为10μl,供试品溶液点样量分别为2μl,3μl和5μl,相应位置下的显色斑点均清晰可见,没有出现拖尾现象,故确定肉桂酸对照品优选浓度为0.2mg/ml点样量10μl,桂枝饮片溶液0.5g/ml点样量10μl,供试品溶液点样量优选为3μl。综合分析,确认优选薄层鉴别方法:取本品1g,加水10ml使溶解,用乙醚振摇提取1次,每次25ml,合并乙醚液,挥干,残渣加乙醚2ml使溶解,作为供试品溶液。另取桂枝对照药材1g,加水50ml,煎煮30分钟,滤过,滤液同法制成对照药材溶液。再取肉桂酸对照品,用甲醇制成每1ml含0.4mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液5μl,对照药材溶液10μl,供试品溶液3μl,分别点于同一硅胶gf254薄层板上,以环己烷-乙醚-冰醋酸(5:5:0.3)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。b耐用性考察按上述确定方法进行耐用性试验,考察不同厂家的硅胶gf254的薄层板(烟台化学工业研究所和青岛海洋化工厂、默克)以及不同展开温度(4℃和25℃)以及相对湿度(74%和85%)等影响因素。见图3。结论:通过对低温、常温、高湿环境及不同厂家的硅胶gf254薄层板进行耐用性考察,结果不同影响因素下,此桂枝薄层鉴别条件耐用性良好。故将此薄层方法列入本发明正文。c优选方法确定取本品1g,加水10ml使溶解,用乙醚振摇提取1次,每次25ml,合并乙醚液,挥干,残渣加乙醚2ml使溶解,作为供试品溶液。另取桂枝对照药材1g,加水50ml,煎煮30分钟,滤过,滤液同法制成对照药材溶液。再取肉桂酸对照品,用甲醇制成每1ml含0.4mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液5μl,对照药材溶液10μl,供试品溶液3μl,分别点于同一硅胶gf254薄层板上,以环己烷-乙醚-冰醋酸(5:5:0.3)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。②甘草甘草主要化学成分为三萜类和黄酮类,除此之外还含有多糖、有机酸和香豆素等。根据以上化学成分对甘草进行如下薄层色谱的摸索实验。a建立薄层色谱方法方法一:参考《中国药典》2015年版一部“甘草”项下薄层鉴别方法取对应实物(冻干粉)及缺甘草阴性冻干粉1g,加水40ml,超声30分钟,滤过,用乙醚振摇提取2次,每次10ml,弃去乙醚液,水液用水饱和正丁醇振摇提取3次,每次20ml,合并正丁醇液,用氨试液振摇提取2次,每次30ml,合并氨试液,用盐酸调ph值至3~4。再用乙酸乙酯振摇提取2次,每次30ml,合并乙酸乙酯液,蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。另取甘草饮片1g,加水50ml,煎煮30分钟,滤过,同法制成对照药材溶液。再取甘草苷对照品,加70%乙醇甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取上述四种溶液适量,分别点于同一1%naoh硅胶g薄层板上,以三氯甲烷-甲醇-水(13:7:2)10℃以下放置的下层液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置日光及紫外光灯(365nm)下检视,结论:供试品色谱中,在与甘草饮片色谱和对照品色谱相应的位置上,显示相同颜色的斑点,但是拖尾较为严重,分离效果较差,0.5μl的点样量较小,定量较难且不准确,故进行点样量摸索。方法二:点样量摸索吸取上述四种溶液适量,分别点于同一硅胶g薄层板上,以三氯甲烷-甲醇-水(13:7:2)5~10℃放置的下层液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置日光及紫外光灯(365nm)下检视。结果分析:供试品色谱中,在与甘草饮片色谱和对照品色谱相同位置上,显相同颜色的斑点,且阴性无干扰,但是各样品斑点拖尾严重,需稀释供试品浓度在进行点样量摸索。方法三:供试品溶液浓度调整及点样量确定取对应实物(冻干粉)及缺甘草阴性冻干粉0.5g,加水40ml,超声处理30分钟,滤过,用乙醚振摇提取2次,每次10ml,弃去乙醚液,水液用水饱和正丁醇振摇提取3次,每次20ml,合并正丁醇液,用氨试液振摇提取2次,每次30ml,合并氨试液,用盐酸调ph值至3~4。再用乙酸乙酯振摇提取2次,每次30ml,合并乙酸乙酯液,蒸干,残渣加甲醇2ml使溶解,作为供试品溶液。另取甘草对照药材0.5g,加水50ml,煎煮30分钟,滤过,同法制成对照药材溶液。再取甘草苷对照品,加70%乙醇制成每1ml含0.5mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取上述四种溶液适量,分别点于同一硅胶g薄层板上,以三氯甲烷-甲醇-水(13:7:2)10℃以下放置的下层液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置紫外光灯(365nm)下检视。(如图4)结论:供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点,并且阴性无干扰,方法可行。确定对照品、甘草对照药材及供试品点样量优选均为1μl。b耐用性考察按上述确定方法进行耐用性试验,考察不同厂家的硅胶g薄层板(烟台化学工业研究所和青岛海洋化工厂、默克)以及不同展开温度(2±5℃和25±5℃)以及相对湿度(70±5%和85%)等影响因素。结论:通过对低温、常温、高湿环境及不同厂家硅胶g薄层板进行耐用性考察,结果不同影响因素下,此薄层鉴别条件耐用性良好。c优选方法确定取本品约1g,加水40ml,超声处理30分钟,滤过,滤液用乙醚振摇提取2次,每次10ml,弃去乙醚液,水液用水饱和正丁醇振摇提取3次,每次20ml,合并正丁醇液,用氨试液振摇提取2次,每次30ml,合并氨试液,用盐酸调ph值至3~4。再用乙酸乙酯振摇提取2次,每次30ml,合并乙酸乙酯液,蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。另取甘草对照药材1g,加水50ml,煎煮30分钟,滤过,同法制成对照药材溶液。再取甘草苷对照品,加70%乙醇制成每1ml含0.5mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取对照品溶液5μl、对照药材溶液及供试品溶液各1μl,分别点于同一硅胶g薄层板上,以三氯甲烷-甲醇-水(13:7:2)5~10℃放置的下层液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置日光和紫外光灯(365nm)下检视。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点或荧光斑点。(2)指纹图谱由于单纯的指标成分的定性鉴别和定量分析,难以反映物质基准质量的优劣。作为衡量物质基准对应实物是否与物质基准基本一致的标准参照物,其质量应加强专属性鉴别和多成分、整体质量控制。因而物质基准质量控制要重视以指纹图谱为主的整体质量控制。①仪器与试药液相色谱仪:岛津lc-20a,安捷伦1260ⅱ;色谱柱:watersc18(5μm,250×4.6mm);agilentzorbaxsbc18(5μm,250×4.6mm)等。电子分析天平:常熟市双杰测试仪器厂jj1000(百分之一)、赛多利斯科学仪器(北京)有限公司bsa224s-cw(万分之一)梅特勒-托利多仪器(上海)有限公司me503t(千分之一)乙腈为色谱纯,oceanpak生产;磷酸为色谱纯,山东西亚化学股份有限公司生产;甲醇为分析纯,广州化学试剂厂生产;水为超纯水,上海和泰仪器有限公司。甘草苷对照品(批号:111610-201607,纯度:93.1%),甘草酸铵对照品(批号:110731-201619,纯度:93.0%),肉桂酸(批号:110786-201604,纯度:98.8%)购自中国食品药品检定研究院。②色谱条件的摸索方法一:参照《中国药典》2015年版一部“甘草”项下含量测定方法色谱条件与系统适用性试验waterssymmtryc18(4.6×250mm,5μm)为色谱柱;以乙腈为流动相a,以0.05%磷酸溶液为流动相b,按下表中的规定进行梯度洗脱;流速为1ml/min,柱温为30℃;检测波长为260nm。见表9。表9流动相梯度洗脱程序参照物溶液的制备供试品溶液的制备取本品约(批号:lgzgt-b-180707-d04)0.5g,精密称定,置具塞锥形瓶中,精密加入70%甲醇20ml,密塞,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取参照物溶液和供试品溶液各10μl,注入液相色谱仪,测定,记录色谱图,即得。结果分析:在该流动相系统中,22~24min及62~76min之间的峰分离度较差,且23min的峰型对称性较差,更改流动相比例后重新进行进样。方法二:将流动相梯度洗脱条件进行调整,其它条件不变,具体梯度如下表10和图5。表10流动相梯度洗脱程序实验分析:在该梯度条件下,色谱峰之间的分离度良好,在这个流动相系统中体现有效信息最大化原则,增加流动相梯度时间。③采集信息最大化为考察供试品所包含的主要成分是否在图谱中体现,是否满足有效信息最大化原则,精密吸取供试品溶液10μl,以乙腈为流动相a,0.05%磷酸溶液为流动相b,按下表中的规定进行梯度洗脱;流速为每分钟1ml;检测波长为全波长(190~400nm),记录供试品指纹图谱和空白溶剂图谱,结果如图6~图7。表11流动相梯度洗脱程序结果分析:由上图可知采集时间为110分钟时,色谱峰已基本采集完毕,波长为260nm下,可以兼顾各色谱峰信息,该色谱条件已达最大化信息采集。④供试品溶液制备方法的选择①提取溶媒类型选择a.70%甲醇超声处理:取本品(批号:lgzgt-b-180707-d04)约0.5g,精密称定,置具塞锥形瓶中,精密加入70%甲醇20ml,称定重量,超声处理(250w,40khz)30分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。b.水饱和正丁醇萃取:取本品(批号:lgzgt-b-180707-d04)约0.5g,精密称定,置具塞锥形瓶中,精密加入70%甲醇50ml,称定重量,超声处理(250w,40khz)30分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取滤液25ml,滤液蒸干,残渣加水25ml使溶解,用水饱和正丁醇萃取3次,每次25ml,合并正丁醇液,蒸干,残渣加甲醇适量使溶解,转移至10ml量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。c.乙酸乙酯萃取:取本品(批号:lgzgt-b-180707-d04)约0.5g,精密称定,置具塞锥形瓶中,精密加入70%甲醇50ml,称定重量,超声处理(250w,40khz)30分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取滤液25ml,滤液蒸干,残渣加水25ml使溶解,用乙酸乙酯萃取3次,每次25ml,合并乙酸乙酯液,蒸干,残渣加甲醇适量使溶解,转移至10ml量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。按上述确定的色谱条件测定,记录不同溶媒提取的同一样品的供试品溶液色谱图,结果见图8。结果表明:通过上图可知,70%甲醇提取色谱图中在69.5分钟时正丁醇萃取和乙酸乙酯萃取的色谱图多一个色谱峰。正丁醇萃取的峰响应值相对70%甲醇提取较小,乙酸乙酯萃取色谱图缺少峰较多;故优选70%甲醇超声处理为供试品制备方法。⑤峰归属及参照物的选择a药味归属按照物质基准制备方法,制备单味药材的冻干粉及缺单味药的阴性样品冻干粉,按照确定的指纹图谱供试品溶液制备方法制备供试品溶液,按照确定的色谱条件进行测定,确定冻干粉指纹图谱中各个色谱峰归属于哪味饮片,见图9和表12。表12药味归属表实验结论:物质基准色谱峰主要为桂枝及甘草特征峰,流动相空白无干扰,无茯苓及白术特征色谱峰。b色谱峰指认通过文献调研及一级质谱推测成分:选择肉桂酸、甘草苷、甘草酸、芹糖甘草苷、桂皮醛等对照品进行峰定位验证。(见图10和图11)。结论:确认苓桂术甘汤物质基准含有甘草苷、甘草酸、桂皮醛、肉桂酸、香豆素、芹糖甘草苷、甘草素成分。c参照物的选择其中肉桂酸色谱峰保留时间适中,响应值较高,达到基线分离,故选择肉桂酸作为对照品参照峰,并将对肉桂酸标记为峰s,同时将肉桂酸对照品作为参照物。⑥方法的初步确定色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序表进行梯度洗脱;检测波长为260nm,流速为每分钟1ml,柱温30℃。理论板数按肉桂酸峰计算应不低于5000。见表13。表13流动相梯度洗脱程序参照物溶液的制备取肉桂酸对照品适量,精密称定,加甲醇制成每1ml含20μg的溶液,即得。供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入70%甲醇20ml,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取参照物溶液和供试品溶液各10μl,注入液相色谱仪,测定,记录色谱图,即得。⑦方法学考察a专属性及整体性试验为考察空白溶剂是否有干扰,结果空白溶剂无干扰。同时也对供试品整体性进行了考察,结果基本满足了信息量最大的原则(见表14,图12)。表14流动相梯度洗脱程序结果分析:通过空白溶剂图谱和供试品溶液色谱峰的比较发现空白无干扰。b精密度试验取本品约(批号:lgzgt-b-180707-d04)0.5g,精密称定,按正文供试品溶液的制备和测定法项下操作,连续进样6次,对其相对保留时间及相对峰面积进行计算,其相对保留时间及相对峰面积具体测定结果见表15~16,图13。表15指纹图谱精密度相对保留时间计算结果表16指纹图谱精密度相对峰面积汇总结果结果表明:相对保留时间差异不大,rsd<2.0%,仪器精密度良好。相对峰面积rsd<10.0%,说明仪器精密度良好。c稳定性试验取本品约(批号:lgzgt-b-180707-d04)0.5g,精密称定,按正文供试品溶液的制备和测定法项下操作,分别在制备后放置0、3、6、9、12、24小时进样测定,对其相对保留时间及相对峰面积进行计算,其相对保留时间及相对峰面积具体测定结果如下表17~表18,图14。表17指纹图谱稳定性相对保留时间计算结果表18指纹图谱稳定性相对峰面积汇总结果结果表明,相对保留时间差异不大,rsd<2.0%;相对峰面积rsd<10.0%。说明供试品溶液中在24小时内稳定性良好。d重复性实验取本品(批号:lgzgt-b-180707-d04)约0.5g,(共6份),精密称定,按正文供试品溶液制备和测定法项下进行操作。对其相对保留时间及相对峰面积进行计算,其相对保留时间及相对峰面积具体测定结果如下表19~20,图15。表19指纹图谱重复性相对保留时间计算结果表20指纹图谱重复性相对峰面积汇总结果结果表明,相对保留时间差异不大,rsd<2.0%;相对峰面积rsd<10.0%,说明本方法的重复性良好。e耐用性实验考察了不同流速、不同柱温、不同的色谱柱和不同仪器对本色谱条件的耐用性,以重复性图片生成对照图谱r,计算相似度。其测定结果见图16~图22,表21~表25。a)不同流速考察按上述确定方法,考察不同流速(0.8ml/min,1.0ml/min,1.2ml/min),评价本色谱条件的耐用性,对其相似度进行计算。见图16、图17、表21。表21不同流速相似度结果rs2s3s4r1.0000.9940.9970.999s20.9941.0000.9870.994s30.9970.9871.0000.996s40.9990.9940.9961.000计算校正峰组0组r:对照指纹图谱、s2流速0.8ml/min、s3流速1.2ml/min、s4流速1.0ml/min实验结果:不同流速条件下测定谱图中各共有峰峰型尖锐,对称,分离度良好。相似度>0.95,但流速0.8ml/min色谱图中,甘草酸铵色谱峰出峰时间超出110min,故将检测时间延长至120min。b)不同色谱柱按上述确定方法,用不同生产厂家色谱柱,检测同一批对应实物(冻干粉),对其相似度进行计算。见图18、图19、表22。表22不同色谱柱相似度结果rs2s3s4r1.0000.9991.0000.912s20.9991.0000.9990.917s31.0000.9991.0000.920s40.9120.9170.9201.000计算校正峰组0组r.对照指纹图谱、s2.菲罗门gemini-c18(4.6×250mm,5μm)s3.waterssymmetryc18(4.6×250mm,5μm)s4.agilentzorbaxsb-c18(4.6×250mm,5μm)实验结果:不同色谱柱条件下测定色谱图中各共有峰峰型尖锐,对称,分离度良好。个别峰相对保留时间差异大,但主要峰基本一致。相似度>0.90,表明本方法不同色谱柱耐用性良好。c)不同仪器考察按上述确定方法考察不同仪器(安捷伦1260,岛津20a)对本色谱条件的耐用性,对其相似度进行计算。见图20、图21、表23。表23不同仪器相似度结果rs2s3r1.0000.9840.998s20.9841.0000.981s30.9980.9811.000计算校正峰组0组r:对照指纹图谱、s2岛津20a、s3安捷伦1260ⅱ实验结果:不同仪器条件下测定色谱图中各共有峰峰型尖锐,对称,分离度良好。相对保留时间差异不大,rsd<2.0%。不同仪器间相似度>0.95,表明本方法不同仪器耐用性良好。d)不同柱温考察按上述确定方法考察不同柱温(25℃、30℃、35℃)对本色谱条件的耐用性对其相似度进行计算。见图22、图23、表24。表24不同柱温相似度结果rs2s3s4r1.0000.9980.9990.998s20.9981.0001.0000.999s30.9991.0001.0000.999s40.9980.9990.9991.000计算校正峰组0组r.对照指纹图谱、s2.35℃、s.3柱温30℃、s4.柱温25℃实验结果:不同柱温条件下测定色谱图中各共有峰峰型尖锐,对称,分离度良好,不同柱温出峰时间稍有差异,但峰个数基本一致。相似度>0.95,考虑25℃甘草酸色谱峰出峰时间较长,故固定柱温优选为30℃。⑧优选指纹图谱测定方法确认色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序进行梯度洗脱(表25);检测波长为260nm,柱温30℃。理论板数按肉桂酸峰计算应不低于5000。表25流动相梯度洗脱程序参照物溶液的制备取肉桂酸对照品适量,精密称定,加甲醇制成每1ml含20μg的溶液,即得。供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入70%甲醇20ml,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取参照物溶液和供试品溶液各10μl,注入液相色谱仪,测定,记录色谱图,即得。⑨指纹图谱的建立a共有峰的标定采用【指纹图谱】项下的方法对15批供试品色谱峰进行测定,并对所得指纹图谱进行分析,选择15批样品指纹图谱中稳定性较好、响应值适宜的色谱峰为共有峰,共标定了15个共有峰。结果见图24。b对照图谱的建立采用国家药典委员会颁布的《中药色谱指纹图谱相似度评价软件系统2012年版》,根据15批次物质基准指纹图谱测定结果,以标出的15个共有峰进行校正,生成如下对照指纹图谱r。结果见图25。c相似度的计算采用中药色谱指纹图谱相似度评价软件系统,以共有峰对30批样品与对照指纹图谱的相似度进行计算,结果见表26~表27。表2615批次相似度评价结果-1r对照图谱s2~s16物质基准批次分别为lgzgt-b-180914-d01-1、lgzgt-b-180915-d02-1、lgzgt-b-180915-d03-1、lgzgt-b-180916-d04-1、lgzgt-b-180919-d05-1、lgzgt-b-180920-d06-1、lgzgt-b-180920-d07-1、lgzgt-b-180920-d08-1、lgzgt-b-180921-d09-1、lgzgt-b-180921-d10-1、lgzgt-b-180921-d11-1、lgzgt-b-180922-d12-1、lgzgt-b-180922-d13-1、lgzgt-b-180926-d14-1、lgzgt-b-180926-d15-1表2715批次相似度评价结果-2r对照图谱s2~s16物质基准批次分别为lgzgt-b-180914-d01-2、lgzgt-b-180915-d02-2、lgzgt-b-180915-d03-2、lgzgt-b-180916-d04-2、lgzgt-b-180919-d05-2、lgzgt-b-80920-d06-2、lgzgt-b-180920-d07-2、lgzgt-b-180921-d08-2、lgzgt-b-180921-d09-2、lgzgt-b-180922-d10-2、lgzgt-b-180922-d11-2、lgzgt-b-180922-d12-2、lgzgt-b-180922-d13-2、lgzgt-b-1809226-d14-2、lgzgt-b-180926-d15-2以上15批次苓桂术甘汤对应实物(冻干粉)指纹图谱生成对照指纹图谱r,以此比较15批次对应实物(冻干粉)相似度均大于0.95,不同批次间对应实物(冻干粉)的相似度良好。暂定供试品指纹图谱与对照指纹图谱的相似度不得低于0.90。(6)含量测定结合处方功效主治及处方药味在处方中的位置,综合确定含量测定指标。由于工艺研究确定水为溶剂,故苓桂术甘汤物质基准中水溶性成分较多,其中君药茯苓主要成分为多糖、三萜酸,故可测定多糖含量。臣药桂枝,由于《中国药典》2015年版测定桂枝桂皮醛含量,但桂皮醛稳定性较差,不宜作为物质基准的评价指标,故建立桂枝测定肉桂酸的内控标准。佐药白术主要含有挥发性成分,水溶性成分没有适宜的指标做含量测定研究,故不建立佐药含量测定标准;使药甘草主要含有黄酮类、皂苷类等,虽为使药,但其药理作用与苓桂术甘汤物质基准的功效相关,故对甘草中甘草苷、甘草酸含量进行测定,以综合评价物质基准质量。①桂枝照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。a仪器与试药液相色谱仪:岛津lc-20a,安捷伦1260ⅱ;色谱柱:watersc18(5μm,250×4.6mm)、kromasil100-5-c18(4.6×150mm,5μm)、agilentzorbaxsb-c18(4.6×250mm,5μm)等;电子分析天平:常熟市双杰测试仪器厂jj1000(百分之一)赛多利斯科学仪器(北京)有限公司cpa225d(十万分之一)赛多利斯科学仪器(北京)有限公司bsa224s-cw(万分之一)赛多利斯科学仪器(北京)有限公司sqp(万分之一)梅特勒-托利多仪器(上海)有限公司me503t(千分之一)数控超声波清洗器:昆山市超声仪器有限公司(kq-500de)乙腈为色谱纯,oceanpak生产;磷酸为色谱纯,山东西亚化学股份有限公司生产;甲醇为分析纯,广州化学试剂厂生产;水为超纯水,上海和泰仪器有限公司。肉桂酸对照品(批号:110786-201604,纯度:98.8%)购自中国食品药品检定研究院。b色谱条件的选择a)检测波长的选择取肉桂酸对照品适量,精密称定,加甲醇制成每1ml含10μg的溶液,在190~400nm波长下进行扫描,可见肉桂酸在276nm处有最大吸收峰且无杂质干扰,故选用276nm作为检测波长。见图26。b)流动相的选择方法一:参照《日本药典》jp17苓桂术甘汤取本品(批号:lgzgt-b-180707-d04)约0.3g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50ml,密塞,称定重量,超声处理(功率500w,频率40khz)30分钟,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。精密吸取供试品溶液10μl,注入液相色谱仪,以乙腈为流动相a,0.1%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序表进行梯度洗脱,流动相梯度洗脱程序具体如表28。表28流动相梯度洗脱程序方法二:上述供试品溶液,调整流动相为乙腈-0.5%磷酸溶液(34:66)。(见图27)结果分析:两种色谱方法均能较好分离肉桂酸,但比较检测时间,等度检测时间较短,且容易操作,故优选乙腈-0.5%磷酸溶液(34:66)为流动相。c供试品溶液制备方法考察a)提取方式的考察取本品(批号:lgzgt-b-180707-d04)约0.3g(共3组),精密称定,分置具塞锥形瓶中,精密加入50%甲醇50ml,密塞,称定重量,分别超声处理(功率500w,频率40khz)30分钟、回流提取30分钟、振摇30分钟,取出,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。精密吸取续滤液10μl,注入液相色谱仪,测定,计算,即得。结果见表29。表29提取方式考察的结果提取方式肉桂酸含量(mg/g)振摇1.3656超声1.3629回流1.3719结果表明,不同提取方式提取率差别不大,考虑操作方便,故选择超声处理。b)提取溶媒的考察取本品(批号:lgzgt-b-180707-d04)约0.3g(共3组),精密称定,分置具塞锥形瓶中,精密加入70%甲醇、稀乙醇、50%甲醇50ml,密塞,称定重量,分别超声处理(功率500w,频率40khz)30分钟,取出,放冷,再称定重量,分别用70%甲醇、稀乙醇、50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。精密吸取续滤液10μl,注入液相色谱仪,测定,计算,即得。结果如下表30-31。表30提取溶媒考察的结果结果表明:不同提取溶媒含量差别不大,稀乙醇毒性较小,故选择稀乙醇作为提取溶剂。提取时间的考察取本品(批号:lgzgt-b-180707-d04)约0.3g(共3组),精密称定,分置具塞锥形瓶中,精密加入稀乙醇50ml,密塞,称定重量,分别超声处理15分钟、30分钟、5分钟,取出,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。精密吸取续滤液10μl,注入液相色谱仪,测定,计算,即得。结果见表31。表31提取时间考察的结果结果表明:不同提取时间含量差别不大,考虑不同批次含量差异,超声时间过短会影响测定结果,故选择超声30分钟。d含量测定方法的初步确定色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.5%磷酸溶液(34:66)为流动相;检测波长为276nm。理论板数按肉桂酸峰计算应不低于7000。对照品溶液的制备取肉桂酸对照品适量,精密称定,加稀乙醇制成每1ml含10μg的溶液,即得。供试品溶液的制备取本品约0.3g,精密称定,置具塞锥形瓶中,精密加入稀乙醇50ml,称定重量,超声处理(功率500w,频率40khz)30分钟,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。e方法学考察a)专属性试验肉桂酸为苓桂术甘汤中臣药桂枝的指标性成分,为考察其它药材是否干扰肉桂酸的测定,按处方比例称取药材同法制成阴性样品(批号:lgzgt-gzy-180709-d01),并按照供试品的处理方法制备缺桂枝的阴性样品溶液进样,记录色谱图。结果表明,阴性色谱中在与肉桂酸相应的保留时间没有色谱峰,表明桂枝以外的其他药材对肉桂酸的测定无干扰,以本法测定本品中肉桂酸的含量具有专属性。(见图28)结果表明,阴性色谱中在与肉桂酸相应的保留时间没有色谱峰,表明桂枝以外的其他药材对肉桂酸的测定无干扰,以本法测定本品中肉桂酸的含量专属性良好。b)峰纯度检查取上述对照品和供试品溶液,注入液相色谱仪,采用上述色谱条件以pda检测器进行全波长检测,计算峰纯度,结果样品色谱中肉桂酸未检测到杂质峰;峰纯度阈值为999.9,说明在该色谱条件下,肉桂酸色谱峰纯度符合要求。(见图29)c)线性关系考察精密称取肉桂酸对照品9.99mg(批号:110786-201604,纯度:98.8%),置50ml量瓶中,加稀乙醇适量,超声使溶解,取出,放冷,加稀乙醇稀释至刻度,摇匀,即得0.1998mg/ml的肉桂酸对照品贮备溶液;分别精密量取对照品贮备液1ml、5ml,分置20ml量瓶中,分别用稀乙醇稀释至刻度,摇匀,配制成浓度为9.99μg/ml、49.95μg/ml的对照品溶液。分别精密吸取浓度为9.99μg/ml对照品溶液2μl、4μl、6μl、10μl、浓度为49.95μg/ml对照品溶液5μl、10μl,注入液相色谱仪,照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。以进样量(μg)为横坐标,峰面积为纵坐标,绘制标准曲线。结果如下表32、图30。回归方程:y==8459.80x-40.414、相关系数:r=0.9999结果表明,肉桂酸在0.02μg~0.4995μg范围内线性良好。表32肉桂酸线性关系d)仪器精密度取肉桂酸对照品溶液,按正文测定法项下操作,连续进样6次,测定结果见表33。表33仪器精密度试验结果(n=6)结果表明:rsd<1%,仪器精密度良好。e)稳定性试验取本品(批号:lgzgt-b-180707-d04)约0.3g,精密称定,按确定供试品溶液的制备和测定法项下操作,分别在制备后放置0、2、4、8、12、24小时进样测定,测定结果见下表34。表34稳定性试验结果结果表明,供试品溶液在24小时内稳定性良好。f)重复性试验实验人员(a)操作,取本品(批号:lgzgt-b-180707-d04)约0.3g(共6份),精密称定,按正文供试品溶液制备和测定法项下进行操作。结果见下表35。表35重复性试验结果(n=6)结果表明,rsd<3.0%,说明本方法的重复性良好。g)准确度试验采用加样回收法,精密称取肉桂酸对照品10.41mg(批号:110786-201604,纯度:98.8%),置20ml量瓶中,加甲醇适量使溶解并稀释至刻度,摇匀,即得浓度为0.5205mg/ml的对照品溶液。按对照品与样品中肉桂酸含量比0.5∶1、1∶1、1.5∶1设计,分别精密加入0.5205mg/ml对照品溶液0.20、0.41、0.61ml,置具塞锥形瓶中蒸干,取本品约0.15g(共9份),精密称定,置具塞锥形瓶中,分别精密加入稀乙醇50ml,密塞,称定重量,超声处理(功率500w,频率40khz)30分钟,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。分别精密吸取对照品溶液和供试品溶液各10μl,注入液相色谱仪,测定,即得。结果见下表36。苓桂术甘汤对应实物(冻干粉)(批号:lgzgt-b-180707-d04)中肉桂酸含量为1.4101mg/g。表36肉桂酸准确度试验结果(n=6)结果,平均回收率为101.45%,rsd<3.0%,表明本方法准确度良好。h)中间精密度试验选择不同的测定时间、不同的高效液相色谱仪、不同的实验人员(b),取本品(批号:lgzgt-b-180707-d04),取约0.3g,精密称定,按正文供试品溶液制备和测定项下进行操作。结果见下表37。表37中间精密度试验结果(n=6)结果,a和b测定的样品中肉桂酸平均含量为1.4060mg/g,二者偏差2.0%,表明本方法中间精密度良好。i)耐用性试验考察不同柱温、不同流速、不同流动相比例、不同色谱柱对本色谱条件的耐用性,结果见表38。表38耐用性试验结果结果表明,各个条件下测定结果基本一致,rsd<2.0%,色谱图中肉桂酸峰型尖锐、对称,分离度良好,表明本方法对不同柱温、不同流速、不同流动相比例、不同色谱柱耐用性良好。f)含量测定方法确认(优选方案)以上的研究结果试验表明,苓桂术甘汤对应实物(冻干粉)中肉桂酸的含量测定方法的专属性强,稳定性、重复性、中间精密度、准确度等均符合规定,且色谱条件的耐用性良好,故此液相色谱条件可以用于苓桂术甘汤对应实物(冻干粉)中的肉桂酸的含量测定,具体测定条件如下:色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.5%磷酸溶液(34:66)为流动相;检测波长为276nm。理论板数按肉桂酸峰计算应不低于7000。对照品溶液的制备取肉桂酸对照品适量,精密称定,加稀乙醇制成每1ml含10μg的溶液,即得。供试品溶液的制备取本品约0.3g,精密称定,置具塞锥形瓶中,精密加入稀乙醇50ml,称定重量,超声处理(功率500w,频率40khz)30分钟,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。②甘草照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。a仪器与试药液相色谱仪:岛津lc-20a,安捷伦1260ⅱ;色谱柱:agilentzorbaxsb-c18(5μm,250×4.6mm);watersc18(5μm,250×4.6mm)、kromasil100-5-c18(5μm,250×4.6mm)等;电子分析天平:常熟市双杰测试仪器厂jj1000(百分之一)、赛多利斯科学仪器(北京)有限公司cpa225d(十万分之一)、赛多利斯科学仪器(北京)有限公司bsa224s-cw(万分之一)、赛多利斯科学仪器(北京)有限公司sqp(万分之一)、梅特勒-托利多仪器(上海)有限公司me503t(千分之一)数控超声波清洗器:昆山市超声仪器有限公司(kq-500de)。乙腈为色谱纯,oceanpak生产;磷酸为色谱纯,山东西亚化学股份有限公司生产;甲醇为分析纯,广州化学试剂厂生产;水为超纯水,上海和泰仪器有限公司。甘草苷对照品(批号:111610-201607,纯度:93.1%)购自中国食品药品检定研究院。甘草酸铵对照品(批号:110731-201619,纯度:93.0%)购自中国食品药品检定研究院。b色谱条件的选择a)检测波长的选择取甘草苷、甘草酸铵对照品适量,精密称定,加70%乙醇制成每1ml含甘草苷20μg和甘草酸铵0.2mg的溶液,在190~400nm波长下进行扫描,可见甘草苷、甘草酸铵分别在216nm、252nm处有最大吸收峰。药典检测波长237nm介于二者之间,为兼顾甘草苷及甘草酸的测定,选用237nm作为检测波长。b)流动相的选择方法一:参照《中国药典》2015年版一部“甘草”项下甘草苷、甘草酸铵含量测定方法进行摸索。以乙腈为流动相a,以0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序表进行梯度洗脱(见表39);流速为每分钟1ml;柱温为30℃;检测波长为237nm。表39流动相梯度洗脱程序表结果;甘草苷分离度较好,甘草酸铵与相邻峰分离较差,故对洗脱程序进行调整。方法二:在方法一的基础上调整流动相梯度如下,进行摸索。(见表40、图31)表40流动相梯度洗脱程序结果:甘草苷及甘草酸的分离度达到要求。故确定流动相为以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以0.05%磷酸溶液为流动相b,按上表中的规定进行梯度洗脱,检测波长为237nm。c)供试品溶液制备方法考察a)提取溶媒的考察取本品(批号:lgzgt-b-180707-d04)约0.5g(共3组),精密称定,分置具塞锥形瓶中,精密加入无水乙醇、50%乙醇、70%乙醇溶液各50ml,密塞,称定重量,分别超声处理(功率500w,频率40khz)30分钟,取出,放冷,再称定重量,分别用乙醇、50%乙醇、70%乙醇补足减失的重量,摇匀,滤过,取续滤液。精密吸取续滤液10μl,注入液相色谱仪,测定,计算,即得。结果见下表41。表41提取溶媒考察的结果结果表明,不同提取溶媒含量差别较大,故优选50%乙醇作为提取溶剂。b)提取方式的考察取本品(批号:lgzgt-b-180707-d04)约0.5g(共3组),精密称定,分置具塞锥形瓶中,精密加入50%乙醇溶液50ml,密塞,称定重量,分别超声处理(功率500w,频率40khz)30分钟、回流提取30分钟、振摇30分钟,取出,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液。精密吸取续滤液10μl,注入液相色谱仪,测定,计算,即得。结果如下表42。表42提取方式考察的结果结果表明,不同提取方式提取率差别不大,考虑操作方便,故优选超声处理。c)提取时间的考察取本品(批号:lgzgt-b-180707-d04)约0.5g(共3组),精密称定,分置具塞锥形瓶中,精密加入50%乙醇溶液50ml,密塞,称定重量,分别超声处理(功率500w,频率40khz)15分钟、30分钟、45分钟,取出,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,精密吸取续滤液10μl,注入液相色谱仪,测定,计算,即得。结果如下表43。表43提取时间考察的结果结果表明:不同提取时间甘草苷提取率差别不大,但其中超声45min后甘草酸含量略降低,并考虑到不同批次含量差异,超声时间过短会影响测定结果,故优选超声30分钟。d)含量测定方法的初步确定色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序表进行梯度洗脱;检测波长237nm。理论塔板数按甘草苷峰计算应不低于5000。见表44。表44流动相梯度洗脱程序对照品溶液的制备取甘草苷,甘草酸铵对照品适量,精密称定,加50%乙醇制成每1ml含甘草苷20μg,甘草酸铵0.1mg的溶液,即得(甘草酸重量=甘草酸铵重量/1.0207)。供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入50%乙醇50ml,密塞,称定重量,超声处理(功率500w,频率40khz)30分钟,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。e方法学考察a)专属性试验甘草中含有甘草苷、甘草酸铵,为考察其它药材是否干扰甘草苷、甘草酸铵的测定,按处方比例称取药材同法制成阴性样品(批号:lgzgt-gcy-180709-d01),并按照供试品的处理方法制备缺甘草的阴性样品溶液进样,记录色谱图。结果表明,阴性色谱中在与甘草苷、甘草酸铵相应的保留时间没有色谱峰,表明甘草以外的其他药材对甘草苷、甘草酸铵的测定无干扰,以本法同时测定本品中甘草苷、甘草酸铵的含量具有专属性。(见图32)结果表明,阴性色谱中在与甘草苷、甘草酸相应的保留时间没有色谱峰,表明甘草以外的其他药材对甘草苷及甘草酸的测定无干扰,以本法同时测定本品中甘草苷、甘草酸的含量专属性良好。d)峰纯度检查取上述对照品和供试品溶液,注入液相色谱仪,采用上述色谱条件以pda检测器进行全波长检测,计算峰纯度,结果供试品色谱中甘草苷和甘草酸铵均未检测到杂质峰;峰纯度指数分别为1000.0、999.9,说明在该色谱条件下,甘草苷和甘草酸铵色谱峰纯度符合要求。c)线性试验精密称取甘草苷对照品11.78mg(批号:111610-201607,纯度:93.1%)、甘草酸铵对照品10.94mg(批号:110731-201619,纯度:93.0%),分别置20ml容量瓶中,加50%乙醇适量,超声处理使溶解,取出,放冷,加50%乙醇稀释至刻度,摇匀,即得浓度分别为0.5484mg/ml的甘草苷、0.5087mg/ml的甘草酸铵对照品贮备溶液;精密量取甘草苷对照品贮备液1ml、甘草酸铵对照品贮备液2ml,置10ml量瓶中,加50%乙醇稀释至刻度,摇匀,制成甘草苷、甘草酸铵浓度分别为54.84μg/ml,0.1017mg/ml的混合对照品溶液a。另取甘草酸铵6.17mg,再精密量取浓度为0.5484mg/ml的甘草苷对照品溶液5ml,置10ml量瓶中,加50%乙醇稀释至刻度,摇匀,配制成甘草苷、甘草酸铵浓度分别为0.2742mg/ml,0.5738mg/ml的混合对照品溶液b。分别精密吸取上述混合对照品溶液a2μl、4μl、6μl、10μl,混合对照品溶液b5μl、10μl,注入液相色谱仪,照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。以进样量(μg)为横坐标,峰面积为纵坐标,绘制标准曲线。结果如下表45~46,图33、图34。回归方程:y=1865.4x+33.986,相关系数:r=0.9999。结果表明,甘草苷在0.1097μg~2.7420μg范围内线性良好。表45甘草苷线性关系结果表明,甘草酸在0.2035μg~5.7380μg范围内线性良好。表46甘草酸线性关系d)精密度试验取对照品溶液,按正文测定法项下操作,连续进样6次,测定结果见表47。表47仪器精密度试验结果(n=6)结果表明,仪器精密度良好。e)稳定性试验取本品(批号:lgzgt-b-180707-d04)约0.5g,精密称定,按确定供试品溶液的制备和测定法项下操作,分别在制备后放置0、2、4、8、12、24小时进样测定,测定结果见下表48。表48稳定性试验结果(n=6)结果表明,供试品溶液在24小时内稳定性良好。f)重复性试验实验人员(a)操作,取本品(批号:lgzgt-b-180707-d04)约0.5g(共6份),精密称定,按正文供试品溶液制备和测定法项下进行操作。结果见下表49。表49重复性试验结果(n=6)结果表明,rsd<2.0%,说明本方法的重复性良好。g)准确度试验采用加样回收法,精密称取甘草苷对照品48.34mg(批号:111610-201607,纯度:93.1%),甘草酸铵对照品71.60mg(批号:110731-201619,纯度:93.0%),置10ml量瓶中,加50%乙醇稀释至刻度,摇匀,即得浓度为4.5005mg/ml、6.6588mg/ml的甘草苷、甘草酸铵的对照品贮备溶液;分别精密量取对照品贮备溶液1ml、2ml、3ml,分别置200ml量瓶中,分别加50%乙醇稀释至刻度,摇匀,即得三个浓度的混合对照品溶液。按对照品与样品中甘草苷、甘草酸含量比0.5:1、1:1、1.5:1设计,取本品(批号:lgzgt-b-180707-d04)约0.25g(共9份),精密称定,置具塞锥形瓶中,分别精密加入不同浓度的混合对照品溶液50ml,称定重量,超声处理(功率500w,频率40khz)30分钟,取出,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液。精密吸取供试品溶液10μl,注入液相色谱仪,测定,即得。结果见下表50~51。苓桂术甘汤对应实物(冻干粉)(批号:lgzgt-b-180707-d04)中甘草苷的含量为8.9208mg/g,甘草酸铵的含量为11.9205mg/g。表50甘草苷准确度试验结果(n=9)结果表明,平均回收率为98.85%,rsd<2.0%,表明本方法准确度较好。表51甘草酸铵准确度试验结果(n=9)结果表明,平均回收率为99.27%,rsd<2.0%,表明本方法准确度较好。h)中间精密度试验选择不同的测定时间、不同的高效液相色谱仪、不同的实验人员(b),取本品(批号:lgzgt-b-180707-d04)约0.5g,精密称定,按正文供试品溶液制备和测定项下进行操作。结果见下表52~53。表52甘草苷中间精密度试验结果(n=6)表53甘草酸铵中间精密度试验结果结果,a和b测定的样品中甘草苷平均含量为9.0441mg/g,rsd<3.0%,甘草酸平均含量为12.7256mg/g,二者偏差≤3.0%,表明本方法中间精密度良好。i)耐用性试验考察不同柱温、不同流速、不同色谱柱对本色谱条件的耐用性,结果见表54。表54耐用性试验结果结论:不同柱温、不同流速对含量影响不大,rsd分别为0.9%,0.6%;不同酸比例0.02%甘草酸分离度较差,0.1%分离效果较好,酸比例对方法影响较大,故固定酸比例为0.05%;不同色谱柱均能达到良好分离,耐用性良好。不同仪器甘草苷及甘草酸色谱峰分离度均达到要求,不同仪器耐用性良好。f含量测定方法确认以上的研究结果试验表明,苓桂术甘汤对应实物(冻干粉)中甘草苷、甘草酸的含量测定方法的专属性强,稳定性、重复性、中间精密度、准确度等均符合规定,且色谱条件的耐用性良好,故此液相色谱条件可以用于苓桂术甘汤对应实物(冻干粉)中的甘草苷、甘草酸的含量测定,具体测定条件如下:色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以0.05%磷酸溶液为流动相b,按规定的流动相梯度洗脱程序表进行梯度洗脱;检测波长237nm。理论塔板数按甘草苷峰计算应不低于5000。表55。表55流动相梯度洗脱程序对照品溶液的制备取甘草苷,甘草酸铵对照品适量,精密称定,加50%乙醇制成每1ml含甘草苷50μg甘草酸铵0.1mg的溶液,即得(甘草酸重量=甘草酸铵重量/1.0207)。供试品溶液的制备取本品约0.5g,精密称定,置具塞锥形瓶中,精密加入50%乙醇50ml,称定重量,超声处理(功率500w,频率40khz)30分钟,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。(7)对应实物关键质量属性范围的确定1)出膏率本发明通过实验证实15批次物质基准出膏率范围10.57~16.13%,平均出膏率12.11%,均在3sd浮动范围7.63~16.58%;±30%浮动范围8.47~15.74%。暂定出膏率范围为7.00~25.00%。2)水分15批次物质基准水分范围5.48~10.17%,平均水分8.0%,暂定水分不得过12.0%。3)浸出物15批次物质基准浸出物范围17.46~33.05%,平均浸出物25.33%,暂定浸出物范围为10.0~40.0%。4)指纹图谱15批次苓桂术甘汤物质基准指纹图谱生成对照指纹图谱,以次比较30批次物质基准相似度均大于0.95,不同批次间物质基准的相似度良好,暂定指纹图谱相似度限度为≥0.90。5)含量测定15批物质基准肉桂酸范围0.7~1.5mg/g,平均含量1.2mg/g,均在±30%及3sd范围内;参照±30%及3sd浮动范围,同时考虑到实际生产过程中的各种影响因素等,暂定本品按干燥品计算,每1g含桂枝以肉桂酸(c17h24o10)计,应为0.50~2.0mg。15批物质基准甘草苷范围8.9~13.9mg/g,平均含量10.8mg/g,均在3sd浮动范围内,考虑到实际生产过程中的各种影响因素等,暂定本品按干燥品计算,每1g含甘草以甘草苷(c21h22o9)计,应为5.0~15.0mg。15批物质基准甘草酸范围11.2~25.2mg/g,平均含量18.0mg/g,均在3sd范围内,参照±30%及3sd浮动范围,同时考虑到实际生产过程中的各种影响因素等,暂定本品按干燥品计算,每1g含甘草以甘草酸(c42h62o16)计,应为5.0~30.0mg。虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作出一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1