1-磷酸鞘氨醇在制备用于防护唾液腺放射损伤的药物中的应用的制作方法
本发明涉及医药技术领域,具体涉及1-磷酸鞘氨醇在制备用于防护唾液腺放射损伤的药物中的应用。
背景技术:
癌症已成为中国公共卫生的主要风险和关注点,据统计,2018年全球唇部和口腔癌新发病例为354,864例,是全球癌症相关死亡的第六大原因。放疗已经成为头颈部恶性肿瘤重要的治疗手段之一,全球每年超过50000例头颈部肿瘤患者需要接受放射治疗。头颈部放疗治疗时唾液腺往往包括在放射野中,常导致唾液腺急性放射性损伤及后期功能障碍,引起口腔干燥、吞咽困难、味觉障碍、龋齿等并发症,进一步引发胃肠疾病,严重地影响患者的生活质量。
早在1911年,唾液腺放射损伤已有报道,最近研究发现放射线对唾液腺组织的损伤是不可逆的,病理改变表现为腺泡细胞逐渐萎缩乃至消失,腺体实质被大量的纤维结缔组织取代,导致唾液腺的功能改变,患者口腔唾液分泌减少,同时,唾液渗透度、黏度、乳铁蛋白、蛋白质、钠、氯化物及唾液钾浓度会明显增加,而唾液钙和淀粉酶会降低。目前研究证实导致这些的改变可能与腺泡细胞正常结构和唾液腺血管内皮细胞损伤凋亡、微血管密度减低有关。
唾液腺放射损伤的预防、临床治疗现状不是很理想。为了更好地保护和恢复唾液腺功能,研究人员在改进放疗技术、开发放射性防护药物以及基因转导治疗等方面做了很多尝试。放射治疗技术改进能有效提高靶区剂量并且降低周围正常组织受量,但仍不能保证唾液腺剂量在损伤阈值以下,患者仍会出现不同程度并发症,如吞咽困难、味觉障碍、龋齿、胃肠疾病。目前临床上尚无有效的治疗唾液腺放射损伤的方法,无论是阿米福汀、毛果芸香碱等化学药物,或者是人工唾液等治疗手段,仅可暂时缓解症状。应用药物(雷帕霉素)以及基因治疗(adrat-shh、adaqp1)等手段防护和治疗小型猪腮腺放射损伤血管密度明显减少,唾液腺功能没有有效恢复,作用时间相对较短,且远期效果不佳。
因此,开发能够在放射治疗过程中有效减轻或预防唾液腺放射损伤的方法具有重要意义。
技术实现要素:
为解决现有技术中的技术问题,本发明的目的在于提供1-磷酸鞘氨醇(s1p)在制备用于防护唾液腺放射损伤的药物中的应用以及具有防护唾液腺放射损伤功能的药物。
为实现上述目的,本发明的技术方案如下:
第一方面,本发明提供1-磷酸鞘氨醇在制备用于预防或减轻唾液腺放射损伤的药物中的应用。
第二方面,本发明提供1-磷酸鞘氨醇在制备用于降低唾液腺细胞或唾液腺血管内皮细胞对放射线的敏感性的药物中的应用。
第三方面,本发明提供1-磷酸鞘氨醇在制备用于头颈部肿瘤放射治疗防护的药物中的应用。
本发明通过对多种化合物的防护唾液腺放射损伤功能进行分析,筛选具有优异的抗唾液腺放射损伤功能的物质,发现1-磷酸鞘氨醇能够有效减轻放射治疗导致的唾液腺功能障碍。
优选地,上述应用中,所述药物的单位剂量至少含有1-磷酸鞘氨醇0.6mg。
更优选地,所述药物的单位剂量含有1-磷酸鞘氨醇0.6~0.8mg。
本发明所述的单位剂量为以人为对象时,进行一次放射线照射治疗时使用的药物剂量。
优选地,上述应用中,所述药物的剂型为混悬剂、注射剂、粉针剂、冻干粉针剂中的一种。
第四方面,本发明提供一种药物,其含有1-磷酸鞘氨醇;所述药物为单位剂量形式,每单位剂量至少含有1-磷酸鞘氨醇0.6mg。
优选地,每单位剂量含有1-磷酸鞘氨醇0.6~0.8mg。
本发明提供的所述药物具有如下任一种功能:
(1)预防或减轻护唾液腺放射损伤;
(2)降低唾液腺细胞或唾液腺血管内皮细胞对放射线的敏感性;
(3)头颈部肿瘤放射治疗的防护。
优选地,所述药物为1-磷酸鞘氨醇与其它有效成分组合或单独使用,并加入药学领域允许的辅料制备得到的混悬剂、注射剂、粉针剂、冻干粉针剂中的一种。
现有技术中多采用甲醇溶解s1p,为克服溶剂甲醇的生物毒性问题,本发明发现以含有聚乙二醇、乙醇和吐温-80的pbs溶液为溶剂,同时在制备过程中进行超声处理,能够将s1p均匀混悬于溶剂中,制备的s1p的混悬剂能够更好地保证制剂的生物安全性和有效性。
更优选地,所述药物的剂型为混悬剂;所述混悬剂为以含有聚乙二醇、乙醇和吐温-80的pbs溶液为溶剂经超声粉碎制备得到。
作为本发明的优选方案,所述药物的剂型为混悬剂;所述混悬剂的溶剂中,所述聚乙二醇的含量为4~5%;乙醇的含量为1.5~2.5%;吐温80的含量为0.8~1%。
上述药物在用于防护唾液腺放射损伤时,为在放射治疗前给予含有1-磷酸鞘氨醇的药物。优选为在放射治疗前0.5~5小时给药,更优选为在放射治疗前1~3小时给药。
上述药物在用于防护唾液腺放射损伤时,给药方式优选为唾液腺组织局部给药。当所述唾液腺组织为腮腺时,可通过腮腺导管给药。
上述药物在用于防护唾液腺放射损伤时,以人为对象,给药剂量优选为10~15μg/kg。
第五方面,本发明提供利用1-磷酸鞘氨醇防护唾液腺放射损伤的方法,其为在放射治疗前给予含有1-磷酸鞘氨醇的药物。
优选地,在放射治疗前0.5~5小时给予含有1-磷酸鞘氨醇的药物。
更优选地,在放射治疗前1~3小时给予含有1-磷酸鞘氨醇的药物。
上述在放射治疗前给予含有1-磷酸鞘氨醇的药物的给药方式优选为唾液腺组织局部给药。当所述唾液腺组织为腮腺时,可通过腮腺导管给药。
上述在放射治疗前给予含有1-磷酸鞘氨醇的药物,以人为对象,给药剂量优选为10~15μg/kg。
作为本发明的优选方案,利用1-磷酸鞘氨醇防护唾液腺放射损伤的方法为:在放射治疗前2小时,在唾液腺组织局部注射给药10~15μg/kg。
本发明的有益效果在于:本发明首次发现1-磷酸鞘氨醇具有预防和减轻放射治疗过程中的唾液腺放射损伤的功能,通过在放射治疗前给药1-磷酸鞘氨醇,可有效降低放射线对于唾液腺细胞和唾液腺血管内皮细胞的损伤,减少唾液腺细胞和唾液腺血管内皮细胞的凋亡,降低唾液腺微血管密度的减少,从根本上减轻放射治疗引起的唾液腺功能障碍;而且1-磷酸鞘氨醇对于唾液腺放射损伤的防护和减轻具有较长的有效作用时间。本发明的发现为临床上解决因头颈放射治疗等引起的唾液腺放射损伤和功能障碍的预防和治疗提供了新的思路和方法。
附图说明
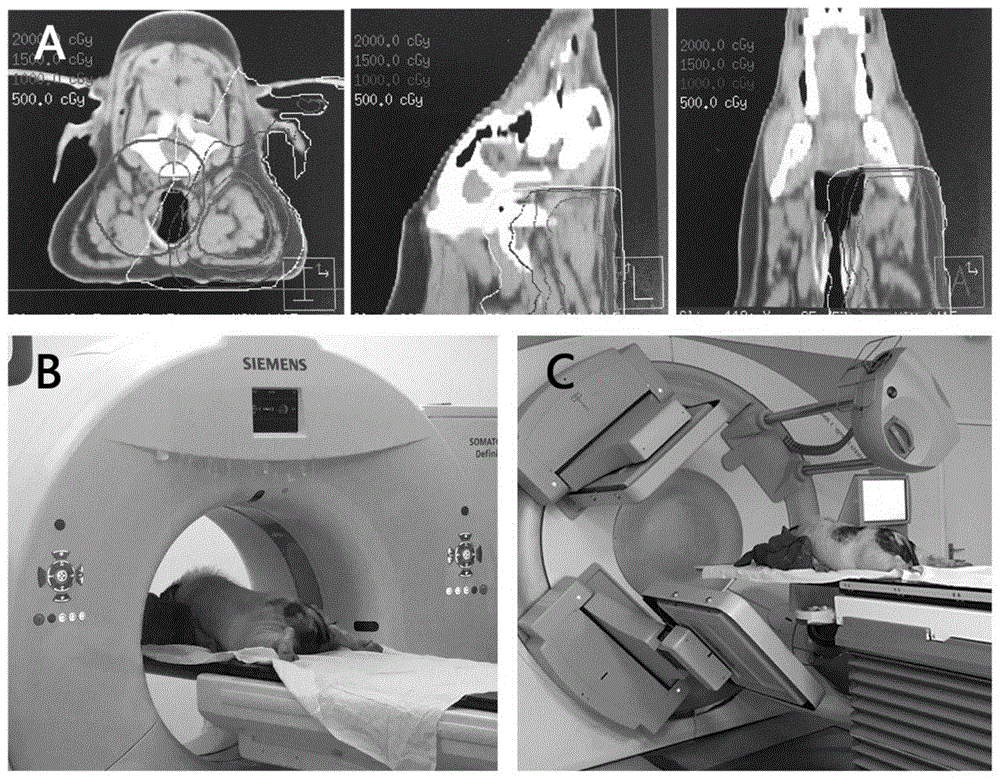
图1为本发明实施例1中小型猪单侧腮腺放射损伤模型建立方法的流程示意图;其中,a为三维适形调强设计用于准确定位右腮腺作为放射治疗的目标区域;b为放疗前一周,小型猪在俯卧位拍摄头颈部ct;c为基于确定区域的图像引导放射治疗。
图2为本发明实施例1中s1p对于腮腺经放射线处理后的唾液腺功能障碍的作用分析;其中,a为实验设计方案示意图,ir+s1ptreatment表示ir+s1p组注射s1p的时间点;b为唾液流速检测结果;c为放射后20周唾液腺组织切片染色观察结果;d为放射后20周masson染色观察结果;e为放射后20周westernblotting检测aqp5蛋白水平的结果;nt代表空白对照组,ir代表单纯放疗组(未给予s1p),ir+s1p代表放疗前给予s1p的实验组。
图3为本发明实施例1中小型猪单侧腮腺放射损伤模型的ir侧和非ir侧的唾液流速检测结果;其中,a为ir侧的唾液流速检测;b为非ir侧的唾液流率检测。
图4为本发明实施例1中放射处理后20周的nt组、ir组和ir+s1p组的多个器官的组织学观察结果;其中,a为心脏,b肝脏,c为脾脏,d为肺脏,e为肾脏。
图5为本发明实施例2中s1p对放射治疗后20周腮腺微血管密度的作用分析;其中,a为局部血流速率分析;b为westernblotting检测cd31表达的结果(以actin蛋白作为内参);c为ihc检测cd31表达的结果。
图6为本发明实施例2中s1p对于腮腺放射损伤导致的细胞凋亡的作用分析;其中,a为采用tunel检测放射处理后早期细胞凋亡水平;b为westernblotting检测放射后早期bcl-2和bax蛋白水平的结果;c为ihc检测caspase3的蛋白水平的结果;d为westernblotting检测放射后早期caspase3的蛋白水平。
图7为本发明实施例2中s1p对于腮腺放射后微血管内皮细胞凋亡的作用分析;其中,a为放疗早期血流速率检测;b为westernblotting检测放疗后早期cd31的蛋白水平;c为腮腺组织tunel和抗cd31双重免疫荧光染色分析凋亡的微血管上皮细胞/腺泡细胞比例。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
以下实施例中使用的s1p悬浊液的配制方法如下:
(1)pet溶液的配制:以无菌pbs为基础溶液,配制含有5%聚乙二醇,2.5%乙醇,0.8%吐温-80的pbs溶液作为溶剂。
(2)s1p悬浊液的配制:以步骤(1)配制的pet溶液作为溶剂,每头小型猪根据体重,称量20μg/kg的s1p粉剂,悬浮至4mlpet中,使用智能型超声波细胞粉碎机(上海之信仪器有限公司生产),超声时间2min,间隔时间2min,超声次数8次,温度4℃,功率调整为10。为了避免产热,在超声混悬时离心管壁周使用了冰块降温。为了保证制剂混悬后有效性,均于注射前当天配置,途中4℃冷藏。
以上使用的聚乙二醇、乙醇和吐温-80均于常温避光保存;s1p粉剂冻存在-20℃冰箱中;所有试剂均当天配置当天使用,途中冷藏、避光保存,使用前摇匀。
以下实施例中的麻醉方法如下:将舒泰和速眠新ii按1:1混合,按0.1ml/kg剂量,耳后肌注。
以下实施例的实验设计及分组如下:选取8月龄、25kg-30kg雄性巴马小型猪30只(购自中国农业大学)。首先选取9头小型猪,随机分为3组,空白对照组(nt)、s1p放疗组(irradiation+s1p,ir+s1p)及单纯放疗组(irradiation,ir),每组3头动物,以放疗后20周的时间点为长期观察点,确定s1p在唾液腺放射损伤中的预防作用。再选取小型猪21头,随机分为7组,空白对照组(nt),ir12h组,ir+s1p12h组,ir24h组,ir+s1p24h组,ir1week组,和ir+s1p1week组,每组3头动物,以放疗后12小时、24小时和7天为短期观察点,确定s1p在唾液腺放射损伤中的预防作用。每次实验前12小时动物禁食、禁水。
以下实施例中,小型猪腮腺唾液采集及唾液流率测定方法如下:待小型猪麻醉满意后,取仰卧位,根据每只小型猪体重于双侧耳后等量肌注硝酸毛果芸香碱0.1mg/kg(小型猪催唾剂),注射后约10-20min,当形成成股、沿口角流下清亮的唾液时,将接上负压吸引器的lashley杯吸附于双侧腮腺乳头处,15ml离心管负压收集双侧唾液10min,记录唾液流率ml/10min。唾液离心后分装于1ml离心管中,当日检测唾液生化,途中冷藏保存。
以下实施例中,小型猪血液的收集方法如下:待小型猪麻醉满意后,取仰卧位,于前腔静脉处取血5ml,其中2ml分装于抗凝采血管,2小时内血常规检测;3ml置于离心管中1600rpm离心6min,收集血清,2小时内用于血清生化检测。途中冷藏保存。
以下实施例中的腮腺局部给药方法如下:小型猪全麻后,于双侧耳后按照每只小型猪体重注射阿托品注射液0.1mg/kg,15min后,开口,将涎腺导管插入小型猪右侧腮腺主导管内3cm,用5ml注射器注入s1p悬液4ml,保持开口及猪体位,完毕后保留插管并压迫腮腺导管乳头15min防止液体回流,使悬液能被腮腺有效的吸收。取出导管、闭口,小型猪侧卧静息,操作侧在上不受压迫,2小时后进行右侧腮腺放射损伤模型建立。
以下实施例中,小型猪单侧腮腺放射损伤模型建立的方法如下:放疗前一周,小型猪全麻满意后,俯卧位拍摄头颅ct进行精准定位;根据ct影像划定小型猪右侧腮腺区域,采用三维适形调强设计,中心靶区放射剂量达到95%以上,临床靶区剂量为100%,精准定位右侧腮腺为放疗靶区。一周后,根据划定的区域进行图像引导的放射治疗,小型猪全麻满意后俯卧于操作台上,放射源距皮肤95cm,射线平均能量6mv,照射距离100cm,剂量率3.2gy/min,仪器为elekta直线加速器(elektaab,stockholm,sweden)。
以下实施例中,腮腺组织样本收集与保存方法如下:在放疗后12小时、24小时、7天、20周这四个时间点时,分别将小型猪注射过量麻醉药物处死,腮腺区域及周边剃毛,备皮,消毒铺巾,于下颌骨升支后缘2cm及下颌角处做切口,依次切开皮肤、皮下组织、颈阔肌,在紧贴颈阔肌深层暴露腮腺,将整个腮腺组织取下,每头小型猪均收集双侧腮腺,20周处死组额外收集心脏、肝脏、肺、肾脏、脾脏。将组织使用生理盐水清洗后、擦干,切为0.5cm*0.5cm大小组织块,标号。一部分组织于4%多聚甲醛内4℃固定48小时,经冲水过夜、梯度酒精脱水、浸蜡、石蜡包埋后,切片厚度5um,烤片,进行组织病理学(he染色)及免疫组织化学检测(ihc);一部分新鲜组织分切后置于1ml离心管,-80℃冰箱中保存,免疫蛋白印迹实验备用;剩余新鲜组织分切后全部装于15ml离心管,-80℃冰箱中冻存。
以下实施例中,免疫组化染色方法如下:
(1)常规烤片、二甲苯脱蜡;
(2)梯度酒精复水;
(3)pbst洗3次,每次5min;
(4)高压热修复抗原:锅内放入0.01mol/l、ph7.0-7.5的柠檬酸钠,切片架放入其中,盖盖儿加热至高压锅上气后持续2min,后冷却至室温;于pbst洗5min×3次;
(5)将切片置于湿盒中,滴加3%h202,避光30min,pbst洗3次,每次5min;
(6)画圈,5%bsa血清封闭30min;
(7)甩去bsa,滴加1%bsa稀释的一抗,放湿盒内,4℃冰箱中过夜;
(8)pbst洗3次,每次5min;
(9)滴加二抗,37℃烤箱30min,pbst洗3次,每次5min;
(10)滴加dab显色液,显微镜下观察出现阳性染色,后蒸馏水终止反应;
(11)苏木精复染细胞核3min,0.5%盐酸-乙醇分化3-5秒,自来水返蓝2min;
(12)梯度乙醇脱水,二甲苯透明,中性树胶封片。
以下实施例中,tunel与cd31共染色的方法如下:
(1)常规切片脱蜡至水,含0.005%
(2)tunel凋亡染色按试剂盒说明进行,滴加试剂盒内组织蛋白酶k,37℃孵育30分钟,0.005%
(3)滴加tdt缓冲液,室温孵育10分钟,倾去tdt缓冲液;
(4)滴加tdt末端原位标记液,37℃孵育1小时,倾去tdt标记液;
(5)滴加tris-borate缓冲液,室温孵育2分钟;
(6)0.005%
(7)滴加阻断剂,室温孵育20分钟;
(8)0.005%
(9)滴加fitc荧光显色剂,避光37℃孵育30分钟;
(10)避光0.005%
(11)10%正常兔血清(pbs稀释)封闭,避光室温孵育10分钟,倾去血清;
(12)滴加cd31抗体(1:100),避光37℃孵育1小时;
(13)避光0.005%
(14)滴加驴抗羊二抗(1:200),避光37℃孵育30分钟;
(15)避光0.005%
(16)避光室温下pi核复染1.5分钟;
(17)避光0.005%
(18)亲水防荧光淬灭封片剂封片,荧光显微镜下观察。
以下实施例中,westernblotting检测的方法如下:
1、总蛋白提取
(1)组织块用预冷的pbs洗2-3次,去除血污,剪成小块置于匀浆器。加入10倍组织体积本试剂冰上彻底匀浆;
(2)将匀浆液转移至1.5ml离心管中,振荡。冰浴30min,期间用移液器反复吹打,确保细胞完全裂解;
(3)12000g离心10min,收集上清,即为总蛋白溶液。
2、bca法测蛋白浓度。
3、sds-page电泳
(1)清洗玻璃板;
(2)灌胶与上样:将玻璃板对齐后放入夹中卡紧,操作时要使两玻璃对齐以免漏胶。按实验安排配制分离胶,加入temed后立即摇匀即可灌胶。大约45min后可倒去胶上层水并用吸水纸将剩余水吸干。按上面方法配5%的浓缩胶,加入temed后立即摇匀即可灌胶。将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中。
(3)加足够的电泳液后上样电泳。将样品加入电泳孔中,电泳。浓缩胶电压75v,分离胶用120v。电泳至溴酚蓝刚跑出即可终止电泳,进行转膜。
4、转膜
(1)准备6张7×9cm的滤纸和一张大小适中的pvdf膜,pvdf膜在使用之前要先用甲醇活化;
(2)在加有转移液的盆里放入转膜用的夹子,两块海绵垫,一支玻棒,滤纸和经过活化的pvdf膜;
(3)将夹子打开使黑的一面保持水平。在垫子上垫海绵、三层滤纸;
(4)小心剥下分离胶盖于滤纸上,将膜盖于胶上,并除气泡。在膜上盖三张滤纸并除去气泡。最后盖上另一个海绵垫。
5、免疫反应
(1)将转好的膜于室温下脱色摇床上用5%的脱脂牛奶(0.5%tbst配制),封闭1h;
(2)稀释一抗(tbst溶解的5%脱脂牛奶,磷酸化蛋白使用tbst溶解的5%bsa),4℃孵育过夜(快转),或者4℃孵育抗体3h;
(3)用tbst在室温下脱色摇床上洗三次,每次5min;
(4)将二抗用tbst稀释3000倍,室温下孵育30min后,用tbst在室温下脱色摇床上洗三次,每次5min。
6、化学发光:将ecla和eclb两种试剂在离心管中等体积混合,将pvdf膜的蛋白面朝上与此混合液充分接触,1-2min后,去尽残液,包好,放入暗匣中曝光。最后用显影、定影试剂进行显影和定影。根据不同的光强度调整曝光条件。
7、图像分析。
以下实施例中,he染色方法如下:
(1)玻片架放入二甲苯(i、ii、iii)缸中各10min;
(2)100%乙醇(i、ii)缸中各5min;
(3)95%乙醇(i、ii)缸中各5min。
(4)放入苏木素染液4min;
(5)自来水冲洗,分化液分化;
(6)返蓝液返蓝;
(7)自来水浸泡10min;
(8)蒸馏水冲洗;
(9)入伊红染液40s;
(10)自来水冲洗;
(11)95%乙醇(i、ii)缸中各5min;
(12)100%乙醇(i、ii)缸中各5min;
(13)二甲苯(i、ii)缸中各5s;
(14)玻片架放入二甲苯(iii)缸中;
(15)中性树脂封片。
以下实施例中,masson染色的方法如下:
(1)脱蜡:二甲苯中脱蜡10-15分钟。再换用新鲜的二甲苯脱蜡10-15分钟;
(2)将脱蜡后的片子用95%乙醇浸泡2分钟,再分别用70%、30%乙醇各2分钟;
(3)水合:蒸馏水中浸泡2分钟;
(4)漂洗:30-40℃水漂洗两次,每次30-60秒;
(5)用蒸馏水润湿玻片30-60秒;
(6)核染液染色60秒左右,冲洗液冲洗30秒;
(7)浆染液染色30-60秒,冲洗液冲洗30秒;
(8)分色液分色6-8分钟。显微镜下观察,样本中胶原纤维部分褪成淡的粉红色为宜。如果褪色效果不佳,可适当延长时间;
(9)复染液染色5分钟,用无水乙醇冲洗干净;
(10)吹干后,用封固剂封片;
(11)结果观察。
实施例1s1p减轻腮腺放射线处理后的唾液腺功能障碍
本实施例分析s1p对于腮腺放射线处理后的唾液腺功能障碍的作用,具体方法如下:
(1)首先收集小型猪腮腺唾液,检测其唾液流率。对小型猪进行前腔静脉采血,检查血液常规、血清的生化。
(2)小型猪单侧腮腺放射损伤模型的建立:放疗前一周,小型猪拍摄头颅ct,划定腮腺放射区域,采用三维适形调强设计中心靶区放射剂量达到95%以上,临床靶区剂量为100%。一周后根据放疗计划进行图像引导放射治疗,照射源为elekatasynergy直线加速器,射线平均能量6mv,照射距离100cm,剂量率3.2gy/min,对放射区域右侧腮腺进行20gy的单次放疗。单侧腮腺放射损伤模型的建立流程如图1所示。
(3)s1p给药
结合对s1p的药物动力学的分析进行给药时间的筛选,确定于放射治疗前2小时给药。
对s1p给药剂量进行筛选,确定每只小型猪的给药剂量为20μg/kg;综合考虑小型猪腮腺液体容量,确定给药体积为4ml。
对ir+s1p组小型猪通过腮腺导管逆行注射s1p悬浊液4ml,对ir组小型猪通过腮腺导管逆行注射pet4ml。分别于放疗后12小时、24小时、7天和20周时,对nt组、ir组和ir+s1p组三个组别的小型猪分别检测腮腺的血流率、唾液流率、血常规、血生化和唾液成分,并处死取标本,分析s1p在理想的给药时机和给药剂量下对小型猪腮腺放射损伤的防护作用,实验设计方案如图2的a所示。
上述检测的实验结果如下:
(1)对唾液流速进行检查,结果显示,在放射后20周,ir组小型猪放疗侧唾液流率下降至正常侧的20%左右,而ir+s1p组可以恢复至nt组的40%左右(如图2的b所示)。ir侧和非ir侧的唾液流速如图3所示,放疗后,唾液流率随时间逐渐下降,在第18周,ir组的唾液流率维持在约3ml/min,而ir+s1p组的唾液体积维持在约5ml/min(图3的a);而放疗后非ir侧的唾液流率没有显著变化(图3的b)。
(2)组织切片染色观察结果显示(图2的c),ir+s1p组的组织切片可见腺泡细胞数量明显高于ir组。同时,ir+s1p组的masson阳性染色区域明显小于ir组。(图2的d)。
(3)westernblotting检测结果显示,ir+s1p组的水通道蛋白5(aqp5)的蛋白水平显著高于ir组(图2的e)。
以上结果表明s1p可以显著减轻小型猪模型中放射诱导的腮腺功能障碍。
为了评估s1p对于放射诱导的腮腺功能障碍小型猪模型中的安全性,分别在放射处理前1小时、放射处理后24小时以及放射处理后1周检查ca2+,k+,na+,cl-,alp,alt,ast,ldh的血液生化。检测结果如表1所示,结果表明,ir和ir+s1p组之间在放射前后的血液生化指标没有检测到显着差异。进一步地,在放射处理后20周检查多个器官(心脏,肝脏,脾脏,肺,肾)的组织学观察,结果如图4所示,结果表明,ir组和ir+s1p组的组织学观察没有显著差异。
表1放疗前后小型猪模型的血清生化指标检测结果
表1中n=3,数据显示为平均值±sem,p<0.05代表有差异。缩写:alp,碱性磷酸酶;alt,丙氨酸氨基转移酶;ast,天冬氨酸氨基转移酶;ldh,乳酸脱氢酶。
以上结果表明,s1p具有较高的安全性,对于生化指标和心脏、肝脏、脾脏、肺、肾等组织没有显著影响。
实施例2s1p对放射损伤小型猪腮腺微血管密度和细胞凋亡的作用本实施例分析s1p对放射损伤小型猪腮腺微血管密度(mvd)和细胞凋亡的作用,具体方法如下:
选择放射处理后12小时、24小时和7天为早期观察时间点,处死动物,利用免疫组化染色检测caspase-3、tunel含量,确定s1p是否可以抑制放疗后早期引起的唾液腺血管内皮细胞凋亡;同时通过免疫蛋白印迹实验(westernblotting)检测放疗后凋亡执行蛋白影响因子bax及bcl-2含量的动态变化,以确定s1p抑制唾液腺细胞凋亡的机制。
选择放射处理后20周为长期观察点,处死动物,利用免疫组化染色(ihc)及免疫蛋白印迹实验,以cd31为靶标检测微血管的密度变化;以aqp5为靶标检测小型猪唾液腺分泌功能指标的变化。
上述检测的实验结果如下:
根据报道,放射处理可显著降低局部微血管密度和血流速率,从而诱导随后的组织损伤。本实施例中,与ir组相比,在第20周时,与nt组相比,ir前使用s1p可以维持近70%的局部血流率,而ir组仅能维持在50%左右(图5的a)。
结合westernblotting检测cd31表达的结果(图5的b)和ihc检测cd31表达的结果(图5的c)分析腮腺微血管密度,结果显示s1p使用后腮腺微血管密度得到显著恢复。
以上实验结果表明,s1p可有效降低放射后腮腺微血管密度的减少。
为探讨s1p预防放射诱导腮腺功能障碍的可能机制,采用tunel检测放射处理后12小时、24小时和1周时的细胞凋亡水平。结果显示,ir组tunel阳性细胞明显高于nt组,但ir+s1p组的tunel阳性细胞显著降低(图6的a)。
bcl-2和bax的蛋白水平与细胞凋亡水平密切相关,因此,进一步采用westernblotting检测bcl-2和bax的蛋白水平。结果显示,ir+s1p组中蛋白质bcl-2/bax比例数值高于ir组(图6的b),表明s1p有效抑制了细胞凋亡水平。在放疗7天后,各个组的bcl-2/bax表达未见明显差异(图6的b)。
在细胞凋亡过程中,活化的caspase-3蛋白被认为是细胞凋亡执行分子。因此,进一步采用westernblotting和ihc检测caspase3的蛋白水平。结果显示,ir+s1p组活化的caspase3的ihc和westernblotting检测结果均显著低于ir组,证实了s1p具有抗凋亡的作用。在放疗7天后,各组的caspase-3表达未见明显差异(图6的c和d)。
以上结果表明,s1p具有抑制放射损伤导致的细胞凋亡的作用。
放疗后早期微血管内皮细胞的凋亡与腮腺最终的功能障碍有关。本实施例中,在放射处理后12小时,与nt组相比,ir+s1p组和ir组的局部血流量下降超过12%;在放射处理后24小时至1周,ir组的血流速率持续下降,而在ir+s1p组中,血流速率维持在nt组的约75%的水平(图7的a)。
进一步地,分别在放射处理后12小时,24小时和1周,采用westernblotting检测检查cd31的蛋白水平,结果显示,s1p+ir组的cd31水平显著高于ir组(图7的b)。
进一步地,分别在放射处理后12小时、24小时和1周对腮腺组织进行双重免疫荧光染色(tunel和抗cd31),以分析凋亡的微血管上皮细胞/腺泡细胞比例。观察结果如下:早期凋亡的细胞中,绝大部分为cd31+的血管内皮细胞,提示可能是ir引起的微血管内皮细胞损引起了唾液腺功能障碍。此外,ir组微血管内皮细胞凋亡数明显高于ir+s1p组和nt组(图7的c)。
以上结果表明,s1p通过减少放射后微血管内皮细胞的凋亡来减轻微血管损伤。
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 具有 1 -磷酸 -鞘氨醇( s 1 p)受体拮抗剂生物活性的带芳基或者杂芳基基团的吲哚 ...的制作方法
- 鞘氨醇-1-磷酸结合抑制物质的制作方法
- 作为1-磷酸鞘氨醇受体调节剂的氨基-丙醇衍生物的制作方法
- 作为1-磷酸-鞘氨醇受体调节剂的氨基-丙醇衍生物的制作方法
- 经取代的噁二唑化合物及其作为S1P<sub>1</sub>激动剂的用途的制作方法
- 作为1-磷酸鞘氨醇1受体激动剂的4-(5-异噁唑基或5-吡唑基-1
- 对鞘氨醇-1-磷酸(s1p)具有活性的*二唑衍生物的制作方法
- 对鞘氨醇-1-磷酸(s1p)具有活性的*二唑衍生物的制作方法
- 具有1-磷酸-鞘氨醇(s1p)受体生物学活性的带芳基或者杂芳基基团的吲哚化合物的制作方法
- 鞘氨醇激酶抑制剂的制作方法