一种双黄酮类化合物的应用的制作方法
本发明涉及医学技术领域,具体而言,涉及一种双黄酮类化合物的应用。
背景技术:
炎性肠病(肠炎)是病因尚不明确的非特异性肠炎,是诱发肠癌的高风险致病因素之一,已逐渐发展为全球5大流行病种之一。据世界卫生组织估计大约15%肠炎患者最终导致癌症发生与转移,严重威胁病人的健康安全。因此,控制肠炎的发生与发展在预防炎症引起的肠癌起着重要的作用。然而,尽管20多年来在与控制肠炎及肠炎引发肠癌的研究已取得许多的进步,但是到现在为止,肠炎的临床治疗效果仍旧不理想。目前对该病急性期的药物治疗,主要是秋水仙碱、非甾体抗炎药及激素等,但此类药物用量较大,副作用较多,很多患者不能耐受。中医药治疗肠炎临床疗效好,且副作用较少,容易被患者接受。但是现有技术中并没记录中药中哪种单一化合物对肠炎有良好的治疗效果。
鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供一种双黄酮类化合物的应用,该化合物对于结肠炎有良好的治疗效果。
第一方面,本发明实施例提供一种式(1)所示化合物在制备治疗结肠炎药物中的应用,
其中,r1为氢或羟基。
在可选的实施方式中,所述结肠炎为溃疡性结肠炎;
优选地,化合物选自下述化合物中的任意一种:
在可选的实施方式中,所述药物是利用所述化合物降低炎症因子含量的药物。
在可选的实施方式中,所述药物是利用所述化合物抑制il-β、il-6和tnf-α的mrna表达水平的药物。
在可选的实施方式中,所述药物是利用所述化合物提升nqol、nrf2、sirt6和gclm的mrna表达的药物。
在可选的实施方式中,所述化合物是从藤黄科植物中提取得到的物质,优选地,所述藤黄科植物为藤黄可乐;更优选地,提取原料为藤黄可乐的种子;
优选地,提取方法是利用有机溶剂进行提取后再进行分离纯化;
更优选地,有机溶剂为醇溶剂,优选为一元醇溶剂,进一步优选为c1-c3一元醇溶剂,更优选为乙醇溶剂,最优选为质量百分数为95%的乙醇溶剂;
优选地,分离纯化是利用色谱柱进行分离纯化。
第二方面,本发明实施例提供一种式(1)所示化合物在制备改善肠道粘膜屏障功能药物中的应用。
在可选的实施方式中,所述药物是利用所述化合物降低肠道粘膜通透性的药物。
在可选的实施方式中,所述药物是利用所述化合物抑制肠粘膜上皮细胞紧密连接蛋白zo1和occludin的mrna表达的药物。
第三方面,本发明实施例提供一种式(1)所示化合物在制备改善大肠缩短或者便血的药物中的应用。
本发明具有以下有益效果:通过将上述化合物作用于dss诱导的小鼠肠炎,可以发现该化合物能够改善小鼠结肠炎的症状,说明该化合物对于结肠炎有良好的治疗效果,可以应用于治疗结肠炎药物的制备,扩大了该药物的应用范围。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实验例1的实验结果图;
图2为本发明实验例2的实验结果图;
图3为本发明实验例3的实验结果图;
图4为本发明实验例4的实验结果图;
图5为本发明实验例5的实验结果图;
图6为本发明实验例6的实验结果图;
图7为本发明实验例7的实验结果图;
图8为本发明实验例8的实验结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
本发明实施例提供一种式(1)所示化合物的一种新用途,
中,r1为氢或羟基。
优选地,化合物选自下述化合物中的任意一种:
该化合物通过小鼠模型试验以及采用real-timepcr技术,证明该化合物可以用于治疗结肠炎,特别对溃疡性结肠炎有良好的治疗效果,该化合物提升nqol、nrf2、sirt6和gclm的mrna表达水平,降低炎症因子含量,抑制il-β、il-6和tnf-α的mrna表达水平,实现对结肠炎的良好的治疗,同时其副作用低。且该化合物改善肠道粘膜屏障功能改善大肠缩短,特别是降低肠道粘膜通透性有良好的效果,其可以抑制肠粘膜上皮细胞紧密连接蛋白zo1和occludin的mrna表达,扩大了该化合物的应用范围。
该化合物可以通过化学合成得到,也可通过植物提取得到,具体可以从藤黄科植物中提取得到的物质,优选地,所述藤黄科植物为藤黄可乐;更优选地,提取原料为藤黄可乐的种子。采用上述原料能够保证提取得到的化合物的纯度,更有利于发挥其药效。
进一步地,提取方法是利用有机溶剂进行提取后再进行分离纯化;
更优选地,有机溶剂为醇溶剂,优选为一元醇溶剂,进一步优选为c1-c3一元醇溶剂,更优选为乙醇溶剂,最优选为质量百分数为95%的乙醇溶剂;
优选地,分离纯化是利用色谱柱进行分离纯化,色谱柱的填料为硅胶,或辛烷基烷化硅胶,或十八烷基烷化硅胶,或大孔树脂,或葡聚凝胶。
实施例1
从藤黄可乐种子中提取得到式(2)所示化合物,具体操作为:将5kg藤黄可乐果粉碎,用95%乙醇浸提,滤液减压浓缩至膏状,滤渣加水回流提取后,合并滤液减压浓缩至膏状,将浸膏分别采用正丁醇、乙酸乙酯、石油醚萃取,收集正丁醇相、乙酸乙酯相、石油醚相。乙酸乙酯相上硅胶柱,以氯仿-甲醇系统为洗脱剂进行梯度洗脱,经sephadexlh20柱色谱和hplc分离得到化合物。
对该化合物进行表征:
白色粉末(甲醇),c30h22o10,紫外灯254nm下呈蓝色荧光,硫酸乙醇显色后呈黄色。
1h-nmr(500mz,dmso-d6)δ:2.59(1h,d,j=15.7hz),2.75(2h,d,j=19.8hz,h-3a"),4.67(1h,d,j=12.1hz),4.53(1h,d,j=12.2hz,h-3),7.14(1h,d,j=8.2hz),7.22(1h,d,j=8.1hz,h-2'",h-6'"),7.12(2h,d,j=7.7hz),6.85(1h,d,j=8.1hz,h-2',h-6'),6.85(2h,d,j=8.1hz),6.71(2h,d,j=8.0hz,h-3'",h-5'"),6.64(3h,d,j=7.2hz,h-3',h-5'),5.87(1h,s),5.78(1h,s,h-6"),5.82(1h,s,h-8),5.91(2h,d,j=8.9hz),5.94(1h,s,h-6),5.69(1h,d,j=12.1hz),5.56(1h,m),5.38(2h,m,h-2),4.67(1h,d,j=12.1hz,h-2"),4.53(1h,d,j=12.2hz,h-3);
13cnmr(176mhz,dmso-d6)δ:81.77,81.29(c-2),47.37(c-3),196.81,196.58(c-4),163.85,163.63(c-5),96.10(c-6),166.38(c-7),95.53,95.13(c-8),101.3(c-4a),162.79,162.65(c-8a),129.45,129.13(c-1'),128.98,128.90(c-2',c-6'),115.24,115.10(c-3',c-5"),157.72,157.54(c-4"),78.41,78.22(c-2"),43.15,42.70(c-2'),196.11(c-4"),162.47,162.02(c-5"),96.10(c-6"),164.97,164.49(c-7"),101.62,101.41(c-8"),101.14,101.05(c-4"a),162.79,162.65(c-8a),126.68(c-1'"),128.07,128.99(c-2'",c-6'"),114.76,114.68(c-3'",c-5'"),157.15(c-4'")。
因此,化合物被鉴定为4',4'",5,5",7,7"-heptahydroxy-3,8"-biflavanone.3,8"-binaringenin,garciniabiflavonoid1a,又名gb1a,其结构式为式(2)所示:
实施例2
从藤黄可乐种子中提取得到式(3)所示化合物,具体操作为:将5kg藤黄可乐果粉碎,用95%乙醇浸提,滤液减压浓缩至膏状,滤渣加水回流提取后,合并滤液减压浓缩至膏状,将浸膏分别采用正丁醇、乙酸乙酯、石油醚萃取,收集正丁醇相、乙酸乙酯相、石油醚相。乙酸乙酯相上硅胶柱,以氯仿-甲醇系统为洗脱剂进行梯度洗脱,经sephadexlh20柱色谱和hplc分离得到化合物。
对该化合物进行表征:
化合物:白色粉末(甲醇),c30h22o11,紫外灯254nm下呈蓝色荧光,硫酸乙醇显色后呈黄色。
1h-nmr(500mz,dmso-d6)δ:4.65(1h,d,j=12.1hz),4.40(1h,d,j=12.1hz,h-3),4.21(1h,d,j=112hz),3.99(1h,d,j=11.2hz,h-3"),5.65(1h,d,j=12.1hz),5.30(1h,d,j=12.1hz,h-25.12(1h,d,j=11.2hz),4.95(1h,d,j=11.6hz,h-2"),5.93(1h,s,h-6),5.80(1h,s,h-8),5.76(1h,s,h-6"),6.74(1h,d,j=8.2hz),6.64(1h,d,j=5.9hz,h-3'),6.74(1h,d,j=8.2hz),6.64(1h,d,j=5.9hz,h-5'),7.16(1h,d,j=4.5hz,h-2'"),6.83(1h,d,j=8.2hz),6.64(1h,d,j=5.9hz,h-5'"),7.16(1h,d,j=4.5hz,h-6'"),7.09(1h,dd,j=14.8,8.3hz,h-2'),7.09(1h,dd,j=14.8,8.3hz,h-6'),6.83(1h,d,j=8.2hz),6.64(1h,d,j=5.9hz,h-3'"),9.57(2h,s),9.45(1h,s,h-4'",h-4"),12.29(1h,s),12.17(1h,s,5-oh),11.86(1h,s),11.73(1h,s,5'-oh);
13cnmr(176mhz,dmso-d6)δ:81.80,81.26(c-2),47.49,47.39(c-3),196.54,196.89(c-4),101.38,101.44(c-4a),163.73,163.93(c-5),96.18,95.97(c-6),166.40,166.53(c-7),95.45(c-8),162.70,162.83(c-8a),129.16,128.83(c-1'),128.01,127.92(c-2'),114.69,114.71(c-3'),157.63,157.41(c-4'),114.81,115.01(c-5'),127.66(c-6'),82.59,82.54(c-2"),72.47,71.98(c-3"),197.47(c-4"),99.70,100.24(c"-4a),161.90,162.33(c-5"),95.10,95.02(c-6"),165.03,165.33(c-7"),101.34(c-8"),159.46,160.24(c"-8a),129.05,128.83(c-1'"),128.24(c-2'"),114.81,115.01(c-3'"),157.89,157.81(c-4'"),114.81,115.01(c-5'"),128.24(c-6'")。化合物被鉴定为3",4',4'",5,5",7,7"-heptahydroxy-3,8"-biflavanone,garciniabiflavonoid1,又名gb1。其结构式为式(3)所示:
对实施例1的化合物进行实验
实验例1gb1a改善dss诱导的小鼠肠炎
具体方法:
spf级c57bl小鼠58只,雄性,随机分为4组即对照组、sasp(柳氮磺胺吡啶)组(100mg/kg)、dss组、dss+gb1a组(100mg/kg),正常组10只,其余每组各12只。每组小鼠均自由饮用纯净水3天,预先用sasp(100mg/kg)和gb1a灌胃诱导3天。从第4天开始到第10天,对照组小鼠自由饮用生理盐水,其余各组小鼠自由饮用4%dss(w/v)的水溶液。而sasp组和dss+gb1a组小鼠继续灌胃7天,第10天结束实验,所有小鼠眼球采血,并处死,解剖,取结肠进行各项指标的检测。
症状观察及病理组织切片观察。
每天对各组小鼠进行称重并记录,观察小鼠粪便,记录小鼠发生腹泻、血便的例数。
取肛门以上7cm肠段卷起,置4%的多聚甲醛中固定,常规脱水,石蜡包埋切片,4μm厚连续切片,分别作he染色,于光镜下观察肠细胞变性、坏死,炎症细胞浸润等病理损伤情况。
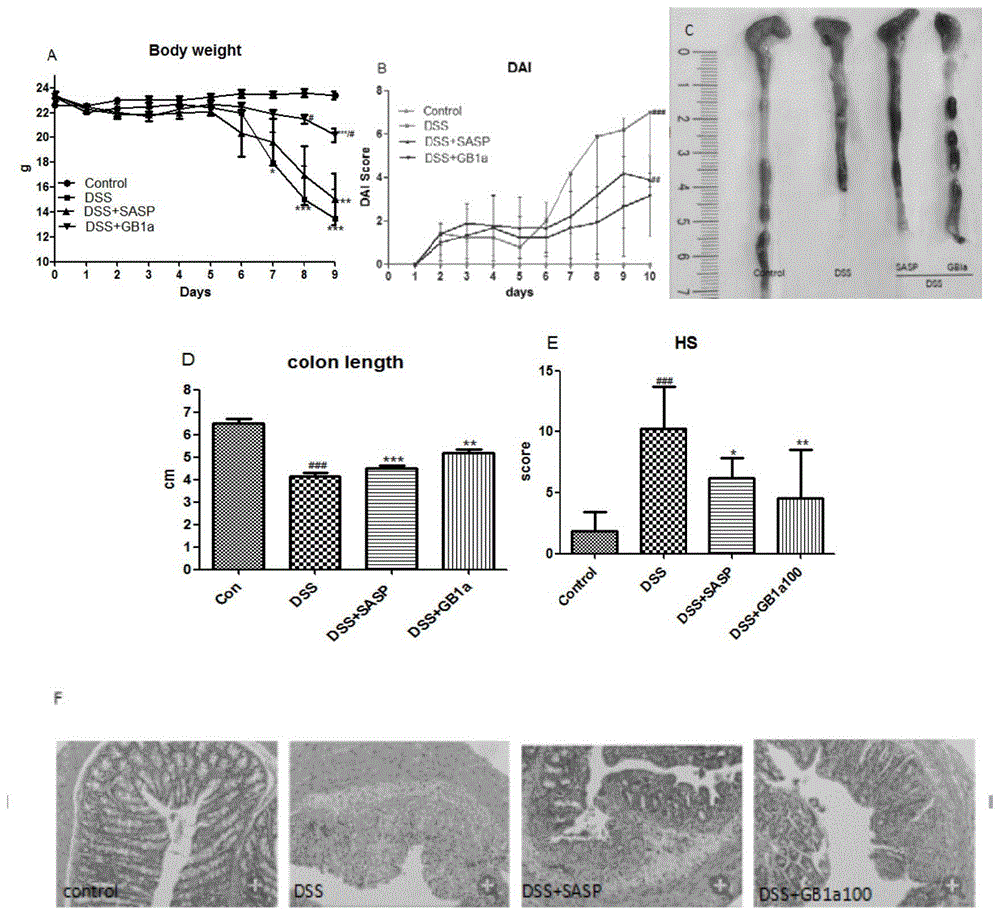
实验结果参见图1,其中,a为小鼠体重变化;b为小鼠疾病活动指数评分情况;c为大肠长度;d为gb1a抗dss诱导结肠缩短的代表性图片;e为病理级别;f为代表性病理图片。图1所示,gb1a显著保护dss诱导的体重降低(图1中a),减少dss所致的疾病活动指数评分情况(图1中b),逆转dss所致的大肠缩短情况(图1中c和d),并改善小鼠结肠的病理变化(图1中e和f)。结果表明gb1a具有改善小鼠结肠炎症的功效。
实验例2肠粘膜的炎症因子il-β、il-6和tnf-α的mrna表达水平和含量测定
测定方法:采用real-timepcr技术分别测定组织内il-β、il-6和tnf-α的mrna表达水平。眼球取血检测tnf-α、il-6和il-1β等。另取新鲜结肠组织,用预冷的pbs冲洗除去血液,滤纸吸干称质量,加9倍pbs,在低温(冰水)中用匀浆器将组织匀浆,高速离心取上清液低温(4℃)保存待测,其中,使用到的引物参见下表。
实验结果参见图2,其中,a为小鼠il-1βmrna表达水平;b为小鼠il-6mrna表达水平;c为小鼠tnf-αmrna表达水平;d为小鼠组织il-1β含量;e为小鼠血清il-1β含量;f为小鼠组织il-6含量;g为小鼠血清il-6含量;h为小鼠组织tnf-α含量;i为小鼠血清tnf-α含量。图3所示,gb1a抑制il-β、il-6、tnf-α的mrna表达水平(图2中a、b和c),进而降低dss诱导的炎症因子的含量(图2中d-i)。结果表明gb1a有利于减轻结肠粘膜炎症,具有改善结肠炎症的功效。
实验例3结肠粘膜通透性(fitc-d)检测、肠组织中zo-1和occludin的mrna表达水平
小鼠处死前2小时灌胃fitc-4k,眼球取血高速离心取上清液低温(-20℃)保存待测,激发波长490nm,发射520nm下测荧光表达量。采用real-timepcr技术分别测定组织内zo-1和occludin的mrna表达水平。其中,使用到的引物参见下表。
实验结果见图3,其中,a为小鼠肠组织中zo-1mrna表达水平;b为小鼠肠组织occludinmmrna表达水平;c为小鼠肠组织fitc-d含量。图3所示gb1a改变肠粘膜上皮细胞紧密连接蛋白zo1、occludin的mrna表达(图3中a和b),从而抑制dss诱导的小鼠结肠粘膜通透性升高(图3中c)。结果表明gb1a可以改善肠粘膜屏障功能。
实验例4肠组织中nqol、nrf2、sirt6和gclm的mrna表达水平
采用real-timepcr技术分别测定组织内nqol、nrf2、sirt6、gclm的mrna表达水平,其中,使用的引物参见下表。
实验结果见图4,其中,a为小鼠nqolmrna表达水平;b为小鼠nrf2mrna表达水平;c为小鼠sirt6mrna表达水平;d为小鼠组织gclmmrna表达水平。图4所示,gb1a干预后使抗氧化基因nqol、nrf2、sirt6、gclm的mrna表达上调,同时也证明了sirt6的表达受nrf2的调控(图4中b和c)。结果表明gb1a具有抗氧化的作用。
对实施例2的化合物进行实验
实验例5gb1改善dss诱导的小鼠肠炎
spf级c57bl小鼠,雄性,小鼠随机分为6组:即对照组、sasp组(100mg/kg)、dss组、dss+gb1高、中、低组(150,75和37.5mg/kg)。正常组10只,其余每组各12只。每组小鼠均自由饮用水3天,预先用sasp和gb1灌胃诱导3天。从第3天开始到第10天,dss组小鼠自由饮用纯净水4%dss(w/v)的水溶液,对照组小鼠自由饮用生理盐水。而sasp组和dss+gb1高、中、低组小鼠继续灌胃7天,第10天结束实验,眼球采血,并处死小鼠,解剖,取结肠进行各项指标的检测。
症状观察及病理组织切片观察。
每天对各组小鼠进行称重并记录,观察小鼠粪便,记录小鼠发生腹泻、血便的例数。
取肛门以上7cm肠段卷起,置4%的多聚甲醛中固定,常规脱水,石蜡包埋切片,4μm厚连续切片,分别作he染色,于光镜下观察肠细胞变性、坏死,炎症细胞浸润等病理损伤情况。
实验结果参见图5,其中,a为小鼠体重变化;b为小鼠疾病活动指数评分情况;c为大肠长度;d为gb1抗dss诱导结肠缩短的代表性图片;e为病理级别;f为代表性病理图片。图5所示,gb1显著保护dss诱导的体重降低(图5中a),减少dss所致的疾病活动指数评分情况(图5中b),逆转dss所致的大肠缩短情况(图5中c和d),并改善小鼠结肠的病理变化(图5中e和f)。结果表明gb1具有改善小鼠结肠炎症的功效。
实验例6肠粘膜的炎症因子il-β、il-6和tnf-α的mrna表达水平和含量测定
测定方法:采用real-timepcr技术分别测定组织内il-β、il-6、tnf-α的mrna表达水平。眼球取血检测tnf-α、il-6、il-1β等。另取新鲜结肠组织,用预冷的pbs冲洗除去血液,滤纸吸干称质量,加9倍pbs,在低温(冰水)中用匀浆器将组织匀浆,高速离心取上清液低温(4℃)保存待测。
实验结果见图6,其中,a为小鼠il-1βmrna表达水平;b为小鼠il-6mrna表达水平;c为小鼠tnf-αmrna表达水平;d为小鼠组织il-1β含量;e为小鼠血清il-1β含量;f为小鼠组织il-6含量;g为小鼠血清il-6含量;h为小鼠组织tnf-α含量;i为小鼠血清tnf-α含量。图6所示,gb1抑制il-β、il-6、tnf-α的mrna表达水平(图6中a、b、c),进而降低dss诱导的炎症因子的含量(图6中d-i)。结果表明gb1有利于减轻结肠粘膜炎症,具有改善结肠炎症的功效。
实验例7结肠粘膜通透性(fitc-d)检测、肠组织中zo-1和occludin的mrna表达水平
测定方法:小鼠处死前2小时灌胃fitc-4k,眼球取血高速离心取上清液低温(-20℃)保存待测,激发波长490nm,发射520nm下测荧光表达量。采用real-timepcr技术分别测定组织内zo-1、occludin的mrna表达水平。
实验结果见图7,其中,a为小鼠肠组织中zo-1mrna表达水平;b为小鼠肠组织occludinmmrna表达水平;c为小鼠肠组织fitc-d含量。图7所示gb1改变肠粘膜上皮细胞紧密连接蛋白zo1、occludin的mrna表达(图7中a和b),从而抑制dss诱导的小鼠结肠粘膜通透性升高(图7中c)。结果表明gb1可以改善肠粘膜屏障功能。
实验例8
检测方法:采用real-timepcr技术分别测定组织内nqol、nrf2、sirt6、gclm的mrna表达水平。
实验结果见图8,其中,a为小鼠nqolmrna表达水平;b为小鼠nrf2mrna表达水平;c为小鼠sirt6mrna表达水平;d为小鼠组织gclmmrna表达水平。图8所示,gb1干预后使抗氧化基因nqol、nrf2、sirt6、gclm的mrna表达上调,同时也证明了sirt6的表达受nrf2的调控(图8中b和c)。结果表明gb1具有抗氧化的作用。
上述实验进一步表明gb1对于结肠炎有良好的治疗效果,可以应用于治疗结肠炎药物的制备。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!