用于找到组织接近度的射频(RF)发送系统的制作方法
本发明整体涉及侵入式医疗器械,并且更具体地涉及利用体内探头进行电解剖标测的方法。
背景技术:
提出了用于心脏组织的电解剖标测的各种技术。例如,美国专利申请公布2006/0116576描述了用于相对于心脏来导航导管的系统和方法。在解剖体的表示上显示表示感兴趣的解剖区域(诸如针对治疗的心脏组织)的标记(诸如点或线)。在三维坐标系中确定医疗探头和标记的位置,并且基于这些位置确定医疗探头和标记之间的接近度。然后可将该接近度指示给用户(例如,使用图形、文本或可听声音)。
又如,美国专利申请公布2001/0009976描述了一种系统,该系统记录了被部署成与患者体内的心脏组织可操作地相关联的结构的使用。图像控制器生成在患者体内使用的结构的图像。输入装置接收包括识别患者的信息的数据。输出装置处理与数据相关联的图像以作为患者专用的数据库记录,以供存储、检索或操作。
美国专利申请公布2012/0158011描述了一种包括接近度感测功能的机器人导管控制系统,接近度感测功能被配置成生成指示医疗装置诸如电极导管与最近解剖结构诸如心脏壁的接近度的接近度信号。控制系统包括逻辑器,该逻辑器在导管的被引导运动期间监测接近度信号,以确保与身体组织的意外接触被检测到并被避免。该逻辑器包括用于限定多个接近度区域的装置,每个接近度区域具有与其相关联的相应接近度(距离)标准。
美国专利申请公布2006/0287649描述了一种用于对患者身体血管内的生物组织进行消融的射频型导管系统和方法,该射频型导管系统和方法包括用于在具有射频发送线的可部署导管中生成高频射频能量信号的射频(“rf”)发生器、安装在导管的远侧部分上的rf天线、以及也安装在导管的远侧部分上以用于检测邻近消融位点的温度的温度传感器。可成形的导管装置可带有一个或多个心内心电图(ecg)电极,以允许医师获得最佳组织接近度以及组织消融之前和之后的导电活动。
技术实现要素:
本发明的实施方案提供了一种方法,该方法包括从包括电极并且被定位在患者器官中的腔体内的探头接收:(i)指示电极与腔体的壁的接近度的接近度信号、以及(ii)指示电极在腔体内的位置的位置信号。基于接近度信号和位置信号,通过包括多个球体的球体模型表示腔体的体积的至少一部分。基于球体模型计算腔体的壁的估计轮廓。将壁的估计轮廓呈现给使用者。
在一些实施方案中,计算估计轮廓包括在球体模型中识别球体的尺寸单调减小所沿的方向、以及取决于方向来计算估计轮廓。
在一些实施方案中,计算该估计轮廓包括找到球体模型中的最小尺寸球体之间的交集、以及限定包含交集的估计轮廓。
在一个实施方案中,通过球体模型表示体积包括基于接近度信号和位置信号的子集来标定球体的半径,接近度信号和位置信号是在电极中的一个或多个与腔体的壁物理接触时产生的。在一个实施方案中,标定半径包括基于探头的已知几何形状来标定球体的半径。
在一些实施方案中,接收接近度信号包括接收在处于一个或多个射频范围的电极之间交换的双极电信号。
根据本发明的实施方案,还提供了一种包括接口和处理器的系统。接口被配置成从包括电极并且被定位在患者器官中的腔体内的探头接收:(i)指示电极与腔体的壁的接近度的接近度信号、以及(ii)指示电极在腔体内的位置的位置信号。处理器被配置成基于接近度信号和位置信号,通过包括多个球体的球体模型来表示腔体的体积的至少一部分。处理器还被配置成基于球体模型计算腔体的壁的估计轮廓,并且将壁的估计轮廓呈现给使用者。
结合附图,通过以下对本发明的实施方案的详细描述,将更全面地理解本发明,其中:
附图说明
图1为根据本发明的实施方案的用于电解剖标测的系统的示意性图解;
图2a和图2b为根据本发明的实施方案的执行组织接近度测量的导管的远侧端部的侧视图;
图3为根据本发明实施方案的局部腔体球体模型的几何构造的示意性图解;并且
图4为根据本发明的实施方案的示意性地示出用于心腔的电解剖标测的方法的流程图。
具体实施方式
概述
下文所述的本发明的实施方案提供了一种用于估计患者器官的腔体壁的组织与腔体内的导管的接近度的射频(rf)传输系统和方法。本发明所公开的方法依赖于相比于血液通常更高的组织阻抗,尤其是在若干khz的低rf频率范围内。因此,测量的阻抗随着导管靠近腔体壁而增大,从而指示组织的较近接近度。
在一些实施方案中,在腔体(诸如心腔)的电解剖标测阶段期间,将具有多个远侧电极的导管定位在腔体中。本发明所公开的系统测量一个或多个rf频率范围内的双极阻抗(远侧电极对之间的阻抗)。处理器利用所测量的阻抗以及先前的校准过程来估计组织与导管的接近度。标测涉及三个阶段:
数据采集阶段
在一些实施方案中,处理器被配置成利用球体模型表示患者器官的腔体体积的至少一部分。球体模型包括不同尺寸的球体,其中较小的球体被定位成更靠近表面。处理器识别球体尺寸单调减小所沿的方向。基于相应指示方向上的最小球体之间的交集,处理器计算沿腔体壁的表面的估计轮廓。
在一些实施方案中,当导管移动穿过心腔时,位置跟踪系统测量导管远侧端部的各个位置p。该系统采用例如装配在导管的远侧端部处的磁性传感器。传感器响应于外部施加的磁场来输出位置信号,该位置信号由位置跟踪系统的处理器接收。基于位置信号,处理器导出心腔内的导管位置p。
同时,系统测量接近度信号,诸如装配在导管的远侧端部上的一对或多对远侧电极之间的双极电信号。基于如上所述的指示壁组织与导管的接近度的双极信号并且基于所测量的位置p,处理器构建腔体球体模型。球体模型通过部分重叠的球体集合{(p,ρ)}来表示腔体体积的至少一部分。模型中的每个球体(p,ρ)由(a)其中心的已知位置p以及(b)还未标定的半径ρ描述,未标定的半径指示位置p与腔体壁之间的距离。在一个实施方案中,(i)磁性测量位置p为球体{(p,ρ)}的中心p,并且(ii)未标定的半径从ρ电测量阻抗导出,使得当阻抗变大时,ρ变小。
在本发明所公开的腔体表示中,位于腔体内较深位置(即,较远离腔体壁)的球体(p,ρ)将通常大于位于较靠近壁的球体(即,较深的球体具有较大的ρ)。从较大直径球体到较小直径球体的转变通常为渐进的且“平滑的”。
校准阶段
为了将半径ρ标定成绝对值r(即,校准ρ),处理器使用远侧端部与腔体壁组织物理接触的情况。当在电极对与腔体壁组织上的位置t物理接触时,处理器使双极信号与电极对和磁性传感器之间的几何已知距离rt相关联,该磁性传感器位于相应的位置pt处。距离rt基于导管远侧端部的尺寸为已知的,从而产生用于标定半径集合{(p,ρ)}t的参考球体(pt,rt)。在一个实施方案中,实时地执行标定。
在一些实施方案中,处理器在基于位置t的腔体的特定部分中标定球体的半径,在该位置t中已知导管已与腔体壁(组织)形成物理接触。为了检测位置t处的物理接触,系统可采用远侧电极和/或专用传感器,诸如接触力传感器、或本领域已知的其他方法和装置。
在一个实施方案中,当导管在心腔内移动时,使用多个不同的校准点t。以此方式,将各自围绕不同接触位置定位的多个球体模型组合成表示心腔的较大部分(可能是整个腔体)的整体球体模型。
标测阶段
一旦已执行校准,即,在处理器构建围绕位置t的校准球体模型之后,处理器就在球体表示中识别从较大球体到最小球体平滑转变的方向。该方向指向局部壁组织的位置,因为最小球体为最靠近壁组织的球体,如上所述。
此时,处理器识别由最小重叠球体限定的区段,该最小重叠球体大致位于位置t附近的腔体壁上。
在一些实施方案中,处理器进一步分析所导出的区段集合,以便局部地标测位置t附近的连续腔体壁(例如,通过在区段之间插值)。
在一个实施方案中,本发明所公开的系统和方法可随后生成心腔的电解剖标测图。可将标测图呈现给使用者,例如医师。
处理器利用包含特定算法的软件进行编程,该算法使处理器能够执行上文列出的处理器相关步骤和功能中的每个。
本发明所公开的用于估计组织接近度的rf发送系统和方法能够快速地提供心腔的至少一部分的电解剖模型。结合通过使用低电压、高频电信号(即,远高于任何生物生理活动频率)实现的对心脏组织的最小干扰,本发明所公开的系统和方法可为医师提供获得临床信息以支持治疗决策(诸如如何抑制心律失常)的有效且安全的方式。
系统说明
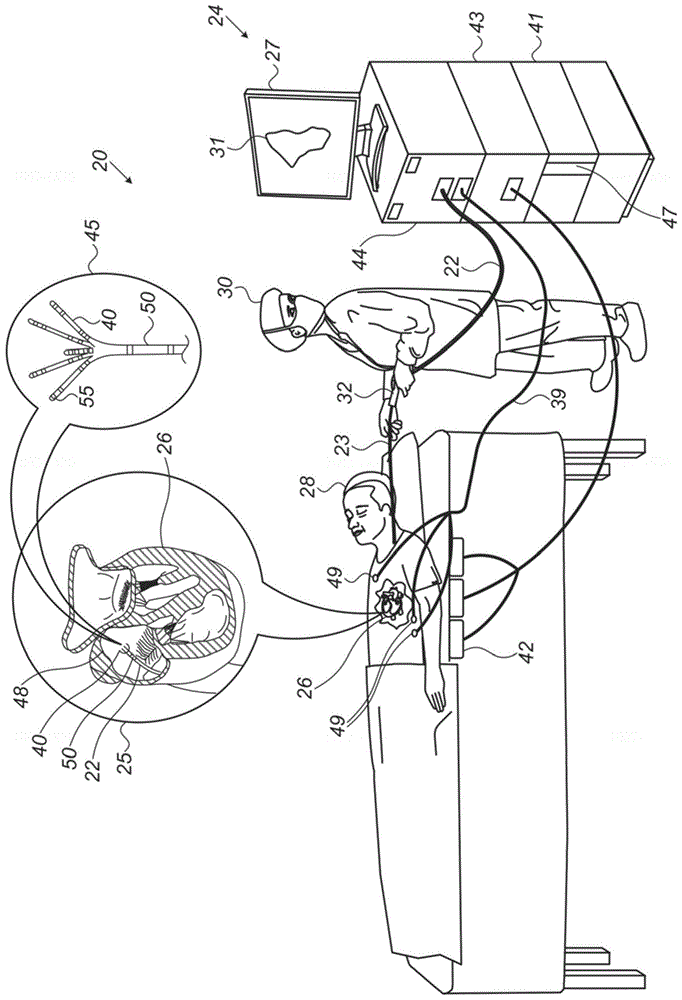
图1为根据本发明的一个实施方案的电解剖标测系统20的示意性图解。如图所见,医师30通过使用靠近导管的近侧端部的操纵器32操纵轴22和/或从护套23的挠曲来将详细地示于插图45中的
导管40以折叠配置插入穿过护套23,并且仅在护套23缩回之后,套索导管40才恢复其预期的功能形状。通过将导管40包含在折叠配置中,护套23还用于使在其到目标位置的途径上的血管创伤最小化。
图1示出了利用可见于插图25中的导管40来对患者28的具有腔体壁48的心脏26的腔体执行电解剖标测的医师30。在一些实施方案中,系统20确定导管40相对于心脏26的腔体中的心脏壁48组织的位置和/或接近度,如下所述。
导管40在轴22上包含磁性传感器50。导管40还包括可为机械柔性的一个或多个臂,其中臂中的每个联接一个或多个远侧电极55,如在插图45中所见。磁性传感器50和远侧电极55通过穿过轴22的导线连接到控制台24中的各种驱动电路。
在一些实施方案中,系统20包括磁性感测子系统以估计导管40在心脏26的心腔内的位置。将患者28放置在由包含磁场发生器线圈42的垫生成的磁场中,该磁场发生器线圈由单元43驱动。由线圈42生成的磁场在磁性传感器50中生成位置信号,该位置信号随后作为对应的电输入提供给处理器41,该处理器41使用这些输入来计算导管40的位置。
使用外部磁场和传感器50的位置感测的方法在各种医疗应用中实现,例如在由biosense-webster生产的cartotm系统中实现,并且详细地描述于美国专利5,391,199、6,690,963、6,484,118、6,239,724、6,618,612和6,332,089、pct专利公布wo96/05768、以及美国专利申请公布2002/0065455a1、2003/0120150a1和2004/0068178a1中,这些专利的公开内容均以引用方式并入本文。
处理器41(通常为通用计算机)经由合适的前端和接口电路44被进一步地连接,以接收来自表面电极49的信号。处理器41通过穿过电缆39延伸到患者28的胸部的导线连接到表面电极49。在一些实施方案中,处理器41通过使从远侧电极55和/或表面电极49接收的电位置信号与先前采集的位置校准电信号相关联来估计导管40在腔体内的位置。使用校准电信号的电极位置感测的方法在各种医疗应用中实现,例如在由biosense-webster生产的cartotm系统中实现,并且在美国专利7,756,576、7,869,865、7,848,787和8,456,182中有详细描述,其公开内容均以引用方式并入本文。
在一些实施方案中,在标测过程期间,远侧电极55采集并且/或者注入射频(rf)双极信号(即,远侧电极55对之间的差分电信号)。至少部分地穿过壁48组织的信号通常比穿过心脏26的血液的信号衰减得更多。处理器41经由电接口44接收各种rf双极接近度信号,并且利用包含在这些信号中的生物阻抗信息来构建腔体的电解剖接近度标测图31,如下文进一步详述。在该过程期间和/或之后,处理器41可在显示器27上显示电解剖接近度标测图31。
在一些实施方案中,处理器41还被配置成在测量期间估计和验证远侧电极55中的每个与壁48(即,心腔的表面)之间的物理接触的质量,以便使rf双极接近度指示信号与已知距离相关联。使用相关联的双极接近度信号和由传感器50测量的相应位置,处理器41构建腔体球体模型,该腔体球体模型用于例如标测心脏26的至少一部分,如下所述。
在一个实施方案中,处理器基于从装配在导管40的远侧端部处的一个或多个接触力传感器接收的信号来指示物理接触。在另一个实施方案中,物理接触的指示基于由远侧电极55感测的阻抗的频率响应。此类方法和技术描述于2018年5月29日提交的标题为“基于组织的频率响应的接触检测(touchdetectionbasedonfrequencyresponseoftissue)”的美国专利申请15/991,291中,该专利转让给本专利申请的受让人并且其公开内容以引用方式并入本文。
在另一个实施方案中,处理器41被配置成基于识别臂的几何屈曲来确定导管的多臂远侧端部的一个或多个柔性臂是否与壁48物理接触。此类技术描述于例如提交于2017年6月1日的标题为“使用导管臂的分段线性模型识别与组织的接触(usingapiecewise-linearmodelofacatheterarmtoidentifycontactwithtissue)”的美国专利申请15/610,865中,该专利转让给本专利申请的受让人并且其公开内容以引用方式并入本文。
处理器41通常在软件中编程以执行本文所述的功能。该软件可通过网络以电子形式被下载到计算机,例如或者其可另选地或另外地设置和/或存储在非暂态有形介质(诸如磁学、光学或电子存储器)上。
具体地讲,处理器41运行专用算法以使处理器41能够执行本发明所公开的步骤,包括计算接近度和位置、校准以及计算腔体表面,如下文进一步所述。
图1所示的示例性例证完全是为了概念清晰而选择的。为了简单和清楚起见,图1仅示出了与本发明所公开的技术有关的元件。系统20通常包括附加模块和元件,附加模块和元件与本发明所公开的技术不直接相关,并且因此附加模块和元件从图1和对应的描述中被有意地省略。系统20的元件以及本文所述的方法可进一步地用于例如使用远侧电极55的部分来控制的心脏26的壁48组织的消融。
可同样使用其他类型的感测和/或治疗导管,诸如
用于找到组织接近度的rf发送系统
图2a和图2b为根据本发明的实施方案的执行组织接近度测量的导管40的远侧端部的侧视图。将导管远侧端部在组织36的腔体壁48附近浸入心腔的血池中。
数据采集阶段
图2a示出了包括多个远侧电极55的局部导管,例如,
在一个实施方案中,该过程为预设的,就此而言,注入电极和接收电极被预先选定,提供给注入电极的电流的频率和驱动电压也被预先选定。
在一些实施方案中,不同的电频率范围包括1khz-4khz和12khz-100khz的范围。使用两个不同频率范围的原因在于阻抗在12khz-100khz范围下对组织36上不敏感,而信号在1khz-4khz范围下显示出对组织36测量敏感性。使用高频作为参考,可准确地解决低频阻抗的小变化,即,随组织接近度而变化。
在一个实施方案中,当导管40在心腔内移动时,处理器41接收在成对远侧电极55之间测量的阻抗测量值。每个阻抗测量值取决于发送电极和接收电极、注入频率和电压、以及居间材料(血液和/或组织)。通常,组织具有比血液更高的阻抗,尤其是在较低频率范围内,使得如果电极更靠近组织36的壁48,则阻抗通常更高,反之亦然。在一个实施方案中,阻抗对频率以及对血液和/或组织的依赖性提供于上文引用的美国专利申请15/991,291中。
处理器41将双极阻抗布置在矩阵[m]中。处理器41使每个矩阵[m]与通过位置传感器50测量的相应位置p(在该位置处测量双极阻抗)相关联。处理器41将有序对集合{(p,[m])}存储在存储器47中。每个双极阻抗信号矩阵[m]与相对导管的未标定壁组织接近度ρδ相关。因此,在该阶段,处理器保持球体模型,该球体模型包括集合{(p,ρ)},其中半径ρ未进行标定。
校准阶段
图2b示出了其中导管40在接触点t处与腔体壁48接触的情况。物理接触的出现可由任何合适的传感器来确定,例如通过由导管40中的力传感器测量的力和/或选定远侧电极55之间的阻抗的变化来确定。(图2b假定接触位于两个相邻电极550处。)
在接触情况下,处理器将ρ接触点t处的接触组织壁48与导管中的位置传感器50之间的距离标定成rt(基于导管几何形状,如上所述),从而产生校准球体(pt,rt)。
基于位置t处的校准,处理器构建关联对(rt,[m]t),然后处理器标定与在接触点t附近测量的先前矩阵[m]ρ相关联的距离,以产生局部标定的球体集合{(p,r)}t。
如上文所指出的那样,仅已知到壁48组织的距离rt,而不知到组织壁的方向,并且该距离限定围绕传感器50的位置pt的具有半径r的球体70,如图2b所示。(图3描述了处理器40如何确定到组织壁36的方向。)
在一个实施方案中,当导管40触及腔室中的不同位置{t}处的组织时,重复该校准过程。所得的局部球体模型{(p,r)}t随后用于估计每个接触位置的t∈{t}附近的腔体壁接近度。如下文进一步所述,本发明所公开的校准在围绕相应接触点t定位的区域中是有效的。标测整个腔体需要多个接触点。
图2a和2b中的图解以举例的方式提供。又如,在一些实施方案中,远侧端部40为多臂导管(例如,臂)的部分。在另一个实施方案中,利用篮型导管远侧端部来应用本发明所公开的组织接近度估计方法。在当前注入采集方法的替代形式中,将不同频率的双极电势60a施加在成对的远侧电极55之间,然后测量相应的阻抗。
标测阶段
图3为根据本发明实施方案的局部腔体球体模型的几何构造的示意性图解。在例如基于使用导管40采集的信号的研究性电解剖标测阶段期间,处理器41构建腔体壁48上的位置t附近的局部校准球体集合{{p,r)}t,即球体68和球体70。
在一个实施方案中,成为局部集合{(p,r)}t的部分的球体的入选标准基于例如位置p,该位置p与用于标定半径的位置pt至多具有给定距离。因此,图3仅描述了围绕给定物理接触位置t定位(例如,从意义上而言)的腔体球体模型。
如果例如在校准期间在整个腔体壁上记录足够数量的不同接触位置t,并且获得一系列独立的球体模型(例如,彼此间隔开距离),则腔球体模型可覆盖腔体的较大部分,并且最多覆盖整个腔体。
对于较靠近腔体中心并且与腔体壁大约等距的区域,相应的球体68集合具有近似相等的直径。这被示意性地示为图3的区域a,其中圆(球体)通常将具有比所示的直径更大的直径。
较靠近壁的点p处的球体70的半径将通常小于较远离壁48球体的半径,如图3中的区域b所示。从较大直径球体到较小直径球体的渐进转变限定了腔体壁48存在的方向77。
部分重叠的最小球体70的最外相交区段75(示为点75)估计腔体壁48的位置。在一个实施方案中,处理器41通过在区段75上插值来局部地标测组织壁48。
图3所示的示例性例证完全是为了概念清晰而选择的。例如,为了便于显示,所示的球体中的一些可未精确地标定。区段75在空间中实际上为沿进出页面的方向延伸的曲线。
图4为根据本发明的实施方案的示意性地示出用于心腔的电解剖标测的方法的流程图。在一些实施方案中,该算法的步骤通过对处理器41编程的软件来执行。
数据采集阶段100(步骤80-82)
在接近度数据采集步骤80处,该过程开始于医师30将配备有磁性传感器50的导管40移动到心腔内以采集多个磁性位置信号和双极电接近度信号。
同时,在采集物理接触指示步骤82处,包括用于检测与心腔壁的物理接触的装置的导管40偶尔向处理器41指示导管40与壁组织形成物理接触。
在位置和未标定的接近度计算步骤84处,基于位置信号和相应的接近度信号并且利用专用算法,处理器41计算位置和相应的相对(即,未标定的)接近度。接下来,在局部球体模型构建步骤86处,处理器41利用球体{(p,ρ)}t表示心腔的一部分。
校准阶段110
接下来,基于附近的物理接触的指示(即在步骤82处),处理器41在校准步骤88处将球体模型校准成具有已知半径的球体模型{(p,r)}t。
标测阶段120
接下来,在壁方向估计步骤90处,基于局部标定的球体模型{(p,r)}t,处理器41通过确定半径r变小的方向77来估计壁组织所处的方向。
然后,在组织壁识别步骤92处,处理器41估计最小球体{(p,r)}t的相交区段75的位置,以便估计腔体壁48的位置。基于腔体壁48识别步骤,处理器41估计腔体壁组织48与导管40的接近度(即,距离)。
如上所述,估计的组织接近度为局部的。为了产生腔体的解剖标测图,通常随着导管在腔体内移动来将步骤80-94中所述的过程重复n次。接下来,在腔体标测步骤96处,基于n个采集的接近度,处理器41计算心腔的表面。在存储步骤98处,将计算的表面存储在存储器47中。最后,在腔体标测图显示步骤100,处理器41在显示器27上向医师30呈现计算的表面(例如,腔体的至少一部分的接近度标测图31)。
图4所示的示例性流程图完全是为了概念清晰而选择的。在另选的实施方案中,例如,在心腔壁上的多个不同位置t处重复采集步骤80-82并且重复建模步骤84-94,直到腔体壁的足够部分已被电解剖标测,由此使得整个腔体被标测。在一个实施方案中,处理器在相交区段75上插值,以便导出局部连续的腔体壁。
虽然本文所述的实施方案主要涉及心脏应用,但本文所述的方法和系统也可以用于其他医疗应用,诸如神经学和肾脏学。
因此应当理解,上面描述的实施方案以举例的方式被引用,并且本发明不限于上文特定示出和描述的内容。相反,本发明的范围包括上文描述的各种特征的组合和子组合以及它们的变型和修改,本领域的技术人员在阅读上述描述时将会想到该变型和修改,并且该变型和修改并未在现有技术中公开。以引用方式并入本专利申请的文献被视为本申请的整体部分,不同的是如果这些并入的文献中限定的任何术语与本说明书中明确或隐含地给出的定义相冲突,则应仅考虑本说明书中的定义。
- 还没有人留言评论。精彩留言会获得点赞!