一种载有ICIs单抗的载药微球及其制备方法与流程
本发明属于生物医药技术领域,具体为一种载有icis单抗的载药微球及其制备方法。
背景技术:
icis(免疫检查点抑制剂)治疗使多种实体瘤患者生存率得到临床意义上的延长,这种抑制剂包括ctla-4、pd-1等抗体,程序性死亡受体-1(programmedcelldeathprotein-1,pd-1)是由激活的t细胞和b细胞表达的关键免疫检查点受体并介导免疫抑制。pd-1属于cd28家族成员,是一种由288个氨基酸残基构成的单体糖蛋白。pd-1分为胞外区、跨膜区和胞质区三个部分。胞外区含有一个igv样结构域,有4个重要的n连接糖基化位点,该结构与其配体结合而诱导负性免疫应答。pd-1有两个配体,pd-l1和pd-l2,两者均属于b7家族的跨膜分子,其中以pd-l1的调控作用最为突出。pd-l1是由290个氨基酸亚基组成的跨膜蛋白,包含胞外段的两个免疫球蛋白恒定区igc和igv样结构域,1个跨膜疏水区和1个由30个氨基酸组成的胞内区。pd-l1主要表达于成熟的cd4+、cd8+t细胞、b细胞、树突状细胞等造血细胞。
正常情况下,pd-1与其配体结合后会抑制t、b细胞的增殖、il-2和ifn-γ等细胞因子的产生以及抗体的分泌,进而抑制自身免疫应答,防止自身免疫性疾病的发生。但是,许多肿瘤细胞系及肿瘤细胞(如黑色素瘤、卵巢瘤、肺癌、肾透明细胞癌、尿路上皮癌等)高表达pd-l1分子,其与淋巴细胞表面的pd-1分子结合后,通过该机制削弱了机体的抗肿瘤免疫应答,进而促进肿瘤发生免疫应答。鉴于pd-1的免疫抑制作用,pd-1抑制剂被认为能激活免疫系统来攻击肿瘤细胞,因而可用于治疗肿瘤和其它免疫相关疾病。目前已有多个pd-1单抗药物(pembrolizumab,nivolumab,pidilizuma和lambrolizumab)上市,用于治疗某些晚期实体瘤,主要有肺癌、肾细胞癌、黑色素瘤、膀胱癌等。但是,鉴于很多肿瘤均为冷肿瘤,现有技术中应用静脉注射、瘤内注射等方式使pd-1等icis抗体的治疗反应并不充分。
技术实现要素:
为了解决现有技术中采用静脉注射、瘤内注射等方式使icis单抗的治疗反应并不充分的缺陷,本发明提供了一种载有icis单抗的载药微球及其制备方法,实现的目的为,通过介入给药能够定位靶向作用于肿瘤部位,从而增强抗瘤效果,也可实现对药物释放的可调可控。
为了实现上述目的,本发明提供的技术方案为,(1)将明胶材料甲基丙烯酰化明胶、光引发剂lap溶于磷酸盐溶液,得到明胶水凝胶溶液;
(2)向步骤(1)得到的明胶水凝胶溶液中加入icis单抗,使明胶水凝胶溶液与icis单抗充分混匀,得到载有icis单抗的明胶水凝胶溶液,作为水相避光保存,待用;
(3)配置含表面活性剂span80的油性溶液,表面活性剂span80在油性溶液中占的质量百分比为2%,将该油性溶液超声静置3-6小时去除气泡,作为油相备用;
(4)分别将步骤(2)制备好的水相与步骤(3)制备好的油相与微泵注射器连接,油相的质量至少大于水相质量的3倍,根据要取得的载药微球粒径大小设定流速,在收集端使用蓝光照射水相与油相混合制成的微球前体,使之交联形成载药微球;
(5)将步骤(4)交联好的载药微球进行去除油污、冷冻干燥的后处理,即可得到载有icis单抗的载药微球。
载药微球是指药物溶解或分散在成球材料中,形成的微小球形或类球形微粒。借助特定高分子材料的生物降解性和降解事件的的可控性,采用微球给药可以实现超长时间的缓控释作用,并使药物浓集于靶区,可以避免出现血药浓度峰谷现象减少毒副作用、实现提高药物疗效、延缓给药周期,提高用药顺应性等。明胶是一种动物的结缔组织或表皮组织中的胶原部分变性或降解的产物,由18种氨基酸与多肽交联形成的直链聚合物,明胶具有良好的生物相容性、生物降解性和生物吸附性,本发明采用明胶微球载入抗肿瘤单抗体给药,相较于现有技术单抗静脉注射、瘤内注射等给药方式,给药更为方便,而且通过微球介入给药可以将肿瘤血管栓塞,造成肿瘤局部缺氧、坏死和凋亡,释放肿瘤抗原,将“免疫冷肿瘤”转变为“免疫热肿瘤”,增强抗瘤效果;还可以避免免疫治疗引发全身免疫不良反应,通过本方法制备出的载药微球可以实现局部给药,从而实现局部调节免疫反应,减低全身免疫细胞因子风暴的不良反应发生;还可以通过载药微球本身的性质实现对药物释放的可调可控。
进一步的,所述步骤(1)的具体操作方法为称取300mg甲基丙烯酰化明胶与30mg光引发剂lap加入6ml磷酸盐缓冲液中,得到含明胶的混合液,再向所述含明胶的混合液中加入造孔剂,造孔剂在该含明胶的混合液中占的质量百分比为1%-20%,置于60℃水浴锅内,间断震荡至完全溶解,得质量浓度为5%的明胶水凝胶溶液,避光保存,待用。
进一步的,所述步骤(2)中icis单抗在明胶水凝胶溶液中的浓度为1ppm-10000ppm,在100-1000转/分钟条件下搅拌,使明胶水凝胶溶液与icis单抗充分混匀。
进一步的,所述步骤(2)中抗肿瘤单抗体为pd-1、pd-l1、pd-l2、ox-40、41bb中任意一种或一种以上。公开号为cn104736168a专利也披露了一种pd-l1单抗,这种单抗也能够同样采用本发明制备方法得到载药微球,鉴于很多肿瘤均为冷肿瘤,对全身的icis抗体治疗反应并不充分,本发明采用的上述制备方法,在载药微球中载入icis能够促进肿瘤区肿瘤相关抗原释放,提高肿瘤区域免疫刺激活性,转变冷肿瘤为热肿瘤,从而提高抗瘤效果。
进一步的,所述步骤(3)中油性溶液为石蜡油、矿物油中的一种或一种以上。
进一步的,所述步骤(5)中后处理方法包括将交联好的载药微球使用异丙醇清洗去除油污,再使用超纯水清洗后使用超纯水保存微球,得到含有抗肿瘤单抗体的超纯水微球悬液,最后将该微球悬液进行-20℃冷冻干燥2天,即可获得载有icis单抗的载药微球。
进一步的,本发明还要求保护由上述制备方法制备得到的载有icis单抗的载药微球。
本发明采用上述技术方案,有益效果包括:本发明采用生物相容性的明胶等材料制备微球介入icis单抗,微球介入给药可以将肿瘤血管栓塞,造成肿瘤局部缺氧、坏死和凋亡,释放肿瘤抗原,将“免疫冷肿瘤”转变为“免疫热肿瘤”,增强抗瘤效果。该水凝胶多孔微球的粒径从几微米至几百微米,可形成不同释放能力的微球,实现单抗定位、定量、定时的精确释放。
附图说明
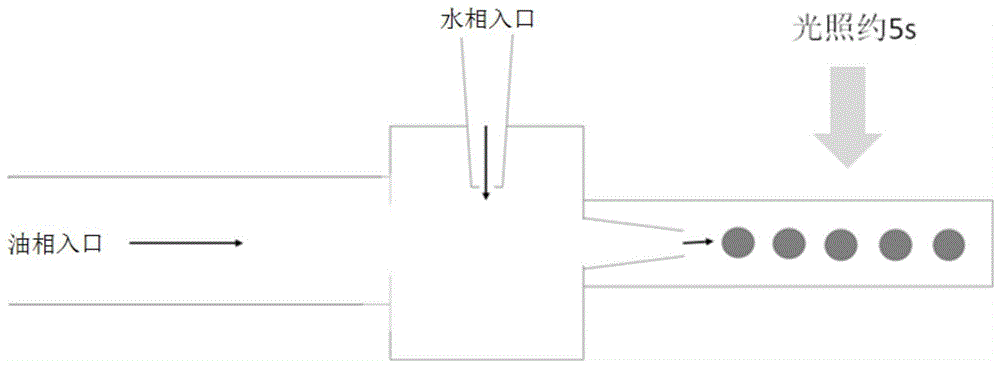
图1是本发明实施例一中载药微球合成流程示意图。
图2是本发明实施例一中制得的载药微球粒径分布图。
图3是本发明实施例一中制得的载药微球降解速度曲线图。
具体实施方式
以下结合实施例对本发明作出进一步的说明。本发明中没有特殊说明的操作方法都是现有技术,没有特殊说明的操作条件也都是常温常压下,试剂均为市售自购。
实施例一:本发明提供的一种载有抗肿瘤单抗体的载药微球的制备方法,包括如下步骤:
(1)将明胶材料甲基丙烯酰化明胶、光引发剂lap溶于磷酸盐缓冲液中,得到明胶水凝胶溶液;
(2)向步骤(1)得到的明胶水凝胶溶液中加入icis单抗,使明胶水凝胶溶液与icis单抗充分混匀,得到载有icis单抗的明胶水凝胶溶液,作为水相避光保存,待用;
(3)配置含表面活性剂span80的油性溶液,表面活性剂span80在油性溶液中占的质量百分比为2%,将该油性溶液超声静置3小时去除气泡,作为油相备用;
(4)分别将步骤(2)制备好的水相与步骤(3)制备好的油相与微泵注射器连接,油相的质量大于水相质量的3倍,根据要取得的载药微球粒径大小设定流速,在收集端使用蓝光照射水相与油相混合制成的微球前体,照射的时间约5s左右,使之交联形成载药微球;
(5)将步骤(4)交联好的载药微球进行去除油污、冷冻干燥的后处理,即可得到载有icis单抗的载药微球。
具体地,所述步骤(1)的具体操作方法为称取300mg甲基丙烯酰化明胶与30mg光引发剂lap加入6ml磷酸盐缓冲液中,得到含明胶的混合液,再向所述含明胶的混合液中加入造孔剂,造孔剂在该含明胶的混合液中占的质量百分比为20%,置于60℃水浴锅内,间断震荡至完全溶解,得质量浓度为5%的明胶水凝胶溶液,避光保存,待用。
具体地,所述步骤(2)中icis单抗在明胶水凝胶溶液中的浓度为1ppm,在100转/分钟条件下搅拌,使明胶水凝胶溶液与icis单抗充分混匀。
所述步骤(2)中抗肿瘤单抗体为pd-1。
进一步的,所述步骤(3)中油性溶液为石蜡油。
所述步骤(5)中后处理方法包括将交联好的载药微球使用异丙醇清洗三遍以上去除油污,再使用超纯水清洗三遍以上后使用超纯水保存微球,得到含有抗肿瘤单抗体的超纯水微球悬液,最后将该微球悬液进行-20℃冷冻干燥2天,即可获得载有icis单抗的载药微球。
实施例二:本发明提供的一种载有抗肿瘤单抗体的载药微球的制备方法,包括如下步骤:
(1)将明胶材料甲基丙烯酰化明胶、光引发剂lap溶于磷酸盐缓冲液中,得到明胶水凝胶溶液;
(2)向步骤(1)得到的明胶水凝胶溶液中加入icis单抗,使明胶水凝胶溶液与icis单抗充分混匀,得到载有icis单抗的明胶水凝胶溶液,作为水相避光保存,待用;
(3)配置含表面活性剂span80的油性溶液,表面活性剂span80在油性溶液中占的质量百分比为2%,将该油性溶液超声静置6小时去除气泡,作为油相备用;
(4)分别将步骤(2)制备好的水相与步骤(3)制备好的油相与微泵注射器连接,油相的质量至少大于水相质量的3倍,例如5倍,根据要取得的载药微球粒径大小设定流速,在收集端使用蓝光照射水相与油相混合制成的微球前体,照射的时间约5s左右,使之交联形成载药微球;
(5)将步骤(4)交联好的载药微球进行去除油污、冷冻干燥的后处理,即可得到载有icis单抗的载药微球。
具体地,所述步骤(1)的具体操作方法为称取300mg甲基丙烯酰化明胶与30mg光引发剂lap加入6ml磷酸盐缓冲液中,得到含明胶的混合液,再向所述含明胶的混合液中加入造孔剂,造孔剂在该含明胶的混合液中占的质量百分比为1%,置于60℃水浴锅内,间断震荡至完全溶解,得质量浓度为5%的明胶水凝胶溶液,避光保存,待用。
具体地,所述步骤(2)中icis单抗在明胶水凝胶溶液中的浓度为10000ppm,在1000转/分钟条件下搅拌,使明胶水凝胶溶液与icis单抗充分混匀。
所述步骤(2)中抗肿瘤单抗体为pd-l1。
进一步的,所述步骤(3)中油性溶液为矿物油。
所述步骤(5)中后处理方法包括将交联好的载药微球使用异丙醇清洗三遍以上去除油污,再使用超纯水清洗三遍以上后使用超纯水保存微球,得到含有抗肿瘤单抗体的超纯水微球悬液,最后将该微球悬液进行-20℃冷冻干燥2天,即可获得载有icis单抗的载药微球。
本发明制备方法中水相和油相经照射合成得到载药微球的流程参照图1所示;采用上述方法能够将pd-1抗体载入载药微球中,且并没有由于抗体的载入而使载药微球发生性质上的变化,例如图2、图3所示的,本发明得到的载药微球粒径分布范围可以很广,以适应于不同的要求,还具有缓释释放的作用,这种方法同样适用于pd-l1、pd-l2,ox-40、41bb等一些icis免疫检查点抑制剂,制备方法均是一样的,实现的效果大体上也是一样的,只不过具体抗体不同,可能降解速率有所不同而已,但是其他的抗体也是具有很广的载药微球粒径分布范围,以及缓释的降解作用,其他的抗体示例仅是文字上的重复,为了节省篇幅,故本发明就不再一一举例了。
现有技术大多常用的给药方式:一、瘤内注射,瘤内注射多用于实体瘤或部位局限的肿瘤,瘤内注射给药操作复杂,极大地限制了药物的临床应用范畴;二、静脉给药,静脉给药易被循环液(血液等)稀释,从而降低使肿瘤细胞凋亡的疗效。相较于现有技术的给药方式,通过本发明制备方法可以将抗肿瘤抗体负载于载药微球中,通过微球的介入给药,能够靶向定位到瘤内,给药方便,可以将肿瘤血管栓塞,造成肿瘤局部缺氧、坏死和凋亡,还可以刺激肿瘤相关抗原释放,由此提高抗瘤的作用,由于是局部给药,还可以避免免疫治疗引发全身免疫不良反应,同时借助微球自身的性质,实现药物释放的可调可控。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!