一种帕金森病动物模型的构建方法与流程
本发明属于动物模型构建技术领域,具体涉及一种帕金森病动物模型的构建方法。
背景技术:
帕金森病(parkinson’sdisease,pd)是一种严重的进行性运动障碍疾病。在我国年龄高于65岁的人群中,pd的发病率约为1.7%,是仅次于老年痴呆症的第二大神经退行性疾病。帕金森病的病理特征是黑质致密部分(snpc)多巴胺能神经元变性,纹状体多巴胺(da)丢失,以及α-突触核蛋白变性聚集物形成路易体。据估计,90%的pd患者没有家族史,散发性帕金森病被认为是由遗传易感性和环境因素共同作用引起的。
合适的动物模型有助于推动疾病发生机制的研究,并可成为疾病治疗药物筛选的有效工具。除了用于研究家族遗传性pd的转基因(sncaa53t转基因)和基因敲除(pink1或parkin敲除)动物模型外,目前广泛使用的药物诱导pd模型主要有:6-羟多巴胺定位损毁模型、mptp(1-甲基-4-苯基-1,2,3,6-四氢吡啶)诱导的急性或亚急性pd模型以及鱼藤酮诱导的慢性pd进展模型。综合比较这三种模型:(1)6-羟多巴胺不能穿过血脑屏障进入动物大脑,需借助大脑立体定位仪在纹状体区域直接注射才能造成中脑多巴胺能神经元的急性损伤,此外,该模型的制备在操作上依赖于实验人员的技术水平,成功率和重复性较难保证。(2)mptp和鱼藤酮诱导的pd模型中使用的药物浓度相对较大(mptp:c57bl6小鼠,剂量为30mg/kg,持续给药5天;鱼藤酮:大鼠,剂量为1.5-2.0mg/kg,持续给药4周左右),在生活中人们不易暴露在这样高浓度的药物环境下。(3)6-羟多巴胺、mptp和鱼藤酮都是线粒体复合物的抑制剂,在诱导原理上,有很大的类似之处。综上所述,这3种常见pd模型均以单一的化学试剂诱导多巴胺能神经元死亡,它们一定程度上忽视了帕金森病是多因素导致的神经变性性疾病。
囊泡单胺类转运体2(vmat2)是溶质运载蛋白家族18(solutecarrierfamily18,slc18)的成员,它负责将单胺类神经递质包装到囊泡中以调控其贮存和释放。vmat2的这种功能保护多巴胺能神经元免受生理条件下多巴胺代谢产物的毒性影响。vmat2的p387l突变显著降低了其囊泡转运活性,与婴儿震颤麻痹、运动障碍、情感障碍和发育迟缓密切相关,提示vmat2是pd的遗传易感性因素之一。在pd死亡患者纹状体分离的突触小泡中,pd病人的多巴胺摄取、vmat2与[3h]dtbz的结合能力分别降低了87-90%和71-80%。事实上,在模式动物中降低基因表达或用药物抑制vmat2活性都会产生不良反应。纯合型vmat2基因敲除小鼠出生后数天内死亡,单胺类储存和囊泡释放严重受损,而杂合子vmat2小鼠对可卡因、苯丙胺和mptp表现出超敏反应。用vmat2抑制剂如利血平和丁苯那嗪(tbz)处理啮齿类动物,可导致单胺类神经递质的消耗和pd样症状如静态震颤的出现。与pd相关的环境毒素如鱼藤酮、七氯及其结构类似物多氯联苯已被发现可抑制vmat2的活性。因此,vmat2的活性降低与多巴胺能神经元的变性密切相关,说明它是帕金森病的致病因素之一。
《vmat2基因联合环境毒素对帕金森病非运动症状的作用研究》([d].2016.徐小云.)中,发现vmat2基因敲低联合鱼藤酮组出现最为明显的抑郁症状,表现于行为学及病理生理学的变化,表明vmat2基因对帕金森病有保护作用,vmat2基因敲低联合鱼藤酮建立帕金森病动物模型,能更好的模拟帕金森病的非运动症状。但是,其使用的是vmat2缺失的小鼠,而这种vmat2缺失的情况在人群中发生的比例较低。因此,vmat2基因敲低小鼠联合鱼藤酮建立的帕金森病动物模型不能很好地模拟帕金森病的进展。
环境神经毒素与帕金森病密切相关的最初证据是使用了被mptp(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,1-甲基-4-苯基-1,2,3,6-四氢吡啶)污染的毒品mppp(1-甲基-4-苯基-4-哌啶丙酸酯)的吸毒者被诊断患上了帕金森病。近几十年来,急性(20mg/kg/剂量×1天4次)和亚急性(30mg/kg/天连续5天)小鼠mptp模型极大地促进了帕金森病的病理生理学研究。在多巴胺能神经元中,mpp+是mptp的代谢产物,它与线粒体复合物i的结合破坏了细胞能量代谢,从而通过氧化应激诱导细胞死亡。然而,由于快速的毒性动力学和较短的给药模式,高剂量的mptp不能很好地模拟人类帕金森病的缓慢进展的特征。
目前,国内外尚没有研究用化学小分子抑制vmat2的活性进而考察神经毒性物质mptp对多巴胺能神经元损伤的程度。
技术实现要素:
因此,本发明提供一种帕金森病动物模型的构建方法。
本发明的具体技术方案为:
一种帕金森病动物模型的构建方法,包括,采用ii型囊泡单胺转运体的抑制剂与环境神经毒素对动物联合给药。
所述ii型囊泡单胺转运体的抑制剂为利血平、二氢丁苯那嗪及其同分异构体和丁苯那嗪及其同分异构体中的一种或两种以上;
所述环境神经毒素为1-甲基-4-苯基-1,2,3,6-四氢吡啶、6-羟多巴胺和鱼藤酮中的一种或两种以上。
进一步地,所述ii型囊泡单胺转运体的抑制剂为右旋二氢丁苯那嗪或消旋二氢丁苯那嗪,所述环境神经毒素为1-甲基-4-苯基-1,2,3,6-四氢吡啶。
所述ii型囊泡单胺转运体的抑制剂的单次给药量为2.5-7.5mg/kg小鼠,所述环境神经毒素的单次给药量为7.5-12.5mg/kg小鼠。
进一步地,所述ii型囊泡单胺转运体的抑制剂的单次给药量为5mg/kg小鼠,所述环境神经毒素的单次给药量为10mg/kg小鼠。
所述联合给药为,在ii型囊泡单胺转运体的抑制剂给药完成5-120分钟后,再进行环境神经毒素给药;
所述ii型囊泡单胺转运体的抑制剂的给药频率为1次/天,环境神经毒素的给药频率为1次/天;
所述ii型囊泡单胺转运体的抑制剂与环境神经毒素的给药总时长分别为10-50天。
所述给药采用腹腔注射方式。
进一步地,腹腔注射时,所述ii型囊泡单胺转运体的抑制剂的注射液的溶剂为20%dmso(v/v%),所述环境神经毒素的注射液的溶剂为生理盐水。
进一步地,所述ii型囊泡单胺转运体的抑制剂的注射液的溶剂为20%dmso(v/v%),并以盐酸助溶。
所述构建方法,还包括对构建的帕金森病动物模型进行验证,具体为:检测脑纹状体中多巴胺的含量变化,以及黑质和纹状体中多巴胺能神经元变性的情况。
所述动物为c57bl/6小鼠。
一种如上述的构建方法构建得到的帕金森病动物模型。
本发明技术方案,具有如下优点:
1、本发明的帕金森病动物模型的构建方法中,通对动物进行ii型囊泡单胺转运体的抑制剂与环境神经毒素的联合给药得到帕金森病动物模型,一方面,ii型囊泡单胺转运体的抑制剂和环境神经毒素分别靶向vmat2和线粒体复合物i,这种非单因素诱导的pd动物模型与病因学上认为帕金森病是多因素诱导发生相符,能够更好地模拟人类帕金森病的特征。本发明非单因素诱导的pd动物模型,将为pd的多因素诱导发病机制提供支持,并为开发pd治疗的新方案提供理论依据;
另一方面,因vmat2缺失在人群中的比例较低,vmat2杂合子小鼠联合环境毒素建立的帕金森病动物模型不能很好地模拟帕金森病的进展,本发明根据很多环境毒素能够抑制vmat2活性,通过vmat2的抑制剂联合环境神经毒素来构建帕金森病动物模型,从帕金森病与环境毒素的密切关系上看,本发明用药物抑制vmat2活性更具有现实意义。
2、本发明的帕金森病动物模型构建方法中,本发明研究发现,当mptp与dtbz联合用药时可显著增加mptp的毒性,环境神经毒素mptp的剂量显著低于经典的mptp诱导的小鼠帕金森病模型中使用的剂量,一方面,能够更好地模拟人类帕金森病的缓慢进展的特征;另一方面,对实验操作人员具有明显的保护作用,同时减少了副作用的产生。
3、本发明的帕金森病动物模型构建方法中,利用免疫组织化学方法直接考察黑质和纹状体中多巴胺能神经元及其神经纤维含量的差异,病理学评价更为科学。
4、本发明的帕金森病动物模型,为非单因素诱导的pd动物模型,将为pd的多因素诱导发病机制提供支持,以及更好地模拟人类帕金森病的缓慢进展的优势,为开发一种有效治疗pd的新药物制剂提供重要的理论依据。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
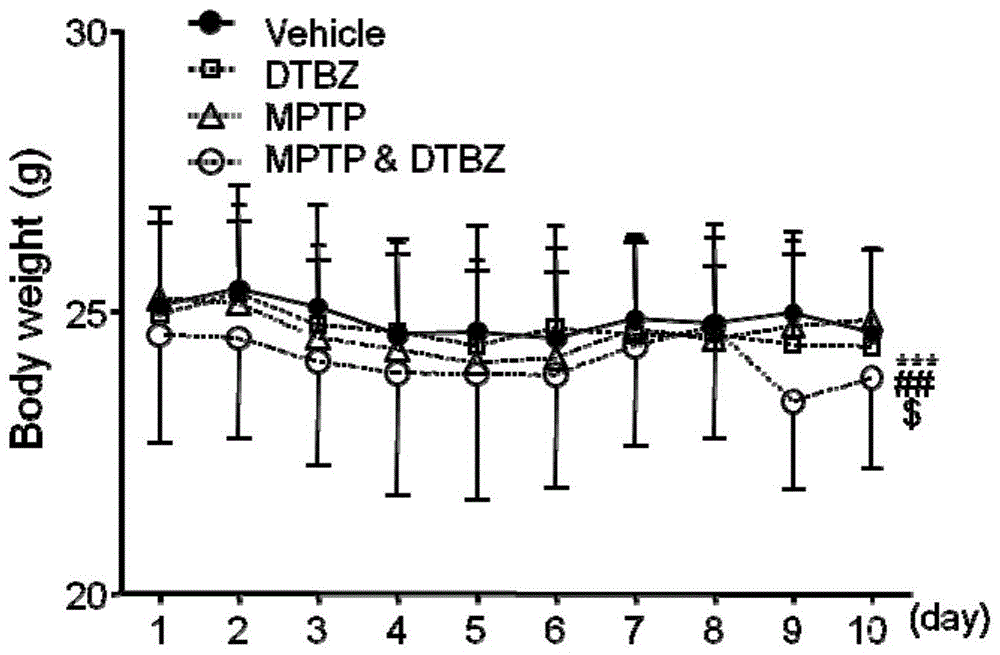
图1是实验例中各处理组小鼠体重变化图;
图2是实验例中da的标准曲线;
图3是实验例中dopac的标准曲线;
图4是实验例中hva的标准曲线;
图5是实验例中各处理组小鼠脑纹状体中多巴胺及其代谢产物含量的变化情况;
图6是实验例中各处理组小鼠脑纹状体中vmat2、酪氨酸羟化酶th和α-突触核蛋白的表达变化情况;
图7是实验例中各处理组小鼠脑黑质和纹状体中多巴胺能神经元及神经纤维含量的变化情况;其中,图7a-各组小鼠脑纹状体中th阳性神经纤维的免疫组织化学染色结果,图7b-各组小鼠脑黑质中th阳性多巴胺能神经元的免疫组织化学染色结果,图7c-小鼠脑纹状体中vmat2阳性神经纤维的免疫组织化学染色结果,图7d-图7a免疫组织化学染色中各组小鼠纹状体th阳性神经纤维的灰度定量图,图7e-图7b免疫组织化学染色的小鼠脑黑质中th阳性多巴胺能神经元数量的统计结果,图7f-图7c免疫组织化学染色中各组小鼠纹状体vmat2阳性神经纤维的灰度定量图。
具体实施方式
实施例1
8周龄c57bl/6雄性小鼠,清洁级,体重20-30g,购于常州卡文斯实验动物有限公司。对小鼠体重、活力进行评估,剔除明显精神萎靡、体重较轻或较重的小鼠,将合格小鼠适应性饲养于江苏省原子医学研究所动物房。适应性饲养1周后,对其进行联合给药。
右旋二氢丁苯那嗪((+)dtbz)溶解于20%dmso中,配制为二氢丁苯那嗪注射液,二氢丁苯那嗪的浓度为1.25mg/ml,备用。mptp(1-甲基-4-苯基-1,2,3,6-四氢吡啶)溶解于生理盐水中,配制为mptp注射液,mptp的浓度为2.5mg/ml,备用。
每天给药前对每只小鼠进行称重,按照(+)dtbz的单次剂量为5mg/kg小鼠,mptp的单次剂量10mg/kg小鼠,并根据体重换算每只小鼠的注射液的注射体积(以25g的小鼠为例,应注射药物的体积为100μl)。
对适应性饲养1周的小鼠进行(+)dtbz和mptp联合给药,具体为,先以5mg/kg小鼠的剂量腹腔注射(+)dtbz注射液,30min后,再以10mg/kg小鼠的剂量腹腔注射mptp注射液。按此操作连续注射10天。完成注射后饲养1-2周,即得帕金森病小鼠模型。
实施例2
8周龄c57bl/6雄性小鼠,清洁级,体重20-30g,购于常州卡文斯实验动物有限公司。对小鼠体重、活力进行评估,剔除明显精神萎靡、体重较轻或较重的小鼠,将合格小鼠适应性饲养于江苏省原子医学研究所动物房。适应性饲养1周后,对其进行联合给药。
右旋二氢丁苯那嗪((+)dtbz)溶解于20%dmso中,并以盐酸助溶(盐酸终浓度为0.036%-0.038%),配制为二氢丁苯那嗪注射液,二氢丁苯那嗪浓度为1.25mg/ml,备用。mptp(1-甲基-4-苯基-1,2,3,6-四氢吡啶)溶解于生理盐水中,配制为mptp注射液,mptp浓度为2.5mg/ml,备用。
每天给药前对每只小鼠进行称重,按照(+)dtbz的单次剂量为2.5mg/kg小鼠,mptp的单次剂量7.5mg/kg小鼠,并根据体重换算每只小鼠的注射液的注射体积。
对适应性饲养1周的小鼠进行(+)dtbz和mptp联合给药,具体为,先以2.5mg/kg小鼠的剂量腹腔注射(+)dtbz注射液,120min后,再以7.5mg/kg小鼠的剂量腹腔注射mptp注射液。按此操作连续注射50天。完成注射后饲养1-2周,即得帕金森病小鼠模型。
实施例3
8周龄c57bl/6雄性小鼠,清洁级,体重20-30g,购于常州卡文斯实验动物有限公司。对小鼠体重、活力进行评估,剔除明显精神萎靡、体重较轻或较重的小鼠,将合格小鼠适应性饲养于江苏省原子医学研究所动物房。适应性饲养1周后,对其进行联合给药。
右旋二氢丁苯那嗪((+)dtbz)溶解于20%dmso中,配制为二氢丁苯那嗪注射液,二氢丁苯那嗪浓度为1.25mg/ml,备用。mptp(1-甲基-4-苯基-1,2,3,6-四氢吡啶)溶解于生理盐水中,配制为mptp注射液,mptp的浓度为2.5mg/ml,备用。
每天给药前对每只小鼠进行称重,按照(+)dtbz的单次剂量为7.5mg/kg小鼠,mptp的单次剂量12.5mg/kg小鼠,并根据体重换算每只小鼠的注射液的注射体积。
对适应性饲养1周的小鼠进行(+)dtbz和mptp联合给药,具体为,先以7.5mg/kg小鼠的剂量腹腔注射(+)dtbz注射液,5min后,再以12.5mg/kg小鼠的剂量腹腔注射mptp注射液。按此操作连续注射10天。完成注射后饲养1-2周,即得帕金森病小鼠模型。
实施例4
8周龄c57bl/6雄性小鼠,清洁级,体重20-30g,购于常州卡文斯实验动物有限公司。对小鼠体重、活力进行评估,剔除明显精神萎靡、体重较轻或较重的小鼠,将合格小鼠适应性饲养于江苏省原子医学研究所动物房。适应性饲养1周后,对其进行联合给药。
左旋二氢丁苯那嗪((-)dtbz)和右旋二氢丁苯那嗪((+)dtbz)溶解于20%dmso中,配制为消旋二氢丁苯那嗪注射液,二氢丁苯那嗪浓度为1.25mg/ml,备用。mptp(1-甲基-4-苯基-1,2,3,6-四氢吡啶)溶解于生理盐水中,配制为mptp注射液,mptp的浓度为2.5mg/ml,备用。
每天给药前对每只小鼠进行称重,按照dtbz的单次剂量为5mg/kg小鼠,mptp的单次剂量10mg/kg小鼠,并根据体重换算每只小鼠的注射液的注射体积。
对适应性饲养1周的小鼠进行dtbz和mptp联合给药,具体为,先以5mg/kg小鼠的剂量腹腔注射dtbz注射液,30min后,再以10mg/kg小鼠的剂量腹腔注射mptp注射液。按此操作连续注射10天。完成注射后饲养1-2周,即得帕金森病小鼠模型。
实验例
一、小鼠帕金森病动物模型的构建
8周龄c57bl/6雄性小鼠40只,清洁级,体重20-30g,购于常州卡文斯实验动物有限公司。对小鼠体重、活力进行评估,剔除明显精神萎靡、体重较轻或较重的小鼠,将合格小鼠适应性饲养于江苏省原子医学研究所动物房。适应性饲养1周,备用。
将上述c57bl/6雄性小鼠按照体重体重随机分为4组,每组10只,分别为溶剂对照组、单独dtbz处理的对照组、单独mptp处理的对照组、dtbz与mptp联合处理组(即模型组)。
右旋二氢丁苯那嗪((+)dtbz)溶解于20%dmso中,配制为二氢丁苯那嗪注射液,二氢丁苯那嗪浓度为1.25mg/ml,备用。mptp(1-甲基-4-苯基-1,2,3,6-四氢吡啶)溶解于生理盐水中,配制为mptp注射液,mptp的浓度为2.5mg/ml,备用。
每天给药前对每只小鼠进行称重,按照(+)dtbz的单次剂量为5mg/kg小鼠,mptp的单次剂量10mg/kg小鼠,并根据体重换算每只小鼠的注射液的注射体积(以25g的小鼠为例,应注射药物的体积为1001l)。
溶剂对照组:对该组小鼠分为两组,分别腹腔注射生理盐水和20%dmso两种溶剂,形成溶剂对照组。按此操作连续注射10天。完成注射后饲养2周。
单独dtbz处理的对照组:对该组小鼠先以5mg/kg的剂量腹腔注射(+)dtbz注射液,30min后再腹腔注射生理盐水。按此操作连续注射10天。完成注射后饲养2周。
单独mptp处理的对照组:对该组小鼠先腹腔注射20%dmso溶剂,30min后,再以10mg/kg的剂量腹腔注射mptp注射液。按此操作连续注射10天。完成注射后饲养2周。
dtbz与mptp联合处理组:先以5mg/kg小鼠的剂量腹腔注射(+)dtbz注射液,30min后,再以10mg/kg小鼠的剂量腹腔注射mptp注射液。按此操作连续注射10天。完成注射后饲养2周。
二、对各组进行以下项目的评价试验:
1、小鼠状态分析
观察各组小鼠模型构建期间小鼠的精神状态、体重、毛发色泽和大便形态的变化。
溶剂对照组:小鼠被毛整齐有光泽,精神状态好,行为灵活,粪便呈现正常的颗粒状,体重基本没有变化。期间没有出现小鼠死亡。
单独dtbz处理的对照组:小鼠被毛略显松散,活力略下降,粪便仍然呈正常颗粒状,体重无显著变化。期间没有出现小鼠死亡。
单独mptp处理的对照组:被毛略显松散,活力略下降,粪便仍然呈正常颗粒状,体重无显著变化。在给药6天后有1只死亡。
dtbz与mptp联合处理组:小鼠精神萎靡,体重降低明显,在饲养笼中基本没有活动,粪便不能形成正常颗粒状,便稀。在给药6天后有1只死亡。
2、小鼠体重变化
各组小鼠,每天腹腔注射前对小鼠称重。
结果如图1所示,与溶剂对照组小鼠体重变化相比,单独dtbz或单独mptp处理的小鼠体重变化无明显差异,而dtbz和mptp联合处理的小鼠体重在给药期间明显下降,与溶剂对照、单独dtbz处理和单独mptp处理这三组小鼠之间均存在显著性差异。
3、小鼠脑纹状体中多巴胺及其代谢产物含量的变化情况
各组小鼠饲养2周后,用2%(m/v%)的戊巴比妥钠(生理盐水配制)麻醉小鼠,解剖取出小鼠脑组织后转移到冰上操作。剥离大脑皮层和海马结构,暴露双侧纹状体,小心剥离纹状体存放于预冷的1.5ml离心管中,立即保存于-80℃冰箱中。
从-80℃冰箱中取出小鼠纹状体组织,放置于冰上。首先用精密天平称取每只小鼠纹状体的重量并记录。根据纹状体的重量加入两倍体积的预冷的0.1mol/l高氯酸溶液,用震荡研磨仪进行组织匀浆,设定60hz运行60s。放置于冰上沉降5分钟后于冷冻离心机中以12000rpm/min的转速离心15分钟,取上清液于干净的离心管中保存,即得待检测的纹状体提取物。
从sigma公司购买多巴胺(da)、二羟基苯乙酸(dopac)和高香草酸(hva)的标准品,用高特异性的hplc-电化学检测技术建立da、dopac和hva的分离和定量分析方法。
称取da、dopac和hva各2mg,混合后用2ml的0.1mol/l高氯酸溶液溶解为混合液,各个成分的浓度为1mg/ml。用梯度稀释法配制终浓度为0.02、0.04、0.08、0.16、0.2、0.4、0.8ng/μl的待检测标准品备用。hplc进样体积为10μl,流量为0.5ml/min,柱温为35℃,检测电压为0.52v,流动相为10%甲醇和90%盐缓冲液(0.1mmedta,10mm柠檬酸,2.0mm辛烷磺酸和70mm磷酸二氢钾,ph3.2-3.4)。色谱柱型号是kinetex1c18柱(100×4.6mm,填料尺寸为2.6μm)。根据出峰时间和峰面积,分别绘制da、dopac和hva的标准曲线(分别如图2、3和4所示)。
标准曲线绘制完成后,再检测每个纹状体提取物,根据出峰时间和峰面积计算da及其代谢产物dopac和hva的含量(每10mg纹状体组织中含有的ng数)。
结果如图5所示。与单独dtbz处理组(104.7±21.6ng/10mg组织)和溶剂对照组(101.7±36.5ng/10mg组织)相比,单独mptp处理(33.8±9.1ng/10mg组织)导致的多巴胺含量的降低因dtbz联合处理(12.2±9.2ng/10mg组织)而加剧(图5a)。dtbz和mptp联合处理组中dopac和hva的含量也显著降低(dopac:从溶剂对照组的71.3±28.9减少为10.9±4.8ng/10mg组织;hva:从溶剂对照组的20.3±8.5减少为10.0±1.8ng/10mg组织),而dopac和hva的含量在单独mptp处理组中基本保持不变,尽管dopac显示出下降趋势(35.1±10.5ng/10mg组织)(图5b和5c)。dtbz和mptp联合处理组中da、dopac和hva的含量变化与帕金森病患者的病理表现是一致的,即纹状体中多巴胺及其代谢产物浓度的显著下降。
4、用蛋白质免疫印迹法检测小鼠脑纹状体中vmat2、酪氨酸羟化酶(th)和α-突触核蛋白的表达变化
从-80℃冰箱中取出小鼠纹状体组织,放置于冰上。先用精密天平称取每个纹状体的重量并记录,每30mg组织加入1001l预冷的组织匀浆液(1%(v/v%)tritonx-100,0.1%(m/v%)sds,50mmtris-hcl,150mmnacl,蛋白酶抑制剂)。用组织震荡研磨仪进行提取蛋白裂解液,研磨仪设定为60hz运行60s。震荡研磨结束后,取出离心管于冰上放置5分钟后,以12000g/min的转速在冷冻离心机中离心15分钟,小心吸取上清于干净离心管中即得待检测的蛋白样品。
帕金森病的病理学特征是多巴胺能神经元变性,以及路易小体的出现。为分析各组纹状体多巴胺能神经元含量以及路易小体的表达,采用westernblotting分析了多巴胺能神经元标记物——酪氨酸羟化酶(th)和vmat2的表达水平,以及路易小体的主要结构成分-α-突触核蛋白。
结果如图6所示。dtbz和mptp联合处理组小鼠纹状体中th和vmat2的蛋白质水平显著降低(图6a)。蛋白条带灰度定量的结果(图6b和6c)表明,th和vmat2的表达分别下降到溶剂对照组的44.0±14.4%和30.2±18.6%。dtbz和mptp联合处理组小鼠纹状体中,α-突触核蛋白显著上调表达(522.0±64.5%),表明在存活的多巴胺能神经元中发生着α-突触核蛋白的积累(图6d)。
5、用免疫组织化学方法检测小鼠纹状体和黑质中多巴胺能神经元及神经纤维含量的变化情况
各组小鼠饲养2周后,用2%(m/v%)的戊巴比妥钠(生理盐水配制)麻醉小鼠,经心脏分别灌注预冷的磷酸盐缓冲液和4%(m/v%)多聚甲醛溶液。灌注完成后,解剖取脑组织浸泡于4%(m/v%)多聚甲醛中过夜固定,第二天取出脑组织吸干表面液体后浸泡于15%(m/v%)蔗糖溶液中脱水。等脑组织完全沉降后,取出脑组织吸干表面液体,浸泡于30%(m/v%)蔗糖溶液中进一步脱水。等脑组织完全沉降后,用冰冻切片包埋剂(商品化试剂,一种聚乙二醇和聚乙烯醇的水溶性混合物)对脑组织块进行包埋,包埋后的组织块可存放于-80℃冰箱中备用。
取包埋后的组织块,对脑组织的纹状体和黑质区域分别进行冰冻切片,切片厚度为20μm。对冰冻切片进行免疫染色,首先用pbs洗去包埋剂,再用柠檬酸缓冲液进行抗原修复10分钟,用0.3%(v/v%)的双氧水封闭内源性的过氧化物酶,接着用3%(m/v%)bsa(用0.3%(m/v%)的tritonx-100配制)封闭非特异性的信号,再分别进行一抗(anti-vmat2和anti-th)和辣根过氧化物酶偶联二抗(辣根过氧化物酶标羊抗鼠、兔igg通用型二抗)的孵育,最后用dab(二氨基联苯胺)进行显色。
为了确定dtbz和mptp处理是否会破坏黑质纹状体连接的完整性,采用免疫组织化学方法测量了纹状体中th或vmat2阳性神经纤维的密度和含量。
结果如图7所示。与溶剂对照组相比,单独dtbz处理组和单独mptp处理组小鼠纹状体中th(图7a和7d)和vmat2(图7c和7f)的免疫反应性基本不变,而dtbz和mptp联合处理组导致多巴胺能纤维密度(th阳性:占溶剂对照组的56.1±5.6%;vmat2阳性:占溶剂对照组的38.1±2.8%)均显著下降。同时,以th为多巴胺能神经元的特异性标记物分析了黑质致密部多巴胺能神经元的数量,如图7b和7e所示,在用dtbz抑制vmat2的活性后,低剂量的mptp也使多巴胺能神经元的数量急剧减少(占溶剂对照组的25.9±12.2%)。结果表明,与dtbz联合用药可显著增加mptp对黑质纹状体多巴胺能神经元的毒性。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!